
全反式维甲酸立体稳定脂质体的制备
赵 蓉,朱家壁3
(中国药科大学中昆药剂研究所,江苏南京210009)
摘要:目的 制备全反式维甲酸(RA)的立体稳定脂质体,初步研究其物理化学性质。方法 用DSC、1HNMR、激光粒径测定仪研究其微观结构、粒径大小及其分布,并用TEM拍摄。结果 制备的普通和立体稳定脂质体粒径分别约为0135和0142μm,电镜下可观察到脂质体的立体稳定结构。结论 立体稳定脂质体中磷脂极性头部被吐温280的聚氧乙烯基所覆盖,吐温280掺入脂质膜,伸出的亲水性聚氧乙烯基提供了RA立体稳定脂质体的立体位阻。
关键词:全反式维甲酸;立体稳定脂质体;物理化学性质
中图分类号:R943;TQ460.6 文献标识码:A 文章编号:0513-4870(2000)12-0921-03
全反式维甲酸(all2trans retinoic acid,RA)是一种多烯酸,可用作癌症的预防治疗[1]。目前市售RA仅有口服片剂,长期口服RA片,可产生耐药性。原因在于血液中的药物浓度急剧下降[2]。故本文制备RA用于静脉注射脂质体粉针,既解决了耐药性,又增加了药物的稳定性。
差示量热扫描法(DSC)、核磁共振(NMR)被广泛用于表面活性剂与脂质双层膜的相互作用的研究[3]。参照文献[4,5],通过吐温280掺入脂质膜,本文制备了AR立体稳定脂质体,并对其物理化学性质进行了研究。
材料和方法
材料与仪器 冷冻干燥机(德国Heto FD2.5), Sephadex G250(Pharmacia),Mettler DSC25差示扫描量热仪(瑞士Mettler公司),Varian AMX2600型超导核磁共振谱仪(Varian Company,瑞士),激光散射粒径测定仪(90Plus Particle Size Analyzer, Brookhaven Instrument Corp.,Holtsville,N Y),透射式电子显微镜(J EOL J EM100CX II,Japan)。
RA(山东良福制药厂),卵磷脂(德国汉堡,上海捷成洋行代理),胆固醇(Holland进口分装),吐温2 80(上海大众制药厂),其余试剂均为分析纯。
脂质囊泡的制备与包封率的测定 以薄膜蒸发法结合冷冻干燥法制备RA普通和立体稳定脂质
收稿日期:2000204203
作者简介:朱家壁,男,教授.
3联系人 Tel:(025)3271372,Fax:(025)3301655,
E2mail:zhujb@https://www.doczj.com/doc/ea11400689.html, 体:将适量药物、卵磷脂、胆固醇、吐温280等依次溶于无水乙醇,经旋转蒸发仪真空抽干,置真空干燥器中过夜,加入冻干保护剂的水溶液水合,预冻12h 后,冷冻干燥,即得RA脂质体粉针。
包封率的测定采用葡聚糖凝胶Sephadex G250色谱法进行分离测定[6],以Tris2HCl p H910缓冲液为洗脱液,收集前40mL和后50mL,分别用甲醇破坏、稀释至一定浓度后,用紫外分光光度法在338 nm测定脂质体中药物和游离药物含量。该方法的柱回收率为10014%±015%。包入脂质体中的药物量除以药物上样量即为脂质体包封率,3次测得包封率平均值为9811%±110%。
粒径大小及分布的测定 经激光粒径测定仪测定粒径大小及分布,普通脂质体的平均粒径为35116nm,多分散性指数为01275,立体稳定脂质体的平均粒径为41812nm,多分散性指数为01250。立体稳定脂质体较普通脂质体粒径大,而多分散性指数较小,说明加入吐温280后,亲水性聚氧乙烯基均匀分布在脂质体表面,脂质体分子之间相互吸引、聚集的机会减少,物理稳定性更好。
结果
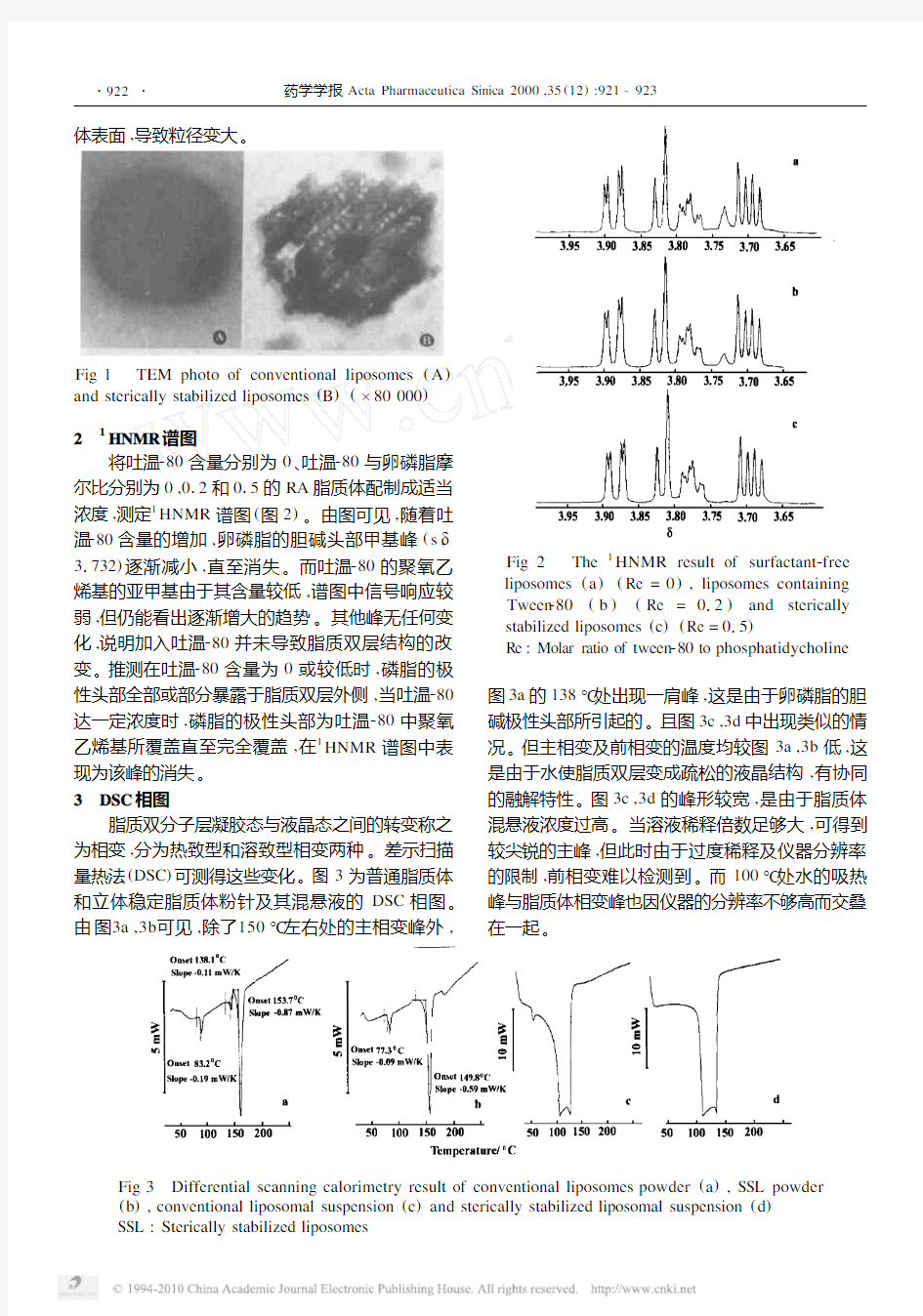
1 表面形态观察
经2%的磷钨酸染色,用负染法在透射式电子显微镜下观察普通和立体稳定脂质体的内部结构(图1),可见普通和立体稳定脂质体均为大单室囊泡结构。样品均放大80000倍。由图1A可见普通脂质体为一表面光滑的中空结构,而图1B中立体稳定脂质体的表面有凹凸感,且粒径较普通脂质体大。说明了吐温280的聚氧乙烯基伸出覆盖于脂质
?
1
2
9
?
药学学报Acta Pharmaceutica Sinica2000,35(12):921-923
体表面,导致粒径变大
。
Fig 1 TEM photo of conventional liposomes (A )and sterically stabilized liposomes (B )(×80000)
2 1HNMR 谱图
将吐温280含量分别为0、吐温280与卵磷脂摩尔比分别为0,012和015的RA 脂质体配制成适当浓度,测定1HNMR 谱图(图2)。由图可见,随着吐
温280含量的增加,卵磷脂的胆碱头部甲基峰(s ,δ31732)逐渐减小,直至消失。而吐温280的聚氧乙
烯基的亚甲基由于其含量较低,谱图中信号响应较
弱,但仍能看出逐渐增大的趋势。其他峰无任何变化,说明加入吐温280并未导致脂质双层结构的改变。推测在吐温280含量为0或较低时,磷脂的极性头部全部或部分暴露于脂质双层外侧,当吐温280达一定浓度时,磷脂的极性头部为吐温280中聚氧乙烯基所覆盖直至完全覆盖,在1HNMR 谱图中表现为该峰的消失。3 DSC 相图脂质双分子层凝胶态与液晶态之间的转变称之为相变,分为热致型和溶致型相变两种。差示扫描量热法(DSC )可测得这些变化。图3为普通脂质体和立体稳定脂质体粉针及其混悬液的DSC 相图。由图3a ,3b 可见,除了150℃左右处的主相变峰外
,
Fig 2 The 1HNMR result of surfactant 2free
liposomes (a )(Re =0),liposomes containing Tween 280(b )(Re =012)and sterically stabilized liposomes (c )(Re =015)
Re :Molar ratio of tween 280to phosphatidycholine
图3a 的138℃处出现一肩峰,这是由于卵磷脂的胆碱极性头部所引起的。且图3c ,3d 中出现类似的情况。但主相变及前相变的温度均较图3a ,3b 低,这是由于水使脂质双层变成疏松的液晶结构,有协同的融解特性。图3c ,3d 的峰形较宽,是由于脂质体混悬液浓度过高。当溶液稀释倍数足够大,可得到较尖锐的主峰,但此时由于过度稀释及仪器分辨率的限制,前相变难以检测到。而100℃处水的吸热峰与脂质体相变峰也因仪器的分辨率不够高而交叠在一起
。
Fig 3 Differential scanning calorimetry result of conventional liposomes powder (a ),SSL powder (b ),conventional liposomal suspension (c )and sterically stabilized liposomal suspension (d )SSL :Sterically stabilized liposomes
?229?药学学报Acta Pharmaceutica Sinica 2000,35(12):921-923
讨论
由于RA 极不稳定,所有操作均在暗室中进行,实验中使用棕色容器,且避免高温、高温。
当脂质双层中磷脂胆碱极性头部被其他基团所包裹,在1HNMR 和DSC 相图中则观察不到胆碱头部的信号。根据此原理,本文验证了立体稳定脂质体的结构。由于含全反式维甲酸的立体稳定脂质体的表面被掺在脂质双层中的吐温280伸出的聚氧乙烯基所包裹,故而表现出与普通脂质体不同的物理化学性质。
RA 立体稳定脂质体的包封率较高,表明脂质双分子层可显著增溶疏水性RA ,使RA 通过脉管内给药成为可能,这将是解决RA 口服生物利用度低和耐药性的有效手段之一。
立体稳定脂质体的外观近似于膨胀的脂质双层的形态,因此其粒径较普通脂质体大。有关聚合物在脂质体表面覆盖的浓度和厚度、亲水基团恰能完全覆盖脂质双层表面所需的表面活性剂的用量及立
体稳定脂质体的生物学性质有待进一步研究。REFERENCES :
[1]Han Rui.A nticancer Drug Research and Ex perimental
Technology [M ].Beijing :Beijing Medical University and Peking Union Medical College United Publishing House ,1997.48-65.
[2]David WS.Physicians Desk Ref erence [M ].48edition.
New Jersey :Medical Economics Data Production Company ,1994.1711.
[3]Zhang ZH ,Liu WL.Membrane Biophysics [M ].
Shanghai :High Education Press ,1987.28-58.
[4]Jamshaid M ,Farr S J ,K earney P ,et al .Poloxamer
sorption on liposomes :comparison with polystyrene latex and influence on solute efflux [J ].Int J Pharm ,1998,48(1-3):125-131.
[5]Kronberg B ,Dahlman A ,Carlfors J ,et al .Preparation
and evaluation of sterically stabilized liposomes :colloidal stability ,serum stability ,macrophage uptake ,and toxicity [J ].J Pharm Sci ,1990,79(8):667-671.[6]Zhang J H ,Zhu JB ,Wang H.Determination of
encapsulation efficiency of liposomal amikacin [J ].Chin Pharm J (in Chinese ),1999,34(12):818-820.
PREPARATION OF STERICALLY STABIL IZED L IPOSOMES
CONTAINING ALL 2TRANS RETINOIC ACID
ZHAO Rong ,ZHU Jia 2bi
(Zhongkun Pharm aceutical Research Instit ute ,Chi na Pharm aceutical U niversity ,N anji ng 210009,Chi na )
ABSTRACT:AIM To prepare sterically stabilized liposomes containing all 2trans retinoic acid ,and to study its physicochemical properties.METH ODS The microstructure ,the particle size and its distribution was determined by DSC ,1HNMR and 90Plus Particle Size Analyzer and a TEM photo was taken.RESU LTS The size of conventional liposomes and sterically stabilized liposomes were about 0135and 0142μm.The sterically stabilized structure can be confirmed by TEM photo.CONCL USION The stericallly stabilized liposomes containing all 2trans retinoic acid can be prepared by combination of film 2casting and freeze 2drying.
KEY WOR DS :all 2trans retinoic acid ;sterically stabilized liposomes ;physicochemical properties
?
329?药学学报Acta Pharmaceutica Sinica 2000,35(12):921-923
微脂体(又称脂质体)及其制备方法一二 微脂体(又称脂质体) 微脂体起源于1960 年代中期,Bangham博士等人首先提出,在磷酸脂薄膜上加入含盐分的水溶液后,再加以摇晃,会使脂质形成具有通透性的小球;196 8年,Sessa 和Weissmann 等人正式将此小球状的物体命名为微脂体(liposo me)并做出明确的定义: 指出微脂体是由一到数层脂质双层膜(lipid bilayer) 所组成的微小的囊泡,有自行密合(self-closing)的特性。微脂体由脂双层膜包裹水溶液形成,由于构造的特性,可同时作为厌水性(hydrophobic)及亲水性(hydrophilic)药品的载体,厌水性药品可以嵌入脂双层中,而亲水性药品则可包覆在微脂体内的水溶液层中。如同细胞膜,微脂体的脂质膜为脂双层构造,由同时具有亲水性端及厌水性端的脂质所构成,脂双层由厌水性端相对向内而亲水性端面向水溶液构成,组成中的两性物质以磷酸脂质最为常见。微脂体的形成是两性物质在水溶液中,依照热力学原理,趋向最稳定的排列方式而自动形成。微脂体的性质深受组成脂质影响,脂质在水溶液的电性,决定微脂体是中性或带有负电荷、正电荷。此外,磷酸脂碳链部分的长短,不饱和键数目,会决定微脂体的临界温度(transition temperature, Tc),影响膜的紧密度。一般来说,碳链长度越长临界温度越高,双键数越多则临界温度越低,常见的DPPC(dipalmitoylp hosphatidylcholine)与DSPC(distearoylphosphatidylcholine)的临界温度分别是42℃与56℃,而Egg PC(egg phosphatidylcholine)与POPC(palmitoyl oleoyl phosphatidylcholine)的Tc 则低于0℃。临界温度影响微脂体包裹及结合药物的紧密度,当外界温度高于Tc时,对膜有通透性的药物,较容易通过膜;此外,当外界温度处于临界温度时,微脂体脂质双层膜中的脂质,会因为流动性不一致而使微脂体表面产生裂缝,造成内部药物的释出。在磷脂质内加入胆固醇,会对微脂体性质产生下列影响:增加微脂体在血液中的安定性,较不易发生破裂;减少水溶性分子对微脂体脂膜的通透性;增加微脂体的安定性,使其在血液循环中存在的时间较长。 微脂体可依脂双层的层数或是粒子大小,加以命名或分类: (1) Multilamellar vesicle(MLV)是具有多层脂双层之微脂体,粒子大小介于100-1000 nm,特色是粒子内具多层脂质膜,一般而言,干燥后的脂质薄膜,
Hieff TransTM 脂质体核酸转染试剂 产品描述 Hieff Trans TM 脂质体核酸转染试剂是一种多用途的脂质体转染试剂,适用于DNA 、RNA 和寡核苷酸的转染,对大多数真核细胞具有很高的转染效率。其独特的配方使其可直接加入培养基中,血清的存在不会影响转染效率,这样可以减少去除血清对细胞的损伤。转染后不需要除去核酸-Hieff Trans TM 复合物或更换新鲜培养基,也可在4~6小时后除去。 Hieff Trans TM 以无菌的液体形式提供。通常情况下对于 24 孔板转染,每次用1.5μl 左右,则1ml Hieff Trans TM 约可做660次转染;对于6孔板,每次用6μl 左右,则1ml Hieff Trans TM 约可做160 次转染; 运输与保存方法 冰袋(wet ice )运输。产品4oC 保存,一年有效。不可冷冻! 注意事项 1)Hieff Trans TM 脂质体核酸转染试剂要求细胞铺板密度较高,以90%-95%为佳,这有助于减少阳离子脂质体细胞毒性造成的影响;如果你研究的基因要求比较长的表达时间,比如细胞周期相关基因,或者细胞表面蛋白,最好选择细胞铺板密度要求较低的转染试剂,不适合用脂质体核酸转染试剂。 2)Hieff Trans TM 脂质体核酸转染试剂可用于有血清培养基的转染,并且转染前后不需要换培养基。但是,制备转染复合物时要求用无血清培养基稀释DNA 和转染试剂,因为血清会影响复合物的形成。另外,要检测所用的无血清培养基与脂质体核酸转染试剂的相容性,已知CD293, SFMII, VP-SFM 就不相容。 3)转染的时候培养基中不能添加抗生素。 4)使用高纯度的DNA 或RNA 有助于获得较高的转染效率,质粒中的内毒素是转染的大敌。 5)阳离子脂质体应该在4度保存,要注意避免多次反复长时间开盖,因为可能会导致脂质体氧化而影响转染效率。 6)初次使用应优化DNA 浓度和阳离子脂质体试剂量以得到最大的转染效率。DNA 和转染试剂的比例,通常推荐是1:2-1:3,比如24孔板内接种0.5-2×105个细胞,使用0.5 μg DNA 和1-1.5 μl 转染试剂。通过调整DNA/Hieff Trans TM 脂质体核酸转染试剂比例优化转染效率,保证细胞密度大于90%,DNA (μg ): Hieff Trans TM (μl )比值在1:0.5-1:5。 操作流程(以24孔板为例,其他培养板加样体积请参考表一) 【注】:转染试剂使用量受细胞类型及其他实验条件影响,建议初次使用时设置梯度进行优化最佳使用量。 贴壁细胞:转染前一天(20-24小时),胰酶消化细胞并计数,细胞铺板(不含抗生素),使其在转染时密度为90-95%(0.5-2 × 105 cells/well for a 24-well plate )。 c c l 整 理
脂质体转染的实验原理与操作步骤大全 细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等,理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等,本文主要介绍细胞转染常用的方法-脂质体转染的原理和操作步骤等。 脂质体(lipofectin regeant,LR)试剂是阳离子脂质体N-[1-2,3-Dioleyoxy,Propyl]-n, n,n-Trimethylammonium Chloride(DOTMA)和Dioleoyl photidye-thanolamine(DOPE)的混合物[1:1(w/w)]。它适用于把DNA转染入悬浮或贴壁培养细胞中,是目前条件下最方便的转染方法之一。转染率高,优于磷酸钙法,比它高5~100倍,能把DNA和RNA转染到各种细胞。 用LR进行转染时,首先需优化转染条件,应找出该批LR对转染某一特定细胞适合的用量、作用时间等,对每批LR都要做:第一,先要固定一个DNA的量和DNA/LR混合物与细胞相互作用的时间,DNA可从1~5μg和孵育时间6小时开始,按这两个参数绘出相应LR需用量的曲线,再选用LR和DNA两者最佳的剂量,确定出转染时间(2~24小时)。因LR对细胞有一定的毒性,转染时间以不超过24小时为宜。 细胞种类:COS-7、BHK、NIH3T3、Hela和Jurkat等任何一种细胞均可作为受体细胞。 一、脂质体(liposome)转染方法原理 脂质体(liposome)转染方法原理:脂质体((Iiposome)作为体内和体外输送载体的工具,已经研究的十分广泛,用合成的阳离子脂类包裹DNA,同样可以通过融合而进人细胞。使用脂质体将DNA带人不同类型的真核细胞,与其它方法相比,有较高的效率和较好的重复性。 中性脂质体是利用脂质膜包裹DNA,借助脂质膜将DNA导入细胞膜内。带正电的阳离子脂质体,DNA并没有预先包埋在脂质体中,而是带负电的DNA自动结合到带正电的脂质体上,形成DNA-阳离子脂质体复合物,从而吸附到带负电的细胞膜表面,经过内吞被导入细胞。 二、脂质体转染操作步骤 1、操作步骤[方法一]: (1)细胞培养:取6孔培养板(或用35mm培养皿),向每孔中加入2mL含1~2×105个细胞培养液,37℃CO2培养至40%~60%汇合时(汇合过分,转染后不利筛选细胞)。 (2) 转染液制备:在聚苯乙稀管中制备以下两液(为转染每一个孔细胞所用的量)A液:用不含血清培养基稀释1-10μg DNA,终量100μL,B液:用不含血清培养基稀释2-50μgLR,终量100μL,轻轻混合A、B液,室温中置10-15分钟,稍后会出现微浊现象,但并不妨碍转染(如出现沉淀可能因LR或DNA浓度过高所致,应酌情减量)。 (3)转染准备:用2mL不含血清培养液漂洗两次,再加入1mL不含血清培养液。
[12]卢文胜,危华玲.烧伤涂膜剂的研制[J ].海峡药学,2004,16 (6):31 32. [13]刘世贵,徐桂萍,吕剑涛.正交试验优选拔毒涂膜剂的制备工 艺[J].中医药学刊,2006,24(7):1360 1361. [14]张秋红,李德平,张忠义.烧伤涂膜剂质量标准研究[J].中国 药业,2006,15(14):10 11. [15]王晋,刘巨厚,王占琴.正交试验优化白及成膜材料的制备工 艺[J].中国药房,2005,16(15):1134 1135. [16]罗雄明.一种新型药用止血膜材料的制备及性质研究[D].重 庆大学硕士学位论文,2005. [17]S chroeder I,Frank e P,Schaefer U,et al .Development and characterization of film formin g polymeric solu tion s for skin d rug delivery[J].E ur J Pharm Biopharm,2007,65(1):111 121. [18]盛国荣,谢勇.肤康涂膜剂急性毒性与过敏性试验的研究[J]. 海峡药学,2004,16(2):34 36. [19]李彦,林葳,左从林.鬼臼毒素涂膜剂对家兔皮肤和阴道粘膜 的刺激实验[J ].武警医学,2001,12(8):485 486. [20]朱健平,刘刚,高莉莉,等.环吡酮胺涂膜剂控释机理研究[J]. 广东医学院学报,1999,17(1):8 10. [21]盛国荣.混合促透剂对肤康涂膜剂中水杨酸和酮康唑透皮效 果的影响[J ].中国药业,2005,14(4):29 31. [22]林亚平,赵颖,张永萍,等.雪上一枝蒿涂膜剂、凝胶剂和巴布 剂体外经皮渗透过程的比较[J].中国中药杂志,2007,32(3):203 206. [23]杨建坤,杨章群,曹德英.阿西美辛涂膜剂体外透皮吸收的影 响因素考察[J ].中国医院药学杂志,2005,25(10):937 939.[24]赵文英,金青,朱庆书.芦荟涂膜剂的体外透皮实验研究[J]. 青岛科技大学学报,2006,27(3):200 201. [25]杨荣兵,李瑶.玉屏风涂膜剂的制备工艺研究[J].实用医技杂 志,2008,15(24):3223 3225. [26]陈庆华,廖峻,曾南,等.咳喘灵高分子涂膜剂治疗急慢性支气 管炎临床观察附:193例病例报告[J].成都中医药大学学报,2001,24(2):10 11. [27]M isra A,Pal R,M ajumdar S ,et al .Biphasic testosterone de livery profile observed with tw o different transdermal formula tions[J].Pharm Res,1997,14(9):1264 1268. [28]S chroeder I,Fran ke P,Schaefer U ,et al .Delivery of ethi nylestradiol from film form ing polymeric s olutions across hu man epid ermis in v itr o an d in viv o in pigs [J ].J Control Re lease,2007,118(2):196 203. [收稿日期]2009 03 31 [作者简介]杜雪,女,硕士,助理研究员,电话:0531 ********,E m ail:x uezi 8106@https://www.doczj.com/doc/ea11400689.html, 全反式维甲酸缓释制剂研究进展 杜雪,黄丽华,李铁军,张孝卫 (济南市卫生科技交流服务中心,山东济南250013) [摘要] 目的:介绍近年来国内外全反式维甲酸缓释制剂的研究进展。方法:查阅国内外有关文献进行综合分析。结果:全反式维甲酸缓释制剂主要有聚丙交酯乙交酯(PL GA )微球、聚L 丙交酯(P L LA )和聚乙二醇(PEG) PL L A 镶嵌共聚物(PL E)微球、微乳液、脂质体、混悬剂、环糊精包合物、核 壳型毫微粒、醇溶朊毫微粒等。结论:全面了解全反式维甲酸缓释制剂为有效降低耐药性、减少给药次数、减轻不良反应提供了新的思路。[关键词] 全反式维甲酸;缓释;制剂;微球 [中图分类号]R 944 [文献标识码]A [文章编号]1001 5213(2010)04 0327 03 全反式维甲酸(all tr ans vitamin A acid,tr etinoin,(a ll E) 3,7 dimethyl 9 (2,6,6 trimethy l 1 cyclo hex en 1 yl) 2,4,6,8 nonatetraenoic acid,A T R A )为维生素A 的天然氧化代谢产物。目前临床上主要用于治疗急性早幼粒细胞白血病(A PL ,M 3)和骨髓增生异常综合征(M DS),其优点为疗效高,完全缓解率达84%~95%,不诱发弥漫性血管内凝血(DIC),不引起骨髓抑制。多数患者用药后病情获得缓解,但在持续用药过程中很快出现耐药性,复发几乎普遍发生,其原因可能是A T RA 对参与其代谢的酶活性具有自身诱导作用,持续用药导致血药浓度逐步降低,导致临床应用受到很大限制。 为达到减少给药次数,降低峰浓度,减轻不良反应的目的,已经制备了全反式维甲酸微球,包括硅油、脂质体、白蛋白、聚丙交酯乙交酯,以及纳米颗粒混悬剂和环糊精包合物等。现将其缓释制剂研究进展综述如下。 1 全反式维甲酸聚丙交酯乙交酯缓释微球的研究 潘学工等[1]研究了全反式维甲酸聚丙交酯乙交酯(A T R A P LG A )微球的制备、物理性质的检测以及体外释药性能,结果证明制备的微球具有缓释作用。 微球用于脑内药物传输有很多优点,例如降低抗肿瘤药剂的毒性,克服血脑屏障,有效地传输药物到肿瘤部位和控制释放速率使药物实现长时间释放。Jeo ng Y I 等[2]研究了用于治疗脑瘤的A T RA P LG A 缓释胶囊制备条件的优化及体外释放度的测定。用溶剂挥发法制备了AT RA PL GA 微球,粒径在10~100 m 之间,30d 内A T RA 从微球中缓慢地释放出来,说明包含A T RA 的P LG A 微球用于脑瘤的治疗是可行的。 2 全反式维甲酸镶嵌共聚物缓释微球的研究 Yo ng do o Choi 等[3]通过聚L 丙交酯(PL L A )和聚乙二醇(P EG ) P LL A 镶嵌共聚物(PL E)以不同的混合比率制备微球来控制AT RA 的释放速率,通过调整微球中P L E 和AT RA 的含量获得了不同释放类型的A T RA 。发现当PL E 和A T RA 在微球中的质量比超过4%时得到拟零级释放曲线。 王凤翔等[4]制备了注射用海藻酸钠 维甲酸(alg inate so dium retino ic acid,A GS RA )微球用于眼内给药,所制成的AG S RA 微球可以用注射器直接注入到玻璃体腔,使用极为方便,体内实验和体外释放实验呈理想的持续释放模式,体
转染步骤及经验(精华) 一、基础理论 转染是将外源性基因导入细胞内的一种专门技术。分类:物理介导方法:电穿孔法、显微注射和基因枪;化学介导方法:如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法:有较为原始的原生质体转染,和现在比较多见的各种病毒介导的转染技术。理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。病毒介导的转染技术,是目前转染效率最高的方法,同时具有细胞毒性很低的优势。但是,病毒转染方法的准备程序复杂,常常对细胞类型有很强的选择性,在一般实验室中很难普及。其它物理和化学介导的转染方法,则各有其特点。需要指出的一点,无论采用哪种转染技术,要获得最优的转染结果,可能都需要对转染条件进行优化。影响转染效率的因素很多,从细胞类型、细胞培养条件和细胞生长状态到转染方法的操作细节(见后文)。 二、转染操作流程(以常用的6孔板为例) (1) 细胞培养: 取6孔培养板,以3x104/cm2密度铺板,37℃5%CO2培养箱中培养至70%~90%汇合。(不同细胞略有不同,根据实验室优化的条件进行,汇合过分,转染后不利筛选细胞)。 (2) 转染液制备: 在EP管中制备以下两液(为转染每一个孔细胞所用的量) A液:用不含血清培养基稀释1-10μg DNA,终量100μL, B液:用不含血清培养基稀释对应量的转染试剂,终量100μL; 轻轻混合A、B液(1:1混匀),室温中置15分钟,稍后会出现微浊现象,但并不妨碍转染。 (3) 转染准备:用2mL不含血清培养液漂洗两次,再加入2mL不含血清及PS的培养液。 (4) 转染:把A/B复合物缓缓加入培养液中(缓慢滴加),轻轻摇匀,37℃温箱置6~8小时,吸除无血清转染液,换入正常培养液继续培养。 三、转染注意事项 1. 血清 A. DNA-阳离子脂质体复合物形成时不能含血清,因为血清会影响复合物的形成。 B.一般细胞对无血清培养可以耐受几个小时没问题,转染用的培养液可以含血清也可以不加,但血清一度曾被认为会降低转染效率,转染培养基中加入血清需要对条件进行优化。 C. 对于对血清缺乏比较敏感的细胞,可以使用一种营养丰富的无血清培养基OPTI-MEMⅠ培养基, 或者在转染培养基中使用血清。对血清缺乏比较敏感的贴壁细胞,建议使用LIPOFECTAMINE 2000。无血清培养基OPTI-MEM(GIBICO)很好用,有条件的话,就用它代替PBS洗细胞两遍,注意洗的时候要轻,靠边缘缓缓加入液体,然后不要吹吸细胞,而是转动培养板让液体滚动在细胞表面。如果洗的太厉害,细胞又损失一部分,加了脂质体后,细胞受影响就更大了,死亡细胞会增多。 2.抗生素(PS) 抗生素,比如青霉素和链霉素,是影响转染的培养基添加物。这些抗生素一般对于真核细胞无毒,但阳离子脂质体试剂增加了细胞的通透性,使抗生素可以进入细胞。这降低了细胞的活性,导致转染效率低。所以,在转染培养基中不能使用抗生素,甚至在准备转染前进行细胞铺板时也要避免使用抗生素。这样,在转染前也不必润洗细胞。对于稳定转染,不要在选择性培养基中使用青霉素和链霉素,因为这些抗生素是GENETICIN选择性抗生素的竞争性抑制剂。另外,为了保证无血
小结 所谓急性白血病便是造血系统恶性增生性疾病,是造血干细胞在分化过程中于某一阶段分化阻滞并恶性增殖的疾病.根据白血病细胞系列归属为急性髓系白血病(AML)和急性淋巴细胞白血病(ALL)两大类。 我们不妨先来探讨一下正常的造血过程.现已公认各种血细胞均起源于共同的骨髓造血干细胞,自我更新与多向分化是造血干细胞的两大特征。干细胞受造血微环境、神经介质、体液和免疫因素的调控而自我复制并分化为骨髓和淋巴系干细胞。具体分化过程如下: 骨髓干细胞 1).在促红细胞生成素(EPO)的调控下-红系祖细胞-原红细胞-早中晚幼红细胞-网织红细胞-红细胞 2)在GM-CSF的调控下-粒单系祖细胞-原始粒细胞-早中晚幼粒细胞-杆状核细胞-分叶核细胞---粒单系祖细胞-原单核细胞-幼单核细胞-单核细胞 3)在Meg-CSF的调控下-巨核系祖细胞-原始巨核细胞-幼巨核细胞-颗粒巨核细胞-成熟型巨核细胞-血小板 淋巴系干细胞 1)-T细胞系祖细胞-T原淋巴细胞-T幼淋巴细胞-T淋巴细胞 2)-B细胞系祖细胞-B原淋巴细胞-B幼淋巴细胞-B淋巴细胞 由此可总结出血细胞的发育过程可分为5个阶段: ①初级多能干细胞为最原始未分化干细胞;
②次级多能干细胞,部分分化,如CFU-S,淋巴性干细胞; ③定向组细胞,自我复制能力有限或消失,仅具有一系或2系分化潜能; ④前体细胞,如骨髓中形态已可辩认的各系幼稚细胞; ⑤各系血细胞,成熟血细胞。 在正常生理条件下,每种成熟的血细胞的增殖,分化和凋亡等过程是受到严格的调控,机体因而保持稳态;如果调控机制出现紊乱,造成这些过程异常,就会产生相应的疾病. 在急性白血病中,简单概括下来就是血细胞出现了恶性增殖和分化受阻的问题.那么究 其原因,可以发现相当多的白血病是由染色体易位导致基因异常而引起的.由于基因的断裂,重组,形成新的融合基因,致使基因表达异常,或编码新的融合蛋白,从而在正常造血干/组细胞的恶性转化中起重要作用.就拿这次PBL的案例来说,患者所罹患的是隶属于AML的M3型又称急性早幼粒细胞白血病(APL),在此类患者中常常能检测到PML-RARα基因的表达大大超过野生型PML和RARα表达, 而PML-RARα融合蛋白扣押或阻断了残存正常的PML,RARα蛋白的功能.从而以阻断细胞分化和细胞凋亡的双重效应参与APL的发病. 在正常人体内的PML蛋白起到的是生长抑制作用,PML蛋白的表达水平依细胞周期而发生改变,表现为PML在S期和G2/M期细胞低表达,在G1期细胞高表达。这种表达方式提示这可能和PML显著下调cyclin d1、cdk-2和上调P53、P21的表达及导致Rb蛋白去磷酸化等,使细胞阻滞在G1期有关。 同时PML蛋白还具有促凋亡活性.所谓凋亡是在体内外因索的诱导下,由严格和复杂的信号网络调控而发生的自主性细胞有序死亡过程。Quignon等[1]认为PML诱导的细胞凋亡信号途径不依赖重要的凋亡蛋白酶caspases的活化,因为PML诱导的细胞凋亡在缺乏caspase-3活化的情况下发生。Caspase抑制物如zVAD则能加速PML诱导的细胞凋亡。
Hieff Trans TM脂质体核酸转染试剂说明书 产品描述 Hieff Trans TM脂质体核酸转染试剂是一种多用途的脂质体转染试剂,适用于DNA、RNA 和寡核苷酸的转染,对大多数真核细胞具有很高的转染效率。其独特的配方使其可直接加入培养基中,血清的存在不会影响转染效率,这样可以减少去除血清对细胞的损伤。转染后不需要除去核酸-Hieff Trans TM复合物或更换新鲜培养基,也可在4~6小时后除去。 Hieff Trans TM以无菌的液体形式提供。通常情况下对于 24 孔板转染,每次用1.5μl左右,则1ml Hieff Trans TM约可做660次转染;对于6孔板,每次用6μl左右,则1ml Hieff Trans TM约可做160 次转染; 运输与保存方法 冰袋(wet ice)运输。产品4oC保存,一年有效。不可冷冻! 注意事项 1)Hieff Trans TM脂质体核酸转染试剂要求细胞铺板密度较高,以90%-95%为佳,这有助于减少阳离子脂质体细胞毒性造成的影响;如果你研究的基因要求比较长的表达时间,比如细胞周期相关基因,或者细胞表面蛋白,最好选择细胞铺板密度要求较低的转染试剂,不适合用脂质体核酸转染试剂。 2)Hieff Trans TM脂质体核酸转染试剂可用于有血清培养基的转染,并且转染前后不需要换培养基。但是,制备转染复合物时要求用无血清培养基稀释DNA和转染试剂,因为血清会影响复合物的形成。另外,要检测所用的无血清培养基与脂质体核酸转染试剂的相容性,已知CD293, SFMII, VP-SFM 就不相容。 3)转染的时候培养基中不能添加抗生素。 4)使用高纯度的DNA或RNA有助于获得较高的转染效率,质粒中的内毒素是转染的大敌。 5)阳离子脂质体应该在4度保存,要注意避免多次反复长时间开盖,因为可能会导致脂质体氧化而影响转染效率。 6)初次使用应优化DNA浓度和阳离子脂质体试剂量以得到最大的转染效率。DNA 和转染试剂的比例,通常推荐是1:2-1:3,比如24孔板内接种0.5-2×105个细胞,使用0.5 μg DNA 和1-1.5 μl 转染试剂。通过调整DNA/Hieff Trans TM脂质体核酸转染试剂比例优化转染效率,保证细胞密度大于90%,DNA(μg): Hieff Trans TM(μl)比值在1:0.5-1:5。
实验十五脂质体的制备 一、实验目的 1. 掌握注入法制备脂质体的工艺。 2. 掌握脂质体包封率的测定方法。 二、实验原理 60年代初 Banghan 等发现磷脂分散在水中可形成多层囊,并证明每层囊均为双分子脂质膜组成且被水相隔开,称这种具有生物膜结构的囊为脂质体。197l 年Ryman 等人提出将脂质体作为药物载体, 即将酶或药物包囊在脂质体中。近年来脂质体作为药物载体在传递给药系统中的研究有了迅速的发展。 脂质体系一种人工细胞膜, 它具有封闭的球形结构, 可使药物被保护在它的结构中, 发挥定向作用。特别适于作为抗癌药物载体,以改善药物的治疗作用,降低毒副作用等。脂质体系由磷脂为骨架膜材及附加剂组成。用于制备脂质体的磷脂有天然磷脂, 如豆磷脂,卵磷脂等;合成磷脂,如二棕榈酰磷脂酰胆碱,二硬脂酰磷脂酰胆碱等。磷脂在水中能形成脂质体是由其结构决定的。磷脂具有两条较长的疏水烃链和一个亲水基团。当较多的磷脂加至水或水性溶液中, 磷脂分子定向排列, 其亲水基团面向两侧的水相, 疏水的烃链彼此对向缔合形成双分子层, 并进一步形成椭圆形或球状结构——脂质体。常用的附加剂为胆固醇,它也是两亲性物质,与磷脂混合使用,可制备稳定的脂质体,其作用是调节双分子层流动性,减低脂质体膜的通透性。其它附加剂有十八胺,磷脂酸等,这两种附加剂可改变脂质体表面电荷的性质。 脂质体可分为三类:小单室(层脂质体,粒径在 20~50nm,凡经超声波处理的脂质体混悬液, 绝大部分为小单室脂质体; 多室(层脂质休, 粒径约在 400~1000nm; 大单室脂质, 粒径约为 200~1000nm,用乙醚注入法制备的脂质体多属这—类。 脂质体包封率的测定包封率的定义可用下式表示: 包封率% =(W总 - W游离 / W总 x 100
急性早幼粒细胞白血病( acute promyelocytic leukemia,APL)是一种特殊类型的急性髓系白血病,其细胞遗传学特征为t(15; 17)染色体异位,该异位使15号染色体上的早幼粒细胞白血病(PML)基因与17号染色体上的维甲酸受体α(RARα)基因发生融合,表达PML-RARα融合蛋白,该融合基因是APL发病的分子基础和分子标志,这种异位导致粒细胞分化过程中受阻于早幼粒细胞阶段[1, 2]。目前,针对初次诊断为APL的患者采用全反式维甲酸(all-trans retinoic acid,ATRA)和蒽环类药物为主的联合化疗可使90%左右的患者达到完全缓解(complete remission,CR), 5年生存率可达80%[3]。 尽管维甲酸对治疗APL有很好的疗效,减少了细胞毒药物对细胞的破坏而诱发的播散性血管内凝血(DIC),从而降低了初治APL的早期病死率,可使大部分患者达到完全缓解。但是一些患者在诱导治疗过程中出现分化综合征(differentiation syndrome,DS),以前称之为维甲酸综合征( retionic acid syndrome, RAS),这是一种潜在的风险性很大的副作用。以下就ATRA诱导治疗APL过程中DS的发病率、发病机制、预测因素、临床表现及诊断、治疗及预防做简要介绍。 1DS的发病率及病死率 Tallman和De Botton在各自的调查研究中表明:初次诊断明确的APL患者予以A TRA诱导治疗过程中DS的发生率5% ~27%,病死率为5% ~29%,于ATRA诱导治疗的第1~3天联合化疗,其发生率为6% ~15%,病死率为6%[4, 5]。近年来的文献报道中DS的发病率较以往有所下降,可能与对DS的充分认识及激素类药物的早期应用有关。 2DS的发病机制 目前关于分化综合征的发病机制尚未充分阐明。在临床观察中我们发现DS并未出现在APL患者缓解后用ATRA和(或)ATO维持治疗过程中,也未出现在非APL患者接受ATRA治疗的过程中,仅仅在初次诊断为APL患者接受ATRA和(或)ATO诱导治疗的过程中,这表明APL细胞在DS发生的过程中起着重要的角色[4-10]。APL细胞上的细胞黏附分子CDl5、CDlla及CD11b等可与内皮细胞受体-细胞间黏附分子-1( intracellular adhesion molecule-1, ICAM-1)相互作用[4]。白细胞黏附受体CD11b是表达于中性粒细胞表面的重要细胞黏附分子,在中性粒细胞与内皮细胞间相互作用的炎症反应中起着重要的作用[11]。同时CD11b又是重要的细胞分化标志,在早幼粒细胞阶段为阴性[12]。随着细胞的分化、成熟逐渐表达于细胞表面,如表达的速度过于同步化,则使大量表达黏附分子白血病细胞滞留于肺循环,导致严重的通气功能障碍甚至ARDS[13]。徐娟等通过对初次诊断APL患者在服用ATRA 诱导治疗过程中对不同时间的骨髓细胞黏附分子表达进行动态监测,发现CD11b的大量表达于分化综合征有密切的关系[14]。Vahdat等通过回顾性分析了所有接受维甲酸治疗4年的患者,共评估75项危险因素,发现CD13在DS的发生发展过程中起着重要作用[15]。A TRA因具有能使PML-RARα发生构型的改变、能调节CAMP-PKA信号传导通路激活转录并诱导分化、能触发由caspase介导的PML-RARα溶解途径等作用而广泛应用于APL患者的诱导治疗中。ATRA同时具有上调编码整合素的基因,促进APL细胞表面的黏附受体表达[16]。而整合素(白细胞黏附受体)可介导白细胞黏附至毛细血管内皮细胞(促进病灶内皮渗漏)及细胞外基质[16]。ATRA在诱导APL细胞分化过程中发现特定的趋化因子(CCL2和CXCL8)上调,致使APL细胞增加向肺泡上皮细胞的迁移,导致早期的肺部浸润[17, 18]。地塞米松或中和抗体与特定的趋化因子能抑制肺泡趋化因子的分泌从而减少APL细胞的迁移[17, 18]。在这方面, Tsai等表明在体外ATRA对APL细胞刺激大大增加了白血病细胞对肺泡上皮细胞的浸润[17, 18]。同时A TRA诱导分化的APL细胞分泌IL-1β、IL-6、IL-8、TNFα等血管活性细胞因子[16]。其中IL-1β、IL-6、TNFα等造血生长因子促进白细胞活化。这些细胞因子可解释DS的部分临床表现(发热、突发性低血压、体质量增加或积液)[9, 16]。
脂质体转染的实验原理与操作步骤大全 日期:2012-06-25 来源:互联网作者:青岚点击:3644次 摘要: 细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等,理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等,本文主要介绍细胞转染常用的方法-脂质体转染的原理和操作步骤等。 找产品,上生物帮>> >> 细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等,理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等,本文主要介绍细胞转染常用的方法-脂质体转染的原理和操作步骤等。 脂质体(lipofectin regeant,LR)试剂是阳离子脂质体N-[1-2,3-Dioleyoxy,Propyl]-n,n,n-Trimethylammonium Chloride(DOTMA)和Dioleoyl photidye-thanolamine(DOPE)的混合物[1:1(w/w)]。它适用于把DNA转染入悬浮或贴壁培养细胞中,是目前条件下最方便的转染方法之一。转染率高,优于磷酸钙法,比它高5~100倍,能把DNA和RNA转染到各种细胞。 用LR进行转染时,首先需优化转染条件,应找出该批LR对转染某一特定细胞适合的用量、作用时间等,对每批LR都要做:第一,先要固定一个DNA的量和DNA/LR混合物与细胞相互作用的时间,DNA可从1~5μg和孵育时间6小时开始,按这两个参数绘出相应LR需用量的曲线,再选用LR和DNA两者最佳的剂量,确定出转染时间(2~24小时)。因LR对细胞有一定的毒性,转染时间以不超过24小时为宜。 细胞种类:COS-7、BHK、NIH3T3、Hela和Jurkat等任何一种细胞均可作为受体细胞。 一、脂质体(liposome)转染方法原理 脂质体(liposome)转染方法原理:脂质体((Iiposome)作为体内和体外输送载体的工具,已经研究的十分广泛,用合成的阳离子脂类包裹DNA,同样可以通过融合而进人细胞。使用脂质体将DNA带人不同类型的真核细胞,与其它方法相比,有较高的效率和较好的重复性。 中性脂质体是利用脂质膜包裹DNA,借助脂质膜将DNA导入细胞膜内。带正电的阳离子脂质体,DNA并没有预先包埋在脂质体中,而是带负电的DNA自动结合到带正电的脂质体上,形成DNA-阳离子脂质体复合物,从而吸附到带负电的细胞膜表面,经过内吞被导入细胞。 二、脂质体转染操作步骤 1、操作步骤[方法一]:
脂质体转染的实验原理与操作步骤大全 日期:2012-06-25 来源:互联网作者:青岚点击:3644次 摘要: 细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等, 理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等, 本文主要介绍细胞转染常用的方法 -脂质体转染的原理和操作步骤等。 找产品,上生物帮 >> >> 细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等, 理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等,本文主要介绍细胞转染常用的方法 -脂质体转染的原理和操作步骤等。 脂质体 (lipofectin regeant, LR 试剂是阳离子脂质体 N-[1-2, 3-Dioleyoxy , Propyl]-n, n , n-Trimethylammonium Chloride(DOTMA和 Dioleoyl photidye-thanolamine(DOPE的混合物 [1:1(w/w]。它适用于把 DNA 转染入悬浮或贴壁培养细胞中 ,是目前条件下最方便的转染方法之一。转染率高,优于磷酸钙法,比它高 5~100倍,能把 DNA 和 RNA 转染到各种细胞。 用 LR 进行转染时, 首先需优化转染条件, 应找出该批 LR 对转染某一特定细胞适合的用量、作用时间等,对每批 LR 都要做:第一,先要固定一个 DNA 的量和DNA/LR混合物与细胞相互作用的时间, DNA 可从1~5μg和孵育时间 6小时开始,按这两个参数绘出相应 LR 需用量的曲线,再选用 LR 和 DNA 两者最佳的剂量,确定出转染时间 (2~24小时。因 LR 对细胞有一定的毒性,转染时间以不超过 24小时为宜。
脂质体及其制备方法的选择 1.脂质体概述 1965年,英国学者Bangham和Standish将磷脂分散在水中进行电镜观察时发现了脂质体。磷脂分散在水中自然形成多层囊泡,每层均为脂质的双分子层;囊泡中央和各层之间被水相隔开,双分子层厚度约为4纳米。后来,将这种具有类似生物膜结构的双分子小囊称为脂质体。此两位学者曾获得过诺贝尔奖提名。 某些磷脂分散在过量的水中形成了脂质体,该脂分子本身排成双分子层,在磷脂的主要相变温度(Tm)以上,瞬间形成泡囊,且泡囊包围水液,根据磷脂种类及制备时所用温度,双分子层可以是凝胶或液晶状态。在凝胶态时磷脂烃链是一种有规律的结构,在液态时烃链是无规律的,每一种用来制备脂质体的纯磷脂由凝胶状态过渡到液晶状态时均具有特征的相变温度。这种相变温度(Tin)是根据磷脂性质而变(见下表),它可在-20~+90℃之间变化,双分子层的不同成分混合物可引起相变温度的变化或相变完全消失,当双分子层通过相变温度时,被封闭的 所有这些都明显影响脂质体的稳定性和它们在生物体系中的行为。 脂质体根据其脂质膜的层数和腔室的数量,可以分为单层脂质体,多层脂质体和多囊脂质体,单层脂质体。不同类型的脂质体其结构特点各不相同,见下图表。 1971年,英国Rymen等人开始将脂质体用作药物载体。所谓载体,可以是一组分子,包蔽于药物外,通过渗透或被巨嗜细胞吞噬后载体被酶类分解而释放药物,从而发挥作用。它具有类细胞结构,进入动物体内主要被网状内皮系统吞噬而激活机体的自身免疫功能,并改变被包封药物的体内分布,使药物主要在肝、脾、肺和骨髓等组织器官中积蓄,从而提高药物的治疗指数,减少药物的治疗剂量和降低药物的毒性。脂质体技术是被喻为“生物导弹”的第四代靶向给药技术,也是目前国际上最热门的制药技术。至于药物在脂质体中的负载定位,其取决于所载药物的性质,见下图。
全反式维甲酸联合三氧化二砷治疗成人急性早幼粒细胞白 血病的效果 [摘要] 目的探讨全反式维甲酸(ATRA)联合三氧化二砷治疗成人急性早幼粒细胞白血病的效果。方法选取本院2009年1月~2014年1月收治的57例急性早幼粒细胞白血病患者作为研究对象,随机分成观察组(27例)与对照组(30例)。观察组采用ATRA联合三氧化二砷进行治疗,对照组单纯采用ATRA进行治疗。比较两组的治疗效果及相关不良反应发生率。结果两组的PML-RARα融合基因转阴率比较,差异无统计学意义(P>0.05)。观察组的达到CR时间显著短于对照组,CR率显著高于对照组,白细胞峰值显著小于对照组,差异有统计学意义(P<0.05)。观察组的不良反应发生率显著低于对照组,差异有统计学意义(P<0.05)。所有患者随访1年,观察组的无病生存率显著高于对照组,复发率显著低于对照组,差异有统计学意义(P<0.05)。结论ATRA联合三氧化二砷治疗成人急性早幼粒细胞白血病效果显著,可以缩短CR时间,提高缓解率,且不良反应发生率与复发率较低,值得临床推广应用。 [关键词] 全反式维甲酸;三氧化二砷;成人;急性早幼粒细胞白血病
[中图分类号] R557+.3 [文献标识码] A [文章编号] 1674-4721(2016)03(c)-0081-03 [Abstract] Objective To explore the effect of all trans retinoic acid combined with arsenic trioxide in the treatment of acute promyelocytic leukemia. Methods 57 cases of acute promyelocytic leukemia from January 2009 to January 2014 in our hospital were selected and randomly divided into the observation group (27 cases)and the control group (30 cases).The observation group was treated with all trans retinoic acid combined with arsenic trioxide,the control group was treated with all trans retinoic acid.The therapeutic effect and the incidence rate of adverse reaction in the two groups was compared. Results There was no significant difference in the negative rate of PML-RAR alpha fusion gene between two groups (P>0.05).The time of achieving CR in the observation group was shorter than that in the control group,the CR rate of the observation group was higher than that in the control group,the peak value of white blood cell in the observation group was less than that in the control group,with significant different (P<0.05).The incidence rate of adverse reaction in the observation group was lower than that in the control group,with significant different (P<0.05).All patients were followed
细胞转染的操作步骤 转染,是将外源性基因导入细胞内的一种专门技术。随着基因与蛋白功能研究的深入,转染目前已成为实验室工作中经常涉及的基本方法。转染大致可分为物理介导、化学介导和生物介导三类途径。电穿孔法、显微注射和基因枪属于通过物理方法将基因导入细胞的范例;化学介导方法很多,如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法,有较为原始的原生质体转染,和现在比较多见的各种病毒介导的转染技术。红外碳硫仪理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。病毒介导的转染技术,是目前转染效率最高的方法,同时具有细胞毒性很低的优势。但是,病毒转染方法的准备程序复杂,常常对细胞类型有很强的选择性,在一般实验室中很难普及。其它物理和化学介导的转染方法,则各有其特点。 >需要指出的一点,无论采用哪种转染技术,要获得最优的转染结果,可能都需要对转染条件进行优化。影响转染效率的因素很多,从细胞类型、细胞培养条件和细胞生长状态,到转染方法的操作细节,都需要考虑。 一、细胞传代 1. 试验准备:200ul/1mlTip头各一盒(以上物品均需高压灭菌),酒精棉球,废液缸,试管架,微量移液器,记号笔,培养皿,离心管。 2. 弃掉培养皿中的培养基,用1ml的PBS溶液洗涤两次。 3. 用Tip头加入1ml Trypsin液,消化1分钟。用手轻拍培养瓶壁,观察到细胞完全从壁上脱落下来为止。 4. 加入1ml的含血清培养基终止反应。 5. 用Tip头多次吹吸,使细胞完全分散开。 6. 将培养液装入离心管中,1000rpm离心5min。 7. 用培养液重悬细胞,细胞计数后选择0.8X106个细胞加入一个35mm培养皿。8. 将合适体积完全培养液加入离心管中,混匀细胞后轻轻加入培养皿中,使其均匀分布。 9. 将培养皿转入培养箱中培养,第二天转染。 二、细胞转染 1. 转染试剂的准备 ①将400ul去核酸酶水加入管中,震荡10秒钟,溶解脂状物。 ②震荡后将试剂放在-20摄氏度保存,使用前还需震荡。 2. 选择合适的混合比例(1:1-1:2/脂质体体积:DNA质量)来转染细胞。在一个转染管中加入合适体积的无血清培养基。加入合适质量的MyoD或者EGFP的DNA,震荡后在加入合适体积的转染试剂,再次震荡。 3. 将混合液在室温放置10―15分钟。 4. 吸去培养板中的培养基,用PBS或者无血清培养基清洗一次。 5. 加入混合液,将细胞放回培养箱中培养一个小时。 6. 到时后,红外碳硫仪根据细胞种类决定是否移除混合液,之后加入完全培养基继续培养24-48小时。三、第二次细胞传代1. 在转染后24小时,观察实验结果并记录绿色荧光蛋白表达情况。 2. 再次进行细胞传代,按照免疫染色合适的密度0.8X10 个细胞/35mm培养皿将细胞重新转入培养皿中。 3. 在正常条件下培养24小时后按照染色要求条件固定。