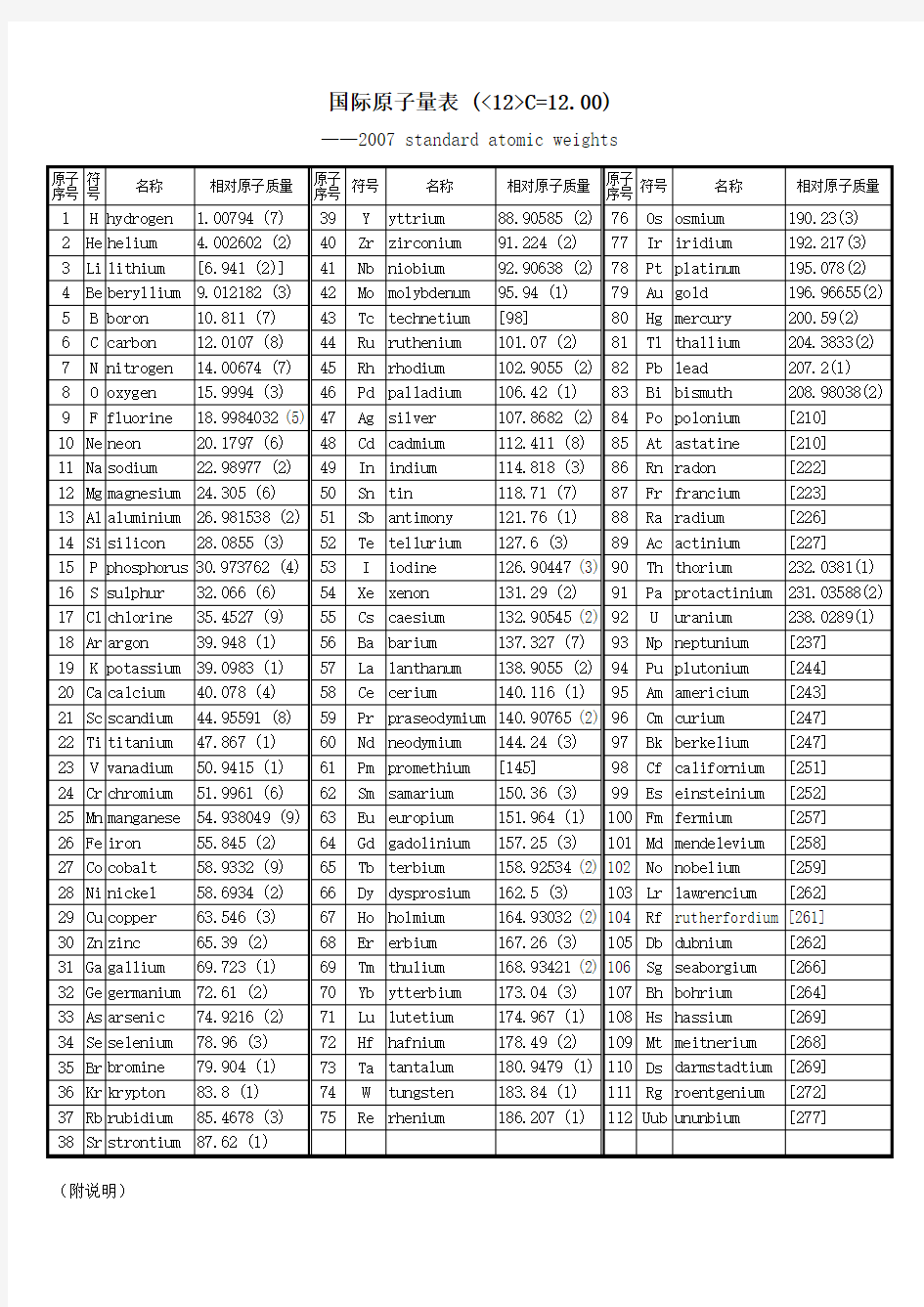

国际原子量表 (<12>C=12.00)
——2007 standard atomic weights
(附说明)
(英文名:Table of Standard Atomic Weights)是指各个元素原子的相对质量的汇总表,由国际原子量委员会(ICAW)根据最新的检测技术确定的各个元素的相对质量制定国际[[原子量表]],目前,国际原子量委员会(ICAW)已并入国际纯粹与应用[[化学]]联合会(IUPAC),最新的国际原子量表为2007年国际原子量表。
原子量表的由来和历史:
19世纪初J.道尔顿在提出原子学说的同时就提出了原子量概念。他将氢原子量定为1.0,并以此做标准,根据物质质量组成及假定其中原子个数比,如把水中氢和氧原子个数比定为1∶1,然后对比得出其他元素原子量。
1803年他发表了世界上第一张原子量表。因为氧的[[化合物]]比氢的化合物多,1818年J.J.贝采利乌斯将氧原子量定为100,并以此做基准。1860年J.S.斯塔提出将天然氧定为16,并以此做基准。
1929年发现氧有3种[[核素]],即O16,O17,O18。后来又证实氧[[同位素]]不是均匀地分布于自然界。用天然氧做原子量标准不够完善,[[物理]]界改用O16等于16做标准,化学界仍采用天然氧等于16做基准。当用物理标准时,氧的各种同位素原子量分别为:O16等于16.0000,O17等于17.0045,O18等于18.0049。因此,自然界中,氧平均原子量为16.0044,两者比值16.0044/16.0000=1.000275。
1940年国际原子量委员会(ICAW)开始采用1.000275为两种标准的换算因数,即
物理原子量=1.000275×化学原子量
1959年马托赫向国际化学协会建议以12C等于12为原子量新基准,可使各元素原子量变动不大。因为12C在碳的天然同位素中所占相对百分数比较固定,而且质谱法测定12C的质量也较精确。1960年和1961年国际物理学会和化学会分别接受了这个建议。从此原子量有了统一的新基准,不再存在所谓化学原子量和物理原子量的区别,而统一改称为国际原子量。
1979年国际原子量委员会提出新定义,一种元素的原子量是“该元素1mol质量对核素12C1mol质量1/12的比值”。即,原子量的真实涵义是元素的相对原子质量,是元素的平均原子质量与核素12C
原子质量的1/12之比。元素的平均原子质量是元素各核素的原子质量与其百分含量(丰度)乘积的加合。原子量表 (<12>C=12.00)(2005年版一部)
原子量测定的历史回顾 原子量的测定在化学发展的历史进程中,具有十分重要的地位。正如我国著名化学家傅鹰先生所说:“没有可靠的原子量,就不可能有可靠的分子式,就不可能了解化学反应的意义,就不可能有门捷列夫的周期表。没有周期表,则现代化学的发展特别是无机化学的发展是不可想象的”,在已建立了科学的原子量基准,并且通过相当完善精密的原子量测定方法测得足够精确的原子量数值的今天,我们回顾一下化学科学发展进程中这段重要史实,对于深入研究化学发展规律,帮助我们正确理解和使用原子量,无疑是大有稗益的。 一、道尔顿的开山之功英国著名的化学家道尔顿 (J.Dalton,1766~1844)在提出原子论观点的同时,就为确定不同元素原子的相对重量作了努力。从而成为化学史上测定原子量的第一人,成为这一领域的拓荒者。在当时的历史条件下,要确定各种元素的相对重量并非易事。这首先要确立一个相对标准,既以谁为参照基准。其次要有准确的定量分布手段,并且要明确单质和化合物分子中元素原子的数目,这在当时对于大多数化合物是很难做到的。正是由于这个原因,道尔顿只能采用主观武断的方法规定不同元素的原子化合形成化合物的原子数目比。例如,他认为水是由1个氧原子和1个氢原子组成的。这祥,根据当时拉瓦锡
(https://www.doczj.com/doc/ed9219979.html,voisier,1743~1794)对水的重量分析的结果,以他选择的氢原子的相对重量为1做基准,算得氧原子相对重量为5.5。 1803年10月21日,道尔顿在曼彻斯特的“文学和哲学学会”上阐述他的原子论观点时,第一次公布了6种元素的原子相对重量,但他没有宣布数据的实验根据。此后,他又先后于1808年、1810年、1827年在其著名的《化学哲学新体系》一书的第一、二卷中不断增加元素种类,使之最终增至37种,并对部分数值做了修正……由于道尔顿以主观武断的方式确定物质的组成,因而所得的原子相对重量都与今天的原子量相差甚远。尽管如此,他的这项极富开性和科学性,使之一直沿用至今。更重要的是他的这项工作在当时为广大化学工作者找到了正确的前进方向,使得化学科学向系统化、理性化迈进了一步。正如恩格斯指出:“在化学中特别是由于道尔顿发现了原子量,现已达到各种结果都具有了秩序和相对的可靠性,已经能够有系统地、差不多是有计划地向还没有被征服的领域进攻,就象计划周密地围攻一个堡垒一样”。二、贝采里乌斯的非凡工作道尔顿首创的确定元素原子相对重量的工作,在当时的欧洲科学界引起了普通的关注和反应。各国的化学家们在充分认识到确定原子量的重要性的同时,对于道尔顿所采用的方法和所得到的数值感到不满和怀疑。于是继他之后,许多人便纷纷投入测定原子量的行列中,使这项工作成为19世纪上半叶化学
原子序数元素名称元素符号相对原子质量 1 氢 H 1.007 94(7) 2 氦 He 4.002 602(2) 3 锂 Li 6.941(2) 4 铍 Be 9.012 182(3) 5 硼 B 10.811(7) 6 碳 C 12.017(8) 7 氮 N 14.006 7(2) 8 氧 O 15.999 4(3) 9 氟 F 18.998 403 2(5) 10 氖 Ne 20.179 7(6) 11 钠 Na 22.989 769 28(2) 12 镁 Mg 24.305 0(6) 13 铝 Al 26.981 538 6(8) 14 硅 Si 28.085 5(3) 15 磷 P 30.973 762(2) 16 硫 S 32.065(5) 17 氯 Cl 35.453(2) 18 氩 Ar 39.948(1) 19 钾 K 39.098 3(1) 20 钙 Ca 40.078(4) 21 钪 Sc 44.955 912(6) 22 钛 Ti 47.867(1) 23 钒 V 50.941 5(1) 24 铬 Cr 51.996 1(6) 25 锰 Mn 54.938 045(5) 26 铁 Fe 55.845(2) 27 钴 Co 58.933 195(5) 28 镍 Ni 58.693 4(2) 29 铜 Cu 63.546(3) 30 锌 Zn 65.409(4) 31 镓 Ga 69.723(1) 32 锗 Ge 72.64(1) 33 砷 As 74.921 60(2) 34 硒 Se 78.96(3) 35 溴 Br 79.904(1) 36 氪 Kr 83.798(2) 37 铷 Rb 85.467 8(3) 38 锶 Sr 87.62(1) 39 钇 Y 88.905 85(2) 40 锆 Zr 91.224(2) 41 铌 Nb 92.906 38(2) 42 钼 Mo 95.94(2) 43 锝 Tc [97.9072]
氢气H2 2 五氧化二磷P2O5142 氧气O232 氢氧化钙(熟石灰)Ca(OH)274 氯气Cl271 氢氧化铜Cu(OH)298 氨气NH317 氢氧化钠NaOH 40 氮气N228 过氧化氢(双氧水)H2O234 一氧化碳CO 28 碱式碳酸铜(绿)Cu2(OH)2CO3222 二氧化碳CO244 盐酸(氯化氢)HCl 36.5 一氧化硫SO 48 氯化钙CaCl2111 二氧化硫SO264 氯化钾KCl 74.5 三氧化硫SO380 氯化铁(淡黄 FeCl3162.5 溶) 二氧化锰MnO287 氯酸钾KClO3122.5 碳酸H2CO362 高锰酸钾(灰锰氧)KMnO4158 碳酸钙CaCO3100 硫酸铜(白固蓝 CuSO4160 溶) 碳酸氢铵NH4HCO379 硫酸钠Na2SO4142 硝酸HNO363 硝酸铵NH4NO380 硫酸H2SO498 甲烷CH416 亚硫酸H2SO382 尿素CO(NH2)260 磷酸H3PO498 甲醇CH3OH 32 水H2O 18 乙醇(酒精)C2H5OH 46 氧化铜(黑)CuO 80 乙炔C2H226 氧化镁(白)MgO 40 乙酸(醋酸)CH3COOH 60 氧化钙(白)CaO 56 四氧化三铁(黑)Fe3O4232 氧化铁(红)Fe2O3160 氧化亚铁(黑)FeO 72
硫酸亚铁(淡绿)FeSO4152 硫酸锌(白/无)ZnSO4161 初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量/ 一个 碳原子质量的1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量×m+B的相 对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m: B的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn 的相对分子质量
元素符号、中文名称及原子量列表(2014年版) 汇编人:Damien QQ:478568144 序数符号台湾名称香港名称大陆名称英文名称相对原子质量 1 H 氫氢Hydrogen 1.00794(7) 2 He 氦Helium 4.002602(2) 3 Li 鋰锂Lithium 6.941(2) 4 Be 鈹铍Beryllium 9.012182(3) 5 B 硼Boron 10.811(7) 6 C 碳Carbon 12.0107(8) 7 N 氮Nitrogen 14.0067(2) 8 O 氧Oxygen 15.9994(3) 9 F 氟Fluorine 18.9984032(5) 10 Ne 氖Neon 20.1797(6) 11 Na 鈉钠 Sodium (来自拉丁语Natrium) 22.98976928(2) 12 Mg 鎂镁Magnesium 24.3050(6) 13 Al 鋁铝Aluminium 26.9815386(8) 14 Si 矽硅Silicon 28.0855(3) 15 P 磷Phosphorus 30.973762(2) 16 S 硫Sulfur/Sulphur 32.065(5) 17 Cl 氯Chlorine 35.453(2) 18 Ar 氬氩Argon 39.948(1) 19 K 鉀钾 Potassium (来自德语Kalium) 39.0983(1) 20 Ca 鈣钙Calcium 40.078(4) 21 Sc 鈧钪Scandium 44.955912(6) 22 Ti 鈦钛Titanium 47.867(1) 23 V 釩钒Vanadium 50.9415(1) 24 Cr 鉻铬Chromium 51.9961(6) 25 Mn 錳锰Manganese 54.938045(5) 26 Fe 鐵铁 Iron (来自拉丁语Ferrum) 55.845(2) 27 Co 鈷钴Cobalt 58.933195(5) 28 Ni 鎳镍Nickel 58.6934(4)
金砷合金砷量的测定 电感耦合等离子体原子发射光谱法试验报告 (征求意见稿) 北京有色金属与稀土应用研究所 2018年11月
金砷合金 砷量的测定 电感耦合等离子体原子发射光谱法 1、前言 金砷合金材料主要用于新一代信息技术、船舶及海洋工程、航空航天、国防科技等领域,是一种优质的电子薄膜材料具有不可代替性,与国家的战略发展紧密联系在一起。并且打破了国际垄断带来的一系列弊端。测试方法的制定和国家“一带一路”技术创新等产业息息相关,因此金砷合金检测方法的制定更为重要。金砷合金材料主要用于集成电路、光盘、LCD、PDP显示器、一般玻璃镀层和P.L.S波段硅功率管等方面,应用广泛需求量大。因此研究制定砷的检测方法势在必行。利用电感耦合等离子发射光谱法测定砷含量操作方法简单,快速,结果准确。制定方法后对控制金砷合金产品的批次一致性、稳定性、生产成本、检测周期会有明显提高和改善,为产品质量监控提供方法保障,同时电感耦合等离子发射光谱仪的市场占有率高,方法容易推广使用,并且填补了金砷合金中砷量测定的空白。 2、实验部分 2.1 试剂与材料 除非另有说明外,在分析中仅使用确认为优级纯试剂和去离子水(在线电阻率不大于18.2MΩ.cm-1)。试验中所需的标准溶液除本部分规定的配制方法配制外,也可使用国家标准物质(标准溶液)。 2.1.1 盐酸(ρ1.19g/mL)。 2.1.2 硝酸(ρ1.42g/mL)。 2.1.3 硝酸(1+1),用时现配。 2.1.4 混合酸:3体积盐酸(2.1.1)和1体积硝酸(2.1.2)混匀,用时现配。 2.1.5 砷标准贮存溶液:称取0.5000g金属砷(w As≥99.99%),置于200mL 烧杯中,加入50mL硝酸(2.1.3),盖上表面皿,加热溶解,冷却,移入500mL 容量瓶中,用水稀释至刻度,混匀。此溶液1mL含1000μg砷。 2.1.6 砷标准溶液:准确移取10.00mL砷标准贮存溶液(2.1.5)至100mL容量瓶中,加入10mL盐酸(2.1.1)稀释至刻度,混匀。此溶液1mL分别含100μg砷。 2.1.7 氩气(体积分数≥99.99%)。 2.2 仪器 电感耦合等离子体发射光谱仪。 -200nm处光谱分辨率应小于0.01nm。 3 试验方法 称取 0.10g 试样,精确至 0.0001g。置于 100mL 烧杯中,加入10 mL 混合酸(2.1.4),加热至试料完全溶解,冷却,按表1移入相应容量瓶,分取试液,加入盐酸(2.1.1),用水稀释至刻度,混匀。随同试料做空白试验,然后用ICP-AES直接检测。
早期原子量与贝采里乌斯 沃壤破土——原子学说的出现 十八世纪七十年代在化学发展史上具有划时代的意义。法国化学家拉瓦锡使用天平研究了燃烧前后物质和氧气的质量变化,提出了燃烧的氧化学说,推翻了燃素说,使倒立的化学理论正立过来。拉瓦锡对天平的使用,对质量守恒定律的信念,开创了定量化学时代。化学家们普遍开始使用天平研究化学反应中的质量变化,研究物质中各成分的含量。 1799年,移居马德里的法国人普罗斯提出了定组成定律:不论来源和制备方法如何,一种化合物总是以相同的质量比含有相同的元素。这一时期发现的重要化学计算定律还有:酸碱中和的当量定律;含同种元素化合物的倍比定律等。1808年,英国中学教师道尔顿以他非凡的科学洞察力提出了原子学说,对这些化学定律提供了简明而深刻的解释。原子论的提出,为整个自然科学找到了中心。 根深才能叶茂——原子论的实验基础:原子量测定 在道尔顿的原子论中,各种原子是以其质量为基本特征的。不同种原子化合时的质量比是与它们的相对质量和原子个数比相联系的。例如氢与氧化合生成水,一份质量的氢需八份质量的氧。如果假定氢、氧原子个数比为1:1,则氧原子质量是氢原子质量的八倍;如果假定氢、氧原子个数比为2:1,则氧原子质量是氢原子质量的十六倍。不同的原子个数比将得出不同的原子相对质量。在缺乏其它实验方法的情况下,道尔顿认为水中只含一个氢原子和一个氧原子。他把氢定为原子量标准,规定氢的原子量为1,从而得出氧的原子量为8。根据对氨组成的分析(含氢20%,含氮80%),并认为氨中只含一个氢原子和一个氮原子,得出氮的原子量为4。这些错误首先是由于道尔顿对化学式毫无根据的武断判断引起的。1809年,瑞典化学家贝采里乌斯知道了道尔顿的原子论,他很受启发。除了在自己的研究中用原子论作理论论证以外,贝采里乌斯还以他的远见卓识看到了原子量测定的意义及其复杂多样性。他在赞赏原子论的同时又指出,可以公正地责备道尔顿解决问题的过程中很少重视实验。他预见到缺乏实验根据的原子量会淹没原子论辉煌的照耀。贝采里乌斯以他生动明快的笔调写道:“我明白了,首先应当以最大的精确度测出尽可能多的元素的原子量。不这样,化学理论所望眼欲穿的光明白昼就不会紧跟着它的朝霞而出现。这是那时候化学研究的最重要任务,所以我完全献身于它。” 从孤儿到化学大师——时代弄潮儿 雅科比·贝采里乌斯1779年8月20日生于瑞典林彻平附近的韦斐松答村。他四岁丧父,母亲改嫁后不久也死去了。继父虽不富裕,但仍给七个孩子请了家庭教师。为了教育的目的,继父常组织郊游。小雅科比十分醉心于研究野外的动植物。继父对雅科比关于植物的精到的见解感到惊奇。有一次他说:“雅科比,你有足够的天赋去追随林奈的足迹。” 那时,瑞典的矿业和冶金工业处于欧洲的前列。全欧洲40%的铁和大部分优质钢由瑞典提供。1807年,在首都斯德哥尔摩制造了第一台蒸汽机。不久,蒸汽机就应用到瑞典工业的各个部门。经济的发展和需求促进了科学的发展,科学界人才辈出。 十八世纪中叶,卡尔·林奈相继发表了《自然体系》、《植物学原理》、《植物的种》等杰出著作,对已积累的实际材料进行系统的分类,并勾画出一幅统一的
常见物质的相对原子质量分别是多少 由于原子的实际质量很小,如果人们用它们的实际质量来计算的话那就非常的麻烦,例如一个氢原子的实际质量为1.674×10?2?千克,一个氧原子的质量为2.657×10?2?千克。一个碳-12原子的质量为1.993×10?2?千克。元素的相对原子质量是其各种同位素相对原子质量的加权平均值。元素周期表中最下面的数字为相对原子质量。今天小编就来介绍一下我们初中阶段常见物质的相对原子质量分别是多少。 常见物质的相对原子质量:
相对原子质量的易错点: 1. 如果在元素符号前面添上系数,就只表示该元素原子个数,不能表示该元素。如:H既表示氢元素,又表示一个氢原子;2H只能表示两个氢原子。 2. 相对原子质量只是一个比,不是原子的实际质量。 3. 在相对原子质量计算中,所选用的一种碳原子是碳12,是含6个质子和6个中子的碳原子,它的质量的1/12约等于1.66×10-27 kg。 常见物质的相对原子质量记忆方法: 1.相对原子质量等于质子数与中子数的和。H没有中子,那么原子质量就是1.。随着原子序数的增加,质量也增加。 2.第二周期记住C、N、O即可。C为12,N为14,O为16。 3.接下来是第三周期,相对更重要一些Na为23,Mg为24, Al为27,Si为28,P为31, S为32,Cl为35.5。这几个是常用的,所以在用的时候多看看书,或者拿一张纸专门记这几个原子质量,需要用的时候看看,看的多了自然就记住了。还有K为39,Ca为40,Fe为56, Cu为6 4.这几个也是同样的道理。 4.至于其他的一些,通常都是在某一种专有的化合物中出现,如KMnO4等,这些就只要记住化合物的质量就行,不必专门记Mn了。
At No Symbol Name Atomic Wt Notes 1 H Hydrogen 1.008 3, 6 2 He Helium 4.002602(2) 1, 2 3 Li Lithium 6.9 4 3, 6 4 Be Beryllium 9.0121831(5) 5 B Boron 10.81 3, 6 6 C Carbon 12.011 6 7 N Nitrogen 14.007 6 8 O Oxygen 15.999 6 9 F Fluorine 18.998403163(6) 10 Ne Neon 20.1797(6) 1, 3 11 Na Sodium 22.98976928(2) 12 Mg Magnesium 24.305 6 13 Al Aluminium 26.9815385(7) 14 Si Silicon 28.085 6 15 P Phosphorus 30.973761998(5) 16 S Sulfur 32.06 6 17 Cl Chlorine 35.45 3, 6 18 Ar Argon 39.948(1) 1, 2 19 K Potassium 39.0983(1) 20 Ca Calcium 40.078(4) 21 Sc Scandium 44.955908(5) 22 Ti Titanium 47.867(1) 23 V Vanadium 50.9415(1) 24 Cr Chromium 51.9961(6) 25 Mn Manganese 54.938044(3) 26 Fe Iron 55.845(2) 27 Co Cobalt 58.933194(4) 28 Ni Nickel 58.6934(4) 2 29 Cu Copper 63.546(3) 2 30 Zn Zinc 65.38(2) 2 31 Ga Gallium 69.723(1) 32 Ge Germanium 72.630(8) 33 As Arsenic 74.921595(6) 34 Se Selenium 78.971(8) 35 Br Bromine 79.904 6 36 Kr Krypton 83.798(2) 1, 3 37 Rb Rubidium 85.4678(3) 1 38 Sr Strontium 87.62(1) 1, 2 39 Y Yttrium 88.90584(2)
蒂 袂 1 2 He 3 Li 4 Be 5 B C 6 7 N 0067 O 8 9 F 价态半径 乳&4 蒇兀素原子半径表 薇H Lit hirni 1. 54 0.55 (+2)0.40 (+3)0. 0Z Nit ragen 康手名称原干数原手宣 原干名称 原子数界千量 廉干半徑 价态半徑 Hydr o£en 1 L 0079 0. 78 (+0-0.38 (-1)1.40 D 0.78 D+? -0.24 D^l ~L40 屢子名称 履子数序手量 原手半径 价恋半径 Heliujn. J 2 4.0D26 1. 00 1 1 原手举径 原手名称原千数 原子半径 价态半径 Beryl 11? 4 9. 0121B 1.13 [(H-2J0. 17 价态半径 原手名称 原千數 療手童 原子半径 Boron 5 30. 81 0. 95 (-2) 1. 06 (-3)1.22 (+1)0. 58 壕子备称 燥子数原子童 嶋干半径 价态半径 C ar bon 5 12.011 0,S6 f7+l)0.49 (+2>□, 00 gO. 55 (-M)-O. 08 [圧 1J1- 10 (-2)1.38 (-4)1.77 斥子名称 原子数源于虽 廩千半径 价态半径 d S0 (+1)0. 59 (+2) 0L 37 (+5)-0. 12 (-1)1* 10 (-2) 1. 2S (+3)0.16 原干名称 原千数原子量 原子半径 桥态半径 Ossygen 呂 15* 3334 卜刃 1. 21 ' L J (-3)1^3 原手名称原于数原手童 原子半径 价态半懂 Flourine 9 18. 998403 □, 64 (+7) 0, 08 (-1) 1. 15
氢气H22五氧化二磷P2O5142 74氧气O232氢氧化钙(熟石灰).Ca(OH) 2 氯气Cl271氢氧化铜Cu(OH)298氨气NH3~17氢氧化钠NaOH40氮气N228过氧化氢(双氧水)H2O234 # 一氧化碳CO28碱式碳酸铜(绿)Cu2(OH)2CO3222二氧化碳CO244盐酸(氯化氢)?HCl 一氧化硫SO48氯化钙CaCl2111二氧化硫SO2,64氯化钾KCl FeCl3 三氧化硫SO380氯化铁(淡黄 溶) 【 二氧化锰MnO287氯酸钾KClO3 158碳酸H2CO362高锰酸钾(灰锰氧)}KMnO 4 CuSO4160碳酸钙CaCO3100硫酸铜(白固蓝 溶) 碳酸氢铵NH4HCO3—79硫酸钠Na2SO4142硝酸HNO363硝酸铵NH4NO380 ) 硫酸H2SO498甲烷CH416 亚硫酸H2SO382尿素!CO(NH )260 2 磷酸H3PO498甲醇CH3OH32水H2O、18乙醇(酒精)C2H5OH46氧化铜(黑)CuO80乙炔C2H226 | 氧化镁(白)MgO40乙酸(醋酸)CH3COOH60氧化钙(白)CaO56] 四氧化三铁(黑)Fe3O4232 氧化铁(红)Fe2O3—160
氧化亚铁(黑)FeO72 ! 硫酸亚铁(淡绿)FeSO4152 硫酸锌(白/无)ZnSO4161》 初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量/ 一个 碳原子质量的1/12 (2)设某化合物化学式为AmBn " ①它的相对分子质量=A的相对原子质量×m+B的相 对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m: B的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn 的相对分子质量
相对原子质量表 本相对原子质量表按照原子序数排列。 本表数据源自2005年IUPAC元素周期表 (IUPAC 2005 standard atomic weights),以12C=12 为标准。 本表方括号内的原子质量为放射性元素的半衰期最长的同位素质量数。 相对原子质量末位数的不确定度加注在其后的括号内。 112-118号元素数据未被IUPAC确定。 原子序数元素名称元素符号相对原子质量原子序数元素名称元素符号相对原子质量 1 氢H 1.007 94(7)21 钪Sc 44.955 912(6) 2 氦He 4.002 602(2)22 钛Ti 47.867(1) 3 锂Li 6.941(2)23 钒V 50.941 5(1) 4 铍Be 9.012 182(3)24 铬Cr 51.996 1(6) 5 硼 B 10.811(7)25 锰Mn 54.938 045(5) 6 碳 C 12.017(8)26 铁Fe 55.845(2) 7 氮N 14.006 7(2)27 钴Co 58.933 195(5) 8 氧O 15.999 4(3)28 镍Ni 58.693 4(2) 9 氟 F 18.998 403 2(5)29 铜Cu 63.546(3) 10 氖Ne 20.179 7(6)30 锌Zn 65.409(4) 11 钠Na 22.989 769 28 (2) 31 镓Ga 69.723(1) 12 镁Mg 24.305 0(6)32 锗Ge 72.64(1) 13 铝Al 26.981 538 6(8)33 砷As 74.921 60(2) 14 硅Si 28.085 5(3)34 硒Se 78.96(3) 15 磷P 30.973 762(2)35 溴Br 79.904(1) 16 硫S 32.065(5)36 氪Kr 83.798(2) 17 氯Cl 35.453(2)37 铷Rb 85.467 8(3) 18 氩Ar 39.948(1)38 锶Sr 87.62(1) 19 钾K 39.098 3(1)39 钇Y 88.905 85(2) 20 钙Ca 40.078(4)40 锆Zr 91.224(2)原子序数元素名称元素符号相对原子质量原子序数元素名称元素符号相对原子质量 41 铌Nb 92.906 38(2)61 钷Pm [145] 42 钼Mo 95.94(2)62 钐Sm 150.36(2) 43 锝Tc [97.9072] 63 铕Eu 151.964(1) 44 钌Ru 101.07(2)64 钆Gd 157.25(3) 45 铑Rh 102.905 50(2)65 铽Tb 158.925 35(2) 46 钯Pd 106.42(1)66 镝Dy 162.500(1) 47 银Ag 107.868 2(2)67 钬Ho 164.930 32(2) 48 镉Cd 112.411(8)68 铒Er 167.259(3) 49 铟In 114.818(3)69 铥Tm 168.934 21(2)
相对原子质量表 ——(1-56H-Ba)—— 原子序数元素名称元素符号相对原子质量1氢H1 2氦He4 3锂Li7 4铍Be9 5硼B10.8 6碳C12 7氮N14 8氧O16 9氟F19 10氖Ne20 11钠Na23 12镁Mg24.3 13铝Al27 14硅Si28 15磷P31 16硫S32
17氯Cl35.4 18氩Ar40 19钾K39 20钙Ca40 21钪Sc50 22钛Ti47.8 23钒V51 24铬Cr52 25锰Mn55 26铁Fe55.8 27钴Co59 28镍Ni58.6 29铜Cu63.5 30锌Zn65.4 31镓Ga69.7 32锗Ge72.6 33砷As75 34硒Se79 35溴Br80 36氪Kr83.798(2) 37铷Rb85.4678(3) 38锶Sr87.62(1)
40锆Zr91.224(2) 41铌Nb92.90638(2) 42钼Mo95.94(2) 43锝Tc[97.9072] 44钌Ru101.07(2) 45铑Rh102.90550(2) 46钯Pd106.42(1) 47银Ag107.8 48镉Cd112.411(8) 49铟In114.818(3) 50锡Sn118.7 51锑Sb121.760(1) 52碲Te127.60(3) 53碘I127 54氙Xe131.293(6) 55铯Cs132.9054519(2) 56钡Ba137.3——(57-71La-Lu镧系)—— 原子序数元素名称元素符号相对原子质量57镧La138.90547(7) 58铈Ce140.116(1) 59镨Pr140.90765(2)
附录 附录一原子量相对质量表(1995年国际原子量)
- 1 -
- 2 -
附录五常见离子和化合物的颜色 一、离子 1.无色离子 阳离子:Na+K+NH4+Mg2+Ca2+Ba3+Al2+Sn4+Pb2+Bi3+Ag+Zn2+Cd2+Hg22+Hg2+ 阴离子:BO2-C2O42-Ac-CO32-SiO32-NO3-NO2-PO43-MoO42-SO32- SO42-S2-S2O32-F-Cl-ClO3-Br- BrO3-I-SCN-[CuCl2]- - 3 -
2.有色离子 [Cu(H2O)4]2+[CuCl4]2-[Cu(NH3)4]2+ 浅蓝色黄色深蓝色 [Cr(H2O)6]2+[Cr(H2O)6]3+[Cr(H2O)5Cl]2+[Cr(H2O)4Cl2]+ 蓝色紫色浅绿色暗绿色 [Cr(NH3)2(H2O)4]3+[Cr(NH3)3(H2O)3]3+[Cr(NH3)4(H2O)2]3+ 紫红色浅红色橙红色 [Cr(NH3)5H2O]2+[Cr(NH3)6]3+CrO2-CrO42-Cr2O72- 橙黄色黄色绿色黄色橙色 [Mn(H2O)6]2+MnO42-MnO4- 肉色绿色紫红色 [Fe(C2O4)3]3-[Fe(NCS)n]3-n FeCl63-FeF63- 黄色血红色黄色无色 [Fe(H2O)6]2+[Fe(H2O)6]3+[Fe(CN)6] 4-[Fe(CN)6] 3- 浅绿色淡紫色黄色浅桔黄色 [Co(H2O)6]2+[Co(NH3)6]2+[Co(NH3)6]3+[CoCl(NH3)5]2+ 粉红色黄色橙黄色红紫色 [Co(NH3)5(H2O)]3+[Co(NH3)5CO3]+[Co(CN)6]3-[Co(SCN)4]2- 粉红色紫红色紫色蓝色 [Ni(H2O)6]2+[Ni(NH3)6]2+I3- 亮绿色蓝色浅棕黄色 二、化合物 ⒈氧化物 CuO Cu2O Ag2O ZnO Hg2O HgO TiO2V2O3黑色暗红色暗棕色白色黑褐色红色或黄色白色或橙红色黑色VO2V2O5Cr2O3CrO3MnO2FeO Fe2O3 深蓝色红棕色绿色红色棕褐色黑色砖红色 Fe3O4CoO Co2O3NiO Ni2O3PbO Pb3O4 - 4 -
原子质量与原子量 原子质量与原子量既是化学中的概念又是原子物理学中的概念.这两个概念,也许是它们文字组成相似之故,所以,颇易引起混淆.原子量是原子质量概念发展起来的一个新概念,诚然,两者之间有密切联系,但是它们毕竟有着各自不同的内涵和外延,是两个可区分的概念. 1、原子质量 由于元素周期表中大多数元素几乎都具有不同数目的稳定同位素,每种核素的一个原子的质量称为该核素的原子质量. 原子质量单位定义为,一个原子质量单位等于一个处于基态的C 12中性原子的静止质量的1/12. 原子质量单位的符号为u ,1u 2710 6605655.1-?=千克. 原子质量可用质谱仪直接测定. 2、原子量 国际原子量与同位素丰度委员会于1979年给原子量下的最新定义是:“一种元素的原子量是该元素1摩尔质量对核素C 12的1摩尔质量的1/12的比值.”因为任何元素,其数量只要是1摩尔,它所含的原子个数就都相同(即等于阿佛加德罗常数).所以,上述定义又可表述为“一种元素的一个原子的平均质量对核素C 12的一个原子质量的1/12的比值即为该种元素的原子量.”这里所谓的一个原子的平均质量,是对一种元素含着多种天然同位素说的,平均质量是根据这种元素的各种核素原子质量与丰度乘积之和而求得(元素的丰度是指化学元素在地球中的相对比率). 由此可见,原子量是一个比值,是一个无单位的纯数,是原子的平均相对质量.原子量常用符号Ar (E )表示,A 代表原子量,r 表示相对,E 代表某元素.例如,氯元素在自然界中有两种同位素:核素Cl 3717,丰度为75.77%,原子质量为34.96885u ;核素Cl 3717,丰度为24.23%,原子质量为36.96590u . 氯元素的平均原子质量u 453.35%23.24u 96590.36%77.75u 96885.34=?+?= 于是,根据原子量的定义,氯元素的原子量为: 453 .351/1212u 35.453u 12/1C Ar(Cl)12=?=?= 的原了质量氯元素的平均原子质量 3、原子质量与原子量的区别 元素的“原子量”和核素的“原子质量”虽然都以C 12 为基准来描述原子的同一物理属性,但是,它们是两个不同的概念.现将它们的主要区别比较如下: (1)原子量是某元素一个原子的平均质量对C 12核素一个原子的质量的1/12之比,
国际原子量表 元素 原子量元素 原子量 元素 原子量 元素 原子量 符号名称符号名称符号名称符号名称 Ac 锕227.0 Er 铒167.3 Mn 锰54.94 Ru 钌101.1 Ag 银107.9 252Es 锿252.1 Mo 钼95.94 S 硫32.07 Al 铝26.98 Eu 铕152.0 N 氮14.01 Sb 锑121.8 243Am 镅243.1 F 氟19.00 Na 钠22.99 Sc 钪44.96 Ar 氩39.95 Fe 铁55.85 Nb 铌92.91 Se 硒78.96 As 砷74.92 257Fm 镄257.1 Nd 钕144.2 Si 硅28.09 210At 砹210.0 223Fr 钫223.0 Ne 氖20.18 Sm 钐150.4 Au 金197.0 Ga 镓69.72 59Ni 镍58.69 Sn 锡118.7 B 硼10.81 Gd 钆157.3 No 锘259.1 Sr 锶87.62 Ba 钡137.3 Ge 锗72.64 Np 镎237.0 Ta 钽180.9 Be 铍9.012 H 氢 1.008 O 氧16.00 Tb 铽158.9 Bi 铋209.0 He 氦 4.003 Os 锇190.2 Tc 锝98.91 247Bk 锫247.1 Hf 铪178.5 P 磷30.97 Te 碲127.6 Br 溴79.9 Hg 汞200.6 231Pa 镤231.0 Th 钍232.0 C 碳12.01 Ho 钬164.9 Pb 铅207.2 Ti 钛47.867 Ca 钙40.08 I 碘126.9 Pd 钯106.4 Tl 铊204.2 Cd 镉112.4 In 铟114.8 145Pm 钷144.9 Tm 铥168.9 Ce 铈140.1 Ir 铱192.2 210Po 钋210.0 U 铀238.0 252Cf 锎252.1 K 钾39.10 Pr 镨140.9 V 钒50.94 Cl 氯35.45 Kr 氪83.80 Pt 铂195.1 W 钨183.9 247Cm 锔247.1 La 镧138.9 239Pu 钚239.1 Xe 氙131.1 Co 钴58.93 Li 锂 6.941 Ra 镭226.0 Y 钇88.91 Cr 铬52.00 Lr 铹260.1 Rb 铷85.47 Yb 镱173.0 Cs 铯132.9 Lu 镥175.0 Re 铼186.2 Zn 锌65.39 Cu 铜63.55 Md 钔256.1 Rh 铑102.9 Zr 锆91.22 Dy 镝162.5 Mg 镁24.31 222Rn 氡222.0
国际标准原子量
————————————————————————————————作者:————————————————————————————————日期:
At No Symbol Name Atomic Wt Notes 1 H Hydrogen 1.008 3, 6 2 He Helium 4.002602(2) 1, 2 3 Li Lithium 6.9 4 3, 6 4 Be Beryllium 9.0121831(5) 5 B Boron 10.81 3, 6 6 C Carbon 12.011 6 7 N Nitrogen 14.007 6 8 O Oxygen 15.999 6 9 F Fluorine 18.998403163(6) 10 Ne Neon 20.1797(6) 1, 3 11 Na Sodium 22.98976928(2) 12 Mg Magnesium 24.305 6 13 Al Aluminium 26.9815385(7) 14 Si Silicon 28.085 6 15 P Phosphorus 30.973761998(5) 16 S Sulfur 32.06 6 17 Cl Chlorine 35.45 3, 6 18 Ar Argon 39.948(1) 1, 2 19 K Potassium 39.0983(1) 20 Ca Calcium 40.078(4) 21 Sc Scandium 44.955908(5) 22 Ti Titanium 47.867(1) 23 V Vanadium 50.9415(1) 24 Cr Chromium 51.9961(6) 25 Mn Manganese 54.938044(3) 26 Fe Iron 55.845(2) 27 Co Cobalt 58.933194(4) 28 Ni Nickel 58.6934(4) 2 29 Cu Copper 63.546(3) 2 30 Zn Zinc 65.38(2) 2 31 Ga Gallium 69.723(1) 32 Ge Germanium 72.630(8) 33 As Arsenic 74.921595(6) 34 Se Selenium 78.971(8) 35 Br Bromine 79.904 6 36 Kr Krypton 83.798(2) 1, 3 37 Rb Rubidium 85.4678(3) 1 38 Sr Strontium 87.62(1) 1, 2 39 Y Yttrium 88.90584(2)