小鼠的腹腔解剖试验
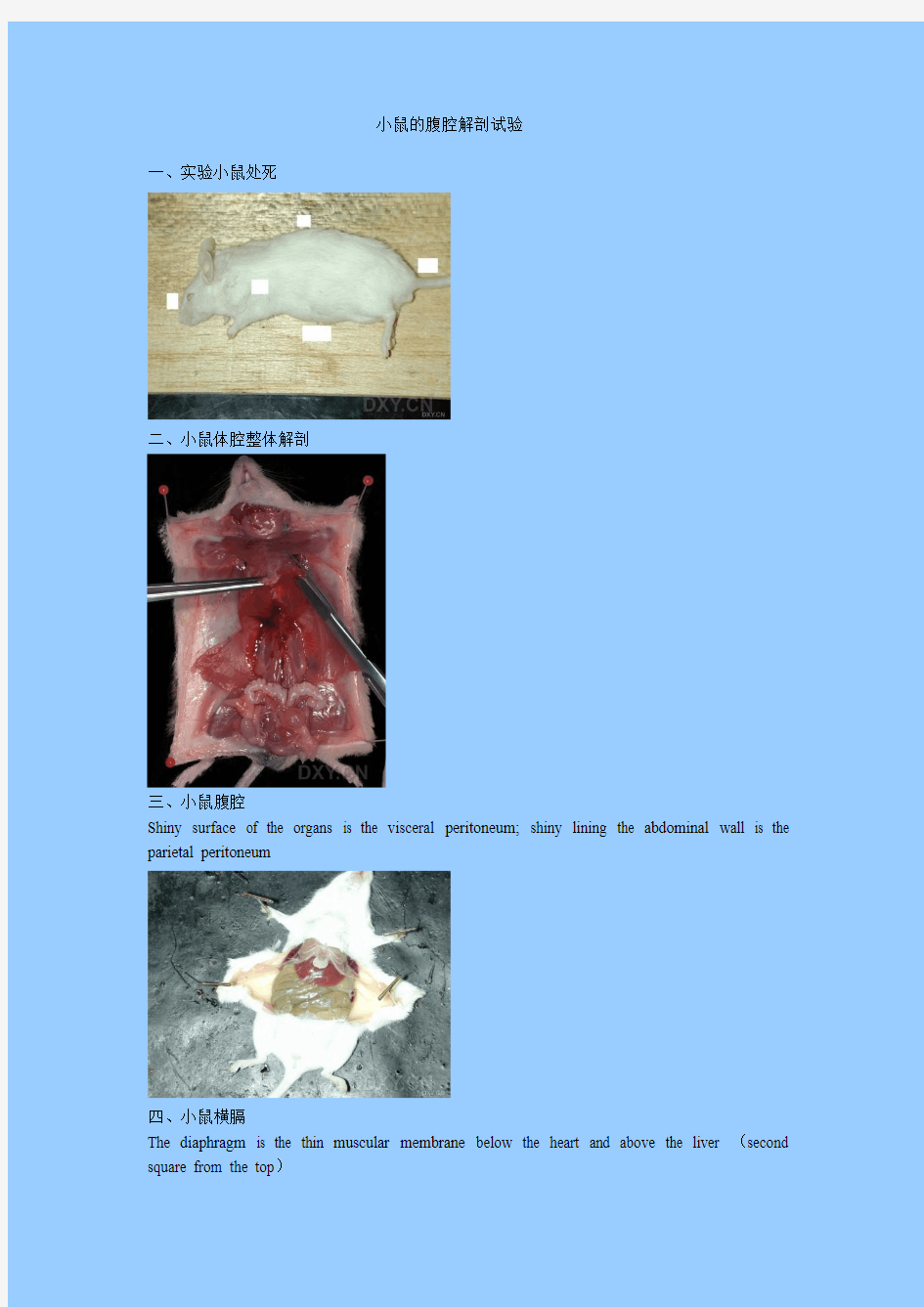
一、实验小鼠处死
二、小鼠体腔整体解剖
三、小鼠腹腔
Shiny surface of the organs is the visceral peritoneum; shiny lining the abdominal wall is the parietal peritoneum
四、小鼠横膈
The diaphragm is the thin muscular membrane below the heart and above the liver (second square from the top)
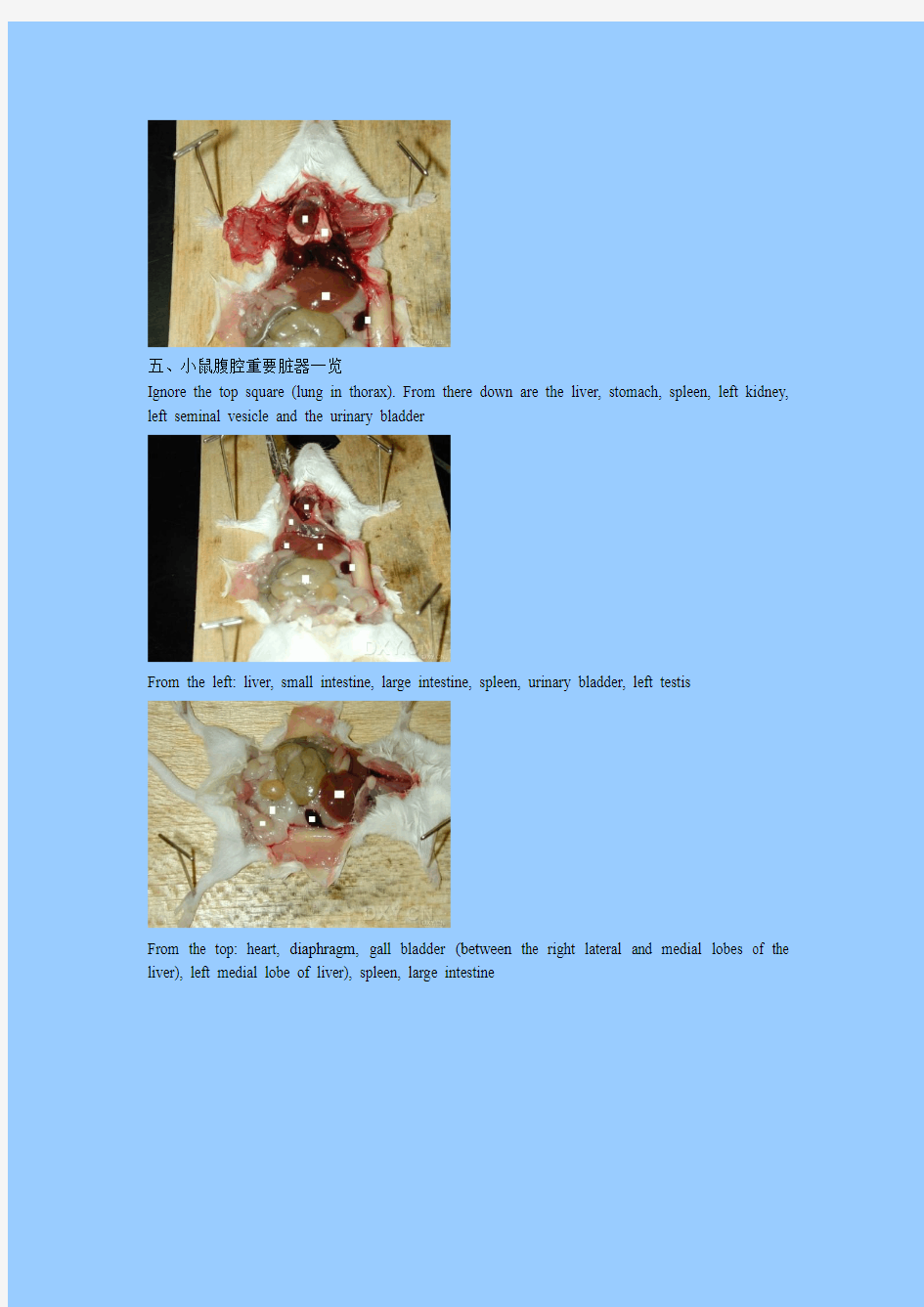
五、小鼠腹腔重要脏器一览
Ignore the top square (lung in thorax). From there down are the liver, stomach, spleen, left kidney, left seminal vesicle and the urinary bladder
From the left: liver, small intestine, large intestine, spleen, urinary bladder, left testis
From the top: heart, diaphragm, gall bladder (between the right lateral and medial lobes of the liver), left medial lobe of liver), spleen, large intestine
From the left: coiled oviduct, left uterine horn, left ovary above the left oviduct; note that the uterus is bicornuate(Female reproductive organs)
六、小鼠心脏和肺
Heart (ventricles) and left lung
Lungs inflated by blowing into nostrils
七、小鼠腹腔脏器相互关系简图
图一
图二
姓名:薛桂凤学号: 实验报告(二) 一、实验目的: 1.掌握大鼠的抓取和固定。 2.掌握大鼠的编号与标记方法。 3.掌握大鼠的常用实验方法。 4.掌握大鼠的常用麻醉方法。 5.掌握大鼠的安死术。 6.掌握大鼠的釆血方法。 7.了解小鼠的采尿、粪的方法。 8.了解小鼠各种脏器标本的采集方法。 二、实验器材:SD大鼠、电子称、手套、实验托盘、固定板、烧杯、注射器(3支)、 剪刀、镊子、灌胃针头、毛细管、酒精棉球、5%水合氯醛、生理盐水 三、实验内容 1.抓取:两种方法。第一种方法:右手食指和中指夹住大鼠颈部,使其头部固定,右 手拇指及无名指分别在大鼠前爪下抓住大鼠身体。第二种方法类似单手抓取小鼠的 方法,用右手拇指及其余四指并捏住大鼠颈部背部皮肤。 2.称重:小鼠放在烧杯中称重(去除烧杯重量),记录小鼠体重210g。 3.鉴别大鼠性别:观察生殖器雄性大鼠的阴囊非常明显。 4.编号:染色法:逆毛方向涂上有色斑点,顺序由左到右,由上向下,用两种颜色 可标记99只动物。 5.给药: (1)皮下注射小于1ml/100g(俯卧固定,左手拇指和食指捏住皮肤提起,右手持针沿纵轴方向刺入皮肤,阻力消失后回抽无血注入药物,拔针)(2)皮内注射小于(麻醉后进行,先备皮)(俯卧固定,与皮肤平行刺入捏起的皮肤,阻力大,注射药物局部有皮丘后停留片刻后拔针) (3)腹腔注射(仰面固定,在腹正中线两侧腹股沟平行的位置30-45°进针,挑起皮肤和肌肉,回抽无血,注药) (4)灌胃1-2ml/100g (大鼠固定身体呈一条直线,灌胃针头顺着上颚插入咽部,先少量注药证明未入气管后继续给药) 6.釆血:尾尖釆血法、眼眶静脉丛釆血法、心脏釆血法(麻醉后) 。 7.大鼠的采尿、粪的方法 (1)少量采集:在抓取固定时受到刺激排出少量尿液和粪便 (2)长期大量采集:使用代谢笼 8.麻醉:根据大鼠体重计算麻醉药物用量5%水合氯醛按300mg/kg,给药,计算药 量为,ip 麻醉小鼠,观察小鼠麻醉期。 (1)全身麻醉的第一期(随意兴奋期):出现运动和运动失调;35秒 (2)全身麻醉的第二期(不随意兴奋期):是由意识完全丧失至深而规则的自动 呼吸开始时止;2分30秒 (3)全身麻醉的第三期:角膜反射由迟钝渐趋消失,翻正反射消失,疼痛反射 消失; 9.安死术:颈椎脱臼法:用左手按住动物的头部于实验台上,右手抓住尾根部,快速、 不间断地向后、略向上使劲拉,以致脊椎脱臼,脊髓与脑干断离而死亡。 10.解剖:观察大鼠的脏器解剖结构
姓名:薛桂凤学号:132015200300 实验报告(二) 一、实验目的: 1.掌握大鼠的抓取和固定。 2.掌握大鼠的编号与标记方法。 3.掌握大鼠的常用实验方法。 4.掌握大鼠的常用麻醉方法。 5.掌握大鼠的安死术。 6.掌握大鼠的釆血方法。 7.了解小鼠的采尿、粪的方法。 8.了解小鼠各种脏器标本的采集方法。 二、实验器材:SD大鼠、电子称、手套、实验托盘、固定板、烧杯、注射器(3支)、 剪刀、镊子、灌胃针头、毛细管、酒精棉球、5%水合氯醛、生理盐水 三、实验内容 1.抓取:两种方法。第一种方法:右手食指和中指夹住大鼠颈部,使其头部固定,右 手拇指及无名指分别在大鼠前爪下抓住大鼠身体。第二种方法类似单手抓取小鼠的 方法,用右手拇指及其余四指并捏住大鼠颈部背部皮肤。 2.称重:小鼠放在烧杯中称重(去除烧杯重量),记录小鼠体重210g。 3.鉴别大鼠性别:观察生殖器雄性大鼠的阴囊非常明显。 4.编号:染色法:逆毛方向涂上有色斑点,顺序由左到右,由上向下,用两种颜色 可标记99只动物。 5.给药: (1)皮下注射小于1ml/100g(俯卧固定,左手拇指和食指捏住皮肤提起,右手持针沿纵轴方向刺入皮肤,阻力消失后回抽无血注入药物,拔针)(2)皮内注射小于0.1ml (麻醉后进行,先备皮)(俯卧固定,与皮肤平行刺入捏起的皮肤,阻力大,注射药物局部有皮丘后停留片刻后拔针)(3)腹腔注射0.01-0.02ml/g(仰面固定,在腹正中线两侧腹股沟平行的位置30-45°进针,挑起皮肤和肌肉,回抽无血,注药) (4)灌胃1-2ml/100g (大鼠固定身体呈一条直线,灌胃针头顺着上颚插入咽部,先少量注药证明未入气管后继续给药) 6.釆血:尾尖釆血法、眼眶静脉丛釆血法、心脏釆血法(麻醉后) 。 7.大鼠的采尿、粪的方法 (1)少量采集:在抓取固定时受到刺激排出少量尿液和粪便 (2)长期大量采集:使用代谢笼 8.麻醉:根据大鼠体重计算麻醉药物用量5%水合氯醛按300mg/kg,给药,计算药 量为 1.26ml,ip 麻醉小鼠,观察小鼠麻醉期。 (1)全身麻醉的第一期(随意兴奋期):出现运动和运动失调;35秒 (2)全身麻醉的第二期(不随意兴奋期):是由意识完全丧失至深而规则的自动 呼吸开始时止;2分30秒 (3)全身麻醉的第三期:角膜反射由迟钝渐趋消失,翻正反射消失,疼痛反射 消失; 9.安死术:颈椎脱臼法:用左手按住动物的头部于实验台上,右手抓住尾根部,快速、 不间断地向后、略向上使劲拉,以致脊椎脱臼,脊髓与脑干断离而死亡。 10.解剖:观察大鼠的脏器解剖结构
实验1.21 牛、.羊的解剖 【目的和要求】在学习各离体内脏器官的基础上,通过牛(或羊)的尸 体解剖,系统复习和观察反刍动物各系统,特别是胸腔和腹腔各器官的位置,相互联系,加深整体概念,并进一步认识和记忆在离体标本上看不到的结构。 【观察内容和步骤】 一、观察腹壁肌肉 剥去腰、腹部皮肤,顺序观察皮肌、腹外斜肌、腹直肌和腹横肌(参考马的尸体解剖部分)。 二、观察牛(羊)的腹腔器官的腹膜 1.切开腹膜使尸体左侧倒卧,沿肋弓切除腹壁肌肉,然后切开腹膜。2.观察大网膜打开右侧腹壁后,可见大网膜包裹了十二指肠外的绝 大部分肠管,位于表面的是大网膜的浅层,剪开浅层可见大网膜深层,观察深层和浅层大网膜的起始部,走向和止于哪些器官? 3.观察小网膜与哪些器官的什么部位相连。 4.剪开大网膜深层观察各肠段的位置关系。 (1)观察十二指肠从皱胃的幽门起始,向上形成乙状弯曲,在肝的脏 面附近转向后走,绕过右肾,再向前方折转,重新达到肝的脏面附近向下延续为空肠。 (2)观察总肠系膜两层腹膜先将盲肠、结肠初袢和终袢包住,然后将 结肠旋袢包在中间,向下延续为小肠系膜,小肠位于结肠旋袢的右侧和下方,羊的结肠旋袢的离心回最后一圈远离旋袢,延伸在小肠系膜之中,肠管
·34· 彭克美编.畜牧兽医基础实验指导.中国农业出版社,2008.10. 第一章畜禽解剖学实验指导 内已形成粪球。 (3)观察肝牛肝分叶不明显,由发达的胆囊和圆韧带把肝分成左 叶、中叶和右叶,寻找胆管,观察其在乙状弯曲的入口。胆管与胰管合 并后开口到乙状弯曲,羊肝的右叶在右背侧,后端结右肾。右叶背面有 尾叶的尾状突,肝左叶位于腹侧。边缘较薄,胆囊附在中叶与右叶 之间。 观察胰:在十二指肠肠袢之间,呈不正四边形,粉红色。寻找胰管,牛的胰管约在距幽门30cm处,单独汇人十二指肠。羊的胰形状不规则,胰管与胆管汇合后共同开口于十二指肠乙状弯曲。 观察盲肠:盲肠的盲端伸向骨盆腔入口处,寻找回肠进入盲肠的部位,观察盲肠转为结肠,观察回盲韧带。 观察胃:牛、羊胃约占据腹腔的3/4,.瘤胃左侧与左腹壁相邻,右侧与肠相邻。网胃在瘤胃的前下方与膈相邻,瓣胃位于瘤胃的右前方。皱胃位于瓣胃的下方和后方。 将胃肠道从腹腔摘出后,观察胃的内部结构:剪开瘤胃,观察瘤胃肉柱、瘤胃乳头;剪开网胃.观察其黏膜结构:牛的网胃内常有金属异物存在;观察食管沟,注意其沟唇、食管沟的经路;剪开瓣胃观察瓣叶结构特点,观察纵向分布的黏膜褶。 观察唾液腺:腮腺的形状和位置.寻找腮腺管及其通入口腔的部位,下
°实验五:小鼠解剖实验 吴雪薇121140059 一、实验目的 1、通过实验学习给小鼠注射、灌胃等技术操作 2、了解戊巴比妥对哺乳动物的影响 3、复习解剖的基本操作 4、通过实验了解小鼠唾液腺的结构 5、通过实验了解小鼠体内器官、系统构造 二、实验原理 1、小鼠唾液腺 唾液腺由颌下腺、腮腺、舌下腺组成,颌下腺最明显,颌下腺两边弥散的是腮腺,舌下腺连于颌下腺上,容易与颌下腺上连的淋巴结搞混。 2、会厌软骨 会厌软骨即构成会厌的软骨,形状扁平,像树叶,下部附着在喉结的内壁上。会厌是喉头上前部的树叶状结构,由会厌软骨和黏膜构成。呼吸或说话时,会厌向上,使喉腔开放;咽东西时,会厌向下,盖住气管,使东西不至进入气管内。 3、小鼠体内结构 (1)胸腔:胸腔内的结构主要有食道、心、肺。 (2)腹腔:主要有胃、肝、胆、胰、脾、肠、肾(包括肾上腺)、输尿管、膀胱和生殖器官:卵巢、输卵管、子宫(雌),睾丸、附睾、精囊腺、输精管(雄)。 (3)胸腔与腹腔由膈膜隔开。 三、实验器材 注射器、烧杯、灌胃针、解剖盘、解剖剪刀、镊子、解剖针、钉子 四、实验材料 小鼠1只、戊巴比妥溶液 五、实验操作 1、抓取一只小鼠,拎住尾巴根部,使其前肢抓在抹布上,后肢提起,用注射器 向其腹腔注射0.5ml戊巴比妥溶液。 2、将小鼠放在烧杯中,观察它的反应。 3、待小鼠不再动时,用注射器向其腹腔再注射0.5ml戊巴比妥溶液,使其死亡。 4、将小鼠放在解剖盘上,用大头针将四肢固定在解剖盘上。 5、用解剖剪刀,从靠近肛门处剪开表皮直至口腔,观察唾液腺。 6、剪开口腔,观察会厌软骨。 7、剪开腹腔和胸腔,观察小鼠体内结构。 8、处理小鼠,清洗、整理实验器材。 六、实验结果 1、观察注射戊巴比妥溶液后的小鼠 本次实验第一次注射,注射了0.4ml的戊巴比妥溶液,第二次注射了0.6ml。
实验一小鼠大体解剖 欧阳学文 注意事项:请按教师的指令进行操作,谨防被小鼠咬伤; 如发生意外,请立即报告老师! 一、实验目的 1. 掌握小鼠的抓取和固定方法; 2. 掌握小鼠的解剖方法; 3. 熟悉脏器系数的测定方法 4. 了解一般实验动物的抓取和固定方法 5. 了解一般实验动物的生物样本的采集方法 二、实验内容 1. 小鼠的抓取和固定 正确的抓取固定动物,是为了不损害动物健康,不影响观察指标,并防止被动物咬伤,保证实验顺利进行。抓取固定动物的方法依实验内容和动物类而定。抓取固定动物前,必须对各种动物的一般习性有所了解,抓取固定时既要小心仔细,不能粗暴,又要大胆敏捷,确实达到正确抓取固定动物的目的。
(1)单手抓取固定法 小鼠性情较温顺,挣扎力小,比较容易抓取和保定。抓取时,用左手拇指和食指捏住小鼠尾巴中部(图1)放在格板或铁笼上。趁着小鼠试图挣脱的瞬间,迅速用另外三个手指压住小鼠的尾巴根部握入手掌(图2);放松拇指和食指,用另外三个手指控制小鼠,然后用食指和拇指捏住小鼠头部两边疏松的皮肤提起小鼠(图3),完成抓取保定。注意,抓小鼠尾巴应抓住尾巴中部或根部,不能仅捏住小鼠尾巴的尾端,因为这时小鼠的重量全部集中到尾端,如果小鼠挣扎,有可能弄破尾端。 在进行解剖、手术、心脏采血、尾静脉注射时,可将小鼠用线绳捆绑在木版上,或固定在尾静脉注射架及粗试管中。 图1 图2 图3 (2)双手抓取固定法 抓取时先用右手抓取鼠尾提起,置于鼠笼或实验台向后拉,在其向前爬行时,用左手拇指和食指抓住小鼠的两耳和颈部皮肤(图4),将鼠体置于左手心中,把后肢拉直,以
无名指按住鼠尾,小指按住后腿即可(图5)。这种在手中固定方式,能进行实验动物的灌胃、皮下、肌肉和腹腔注射以及其他实验操作。 如进行解剖、手术、心脏采血和尾静脉注射时,则需将小鼠作一定形式的固定,解剖手术和心脏采血等均可使动物先取背卧位(必要时先行麻醉),再用大头针将鼠前后肢依次固定在腊板上。尾静脉注射时,可用小鼠尾静脉注射架固定(图6),先根据动物大小选择好合适的固定架,并打开鼠筒盖,手提鼠尾巴,让动物头对准鼠筒口并送入筒内,调节鼠筒长短合适后,露出尾巴,固定筒盖即可进行尾静脉注射或尾静脉采血等操作。 图4 图5 图6 2. 小鼠的处死方法 (1)颈椎脱臼处死法
解剖牛实验报告-
金山学院课程实习报告报告题目《小牛活体解剖课程实习》课程名称《家畜解剖学》 实习地点动物医学家畜解剖实验室实习时间 专业动物医学班 年级 学生姓名 学号 指导老师
(一).实验目的、要求 一、实习目的: 通过活体家畜的解剖活动,使理论联系实践,做到复习和巩固一个学期以来所学到的家畜解剖学的基本知识,并进一步掌握不同家畜品种的各系统器官的解剖结构特点和练习家畜解剖的操作技能和方法,从而为后期有关课程和为将来畜牧生产服务打下良好的基础。 二、实习要求: (一)按照本实习指导书的指导方法和参考教材有关内容与插图,边解剖边观察,认识和掌握各器官的位置、色泽、形态、硬度和结构以及各器官之间的相互关系。 (二)认真做好观察记录,记录要详细,必要时可以绘图或照相。 (三)做到分工明确,各尽其责,团结互助,听从指挥,严守课堂纪律。 (四)总结讨论,认真写好实习报告,按时缴交。 (二).家畜品种:牛 性别:母
年龄:未知 活重:59斤 放血后重:56斤 (三).解剖程序和观察内容 1.活体观察 毛色:褐色前后关节:健全蹄着地情况:正常 观察巩膜为白色,瞳孔为椭圆形,眼结膜粉红色、正常 健康状况:良好叫声:小声,嘶哑鼻镜:湿润眼神:呆滞呼吸时胸部起伏情况:较大 2.活体触摸 左手抓住鼻梁和颊部,右手抓住下颌,用劲拉开口腔(用两指伸入齿间缘,用力往下压)拉出舌头。观察口腔粘膜和舌粘膜的眼神是正常的。呈粉红色。 用手触摸肩前淋巴结、髂下淋巴结 用手触摸肋骨、肋间隙、髋结节、坐骨结节、髋关节、肩关节 触摸乳房,乳头两个 触摸关节和蹄部 触摸喉头、气管,按压颈静脉沟后部,颈静脉怒胀彭起 3.处死 磨刀,绑定,称重。
实验三、小鼠解剖及动物原代细胞培养 引言:细胞培养指的是在无菌条件下,把动、植物细胞从组织中取出,在体外 模拟体内的生理环境,使离体的细胞在体外生长和繁殖,并且维持其结构和功能的一种培养技术。动物细胞培养可分为原代培养和传代培养。从供体获得组织细胞,在无菌条件下,用胰蛋白酶消化或机械分散等方法,将动物组织分散成单个细胞开始首次培养长出单层细胞的方法称为细胞的原代培养。当培养的动物细胞生长增殖达到一定密度,形成致密的单层细胞时,用胰蛋白酶将细胞消化分散成单细胞,从一个容器中以1:2或其他比例转移到另一个容器中扩大培养的方法,称为细胞的传代培养。传代培养的累计次数就是细胞的培养代数。 细胞培养的意义:具有其他生物技术无可比拟的优点;培养条件易改变和控制,便于单因子分析;便于人们直接对细胞内结构、细胞生长及发育等过程的观察;在生物学的各个领域(如分子生物学、细胞生物学、遗传学、免疫学、肿瘤学及病毒学等)已被广泛应用。 细胞培养的局限性:在脱离机体复杂环境下,细胞培养条件与躯体环境有一定距离;观察到的结果有时难以正确反映机体内的状况;细胞培养得到的产物少。培养细胞的条件有水的质量、无菌环境,最适温度、渗透压、气体条件、最适PH、营养条件和培养基质等。 1.实验材料: 实验室购买的雄性小鼠、13.5天孕鼠。 DMEM培养基(胎牛血清、青/链霉素溶液)、胰蛋白酶溶液、PBS溶液(NaCl 8.00g,Na2HP04 1.15g,KCl 0.20g,KH2P04 0.20g,pH调至7.2,超纯水定容到1000mL,分装,121 ℃灭菌20 min) 2.实验步骤: 2.1 处死小鼠 用右手拇指和食指捏住雄性小鼠或怀孕雌鼠尾巴中部放在铁笼上,使小鼠前肢接触铁笼(后肢悬空),左手从小鼠后方向前按住鼠头及颈部。左手拇指、食指用力向下按压鼠头及颈部,同时右手抓住鼠尾根部用力拉向后上方,造成颈椎脱臼,造成小鼠立即死亡。当小鼠停止抽搐,松开左手。将整个小鼠浸入盛有75%乙醇的烧杯中。 2.2 解剖小鼠 将雄性小鼠或怀孕雌鼠从烧杯中移入超净台取出后放在无菌大平皿中,用碘酒棉球消毒腹部的被毛,然后再用酒精棉球擦拭碘酒擦过的部位。用镊子提起腹部皮肤,剪刀剪开皮肤,打开腹腔,将剪开的皮肤分别拉向两边。观察小鼠内脏器官。
姓名班级学号实验日期2014.5.21 科目实验名称Mouse Dissection 合作者指导教师成绩 LAB 10: Mouse Dissection Introduction: In biomedical research, animal models are always regarded as indispensable tools. They contribute to the scientific discovery in biology and our understanding of the functions of individual genes, even the mechanism of different diseases. Typically, although mice are different from humankind in size and appearance, they have a distinct genetic similarity. At the same time, mice have an efficient ability to reproduce, so they are important research tools for experiments in the lab. In this experiment, we will exercise to dissect a mouse, so that we can observe the inside of a mammalian body to identify the female and male mice. Learning and recognizing the anatomical structure of mice, including. Materials and Methods: Materials: Operation plate, Scissor, Forceps, Alcohol cotton, Mouse. Methods: [we get a male mouse] Part 1: Observations of external features. Make a table T-1. 1.Having an overhead view, identify the mouse’s head, neck, truck, and tail; observe the dorsal and ventral surfaces. Roughly record what is seen. 2.Observe the thorax which is supported by the rib cage, and the abdomen, and the details of appendages attached to the abdomen. 3.Find the mouth, two external nostrils, two external auditory canals, and anus, which are on the body surface. 4.Have a simply look at the surface of reproductive organ, prepuce, urethral and penis including. And locate the saclike scrotum; feel for the paired testes in the scrotum. Note the rough features. Part 2: Observation of organs and structures inside the mouse. [Open the Ventral Body Cavities, Thoracic Cavity, and Abdominopelvic Cavity in order. We must break the ribs near the attachment to the vertebral column to fold back the upper flaps.] Make a table T-2. 1.Ventral Body Cavities. a. Make a longitudinal incision through the skin with a dissecting scissor, from the neck to the preputial opening. Pierce the body wall below the ribs, with the blades angled upward, so that it won’t damage the internal organs. b. Pull the sides of the longitudinal incision, and look for the diaphragm. Then make two
实验一小鼠的基本实验操作 一、实验目的:通过实际操作,掌握小鼠的一般操作方法,包括小鼠的抓拿、标记、给药(灌 胃、腹腔注射、皮下、肌肉、尾静脉注射)、取血(眶后静脉丛,摘眼球)、脊椎脱臼法处死、大体解剖。 二、实验动物:昆明小鼠2只(1雌1雄) 三、实验步骤 1、抓取与固定,标记 2、去毛 3、给药:消化道、腹腔注射、尾静脉注射 4、取血:眼眶后静脉丛、尾静脉、眼球摘除法、断头法 5、麻醉:氯胺酮腹腔麻醉 6、处死:脊椎脱臼法 7、解剖: 雄性:睾丸、附睾、输精管、鼠蹊腺(在膀胱下方,胶质状,透明) 雌性:双角子宫、卵巢 肾上腺、胆囊、甲状腺、胃、肝脏、脾、肺、肾、心脏、甲状腺 四、实验结果 1、抓取与固定标记: 抓取:抓小鼠的尾根部 固定:抓住小鼠的尾根部,让小鼠在粗糙平面上爬行,后拉尾跟部,右手的拇 指与食指抓住小鼠两耳及其间的颈部皮肤,小指与无名指将尾巴固定在手掌面。并标记: 2、灌胃法:左手抓取小鼠固定后,右手持特制灌胃针,沿一侧口角进针,紧贴咽后壁,头后仰以便伸直消化道,进针2/3后灌生理盐水0、5ml 3、注射给药: 腹腔注射: 从下腹部的两侧进针 ,进针时针与腹部成45°。进针后稍微晃动针,如无粘滞感则可注射药物 尾静脉注射:一人固定小鼠,另一人用左手中指与拇指将尾拉直,食指托住尾部,在尾动脉位置进针注射0、5ml生理盐水。注射完毕拔出针头,用无菌棉球压迫止血。 4、采血 从眼角内侧0、5cm处进针 眼球摘除法:左手抓取用固定小鼠,右手持弯头镊在眼球根部将眼球摘除,头朝下,眼眶内血迅速流出。 5、麻醉: 0、5%氯胺酮腹腔麻醉:本小鼠重22g,按100mg/kg的药量给药,2分钟麻醉成功 6、处死: 脊椎脱臼法:按住头部,将尾根部向后上方以短促的力量拉即可致死 7、解剖: 雄性:寻找到睾丸、附睾、输精管、鼠蹊腺 雌性:双角子宫、卵巢 3、7、2 肾上腺:米粒大小 胰腺:位于胃下方,类似于脂肪组织,浑浊状 3、7、4 ,胆囊:芝麻大小,浅绿色,半透明,
实验一、羊的病理解剖学检验 一、试验目的:病羊尸体剖检是诊断禽病,指导治疗的非常重要的手段之一,它便于现场开展并可及时提供防治措施。通过对羊尸体病变的诊查、识别与判断,对单发病或群发性羊病进行确定,为疾病防治提供依据。 二、羊病理解剖学检验要点。病鸡的剖检方法包括:了解羊(死羊)的一般状况,外部检查和内部检查。 三、羊的尸体剖检,通常采取左侧卧位,以便于取出约占腹腔3/4的瘤胃。 (一)外部检查外部检查包括检查畜别、品种、年龄、性别、毛色、营养状态、皮肤和可视黏膜以及部分尸征等。(二)体腔的剖开与内脏的采出 ⒈剥皮将尸体仰卧,自下颌部起沿腹部正中线切开皮肤,至脐部后把切线分为两条,绕开生殖器或乳房,最后于尾根部会合。再沿四肢内侧的正中线切开皮肤,到球节作一环形切线,然后剥下全身皮肤。传染病尸体,一般不剥皮。在剥皮过程中,应注意检查皮下的变化。 ⒉切离前、后肢为了便于内脏的检查与摘除,羊先将右侧前、后肢切离。切离的方法是将前肢或后肢向背侧牵引,切断肢内侧肌肉、关节囊、血管、神经和结缔组织,再切离其外、前、后三方面肌肉即可取下。 ⒊腹腔脏器的采出 (1)切开腹腔先将母畜乳房或公畜外生殖器从腹壁切除,然后从肷窝沿肋弓切开腹壁至剑状软骨,再从肷窝沿髂骨体切开腹壁至耻骨前缘。注意不要刺破肠管,造成粪水污染。 切开腹腔后,检查有无肠变位、腹膜炎、腹水或腹腔积血等异常。 (2)腹腔器官采出剖开腹腔后,在剑状软骨部可见到网胃,右侧肋骨后缘部为肝脏、胆囊和皱胃,右肷部可见盲肠,其余脏器均被网膜覆盖。因此,为了采出羊的腹腔器官,应先将网膜切除,并依次采出小肠、大肠、胃和其他器官。 ①切取网膜检查网膜的一般情况,然后将两层网膜撕下。 ②小肠的采出提起羊盲肠的盲端,沿盲肠体向前,在三角形的回盲韧带处分离一段回肠,在距盲肠约15cm处作双重结扎,从结扎间切断。再抓住回肠断端向身前牵引,使肠系膜呈紧状态,在接近小肠部切断肠系膜。由回肠向前分离至十二指肠空肠曲,再作双重结扎,于两结扎间切断,即可取出全部小肠。采出小肠的同时,要边切边检查肠系膜和淋巴结等有无变化。 ③大肠的采出先在骨盆口找出直肠,将直肠内粪便向前挤压并在直肠末端作一次结扎,并在结扎后方切断直肠。抓住直肠断端,由后向前分离直肠系膜至前肠系膜根部。再把横结肠、肠盘与十二指肠回行部之间的联系切断。最后切断前肠系膜根部的血管、神经和结缔组织,可取出整个大肠。 ④羊胃、十二指肠和脾的采出先将胆管、胰管与十二指肠之间的联系切断,然后分离十二指肠系膜。将瘤胃向后牵引,露出食管,并在末端结扎切断。再用力向后下方牵引瘤胃,用刀切离瘤胃与背部联系的组织,切断脾膈韧带,将羊的胃、十二指肠及脾脏同时采出。 ⑤胰、肝、肾和肾上腺的采出胰脏可从左叶开始逐渐切下或将胰脏附于肝门部和肝脏一同取出,也可随腔动脉、肠系膜一并采出。
羊的消化器官解剖 一、实习目的与要求 观察羊的消化器官的构造是研究羊消化特征的基本方法。因为羊的消化器官的组织学结构是其工艺性能的基础。 本实验在于解剖观察羊消化器官如四胃,小肠等的特殊构造,组织内皮细胞及纤毛形状、大小及排列状态在组织结构上的特点。为更好的饲养管理作准备。 认识和记忆羊的消化器官结构。 二、实习用品 动物解剖台,解剖剪,解剖刀,磨刀石,黑绒布板、尖头镊子、外科直剪、玻璃棒、吸水纸、双面刀片、四氯化碳、浓硫酸、蒸馏水、显微镜、肥皂、消毒液等 三、实习方法及步骤 (一)羊的口咽器官 羊唇灵活,上唇中间有明显的纵沟,两鼻孔之间形成鼻唇镜,齿颈明显,舌体后部隆起叫舌圆枕。舌背上有较粗的角质化的乳头,称锥状乳头。菌状乳头分散在舌背上。在靠近舌圆枕处有明显的轮廓乳头。五叶状乳头。唾液腺:腮腺近于三角形,开口于第五上臼齿相对的颊粘膜上。颌下腺比腮腺大,自寰椎起向下颌伸延,在下颌间隙处,左、右颌下腺几乎相连。 (二)羊胃的观察 1.首先观察胃的外形: (1)瘤胃:两侧稍扁,前后稍长的椭圆形,有浅的左纵沟,纵沟将瘤胃分成背囊和腹囊。两个囊的前、后端分别又称为前背盲囊、后背盲囊、前腹盲囊和后腹盲囊。瘤胃后端还有背冠状沟和腹冠状沟。羊的后腹盲囊比后背盲囊长。 (2)网胃:为圆囊状,位于瘤胃背囊的前下方。 (3)瓣胃:呈椭圆形,在瘤胃右侧。 (4)皱胃:呈长囊状,前端较粗大,后端较细,背缘为小弯、腹缘为大弯。 2.观察胃的内腔面:
(1)瘤胃最大,呈前后稍长,左右略扁的椭圆形,占据腹腔的左半部,其下半部还伸到腹腔的右半部。瘤胃的前方与网胃相通,约与第7、8肋间隙相对,后端达骨盆前口。瘤胃的前、后两端有较深的前沟和后沟;左右两侧面有较浅的左纵沟和右纵沟。在瘤胃壁的内面,有与上述各沟相对应的肉柱。沟和肉柱共同围成环状,把瘤胃分成瘤胃背囊和瘤胃腹囊两部分,背囊较长,由于瘤胃前、后沟较深,在瘤胃背囊和腹囊的前、后两端分别形成前背盲囊、后背盲囊、前腹忙囊和后腹盲囊。瘤胃的前端有通网胃的瘤胃口,瘤胃口大,其腹侧和两侧有瘤网褶。瘤胃的入口为贲门,在贲门附近,瘤胃和网胃无明显分界,形成了一个穹窿,称为瘤胃前庭。瘤胃粘膜一般呈棕黑色或棕黄色(肉柱颜色较浅),表面有无数密集的乳头,乳头大小不等。 (2)网胃网胃略呈犁形,前后稍扁,大部分位于体中线的左侧,在瘤胃背囊的前下方,约与第6—8肋骨相对。网胃的壁面(前面)凸,与膈、肝接触,脏面(后面)平,与瘤胃背囊贴连。网胃的下端呈一圆形盲囊,称为网胃底。网胃上端有瘤网口,与瘤胃背囊相通。在网胃壁的内面有食道沟。食管沟起自贲门,沿瘤胃前庭和网胃右侧壁向下伸延到网瓣口。沟两侧隆起的粘膜褶,称为食管沟唇。羊的网胃下部向后弯曲与皱胃相接触。网格较大,但周缘褶较低,次级皱褶明显。 (3)瓣胃瓣胃比网胃小,呈卵圆形,位于右季肋部,约与第9—10肋骨相对。有网瓣口和瓣皱口,分别通网胃和皱胃。瓣胃粘膜形成百余片辫叶,瓣叶呈新月形。 (4)皱胃呈一端粗一端细的弯曲长囊,位于右季肋部和剑状软骨部,在网胃和瘤胃腹囊的右侧,瓣胃的腹侧和后方,大部分与腹腔底壁紧贴,约与第8—12肋骨相对。皱胃的前部较大,为底部,与瓣胃相连,后部较细为幽门部,以幽门与十二指肠相接。皱胃粘膜光滑、柔软,在底部形成12—14片螺旋形大皱褶,粘膜内含有腺体,可分三部分,为贲门腺区、幽门腺区、胃底腺区。
1. 外观大鼠外观与小鼠相似,但个体较大。一般成年大鼠体长不小于18-20cm。尾上覆有短毛和环状角质鳞片,数量多于200片。上下颌各有两个切齿和六个臼齿,共16颗牙齿。齿式为(1003/1003)×2。 2. 大鼠骨骼约105-108块,大鼠的生长发育期长,长骨长期有骨骺存在,不骨化。切齿终生不断生长,大鼠需不断啃咬磨牙以维持其长度恒定,故垫料中应有部分小木块供其啃咬。 3. 大鼠唾液腺包括腮腺、颌下腺和舌下腺。分别位于下颌骨后缘至锁骨的腹外侧、下颌骨后缘和胸腔入口的腹侧、颌下腺口侧。颈区肩胛部间沉积的脂肪组织呈腺体状,称为冬眠腺,在产热中起着重要作用。 4. 胃由前后两部分组成,前胃为无腺区,后胃为有腺区,前后两部分由一个界限嵴分开,食管通过界限嵴的一个褶进入胃小弯,此褶是大鼠不能呕吐的原因。 5. 肠道分为十二指肠、空肠、回肠、盲肠、结肠、直肠。其中小肠最长,约114cm(102-126),盲肠较长,约6-8cm。 6. 肝脏呈紫红色,占体重的比例大,约为体重的1/25,由四叶组成(右侧叶、中叶、左叶和尾叶)。肝脏的再生能力强,经部分肝切除术后仍可再生。成年大鼠切除肝2/3,在一周内肝脏生长最快,三周内肝脏重量可恢复到接近正常。大鼠无胆囊,各肝叶的胆管会合成胆总管,开口于十二指肠。胰脏位于胃和十二指肠的弯曲处,呈淡粉色,形状不规则,似脂肪。 7. 心脏重量约占体重的1/30-1/20,由左心房、左心室、右心房、
右心室组成。左心室发出主动脉弓,由此分出无名动脉、左颈总动脉、左锁骨下动脉。无名动脉又分出右颈总动脉和右锁骨下动脉。主动脉弓到心脏背侧沿脊柱下行,形成背主动脉,背主动脉再分支到髂部和四肢。 8. 肺脏为海绵状,淡粉色,位于胸腔中部,分为左、右两部分。左肺为一个大叶,右肺分为4叶(前叶、中叶、副叶、后叶)。 9. 肾脏呈暗红色、蚕豆状,位于腹腔背侧脊柱两侧。每侧肾都和一条白色细长的输尿管相连,输尿管下接膀胱。 10. 大鼠的神经系统与人类相似,亦包括中枢神经系统和周围神经系统两部分。中枢神经包括脑和脊髓,周围神经包括脑神经、脊神经、植物神经。脑分为大脑、间脑、中脑、小脑和延脑,大鼠的大脑很发达,中脑较小。由脑发出的神经叫脑神经,共12对。脊神经和植物神经和其它动物相似。 实验用大鼠解剖生理学 一、概述 每年约使用3千5百万只鼠应用于研究和测试。使用实验大鼠进行的研究包括老化,肿瘤neoplasia,药效与毒性,含特定菌之动物gnotobiology,龋齿的研究,脂质新陈代谢,维他命之作用,行为,酒精中毒和肝脏硬化,关节炎,苯酮尿症(phenylketonuria),黄疸,果糖不耐症,高血压、胚胎学,畸胎畸形学,肾性尿崩症及传染性疾病等皆可使用大鼠进行研究。 二、解剖构造
实验报告 一、实验名称:羊的解剖 二、试验时间:2010年6月12日 三、实验地点:牧医楼 四、使用器械:镊子(带齿)、手术刀、手术剪刀、骨钳、止血钳 五、解剖程序:首先把羊处死,处死方法:在羊的颈静脉沟处开口,在颈静脉 沟深处找到颈总动脉,在颈总动脉上开口放血,使羊致死;然后进行解剖观察 六、观察内容: 1.肩带肌:躯干与前肢连接的肌肉,大多为板状肌,起于躯干止于前肢的肩 胛骨和肱骨 2.斜方肌:扁平的三角形肌,位于肩颈上半部的浅层,其作用是提举、摆动 和固定肩胛骨 3.菱形肌:在斜方肌和肩胛软骨的深面,起点同斜方肌,止于肩胛软骨的内 侧面。起作用为向前上方提举肩胛骨 4.背阔肌:位于胸侧壁的上部,三角形大板状肌 5.臂头肌:位于颈侧部浅层,长而宽的带状,起于枕骨、颞骨和下颌骨,止 于肱骨嵴;作用:牵引前肢向前,伸肩关节,提举侧偏头颈 6.肩胛横突肌:呈薄带状,起于环锥翼,止于肩峰部的筋膜 7.腹侧锯肌:大型的扇形状,下缘呈锯齿状,位于颈、胸部的外侧面 8.膈:位于胸、腹腔之间,呈圆顶状突向胸腔,上面有3个孔:①主动脉裂 孔②食管裂孔③腔静脉孔 9.腹外斜肌:为腹壁肌的最外层,以肌齿起于第5至最后肋骨的外面
10.腹内斜肌:位于腹外斜肌深层,肌纤维向前方,起于髋结节,止于腹白线, 呈扇形向下方扩展 11.臀股二头肌:长而宽,位臀股部的外侧。起点分为两头椎骨头起于荐骨和 荐结节阔韧带;坐骨头起于坐骨结节,下方有坐骨神经 12.肋间外肌:位于肋间隙的浅层,起于前一肋骨的后缘,肌纤维斜向后下方, 止于后一肋骨的前缘。作用向后方牵引肋骨,使胸廓扩大,引起吸气。13.肋间内肌:位于肋间外肌的深层。起于后一肋骨的前缘,肌纤维斜向前下, 止于前一肋骨的后缘。作用:向后方牵引肋骨,使胸廓变小,帮助呼气. 14.胃:羊的胃为复胃,分为: ①瘤胃:最大,约占4个胃总容积的80%,呈椭圆形 ②网胃:4个胃中最小,呈梨形 ③瓣胃:约占4个胃的7%或8%,呈两侧稍扁的圆球形 ④皱胃:约占4个胃的8%到7%,呈一端粗一端细的弯曲长囊 其中瘤胃、网胃、瓣胃称前胃,内无腺体;皱胃称为真胃,内有腺体 15.肠:分为:十二指肠、空场、回肠、盲肠、结肠、直肠 16.心脏:位于胸腔纵膈内,夹在左右两肺之间,略偏左侧,呈倒圆锥形 17.肺:位于胸腔内在纵膈两侧,左右各一,右肺通常较大,粉红色,呈海绵 状,质地柔软,富有弹性 18.肾:实质性器官,左右各一,略呈豆形,红褐色,位于腰椎下方 七、体会:通过这次羊的实体解剖,我学到了一些东西。首先,要不怕脏,这点老师给我们做了很好的榜样。再者,我们对知识的掌握还大有欠缺;老师的对羊的各个部位的名称与功能都滥熟于心,让我们学生敬佩不已。我们要做的还有很多,要学的还有很多很多!
小鼠骨髓的综合性实验报告 本科学生综合性实验报告 学号姓名 学院专业、班级 实验课程名称: 教师及职称 开课学期至学年学期 填报时间年月日 云南师范大学教务处编印 一( 实验设计方案 实验名称实验序号 实验室实验时间 一、实验目的 1、学习并掌握小鼠骨髓细胞染色体的制备方法。 2、观察小鼠染色体的形态特征,统计细胞的染色体数目。 3、了解微核发生的机制; 4、掌握微核实验的一般程序和实践意义; 5、掌握对实验动物进行药物处理的一般程序; 6、掌握进行实验设计的一般程序和规则,并锻炼实践能力。 二、实验原理、实验流程或装置示意图
1、骨髓细胞具有高度的分裂增殖能力。因此可以直接得到中期细胞而不必象血淋巴细胞或组织那样要经过体外培养。经秋水仙素处理后,分裂增殖中的骨髓细胞由于纺缍体的形成受到抑制,染色体不能正常趋向两极而使之停留于中期,同时染色体缩短,轮廓清晰,把收获的细胞进行低渗,固定处理,使细胞处于膨胀状态,再将细胞悬液滴在载片上,使细胞破裂,染色体散开,染色后即可观察到染色体。 2、微核(Micronucleus):染色单体或染色体的无着丝点断片,或因纺锤体受损而丢失的整个染色体,在细胞分裂后期,仍然遗留在细胞质中。末期之后,单独形成一个或几个规则的次核,被包含在子细胞的胞质内,因比主核小,故称为微核。凡能使染色体发生断裂或使染色体和纺锤体联结损伤的化学物,都可用微核试验来检测。各种类型的骨髓细胞都可形成微核,但有核细胞的胞质少,微核与正常核叶及核的突起难以鉴别。 嗜多染红细胞是分裂后期的红细胞由幼年发展为成熟红细胞的一个阶段,此时红细胞的主核已排出,因胞质内含有核糖体,姬姆萨染色呈灰蓝色,成熟红细胞的核糖体已消失,被染成淡桔红色。骨髓中嗜多染红细胞数量充足,微核容易辨认,而且微核自发率低,因此,骨髓中嗜多染红细胞成为微核试验的首选细胞群。 三、实验设备及材料 1、材料:小白鼠(2n=40) 2、器具:注射器(1ml,5ml各一支)、托盘、解剖剪、镊子、吸管、离心管、离心机、载片、滤纸、白纱布小块等。 3、药品: 0.15mg/ml 秋水仙素, 1%柠檬酸三钠,固定液(3份甲醇,1份冰乙酸,临用时现配),Giemsa染液,2.2%柠檬酸钠,0.01M磷酸缓冲液(PBS)pH6.8。 4、生物显微镜、解剖剪、镊子、注射器、载玻片、盖玻片、塑料吸瓶、吸水纸等。四、实验方法步骤及注意事项
动物实验报告 集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-
实验动物学实验报告学院: 学号: 姓名 时间: 实验一:小鼠实验 一、实验目的 1、掌握小鼠抓取、固定的基本方法; 2、掌握小鼠的雌雄鉴别方法; 3、掌握小鼠的标记方法; 4、掌握小鼠的基本采血技术; 5、掌握小鼠的常用给药方法; 6、掌握小鼠的解剖方法,熟悉内部脏器的自然位置; 二、实验材料 1、实验动物:每组两只雌鼠,两只雄鼠; 2、实验器械及试剂:鼠笼;小鼠固定器和小鼠固定板;眼科剪;眼科镊;解剖刀;1ml注射器;毛细玻璃管;灌胃针;苦味酸染料;葡萄糖液;2%水合氯醛; 三、实验内容及方法 1、小鼠的抓取和固定 抓取时先用右手抓取鼠尾提起,置于鼠笼或实验台向后拉,在其向前爬行时,用左手拇指和食指抓住小鼠的两耳和颈部皮肤,将鼠体置于左手心中,把后肢拉直,以无名指按住鼠
尾,小指按住后腿即可。这种在手中固定方式,能进行实验动物的灌胃、皮下、肌肉和腹腔注射以及其他实验操作。 2、小鼠的雌雄鉴别 雄鼠的阴囊明显,雄鼠可见阴道开口和五对乳头。幼鼠或仔鼠则主要从外生殖器与肛门的距离判定,近者为雌,远者为雄。另外,雌鼠肛门和生殖器之间有一无毛小沟,而雄鼠则在肛门和生殖器之间长毛。 3、小鼠的标记方法 1)耳孔法 用耳号钳在耳上打洞或者用剪刀在耳边缘剪缺口,左耳为十位,右耳为个位。 2)剪趾法 适用于出生一周以内新生仔鼠; 3)染色法 用毛笔将苦味酸涂在动物的不同部位,注意逆着毛发生长方向刷。 4、小鼠的基本采血 1)剪尾采血 当所需血量很少时采用本法。固定动物并历出鼠尾,将鼠尾在45℃温水中浸泡数分钟,也可用酒精棉球涂擦,使局新血管扩张。将鼠尾擦干,再用刀片剪去1-2mm,让血液滴入盛器或直接用吸取,同时自尾根部向尾尖按摩。取血后,先用棉球压迫止血并立即用6%液体火棉胶涂于尾巴伤口处,使伤口外结一层火棉胶薄膜,保护伤口。也可采用切割尾静脉的方法采血,三根尾势脉可交替切割,并自尾尖向尾根方向切割,每次可取0.2~0.3ml 血,切割后用棉球压迫止血。这种采血方法在大鼠进行较好,可以较长的间隔时间连续取血,进行血常规检查。 2)眼眶后静脉丛取血
解剖牛实验报告记录-
作者: 日期: 2
IWIAN AGRICULTURE AND FORESTRY UNIVERSITY 金山学院课程实习报告 实习时间 动物医学班 学生姓名 指导老师 L' ■-- 报告题目 《小牛活体解剖课程实习》 课程名称 《家畜解剖学》 实习地点 动物医学家畜解剖实验室
(一) .实验目的、要求 一、 实习目的: 通过活体家畜的解剖活动, 使理论联系实践,做到复习和巩固一个学期以来所学到的家畜解 剖学的基本知识,并 进一步掌握不同家畜品种的各系统器官的解剖结构特点和练习家畜解剖的操 作技能和方法,从而为后期有关课程和为将来畜牧生产服务打下良好的基础。 二、 实习要求: (一) 按照本实习指导书的指导方法和参考教材有关内容与插图, 边解剖边观察,认识和掌握各器官 的位置、色泽、形态、硬度和结构以及各器官之间的相互关系。 (二) 认真做好观察记录,记录要详细,必要时可以绘图或照相。 (三) 做到分工明确,各尽其责,团结互助,听从指挥,严守课堂纪律。 (四) 总结讨论,认真写好实习报告,按时缴交。 (二). 家畜品种:牛 性 年 活 (三) .解剖程序和观察内容 1. 活体观察 毛色:褐色 观察巩 膜为白色, 健康状况:良好 2. 活体触摸 左手抓住鼻梁和颊部,右手抓住下颌,用劲拉开口腔(用两指伸入齿间缘,用力往下压)拉出舌头。 观察口腔粘膜和舌粘膜的眼神是正常的。呈粉红色。 用手触摸肩前淋巴结、髂下淋巴结 用手触摸肋骨、肋间隙、髋结节、坐骨结节、髋关节、肩关节 触摸乳房,乳头两个 触摸关节和蹄部 触摸喉头、气管,按压颈静脉沟后部,颈静脉怒胀彭起 3. 处死 磨刀,绑定,称重。 右手按压住颈静脉沟的颈基部,让颈静脉鼓起, 主刀手迅速于颈静脉沟的后 1/3部切开皮肤约6厘米长。 钝性分离皮下组织,把颈静脉挤向上方,继续分离结缔组织,在气管的侧面即可摸到搏动的颈动脉。 把颈动脉拉出,分离迷走交感干,用止血钳夹住颈动脉的头端,用一只手拉住颈动脉的胸段,用手 术刀切开颈动脉。进行放血。 抽筋后,用手触摸睫毛,判断是否死亡(如果睫毛不动,则表示已经死亡) 瞳孔放大。 别: 龄: 重: 母 未知 59斤 56斤 放血后重: 前后关节:健全 蹄着地情况:正常 瞳孔为椭圆形,眼结膜粉红色、正常 叫声:小声,嘶哑 鼻镜:湿润 眼神:呆滞 呼吸时胸部起伏情况:较大
金山学院课程实习报告报告题目《山羊活体解剖课程实习》课程名称《家畜解剖学》 实习地点动物医学家畜解剖实验室实习时间 专业动物医学班 年级 学生姓名 学号 指导老师
(一).实验目的、要求 一、实习目的: 通过活体家畜羊的解剖活动,使理论联系实践,做到复习和巩固一个学期以来所学到的家畜解剖学的基本知识,并进一步掌握不同家畜品种的各系统器官的解剖结构特点和练习家畜解剖的操作技能和方法,从而为后期有关课程和为将来畜牧生产服务打下良好的基础。 二、实习要求: (一)按照本实习指导书的指导方法和参考教材有关内容与插图,边解剖边观察,认识和掌握各器官的位置、色泽、形态、硬度和结构以及各器官之间的相互关系。 (二)认真做好观察记录,记录要详细,必要时可以绘图或照相。 (三)做到分工明确,各尽其责,团结互助,听从指挥,严守课堂纪律。 (四)总结讨论,认真写好实习报告,按时缴交。 (二).家畜品种:山羊 性别:母 年龄:未知 活重:59斤 放血后重:56斤 (三).解剖程序和观察内容 1.活体观察 毛色:褐色前后关节:健全蹄着地情况:正常 观察巩膜为白色,瞳孔为椭圆形,眼结膜粉红色、正常 健康状况:良好叫声:小声,嘶哑鼻镜:湿润眼神:呆滞呼吸时胸部起伏情况:较大2.活体触摸 左手抓住鼻梁和颊部,右手抓住下颌,用劲拉开口腔(用两指伸入齿间缘,用力往下压)拉出舌头。观察口腔粘膜和舌粘膜的眼神是正常的。呈粉红色。 用手触摸肩前淋巴结、髂下淋巴结 用手触摸肋骨、肋间隙、髋结节、坐骨结节、髋关节、肩关节 触摸乳房,乳头两个 触摸关节和蹄部 触摸喉头、气管,按压颈静脉沟后部,颈静脉怒胀彭起 3.处死 磨刀,绑定,称重。 右手按压住颈静脉沟的颈基部,让颈静脉鼓起, 主刀手迅速于颈静脉沟的后1/3部切开皮肤约6厘米长。 钝性分离皮下组织,把颈静脉挤向上方,继续分离结缔组织,在气管的侧面即可摸到搏动的颈动脉。把颈动脉拉出,分离迷走交感干,用止血钳夹住颈动脉的头端,用一只手拉住颈动脉的胸段,用手术刀切开颈动脉。进行放血。 抽筋后,用手触摸睫毛,判断是否死亡(如果睫毛不动,则表示已经死亡)。 瞳孔放大。