
第十六章杂环化合物
教学要点:
掌握五元杂环化合物的结构、性质;了解吡啶和生物碱。教学时数: 6 学时
教学方法:教师讲授、
教学手段:多媒体、自制模型
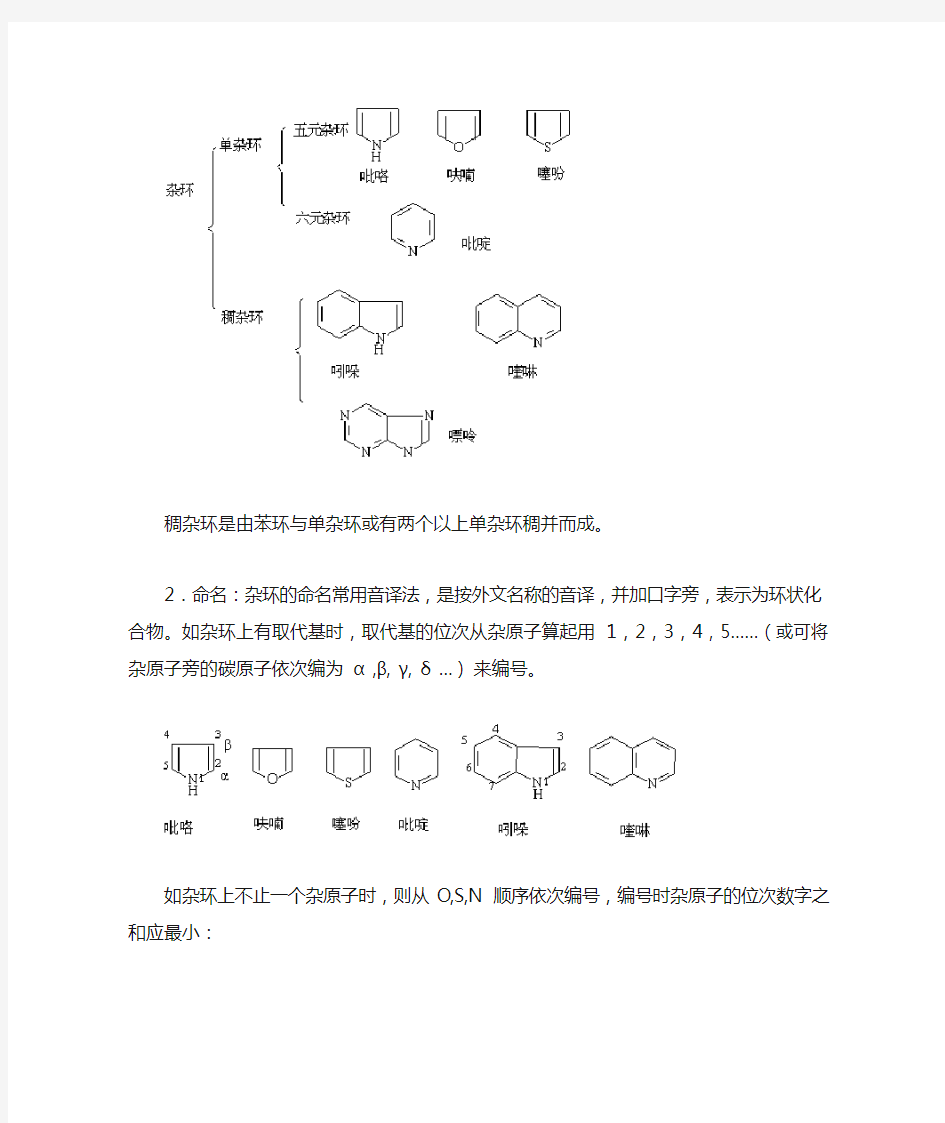
第一节杂环化合物的分类和命名杂环大体可分为:单杂环和稠杂环两类。
1. 分类:
稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。
2.命名:杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为α ,β, γ, δ …)来编号。
如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小:
五元杂环中含有两个杂原子的体系叫唑(azole)
第二节五元杂环化合物
一.含有一个杂原子的五元杂环单环体系:呋喃,噻吩,吡咯。
(1)呋喃,噻分,吡咯的电子结构和光谱性质。
电子结构:这三个杂环化合物中,碳原子和杂原子均以sp2杂化轨道互相连接成σ健,并且在一个平面上,每个碳原子及杂原子上均有一个p轨道互相平行,在碳原子的p轨道中有一个p电子,在杂原子的p轨道中有两个p电子,形成一个环形的封闭的π电子的共轭体系。这与休克尔的4n+2规则相符,因此这些杂环或多或少的具有与苯类似的性质,故称之为芳香杂环化合物。
芳香性大小,试验结果表明:
光谱性质:IR: νc-H = 3077~3003cm-1,νN-H = 3500~3200 cm-1(在非极性溶剂的稀溶液中,在3495 cm-1,有一尖峰。在浓溶液中则于3400 cm-1,有一尖峰。在浓和淡的中间浓度时,两种谱带都有),杂环C=C伸缩振动:1600~1300 cm-1(有二至四个谱带)。
NMR:这些杂环化合物形成封闭的芳香封闭体系,与苯环类似,在核磁共振谱上,由于外磁场的作用而诱导出一个绕环转的环电流,此环电流可产生一个和外界磁场方向相反的感应磁场,在环外的质子,处在感应磁场回来的磁力线上,和外界磁场方向一致,在去屏蔽区域,故环上氢吸收峰移向低场。化学位移一般在7ppm左右。
呋喃:α-H δ=7.42ppm β-H δ=6.37ppm
噻吩:α-H δ=7.30ppm β-H δ=7.10ppm
吡咯:α-H δ=6.68ppm β-H δ=6.22ppm
二.呋喃,噻吩,吡咯的制备。
1.玉米心,稻糠,花生壳,大麦壳,高粱秆等用稀硫酸处理得戊糖,戊糖失水得糠醛,再在400℃下加热,同时在催化剂ZnO,Cr2O3存在下,失去一氧化碳而得呋喃。
2.工业上制备噻吩是用丁烷,丁烯或丁二烯与硫磺混合,在600℃反应得到:
3.噻吩也可用琥珀酸钠盐与五硫化二磷一起加热反应制得:
4.帕尔——克诺尔(C.Paal—L.Knorr)合成法:
1,4—二羰基化合物常在无水的酸性条件下,得到呋喃及其衍生物。1,4—二羰基化合物与氨或硫化合物反应,可制备噻吩,吡咯及他们的衍生物,这个方法称为帕尔—克诺尔合成法:
5.取代吡咯的另一个一般的合成法,称为克诺尔合成法,即用氨基酮与有α-亚甲基的酮进行缩合。例如用氨基酮酸酯与酮酸酯或1,3—二酮缩合,氨基酮酸脂由相应的β-羰基酯制得。
α—氨基酮α—亚甲基酮
(三)呋喃,噻吩,吡咯的反应。
1.亲电取代反应:
(1)呋喃,噻吩,吡咯亲电取代活泼顺序
呋喃,噻吩,吡咯亲电取代反应很容易进行。这是由于环上五个原子共有六个π电子,故π电子出现的几率密度比苯环大。换句话说,环上的杂原子有给电子的共轭效应,能使杂环活化。所以,在亲电取代反应中的速度比苯环快的多。亲电取代反应活泼顺序为:
杂原子给电子共轭效应愈强,环上电子云密度愈大,亲电取代愈易进行。
N 电负性3.0, O 电负性3.5, S 电负性2.4,N、O与碳在同一周期,S在第三周期,其p 轨道与碳的p轨道重叠较小。
(2)亲电基团容易进入杂环的2,5 位(即α, α′位),若杂环的2,5位已有基团存在,则进入3位。
α位比较活泼的原因是因为在反应中形成的中间体正离子有三个共振式参与共振。如果在β位发生反应,形成的中间体正离子只有两个共振式参与共振,参与共振的共阵式愈多,杂化体愈稳定,故在α位发生反应的中间体正离子比较稳定,稳定的中间体正离子的过渡态
能量低,反应速度快。因此亲电取代反应容易在α位发生。
稳定
(3)呋喃,噻吩,吡咯,遇强酸及氧化剂很容易使环破坏,因此进行取代反应须在较温和的条件下进行。
(a)硝化
呋喃,噻吩,吡咯很容易被氧化,甚至也能被空气氧化。硝酸是强氧化剂,因此一般不用硝酸直接氧化。通常用比较温和的非质子的硝化试剂—硝酸乙酰酯进行硝化,反应还须在低温进行:
乙酐乙酰基硝酸酯(硝酸乙酰酯)
杂环亲电取代反应的活泼性越强,反应温度控制的越低。
呋喃比较特殊,在此反应中首先生成稳定的或不稳定的2,5—加成产物,然后加热或用吡啶除去乙酸,得硝化产物:
呋喃易生成2,5—加成物,与反应物的离域能大小有关。离域能大,过渡态已具有稳定的芳香族化合物的部分性质,能量也就较低,活化能小,容易发生亲电取代反应。呋喃的离域能较小(呋喃66.9kJ/mol,噻吩121.3 kJ/mol,吡咯87.8 kJ/mol)易与乙酰氧基负离子发生亲核加成反应,而吡咯具有较高的芳香性,因此,易于失去质子发生亲电取代反应。但必须注意到呋喃与大多数亲电试剂发生亲电取代反应,只有在强的亲核试剂存在时,才发生亲核加成反应(邢其毅等《基础有机化学》第二版874页)噻吩可以用一般的硝化试剂进行硝化,但反应非常猛烈。
(b)磺化
呋喃,噻吩,吡咯也需避免直接用硫酸进行磺化,常用温和的非质子磺化试剂,如用吡
啶与三氧化硫加成物作为磺化剂进行反应:
吡咯—2—磺酸
反应首先得到吡啶的磺酸盐,在用无机酸转为游离的磺酸。由于噻吩比较稳定(芳香性强),可以用硫酸直接进行磺化,但产率不如上述试剂所得到的高。从煤焦油中得到的苯通常含有少量的噻吩。可在室温下反复用硫酸提取,由于噻吩比苯容易磺化,磺化的噻吩溶于浓硫酸内,可以与苯分离。然后水解,将磺酸基去掉,可得到噻吩:
噻吩—2—磺酸69~76%(溶于浓H2SO4)
(c)卤化
呋喃,噻吩在室温与氯或溴反应很强烈,得到多卤代的产物。如希望得到一氯代和一溴代的产物,须在温和的条件下(如用溶剂稀释)及低温下进行反应。不活泼的碘则须在催化剂作用下进行:
吡咯卤代常得到四卤化物。2—氯吡咯很不稳定,是唯一能直接卤化制得的2—卤吡咯。
(d)傅氏酰基化
呋喃用酸酐或酰氯在傅氏催化剂作用下发生酰基化反应,酸酐如用三氟化硼做催化剂产率最高:
呋喃,吡咯,噻吩亲电取代反应小结:呋喃,吡咯遇强酸容易开环或产生聚合物。故所使用的亲电试剂一般比较温和。
噻吩很稳定,与酸不发生上述反应。
噻吩傅氏酰基化反应非常有用,但需要小心控制反应条件,如用无水三氯化铝,氯化锡等催化剂易于噻吩产生树脂状物质。必须将三氯化铝等先与酰化试剂反应生成活泼的亲电试剂,然后在与噻吩反应。
吡咯可用乙酸酐在150~200℃直接酰化:
(e)傅氏烷基化
呋喃,噻吩,吡咯进行烷基化反应很难得到一烷基取代的产物。常得到混合的多烷基取代物。甚至不可避免的产生树脂状物质,因此用处不大。
2.加成反应:
(a) D-A反应
呋喃的离域能较小,芳香性较差,故环的稳定性较低。可以看作是1,3—二烯。具有共轭双烯的性质,可以发生双烯加成类型的反应:
吡咯与顺丁烯酸酐不发生D—A反应,可能是氮原子的未共用电子对参加了共轭体系,典型的亲二烯试剂丁炔二酸(或酯)与之发生迈克尔加成反应。
吡咯能发生下列加成反应:
噻吩发生上述加成反应的倾向性很小。噻吩与乙炔的亲二烯试剂加成的研究较多,双烯加成产物通常不稳定,失硫而得苯的衍生物。
噻吩和吡咯中,由于硫和氮原子的电负性较小,芳香性较强,共轭二烯的性质较差。
(b)催化氢化反应
呋喃,噻吩,吡咯均可进行催化氢化反应,失去芳香特性而得到饱和杂环化合物。呋喃和吡咯可用一般催化剂还原,噻吩能使一般催化剂中毒,需使用特殊催化剂:
3.吡咯的弱碱性和弱酸性
从结构上看,吡咯是环状第二胺,但因氢原子上的未共用电子对参与了环的共轭体系,使氮原子上的电子出现的几率密度降低。减弱吸引H+的能力,故吡咯的碱性极弱,K b=2.5×10-14,比苯胺弱的多,苯胺Kb=3.8×10-10.另一方面,吡咯氮原子上的氢原子却有极微弱的酸性,其酸性电离常数Ka=10-15,较醇强而较酸弱。苯酚Ka=1.3×10-10,乙醇Ka≈10-18。故吡咯能与固体氢氧化钾加热成为钾盐:
吡咯也能与格氏试剂作用放出烃(RH)而成吡咯卤化镁:
吡咯卤化镁
吡咯钾盐及吡咯卤化镁都可以用来合成吡咯衍生物。
N—苯甲酰基吡咯70%
4.吡咯的其它反应:吡咯的性质与酚很类似,可发生下列反应:
2—吡咯甲醛(瑞穆尔—梯曼反应)
2—吡咯甲酸铵盐(柯尔柏反应)
第二节五元杂环化合物(二)
二.呋喃,吡咯的衍生物
1.糠醛(α—呋喃甲醛):
糠醛是无色透明液体,糠醛在工业上由农副产物如甘蔗渣,花生壳,高粱秆,棉子壳等用稀酸加热蒸煮制取。
(1)糠醛是良好的溶剂:糠醛常用作精炼石油的溶剂,以溶解含硫物质及环烷等。还可以精制松香,脱除色素,溶解硝酸纤维等。
(2)催化加氢。
(3)氧化反应:
(4)歧化反应:(无α-H的醛)
(5)安息香缩合:
(6)合成四氢呋喃
2.卟吩化合物:四个吡咯环和四个次甲基交替相连组成的大环,叫卟吩环。含卟吩环的化合物称卟啉化合物。
卟吩环碳上氢原子被取代及部分或全部取代后形成的化合物,叫做卟啉。卟吩化合物广泛分布于自然界,例如血红素和叶绿素。血红素存在于哺乳动物的红血球中,它与蛋白质合成为血红蛋白质。血红蛋白质的功能是运载氧气及二氧化碳。
叶绿素与蛋白质结合存在于植物的叶和绿色的茎中。植物光合作用时,叶绿素吸收太阳能转变为化学能,是植物进行光合作用时必需的催化剂。自然界的叶绿素不是一个单纯的化合物,而是由两种叶绿素组合而成,即蓝绿色的叶绿素a(熔点:117~120 ℃)和黄绿色的叶绿素b(熔点:120~130 ℃),两者的比例为:3a:4b,叶绿素环中含镁。叶绿素a 已经被合成(1960年)
叶绿素α 的结构
维生素B12,是含钴的类似卟啉环化合物。但其卟啉环在δ-位少一个碳原子。它具有强的医治贫血的功能。
三.含有一个杂原子的五元杂环苯并体系
苯与呋喃,噻吩,吡咯共用两个碳原子而成的苯并体系,成为苯并呋喃,苯并噻吩,吲哚:
这三类化合物中,以吲哚环系比较重要,因此主要对吲哚环系进行一些介绍。吲哚本身为线状结晶,具有极臭的气味,但在其稀薄时则有香味,可以当作香料用。含吲哚环的生物
碱广泛存在于植物中,如麦角碱,马钱子碱,利血平等。植物生长调节剂β-吲哚乙酸,哺乳动物及人脑中思维活动的重要物质5—羟基色胺,植物染料靛蓝以及蛋白质组分的色氨酸都会有吲哚环。
1. 合成:费歇尔吲哚合成法是吲哚环系一个重要的广泛应用的合成方法,它是用苯腙在酸催化下加热重排消除一分子氨得到2—取代或3—取代吲哚衍生物。
现举例子如下:
2.反应:五元杂环与苯并和后,仍具芳香性,但亲电取代反应的活泼性比未并和的五元杂环低,比苯高,故亲电取代反应在杂环上进行。这些环系遇浓硫酸易树脂化,需避免在浓硫酸存在下进行反应:
从上面反应可以看到,这些杂环化合物的亲电取代反应主要发生在3位。这与反应中间体正离子的稳定性有关。亲电试剂在C2位进攻,带有完整苯环的稳定共振式只有一个;而在C3位进攻,带有完整苯环的稳定共振式有两个:
在C2位进攻:
在C3位进攻:
(八电子的带正电荷的氮)
参与的稳定的共振式视愈多,中间体正离子愈稳定。
四. 含有两个杂原子的五元杂环单环体系:
五元杂环中含有两个杂原子的体系叫唑(azole),根据杂原子在环中的位置不同,又可分为1,2—唑与1,3—唑两类。
命名:环中有不同杂原子,按氧,硫,氮顺序编号。使杂原子编号最小:
1,2唑:
1,3唑:
1.噻唑
一些重要的天然产物集合成药物含有噻唑结构,如:
2. 咪唑
山东理工大学教案
第十七章 杂环化合物 杂环化合物是指组成环的原子中含有除碳以外的原子(杂原子——常见的是N 、O 、S 等)的环状化合物。 杂环化合物 非芳香杂环芳杂环(符合休克尔规则的杂环)如 如 O O NH N N H O , ………… ,, 杂环化合物不包括极易开环的含杂原子的环状化合物,例如: NH O , , , O O O O O O 本章我们只讨论芳香族杂环化合物。 在具有生物活性的天然化合物中,大多数是杂环化合物。例如,中草药的有效成分生物碱大多是杂环化合物;动植物体内起重要生理作用的血红素、叶绿素、核酸的碱基都是含氮杂环;一些维生素、抗菌素、植物色素、植物染料、合成染料都含有杂环。 §17.1 杂环化合物的分类和命名 §17.1.1 杂环从结构上大体分为:单杂环和稠杂环两类。
§17.1.2命名 杂环化合物的命名比较复杂,现在一般通用的有两种类型的命名方法。一种是按照化合物的西文名称音译,另一种是根据相应的碳环化合物名称类比命名。杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。 1.单杂环的命名方法 第一步,写出杂环化合物的基本名称 thiophene imidazole oxazole 呋喃 吡咯 噻吩 咪唑 噁唑 噻唑 吡喃 吡啶 嘧啶 吡嗪 第二步, 是将杂环上每个"环节"原子编号,并使杂原子处在最小号数位置,如果一个环上有两个或多个不同种类的杂原子时,则规定按O ,S ,N ,…顺序使其位号由小到大。例如:两个或多个不同种类的杂原子时,则规定按O ,S ,N ,…顺序使其位号由小到大。例如: 第三步,当环上有取代基时,先将取代基的名称放在杂环基本名称(或称主体环名称)的前面,并把主体环的位号写在取代基名称的前面,以表示取代基在主体环上的位置。如果杂环分子上有两个或两个以上取代基时,则按照最低系列原则编号。例如: 3—甲基吡啶 1,3—二甲基吡咯(不是1,4—二甲基吡咯)
第十七章 杂环化合物 (heterocyclic Ring compounds ) 一、教学目的和要求 1.掌握杂环化合物的分类和命名。 2.掌握五元单杂环、六元单杂环化合物的化学性质。 3.理解杂环化合物的结构与芳香性。 4.理解吡咯、吡啶的结构与性质的关系。 二、教学重点与重点 重点:杂环化合物、甾体化合物结构特征与命名(俗名)。 难点:杂环化合物的结构。 三、教学方法和教学学时 (1)教学方法:以课堂讲授为主,结合必要的课堂讨论。教学手段以板书和多媒体相结合。 (2)教学学时:4学时 四、教学内容 1、杂环化合物 (1)杂环化合物概述 (2)吡咯及其衍生物 (3)吡啶及其衍生物 (4)吲哚及其衍生物 (5)苯并吡喃及其衍生物 (6)嘧啶和嘌呤及其衍生物 2、生物碱 (1)生物碱概述 (2)生物碱举例 五、总结、布置作业 17.1 几种基本杂环 (分类和命名) 杂环化合物定义 :杂环化合物是指环比较稳定、含杂原子的环状化合物,包括芳香性杂环和非芳香杂环。 杂环化合物的种类很多,有单环,也有与芳香环或其他杂环并联成的稠杂环。环上的杂原子可以是一个、两个或更多个,而且可以是相同的或是不同的。一般最常见的杂环是五元或六元环。 根据1980年中国化学会颁布的有机化学命名原则,杂环化合物的命名按外文名称音译,并以一口字旁表示是环状化合物。以下是几种常见的杂环化合物的结构与名称。 O S N S N N N H H 呋喃 噻吩 吡咯 噻唑 咪唑 Furan Thiophene Pyrrole Thiazole Imidazole N O N N N N N N
吡啶 吡喃 哒嗪 嘧啶 吡嗪 Pyridine Pyran Pyridazine Pyrimidine Pyrazine H N O N N N N 吲哚 苯并呋喃 嘌呤 N N N 喹啉 异喹啉 吖啶 17.2 几种重要杂环化合物的结构 吡咯、吡啶 、呋喃、噻吩 ----C 、N 、O 、S 皆为 SP2 杂化 ,符合休克尔规则,有芳香性。但根据具体情况的不同,有的是富电子芳杂环,有的是缺电子芳杂环。 1. 1. 五元杂环 吡咯的共轭体系及比例模型如下: 吡咯是富电子芳杂环。 2. 2. 六元杂环 吡啶的共轭体系及比例模型如下: 吡啶是缺电子芳杂环。 富电子芳杂环与缺电子芳杂环因为结构特点的不同而表现出不同的化学 性质,其中亲电取代反应的差异尤为明显。
第14章杂环化合物 杂环化合物是由碳原子和非碳原子共同组成环状骨架结构的一类化合物。这些非碳原子统称为杂原子,常见的杂原子为氮、氧、硫等。前面已经学过的内酯、内酰胺、环醚等化合物都是杂环化合物,但是这些化合物的性质与同类的开链化合物类似,因此都并入相应的章节中讨论。本章将主要讨论的是环系比较稳定、具有一定程度芳香性的杂环化合物,即芳杂环化合物。 杂环化合物的种类繁多,数量庞大,在自然界分布极为广泛,许多天然杂环化合物在动、植物体内起着重要的生理作用。例如:植物中的叶绿素、动物血液中的血红素、中草药中的有效成分生物碱及部分苷类、部分抗生素和维生素、组成蛋白质的某些氨基酸和核苷酸的碱基等都含有杂环的结构。在现有的药物中,含杂环结构的约占半数。因此,杂环化合物在有机化合物(尤其是有机药物)中占有重要地位。 第一节分类和命名 一、杂环化合物的分类 芳杂环化合物可以按照环的大小分为五元杂环和六元杂环两大类;也可按杂原子的数目分为含一个、两个和多个杂原子的杂环,还可以按环的多少分为单杂环和稠杂环等。见表14-1。 表14-1 有特定名称的杂环的分类、名称和标位 14-1
二、杂环化合物的命名 (一)有特定名称的稠杂环14-2
杂环化合物的命名比较复杂。现广泛应用的是按IUPAC(1979)命名原则规定,保留特定的45个杂环化合物的俗名和半俗名,并以此为命名的基础。我国采用“音译法”,按照英文名称的读音,选用同音汉字加“口”旁组成音译名,其中“口”代表环的结构。见表14-1。 (二)杂环母环的编号规则 当杂环上连有取代基时,为了标明取代基的位置,必须将杂环母体编号。杂环母体的编号原则是: 1.含一个杂原子的杂环 含一个杂原子的杂环从杂原子开始编号。见表14-1中吡咯、吡啶等编号。 2.含两个或多个杂原子的杂环 含两个或多个杂原子的杂环编号时应使杂原子位次尽可能小,并按O、S、NH、N 的优先顺序决定优先的杂原子,见表14-1中咪唑、噻唑的编号。 3.有特定名称的稠杂环的编号有其特定的顺序 有特定名称的稠杂环的编号有几种情况。有的按其相应的稠环芳烃的母环编号,见表14-1中喹啉、异喹啉、吖啶等的编号。有的从一端开始编号,共用碳原子一般不编号,编号时注意杂原子的号数字尽可能小,并遵守杂原子的优先顺序;见表14-1中吩噻嗪的编号。还有些具有特殊规定的编号,如表14-1中嘌呤的编号。 4.标氢 上述的45个杂环的名称中包括了这样的含义:即杂环中拥有最多数目的非聚集双键。当杂环满足了这个条件后,环中仍然有饱和的碳原子或氮原子,则这个饱和的原子上所连接的氢原子称为“标氢”或“指示氢”。用其编号加H(大写斜体)表示。例如: N N H O O 1H-吡咯2H-吡咯2H-吡喃4H-吡喃 若杂环上尚未含有最多数目的非聚集双键,则多出的氢原子称为外加氢。命名时要指出氢的位置及数目,全饱和时可不标明位置。例如: 14-3
第十一章 杂环化合物和生物碱 一、学习要求 1.掌握杂环化合物的分类和命名 2.掌握五元杂环、六元杂环和稠杂环的结构和性质 3.掌握生物碱的基本概念及分类 4.了解生物碱的一般性质、提取方法及重要的生物碱 二、本章要点 (一)杂环化合物的分类和命名 1.杂环化合物的概念 由碳原子和非碳原子所构成的环状有机化合物称为杂环化合物,环中的非碳原子称为杂原子,最常见的杂原子有氧、硫、氮等。 2.杂环化合物的分类 按环的数目不同,可分为单杂环和稠杂环两大类。单杂环按环的大小不同又可分为五元杂环和六元杂环。稠杂环通常由苯与单杂环或单杂环与单杂环稠合杂环化合物而成。 3.杂环化合物的命名 杂环化合物的命名比较复杂,目前我国常使用“音译法”,即按英文的读音,用同音汉字加上“口”字旁命名: O 1 2 3 45 5 43 2 1 S 5 432 1N 543 2 1 N S 543 2 1N N H 5432 1N N H 呋喃 噻吩 吡咯 噻唑 吡唑 咪唑 (furan ) (thiophene ) (pyrrole ) (thiazole ) (pyrazole ) (imidazole ) 6 54 32 1 O N N 1 2 3456 N N 1 2 3456 N N 1 2 3456 6 54 3 2 1 N 吡啶 哒嗪 嘧啶 吡嗪 吡喃(pyridine ) (pyridazine) (pyrimidine) (pyrazine) (pyran)
环上有取代基的杂环化合物的名称是以杂环为母体,并注明取代基的位置、数目和名称。杂原子的编号,除个别稠杂环外,一般从杂原子开始编号,环上有不同不同杂原子时,按O 、S 、NH 和N 的顺序编号;某些杂环可能有互变异构体,为区别各异构体,需用大写斜体“H ”及其位置编号标明一个或多个氢原子所在的位置。例如: 2,4-二羟基嘧啶 2-氨基-6-氧嘌呤 4H -吡喃 2H -吡喃 此外,还可以将杂环作为取代基,以官能团侧链为母体进行命名。例如: N ,N-二乙基-3- 4-嘧啶甲酸 3-吲哚乙酸 2-呋喃甲醛 吡啶甲酰胺 (二)含氮六元杂环 1.吡啶的结构 1 2345 6 7 8 9 N N N N H 2N O H N N OH OH 1 23 4 56 O 1 2 34 56 1 2 3 45O 6 1 2 1 CHO O CON(C 2H 5)2 N 2 34 56 COOH 6 5432 1 N N CH 2COOH N H 12 3 456 7 N .. 6 8 75 43 2 110 98 76 5321 6 58 7 654321 H N N N N N N 8 7 65 432 N 7 4 32 1H N 喹啉 异喹啉 吲哚 吖啶 嘌呤 ( quinoline) (isoquinoline) (indole) (acridine) (purine)
第十八章杂环化合物 1、命名下列化合物: 解:(1) 4-甲基-2-乙基噻唑(2) 糠酸(α-呋喃甲酸) (3) N-甲基吡咯(4) 4-甲基咪唑(5) α,β-吡啶二甲酸(2,3-吡啶二甲酸)(6)β-乙基喹啉(3-乙基喹啉)(7) 5-异喹啉磺酸(8) β-吲哚乙(3-吲哚乙酸)(9) 6-氨基嘌呤(10) 6-羟基嘌呤 2、为什么呋喃能与顺丁烯二酸酐进行双烯合成反应,而噻吩及吡咯则不能?试解释之。 解:在呋喃、吡啶和噻吩中,杂原子分别是O、N和S。电负性是O>N>>S ,提供电子对构成具有芳香性的芳环的能力与此电负性的关系相反。因此芳香性:呋喃>吡啶>噻吩。另一方面,反应出来的共轭二烯性:呋喃>吡啶>噻吩。因此,呋喃易与顺—丁烯二酸酐发生环加成反应而吡啶、噻吩则需反应性更强的双烯体,如苯炔、丁炔二酸脂等。 3、为什么呋喃、噻吩及吡咯容易进行亲电取代反应,试解释之。 解:在呋喃、噻吩和吡咯中,具有五原子环六个π电子芳香共轭体系,符合[4n+2]休克尔规则,都具有芳香性。因此芳香性大小是:呋喃>吡啶>噻吩。这些芳环又是富电子的芳香共轭体系,易发生亲电取代。
4、吡咯可发生一系列与苯酚相似的反应,例如可与重氮盐偶合,试写出反应式。 N H C6H5N2 X N N N C6H5 2—吡咯偶氮苯 5、比较吡咯与吡啶两种杂环。从酸碱性、环对氧化剂的稳定性、取代反应及受酸聚合性等角度加以讨论。 解: 吡咯和吡啶分子中的氮原子都是sp2杂化的。在吡啶中,有一对未共用电子对处在未参与共轭的sp2杂化轨道上,因此吡啶的碱性很强;另外吡啶氮上的未共用电子对能与水分子形成氢键,吡啶易溶于水,吡咯不具备与水形成氢键的结构特征,因此难溶于水。在吡咯中,氮原子提供一对未参与杂化的p轨道上电子参与芳香体系的形成,因此其碱性很弱;氮原子上的氢电离后形成的负离子未破坏其芳香性,因此,吡啶的性质类似于硝基苯;为一缺电子芳香性分子,对氧化剂较不稳定,亲电取代反应活性也较高。吡啶和强酸作用可生成盐,不破坏其芳香性;吡咯和酸作用时,氮原子提供一对p轨道上的电子和酸结合,破坏了其芳香性,生成聚合产物。 6、写出斯克劳普合成喹啉的反应。如要合成6-甲氧基喹啉,需用哪些原料? 解: HC OH CH2OH CH2OH 24CH CH2
第十八章杂环化合物 第一节杂环化合物的分类和命名 杂环大体可分为:单杂环和稠杂环两类。 1. 分类: 稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。 2.命名:杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为α ,β, γ, δ …)来编号。
如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小: 五元杂环中含有两个杂原子的体系叫唑(azole) 第二节五元杂环化合物 一.含有一个杂原子的五元杂环单环体系:呋喃,噻吩,吡咯。 (1)呋喃,噻分,吡咯的电子结构和光谱性质。 电子结构:这三个杂环化合物中,碳原子和杂原子均以sp2杂化轨道互相连接成σ健,并且在一个平面上,每个碳原子及杂原子上均有一个p轨道互相平行,在碳原子的p轨道中有一个p电子,在杂原子的p轨道中有两个p电子,形成一个环形的封闭的π电子的共轭体系。这与休克尔的4n+2规则相符,因此这些杂环或多或少的具有与苯类似的性质,故称之为芳香杂环化合物。 芳香性大小,试验结果表明: 光谱性质:IR: νc-H = 3077~3003cm-1,νN-H = 3500~3200 cm-1 (在非极性溶剂的稀溶液中,在3495 cm-1,有一尖峰。在浓溶液中则于3400 cm-1,有一尖峰。
在浓和淡的中间浓度时,两种谱带都有),杂环C=C伸缩振动:1600~1300 cm-1(有二至四个谱带)。 NMR:这些杂环化合物形成封闭的芳香封闭体系,与苯环类似,在核磁共振谱上,由于外磁场的作用而诱导出一个绕环转的环电流,此环电流可产生一个和外界磁场方向相反的感应磁场,在环外的质子,处在感应磁场回来的磁力线上,和外界磁场方向一致,在去屏蔽区域,故环上氢吸收峰移向低场。化学位移一般在7ppm左右。 呋喃:α-H δ=7.42ppm β-H δ=6.37ppm 噻吩:α-H δ=7.30ppm β-H δ=7.10ppm 吡咯:α-H δ=6.68ppm β-H δ=6.22ppm 二.呋喃,噻吩,吡咯的制备。 1.玉米心,稻糠,花生壳,大麦壳,高粱秆等用稀硫酸处理得戊糖,戊糖失 水得糠醛,再在400℃下加热,同时在催化剂ZnO,Cr 2O 3 存在下,失去一氧化碳 而得呋喃。 2.工业上制备噻吩是用丁烷,丁烯或丁二烯与硫磺混合,在600℃反应得到: 3.噻吩也可用琥珀酸钠盐与五硫化二磷一起加热反应制得:
第十二章 杂环化合物 一、定义和分类 分子中含有由碳原子和其它原子共同组成的环的化合物称为杂环化合物。杂环中的非碳原子称为杂原子,最常见的杂原子有N 、O 、S 等。象环醚、内酯、环酐及内酰胺等似乎也应属于杂环化合物。但是,由于这些环状化合物容易开环形成脂肪族化合物,其性质又与相应的脂肪族化合物类似,因此,一般不放在杂环化合物中讨论。本章讨论的是环系比较稳定,并且在性质上具有一定芳香性的杂环化合物。 根据环数的多少分为单杂环和多杂环;单杂环又可根据成环原子数的多少分为五元杂环及六元杂环等;多杂环稠杂环、桥杂环及螺杂环,其中以稠杂环较为常见。 二、命名 杂环化合物的名称包括杂环母体及环上取代基两部分。杂环母环的命名有音译法和系统命名法2种。 音译法:是用外文谐音汉字加“口”偏旁表示杂环母环的名称。如呋喃等。 系统命名法:是把杂环看作杂原子转换了相应碳环中的碳原子,命名时以相应的碳环为母体,在碳环名称前加上杂原子的名称,称为“某(杂)某”。如吡啶称为氮(杂)苯,喹啉称为1-氮(杂)萘。 杂环母环的编号规则 (1)含1个杂原子的杂环,从杂原子开始用阿拉伯数字或从靠近杂原子的碳原子开始用希腊字母编号。 (2)如有几个不同的杂原子时,则按O 、S 、-NH-、-N=的先后顺序编号,并使杂原子的编号尽可能小。 (3)有些稠杂环母环有特定的名称和编号原则。 杂环的命名如下: 2-硝基吡咯 4-甲基吡啶 2-甲基-5-苯基噻唑 α-硝基吡咯 γ-甲基吡啶 3-甲基-8-羟基喹啉 1-甲基-7-氯异喹啉 1-甲基-2-巯基咪唑 2-呋喃甲醛(糠醛) 2-噻吩磺酸 3-吡啶甲酰胺 α-呋喃甲醛 α-噻吩磺酸 β-吡啶甲酰胺 N H NO 2N CH 3N S C 6H 5CH 3N CH 3CH 3N Cl N CH 3N SH O CHO S SO 3H N CONH 2
第十二章杂环化合物 【学习目标】 1、说出杂环化合物的概念; 2、能按照IUPAC(1979)原则对杂环化合物进行命名; 3、掌握简单杂环化合物的结构特点,了解其性质和应用; 4、认识常见的杂环化合物的衍生物,了解它们的应用。 在有机化合物中,除碳、氢以外的其他元素的原子通常被称为杂原子,而在环状化合物中,如果其环中除碳原子外,还含有杂原子,则该环即为杂环,该化合物称为杂环化合物,杂环中所含杂原子一般为氮、氧、硫等。 杂环化合物在自然界中分布广泛,例如,植物中的叶绿素和动物血红蛋白中的血红素同属卟啉类的杂环化合物,由于其结构中心的金属离子不同而显不同颜色,叶绿素为镁卟啉显绿色,血红素为铁卟啉显红色;此外,其他如核酸中含嘌呤、嘧啶等杂环化合物等等。 在现代药物体系中,含杂环结构的药物也占了相当大的比例,例如增强胃动力的多潘立酮(又称吗丁啉)结构中含有两个苯并咪唑杂环,再如人类发现的第一个抗生素——青霉素也含有杂环结构,还有常用于治疗肠道感染的氟哌酸结构中含有喹啉杂环结构,诸如此类含有杂环结构的药物数不胜数。 因此,杂环化合物在有机化合物中占有非常重要的地位,学好本章内容是我们步入药学学科领域的关键一步。 内酯、内酰胺和环醚等化合物都属于杂环化合物,但这些化合物的性质与其同类的开环化合物基本相同,因此,本章不再对其重点介绍,本章着重讨论芳香性杂环化合物,亦称其为芳(香)杂环化合物(aromatic heterocycles)。 第一节分类和命名 一、分类 杂环化合物有多种分类方法,按含杂原子数目分为含一个、两个或多个杂原子的杂环;按环的形式可分为单杂环和稠杂环;还可以按照环的大小分为五元杂环和六元杂环。 二、命名 杂环结构纷繁复杂,其命名亦如是。按照IUPAC(1979)(国际纯粹应用化学联合会)原则的规定,保留45个杂环化合物的俗名并以此作为命名的基础。我国则对这45个俗名进
第十八章 杂环化合物 一 写出下列化合物的构造式: 1.α-呋喃甲醇 2.α,β’-二甲基噻吩 3.溴化N,N-二甲基四氢吡咯 4.2-甲基-5乙烯基吡啶 5.2,5-二氢噻吩 二 命名下列化合物: 1. N 3 C 2H 5 2. S N CH 3 3.N H CH 2COOH 4. N CON(CH 3)2 5.N S C SH 三 将下列化合物按碱性强弱排列成序: 1.N 2.N NH 2 3.N CH 3 4. N CN 四 将下列化合物按碱性强弱排列成序: 1. N H 2. N 3. N F 4. O N H 5. N H 五、完成下列反应式,写出主要反应产物: 1. O COOEt COOEt 2. N 4 KOH H 3O 3. S CH 3O HNO 3 H SO 4 4. S COCH 3 3 H SO 4 5.S NO 2 2 6. 2N CH 2OH
7.N COOH COOH8.N CH3 1)PhCHO,OH 2)H2,Ni 9.N NaNH2 10.N KMnO4 NaOH H3O 11.N HNO3 24 12. NaOH O Cl2浓 EtOH 六 化合物 A. B. O C. N H D.S E.N 1.稳定性顺序是: 2。亲电取代反应活性顺序是:
第二十章杂环化合物答案 一.1.O CH2OH 2.S CH3 CH3 3. N CH3CH3 Br 4.N CH 3 5. S 二.1.N-甲基-α-乙基吡咯 2.5-甲基噻唑 3.β-吲哚乙酸 4.N,N-二甲基烟酰胺 5.2-巯基苯并噻唑 三.2>3>1>4 四.5>4>2>3>1 五.1. 2.N COOH 3. S O2N OCH3 4. S COCH3 O2N 5.S NO2 Br 6. N H Br CH2OH 7.N COOH 8. N H CH2CH2Ph9.N NH2 10.N COOH COOH 11. N NO2 , N NO2 12. O Cl CH2OH , O Cl COOH 六1.E>A>D>C>B 2.B>C>D>A>E
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 第16章杂环化合物 第 16 章杂环化合物辽宁中医药大学杏林学院讲稿 课程名称: 有机化学第十六章杂环化合物教学目的: 1. 掌握杂环化合物的分类和命名。 2.理解杂环化合物的结构与芳香性。 3. 掌握五元杂环化合物的化学性质。 教学重点: 杂环化合物命名;结构与芳香性;五元杂环化合物的化学性质 教学难点: 杂环化合物结构与芳香性;化学性质教学方法采用模型、 多媒体课件和板书相结合的课堂讲授方法。 引言杂环化合物是指组成环的原子中含有除碳以外的 原子(杂原子常见的是 N、O、S 等)的环状化合物。 非芳香杂环如杂环化合物 O,,NH, 芳杂环(符合休克尔规则 的杂环)如杂环化合物不包括极易开环的含杂原子的环状化合 物,例如: ,O,O ,本章我们只讨论芳香族杂环化合物。 杂环化合物是一大类有机物,占已知有机物的三分之一。 年月日x0404-08 辽宁中医药大学杏林学院讲稿课程名称: 1 / 14
有机化学环化合物在自然界分布很广、功用很多。 例如,中草药的有效成分生物碱大多是杂环化合物;动植物体内起重要生理作用的血红素、叶绿素、核酸的碱基都是含氮杂环;部分维生素,抗菌素;一些植物色素、植物染料、合成染料都含有杂环。 16.1 杂环化合物的分类杂环大体可分为: 单杂环和稠杂环两类。 稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。 16.2 杂环化合物的命名杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。 如杂环上有取代基时,取代基的位次从杂原子算起用 1,2,3,4,5 年月日x0404-08 辽宁中医药大学杏林学院讲稿课程名称:有机化学(或可将杂原子旁的碳原子依次编为 ,, , )来编号。 如杂环上不止一个杂原子时,则从 O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小: 五元杂环中含有两个杂原子的体系叫唑(azole)当环上有取代基时,取代基的位次从杂原子算起依次用 1,2,3, (或,,)编号。 如杂环上不止一个杂原子时,则从 O、S、N 顺序依次编号。 编号时杂原子的位次数字之和应最小。 16.3 五元杂环化合物一、呋喃、噻吩、吡咯含
第十八章杂环化合物 1.命名下列化合物: 答案:解:(1)4-甲基-2-乙基噻唑(2)2-呋喃-甲酸或糠酸(3)N-甲基吡咯(4)4-甲基咪唑 (5)α,β-吡啶二羧酸(6)3-乙基喹啉 (7)5-磺酸基异喹啉(8)β-吲哚乙酸 (9)腺嘌呤(10)6-羟基嘌呤 2.为什么呋喃能与顺丁烯二酸酐进行双烯合成反应,而噻吩及吡咯则不能?试解释之。. 答案: 解:五元杂环的芳香性比较是:苯>噻吩>吡咯>呋喃。 由于杂原子的电负性不同,呋喃分子中氧原子的电负性(3,
5)较大,π电子共扼减弱,而显现出共扼二烯的性质,易发生双烯合成反应,而噻吩和吡咯中由于硫和氮原子的电负性较小(分别为2.5和3),芳香性较强,是闭合共扼体系,难显现共扼二烯的性质,不能发生双烯合成反应。 3. 为什么呋喃、噻吩及吡咯容易进行亲电取代反应,试解释之。 答案: 解:呋喃、噻吩和吡咯的环状结构,是闭合共扼体系,同时在杂原子的P轨道上有一对电子参加共扼,属富电子芳环,使整个环的π电子密度比苯大,因此,它们比苯容易进行亲电取代反应。 4. 吡咯可发生一系列与苯酚相似的反应,例如可与重氮盐偶合,试写出反应式。 答案: 解: 5. 比较吡咯与吡啶两种杂环。从酸碱性、环对氧化剂的稳定性、取代反应及受酸聚合性等角度加以讨论。 答案: 解:吡咯与吡啶性质有所不同,与环上电荷密度差异有关。它们与苯的相对密度比较如下:
吡咯和吡啶的性质比较:
与环上电荷密度有关, 性有关。与环上电荷密度及稳定 6. 写出斯克劳普合成喹啉的反应。如要合成6-甲氧基喹啉,需用哪些原料? 答案: 解:Skramp法合成喹啉的反应: 7. 写出下列反应的主要产物:
16--杂环化合物 §1. 杂环化合物的分类和命名 一、杂环大体可分为:单杂环和稠杂环两类: 1. 分类: 稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。 二、命名: 杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为α ,β, γ, δ …)来编号。 如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小: 五元杂环中含有两个杂原子的体系叫唑(azole) §2. 呋喃,噻吩,吡咯 含有一个杂原子的五元杂环单环体系:呋喃,噻吩,吡咯。 一、呋喃,噻吩,吡咯的电子结构和光谱性质 电子结构:这三个杂环化合物中,碳原子和杂原子均以sp2杂化轨道互相连接成σ健,并且在一个平面上,每个碳原子及杂原子上均有一个p 轨道互相平行,在碳原子的p轨道中有一个p电子,在杂原子的p轨道中有两个p电子,形成一个环形的封闭的π电子的共轭体系。这与休克尔的4n+2规则相符,因此这些杂环或多或少的具有与苯类似的性质,故称之为芳香杂环化合物。
芳香性大小,试验结果表明: 光谱性质:IR: νc -H = 3077~3003cm -1,νN -H = 3500~3200 cm -1 (在非极性溶剂的稀溶液中,在3495 cm -1,有一尖峰。在浓溶液中则于3400 cm -1,有一尖峰。在浓和淡的中间浓度时,两种谱带都有),杂环C =C 伸缩振动:1600~1300 cm -1 (有二至四个谱带)。 NMR :这些杂环化合物形成封闭的芳香封闭体系,与苯环类似,在核磁共振谱上,由于外磁场的作用而诱导出一个绕环转的环电流,此环电流可产生一个和外界磁场方向相反的感应磁场,在环外的质子,处在感应磁场回来的磁力线上,和外界磁场方向一致,在去屏蔽区域,故环上氢吸收峰移向低场。化学位移一般在7ppm 左右。 呋喃:α-H δ=7.42ppm β-H δ=6.37ppm 噻吩:α-H δ=7.30ppm β-H δ=7.10ppm 吡咯:α-H δ=6.68ppm β-H δ=6.22ppm 二、呋喃,噻吩,吡咯的制备 1.玉米心,稻糠,花生壳,大麦壳,高粱秆等用稀硫酸处理得戊糖,戊糖失水得糠醛,再在400℃下加热,同时在催化剂ZnO,Cr 2O 3存在下,失 去一氧化碳而得呋喃。 2.工业上制备噻吩是用丁烷,丁烯或丁二烯与硫磺混合,在600℃反应得到: 3.噻吩也可用琥珀酸钠盐与五硫化二磷一起加热反应制得: 4.帕尔——克诺尔(C.Paal —L.Knorr )合成法: 1,4—二羰基化合物常在无水的酸性条件下,得到呋喃及其衍生物。
第十六章杂环化合物 教学要点: 掌握五元杂环化合物的结构、性质;了解吡啶和生物碱。 教学时数: 6 学时 教学方法:教师讲授、 教学手段:多媒体、自制模型 第一节杂环化合物的分类和命名 杂环大体可分为:单杂环和稠杂环两类。 1. 分类: 稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。 2.命名:杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为α ,β, γ, δ …)来编号。
如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小: 五元杂环中含有两个杂原子的体系叫唑(azole) 第二节五元杂环化合物 一.含有一个杂原子的五元杂环单环体系:呋喃,噻吩,吡咯。 (1)呋喃,噻分,吡咯的电子结构和光谱性质。 电子结构:这三个杂环化合物中,碳原子和杂原子均以sp2杂化轨道互相连接成σ健,并且在一个平面上,每个碳原子及杂原子上均有一个p轨道互相平行,在碳原子的p轨道中
有一个p电子,在杂原子的p轨道中有两个p电子,形成一个环形的封闭的π电子的共轭体系。这与休克尔的4n+2规则相符,因此这些杂环或多或少的具有与苯类似的性质,故称之为芳香杂环化合物。 芳香性大小,试验结果表明: 光谱性质:IR: νc-H = 3077~3003cm-1,νN-H = 3500~3200 cm-1(在非极性溶剂的稀溶液中,在3495 cm-1,有一尖峰。在浓溶液中则于3400 cm-1,有一尖峰。在浓和淡的中间浓度时,两种谱带都有),杂环C=C伸缩振动:1600~1300 cm-1(有二至四个谱带)。 NMR:这些杂环化合物形成封闭的芳香封闭体系,与苯环类似,在核磁共振谱上,由于外磁场的作用而诱导出一个绕环转的环电流,此环电流可产生一个和外界磁场方向相反的感应磁场,在环外的质子,处在感应磁场回来的磁力线上,和外界磁场方向一致,在去屏蔽区域,故环上氢吸收峰移向低场。化学位移一般在7ppm左右。 呋喃:α-H δ=7.42ppm β-H δ=6.37ppm 噻吩:α-H δ=7.30ppm β-H δ=7.10ppm 吡咯:α-H δ=6.68ppm β-H δ=6.22ppm 二.呋喃,噻吩,吡咯的制备。 1.玉米心,稻糠,花生壳,大麦壳,高粱秆等用稀硫酸处理得戊糖,戊糖失水得糠醛,
第十八章 杂环化合物 教学目的: 掌握杂环化合物的分类和命名及掌握五元单杂环、六元单杂环化合物的化学性质;理解杂环化合物的结构与芳香性,理解吡咯、吡啶的结构与性质的关系;了解嘧啶、喹啉、嘌呤及吲哚,了解几种重要生物碱(麻黄素、烟碱、阿托品、咖啡碱和茶碱)。 教学重点: 杂环化合物的结构与芳香性、亲电取代反应的活性及所用试剂的选择性。 教学难点: 杂环化合物的结构与芳香性、化学性质。 引言 杂环化合物是指组成环的原子中含有除碳以外的原子(杂原子——常见的是N 、O 、S 等)的环状化合物。 杂环化合物 非芳香杂环芳杂环(符合休克尔规则的杂环)如 如 O O NH N N H O , ………… ,, 杂环化合物不包括极易开环的含杂原子的环状化合物,例如: NH O , , , O O O O O O 本章我们只讨论芳香族杂环化合物。 在具有生物活性的天然化合物中,大多数是杂环化合物。例如,中草药的有效成分生物碱大多是杂环化合物;动植物体内起重要生理作用的血红素、叶绿素、核酸的碱基都是含氮杂环;一些维生素、抗菌素、植物色素、植物染料、合成染料都含有杂环。
一、杂环化合物的分类 1.分类 杂环从结构上大体分为:单杂环和稠杂环两类。 二、命名 杂环化合物的命名比较复杂,现在一般通用的有两种类型的命名方法。一种是按照化合物的西文名称音译,另一种是根据相应的碳环化合物名称类比命名。杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。 1. 单杂环的命名方法 ①写出杂环化合物的基本名称,如下: thiophene imidazole oxazole
第十一章杂环化合物和生物碱 杂环化合物和生物碱广泛存在于自然界中,在动植物体内起着重要的生理作用。本章介绍杂环化合物的分类、命名、结构特点、性质及重要的杂环化合物,生物碱的一般性质、提取方法和重要的生物碱。 第一节杂环化合物 环状有机化合物中,构成环的原子除碳原子外还含有其它原子,且这种环具有芳香结构,则这种环状化合物叫做杂环化合物。组成杂环的原子,除碳以外的都叫做杂原子。常见的杂原子有氧、硫、氮等。前面学习过的环醚、内酯、内酐和内酰胺等都含有杂原子,但它们容易开环,性质上又与开链化合物相似,所以不把它们放在杂环化合物中讨论。 杂环化合物种类繁多,在自然界中分布很广。具有生物活性的天然杂环化合物对生物体的生长、发育、遗传和衰亡过程都起着关键性的作用。例如:在动、植物体内起着重要生理作用的血红素、叶绿素、核酸的碱基、中草药的有效成分——生物碱等都是含氮杂环化合物。一部分维生素、抗菌素、植物色素、许多人工合成的药物及合成染料也含有杂环。 杂环化合物的应用范围极其广泛,涉及医药、农药、染料、生物膜材料、超导材料、分子器件、贮能材料等,尤其在生物界,杂环化合物几乎随处可见。
一、杂环化合物的分类和命名 为了研究方便,根据杂环母体中所含环的数目,将杂环化合物分为单杂环和稠杂环两大类。最常见的单杂环有五元环和六元环。稠杂环有芳环并杂环和杂环并杂环两种。另外,可根据单杂环中杂原子的数目不同分为含一个杂原子的单杂环、含两个杂原子的单杂环等。 杂环化合物的命名在我国有两种方法:一种是译音命名法;另一种是系统命名法。 译音法是根据IUPAC 推荐的通用名,按外文名称的译音来命名,并用带“口”旁的同音汉字来表示环状化合物。例如: 呋喃 咪唑 吡啶 嘌呤 furan imidazole pyridine purine 杂环上有取代基时,以杂环为母体,将环编号以注明取代基的位次,编号一般从杂原子开始。含有两个或两个以上相同杂原子的单杂环编号时,把连有氢原子的杂原子编为1,并使其余杂原子的位次尽可能小;如果环上有多个不同杂原子时,按氧、硫、氮的顺序编号。例如: O N N N N N N H N
第十八章杂环化合物 一、教学目的和要求 (1)掌握杂环化合物的分类和命名。 掌握呋喃、噻吩、吡咯、咪唑、噻唑、吲哚、吡啶、嘧啶、喹啉、嘌呤等母体结构及性质特征(芳香性、环稳定性、碱性) (2)掌握糠醛的制法、性质及用途。 (1)掌握Skraup合成法。 (4)了解生物碱的含义、存在、结构、提取方法及生理作用。 二、教学重点与难点 (1)杂环化合物的命名及性质。 (2)Skraup合成法。 三、教学方法和教学学时 1、教学方法:以课堂讲授为主,结合必要的课堂讨论。教学手段以板书和多媒体相结合。 2、教学学时:6学时 四、教学内容 第一节杂环化合物的分类和命名 第二节五元杂环化合物 一、呋喃、噻吩、吡咯的结构 二、呋喃、噻吩、吡咯的性质 三、α-呋喃甲醛 四、呋喃、噻吩、吡咯的制法 五、咪唑、噻唑 六、吲哚 七、卟啉环化合物叶绿素,血红素,维生素B12. 第三节六元杂环化合物 一、吡啶的结构、性质和制备方法 二、嘧啶 三、喹啉的结构和性质,Skraup合成法;异喹啉 四、嘌呤 第四节生物碱 第五节改变人行为的药物 一、兴奋剂 二、幻觉剂 三、抑制剂
五、课后作业、思考题 习题:1、7、8、9、10。 杂环化合物是指组成环的原子中含有除碳以外的原子(杂原子——常见的是N 、O 、S 等)的环状化合物。 杂环化合物不包括极易开环的含杂原子的环状化合物,例如: 本章我们只讨论芳香族杂环化合物。 杂环化合物是一大类有机物,占已知有机物的三分之一。杂环化合物在自然界分布很广、功用很多。例如,中草药的有效成分生物碱大多是杂环化合物;动植物体内起重要生理作用的血红素、叶绿素、核酸的碱基都是含氮杂环;部分维生素,抗菌素;一些植物色素、植物染料、合成染料都含有杂环。 §18~1 杂环化合物的分类和命名 一、分类 (略) 二、命名 杂环的命名常用音译法,是按外文名词音译成带“口”字旁的同音汉字。 NH O , , , O O O O O O 杂环化合物非芳香杂环芳杂环(符合休克尔规则的杂环)如 如 O O NH N N H O ,…… …… ,, N H O S N N N (pyrrole)(furan)(thiophene) (pyridine)(pyrimidine) N N N N H N N H (quinoline)(indole)(purine)吡咯 呋喃 噻吩 吡啶 嘧啶喹啉 吲哚 嘌呤
杂环化合物和生物碱课后习题参考答案 习题1,各化合物名称或结构式如下: 胞嘧啶;α-噻吩磺酸;β-吲哚乙酸;腺嘌啉;8-羟基喹啉;烟碱(N-甲基-α-吡啶四氢吡咯); O N H O Br Br N H COOH N N OH N H2 N N N H N H2 OH 习题2,碱性强弱: 六氢吡啶〉甲胺〉氨〉吡啶〉苯胺〉吡咯习题3, 苯苯酚噻吩三氯化铁 紫色 无紫色 苯酚 苯 噻吩 浓硫酸 溶解 不溶解 r.T.苯 噻吩 吡咯四氢吡咯 紫色 蓝色 紫色石蕊 吡咯 四氢吡咯 蓝色 苯甲醛 糠醛 浓盐酸 松木片 无色 糠醛 苯甲醛 习题4,各反应产物如下: (1)N Br N Br NO2 (2) O OH O O OH + (3) N H N 3 (4)N H SO3H (5) S Br S Br O2N 习题6, O O C H3CHO O H- O C H3 CHO Ag+ NH3 O C H3 COOH N CH3KM nO4 N O OH SOCl2 N O Cl AC l3 N O 习题7,喹啉硝化发生在苯环,因为吡啶环的氮原子用一个P-电子共轭,相当于硝基的钝化
吡啶环;吲哚硝化发生在吡咯环,因为氮原子用一对孤对电子共轭,相当于氨基活化吡咯环。 习题8,各杂环互变异构形式如下; N N H N N H NH N N N H NH 2 N N OH N H 2N N H O N H 2 N N OH O H N N H O O H N N OH O H C H 3N N H O O H 习题9,六氢吡啶典型仲胺,N-原子SP 3杂化;而吡啶虽然类似有3个C-C 键的叔胺。但是N-原子SP 2杂化,孤对电子S 成分多,更靠近原子核。且环中的C-C 单键都是SP 2杂化,共用电子对向N-原子偏移程度小,故碱性减弱。 习题10,依分子式知道有4个不饱和度,2个氧原子,可能是五元芳杂环。经氧化成酸后任然为4 个不饱和度,可能换外有醛基,脱羧后成呋喃环,故原物质为呋喃甲醛。
第十八章杂环化合物 1命名下列化合物: 解:(1) 4-甲基-2-乙基噻唑(2) 糠酸(α-呋喃甲酸) (3) N-甲基吡咯(4) 4-甲基咪唑(5) α,β-吡啶二甲酸(2,3-吡啶二甲酸)(6)β-乙基喹啉(3-乙基喹啉)(7) 5-异喹啉磺酸 (8)β-吲哚乙(3-吲哚乙酸)(9) 6-氨基嘌呤(10) 6-羟基嘌呤 2、为什么呋喃能与顺丁烯二酸酐进行双烯合成反应,而噻吩及吡咯则不能?试解释之。 解:在呋喃、吡啶和噻吩中,杂原子分别是O、N和S。电负性是O>N>>S ,提供电子对构成具有芳香性的芳环的能力与此电负性的关系相反。因此芳香性:呋喃>吡啶>噻吩。另一方面,反应出来的共轭二烯性:呋喃>吡啶>噻吩。因此,呋喃易与顺—丁烯二酸酐发生环加成反应而吡啶、噻吩则需反应性更强的双烯体,如苯炔、丁炔二酸脂等。 3、为什么呋喃、噻吩及吡咯容易进行亲电取代反应,试解释之。 解:在呋喃、噻吩和吡咯中,具有五原子环六个π电子芳香共轭体系,符合[4n+2]休克尔规则,都具有芳香性。因此芳香性大小是:呋喃>吡啶>噻吩。这些芳环又是富电子的芳香共轭体系,易发生亲电取代。
4、吡咯可发生一系列与苯酚相似的反应,例如可与重氮盐偶合,试写出反应式。 N H C6H5N2 X N N N C6H5 2—吡咯偶氮苯 5、比较吡咯与吡啶两种杂环。从酸碱性、环对氧化剂的稳定性、取代反应及受酸聚合性等角度加以讨论。 解: 吡咯和吡啶分子中的氮原子都是sp2杂化的。在吡啶中,有一对未共用电子对处在未参与共轭的sp2杂化轨道上,因此吡啶的碱性很强;另外吡啶氮上的未共用电子对能与水分子形成氢键,吡啶易溶于水,吡咯不具备与水形成氢键的结构特征,因此难溶于水。在吡咯中,氮原子提供一对未参与杂化的p轨道上电子参与芳香体系的形成,因此其碱性很弱;氮原子上的氢电离后形成的负离子未破坏其芳香性,因此,吡啶的性质类似于硝基苯;为一缺电子芳香性分子,对氧化剂较不稳定,亲电取代反应活性也较高。吡啶和强酸作用可生成盐,不破坏其芳香性;吡咯和酸作用时,氮原子提供一对p轨道上的电子和酸结合,破坏了其芳香性,生成聚合产物。 6、写出斯克劳普合成喹啉的反应。如要合成6-甲氧基喹啉,需用哪些原料?解: HC OH CH2OH CH2OH 24CH CH2 NO 2CHO N H CH2 CH2 CHO N H 2 CH2 CHOH 烯醇化
第十六章 杂环化合物 一 写出下列化合物的构造式: 1. α-呋喃甲醇 2. α,β-二甲基噻吩 3. 溴化N,N-二甲基四氢吡咯 4. 2-甲基-5-乙烯基吡啶 5. 2,5-二氢噻吩 6. 4-甲基-2-乙基噻唑 二 命名下列化合物: 1.N 3 C 2H 5 2. S N CH 3 3.N H CH 2COOH 4. N CON(CH 3)2 5. N S C 2H 5H 3C 6. N COOH COOH 7. N H CH 2COOH 8. N C 2H 5 三 将下列化合物按碱性强弱排列成序: 1. 1. N 2. N NH 2 3. N CH 3 4. N CN 2. 1. N H 2. N 3. N F 4. O N H 5. N H 四、完成下列反应式,写出主要反应产物: 1. O COOEt COOEt 2. N KMnO 4 KOH H 3O 3. S CH 3O 3 H SO 4 4. S COCH 3 3 H SO 4
5.S NO 2 2 6. 2N CH 2OH 7. N CH 31)PhCHO,OH 2)H 2,Ni 8. N NaNH 2 9. N KMnO 4 NaOH H 3O 10. NaOH O Cl 2 浓 EtOH 五、 化合物 A. B. O C. N H D. S E. N 1.稳定性顺序是: 2.亲电取代反应活性顺序是: 六、 用化学方法分离化合物 OH N 七、 组胺是广泛存在于动植物体内的一种生物胺,作为身体内的一种化学传导物质,可以影响许多细胞的反应,包括过敏,炎性反应,胃酸分泌等,也可以影响脑部神经传导,会造成想睡觉等效果。化合物结构中含有三种氮,试按照它们的碱性排序,并给予说明。 N N H NH 2 a b c