
实验三乙醇气相脱水制乙烯反应动力学(简易无梯度内循环)
反应动力学描述了化学反应速度与各种因素如浓度、温度、压力、催化剂等之间的定量关系。动力学在反应过程开发和反应器设计过程中起着重要的作用。它也是反映工程学科的重要组成部分。
其中,分子筛催化剂的突出优点是乙烯收率高,反应温度较低。故选用分子筛作为本实验的催化剂。
一.实验目的
1.巩固所学有关反应动力学方面的知识。
2.掌握获得反应动力学数据的手段和方法。
3.熟悉内循环式无剃度反应器的特点及其它有关设备的使用方法,提高实验技能。二.实验原理
乙醇脱水属于平行反应,既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。一般而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。因此,对于乙醇脱水这样一个复合反应,随着反应条件的变化,脱水过程的机理也会有所不同。借鉴前人在这方面所做的工作,将乙醇在分子筛催化剂作用下的脱水过程描述成:
2C2H5OH→C2H5OC2H5+H2O
C2H5OH→C2H4+H2O
三.装置、流程及试剂
1.装置
本实验装置由三部分构成。
第一部分是由微量进料泵、氢气钢瓶、汽化器和取样六通阀组成的进料系统。
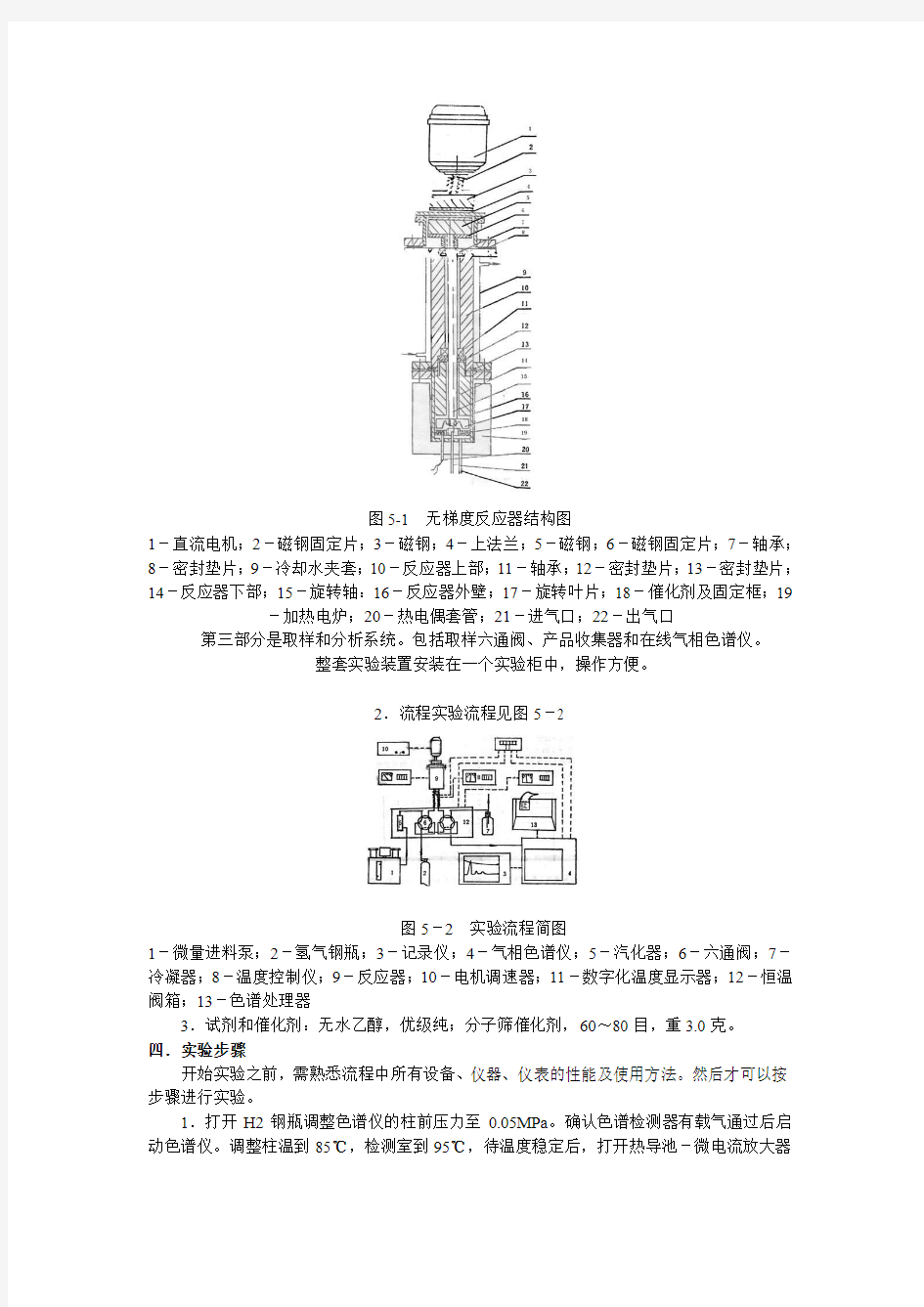
第二部分是反应系统,它是由一台内循环式无剃度反应器、温度控制器和显示仪表组成。反应器的结构如图5-1所示。
图5-1无梯度反应器结构图
1-直流电机;2-磁钢固定片;3-磁钢;4-上法兰;5-磁钢;6-磁钢固定片;7-轴承;8-密封垫片;9-冷却水夹套;10-反应器上部;11-轴承;12-密封垫片;13-密封垫片;14-反应器下部;15-旋转轴:16-反应器外壁;17-旋转叶片;18-催化剂及固定框;19-加热电炉;20-热电偶套管;21-进气口;22-出气口
第三部分是取样和分析系统。包括取样六通阀、产品收集器和在线气相色谱仪。
整套实验装置安装在一个实验柜中,操作方便。
2.流程实验流程见图5-2
图5-2实验流程简图
1-微量进料泵;2-氢气钢瓶;3-记录仪;4-气相色谱仪;5-汽化器;6-六通阀;7-冷凝器;8-温度控制仪;9-反应器;10-电机调速器;11-数字化温度显示器;12-恒温阀箱;13-色谱处理器
3.试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,60~80目,重3.0克。
四.实验步骤
开始实验之前,需熟悉流程中所有设备、仪器、仪表的性能及使用方法。然后才可以按步骤进行实验。
1.打开H2钢瓶调整色谱仪的柱前压力至0.05MPa。确认色谱检测器有载气通过后启
动色谱仪。调整柱温到85℃,检测室到95℃,待温度稳定后,打开热导池-微电流放大器
的开关,并调整桥电流至150Ma.
2.在色谱仪升温同时,打开阀恒温箱加热器开关,使之升温到110℃。管路也保温在110℃。
3.打开反应器温度控制器的电源开关使反应器加热升温,同时向反应器的冷水夹套中通入冷却水。
4.打开微量进料泵,以小流量向汽化器内通入原料乙醇。
5.待所有条件稳定后,用阀箱内的旋转六通阀取样分析反应产物的组成,并记录色谱处理器打印出的峰面积值。
6.在206~380℃之间选择三到四个温度,在各温度下改变三次乙醇的进料速度,测定出在不同条件下的数据。
五.数据处理
实验过程中,应将有用的数据及时、准确地记录下来。记录表格可参见表2.
1.产物组成的计算
2.产物中各组分的摩尔分率可以按下式求出:
xi=Ai·fi/()(1)
式中,xi—尾气中组分i的摩尔分率;
Ai—组分i的色谱峰峰面积值;
f i---组分i在热传导池检测器上的校正因子,具体的数值可参见表1;
n----尾气中所含的组分书。
表1热导池检测器上的fi(载气H2)
根据实验结果求出乙醇的转化率、乙烯的收率及乙烯的生成速率。然后按一级反应求出生成乙烯这一反应步骤的速率常数和活化能。写清计算过程,并将计算结果填入表2中。
计算说明:
乙醇的转化率=反应掉的乙醇摩尔数/原料中乙醇的摩尔数
乙醇的收率=生成乙烯的摩尔数/原料中乙醇的摩尔数
乙醇的进料速度=乙醇液的体积流量×0.7893(乙醇的密度)/46.07(乙醇的分子量)乙烯的生成速度=(乙醇进料速度×乙烯的收率)/[催化剂用量(g)](mol/g.h)
反应器内乙醇的浓度:
C A=P A/RT(mol/l)(2)
式中PA为乙醇的分压;反应的总压为0.1Mpa。所以可将反应器内的混合气视为理想气体。生成乙烯的反应步骤的速率常数k可以通过下式求出,
k =r/cA(3)由阿累尼乌斯方程k=k0exp(-E/RT),将lnk对1/T作图,即可求出k0和E。在低温有乙醚生成的情况下,参照上述计算过程,求出乙醇的消费速率常数常数和相应的活化能。在此,同样可以按一级反应处理。
六.思考题
1.用无梯度反应器测定化学反应动力学的优、缺点是什么?
2.要想证明测定的是本征动力学数据,还需要补充哪些实验内容?
3.分别画出温度和乙醇进料速度与乙醇收率的关系曲线,并对这两类曲线所反映出的规律作出解释。
表2数据处理结果
篇一:分馏实验报告广东工业大学 学院专业班组、学号姓名协作者教师评定 实验题目分馏 一、实验目的 了解分馏的原理与意义,分馏柱的种类和选用方法。学习实验室里常用分馏的操作方法。二、分馏原理 利用普通蒸馏法分离液态有机化合物时,要求其组分的沸点至少相差30℃,且只有当组分间的沸点相差110℃以上时,才能用蒸馏法充分分离。所谓分馏(fractional distillation)就是蒸馏液体混合物,使气体在分馏柱内反复进行汽化、冷凝、回流等过程,使沸点相近的混合物进行分离的方法。即:沸腾着的混合物蒸汽进行一系列的热交换而将沸点不同的物质分离出来。实际上分馏就相当于多次蒸馏。当分馏效果好时,分馏出来的(馏液)是纯净的低沸点化合物,留在烧瓶的(残液)是高沸点化合物。 影响分馏效率的因素有:①理论塔板;②回流比;③柱的保温。 实验室常用的分馏柱为vigreux柱(或刺式分馏柱、维氏分馏柱、韦氏分馏柱、维格尔分馏柱)。使用该分馏柱的优点是:仪器装配简单,操作方便,残留在分馏柱中的液体少。三、实验仪器与药品 电热套、圆底烧瓶、分馏柱、温度计、冷凝管、接液管、丙酮。能与水、甲醇、乙醇、乙醚、氯仿、吡啶等混溶。能溶解油脂肪、树脂和橡胶。五、实验装置六、实验步骤(一)填表及作图 1、在圆底烧瓶内放置40ml混合液(体积比:丙酮∶水=1∶1)及2粒沸石,按简单分馏装置图2-11安装仪器。 2、开始缓缓加热,并控制加热程度,使馏出液以1-2s/d的速度蒸出。将初馏出液收集于量筒中,观察并记录柱顶温度及接受器a的馏出液总体积。继续蒸馏,(从5ml开始)记录每增加1ml馏出液时的温度及总体积。注意温度突变时位置。曲线,讨论分馏效率。数据记录:(二)纯化丙酮 (1)待圆底烧瓶冷却后,加入馏液,补加2粒沸石。安装好分馏装置。(2)收集56~62℃以下的馏液。此馏液为纯丙酮。 馏液总体积ml,回收率=馏液总体积/40= %。(3)观察62~98℃的馏液共滴。 产品:丙酮,无色易挥发和易燃液体,有微香气味。讨论:(很重要,请填写!) 七、思考题篇二:蒸馏与分馏实验预习报告 蒸馏与分馏 目的:1. 掌握普通蒸馏、分馏的原理和操作方法,了解其意义。 2. 学习安装仪器的基本方法。 3. 学会用常量法测定液态物质的沸点。 原理:蒸馏liquid分馏liquid 1、蒸馏 沸点: a bgas gasliquid (纯) liquid (a) 每种纯液态有机物在一定的压力下具有固定的沸点,当液态有机物受热时,蒸气压增大,待蒸气压达到大气压或所给定的压力时,即p 蒸=p 外,液体沸腾,这时的温度称为液体的沸点。(饱和蒸汽压:当液体汽化的速率与其产生的气体液化的液体速率相同时的气压。) (沸点与压强的关系:沸点和当水汽压力与环境压力相等时的温度有关,也就是说,沸点和气压是有关的。通常情况下我们所说的沸点都是在标准大气压下测量得到的(即101325帕斯卡,或1atm)。在海拔较高的地区,由于气压较低,沸点也相对低得多。当气压上升,物体的沸
乙醇气相脱水制乙烯动 力学实验精选文档 TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-
一、实验目的 1、巩固所学的有关动力学方面的知识; 2、掌握获得的反应动力学数据的方法和手段; 3、学会动力学数据的处理方法,根据动力学方程求出相应的参数值; 4、熟悉内循环式无梯度反应器的特点以及其他有关设备的特点以及其它有关设备的使用方法,提高自己的实验技能。 二、实验原理 乙醇脱水属于平等反应。既可以进行分子内脱水成乙烯,又可以分子间脱水生成乙醚。一般而言,较高的温度有利于生成乙烯,而较低的温度则有利于生成乙醚。 三、实验装置及流程 1.实验装置 图7-1 反应器装置图 装置由三部分组成: 第一部分是有微量进料泵,氢气钢瓶,汽化器和取样六通阀组成的系统; 第二部分是反应系统,它是由一台内循环式无梯度反应器,温度控制器和显示仪表组成;
第三部分是取样和分析系统,包括六通阀,产品收集器和在线气相色谱信。 2.实验流程如下图所示: 内循环无梯度反应色谱实验装置流程示意图 K3-进气旁路调节阀;K2-阀箱产物流量调节;K3-气液分离后尾气调节;J-进液排放三通阀;1-气体钢瓶;2-稳压阀;3-转子流量计;4-过滤器;5-质量流量计;6-缓冲器;7-压力传感器;8-预热器;9-预热炉;10-反应器;11-反应炉;12-马达;13-恒温箱;14-气液分离器;15-调压阀;16-皂膜流量计;17-加料泵 12 图7-2 内循环无梯度反应色谱实验装置流程示意图 3.试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,60~80目,重0.4克。 四、实验步骤 1、打开H 2钢瓶使柱前压达到0.5kg/cm 2确认色谱检测中截气通过后启动色谱,柱 温110℃,汽化室130℃,检测室温达到120℃,待温度稳定后,打开导热池——微电流放大器开关,桥电流至100mA ; 2、在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温 至160℃; 3、打开反应器温度控制开关,升温,同时向反应器冷却水夹套通冷却水。
一、实验目的 1、巩固所学的有关动力学方面的知识; 2、掌握获得的反应动力学数据的方法和手段; 3、学会动力学数据的处理方法,根据动力学方程求出相应的参数值; 4、熟悉内循环式无梯度反应器的特点以及其他有关设备的特点以及其它有关设备的使用方法,提高自己的实验技能。 二、实验原理 乙醇脱水属于平等反应。既可以进行分子内脱水成乙烯,又可以分子间脱水生成乙醚。一般而言,较高的温度有利于生成乙烯,而较低的温度则有利于生成乙醚。 三、实验装置及流程 1.实验装置 图7-1 反应器装置图 装置由三部分组成: 第一部分是有微量进料泵,氢气钢瓶,汽化器和取样六通阀组成的系统; 第二部分是反应系统,它是由一台内循环式无梯度反应器,温度控制器和显示仪表组成; 第三部分是取样和分析系统,包括六通阀,产品收集器和在线气相色谱信。 2.实验流程如下图所示:
内循环无梯度反应色谱实验装置流程示意图K3-进气旁路调节阀;K2-阀箱产物流量调节;K3-气液分离后尾气调节;J-进液排放三通阀; 1-气体钢瓶;2-稳压阀;3-转子流量计;4-过滤器;5-质量流量计;6-缓冲器; 7-压力传感器;8-预热器;9-预热炉;10-反应器;11-反应炉;12-马达; 13-恒温箱;14-气液分离器;15-调压阀;16-皂膜流量计;17-加料泵12 图7-2 内循环无梯度反应色谱实验装置流程示意图 3.试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,60~80目,重克。 四、实验步骤 1、打开H 2钢瓶使柱前压达到0.5kg/cm 2确认色谱检测中截气通过后启动色谱,柱温 110℃,汽化室130℃,检测室温达到120℃,待温度稳定后,打开导热池——微 电流放大器开关,桥电流至100mA ; 2、在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温 至160℃; 3、打开反应器温度控制开关,升温,同时向反应器冷却水夹套通冷却水。 4、打开微量泵,以小流量向气化器内通原料乙醇; 5、用阀箱内旋转六通阀取样分析尾气组成,记录色谱处理的浓度值; 6、在200~380℃之间选择四个温度,改变三次进料速度,测定各种条件下的数据。 五、数据处理
广东工业大学 学院专业班组、学号姓名协作者教师评定 实验题目分馏 一、实验目的 了解分馏的原理与意义,分馏柱的种类和选用方法。学习实验室里常用分馏的操作方法。 二、分馏原理 利用普通蒸馏法分离液态有机化合物时,要求其组分的沸点至少相差30℃,且只有当组 分间的沸点相差110℃以上时,才能用蒸馏法充分分离。所谓分馏(fractional distillation) 就是蒸馏液体混合物,使气体在分馏柱内反复进行汽化、冷凝、回流等过程,使沸点相近的 混合物进行分离的方法。即:沸腾着的混合物蒸汽进行一系列的热交换而将沸点不同的物质 分离出来。实际上分馏就相当于多次蒸馏。当分馏效果好时,分馏出来的(馏液)是纯净的 低沸点化合物,留在烧瓶的(残液)是高沸点化合物。 影响分馏效率的因素有:①理论塔板;②回流比;③柱的保温。 实验室常用的分馏柱为vigreux柱(或刺式分馏柱、维氏分馏柱、韦氏分馏柱、维格尔 分馏柱)。使用该分馏柱的优点是:仪器装配简单,操作方便,残留在分馏柱中的液体少。三、 实验仪器与药品 电热套、圆底烧瓶、分馏柱、温度计、冷凝管、接液管、丙酮。 能与水、甲醇、乙醇、乙醚、氯仿、吡啶等混溶。能溶解油脂肪、树脂和橡胶。五、实 验装置 六、实验步骤(一)填表及作图 1、在圆底烧瓶内放置40ml混合液(体积比:丙酮∶水=1∶1)及2粒沸石,按简单分馏 装置图2-11安装仪器。 2、开始缓缓加热,并控制加热程度,使馏出液以1-2s/d的速度蒸出。将初馏出液收集 于量筒中,观察并记录柱顶温度及接受器a的馏出液总体积。继续蒸馏,(从5ml开始)记录 每增加1ml馏出液时的温度及总体积。注意温度突变时位置。 曲线,讨论分馏效率。数据记录: (二)纯化丙酮 (1)待圆底烧瓶冷却后,加入馏液,补加2粒沸石。安装好分馏装置。(2)收集56~ 62℃以下的馏液。此馏液为纯丙酮。 馏液总体积 ml,回收率=馏液总体积/40= %。(3)观察62~98℃的馏液 共滴。 产品:丙酮,无色易挥发和易燃液体,有微香气味。讨论:(很重要,请填写!) 七、思考题篇二:蒸馏与分馏实验预习报告 蒸馏与分馏 目的:1. 掌握普通蒸馏、分馏的原理和操作方法,了解其意义。 2. 学习安装仪器的基本方法。 3. 学会用常量法测定液态物质的沸点。 原理:蒸馏liquid 分馏liquid 1、蒸馏 沸点: a bgas gasliquid (纯) liquid (a) 每种纯液态有机物在一定的压力下具有固定的沸点,当液态有机物受热时,蒸气压增大, 待蒸气压达到大气压或所给定的压力时,即p 蒸=p 外,液体沸腾,这时的温度称为液体的
序号:40 化工专业实验报告 实验名称:乙醇气相脱水制乙烯动力学实验学院:化学工程学院 专业:化学工程与工艺 班级:化工095班 姓名:何小龙 学号:09402010541 指导教师:杨春风 日期:2012年3月22日
一.实验目的 1. 巩固所学有关反应动力学方面的知识; 2. 掌握获得反应动力学数据的手段和方法; 3. 学会动力学数据的处理方法,根据动力学方程求出相应的参数值; 4. 熟悉内循环式无剃度反应器的特点及其它有关设备的使用方法,提高实验技能。 二.实验原理及原理图 乙醇脱水属于平行反应,既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。一般而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。乙醇在分子筛催化剂作用下的脱水过程可描述成: 2C2H5OH→C2H5OC2H5+H2O C2H5OH→C2H4+H2O 三.实验装置、流程及试剂 1. 装置 本实验装置由三部分构成: 第一部分是由微量进料泵、氢气钢瓶、汽化器和取样六通阀组成的进料系统。 第二部分是反应系统,它是由一台内循环式无剃度反应器、温度控制器和显示仪表组成。反应器的结构如图1所示。 1-直流电机;2-磁钢固定片;3-磁钢; 4-上法兰;5-磁钢;6-磁钢固定片;7-轴承; 8-密封垫片;9-冷却水夹套;10-反应器上部; 11-轴承;12-密封垫片;13-密封垫片; 14-反应器下部;15-旋转轴;16-反应器外壁; 17-旋转叶片;18-催化剂及固定框;19-加热 电炉;20-热电偶套管;21-进气口;22-出气口 图1无梯度反应器结构图 第三部分是取样和分析系统。包括取样六通阀、产品收集器和在线气相色谱仪。 整套实验装置安装在一个实验柜中,操作方便。
分馏实验报告_分馏实验报告实验步骤 篇一:分馏实验报告广东工业大学 学院专业班组、学号姓名协作者教师评定 实验题目分馏 一、实验目的 了解分馏的原理与意义,分馏柱的种类和选用方法。学习实验室里常用分馏的操作方法。二、分馏原理 利用普通蒸馏法分离液态有机化合物时,要求其组分的沸点至少相差30℃,且只有当组分间的沸点相差110℃以上时,才能用蒸馏法充分分离。所谓分馏(fractional distillation)就是蒸馏液体混合物,使气体在分馏柱内反复进行汽化、冷凝、回流等过程,使沸点相近的混合物进行分离的方法。即:沸腾着的混合物蒸汽进行一系列的热交换而将沸点不同的物质分离出来。实际上分馏就相当于多次蒸馏。当分馏效果好时,分馏出来的(馏液)是纯净的低沸点化合物,留在烧瓶的(残液)是高沸点化合物。 影响分馏效率的因素有:①理论塔板;②回流比;③柱的保温。 实验室常用的分馏柱为vigreux柱(或刺式分馏柱、维氏分馏柱、韦氏分馏柱、维格尔分馏柱)。使用该分馏柱的优点是:仪器装配简单,操作方便,残留在分馏柱中的液体少。三、实验仪器与药品 电热套、圆底烧瓶、分馏柱、温度计、冷凝管、接液管、丙酮。能与水、甲醇、乙醇、乙醚、氯仿、吡啶等混溶。能溶解油脂肪、树脂和橡胶。五、实验装置六、实验步骤(一)填表及作图 1、在圆底烧瓶内放置40ml混合液(体积比:丙酮∶水=1∶1)及2粒沸石,按简单分馏装置图2-11安装仪器。 2、开始缓缓加热,并控制加热程度,使馏出液以1-2s/d的速度蒸出。将初馏出液收集于量筒中,观察并记录柱顶温度及接受器a的馏出液总体积。继续蒸馏,(从5ml开始)记录每增加1ml馏出液时的温度及总体积。注意温度突变时位置。曲线,讨论分馏效率。数据记录: (二)纯化丙酮 (1)待圆底烧瓶冷却后,加入馏液,补加2粒沸石。安装好分馏装置。(2)收集56~62℃以下的馏液。此馏液为纯丙酮。 馏液总体积ml,回收率=馏液总体积/40= %。(3)观察62~98℃的馏液共滴。产品:丙酮,无色易挥发和易燃液体,有微香气味。讨论:(很重要,请填写!) 七、思考题篇二:蒸馏与分馏实验预习报告 蒸馏与分馏 目的:1. 掌握普通蒸馏、分馏的原理和操作方法,了解其意义。 2. 学习安装仪器的基本方法。 3. 学会用常量法测定液态物质的沸点。 原理:蒸馏liquid分馏liquid 1、蒸馏 沸点: a bgas gasliquid (纯) liquid (a) 每种纯液态有机物在一定的压力下具有固定的沸点,当液态有机物受热时,蒸气压增大,待蒸气压达到大气压或所给定的压力时,即p 蒸=p 外,液体沸腾,这时的温度称为液体的沸点。(饱和蒸汽压:当液体汽化的速率与其产生的气体液化的液体速率相同时的气压。)
验三简易内循环无梯度反应(乙醇气相脱水制乙烯宏观反应速率的测定) 验目的 .巩固所学有关反应动力学方面的知识。 .掌握测取宏观反应动力学数据的手段和方法。 .学会实验数据的处理方法,并能根据动力学方程求出相关的动力学参数值。 .了解内循环式无梯度反应器的特点及其使用方法。 验原理 反学动力学描述了化学反应速率与各种因素如浓度、温度、压力、催化剂等之间的定量关系。动力学在反应过程开发和反应器设计过要的作用。它也是反应工程学科的重要组成部分。 气固相催化反应是一个多步骤的反应,它包括以下七个步骤: .反应物分子由气流主体向催化剂的外表面扩散(外扩散); .反应物分子由催化剂外表面向催化剂微孔内表面扩散(内扩散); .反应物分子在催化剂微孔内表面上被吸附(表面吸附); .吸附的反应物分子在催化剂的表面上发生化学反应,转化成产物分子(表面反应); .产物分子从催化剂的内表面上脱附下来(表面脱附); .脱附下来的产物分子从微孔内表面向催化剂外表面扩散(内扩散); .产物分子从催化剂的外表面向气流主体扩散。 这七个步骤可分为物理过程和化学过程。其中步骤1、2、6、7为物理扩散过程,步骤3、4、5为化学过程。在化学过程中,步骤3、为化学吸附和化学脱附过程,步骤4为表面化学反应过程。整个反应的总速率取决于这7个步骤中阻力最大的一步,该步骤称为反步骤。如果步骤1或7为控制步骤,称反应为外扩散控制反应;如果步骤2或6为控制步骤,称反应为内扩散控制反应;如果步骤任何一步为控制步骤,称反应过程为反应控制或动力学控制。在考虑以上所有步骤的影响的反应速率为为宏观反应速率,在消除了括热量传递和质量传递)的影响的理想情况下,测得的化学反应的反应速率为相应反应的本征反应速率。 在实际反应过程中,由于固体催化剂一般都具有很大的内表面,反应物质通过扩散达到催化剂内部的不同深度进行反应,因而导致常梯度和温度梯度,而这个浓度梯度和温度梯度对催化反应影响一般很大,因此需要了解催化剂颗粒内表面的浓度和温度梯度,即内
化工专业实验报告 实验名称:乙醇气相脱水制乙烯动力学实验 学院:化学工程学院 专业:化学工程与工艺 班级:化工班 姓名:学号 同组者姓名: 指导教师: 日期:
一、实验目的 1、巩固所学的有关动力学方面的知识; 2、掌握获得的反应动力学数据的方法和手段; 3、学会动力学数据的处理方法,根据动力学方程求出相应的参数值; 4、熟悉内循环式无梯度反应器的特点以及其它有关设备的使用方法,提高自己的实验技能。 二、实验原理 乙醇脱水属于平等反应。既可以进行分子内脱水成乙烯,又可以分子间脱水 生成乙醚。一般而言,较高的温度有利于生成乙烯,而较低的温度则有利于生成乙醚。 较低温度:O H H OC H C OH H C 25252522+→ 较高温度:O H H C OH H C 24252+→ 三、实验装置、流程及试剂 1.装置 本实验装置由三部分构成。 第一部分是有微量进料泵、氢气钢瓶、汽化器和取样六通阀组成的系统。 第二部分是反应系统。它是由一台内循环式无梯度反应器,温度控制器和显示仪表组成。 第三部分是取样和分析系统。包括取样六通阀,产品收集器和在线气相色谱信。 2.实验流程
内循环无梯度反应色谱实验装置流程示意图K3-进气旁路调节阀;K2-阀箱产物流量调节;K3-气液分离后尾气调节;J-进液排放三通阀;1-气体钢瓶;2-稳压阀;3-转子流量计;4-过滤器;5-质量流量计;6-缓冲器;7-压力传感器;8-预热器;9-预热炉;10-反应器;11-反应炉;12-马达;13-恒温箱;14-气液分离器;15-调压阀;16-皂膜流量计;17-加料泵 12 内循环无梯度反应色谱实验装置流程示意图 3.试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,60~80目,重0.4g 。 四、实验步骤 1、打开H 2钢瓶使柱前压达到0.5kg/cm 2确认色谱检测中截气通过后启动色谱,柱温110℃,汽化室130℃,检测室温达到120℃,待温度稳定后,打开热导池——微电流放大器开关,桥电流至100mA ; 2、在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温至180℃; 3、打开反应器温度控制开关,升温,同时向反应器冷却水夹套通冷却水; 4、打开微量泵,以小流量向气化器内通原料乙醇; 5、在200~380℃之间选择三个温度,测定每5分钟内反应后乙醇和水的质量并记录,每个温度测定2~3次。 五、数据处理 乙醇进料速度:0.3ml/min 乙醇每5min 内进料质量:1.5×0.79=1.185g
工业酒精的蒸馏实验报告范文篇一:工业酒精的蒸馏实验报告范文 实验名称:蒸馏工业酒精 一、实验目的 1学习和认识有机化学实验知识,掌握实验的规则和注意事项。2学习和认知蒸馏的基本仪器和使用方法以及用途。3掌握,熟悉蒸馏的操作。 二、实验原理 纯液态物质在一定压力下具有一定沸点,一般不同的物质具有不同的沸点。蒸馏就是利用不同物质沸点的差异,对液态混合物进行分离和提纯的方法。当液态混合物受热时,低沸点物质易挥发,首先被蒸出,而高沸点物质因不易挥发而留在蒸馏瓶中,从而使混合物分离。若要有较好的分离效果,组分的沸点差在30℃以上。 三、仪器与试剂 试剂:未知纯度的工业酒精,沸石。 仪器:500ml圆底烧瓶,蒸馏头,温度计,回流冷凝管,接引管,锥形瓶,橡皮管,电热套,量筒,气流烘干机,温度计套管,铁架台,循环水真空汞。 四、仪器装置 五、实验步骤及现象 1将所有装置洗净按图装接(玻璃内壁没有杂质,且清澈透明)。2取出圆底烧瓶,量取30ml的工业酒精,再加入1‐2颗沸石。3
先将冷凝管注满水后打开电热套的开关。 4记录第一滴流出液时和最后一滴时的温度,期间控制温度在90℃以下。 5当不再有液滴流出时,关闭电热套。待冷却后,拆下装置,测量锥形瓶中的液体体积,计算产率。 六、注意事项 1温度计的位置是红色感应部分应与具支口的下端持平。当温度计的温度急速升高时,应该减小加热强度,不然会超过限定温度。2酒精的沸点为78℃,实验中蒸馏温度在80-83℃。 七、问题与讨论 1在蒸馏装置中,把温度计水银球插至靠近页面,测得的温度是偏高还是偏低,为什么? 答:偏高。页面上不仅有酒精蒸汽,还有水蒸气,而水蒸气的温度有 100℃,所以混合气体的温度会高于酒精的温度。 2沸石为什么能防止暴沸,如果加热一段时间后发现为加入沸石怎么办? 答:沸石是多空物质,他可以液体内部气体导入液体表面,形成气化中心,使液体保持平稳沸腾。若忘加沸石,应先停止加热,待液体稍冷后在加入沸石。 4当加热后有流出液体来,发现为通入冷凝水,应该怎样处理?答:这时应停止加热,使冷凝管冷却一下,在通水,再次加热继续蒸
分馏实验报告分馏实验报告实验步骤 篇一:分馏实验报告广东工业大学 学院专业班组、学号姓名协作者评定 实验题目分馏 一、实验目的 了解分馏的原理与意义,分馏柱的种类和选用方法。学习实验室里常用分馏的操作方法。二、分馏原理 利用普通蒸馏法分离液态有机化合物时,要求其组分的沸点至少相差30℃,且只有当组分间的沸点相差110℃以上时,才能用蒸馏法充分分离。所谓分馏(fractional distillation)就是蒸馏液体混合物,使气体在分馏柱内反复进行汽化、冷凝、回流等过程,使沸点相近的混合物进行分离的方法。即:沸腾着的混合物蒸汽进行一系列的热交换而将沸点不同的物质分离出来。实际上分馏就相当于多次蒸馏。当分馏效果好时,分馏出来的(馏液)是纯净的低沸点化合物,留在烧瓶的(残液)是高沸点化合物。 影响分馏效率的因素有:①理论塔板;②回流比;③柱的保温。
实验室常用的分馏柱为vigreux柱(或刺式分馏柱、维氏分馏柱、韦氏分馏柱、维格尔分馏柱)。使用该分馏柱的优点是:仪器装配简单,操作方便,残留在分馏柱中的液体少。三、实验仪器与药品 电热套、圆底烧瓶、分馏柱、温度计、冷凝管、接液管、丙酮。能与水、甲醇、乙醇、乙醚、氯仿、吡啶等混溶。能溶解油脂肪、树脂和橡胶。五、实验装置六、实验步骤(一)填表及作图 1、在圆底烧瓶内放置40ml混合液(体积比:丙酮∶水=1∶1)及2粒沸石,按简单分馏装置图2-11安装仪器。 2、开始缓缓加热,并控制加热程度,使馏出液以1-2s/d的速度蒸出。将初馏出液收集于量筒中,观察并记录柱顶温度及接受器a 的馏出液总体积。继续蒸馏,(从5ml开始)记录每增加1ml馏出液时的温度及总体积。注意温度突变时位置。曲线,讨论分馏效率。数据记录: (二)纯化丙酮 (1)待圆底烧瓶冷却后,加入馏液,补加2粒沸石。安装好分馏装置。(2)收集56~62℃以下的馏液。此馏液为纯丙酮。
实验 乙醇气相脱水制乙烯 反应动力学描述了化学反应速度与各种因素(如浓度、温度、压力、催化剂等)之间的定量关系。动力学在反应过程开发和反应器设计过程中起着重要的作用。它也是反应工程学科的重要组成部分。 在实验室中,乙醇脱水是制备纯净乙烯的最简单方法。常用的催化剂有: 浓硫酸 液相反应,反应温度约170℃。 三氧化二铝 气-固相反应,反应温度约360℃。 分子筛催化剂 气-固相反应,反应温度约为300℃。 (一)实验目的 1.巩固所学有关反应动力学方面的知识。 2.掌握获得反应动力学数据的手段和方法。 3.学会实验数据的处理方法,并能根据动力学方程求出相关的动力学参数值。 (二)实验原理 乙醇脱水属于平行反应。既可以进行分子内脱水生成乙烯,又可以进行分于间脱水生成乙醚。一殷而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。因此,对于乙醇脱水这样一个复合反应,随着反应条件的变化,脱水过程的机理也会有所不同。借鉴前人在这方而所做的工作,将乙醇在三氧化二铝催化剂作用下的脱水过程描述成: 25222C H OH CH CH H O →=+ 气固相催化反应是一个多步骤的反应,它包括以下七个步骤: 1. 反应物分子由气流主体向催化剂的外表面扩散(外扩散); 2. 反应物分子由催化剂外表面向催化剂微孔内表面扩散(内扩散); 3. 反应物分子在催化剂微孔内表面上被吸附(表面吸附); 4. 吸附的反应物分子在催化剂的表面上发生化学反应,转化成产物分子(表面反应); 5. 产物分子从催化剂的内表面上脱附下来(表面脱附); 6. 脱附下来的产物分子从微孔内表面向催化剂外表面扩散(内扩散);
固定床乙醇脱水制乙烯反应研究实验 学校:齐齐哈尔大学化学 学院:化学与化学工程学院 班级:化工112 马林福,何青云,张杰 化工113 贾楠,王丽博 指导教师:韩福忠 日期:2014年11月26日
固定床乙醇脱水制乙烯反应研究实验 贾楠,马林福,王丽博,何青云,张杰 (齐齐哈尔大学化学与化学工程学院,161006) 摘要:乙烯是重要的基本有机化工产品。在固定床反应器中进行乙醇脱水反应研究,反应产物随着反应温度的不同,可以生成乙烯和乙醚。温度越高,越容易生成乙烯,温度越低越容易生成乙醚。实验中,通过改变反应的进料速度,可以得到不同反应条件下的实验数据,可以得到反应温度下的最佳工艺条件。 关键词:乙烯;进料速度;固定床反应器;最佳工艺条件; Abstract:Ethylene is an important basic organic chemical products.For ethanol dehydration reactionresearch in a fixed bed reactor,reaction products can be ethylene or ether with a different reaction temperature in a chemical reaction that the higher temperature,the more tend to generate ethylene and the lower temperature,the more tend to generate ether.By changing the speed of incoming materials of reactions,the experimental datas dissective to get the best process conditions are obtained in a different reaction condition. Key words:ethylene;feed rate;fixed bed reactor;the best process conditions 1前言 乙醇脱水生成乙烯和乙醚,是一个吸热、分子数增不变的可逆反应。提高反应温度、降低反应压力,都能提高反应转化率。乙醇脱水可生成乙烯和乙醚,但高温有利于乙烯的生在,较低温度时主要生成乙醚,有人解释这大概是因为反应过程中生成的碳正离子比较活泼,尤其在高温,它的存在寿命更短,来不及与乙醇相遇时已经失去质子变成乙烯.而在较低温度时,碳正离子存在时间长些,与乙醇分子相遇的机率增多,生成乙醚。有人认为在生成产物的决定步骤中,生成乙烯要断裂C—H 键,需要的活化能较高,所以要在高温才有和于乙烯的生成。 乙醇在催化剂存在下受热发生脱水反应,既可分子内脱水生成乙烯,也可分子间脱水生成乙醚。现有的研究报道认为,乙醇分子内脱水可看成单分子的消去反应,分子间脱水一般认为是双分子的亲核取代反应,这也是两种相互竞争的反应过程,具体反应式如下: C2H5OH → C2H4 + H2O (1)
有机化学分馏实验报告 篇一:分馏实验报告 广东工业大学 学院专业班组、学号姓名协作者教师评定 实验题目分馏 一、实验目的 了解分馏的原理与意义,分馏柱的种类和选用方法。学习实验室里常用分馏的操作方法。二、分馏原理 利用普通蒸馏法分离液态有机化合物时,要求其组分的沸点至少相差30℃,且只有当组分间的沸点相差110℃以上时,才能用蒸馏法充分分离。所谓分馏(Fractional Distillation)就是蒸馏液体混合物,使气体在分馏柱内反复进行汽化、冷凝、回流等过程,使沸点相近的混合物进行分离的方法。即:沸腾着的混合物蒸汽进行一系列的热交换而将沸点不同的物质分离出来。实际上分馏就相当于多次蒸馏。当分馏效果好时,分馏出来的(馏液)是纯净的低沸点化合物,留在烧瓶的(残液)是高沸点化合物。 影响分馏效率的因素有:①理论塔板;②回流比;③柱的保温。 实验室常用的分馏柱为Vigreux柱(或刺式分馏柱、维氏分馏柱、韦氏分馏柱、维格尔分馏柱)。使用该分馏柱的优点是:仪器装配简单,操作方便,残留在分馏柱中的液体
少。三、实验仪器与药品 电热套、圆底烧瓶、分馏柱、温度计、冷凝管、接液管、丙酮。 能与水、甲醇、乙醇、乙醚、氯仿、吡啶等混溶。能溶解油脂肪、树脂和橡胶。五、实验装置 六、实验步骤(一)填表及作图 1、在圆底烧瓶内放置40ml混合液(体积比:丙酮∶水=1∶1)及2粒沸石,按简单分馏装置图2-11安装仪器。 2、开始缓缓加热,并控制加热程度,使馏出液以1-2s/D 的速度蒸出。将初馏出液收集于量筒中,观察并记录柱顶温度及接受器A的馏出液总体积。继续蒸馏,(从5ml开始)记录每增加1ml馏出液时的温度及总体积。注意温度突变时位置。 曲线,讨论分馏效率。数据记录: (二)纯化丙酮 (1)待圆底烧瓶冷却后,加入馏液,补加2粒沸石。安装好分馏装置。(2)收集56~62℃以下的馏液。此馏液为纯丙酮。 馏液总体积ml,回收率=馏液总体积/40= %。(3)观察62~98℃的馏液共滴。 产品:丙酮,无色易挥发和易燃液体,有微香气味。讨论:(很重要,请填写!)
乙醇脱水制乙烯实验探究 李增祥 中学化学实验室中常用浓硫酸作为乙醇脱水制取乙烯的催化剂、脱水剂,但是实验中存在很多的弊端,如:炭化现象严重影响观察,反应所需要的时间长,制取的乙烯纯度不高等。苏教版全国高中化学新教材——《有机化学基础》(选修)P69页,关于乙醇脱水制取乙烯的实验中,没有采用传统的方法即以浓硫酸作为催化剂,而是选用石棉绒作为催化剂制取乙烯[1]。教材中采用试管作为反应仪器,将乙醇和石棉绒加入其中用酒精灯进行加热,并用水进行洗气来制取乙烯。那么石棉绒能否作为制取乙烯的催化剂,还需要从其反应机理来看。 乙醇脱水反应是按照E1机理进行的,具体过程如下: 在酸的作用下,乙醇分子上不容易离去的集团——C—O转变成易离去的集团,C—O键断裂脱水形成C+,C+的邻位碳原子上失去一个质子,一对电子转移过来中和正电荷形成双键。从反应机理上看,生成C+的一步是整个反应的速控步骤,还表明醇的脱水反应是一个可逆反应。因此可以通过控制H+的浓度即用较浓的酸来使反应向右进行,可以选用浓硫酸或五氧化二磷作为催化剂和脱水剂。另外,醇在350-400℃在氧化铝或者硅酸盐表面上脱水,不发生重排反应[2]。如: 石棉属于硅酸盐类矿物,化学成份是Mg6[Si4O10][OH]8,含有氧化镁、铝、钾、铁、硅等成分[3]。因此从理论上看石棉绒可以作为乙醇脱水制取乙烯的催化剂,那么它在实际操作中能否有良好的催化效果?与浓硫酸、五氧化二磷在实验室中的催化效果有什么不同?笔者对此进行了一系列的对比实验。 一、实验内容: 1、实验内容: (1)采用浓硫酸作催化剂; (2)采用石棉绒作为催化剂,分别采用角闪石和蛇纹石石棉; (3)采用五氧化二磷作催化剂; (4)采用浓硫酸和石棉绒作为混合催化剂; (5)采用五氧化二磷和石棉绒作为混合催化剂。 2、实验装置: 3、乙醇的具体用量及催化剂用量及见下表:
第29卷第3期2014年6月 大学化学 UNIVERSITY CHEMISTRY Vol.29No.3 Jun.2014 乙醇脱水制备乙烯综合性实验设计* 马新起 郭泉辉 杨显 (河南大学化学化工学院精细化学与工程研究所 河南开封475004) 摘要 从实验设计的思路二实验目的二实验设备二实验操作流程二实验思考题二实验数据记录和实验结果的处理等方面介绍乙醇脱水制备乙烯综合性实验的设计与实现过程三 关键词 高等教育 综合性实验 实验设计 随着高等教育改革的进一步深化,各高等院校更加注重对大学生创新意识二创新精神和创新能力的培养,对于理工科院校来说,进一步强化学生的工程实践能力是很重要的[1?3]三学生通过系统的实验训练,可以初步了解和掌握所学理论知识的运用,培养实践能力二分析问题能力和创新能力[4?6]三学生在学过乙烯的相关内容后,对以石油路线制备乙烯的过程有了一定的了解;同时也了解了利用可再生的生物质为原料制备生物乙醇二再以生物乙醇制备乙烯的路线[7?9]三 本文从实验设计的思路二实验目的二实验主要设备二实验操作流程二实验思考题二实验数据记录方法和实验结果的处理方法等方面,介绍我们利用本校现有实验装置开设的一个乙醇脱水制备乙烯综合性实验的设计与实现过程三希望借此为理工科院校实验教学改革提供一些参考三本文介绍的实验可作为化学化工类本科生的必修或选修实验三 1 实验设计的思路 笔者在本科生的专业课教学中主要是主讲及辅导化工工艺学和化工实验等课程三为了使学生熟悉后石油时代替代能源开发和利用的方法及其重要性,掌握利用生物乙醇制备乙烯的原理二工艺过程及自控系统二产物分析检测的方法,培养学生的实践能力和创新能力[10?11],笔者根据对石油路线制乙烯的工艺过程的了解,利用现有实验装置作为平台,开设了乙醇脱水制备乙烯的综合性实验三 乙醇催化脱水制备乙烯综合性实验综合运用了先修课程中学过的有机化学二化工原理二化学反应工程二化工仪表与自动化二仪器分析二化工工艺学等内容三先修课程所学内容在综合实验中的应用见表1三 表1摇先修课程所学内容在综合实验中的应用 先修课程先修课对应内容实验使用内容 有机化学烯烃的制备乙烯的制备方法 化工工艺学烃类裂解制乙烯乙醇制乙烯二数据处理 化工原理流体输送物料的输送与计量 化学反应工程反应器的型式固定床反应器 化工原理传热设备冷凝冷却器的选择 化工仪表与自动化仪表二自动化控制在线控制系统 仪器分析气相色谱反应产物的分析检测 *基金资助:河南大学第十二批校级教学改革研究资助项目(No.20120046)
广东工业大学 学院专业班组、学号 姓名协作者教师评定 实验题目分馏 一、实验目的 了解分馏的原理与意义,分馏柱的种类和选用方法。学习实验室里常用分馏的操作方法。 二、分馏原理 利用普通蒸馏法分离液态有机化合物时,要求其组分的沸点至少相差30℃,且只有当组分间的沸点相差110℃以上时,才能用蒸馏法充分分离。所谓分馏(Fractional Distillation)就是蒸馏液体混合物,使气体在分馏柱内反复进行汽化、冷凝、回流等过程,使沸点相近的混合物进行分离的方法。即:沸腾着的混合物蒸汽进行一系列的热交换而将沸点不同的物质分离出来。实际上分馏就相当于多次蒸馏。当分馏效果好时,分馏出来的(馏液)是纯净的低沸点化合物,留在烧瓶的(残液)是高沸点化合物。 影响分馏效率的因素有:①理论塔板;②回流比;③柱的保温。 实验室常用的分馏柱为Vigreux柱(或刺式分馏柱、维氏分馏柱、韦氏分馏柱、维格尔分馏柱)。使用该分馏柱的优点是:仪器装配简单,操作方便,残留在分馏柱中的液体少。 三、实验仪器与药品 电热套、圆底烧瓶、分馏柱、温度计、冷凝管、接液管、丙酮。 能与水、甲醇、乙醇、乙醚、氯仿、吡啶等混溶。能溶解油脂肪、树脂和橡胶。 五、实验装置
六、实验步骤 (一)填表及作图 1、在圆底烧瓶内放置40ml混合液(体积比:丙酮∶水=1∶1)及2粒沸石,按简单分馏装置图2-11安装仪器。 2、开始缓缓加热,并控制加热程度,使馏出液以1-2s/D的速度蒸出。 将初馏出液收集于量筒中,观察并记录柱顶温度及接受器A的馏出液总体积。继续蒸馏,(从5ml开始)记录每增加1ml馏出液时的温度及总体积。注意温度突变时位置。 曲线,讨论分馏效率。 数据记录: (二)纯化丙酮 (1)待圆底烧瓶冷却后,加入馏液,补加2粒沸石。安装好分馏装置。 (2)收集56~62℃以下的馏液。此馏液为纯丙酮。 馏液总体积ml,回收率=馏液总体积/40= %。 (3)观察62~98℃的馏液共滴。 产品:丙酮,无色易挥发和易燃液体,有微香气味。 讨论:(很重要,请填写!) 七、思考题
竭诚为您提供优质文档/双击可除 简单分馏实验报告 篇一:分馏实验报告 广东工业大学 学院专业班组、学号姓名协作者教师评定 实验题目分馏 一、实验目的 了解分馏的原理与意义,分馏柱的种类和选用方法。学习实验室里常用分馏的操作方法。二、分馏原理 利用普通蒸馏法分离液态有机化合物时,要求其组分的沸点至少相差30℃,且只有当组分间的沸点相差110℃以上时,才能用蒸馏法充分分离。所谓分馏(FractionalDistillation)就是蒸馏液体混合物,使气体在分馏柱内反复进行汽化、冷凝、回流等过程,使沸点相近的混合物进行分离的方法。即:沸腾着的混合物蒸汽进行一系列的热交换而将沸点不同的物质分离出来。实际上分馏就相当于多次蒸馏。当分馏效果好时,分馏出来的(馏液)是纯净的低沸点化合物,留在烧瓶的(残液)是高沸点化合物。
影响分馏效率的因素有:①理论塔板;②回流比;③柱的保温。 实验室常用的分馏柱为Vigreux柱(或刺式分馏柱、维氏分馏柱、韦氏分馏柱、维格尔分馏柱)。使用该分馏柱的优点是:仪器装配简单,操作方便,残留在分馏柱中的液体少。三、实验仪器与药品 电热套、圆底烧瓶、分馏柱、温度计、冷凝管、接液管、丙酮。 能与水、甲醇、乙醇、乙醚、氯仿、吡啶等混溶。能溶解油脂肪、树脂和橡胶。五、实验装置 六、实验步骤(一)填表及作图 1、在圆底烧瓶内放置40ml混合液(体积比:丙酮∶水=1∶1)及2粒沸石,按简单分馏装置图2-11安装仪器。 2、开始缓缓加热,并控制加热程度,使馏出液以1-2s/D 的速度蒸出。将初馏出液收集于量筒中,观察并记录柱顶温度及接受器A的馏出液总体积。继(:简单分馏实验报告)续蒸馏,(从5ml开始)记录每增加1ml馏出液时的温度及总体积。注意温度突变时位置。 曲线,讨论分馏效率。数据记录: (二)纯化丙酮 (1)待圆底烧瓶冷却后,加入馏液,补加2粒沸石。安装好分馏装置。(2)收集56~62℃以下的馏液。此馏液为
第32卷第4期2007年12月 广州化学 Guangzhou Chemistry V ol.32, No.4 Dec., 2007 生物乙醇催化脱水制乙烯的研究进展洪爱珠,颜桂炀,刘欣萍,肖荔人,陈庆华* (福建师范大学化学与材料学院,福建省改性塑料技术开发基地,福建福州350007) 摘要:阐述了利用生物质能源的重要性,介绍了生物乙醇催化脱水制乙烯的发展现状,特别是 其催化剂的研究状况。针对乙醇脱水制乙烯催化剂存在的问题,提出当前催化剂的发展趋势。 关键词:生物乙醇;脱水;乙烯;催化剂;进展 中图分类号:TQ 221.21+1 文献标识码:A 文章编号:1009-220X(2007)04-0060-06 进入21世纪,全球能源政策正在进行着决定性的转折。生物质能源等可再生能源正在逐步替代矿物能源,不但能源短缺的国家如此,而且能源丰富的发达国家也在悄然地调整能源政策。目前,在生物能源产品产业规模方面,发展最快的是燃料乙醇。同时,国内外专家对生物发酵技术的研究取得了重大进展,这为乙醇脱水制乙烯提供了广阔的来源。 乙烯工业是石油化学工业的龙头产业,乙烯产品占石化产品的70%以上,在石油化学工业乃至国民经济中占有重要地位[1]。随着社会经济的持续高速发展,乙烯的需求日益扩大,据美国化学品制造商协会(CMAI)的最新预测,2005年~ 2009年世界乙烯需求年增长率为4.5%[2],但是乙烯工业的最基本原料——石油,却呈现逐渐枯竭之势,所以目前全球乙烯市场一直处于短缺状态。据《日本化学周刊》报道[3],2005年全球乙烯市场供应缺口约194万吨/年,估计2006年将增至231万吨/年,此后三年间乙烯市场将持续供不应求,缺口分别为45万吨、197万吨和116万吨。可见,开展生物乙醇脱水制乙烯研究具有重要的意义。 1 生物乙醇脱水制乙烯的发展现状 以生物质生产乙烯,是一个“生物质水解产生糖,糖发酵后产出乙醇,乙醇脱水制成乙烯”的过程。在19世纪,乙醇脱水曾经是主要的乙烯生产路线。由于石油化工的蓬勃发展,乙醇脱水制乙烯逐渐被淘汰。随着社会经济的持续高速发展,近些年来,生物乙醇脱水制取乙烯路线逐渐受到重视并取得了显著的发展。 生物乙醇是绿色可再生原料,符合我国“十一·五”规划循环经济的要求,同时生物技术最近取得的巨大进步可望大幅度地降低乙醇价格,生物乙醇路线即具有较强的竞争力。生物乙烯具有原料来源广泛、价廉易得的特点,根据“863计划”中乙醇的生产成本,并结合丰盛集团乙烯的价格[1]进行分析,从生物乙醇生产的乙烯价格可以达到5500 ~ 7200元/吨。 收稿日期:2007-02-07 *通讯联系人。陈庆华,教授,硕士生导师。 基金项目:国家科技支撑计划(2006BAE03B01-08);教育部“新世纪优秀人才支持计划”(NCET-04-0614); 福建省教育厅科技计划(JB06079)资助项目 作者简介:洪爱珠(1984-),女,福建南安人,硕士研究生,从事环境友好新材料研究。
三、乙烯水合制乙醇 乙醇早期由含淀粉类物质(大米、玉米、高粱、薯类)发酵得到。生产1 t酒精,约需消耗3~4 t粮食。自1930年在美国最先实现由乙烯间接水合法(又称硫酸水合法)制乙醇的工业生产以来,又开发成功乙烯直接水合法制乙醇工艺。现在,世界上主要采用直接水合法生产乙醇。 1.生产方法评述 (1)硫酸水合法生产工艺分二步进行,第一步是乙烯与硫酸反应生成烷基硫酸酯: CH2=CH2+H2SO4→←CH3CH2SO4H CH3CH2SO4H+CH2=CH2→←(CH3CH2)2SO4 反应的工艺条件为:硫酸浓度94%~98%,反应温度60~90℃,压力1.7~3.5MPa。 第二步是烷基硫酸酯水解生成乙醇:
CH3CH2SO4H+H2O CH3CH2OH+H2SO4 (CH3CH2)2SO4+2H2O2CH3CH2OH+H2SO4 水解用通直接蒸气加热实现,同时蒸出醇,但硫酸浓度几乎被稀释至原来的一半,即50%左右。 因此,处理生成的大量稀硫酸就成为该工艺的一大难题,把硫酸浓缩至70%~75%是比较容易的,再提浓时有SO3烟雾产生,而且提纯的浓度愈高,SO3烟雾愈多。为此需要采用特殊的蒸发器进行真空蒸发,费用大、污染严重。到目前为止还没有找到既经济又不产生污染的好方法。此外,硫酸水合法由于副反应多,故原料消耗高,生产成本比直接水合法高20%。 (2)直接水合法有气相法和液相法两种,但已工业化的仅气相法一种。 反应的工艺条件为:反应温度250℃左右,压力7.0MPa,H2O/C2H4(摩尔比)为0.6∶1,以磷酸硅
藻土为催化剂。在此工艺条件下,乙烯的单程转化率 在5%左右,选择性94%~95%,该工艺的优点是不存在 治理大量废酸问题,环境污染也比硫酸水合法小得多。缺点是转化率低,绝大多数乙烯需循环使用。 2.气相直接水合法工艺原理 (1)化学反应主反应为: CH2=CH2+H2O→CH3CH2OH △H=-40 kJ/mol 副反应主要有生成二乙醚和乙醛的反应: CH2=CH2+HC3CH2OH→C2H5 OC2H5 CH3CH2OH====CH3CHO+H 2 此外,还有乙烯齐聚生成C8以下异构烷的反应,乙烯脱氢缩合生成焦的反应等,实验研究表明,转化的乙烯 消耗于生成各种产物的分配比例大致为: 乙醇 94.5%(w) 乙醛 2%(w)