
第一章绪论
1.1引言
随着化学这一学科的不断发展,化学可大致分为无机化学和有机化学两大分支。在有机化学方面,不断的有自然界不存在的新的物质被合成,各种具有不同性质活性的天然产物不断的被发现、分离出来。于是有机化学就和生物学、医学、药学等多门学科发生交叉,产生生物有机化学等新兴的交叉学科。2H-吡喃及其衍生物和与苯并和的二环系化合物是许多重要天然产物的母体,其中许多化合物具有重要的生物活性和药理活性。本文要讨论的就是利用三组分反应催化合成2H-吡喃的一系列衍生物。
1.2 β-酮砜的合成
砜基(-SO2-)是一种化学基团,有机化学中化合物的重要官能团之一,就像甲基(-CH3),氨基(-NH2),羧基(-COOH),羟基(-OH),醛基(-CHO)一样,一般附着在苯环上。具有磺酰基并通常借助硫与两个碳原子连结为特征的一类有机化合物,一般是结晶状稳定化合物,可通过有机硫化物的氧化或其他方法制得随着人们对有机硫化物的研究不断深入,β-酮砜的合成及其做为其他重要有机化合物的合成前体、中间体己经成为有机合成化学中一个重要的领域。β-酮砜类化合物,不仅可以作为Michael加成和Knoevenage缩合反应的中间体,而且是合成酮、查尔酮、丙二烯类、乙炔、乙烯砜和2H-吡喃的前体。β-酮砜是由烷基化试剂与亚磺酸盐在合适的溶剂中反应制得,特别是含有芳香取代基的酮砜,通常由苯亚磺酸钠和酮类化合物制备而来。β-酮砜特有的酮基和砜基官能团由—CH2—连接在一起,由于酮基和砜基的强吸电子作用,使中间的亚甲基碳原子上的H更加活泼。大部分β-酮砜为白色粉末状,个别为棕色粉末,如噻吩基β-酮砜。2-苯磺酰基苯乙酮熔点为93-95℃,结构式如图1。
O
O
S
O
图1-1 2-(苯基磺酰)苯乙酮
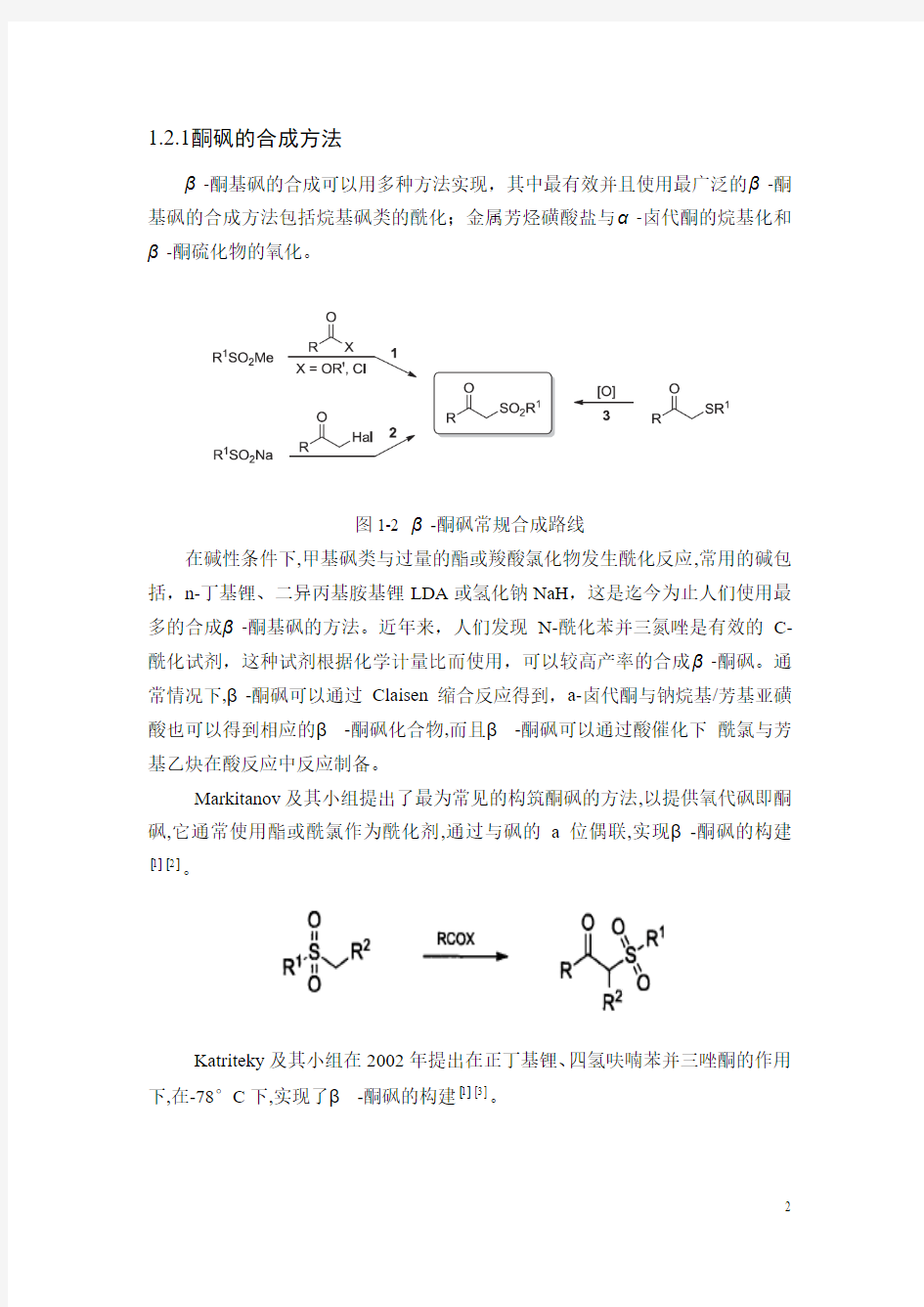
1.2.1酮砜的合成方法
β-酮基砜的合成可以用多种方法实现,其中最有效并且使用最广泛的β-酮基砜的合成方法包括烷基砜类的酰化;金属芳烃磺酸盐与α-卤代酮的烷基化和β-酮硫化物的氧化。
图1-2 β-酮砜常规合成路线
在碱性条件下,甲基砜类与过量的酯或羧酸氯化物发生酰化反应,常用的碱包括,n-丁基锂、二异丙基胺基锂LDA或氢化钠NaH,这是迄今为止人们使用最多的合成β-酮基砜的方法。近年来,人们发现N-酰化苯并三氮唑是有效的C-酰化试剂,这种试剂根据化学计量比而使用,可以较高产率的合成β-酮砜。通常情况下,β-酮砜可以通过Claisen缩合反应得到,a-卤代酮与钠烷基/芳基亚磺酸也可以得到相应的β-酮砜化合物,而且β-酮砜可以通过酸催化下酰氯与芳基乙炔在酸反应中反应制备。
Markitanov及其小组提出了最为常见的构筑酮砜的方法,以提供氧代砜即酮砜,它通常使用酯或酰氯作为酰化剂,通过与砜的a位偶联,实现β-酮砜的构建[]1[]2。
Katriteky及其小组在2002年提出在正丁基锂、四氢呋喃苯并三唑酮的作用下,在-78°C下,实现了β-酮砜的构建[]1[]3。
Venkateshwariu及其小组在2008年提出在微波条件下,以水作催化剂,反应3-5 min,实现了由卤代苯乙酮和对甲基苯磺酸钠的偶联生成β-酮砜的构建[]1[]4。
Vanelle及其小组在2009年报道了在水相,利用NaSO4;NaHCOs做催化剂,在10下,在500W微波条件下,反应10 min,实现了氯与2-溴-4-硝基苯乙酮构建酮砜类化合物[]1[]5。
Hossein Loghmani-Khouzani及其小组在2010年报道了在间氯过氧苯甲酸和二氯甲烷的作用下,实现了通过硫醚构建酮砜的反应,该反应达到了82%的产率[]1[]6。
Lei及其小组在2013年报道了有氧氧化的甲基酸和苯乙炔在吡喃作用下,以碳酸二乙酯(DEC)作为溶剂,高效的合成了β-酮砜类化合物[]1[]8。
Wang及其课题组在2013年报道了在有氧氧化条件下,以Cu(0Ac)2作为催化剂,实现了取代基乙稀与酰肼反应,构建了β-酮砜类化合物[]1[]8。
Pospí?il J,等[]9合成了包含苯并噻唑或苯并四氮唑的杂环β-酮砜,这些带有杂环的酮砜是相应的杂环甲基砜类使用LiN(TMS)2作为碱性酰化试剂制备。使用的非亲核性碱源与亲电中心内的杂环甲基砜反应,杂环甲基砜连在形成产物的侧链。
Kamijo S.[]10等在低温下用n-丁基锂作为催化剂,通过Claisen缩合反应,由环状羧酸三氟甲烷磺酸烯烃和二甲亚砜的阴离子反应获得羰基侧链上含有炔键的β-酮砜的合成。
Kreis M.等[]11在二聚对二甲苯分子上构造了β-酮砜基团,该方法涉及甲基酮的磺酰化。这种方法用于手性β-酮砜的对环芳烃衍生物的合成,使用不对称催化剂配体,由4-羟基-5-酰基对环芳烷和氢化钠、三氟甲磺酸酐或者NfF反应合成。
Kamigata N[]12通过链烷烃与芳烃磺酰氯和烯醇硅醚一起反应制备β-酮砜。作为起始底物,烯醇硅醚由乙酰苯派生物制备而来,并且证明是很有效的合成β-
酮砜方法。链烷烃与芳烃磺酰氯和烯醇硅醚在[RuCL2(PPh3)3]络合物催化下高产率合成β-酮砜。
1.2.2酮砜参与的反应
因两侧分别与两个强的吸电子基羰基和磺酰基相连,致使β-酮砜带有活泼的亚甲基,。由于这些吸电子基的存在,使β-酮砜具有相当强的酸性,它的酸性相当于β-酮酸酯(pKa = 11.4),因此β-酮砜可以参与很多反应。
(1)β-酮砜的缩合反应
Yuriy M等[]13报道了苯磺酰基苯乙酮和2-(3-甲基-2-丁烯氧基)醛和2-(E-3-苯基-丙氧基) 醛的Knoevenagel缩合反应,由EDDA催化,在分子内发生氧杂-狄尔斯-阿尔德反应,得到环化顺式和反式加成产物的混合物。
(2) β-酮砜的苯并环化反应
(3)金属Pd盐催化苯磺酰基苯乙酮的烯丙基化反应
(4)α-亚联氨基-β-酮砜的合成
(5)α-叠氮-β-酮砜的合成
1.2.3酮砜参与的三组分反应
目前,β-酮砜参与的三组分反应研究的较少,其中使用β-酮砜作为亲核试剂完成三组分反应研究报道得更少,特别是利用β-酮砜合成取代二氢吡喃基本没有报道。在前期工作的基础上,我们认为在适当的条件下,β-酮砜可能作为亲核试剂与醛、其它的亲核试剂(如α-甲基苯乙烯)发生反应完成取代二氢吡喃的制备。本文主要研究β-酮砜、甲醛和α-甲基苯乙烯的三组分反应,首先β
-酮砜与甲醛形成中间体,其中间体进一步与α-甲基苯乙烯发生氧杂狄尔斯-阿尔德反应,即共轭二烯烃与含有碳碳双键的不饱和化合物进行1,4-加成反应,生成环状吡喃化合物。
1.2.4酮砜的提纯
因为大部分β-酮砜为白色粉末状,个别为棕色粉末,即大都分的酮砜为固体粉末状态,所以选择重结晶操作来对合成的酮砜进行提纯。
1.3 吡喃的合成
吡喃,是含有一个杂原子的六元杂环化合物,其中的杂原子是氧原子。含六员杂环体系,照理应该与吡啶及其同系物相当,即氧原子顶替六员碳环中的一个环碳节单位。然而,由于氧原子是两价的,它只能以两个σ键与环碳原子相连,所以在这样的分子中,不存在像吡啶和苯分子那样的连续封闭的π电子共轭体系。在吡喃环中,还有一个sp3杂化的碳原子,因此吡喃环是不具有芳香性的,属于烯型杂环化合物。吡喃的类衍生物是一类具有明显的生物活性和独特的药理活性的化合物,是重要的反应中间体,广泛应用于化妆品、医疗药物等众多领域,是杂环化合物体系中比较特殊的一类。吡喃催化加氢所得到的产物二氢吡喃的取代物制备困难,但是随着研究的深入,人们已经合成了多种结构新颖独特的吡喃衍生物。
1,3,1吡喃的合成方法
γ-吡喃直至1962年才首次合成[]14[]15。其方法是戊二醛在无水HCl和二乙基苯胺作用下环化而得。反应方程式为:
使用氯化锌作为催化剂,催化乙酰乙酸乙酯和甲醛的反应,生成相应的取代γ-吡喃[]15。反应方程式如下:
Quinteiro等人用一个α、β-不饱和酮和丙二腈反应也能制得取代γ-吡喃化合物[]15。反应方程式如下:
γ-吡喃本身可通过下列方法合成:
α-吡喃,现在还不能合成,但是它的取代衍生物是可以制得的,不过一般它们都不太稳定,很容易开环而生成相应的链状化合物。例如,1,3,5-三甲基吡喃盐还原能生成2,4,6-三甲基-γ-吡喃和2,4,6-三甲基-α-吡喃[]15,但后者不稳定迅速发生开环反应,得到的产物是一个链状的不饱和酮:
1.3.2吡喃衍生物的合成方法
二氢吡喃是无色易燃液体,有类似醚的气味。它可由α-吡喃和γ-吡喃催化加氢得到。也可由糠醛催化加氢得到四氢呋喃甲醇,再以氧化铝为催化,高温(300~400℃)下脱水重排制得[]15。反应方程式如下:
二氢吡喃可以作为重要的羟基和羰基保护剂用于精细有机合成反应中。与醇或羧酸在很温和的反应条件下生成醚或酯。这种醚或酯在中性条件和碱性环境中,对亲和试剂、还原剂及一般氧化剂稳定,对取代基进行各种改造后,又可以用醋酸水溶液将羟基或羧基复原[]15。反应方程式如下:
以少量酸为催化剂,与醇、酚类发生加成反应,生成可稳定存在的α-四氢吡喃醚类化合物[]15。反应方程式如下:
得到的化合物是羟基保护基,在氧化剂、碱、烃基锂、格氏试剂、催化加氢等作用下均较稳定,但遇无机酸会缓慢水解,生成原来的醇和5-羟基戊醛。
2005年,Baruah等[]16以β-萘酚和芳香醛为原料,硫酸为催化剂在乙酸中合成了二苯并吡喃类衍生物,合成路线如下:
2009年,He等[]17在丙三醇溶剂中,以1,3-环己二酮和芳香醛为原料,回流合成了吡喃类化合物;Gong等在水相中以碱性离子液体为催化剂,催化1,3-苯二酚、丙二睛和芳香醛三者反应,得到了吡喃类衍生物,合成路线如下:
2013年,韩利民等[]18在近室温无催化剂条件下以乙烯基二茂铁为捕捉体,与β-二羰基类化合物及甲醛水溶液构建了一系列新型含有二茂铁基二氢吡喃类化合物。
本实验中,采用的是以无水乙醇为溶剂、碱性离子液体[BMIM]OH为催化剂,在搅拌、油浴加热到80℃的条件下,以甲醛、酮砜、α-甲基苯乙烯为原料的三组分反应,来得到吡喃的衍生物。
1.3.3吡喃衍生物的分离与提纯
在本实验中,因为是一无水乙醇做溶剂,故反应在液相中进行,结束反应后,生成的产物、副产物,还有剩余的原料,不参加反应的催化剂、溶剂均混合在一起。因此,在使用薄层层析的方法,在薄层板上试验出合适的洗脱剂后,便用柱层析的方法将混合物分离出来,最后在进行浓缩。
1.4 离子液体
1.4.1 碱性离子液体简介
离子液体(或称离子性液体)是指全部由离子组成的液体。离子液体的熔点受到阴阳离子的电荷数量和离子半径的影响,离子半径越大,阴阳离子之间的作用力就越小,则离子液体的熔点就越低。有一些离子化合物的阴阳离子半径很大,所以很难排列紧密,形成对称的结构,至致它们之间的作用力降低,从而熔点与室温相近。离子液体具有很大的使用价值,已经被广泛的应用在有机合成、催化化学反应、电化学和材料科学等很多领域。本实验使用的催化剂是氢氧化1-丁基
-3-甲基咪唑([BMIM]OH),属于碱性离子液体[]19
。
1.4.2 碱性离子的制备
离子液体是一种可设计型的化合物,只要改变阳离子、阴离子的种类,就可以设计出不同的离子液体。可用两种方法得到离子液体:一步合成法和两步合成法。不能用一步合成法直接得到目标离子液体的就使用两步法合成。
一步合成发即直接合成20:利用酸碱中和反应或季胺化反应等一步合成离子液体,方法简便,只得到目标产物。Hlrao等利用不同的阳离子通过酸碱中和的方法合得到了一系列含有不同阳离子的四氟硼酸盐离子液体。
两步合成[]20
:使用直接合成的方法无法得到或者得到的操作很难、繁杂,
则使用两步合成的方法。经常用到的四氟硼酸盐类和六氟磷酸盐类离子液体,通常采用两步法来合成。第一步,先得到含目标阳离子的卤盐;然后用待得到的阴离子置换卤素离子或加入Lewis酸来进行第二步反应得到所要合成的离子液体。
在第二步反应中,使用的金属盐通常是含有银离子、铵根离子或含有氢离子时,会产生Ag盐沉淀或胺盐、HX气体是很容易被除去,然后对离子液体进行萃取,最后利用减压蒸发除去有机溶剂得到纯净的离子液体。
季铵化反应可以一步得到多种离子液体,例如[BMIM] [CF3SO3]、[BMIM]Cl。
1.4.3 碱性离子液体的应用
离子液体是一些有机化学反应的良好溶剂,而且,很多离子液体可以作为有机合成反应的催化剂。由于离子液体具有这样的特性,它被运用与诸如聚合反应、选择性烷基化和胺化反应、酰基化反应、酯化反应、化学键的重排反应等方面。
傅-克反应可以在有机化合物中引入酰基和烷基。到目前为止常用的催化剂有沸石、固体酸和分子筛等。但是为了降低对环境的污染和反应的成本,很多化学研究人员已经在进行相关研究时开发利用离子液体。例如,Seddon等在研究可亲核试剂吲哚和2-萘酚的烷基化反应中使用了离子液体。这个方法在杂原子上的区域选择性非常高,产率在90%以上。在我国,邓友全[]22等在烷烃中引入酰基方面作了相关的研究。他们首次发表了以卤化1-烷基吡啶和1-甲基-3-烷基咪唑盐与无水AlCl3组成的超强酸性离子液体中,几种烷烃与一氧化碳的直接羰基化反应,产物为酮。
Heck反应,就是利用烯烃和卤代芳烃催化合成芳香烯烃的反应,通过这个反应可引入碳-碳双键。在这一反应中使用离子液体能使催化剂尽量不流失,也
可以减少所用溶剂挥发。Seddon等研究小组在[BMIM]PF6/水/己烷的三相系统中进行了Heck反应,反应结束后催化剂留在离子液体中,待下次反应还可再用。并且,反应后得到的产品溶解在有机层内,副产物被提取到水相中,易于分离。
碱性离子液体还被大量的用于Michael加成中,Michael加成是在碱性催化剂催化下发生亲核1,4-共轭加成反应。通常采用强碱作催化剂,但反应中会有副产物产生。Ranu等[]22研究发现,碱性离子液体[BMIM]OH对活泼亚甲基化合物、共轭酮、羧酸酯及腈类等化合物的Michael加成反应具有良好的催化作用。研究表明,以α,β-不饱和酮作为原料时,产率可达到90%左右。Yang等报道碱性离子液体[BMIM]OH催化芳香胺、咪唑、等N-杂环化合物与脂肪酮的杂氮-Michael 加成反应,反应在室温条件下进行,结果表明离子液体循环使用多次后催化效果仍很好。
R1
R2+ArNH2
R2
ArHN
R1
O
O
cat.ionic liquid
solven-free,r.t
碱性离子液体催化芳香胺的反应
Xu等[]23发表在常温条件下,碱性离子液体[BMIM]OH催化嘧啶、嘌呤、胺等N-杂环化合物与α,β-不饱和化合物的Michael加成反应。研究结果表明,碱性离子液体催化剂具有催化效果好、目标产率高,反应时间短的特点。
Nu-H+
R
R1EWG [Bmim]OH
r.t
R1
Nu
R
EWG
EWG = CN、 CO2CO3、COCH3
碱性离子液体催化Michael加成反应
碱性离子液体在Knoevenagel缩合反应中也有广泛应用,Knoevenagel缩合反应是在弱碱性的催化作用下,醛、酮和含有活泼亚甲基的化合物发生的失水所和反应。Ranu等报发表,在常温下以碱性离子液体为催化剂,催化饱和羰基化合物、不饱和羰基化合物与含有活泼亚甲基的化合物的Knoevenagel缩合反应,该反应表明,此催化剂对大多数底物普遍适用且可重复使用。Wang[]24合成氢氧化1-甲基-3[2-(N,N-二乙基)氨基]乙基咪唑盐这种新型的碱性离子液体,并且将这一新的碱性离子液体用于Knoevenagel缩合反应中的催化性能及催化机理的研
究。结果表明醛或酮与氰乙酸乙酯的缩合反应可被很好的催化,目标产物的产率可达85%~99%。Yadav等[]25报道碱性离子液体在常温下催化促进水杨醛与2-苯基嗯唑-5-酮合成3-苯甲酰氨基香豆素的Knoevenagel缩合反应。研究表明,反应过程中没有副产物产生、操作简便、目标产率高(85%~97%),并且离子液体可多次循环使用并保持催化性能不发生变化。
在电化学研究中使用离子液体可以减轻放电,因为离子液体具有导电性、难挥发、电化学稳定、电位窗口比其它水溶液电解质大很多等特点。将离子液体用于电池电解质中,可降低使用温度,所以离子液体作为电解液被用于制造新型高性能电池、太阳能电池以及电容器等。在不对称催化反应中运用离子液体,对映体的选择性相对于普通溶剂有很大的提高,而且得到的产物容易从反应体系中分离。Chen科研小组发表了再不对称烯丙基烷基化反应中使用离子液体;Song科研小组则在不对称环氧化反应中使用离子液体。以上不对称离子液体的合成,在研究不对称催化反应中有重大意义。
1.4.4离子液体的有点与特点
离子液体里只有阴离子和阳离子,在较宽的温度范围内呈液体状态,在很多情况下允许动力学控制。离子液体的对环境污染小、难燃烧、易与产物分离、具有良好的导电性、可反复多次循环使用、使用方便等优点,是传统挥发性有机溶剂的理想替代品。由于离子液体的这些特殊性质和表现,它被认为与超临界CO2,和双水相一起构成三大绿色溶剂,具有广阔的应用前景。
1.5选题意义
本文主要探讨酮砜参与的化学反应,酮砜在有机合成有着特有的官能团而占有重要位置。本文以碱性离子液体为催化剂,通过研究α-甲基苯乙烯、甲醛水溶液和β-酮砜的三组分反应,希望建立绿色合成吡喃类化合物的新途径。
第二章实验部分
2.1 实验仪器与试剂
本实验使用的均为普通简单易操作的化学仪器,主要有圆底烧瓶、试管、锥形瓶、量筒、玻璃棒、磁子、抽滤瓶、温度计、漏斗、布氏漏斗、层析柱、薄层色谱硅胶板、移液管、内径为0.5mm管口平整玻璃细管、滤纸、胶头滴管、玻璃皿、展缸、变径、烧杯等,其他仪器简单介绍如下:
表2-1 仪器基本介绍
仪器名称型号实验用途生产厂家
电子分析天平FA1104N 高精度称量药品上海精密科学仪器
有限公司
循环水式多用真空
泵SHB-Ⅲ抽滤、减压
郑州长城科工贸有
限公司
恒温磁力搅拌器79HW-1 合成酮砜江苏省金坛市荣华仪器制造有限公司
三用紫外分析仪UV-Ⅲ确定产物生成情况北京炳泽科技有限
公司
集热式恒温加热磁力搅拌器DF-101S 确保反应温度
郑州英峪予仪器有
限公司
接触调压器TDGC2-2 调节电压正泰集团公司
液相色谱质谱联用
仪LCMS-2020
化合物的质谱分析日本岛津公司
旋转蒸发器
RE-52减压蒸发上海亚荣生化仪器
厂
电热鼓风干燥箱星火牌BKH-C型玻璃仪器的干燥郑州长城科工贸有
限公司
本实验中使用的药品如表2-2所示,
表2-2 实验所用药品基本介绍
名称分子量分子式
熔
点°C
性状
苯亚磺酸钠164.13 C6H5NaO2S 300 白色或淡黄色鳞片状结
晶或粉末
对甲基苯亚磺酸钠178 C7H8NaO2S >300°C白色粉末
α-甲基苯乙烯118.18 C9H10-23.21 无色液体,,具有刺激性臭味,受热发生聚合,易燃
2-溴代苯乙酮199 C8H7BrO 46-51 白色至暗棕绿色晶体或
粉末
2-溴代萘乙酮249 C12H9OBr -- 土黄色粉末甲醛30 HCHO -92
无色,有强烈刺激性和窒息
性气味的气体
氢氧化1-丁基-3-甲
基咪唑
156.25 C8H16N2O -- 褐色液体
本实验合成原料如表2-3所示:
表2-3 实验合成药品基本介绍
名称分子式熔点°C 性状
萘环酮砜C18H14SO3154-156 乳白色粉末
对硝基酮砜C13H11NSO4146-148 乳白色粉末
对羟基酮砜C13H12SO4157-158 乳白色粉末
二茂铁酮砜C18H16SO3Fe -- 暗紫色晶体酮砜C14H12SO393-95 白色晶体对甲基酮砜C15H14SO3109 淡黄色晶体
表2-4 实验所用试剂基本介绍
名称规格生产厂家
石油醚分析纯天津市化学试剂工厂
乙酸乙酯分析纯天津市化学试剂工厂
丙三醇分析纯北京益利精细化学品有限公司
乙腈分析纯天津市北联精细化学品开发有限公
司
甲苯分析纯天津市化学试剂工厂二氯甲烷分析纯沈阳市华东试剂厂N,N-二甲基甲酰胺分析纯天津市化学试剂三厂二甲基亚砜分析纯天津市化学试剂三厂
四氢呋喃分析纯天津市化学试剂三厂
蒸馏水- -
50%乙醇分析纯天津市化学试剂工厂
无水甲醇分析纯天津市化学试剂工厂
无水乙醇分析纯天津永晟精细化工有限公司
2.2实验原料的合成
2.2.1酮砜的制备
实验中酮砜是主要的反应底物,而且需求量比较大,需自行合成,酮砜的合成属于绿色合成方法,环保、绿色、安全、便捷。简单介绍其合成方法及实验所用仪器:
制备酮砜的实验装备如图2-1所示,在干净的圆底烧瓶中加入1.355g(8.26 mmol)苯亚磺酸钠、1.095g (5.5 mmol) 2-溴代苯乙酮、50%乙醇水溶液5.0 ml和0.1720 g (1.1 mmol) 1-丁基-3-甲基咪唑碱性离子液体作为催化剂进行搅拌,反应时间为2小时。在反应开始后每半小时点一次板,点板时,将提前画好基线地硅胶板从甲醇中取出晾干,用乙酸乙酯溶解少量产物,用毛细管蘸取少量产物溶液,少量多次地进行点板。将产物与原料对比的点在基线上,待晾干后把薄层板放在盛有展开剂广口瓶中,用石油醚:乙酸乙酯为4:1的溶液作为展开剂,当张开剂的前沿线刚好走到板的尽头时取出,放在紫外灯下观察结果。当产物点中原料消失就是反应结束的时候。反应停止后抽滤,得到的滤液中含有全部的离子液体,将滤液保存好并可以循环使用。抽滤前,布氏漏斗的滤纸一定要合适,不宜过大或过小,太大影响抽滤,太小损失产品。抽滤时先用蒸馏水润湿滤纸,抽到产物干燥为止。晾干滤饼,得到产品后,点板确定是否纯净。当薄层板出现一个点就是纯净,如果出现其他点,说明产物中含有其他杂质,应该重结晶提纯。
图2-1合成酮砜的装置和柱层析装置图
苯亚磺酸钠与2-溴代苯酮反应方程式: S ONa O
+O
Br BMim OH/C 2H 5OH O S
O O r.t,2h
苯亚磺酸钠与α-溴代对羟基苯乙酮反应方程式:
BMim OH/C 2H 5OH
r.t, 1.5h
苯亚磺酸钠与2-
溴代萘乙酮反应方程式:
BMim OH/C 2H
5OH
r.t, 2h
苯亚磺酸钠与2-溴代噻吩乙酮反应方程式:
对甲基苯亚磺酸钠与2-溴代苯酮反应方程式:
2.2.2 反应机理 本实验使用苯亚磺酸钠与2-溴代苯酮、α-溴代对羟基苯乙酮、a-溴代对硝基苯乙酮、2-溴代萘乙酮分别反应来合成不同结构的酮砜,其反应原理相同,在合成反应中属于硫的烃基化反应,此反应属于S N 2亲核取代反应,反应机理如下: Ph S O
O -+R X Ph S O
R
O +NaX Na +
2.2.3 对酮砜的重结晶操作
(1)重结晶的原理[]26[]27 重结晶的原理是利用待提纯物质中各组分在不同溶剂中溶解度的不同,或在同一溶剂中不同温度时的溶解度不进行提纯分离的操作。准备进行重结晶操作的固体化合物在一种溶剂中的溶解度随温度的不同而不同,基本上大部分化合物在溶剂温度升高时溶解度增大,温度降低时溶解度减小。重结晶就是将待提纯固体溶解在适当的热溶剂中,使溶液达到过饱和。当溶液温度下降时,由于溶质的溶解度降低,溶质从溶液中结晶析出,可溶解于溶剂的杂质留在溶剂中,。从而,将所需产品和杂质分离,达到分离提纯效果。
此方法适用范围:适用于产品与杂质性质有很大差别、产品中杂质含量小于5 %的体系。
(2)溶剂的选择
被提纯的化合物,其自身的结构性质影响其在不同溶剂中的溶解度。通常,都是符合相似相溶院里的。借助文献资料、手册可以了解已知化合物在某种溶剂中的溶解度,但选择溶剂主要是通过试验来确定。
应用一下条件选择进行重结晶的溶剂:
①所使用溶剂和待提纯产物不发生化学反应;
②被提纯的产物在这种溶剂的溶解度在不同温度下差别大;
③杂质和所要产物在这一溶剂中的容积度差别和大;
④所使用的溶剂对于产物形成结晶不影响或者影响很小;
⑤溶剂的沸点不宜过高也不宜过低,容易挥发;
1.2.4离子液体的合成 (1)直接合成法 通过酸碱中和反应或季铵化反应一步合成离子液体,操作经济简便,没有副产物,产品易纯化。硝基乙胺离子液体可以由乙胺的水溶液与硝酸中和一步合成。 通过季铵化反应也可以一步制备出多种离子液体,如1-丁基-3-甲基咪唑盐[Bmim][CF3SO3],[Bmim]Cl等[11]。 (2)两步合成法 如果直接法难以得到目标离子液体,就必须使用两步合成法。 首先,通过季铵化反应制备出含目标阳离子的卤盐([阳离子]X型离子液体);然后用目标阴离子Y—置换出X—离子或加入Lewis酸MX y来得到目标离子液体。 应特别注意的是,在用目标阴离子Y—交换X—阴离子的过程中,必须尽可能地使反应进行完全,确保没有X—阴离子留在目标离子液体中,因为离子液体的纯度对于其应用和物理化学特性的表征至关重要。高纯度二元离子液体的合成通常是在离子交换器中利用离子交换树脂通过阴离子交换来制备[12]。另外,直接将Lewis酸MX y与卤盐结合,可制备[阳离子][M n X ny+1]型离子液体,如氯铝酸盐离子液体的制备就是利用这个方法[13]。 (3)微波辅助合成法 一般离子液体均在有机溶剂中加热回流制备,反应时间数小时至数十小时不等。而在微波作用下无需有机溶剂,且反应速度快、产率高,产品纯度好。微波是一种强电磁波,在微波照射下能产生热力学方法得不到的高能态原子、分子和离子,可以迅速增加反应体系中自由基或碳正离子的浓度,从能量角度分析,只要能瞬间提高反应物分子的能量,使体系中活化分子增加,就有可能增加反应速率,缩短反应时间。超声波能减小液体中悬浮粒子的尺寸,提高异相反应速率。但微波功率宜采用中低档功率较合适,若采用微波加水浴的方法效果相对较好些。 (4)超声波辅助合成法 超声波能减小液体中悬浮粒子的尺寸,提高异相反应速率。Welton等[14]采用超声波作为能量源,在密闭体系非溶剂条件下合成离子液体。他们发现卤代物
离子液体在催化剂制备中的应用 摘要:离子液体具有很多独特的物理、化学性质,正引起人们越来越多的重视,被认为是一类可以取代传统有机溶剂对环境友好的新型绿色溶剂,在很多领域中有着诱人的应用前景。本文归纳了离子液体的优越性质,介绍了离子液体的分类和制备方法,综述了其作为催化剂在各种化学反应中的应用,并展望了离子液体在该领域中的应用前景。同时,还对离子液体的固定化方法进行了评述,并指出了该研究领域目前存在的问题及发展趋势。 关键词:离子液体,催化剂,合成,应用,固定化 1 前言 1.1 离子液体的定义 离子液体(Ionic liquids)是完全由离子组成的在低温下呈液态的盐,也称为低温熔融盐,它一般由较大的有机阳离子和较小的无机阴离子所组成。离子液体与传统的熔融盐的显著区别是它的熔点较低,一般低于150℃,而传统的熔融盐具有高熔点、高薪度和高的腐蚀性。根据离子液体的这一性质,可以用它代替传统的有机溶剂和电解质作为化学反应与电化学体系的介质等。离子液体的产生可追溯到1914年,当Walden无意间将乙胺与浓硝酸混合时发现所形成的盐-硝酸乙基胺在室温下为液体,这就是第一个离子液体[1]。 1.2 离子液体的分类 离子液体的分类[2]比较多,按照阳离子可以分为四类:(1)1,3-二烷基取代的咪唑离子或称N,N'-二烷基取代的咪唑离子,简记为[RR'im]+,例如1-丁基-3-甲基咪唑离子记为[Bmim]+,若2位上还有取代基R'',则简记为[RR''R'im]+,如1,2-二甲基-3-丙基咪唑离子记为[MM'M''im]+;(2)N-烷基取代的吡啶离子,简记为[RPy]十;(3)烷基季铵离子[NR X H4-x]+,例如[Bu3NMe]+;(4)烷基季磷离子[PRxH4-x]+,例如[Ph3PO c]+。 图1-1 离子液体中常见的正离子结构 根据阴离子的不同,离子液体可分为二类:(1)卤化盐+AlCl3型(其中Cl也可用Br代替),如1-乙基-3-甲基咪唑氯代铝酸盐([emim]Cl-AlCl3),其缺点是对水极其敏
河南科技学院新科学院有机合成化学课程论文离子液体在催化过程中的应用 院系:新科学院化学工程系 专业:化学工程与工艺 班级:化工143班 学号: 2014160305 姓名:裴富洋 2017年5月19日 1
摘要 离子液体具有很多独特的物理、化学性质,正引起人们越来越多的重视,被认为是可以取代传统有机溶剂对环境友好的新型绿色溶剂,在很多领域中有着诱人的应用前景。 【关键词】:离子液体催化剂合成应用 引言 本文归纳了离子液体的优越性质,介绍了离子液体的分类和制备方法,综述了其作为催化剂在各种化学反应中的应用,并展望了离子液体在该领域中的应用前景。并指出了该研究领域目前存在的问题及发展趋势 1 离子液体 1.1 离子液体的定义 离子液体(Ionic liquids)是完全由离子组成的在低温下呈液态的盐,也称为低温熔融盐,它一般由较大的有机阳离子和较小的无机阴离子所组成。离子液体与传统的熔融盐的显著区别是它的熔点较低,一般低于150℃,而传统的熔融盐具有高熔点、高薪度和高的腐蚀性。根据离子液体的这一性质,可以用它代替传统的有机溶剂和电解质作为化学反应与电化学体系的介质等。离子液体的产生可追溯到1914年,当Walden无意间将乙胺与浓硝酸混合时发现所形成的盐-硝酸乙基胺在室温下为液体,这就是第一个离子液体。 1.2 离子液体的分类 离子液体的分类比较多,按照阳离子可以分为四类:(1)1,3-二烷基取代的咪唑离子或称N,N'-二烷基取代的咪唑离子,简记为[RR'im]+,例如1-丁基-3-甲基咪唑离子记为[Bmim]+,若2位上还有取代基R'',则简记为[RR''R'im]+,如1,2-二甲基-3-丙基咪唑离子记为[MM'M''im]+;(2)N-烷基取代的吡啶离子,简记为[RPy]十;(3)烷基季铵离子[NRXH4-x]+,例如[Bu3NMe]+;(4)烷基季磷离子[PRxH4-x]+,例如[Ph3POc]+。 2
离子液体概述及其应用 前言:离子液体是仅由阴阳两种离子组成的有机液体,也称之为低温下的熔盐。离子液体具有低蒸汽压,良好的离子导电导热性,液体状态温度范围广和可设计性等优点。离子液体所具备的这些其他液体无法比拟的性质,给大部分传统化工反应提供了新的思路,特别是在绿色化学设计中的应用。本文首先阐述了离子液体的基础知识,而后着重讨论了离子液体在催化及有机合成领域,摩擦领域,生物医药领域中的应用。 主题: 一 离子液体概述 1.1离子液体的发展及性质 20世纪时“离子液体”(IL )仅仅是表示熔融盐或溶盐的一个术语,比如高温盐。现在,术语IL 大部分广泛的用在表示在液态或接近室温条件下存在的熔盐。早在1914年,Walden [1]合成出乙基硝酸铵,熔点为12℃,但当时这一发现并未引起关注。20世纪40年代,Hurley 等人报道了第一个氯铝酸盐离子液体系AlCl3-[EPy]Br 。此后对这一氯铝酸盐离子液体系进行了不断的扩充,包括各种基团修饰,如N-烷基吡啶,1,3-二烷基咪唑等,另外研究了此类离子液体系在电化学,有机合成以及催化领域的应用并有很好的效果[2]。但是由于此类离子液体共同的缺点就是遇水反应生成腐蚀性的HCl ,对水和空气敏感,从而限制了他们的应用。所以直到1992年,Wilkes [3]领导的小组合成了一系列由咪唑阳离子与-4BF ,-6PF 阴离子构成的对水和空气
都很稳定的离子液体。此后在全世界范围内形成了研究离子液体的热潮。这是由于ILs 存在很多优异而特殊的性质。(1)液体状态温度范围广,300℃;(2)蒸汽压低,不易挥发;(3)对有机物,无机物都有很好的溶解性,是许多化学反应能够在均相中完成;(4)密度大,与许多溶剂不溶,当用另一溶剂萃取产物时,通过重力作用,可实现溶剂与产物的分离;(5)较大的可调控性;(6)作为电解质具有较大的电化学窗口,良好的导电性,热稳定性。这些特殊的物理化学性质可以产生许多新应用,同时也会提高现有的科技水平。到目前为止,已经合成并报道了大量的ILs ,图1显示了典型的阳离子结构,阴离子结构和侧基链[4]。我们可以通过选择合适的离子组成从而实现ILs 物理化学性质的设计。比如说咪唑阳离子(1-丁基-3-甲基咪唑阳离子)和-4BF 或-4AlCl 组合,生成的离子液体是亲水性的,而同样的阳离子和 -6PF 或-2NTf 产生的是强憎水性的离子液体。 目前研究较多的是咪唑阳离子和吡啶阳离子与含氟阴离子构成的离子液体。
离子液体的制备
一.3.1 咪唑类离子液体的制备(制备氧化锆) 3.1.1 溴化1-辛基-3-甲基咪唑([C8mim]Br)的合成及纯化 这种离子液体的合成反应可表示为: C8H17Br + C4H6N2 → [C8mim]Br 实验步骤:在圆底烧瓶中加入100 g新蒸馏的N-甲基咪唑和300 mL三氯乙烷,在强烈搅拌下,在60℃滴加236 g新蒸馏的正溴辛烷,滴加时间超过2 h,滴加完毕后在83℃下回流约3 h,反应现象是先浑浊后变为橙黄色粘稠的液体,经分液漏斗分离出离子液体, 并用三氯乙烷洗涤数次后, 在65℃真空干燥48 h除去残余的溶剂和水,即可得到最终产品。 3.1.2 1-辛基-3-甲基咪唑四氟硼酸盐([C8mim][BF4])的合成及纯化 该离子液体的制备反应可表示为: [C8mim]Br + NaBF4 → [C8mim][BF4] + NaBr 实验步骤:将160.6 gNaBF4溶于550 mL水中,再加入202.6 g[C8mim]Br,搅拌48 h,而后用二氯甲烷萃取,有机层多次用水洗涤,直到在被除去的水相中滴加AgNO3溶液没有黄色沉淀出现为止。先蒸去二氯甲烷溶剂,再在65℃真空干燥48 h用以除去残余的溶剂和水。 3.1.3 溴化1-十二烷基-3-甲基咪唑([C12mim]Br)的合成及纯化 该离子液体的制备反应可表示为: C12H 25Br + C4H6N2 → [C12mim]Br 实验步骤:在圆底烧瓶中,加入75 g新蒸馏的N-甲基咪唑和250 mL三氯乙烷,在强烈搅拌下,在60℃滴加250 mL新蒸馏的正溴十二烷,滴加时间超过2 h,滴加完毕后在83℃再回流3 h,反应现象是先浑浊后变为橙黄色粘稠的液体。然后蒸出溶剂三氯乙烷,得到此离子液体极其粘稠,[C12mim]Br在65℃真空干燥48 h用以除去残余的溶剂和水。
一.3.1 咪唑类离子液体的制备(制备氧化锆) 3.1.1 溴化1-辛基-3-甲基咪唑([C8mim]Br)的合成及纯化 这种离子液体的合成反应可表示为: C8H17Br + C4H6N2 → [C8mim]Br 实验步骤:在圆底烧瓶中加入100 g新蒸馏的N-甲基咪唑和300 mL三氯乙烷,在强烈搅拌下,在60℃滴加236 g新蒸馏的正溴辛烷,滴加时间超过2 h,滴加完毕后在83℃下回流约3 h,反应现象是先浑浊后变为橙黄色粘稠的液体,经分液漏斗分离出离子液体, 并用三氯乙烷洗涤数次后, 在65℃真空干燥48 h除去残余的溶剂和水,即可得到最终产品。 3.1.2 1-辛基-3-甲基咪唑四氟硼酸盐([C8mim][BF4])的合成及纯化 该离子液体的制备反应可表示为: [C8mim]Br + NaBF4 → [C8mim][BF4] + NaBr 实验步骤:将160.6 gNaBF4溶于550 mL水中,再加入202.6 g[C8mim]Br,搅拌48 h,而后用二氯甲烷萃取,有机层多次用水洗涤,直到在被除去的水相中滴加AgNO3溶液没有黄色沉淀出现为止。先蒸去二氯甲烷溶剂,再在65℃真空干燥48 h用以除去残余的溶剂和水。 3.1.3 溴化1-十二烷基-3-甲基咪唑([C12mim]Br)的合成及纯化 该离子液体的制备反应可表示为: C12H 25Br + C4H6N2 → [C12mim]Br 实验步骤:在圆底烧瓶中,加入75 g新蒸馏的N-甲基咪唑和250 mL三氯乙烷,在强烈搅拌下,在60℃滴加250 mL新蒸馏的正溴十二烷,滴加时间超过2 h,滴加完毕后在83℃再回流3 h,反应现象是先浑浊后变为橙黄色粘稠的液体。然后蒸出溶剂三氯乙烷,得到此离子液体极其粘稠,[C12mim]Br在65℃真空干燥48 h用以除去残余的溶剂和水。 3.1.4 十二烷基-3-甲基咪唑四氟硼酸盐([C12mim][BF4])的合成及纯化 该离子液体的制备反应可表示为: [C12mim]Br + NaBF4 → [C12mim][BF4] + NaBr 实验步骤:将142 gNaBF4溶于600 mL水中,再加入215 g[C12mim]Br,接着搅拌48 h,而后用二氯甲烷萃取,有机层多次用水洗涤,直到在被除去的水相
咪唑类酸性离子液体催化剂的制备及其表征 【摘要】本文用一步合成法制备了三种咪唑类Br?覫nsted酸性离子液体:[Hmim]CH3COO、[Hmim]H2PO4、[Hmim]C4H7O2,收率分别为85.5%、79.0%、87.0%,并通过FT-IR对三种离子液体进行了表征,对其结构及性质进行了初步的研究。 【关键词】咪唑;酸性离子液体;FT-IR 0 概述 离子液体,是由一系列杂环阳离子和多种阴离子组合而成[1]。在电化学业、重金属离子提取、相转变催化、重合、增溶作用以及在酶反应中做低挥发的有机溶剂等领域有着潜在的商业应用[2]。离子液体虽然为离子组成,但其组成可调变,故称为“设计溶剂”(designed solvents)。采用一步合成法制备离子液体,操作简便,没有副产物,产品易分离,纯化[3-4]。离子液体可用波谱学、物理学方法和电化学等手段对其进行表征。通过IR图谱的分析,可以证实产物(特别是阳离子部分)是否正确[5]。本文合成三种咪唑类离子液体[Hmim]CH3COO、[Hmim]H2PO4、[Hmim]C4H7O2,并采用光谱法对其结构及性质进行了初步的研究。 1 实验部分 1.1 试剂 N-甲基咪唑(wt≥98%,浙江省宁海市凯乐化工公司)、冰醋酸(化学纯,上海凌峰化学试剂有限公司)、磷酸(分析纯,国药集团化学试剂有限公司)、正丁(分析纯,上海化学试剂有限公司)等。 1.2 离子液体催化剂制备 [Hmim]CH3COO的制备 称量摩尔比为1:1的N-甲基咪唑8.21g和醋酸6.01g于250ml三口烧瓶中,加入少量水作溶剂,旋转搅拌,将温度控制在80℃,反应进行6h,得到淡黄色液体。将得到的淡黄色液体进行减压蒸馏,控制减压蒸馏的真空度为0.07MPa,顶部温度为92℃,蒸馏时间为3h,即得到咪唑醋酸盐离子液体[Hmim]CH3COO。 [Hmim]C4H7O2的制备 称量摩尔比为1:1的N-甲基咪唑8.21g和正丁酸8.82g于250ml三口烧瓶中,加入少量水作溶剂,加热并搅拌,反应温度控制在80℃,反应7h,得到黄色液体。将得到的液体进行减压蒸馏,控制真空度为0.05MPa,顶部温度为75℃
1、1-磺酸丙基-3-甲基咪唑硫酸氢盐[HSO3-pmim]HSO4的合成 第一步,合成离子液体中间体1–磺酸丙基–3–甲基咪唑盐[MIM–PS]。取等物质的量的N–甲基咪唑和1,3–丙烷磺内酯于三口烧瓶中,磁力搅拌使其充分混合,温度缓慢升到40℃,反应体系在该温度下,磁力搅拌反应48h。反应结束后,得到白色沉淀,用乙酸乙酯洗涤3次,旋蒸除去有机溶剂,产物在真空干燥箱里干燥至恒重,即得离子液体中间体1–磺酸丙基–3–甲基咪唑盐[MIM–PS]。 第二步,取等物质的量的离子液体中间体[MIM–PS]和浓硫酸于三口烧瓶中,磁力搅拌使其充分混合,温度缓慢升到80℃,恒温条件下不断磁力搅拌反应6 h。反应结束后,用乙酸乙酯洗涤3次,旋蒸除去有机溶剂,产物转移到真空干燥箱里干燥,即得目标离子液体[HSO3-pmim]HSO4。 2、2-吡咯烷酮硫酸氢盐[Hnhp]HSO4的合成 在圆底烧瓶中加入2-吡咯烷酮,冰浴下滴加等摩尔量的浓硫酸,室温搅拌反应24 h。然后用乙酸乙酯洗涤,旋转蒸发、真空(0.01MPa)干燥后即得淡黄色透明粘稠离子液体[Hnhp]HSO4。 3、1-甲基-2-吡咯烷酮硫酸氢盐[Hnmp]HSO4的合成 在圆底烧瓶中加入1 -甲基-2-吡咯烷酮,冰浴下滴加等摩尔量的浓硫酸,室温搅拌反应24 h。然后用乙酸乙酯洗涤,旋转蒸发、真空(0.01MPa)干燥后即得淡黄色透明粘稠离子液体[Hnmp]HSO4。 4、1-甲基咪唑硫酸氢盐[Hmim]HSO4的合成 在圆底烧瓶中加入1-甲基咪唑,冰浴下滴加等摩尔量的浓硫酸,室温搅拌反应24 h。然后用乙酸乙酯洗涤,旋转蒸发、真空(0.01MPa)干燥后即得淡黄色透明粘稠离子液体[Hmim]HSO4。 5、1-( 3-磺酸基) -丙基-2-甲基吡咯烷酮硫酸氢盐 在三口烧瓶中加入等摩尔量的2-吡咯烷酮和1,3-丙烷磺内酯,以无水乙醚为溶剂,磁力搅拌20 h,过滤,甲醇洗涤,真空干燥即得白色固体粉末离子液体前体。于三口烧瓶中加入离子液体前体,滴加等摩尔量的浓硫酸,80℃下磁力搅拌8h,然后用乙酸乙酯洗涤,80℃真空干燥后即得黄褐色粘稠离子液[C3SO3Hnhp] HSO4。 6、正丁基吡啶硫酸氢盐离子液体[BPy]HSO4的制备 将吡啶和溴丁烷按照摩尔比1:1.2加入三口烧瓶中,持续氮气保护,室温磁力搅拌1-2 d,直到无色液体转化成白色固体。提纯、真空干燥,获得溴丁基吡啶离子液体中间体。 将中间体置于三口烧瓶中,逐滴加入等物质量的浓硫酸,室温下磁力搅拌,通氮气带出反应产生的溴化氢气体,反应6 h得到粘稠的液体。提纯、真空干燥,得到正丁基吡啶硫酸氢盐离子液体[BPy]HSO4。 7、乙基三乙胺硫酸氢盐离子液体[ETEA]HSO4的制备 将三乙胺和溴乙烷按照摩尔比1:1.2加入三口烧瓶中,氮气气氛下,密封加热到60℃,搅拌2-3 d,直到无色液体转化成白色固体。提纯、真空干燥获得溴代乙基三乙胺离子液体中间体。 将中间体置于三口烧瓶中,逐滴加入等物质量的浓硫酸,室温下磁力搅拌,通氮气带出反应产生的溴化氢气体,反应6 h得到粘稠的液体。提纯、真空干燥,得到乙基三乙胺硫酸氢盐离子液体[ETEA]HSO4。 8、吡啶硫酸氢盐离子液体[Py]HSO4的制备
2003年 4 月The Chinese Journal of Process Engineering Apr. 2003 离子液体的性质及其在催化反应中的应用 王均凤1,2,张锁江1,陈慧萍1,李闲1,张密林2 (1. 中国科学院过程工程研究所, 北京 100080; 2. 哈尔滨工程大学化学工程系, 黑龙江哈尔滨 150001) 摘要:在对离子液体的国内外研究现状综合分析的基础上, 对离子液体的结构–性能关系和性质 变化规律进行了探讨, 系统地介绍了离子液体作为溶剂或催化剂在催化反应中的应用, 特别是在 金属催化、生物催化、反应–分离耦合方面的进展. 在含微量水或无水离子液体中酶能够保持高的 活性和选择性,有望在生物催化方面带来突破性进展. 超临界CO2/离子液体及离子液体/水/有机相 提供了一种新的反应–分离耦合模式, 将进一步推动绿色化学的发展. 关键词:离子液体;绿色溶剂;性质;催化反应;超临界流体 中图分类号:O645.13 文献标识码:A 文章编号:1009–606X(2003)02–0177–09 1 前言 室温离子液体[1]是由有机阳离子和无机或有机阴离子构成的、在室温或室温附近温度下呈液体状态的盐类, 以下简称离子液体. 它是从传统的高温熔盐演变而来的,但与一般的离子化合物有着非常不同的性质和行为,最大的区别在于一般离子化合物只有在高温状态下才能变成液态,而离子液体在室温附近很大的温度范围内均为液态,最低凝固点可达–96o C[2]. 与传统的有机溶剂相比,离子液体具有如下特点:(1) 液体状态温度范围宽,从低于或接近室温到300o C, 且具有良好的物理和化学稳定性;(2) 蒸汽压低,不易挥发,消除了VOC(V olatile Organic Compounds)环境污染问题;(3) 对大量的无机和有机物质都表现出良好的溶解能力, 且具有溶剂和催化剂的双重功能, 可作为许多化学反应溶剂或催化活性载体;(4) 具有较大的极性可调控性, 粘度低, 密度大, 可以形成二相或多相体系, 适合作分离溶剂或构成反应–分离耦合新体系. 由于离子液体的这些特殊性质和表现,它被认为与超临界CO2和双水相一起构成三大绿色溶剂,具有广阔的应用前景. 早在1914年,Walden [3]就由乙胺和浓缩的硝酸反应合成出乙基硝酸铵(熔点为12o C),但在当时这一发现并没有引起普遍的关注. 20世纪40年代, Hurley等[4]在寻找一种温和条件电解Al2O3时把N–甲基吡啶加入AlCl3中,两固体的混合物在加热后变成了无色透明的液体,这一偶然发现构成了今天所说的离子液体的原型. 随后又先后合成了一些高温或低温的氯化物有机离子盐,但它们的共同缺点就是遇水反应生成腐蚀性的HCl. 所以人们一直在试图探寻一种稳定的离子液体. 直到1992年,Wilkes[5]领导的研究小组合成了一系列由咪唑阳离子与[BF4–], [PF6–]阴离子构成的对水和空气都很稳定的离子液体. 此后,大量的由不同有机阳离子和无机阴离子构成的离子液体才得以合成, 并随着绿色化学概念的提出, 在全世界范围内逐渐形成了离子液体研究的热潮. 北大西洋公约组织(NATO)于2000年召开了有关离子液体的会议[6];欧盟制定了离子液体的研究计划[7];日本有关离子液体的研究也很活跃[8], 正在酝酿建立产学研联合研究体制. 在我国, 中国科学院兰州化学物理研究所、中国科学院过程工程研究所、北京大学、中国科技大学、华东师范大学、北 收稿日期:2003–01–20, 修回日期:2003–02–24 基金项目:国家重点自然科学基金资助项目(编号: 20276073); 中国科学院多相反应实验室基金资助项目 作者简介:王均凤(1974–),女,山东省日照市人,硕士研究生,绿色化学与技术专业.
第28卷第4期2009年7月 大连工业大学学报 Journal of Dalian Polytechnic U niversity Vol.28No.4J ul.2009 文章编号:167421404(2009)0420271203 负载离子液体催化剂制备及催化性能的研究 任俊毅1, 王少君1, 成卫国2, 孙 剑2, 张锁江2 (1.大连工业大学化工与材料学院,辽宁大连 116034;2.中国科学院过程工程研究所,北京 100190) 摘要:采用MCM 241为载体,通过化学法合成了5种负载咪唑类离子液体催化剂,考察了在环状碳酸 丙烯酯合成中的催化作用,考察了溴代烷烃中碳链的长短及羟基官能团对催化剂催化性能的影响。结果表明,在115℃、2.0MPa 、4h 条件下,环状碳酸丙烯酯产率为89.9%,选择性为99.5%。 关键词:离子液体;碳酸丙烯酯;环氧丙烷;固载中图分类号:TQ032.41文献标志码:A Preparation and characteristics of catalyst of ionic liquid RE N J un 2yi 1, WANG Shao 2jun 1,CHE NG Wei 2guo 2, SUN Jian 2, ZH ANG Suo 2jiang 2 (1.School of Chemistry Engineering &Material ,Dalian Polytechnic University ,Dalian 116034,China ;2.Institute of Proce ss Engineering ,Chine se Academy of Science s ,Beijing 100190,China ) Abstract :Five ionic liquids (IL s )supported on MCM 241were prepared and t heir performances for t he synt hesis of p ropylene carbonate from CO 2and p ropylene oxide were investigated.The activity of catalyst is related wit h t he lengt h of alkyl and hydroxyl f unctional group.The yield and t he selectivity of PC is 89.5%and 99.5%respectively at 115℃and 2.0MPa for 4h. K ey w ords :ionic liquid ;prop ylene carbonate ;MCM 241;p ropylene carbonate ;immobilization 收稿日期:2008210210. 基金项目:国家高技术研究发展计划(“863”计划)项目(2006AA062317). 作者简介:任俊毅(19772),男,硕士研究生;通信作者:王少君(19562),男,教授,E 2mail :wgsoju @https://www.doczj.com/doc/d05661389.html,. 0 引 言 碳酸丙烯酯是一种多用途的重要化工产品,可作为惰性溶剂,聚丙烯腈纤维的原材料,燃料、润滑油、液压机液体的添加剂,在制药工业和聚合物合成工业方面也有一定的重要作用。目前,主要通过环氧丙烷和二氧化碳催化制备碳酸丙烯酯,所用催化剂主要分为均相催化剂和异相催化剂,均相催化又分为单一催化剂和复合催化剂。例如,均相催化 剂包括离子液体[1](BMImBF 4)、金属酞菁[2](PcAlCl )、金属氧化物[3](MgO 、ZnO )、金属氧卤化 物[4](SmOCl )、配合物[5]等,这些属于单一均相催化;复合催化剂包括四叔丁基酞菁铁/三正丁胺或 三乙胺[6]、 (2,22Bipy )RuCl 3(CH 3O H )/十六烷基三甲基氯化铵[7]、P 2W 17Co/n 2Bu 4NBr [8]等。这些催化剂的缺点主要是反应温度高、时间长、压力大、分离困难,并且有些催化剂对环境敏感,容易失效。 异相催化剂主要有纤维素固载季铵盐(CS 2N +Me 3C1-)[5,9]、有机碱固载在 SiO 2 上 (N HCH 2CH 2N H 2/SiO 2)[10]、金属氧化物固载在载 体上[1](MgO/Al 2O 3、ZnO/SiO 2),杂多酸固载在载体上[11](PW 12O 40/ZrO 2)、金属卤化物固载在载体上[1](KI/ZnO 、KI/γ2Al 2O 3)等。这些催化剂克服了催化剂分离的困难,但是还存在反应温度高、压力大、时间长等问题。本文利用化学法制备负载型离子液体催化剂,通过催化环氧丙烷和二氧化碳进行合成碳酸丙烯酯测试其催化性能,考察了反应温度、反应时间、反应压力对反应的影响。 1 实 验 1.1 主要试剂 32氯丙基三乙氧基硅烷;正硅酸乙酯;乙醇; 盐酸(36%~38%);咪唑;溴代十六烷基吡啶;溴
离子液体结构性质以及其制备方法 在室温或者在接近室温的环境中,由阴阳离子构成的呈液体状态的熔融盐叫做离子液体,这种液体具有很多优点,比如热稳定性高、熔点低、电化学窗口宽、蒸汽压低等,所以它的应用领域也十分广泛,比如有机反应、电化学[30]、材料制备[31]、分离和萃取领域等。 1.4.1 离子液体的合成 因为我们需要使用的离子液体是由阴阳两种离子构成的,那么就可以通过改变阴阳这两种离子去组成成不同的离子液体。要合成离子液体,一般情况下有两种办法。第一种是两步合成,第二种是直接合成。 (1)直接合成法 直接合成法是一种一步合成离子液体的方法。它通过季铵化反应或者酸碱中和反应来实现。此方法具有成本低,操作简单没有副产品并且产品是已纯化的优点。我们将硝酸和乙胺的水溶液通过中和反应就能够得到硝基乙胺离子液体。具体操作步骤是:将反应后的硝酸和乙胺水溶液在真空中去除水分,然后让离子液体保持纯净状态并溶解于四氢呋喃或者乙腈等此类有机溶剂里面,然后用活性炭进行处理并且在真空中进行纯化,进而将多余的有机溶剂去除掉,最后就可以得到纯净的离子溶液。Hirao 等最近就采用直接合成法制作了一批阳离子不同的四氟硼酸盐离子液体。当然其它类型的离子液体也可以通过季铵化反应来制造。 1.4.2离子液体的应用领域 因为离子液体性质和结构的原因,它的应用范围主要在这三个方面:电化学、分离过程和聚合物的改性上。 (1)分离过程的应用 因为溶剂溶质成分十分复杂,那么对溶液溶质进行分离和提纯则一直是一个
化学难题。具有亲水性要求的就只能在水中进行提纯,挥发性不好的则最好不要采用蒸馏分离法,同时很大一部分的有机溶剂都对环境不利,会导致环境污染。因为这种液体的独特的特点,加上上面提到的可以组合的阴阳离子,那么就非常适合将其作为分离和提纯的溶剂。来自Alabama 大学(美国)的Rogers 小组就甲苯、苯胺、苯甲酸、氯苯(苯的衍生物)在bmim这种离子液体中和水相的分配系数进行了观察。这种液体不会在分离过程中造成损失,因为这种液体不具备挥发性也不溶于水,所以可以重复利用。更重要的是,这种液体还对环境特别友好,是一个非常环保的绿色溶剂。 (2)电化学 完全由阴阳离子组成的离子液体是一种液态电解质。这种电解质具有不挥发、不燃、导电和电化学窗口大的特点,因此可以降低自放电。上述特点也使得离子液体的应用前景广泛,使用领域包括电容器、电沉积、电池、晶体管等方面。在研发的DIME 电池中,Wilkes 等人添加使用了阳离子如[emim]+、[epmim]+,阴离子如BF4-、PF6-、AlCl4-、CF3SO3-的离子液体。而Bonh 等则在太阳电池中加入了离子液体作为电解质进行研究。因为离子液体具有粘度低、化学窗口宽、蒸气压极低、水氧中化学稳定和热稳定性好、导电性高等一系列优点,所以Bonh 等就研发了很多稳定性高并且适合长期操作的离子液体。 (3)聚合物中的应用 制备及填充:因为在300℃至室温的环境中大多数的离子液体都是以液体的方式存在,并且在这种情况下,它的热稳定性高,蒸气压又低,所以使得离子液体能够参与复合材料的共用和纳米材料的制备[33-37]。同时,如果将离子液体添加到聚合物中,还可以起到增塑剂作用。非共价改性:就是一种存在咪唑环的咪唑类离子液体,这种液体可以让石墨烯和碳纳米管表面的π电子跟阳离子-π 或π-π 形式发生作用,以此来帮助石墨烯和碳纳米管的分散,进而防止他们发生团聚,从而影响性能。另外,石墨烯的和碳纳米管的结构并不会被非共价改性破坏,所以上述效果会更好。 共价改性[38-43]:通过利用离子液体对石墨烯材料和碳纳米管进行共价改性,就可以让他们在水中以及有机溶剂中的分散性得到增强。比如我们可以通过改变
离子液体的应用综述大全 摘要:离子液体作为环境友好、“可设计性”溶剂正越来越多地受到关注。已有的研究表明,离子液体具有独特的性能并有着十分广阔的应用前景。该文在介绍离子液体特性的基础上,综述了其在有机合成、聚合反应、电化学、分离过程、新材料制备、生物技术等方面的应用。关键词:离子液体;绿色溶剂;有机合成;聚合反应;电化学;分离过程 离子液体是在室温或室温附近呈液态的由离子构成的物质,具有呈液态的温度区间大、溶解范围广、没有显著的蒸气压、良好的稳定性、极性较强且酸性可调、电化学窗口宽等许多优点,因此,它是继超临界CO2后的又一种极具吸引力的绿色溶剂,是传统挥发性溶剂的理想替代品。 离子液体的阳离子和阴离子可以有多种形式,可设计成为带有特定末端或具有一系列特定性质的基团。因此,离子液体也被称为“designer solvents”,这就意味着它的性质可以通过对阳离子修饰或改变阴离子来进行调节,像熔点、黏性、密度、疏水性等性质,均可以通过改变离子的结构而予以改变[1]。因此,它不仅作为绿色溶剂在分离过程、电化学、有机合成、聚合反应等方面有着十分广阔的应用前景,而且由于其独特的物理化学性质及性能,有望作为新型功能材料使用,是近年来国内外精细化工研究开发的热点领域。 1、在化学反应中的应用 以离子液体作为化学反应的介质,为化学反应提供了不同于传统分子溶剂的环境,有可能通过改变反应机理而使催化剂活性、稳定性更好,转化率、选择性更高。离子液体种类多,选择范围宽,将催化剂溶于离子液体中,与离子液体一起循环利用,催化剂兼有均相催化效率高、多相催化易分离的优点。同时离子液体无蒸气压,液相温度范围宽,产物可通过倾析、萃取、蒸馏等简单的方法分离出来。 1.1在有机合成中的应用 离子液体[EtNH3] [NO3]最先应用于环戊二烯与丙烯酸甲酯和甲基酮的Diels2Alder反应,结果表明:离子液体的种类和组成对内、外旋产物的比例影响较大,与丙酮等非极性分子溶剂相比,离子液体体系中反应速率更快,内旋产物的选择性更高,为解决对水敏感的Diels2Alder 反应提供了一个良好的溶剂环境。Abbott等人的研究也表明在离子液体进行的Diels2Alder 反应有很好的立体选择性[2]。Howarth等人以Pd(OAc)2/PPh3为催化剂,分别在传统溶剂DMF 和离子液体[bmim]PF6中进行了一系列的卤代苯与甲基丙烯酸酯之间的Heck反应[3],发现离子液体的使用不仅使产率大大提高,而且有效地防止了催化剂的还原失活,溶剂和催化剂可重复使用。Admas等人在离子液体[ emim]Cl2AlCl3中研究了苯的衍生物如甲苯、氯苯、甲氧基苯等的Friedel2Crafts反应,产率等于用分子溶剂的最好文献值,产物选择性很好。离子液体在其他反应如催化Bigineli反应、羰基化反应、酯化反应、异构化[4]、Knoevenagal和Ronbinson 关环反应、氧化还原反应[5]、有机金属反应[6]、烯烃的选择氢化[7]、区域选择烷基化[8]等反应中都得到了广泛的应用。 邓友全等人[9]用离子液体负载碱性催化剂催化活化CO2,与胺类化合物反应,制备了二取代脲及异氰酸酯,以无毒的温室气体CO2为羰化剂取代光气和一氧化碳等剧毒羰化剂,使生产过程成为安全的“绿色过程”,并且为CO2的利用提供了新的途径,有利于减少温室效应,保护环境。同时,由于离子液体可以重复使用,将有可能降低异氰酸酯的生产成本。他们在离子液体[BuPy] [PF4]中以五氯化磷为催化剂实现了环己酮肟的Beckmann重排,有很好的转化率和选择性,解决了工业生产已内酰胺使用发烟硫酸造成的设备腐蚀、环境污染等问题。 1.2在聚合反应中的应用 由于阴离子为AlCl4-, PF6-或BF4-的离子液体与过渡金属具有弱配位作用,此类离子液体
咪唑离子液体 离子液体是由阴阳离子组成,其中阳离子有几种类型,主要部分是咪唑环的则称为咪唑类离子液体,如图为1,3-二甲基咪唑阳离子,侧链可以是不同碳链的,也可以是1,2,3三取代的,这些阳离子组成的离子液体都称为咪唑类离子液体 根据离子液体的酸碱性可把离子液体分为Lewis酸性、Lewis碱性、Br?nsted酸性、Br?nsted 碱性和中性离子液体。广义的酸性离子液体就是指可以提供质子或者得到电子的离子液体 反应类型 1934年,英国曼彻斯特Bragg研究小组的年轻物理学者J. F. Keggin在实验室中合成出H3 PW12O40 ·5H2O,他把该物质粉末的X射线衍射实验的结果与计算值进行比较,提出了具有划时代意义的Keggin结构模型(1: 12系列A型) 。40年后,即1974年,再次测定证明Keggin结构是正确的。1953年,Dawson首次用X射线衍射法测定了K6 [ P2W18O60 ] ·14H2O的结构,结果表明其为三斜晶系。Strandbery在对Na6 [ P2Mo18O60 ] ·24H2O的结构进行测定后指出: Na6 [ P2Mo18O60 ] ·24H2O和K6 [ P2W18O60 ] ·14H2O具有相同的结构构型。此后一些有关2: 1868系列杂多化合物的结构相继被测定出来,它们都具有与K6 [ P2W18O60 ] ·14H2O相类似的骨架。后人为纪念Dawson,称2: 18系列杂多化合物为Dawson结构杂多化合物。早在1937年, J. A.Anderson就已经推测出1: 6型杂多化合物的结构,如: [ IMo6O24 ]6 - ,其中 I( Ⅶ) :Mo = 1: 6,但直到1974年才被最终确定下来,故称1: 6系列杂多化合物为Anderson结构杂多化合物,但第一个真正的Anderson结构化合物被认为是1948 年Evans报[ FeMo6O24 ]6 - 。1953 年,Wangh首次合成了(NH4 ) 6 [XMo9O12 ] (X =Ni4 + ,Mn4 + ) ; 1960年B rown. D. H 报道了1: 9BeW9的合成;上世纪70年代以后,相继合成了以P、Si、As为杂原子的钼的杂多化合物和以P、Si、As、Ge、Sb为杂原子的钨的杂多化合物,后人称此类化合物为Wangh结构( 1: 9系列)杂多化合物。此外还有Silverton (1: 12系列B型)结构,它们与Keggin、Dawson、Anderson以及同多酸的Lindqvist结构(M6O19结构)一起被称为多酸的6种基本结构[ 2 ] 。由于多酸化合物中原子数目较多,结构复杂,传统的描述方法是把它们的结构看成是以金 属为中心的MOn多面体通过共有角氧和边氧形成的组合。由于受测试手段的限制,到1971年,能够进行结构解析的多酸晶体只有14种(其中单晶12种) 。从20世纪80年代开始,随着四圆X射线衍射仪的普及,迄今已确定了100多种多酸结构,其中Keggin结构和Dawson结构是两种常见的基本结构[ 4 ] 。 (1) Keggin结构(1: 12系列A型)具有Keggin结构的杂多阴离子结构通式为[ XM12 O40 ]n - (X = P、Si、Ge、As等,M =Mo、W) 。四面体的XO4位于分子结构的中心,相互共用角氧和边氧的12 个八面体MO6包围着XO4。Keggin结构杂多阴离子共有α、β、γ、δ和ε型5种异构体(2) Dawson结构(2: 18系列)
配合物的合成方式——离子液体合成法 1离子液体 离子液体是由阳离子和阴离子组成的在室温或近于室温下呈液态的盐类,它不燃烧、导电性好、热稳定性较高,在很宽的温度范围内处于液态,它能溶解许多有机物和无机物,并可循环使用,是一种新型的溶剂体系。离子液体不挥发,蒸汽压基本为零,被称为环境友好的绿色溶剂,可以取代许多化学反应中使用的挥发性有机物。更为重要的是,组成离子液体的阴、阳离子可以根据利用者的需要或为具有某种特种性质而设计,所以离子液体也被一些化学家称为“设计者溶液”;至今,人工合成的离子液体大约有100多种,而且新型的离子液体不断地被合成出来,种类的多样化可以满足材料制备的优化和控制的不同需要。由于其独特性质和环境友好特性,离子液体在有机化学反应、分离以及电化学领域的应用己经广泛研究。 离子液体作为离子化合物,它一般由有机阳离子和无机阴离子组成,当前研究的离子液体的正离子有4类:烷基季铵离子、烷基季膦离子、1, 3 -二烷基取代的咪唑离子、N - 烷基取代的吡啶离子。阴离子有卤素离子、四氟硼酸根离子、六氟磷酸根离子等。研究的离子液体中,阳离子主要以咪唑阳离子为主,阴离子主要以卤素离子和其它无机酸离子(如四氟硼酸根等)为主。 根据负离子的不同可将离子液体分为两大类:一类是卤化盐。其制备方法是将固体的卤化盐与AlCl3混合即可得液态的离子液体,但因放热量大,通常可交替将2种固体一点一点地加入已制好的同种离子液体中以利于散热。此类离子液体被研究得较早,对以其为溶剂的化学反应研究也较多。此类离子液体具有离子液体的许多优点,其缺点是对水极其敏感,要完全在真空或惰性气氛下进行处理和应用,质子和氧化物杂质的存在对在该类离子液体中进行的化学反应有决定性的影响。此外因AlCl3遇水会放出HCl,对皮肤有刺激作用。 另一类离子液体,也被称为新离子液体。这类离子液体不同于AlCl3离子液体,其组成是固定的,而且其中许多品种对水、对空气稳定,因此近几年取得惊人进展。其正离子
离子液体作为催化剂在傅克烷基化反应中的应用进展 摘要:离子液体由于具有特殊的性质,包括挥发性低,极性大,良好的热稳定性,通过调整阴阳离子具有不同的溶解性等特点,已经作为绿色催化剂应用于傅克烷基化反应。与传统催化剂反应相比,离子液体后处理简单且回收后可多次重复使用。本文综述了离子液体作为催化剂在傅克烷基化反应中最新研究成果。 关键词:氯铝酸盐离子液体;功能化离子液体;傅克烷基化反应 Progress of ionic liquids catalyzing in Friedel-Crafts alkylation reactions Abstract: Ionic liquids have special properties, including low volatility, big polarity, good thermal stability, with different solubilities by adjusting ions, and has been used as a green catalyst for Friedel-Crafts alkylation reaction. Compared with the conventional catalyst, the ionic liquids are simple post-processing, recovered and can be used repeatedly. This paper reviews latest research results of the ionic liquids as a catalyst in the Friedel-Crafts alkylation. Key words:Chlorine aluminate ionic liquids; functional ionic liquids; Friedel-Crafts alkylation reaction 引言 离子液体,又称为室温离子液体、室温熔融盐(熔点一般<100 ℃),是由有机阳离子和无机或有机阴离子构成的在室温或近室温下呈液态的盐类化合物。具有熔点低、不易挥发、热稳定性和化学稳定性高、对部分无机盐具有很强的溶解能力、液态温度范围宽及电化学窗口较宽等优良特性,其物理、化学性质可以通过改变阴阳离子的结构来实现,即具有结构可调性,且易于循环使用。近年来在精细有机合成等方面应用广泛。 Friedel-Crafts反应是有机合成中经典的对芳环上进行衍生的反应,包括烷基化和酰基化反应。烷基化反应一般指芳烃的反应。通常,Friedel-Crafts烷基化反应所用溶剂为石油醚、苯、氯苯等有机溶剂,在Lewis酸或Br?nsted酸的催化下进行反应,这些烷基化反应技术比较成熟并且已经工业化,目前工业上仍普遍使用AlC13等传统均相催化剂。但传统的烷基化反应,无论从催化剂还是到终产物都会产生酸性气体HCl,不仅使得反应的原子经济性低,而且严重腐蚀设备、污染环境,催化剂也会大量消耗、难以回收。从根源上使烷基化反应绿色化的工艺开发具有重要的理论和现实意义。 1 氯铝酸盐离子液体 以Lewis酸型离子液体氯铝酸离子液体([Et3NH]Cl-AlCl3)为催化剂[1,2],催化苯与氯乙烷烷基化反应合成乙苯,间歇式反应的苯转化率和乙苯选择性均高于间歇式反应,半间歇式反应的苯转化率可达到9.48 %,乙苯选择性为93.65 %;[Et3NH]Cl-AlCl3的催化活性明显高于AlCl3。[bmim]Br-AlCl3对苯与环己烯的Friedel-Crafts烷基化反应[3],己基苯收率达到为86.75%。 谢方明等[4]以异丙醇与HCl反应生成的2-氯丙烷作为烷基化剂,[Et3NH]Cl?2AlCl3离子液体催化作用下制备异丙苯,研究了Lewis酸离子液体催化苯与2-氯丙烷进行烷基化反应,苯转化率为29.38%,