
第28卷 第6期
2009年 11月环 境 化 学ENV I RONME NT AL CHE M I ST RY Vol .28,No .6November 2009
2009年4月3日收稿.
3通讯联系人,E 2mail:jl5chen@nju 1edu 1cn B i 2M o O 6可见光催化去除4BS 染料实验研究
陈 亚 陈建林3
姚三丽 周 懿 许岳泰
(南京大学环境学院,污染控制与资源化研究国家重点实验室,南京,210093)摘 要 以B i (NO 3)3?5H 2O 和(NH 4)6Mo 7O 24?4H 2O 为原料,采用预超声2水热法合成可见光催化剂B i 2MoO 6,考察了在可见光催化条件下,催化剂的用量、污染物初始浓度、溶液pH 值等因素对偶氮染料直接耐酸大红4BS 去除效果的影响1结果表明,4BS 溶液初始浓度为20mg ?l -1、原始pH 值6190条件下,催化剂的最佳投加量为2g ?l -1,光照60m in 后,4BS 去除率达到9217%;在实验浓度20—100mg ?l -1的范围内,催化剂投加量为210g ?l -1,光照210m in 后染料去除量最大可达到约50mg ?l -1,溶液在弱酸或弱碱性条件下脱色较为稳定,在强酸或强碱性条件下脱色较快,效果明显;催化剂重复使用前后结构和成分稳定,但光催化活性有所下降1
关键词 B i 2MoO 6,预超声2水热合成,光催化,4BS .
染料行业是我国工业废水排污大户,由于染料分子中存在芳香族化合物,化学稳定性高,难以生物降解,传统的生化处理方法效率不高,而半导体光催化技术作为一种新型的环境污染物削减技术,
在偶氮染料废水处理上已引起广泛关注[1]1在新型的光催化剂中,含铋可见光催化剂由于具有较高的
可见光催化活性,越来越受到研究学者的关注1研究表明,B i 元素的B i6s 轨道能和O2p 轨道杂交,
使催化剂的价带电位升高,减小禁带宽度,从而提高催化剂的可见光催化活性[2,3]1
本文采用预超声2水热法合成可见光催化剂B i 2Mo O 6,目标污染物为偶氮染料直接耐酸大红4BS,分子式为C 35H 25N 7O 10S 2?2Na,相对分子质量为790169,研究了催化剂的用量、污染物初始浓度、溶液pH 值等因素对可见光催化脱色效果的影响,从而证明预超声2水热合成的催化剂B i 2MoO 6具有良好的可见光催化活性,以期为可见光催化技术在处理难降解染料废水中的推广应用提供实验依据11 实验部分
111 B i 2MoO 6催化剂的制备及表征
分别称取一定量的B i (NO 3)3?5H 2O 和(NH 4)6Mo 7O 24?4H 2O 固体,溶于去离子水中,室温磁力搅拌30m in,将烧杯置于超声波发生器中均化后,移入聚四氟乙烯反应罐中,置于不锈钢水热反应釜中,密封后放入烘箱中水热反应,从烘箱中取出反应釜冷却至室温,过滤得到淡黄色沉淀,用蒸馏水反复洗涤,80℃恒温干燥后用玛瑙研钵研细后备用1
采用X ’TRA 型旋转阳极X 射线仪(瑞士ARL 公司)测定合成的B i 2MoO 6固体粉末的晶型和平均粒径;用XL30ESE M 扫描电镜(PH I L I PS 公司)观察其外观形貌;用UV 22401PC 型紫外2可见扫描仪(SH I M ADZ U 公司)测定其紫外2可见漫反射光谱;用M icr omeritics AS AP2020测定仪测定催化剂BET 比表面积1
112 光催化去除4BS 染料实验
在自制的夹套式光催化反应器(容积500m l 的烧杯状容器,玻璃材质带夹层,可通冷却水)中加入一定体积的20mg ?l -1
的4BS 溶液和一定量的催化剂,避光磁力搅拌30m in 后光照,通冷却水,日光色镝灯主波长为560n m ,功率400W ,光源和液面的垂直距离约为15c m 1隔一定时间取5m l 样品,
用0122μm 滤膜过滤除去里面悬浮的催化剂颗粒,以UV 2V is 分光光度计于504nm 处测定样品的吸光度值1根据浓度(C )2吸光度(A )曲线确定样品浓度,计算染料浓度去除率1
810 环 境 化 学28卷2 结果与讨论
211 催化剂的合成
参照本实验组姚三丽的专利(申请号20081002341117,专利名称《一种可见光催化剂B i 2MoO 6的
合成方法》)采用预超声2水热合成法(UHT )合成B i 2MoO 6催化剂粉末1催化剂粉末呈无规则的颗粒
状,分散比较均匀,约为80—150nm ,部分颗粒结集在一起,形成大颗粒1B i 2MoO 6催化剂平均粒径为3114nm ,吸收边带达到480n m 左右,能隙禁带宽为2177e V 1
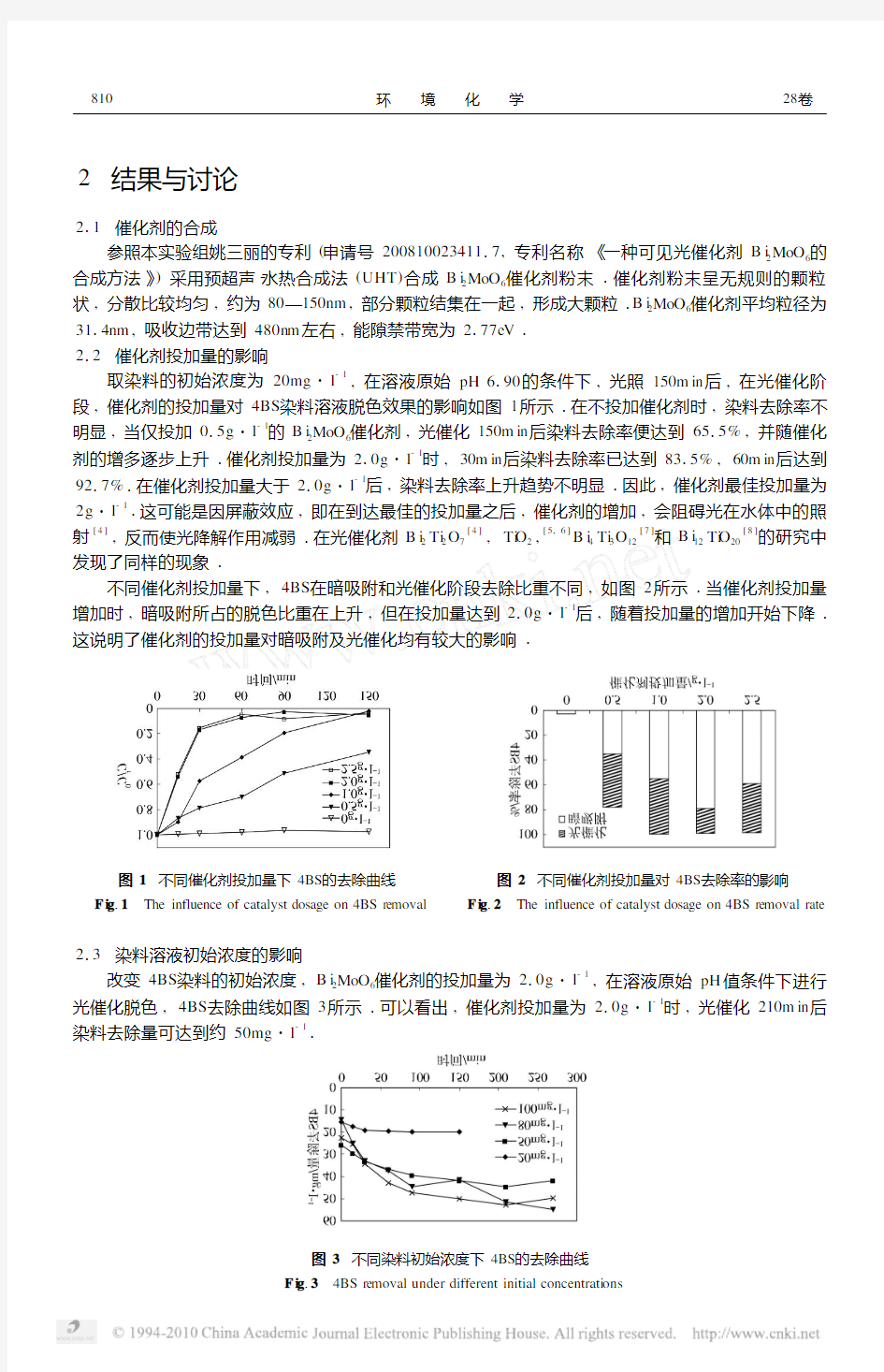
212 催化剂投加量的影响
取染料的初始浓度为20mg ?l -1
,在溶液原始pH 6190的条件下,光照150m in 后,在光催化阶段,催化剂的投加量对4BS 染料溶液脱色效果的影响如图1所示1在不投加催化剂时,染料去除率不
明显,当仅投加015g ?l -1的B i 2MoO 6催化剂,光催化150m in 后染料去除率便达到6515%,并随催化
剂的增多逐步上升1催化剂投加量为210g ?l -1时,30m in 后染料去除率已达到8315%,60m in 后达到
9217%1在催化剂投加量大于210g ?l -1后,染料去除率上升趋势不明显1因此,催化剂最佳投加量为
2g ?l -11这可能是因屏蔽效应,即在到达最佳的投加量之后,催化剂的增加,会阻碍光在水体中的照
射[4],反而使光降解作用减弱1在光催化剂B i 2Ti 2O 7[4],Ti O 2,[5,6]B i 4Ti 3O 12[7]和B i 12Ti O 20[8]的研究中发现了同样的现象1
不同催化剂投加量下,4BS 在暗吸附和光催化阶段去除比重不同,如图2所示1当催化剂投加量
增加时,暗吸附所占的脱色比重在上升,但在投加量达到210g ?l -1后,随着投加量的增加开始下降1
这说明了催化剂的投加量对暗吸附及光催化均有较大的影响1
图1 不同催化剂投加量下4BS 的去除曲线
F i g 11 The influence of catalyst dosage on 4BS re moval 图2 不同催化剂投加量对4BS 去除率的影响F i g 12 The influence of catalyst dosage on 4BS re moval rate 213 染料溶液初始浓度的影响
改变4BS 染料的初始浓度,B i 2MoO 6催化剂的投加量为210g ?l -1
,在溶液原始pH 值条件下进行光催化脱色,4BS 去除曲线如图3所示1可以看出,催化剂投加量为210g ?l -1时,光催化210m in 后染料去除量可达到约50mg ?l -11
图3 不同染料初始浓度下4BS 的去除曲线
F i g 13 4BS re moval under different initial concentrati ons
6期陈亚等:B i
2MoO6可见光催化去除4BS染料实验研究811
214 染料溶液pH值的影响
染料4BS的初始浓度为20mg?l-1,调节溶液pH值分别为2104,4102,6190,7174,811,
10111和11101,B i2MoO6催化剂的投加量为015g?l-1,在光催化阶段染料的去除率如图4所示.溶液初始pH在4102—8110之间时,B i
2
MoO6催化剂在光催化下对4BS染料的去除率变化不大,脱色效果较为稳定,光照150m in后的去除率在5516%—6611%之间1在强酸2104或强碱性11101的条件下,色度迅速降低,4BS染料在催化剂表面的吸附增强,30m in的暗吸附后,红色基本退去,去除率
已分别达到8817%和6018%,如图5所示1光催化条件下,B i
2
MoO6催化剂对4BS染料的脱色在弱酸
或弱碱性条件下较为稳定,在强酸或强碱性条件下脱色较快,效果明显
.
图4 pH值对4BS去除率的影响
F i g14 The influence of pH value of m ixture on
4BS
removal 图5 pH值对4BS在暗吸附和光催化阶段去除效果的影响F i g15 The influence of pH value of m ixture on4BS re moval
during dark abs or p ti on and phot odegradati on
215 催化剂对染料的暗吸附
通过暗吸附实验研究了光照对染料溶液脱色的影响1取100m l的4BS溶液,在原始溶液pH值条
件下,投加B i
2
MoO6催化剂,投加量为1g?l-1,将反应器置于暗箱中避光,磁力搅拌,每隔一定时间取样,同时进行光催化对比实验,结果如图6所示1结果表明,在暗吸附实验中染料颜色并未完全
褪去,暗吸附240m in后,去除率达到8319%1合成的B i
2
MoO6催化剂对4BS染料的吸附作用较强,这主要是由于水热合成的催化剂有较大的比表面积,本实验使用的催化剂BET比表面积为1014m2?g-1. 实验中可以看到,催化剂的吸附并不能使溶液完全脱色,而在经过30m in的暗反应和210m in光照后,去除率达到9715%,这也证明了光照在染料溶液脱色过程中确实发挥了作用1
216 催化剂的重复使用
在一次光催化实验之后,通过微孔过滤回收溶液中的催化剂,不必用蒸馏水洗涤直接晾干,回收,作为下一次使用1实验条件:染料浓度20mg?l-1,原始pH值,催化剂投加量2g?l-1,光照时间前3次为4h,第4,5次为6h1光催化剂在对4BS溶液进行5次脱色反应后,光催化活性有所下降,对4BS染料的去除率降低为7416%1导致催化剂活性降低的主要原因可能是催化剂多次使用后,使得催化剂表面吸附过多的染料,从而降低了催化剂的有效面积1使用前后的XRD表征如图7所示,使
用后催化剂XRD特征峰没有改变,只是峰强要小,证明催化剂在造构上具有稳定性
.
图6 暗吸附和光催化条件下Bi
2
Mo O6对4BS的去除效果对比F i g16 The contrast of4BS re moval induced by B i2MoO6
under dark ads or p ti on and phot odegradati
on 图7 B i
2
MoO6催化剂重复使用5次前后的XRD图谱
F i g17 XRD patterns of B i2MoO6,
without use and after use of five ti m es
环 境 化 学28卷812
重复实验研究说明了B i
MoO6催化剂的光催化活性和催化剂结构的稳定性,催化剂并没有在催化
2
氧化过程中发生光腐蚀现象,而某些掺杂性的Ti O
,WO3和ZnO会产生该类问题[9,10]1这说明
2
B i2MoO6催化剂具有实际应用的潜力,具有很好的开发价值1
3 结论
B i
MoO6催化剂对4BS有较好的脱色效果1初始浓度为20mg?l-1的4BS染料溶液,原始pH6190 2
条件下,催化剂的最佳投加量为2g?l-1,光照60m in后,4BS去除率可以达到9217%;在实验浓度
20—100mg?l-1的范围内,催化剂投加量为210g?l-1,光催化210m in后染料去除量最大可达到约50mg?l-1;染料溶液在弱酸或弱碱性条件下脱色较为稳定,在强酸或强碱性条件下脱色较快,效果明显1B i
MoO6催化剂重复使用前后结构和成分稳定,但光催化活性有所下降,使用5次后,对4BS 2
染料的去除率降低为7416%.
参 考 文 献
[1] 齐普荣,王光辉,光降解偶氮染料的研究进展[J]1染料与染色,2007,44(2)∶1—4
[2] Akihiko Kudo,Devel opment of Phot ocatalyst Materials f or W ater Sp litting[J]1International Journal of Hydrogen Engery12006,31
(2)∶197—202
[3] B i Jinhong,W u L ing,L i J ie et al1,Si m p le Solvother mal Routes t o Synthesize Nanocrystalline B i2MoO6Phot ocatalysts with D ifferent
Mor phol ogies[J]1Acta M aterialia,2007,55(14)∶4699—4705
[4] Yao W F,W ang H,Xu X H et al1,Phot ocatalytic Pr operty of B is muth Titanate B i2Ti2O7[J]1Applied Catalysis A:General,2004,
259(1)∶29—33
[5] Grzechulska J,Mora wskiA W,Phot ocatalytic Decompositi on of Az o2dye Acid B lack1in W ater overModified Titanium D i oxide[J]1Ap2
plied Catalysis B:Environm ental,2002,36(1)∶45—51
[6] Siham A l2Qarada wi,Sal m an R Sal m an,Phot ocatalytic Degradati on ofMethyl O range as a Model Compound[J]1Journal of Photoche m2
istry and Photobiology A:Che m istry,2002,148(1—3)∶161—168
[7] Yao W F,W ang H,Xu X H et al1,Synthesis and Phot ocatalytic Pr operty of B is muth Titanate B i4Ti3O12[J]1M aterials Letters,2003,
57(13—14)∶1899—1902
[8] Yao W F,W ang H,Xu X H et al1,Phot ocatalytic Pr operty of B is muth Titanate B i12Ti O20Crystals[J]1A pplied Catalysis A:General,
2003,243(1)∶185—190
[9] Bae E,ChoiW,H ighly Enhanced Phot oreductive Degradati on of Perchl orinated Compounds on Dye2Sensitized Metal/Ti O2under V isible
L ight[J]1Environm ental Science&Technology,2003,37(1)∶147—152
[10] 汪军,王毓芳,徐伯兴,ZnO光催化降解苯酚的试验研究[J]1污染防治技术,1999,12(2)∶98—100
4BS RE MO VAL IND UCED BY B i2M oO6UND ER
V I S I BL E L I GHT I RRAD I AT I O N
CHEN Ya CHEN J ian2lin YAO San2li ZHOU Yi XU Yue2tai (State Key Laborat ory of Polluti on Contr ol and Res ouce Reuse,School of the Envir onment,Nanjing University,Nanjing,210093,China)
ABSTRACT
V isible2light2driven B i
MoO6phot ocatalyst was p repared by hydr other mal p r ocess with p revi ously
2
ultras onic treat m ent1The effects of phot ocatalytic activity of B i2MoO6catalyst were evaluated by the decol orati on of aqueous4BS dye at r oom te mperature under visible light irradiati on1W hen the concentrati on of the aqueous4BS dye was20mg?l-1at the initial pH6190,the best dosage of B i2MoO6catalyst was2g?l-1, and the re moval rate was9217%after60m in1The structure and compositi on of B i2MoO6catalyst was stable after use of five ti m es,but phot ocatalytic activity declined.
Keywords:B i
MoO6,hydr other mal synthesis with p revi ously ultras onic treat m ent,phot ocatalysis,4BS.
2
光催化降解染料甲基橙 专业班次:应用化学3班学号: 姓名:日期: 2015年5月12日 1.实验目的 1、掌握确定反应级数的原理和方法; 2、测定甲基橙光催化降解反应速率常数和半衰期; 3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。 2.实验原理 国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2 H2O,而污染物中含有的卤原子、硫原子、磷原子和氮原子等则分别转化为X-,SO42-,PO43-,PO43-,NH4+,NO3-等离子。因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。 光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。 光催化以半导体如TiO2,ZnO,CdS,Fe2O3,WO3,SnO2,ZnS,SrTiO3,CdSe,CdTe,In2O3,FeS2,GaAs,GaP,SiC,MoS2等作催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点,帮TiO2是目前广泛研究、效果较好的光催化剂。 半导体之所以能作为催化剂,是由其自身的光电特性所决定的。半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。研究证明,当pH=1时锐钛矿型TiO2的禁带宽度为3.2eV,半导体的光吸收阈值λg与禁带宽度Eg的关系为 λg(nm)=1240/Eg(eV) 当用能量等于或大于禁带宽度的光(λ<388nm的近紫外光)照射半导体光催化剂时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e-),在价带上产生带正电的光生空穴(h+),形成光生电子-空穴对。空穴的能量为7.5 eV,具有强氧化性;电子则具有强还原性。 当光生电子和空穴到达表面时,可发生两类反应。第一类是简单的复合,如果光生电子与空穴没有被利用,则会重新复合,使光能以热能的形式散发掉 e-+h+==N+energy(hv’ N-TiO2的制备及可见光降解有机污染物的测定 一、目的要求 1、N掺杂TiO2光催化剂的简易液溶液制备; 2、测定甲基橙在可见光作用下的光催化降解反应速率常数; 3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。 二、实验原理 国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2, H2O。因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。 光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。 光催化以半导体如TiO2,ZnO,CdS,WO3,SnO2,ZnS,SrTiO3等作催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点。TiO2是目前广泛研究、效果较好的光催化剂之一。 半导体之所以能作为催化剂,是由其自身的光电特性所决定的。半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。研究证明,当pH=1时锐钛矿型TiO2的禁带宽度为3.2eV,半导体的光吸收阈值λg与禁带宽度Eg的关系为 (nm)=1240/E g(eV) 当用能量等于或大于禁带宽度的光(λ<388nm的近紫外光)照射半导体光催化剂时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e-),在价带上产生带正电的光生空穴(h+),形成光生电子-空穴对。空穴具有强氧化性;电子则具有强还原性。 当光生电子和空穴到达表面时,可发生两类反应。第一类是简单的复合,如果光生电子与空穴没有被利用,则会重新复合,使光能以热能的形式散发掉。 第二类是发生一系列光催化氧化还原反应,还原和氧化吸附在光催化剂表面上物质。 TiO2→e-+h+ OH-+h+→·OH TiO2可见光催化的研究进展1 於煌1 郑旭煦1 王颖1 1重庆工商大学环境与生物工程学院(400067) E-mail: yuhuangmail@https://www.doczj.com/doc/da2260435.html, 摘 要:TiO2是一种良好的光催化剂,具有稳定性好、光效率高和不产生二次污染等特点。但TiO2是宽带导体,只有在紫外光下才具有活性,从而限制了它的实际应用。目前TiO2可见光催化的研究取得了一定进展,金属掺杂、非金属掺杂和染料光敏化等方法都不同程度地实现了TiO2可见光催化。本文拟就有关TiO2可见光催化的研究进展做一简单综述。 关键词:二氧化钛 光催化 可见光 掺杂 光敏化 1.引言 自1972年Fujishima和Honda[1]报道利用TiO2单晶电极光解水的实验结果以来,人们对半导体光催化剂TiO2在水处理中的应用进行了大量研究。在去除水中难降解污染物方面,半导体光催化剂具有强氧化性、污染物矿化完全,可直接利用太阳光等特点,有望成为一种新型的污水处理工艺。但是,TiO2光催化目前仍处于实验室阶段,在实际应用中仍存在很多困难,阻碍其应用的一个重要因素就是激发光波长的问题。由于TiO2半导体禁带宽度较宽为3.2eV,其对应的波长为387 nm属于紫外光区,而紫外光只占到达地球表面太阳光的3%-4%,在太阳光谱中占绝大多数的可见光部分(能量约占45%)未得到有效利用[2]。因此,如何修饰TiO2使其能够响应长波长的可见光部分,高效利用太阳能成为目前TiO2光催化最具挑战性的课题[3-5]。解决好了这一课题,TiO2将会有更为广阔的应用前景。目前,实现TiO2可见光催化的主要方法有金属掺杂、非金属掺杂、染料光敏化。 2.金属掺杂 金属掺杂包括过渡金属掺杂、稀土金属掺杂和贵金属沉积掺杂,是最常用的一种实现可见光催化的方法。Choi等[6]对包括Fe3+、Mo5+、Ru3+、Os3+、Re5+、Sb5+、Sn4+、Ga3+、Zr4+、Nb5+、Ta5+、V5+和Rh3+等在内的21种金属离子对胶体TiO2的掺杂效果进行了系统的研究,虽未涉及可见光方面的内容,但讨论了掺杂离子种类、浓度和分散度、掺杂离子d电子构型、在材料中的电位以及光照强度等多种因素对胶体TiO2的光催化活性影响。过渡金属的掺杂可有效改变TiO2的电子特性,从而实现可见光催化。Yamashita等[7]用离子注入法得到V、Mn、Fe离子掺杂的TiO2光催化剂,发现TiO2的吸光范围明显延长至可见光区,三种金属离子中V 掺杂效果最好,能够将TiO2的吸收波长延长到600 nm。并且光吸收范围的扩展程度与离子浓度有关,V掺杂时,当V离子注入量为13.2–22.0×10?7 mol/g催化剂时,其扩展程度最大。其它过渡金属离子(如Cr, Co, Ni, Cu等)用离子注入掺杂时同样能够延长TiO2的吸收波长至 1本课题得到重庆市教委科学技术研究基金(项目编号:KJ050702)资助 1 1物理法 1.1吸附法 吸附法是利用多孔性固体(如活性炭、吸附树脂等)与染料废水接触,利用吸附剂表面活性,将染料废水中的有机物和金属离子吸附并浓集于其表面,达到净化水的目的。 活性炭具有较强的吸附能力,对阳离子染料,直接染料,酸性染料、活性染料等水溶性染料具有较好的吸附功能,但活性炭价格昂贵,不易再生。由壳聚糖与活性炭及纤维素混合制成的染料吸附剂对活性染料和酸性染料有优异的吸附能力,其吸附容量分别为264和421mg/g(椰子活性炭吸附容量少于80mg/g)。该吸附剂在水中具有优良的分散性,可采用简单而廉价的接触过滤法处理。 大孔吸附树脂是内部呈交联网络结构的高分子珠状体,具有优良的孔结构和很高的比表面积。吸附树脂可用于去除难以生物处理的芳香族磺酸盐,萘酚类物质。它易再生,且物理化学稳定性好,树脂吸附法已成为处理染料废水的有效方法之一。 1.2膜分离 膜分离技术应用于染料废水处理方面主要是超滤和反渗透。据报道,用管式和中空纤维式聚砜超滤膜处理还原染料废水脱色率在95%~98%之间,CODCr去除率60%~90%,染料回收率大于95%。近年来,用壳聚糖超滤膜和多孔炭膜的新型膜材料来处理印染废水,取得较好的效果。夏之宁等研究了染料废水在超声作用下,通过醋酸纤维素膜的透水率与透盐率,发现超声波在膜分离中有明显的加速传质和去“浓差极化”作用,有超声波作用时其渗透率是无超声波时的1.5倍,对透盐率影响更大,其截留率分别为94%和67%。 2化学法 2.1化学混凝法 化学混凝法主要有沉淀法和气浮法,此法经济有效,但产生化学的污泥需进一步处理。常用的有无机铁复合盐类。近年来国内外采用高分子混凝剂日益增多。天然高分子絮凝剂主要有淀粉及淀粉衍生物、甲壳质衍生物和木质素衍生物3大类。曾淑兰等用NaOH作催化剂将玉米淀粉和醚化剂M反应制得的阳离子淀粉CST,用量为7~15mg/L时,对酸性染料、活性染料的脱色率达90%以上。吴冰艳等用接枝聚合制得的木质素季胺盐絮凝剂处理J酸染料废水,絮凝剂中的季胺离子与废水中的磺酸基团生成不溶于水的物质,投量20mg/L,色度去除率达90%。 方忻兰利用海虾、蟹壳为原料制得的壳聚糖用来处理印染废水,CODCr去除率达85%以上。天然高分子絮凝剂电荷密度小,分子量低,易发生生物降解而失去絮凝活性。人工合 光催化材料研究进展 20 世纪以来, 人们在享受迅速发展的科技所带来的舒适和方便的同时, 也品尝着盲目和短视造成的生存环境不断恶化的苦果, 环境污染日趋严重。为了适应可持续发展的需要, 污染的控制和治理已成为一个亟待解决的问题。在各种环境污染中, 最普遍、最重要和影响最大的是化学污染。因而, 有效的控制和治理各种化学污染物是环境综合治理的重点, 开发化学污染物无害化的实用技术是环境保护的关键。目前使用的具有代表性的化学污染物处理方法主要有: 物理吸附法、化学氧化法、微生物处理法和高温焚烧法。这些方法对环境的保护和治理起重大作用, 但是这些技术不同程度的存在着或效率低, 不能彻底将污染物无害化, 产生二次污染, 或使用范围窄, 仅适合特定的污染物而不适合大规模推广应用等方面的缺陷[1]。光催化氧化技术是一门新兴的有广阔应用前景的技术, 特别适用于生化、物化等传统方法无法处理的难降解物质的处理。其中TiO2、ZnO、CdS、WO 3、Fe 2 O 3等半导体光催化技术因其可以直接利用光能而被许多研究者看好[2]。 1.1 TiO 2光催化概述 1.1.1 TiO 2的结构性质 二氧化钛是一种多晶型化合物,常见的n型半导体。由于构成原子排列方式不同,TIO2在自然界主要有三种结晶形态分布:锐钛矿型、 金红石型和板钛矿型。三种晶体结构的TIO2中,锐钛矿和金红石的工业用途较广。和锐钛矿相比,金红石的原子排列要致密得多,其相对密度、折射率以及介电常数也较大,具有很高的分散光射线的能力,同时具有很强的遮盖力和着色力,可用作重要的白色涂料。锐钛矿在可见光短波部分的反射率比金红石型高,普遍拥有良好的光催化活性,在光催化处理环境污染物方面有着极为广阔的应用前景[3]。 1.1.2TiO2光催化反应机理 半导休表面多相光催化的基本原理:用能量高于禁带宽度(Eg)的光照射半导体表面时,价带上的电子被激发,跃迁到异带上,同时在价带产生相应的空穴,这样就半导体内部生成电子(e-)—空穴(h+)随后,.电子-空穴对迁移到粒子表面不同位置、与吸附半导体表面的反应物发生相应的氧化或还原反应,同时激发态的二氧化钛重新回归到基态。与电荷分离相逆的是电子-空穴对的复合过程,这是半导体光催化剂失活的主要原因。电子-空穴对的复合将在半导体体内或表面发生,并释放热量。 1.1.3 TiO2催化剂的局限及改性途径 作为光催化剂,虽然二氧化钛具有其他催化剂难以比拟的无毒、价廉以及稳定等优点。但是目前二氧化钛光催化还存在着一些不足和局限,致使其不能再现实中得到大规模应用。究其原因,主要在于二氧化钛催化剂对太阳光的利用率不高并且其量子产率太低。锐钛矿相和金红石相二氧化铁的带隙分别为3.2eV和3.0 eV,对应的吸收阈值分别为420nm和380nm。它们所吸收的光的波长主要集中在紫外区, TiO2光催化降解染料废水的研究进展 给水排水01班李陈奕201010130104 【摘要】综述TiO2光催化降解染料废水的研究现状和机理,简单介绍了降解溶液pH、催化剂用量、掺杂物质浓度、煅烧温度以及超声波等因素对降解效果的影响。最后展望TiO2光催化降解染料废水的应用前景。 【关键词】光催化;TiO2;染料;降解;综述 随着染料合成、印染等工业废水的不断排放和各种染料的不断使用,进入环境的染料数量和种类不断增加,染料造成的环境污染趋严重。据统计,全世界大约15%的染料在生产过程中被排放到废水中[1],而这些有色废水在环境中又会通过氧化、水解以及其它化学反应生成有毒的副产物。采用传统的物理、生化或化学氧化法处理此类废水普遍存在处理周期长、降解速率低等问题,因此如何有效降解染料废水已成为环境学科研究的热点问题。 1 光催化氧化的机理 光催化是指在光催化剂的存在下发生的光诱导反应。光催化剂多为金属氧化物或硫化物。其中TiO2以其无毒、催化活性高、氧化能力强、稳定性好、易于制备和使用等特点最为常用[2]。光催化基本原理是指光催化剂受到大于禁带宽度能量的光子照射后,发生电子跃迁,生成光生电子和空穴对,光生电子具有很强的还原能力,可以还原去除水中的金属离子,而空穴具有极强的氧化性,可对吸附于其表面的污染物进行直接或间接的氧化降解。 2 染料废水的特点 染料分子成分大多是芳烃和杂环化合物,其中除了带有各类显色基团以及极性基团以外,还可能混有各类卤代物、苯胺、酚类及各种助剂,它具有水量大、有机毒物含量高、成分复杂、色度高等特点。另外,染料废水化学需氧量较高,而生化需氧量相对较小,可生化性差。 3 光催化降解染料废水的影响因素 近年来,国内外研究学者对TiO2光催化降解染料废水进行了大量的研究工作,并取得一定进展,本文从其影响因素的角度对这些研究成果进行了较为系统地归纳和总结,总的看来,影响光催化降解有机染料的因素主要有以下几个方面。 3.1 降解溶液pH的影响 降解溶液pH对光催化效果的影响机理很复杂,主要体现在以下三方面:(1)降解溶液pH的变化将影响染料分子在TiO2 表面的吸附;(2)羟基自由基在碱性条件下容易生 光催化降解甲基橙实验报告 光催化降解染料甲基橙 一、目的要求 1 、掌握确定反应级数的原理和方法; 2 、测定甲基橙光催化降解反应速率常数和半衰期; 3 、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。 二、实验原理 光催化始于1972 年,Fujishima 和Honda 发现光照的TiO 单晶电极能分解水,引起人们对光诱导2 氧化还原反应的兴趣,由此推动了有机物和无机物光氧化还原反应的研究。 1976 年,Cary 等报道,在近紫外光照射下,曝气悬浮液,浓度为50 μg/L 的多氯联苯经半小时的光反应,多氯联苯脱氯,这个特性引起了环境研究工作者的极大兴趣,光催化消除污染物的亚牛日趋活跃。国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2 H2O ,而污染物中含有的卤原子、硫原子、磷原子和氮原子等则分别转化为X- ,SO42- , PO43- ,PO43- ,NH4+,NO3- 等离子。因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。 光催化技术的研究涉及到原子物理、凝聚态物2理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。光催化以半导体如TiO ,ZnO, CdS,FeO,322 WO,SnO,ZnS ,SrTiO , CdSe ,CdTe ,InO ,32323 FeSGaAs ,GaP,SiC ,MoS 等作催化剂,其中TiO 222 ,具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点,帮TiO 是目前广泛研究、效果较2 好的光催化剂。半导体之所以能作为催化剂,是由其自身的光电特性所决定的。半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。研究证明,当pH=1 时锐钛矿型TiO 的禁带宽度为 3.2eV ,半导体的光吸2 收阈值λg 与禁带宽度Eg 的关系为λ(nm)=1240/Eg(eV)g当用能量等于或大于禁带宽度的光(λ<388nm 的近紫外光)照射半导体光催化剂 时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e- ),在价带上产生带正电+),形成光生电子- 的光生空穴(h 空穴对。空穴的能3 量(TiO )为7.5 eV ,具有强氧化性;电子则具有强2 还原性。 实验16 光催化降解染料甲基橙 一、目的要求 1、掌握确定反应级数的原理和方法; 2、测定甲基橙光催化降解反应速率常数和半衰期; 3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。 二、实验原理 光催化始于1972年,Fujishima和Honda 发现光照的TiO2单晶电极能分解水,引起人们对光诱导氧化还原反应的兴趣,由此而推动了有机物和无机物光氧化还原反应的研究。 1976年,Cary等报道,在近紫外光照射下,曝气悬浮液,浓度为50 μg/L 的多氯联苯经半小时的光反应,多氯联苯脱氯,这个特性引起了环境研究工作者的极大兴趣,光催化消除污染物的研究日趋活跃。在水的各类污染物中,有机物是最主要的一类。美国环保局公布的129种基本污染物中,有9大类共114种有机物。国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2、H2O,而污染物中含有的卤原子、硫原子、磷原子和氮原子等则分别转化为X-,SO42-,PO43-,PO43-,NH4+,NO3-等离子。因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。 光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。 “光催化”这一术语本身就意味着光化学与催化剂二者的有机结合,因此光和催化剂是引发和促进光催化反应的必要条件。光催化以半导体如TiO2、ZnO、CdS、A-Fe2O3、WO3、SnO2、ZnS、SrTiO3、CdSe、CdTe、In2O3、FeS2、GaAs、GaP、SiC、MoS2 等作光催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点,故TiO2事目前广泛研究、效果较好的光催化剂。 半导体之所以能作为催化剂,是由其自身的光电特性所决定的。半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。研究证明,当pH=1时锐钛矿型TiO2的禁带宽度为3.2eV,半导体的光吸收阈值λg与禁带宽度Eg的关系为 光催化研究发展综述性报告 本人申请攻读动力工程与工程热物理专业博士学位,由于对后续能源与新能源技术专业太阳能分解水制氢方向有浓厚的兴趣,通过对相关文献的阅读和参加相关报告,对太阳能光催化分解水制氢有了详细的了解,对其发展简述如下: 1.前言 当今人类社会面临能源和环境两大问题[1-2]。能源的短缺和环境的污染严重制约着人类社会的发展。一方面,社会的高速发展使得人类对于能源的需求越来越大,而我们目前所用的能源还是以传统的化石燃料为主,但是因为化石燃料的不可再生性,或者说是形成的时间周期太长,使得其必有枯竭的一天。据估计,按照目前的开采水平和消耗量,石油还能够维持四十年左右,煤炭最多也就是两百年,而天然气还可以维持大概六十多年。另一方面,化石燃料的燃烧,引起严重的环境污染和对环境的危害,如温室效应、酸雨、光化学烟雾等等,对人类的生存产生了严重的威胁。 研究自然的、社会的、生态的、经济的以及利用自然资源过程中的基本关系,以确保全球的可持续发展已经成为各国都十分关注的一个话题。就像美国,在2009年提出的7870亿美元的巨额经济刺激计划中,把发展新能源定位于抢占未来发展制高点的重要战略产业,并提出在未来的三年的时间里,国内可再生能源产量要增加一倍。而我国人口众多,常规能源储备远低于世界平均水平,而且近几十年来,环境污染也是日益严峻。这使得寻找一种清洁可持续的替代能源变得更加迫切。而我国幅员辽阔,拥有极为丰富的太阳能资源,开发潜力巨大,从长远发展来看完全可以满足国家可持续发展的需求。但太阳能能量密度低、分散性强、不稳定、不连续的缺点使得我们至今仍缺乏对其高效低成本大规模利用的有效手段。但是考虑到占地表约3/4的水域和植物的光合作用,我们是不是可以利用太阳能分解水,制取氢气,而氢气又是是一种无色无臭无味无毒的清洁燃料, 光催化剂研究进展 李少坤 (化学院11级材料化学3班,20110480) 【摘要】:本文主要介绍了近几年工业上光催化剂的最新研究进展,主要涉及到纳米TiO2光催化剂的改性进展,光催化制氢用纳米结构光催化剂的研究进展以及新型光催化剂ZrW2O7(OH)2(H2O)2的光解水产氢产氧性能等。 【关键词】:纳米TiO2;光催化剂;水分解;改性 自从1972年Fujishima A 等发现TiO 2 单晶电极可以实现光分解水以来,多相光催化反应一直是催化领域的一个极其重要的研究课题,光催化分解水制氢,光 催化还原CO 2 制备有机物、光降解有机污染物等重要光催化过程向人们展示了诱人的应用前景。30多年来,光催化研究无论是在理论上还是在应用研究方面都取得了重要的进展。 一、纳米TiO2光催化剂的改性进展 1.纳米TiO 2 光催化的反应机理 纳米TiO 2 多相光催化过程是指TiO2材料吸收外界辐射光能,激发产生导带电子(e-)和价带空穴(h+),进而与吸附在催化剂表面上的物质发生一系列化学反应 的过程。如锐钛矿型TiO 2 的禁带宽度为3.2 eV,它具有较强的光活性,当它吸收了波长小于或等于387.5 nm的光子后,价带中的电子就会被激发到导带,形成带负电的高活性电子e-,同时在价带上产生带正电的空穴h+,在电场的作用下,电子与 空穴发生分离,迁移到粒子表面的不同位置。分布在表面的h+可以将吸附在TiO 2 表面的OH-和H 2 O分子氧化成·OH自由基。·OH自由基的氧化能力是水体系中存在的氧化剂中最强的,可破坏有机物中C—C键、C—H键、C—N键、C—O键、O—H键和N—H键,因而能氧化大多数的有机污染物及部分无机污染物,将其最终降解为 CO 2、H 2 O等无害物质[1, 2]。 2、纳米TiO2光催化剂的改性 硫及金属硫化物-类石墨相氮化碳纳米复合材料的制备,表征及其光催化性能的研究 第一章绪论 自18世纪60年代的第一次工业革命到现在以来,科学技术迅猛发展、日新月异。工业革命(第一次科技革命)以瓦特的蒸汽机的发明为标志,宣告了人类社会由原来的火器时代,进入到了蒸汽时代。第二次科技革命发生在19世纪70年代,在这个时期,自然科学取得了飞速的进展,由于资本主义制度的逐渐形成和完善,资本主义国家为了生存和发展,开始了大量的对世界资源进行掠夺。两次工业革命对然建立了世界的初步两极格局,但是两次科技革命的功劳还是不容忽视的,它们推动了传统的农业,手工业向现代化工业以及机器化工业的飞速发展,并且带给了人类社会巨大的物质财富,在资本主义国家逐利的对外扩张过程中,不可否认的是它们的争斗促进了人类文明的进步和繁荣。但是,当资本家们在大力发展社会生产力,提高生活水平的同时,对环境也造成了严重的破坏,至今,已严重威胁着我们所处在的的生存环境。 特别是在进入20世纪50年代之后的第三次科技革命;随着工业现代化进程的加快,人类向所生存的环境排放了大量的生产废水、废气,它们其中含有大量的有毒污染物如医用药品、农药、工业染料、表面活性剂和含有重金属离子的溶液等,含有上述物质的这些废水给人类的健康和生存环境带来巨大的威胁。而且在上述这些污染物中,用传统的处理方法很难将其完全消灭和降解。废水中的很多有机化合物能使水中的厌氧微生物发生异变,从而产生明显的毒害作用;所以必须创造出一些其它的非生物的降解技术来除去这些有机化合物[1-3]。因此,开发一种简便、有效、快捷、无害的方法来治理水体污染和大气污染是当前社会一个亟待解决的问题。并且,社会现代化的发展需要消耗大量的能源,据专家分析,传统的化石能源已经不能继续维持人类社会的长期发展,而且传统的化石能源的使用是当前引发严重环境问题的万恶之源。所以,环境问题和能源问题是21世纪可持续发展战略的两大亟待解决的严重问题。 2. 1 物化法 吸附法将多孔性固体与废水接触用物理吸附、化学吸附或交换吸附等方式,将污染物从废水吸附到吸附剂上,从而达到去除的目的。常见的吸附剂主要有活性炭、离子交换树脂、硅藻土、粉煤灰等。在对于染料废水的处理中,使染料废水通过由颗粒状物质(即吸附剂)组成的滤床,染料废水中的染料以及助剂等污染物被吸附在吸附剂表面而被去除。吸附效果很大程度上取决于吸附剂的结构性质以及污染物的结构性质。吸附法比较适合于低浓度染料废水的深度处理,主要优点是投资小,占地面积小,方法简便易行,吸附法还能够去除废水中难生物降解的污染物。 萃取法主要是将与水不互溶,但是对污染物的溶解能力却较强的溶剂(即萃取剂),与废水充分混合,使大部分的污染物转移到溶剂相,再分离废水与溶剂,从而达到净化的效果。主要是利用了有机物在水中和在有机溶剂中的溶解度差异,再将萃取剂与污染物分离,萃取剂可以循环利用,所得的污染物也可以经过进一步处理后变废为宝。但是萃取法比较适于小水量废水的处理,且对成分复杂的难处理染料废水,对萃取剂的要求也很高,费用也会随之大增。因此萃取法仅适用于少数几种有机废水的处理。由于萃取剂总会在水中有一定的溶解度难免会有少量的萃取剂流失,使处理后的水质难以达到排放标准。 膜分离技术应用于染料废水,主要是通过对废水中污染物的分离、浓缩、回收从而达到废水处理的目的。在对染料废水的处理中,应用比较多的是超和反渗透。膜分离技术不需要投加化学试剂,且在处理过程中不产生新的化学物质,避免二次污染,过程简单操作方便,可从废水中回收染料,循环利用。但是膜分离技术存在的最大缺点就是膜通量会随着处理进程延长而下降,更换频率较快,且膜清洗需要一定成本,膜的材质如抗酸碱性、抗腐蚀性等,也会很大程度上影响处理效果。 混凝沉降法 混凝沉降法是目前处理染料废水效果比较稳定、工艺较为成熟的方法。普遍接受的机理有桥联作用、压缩双层、网捕和电中和作用。混凝剂自身特性决定了其沉降性能的好坏,很多环境因素包括温度、pH 和Eh 等则可能对沉降功能起促进或抑制作用。混凝法的主要研究方向是开发有效混凝剂,尤其是有机-无机复合混凝剂。 催化氧化法催化氧化法是通过催化作用加快体系中氧化剂的分解,并使之与水中有机物迅速反应,在较短的时间内致使有机污染物氧化降解。 Fenton 试剂法 以Fe3 + 或Fe2 + 为催化剂,在H2 O2存在时产生的强氧化性,能使许多有机分子氧化,而且反应体系不需要高温高压,反应条件不苛刻,反应设备也比较简单,适用范围较广。Fenton 法的不足之处在于: 氧化能力相对较弱,出水因含大量铁离子而显色。近年来,铁离子的固定化技术,成为Fenton 氧化法的重要方向。 光氧化法 光氧化法是利用光化学反应降解污染物,包括无催化剂和有催化剂参与2 种,前者也称 光化学氧化,后者又称光催化氧化。光降解通常是指有机物在光的作用下,逐步氧化成低分子中间产物,最终生成CO2、H2 O 和其他一些离子,如PO43 -、NO3 -、Cl -等。有机物的光降解过程可分为直接光降解和间接光降解。直接光降解是指有机物分子吸收光能后进一步发生化学反应。间接光降解则是周围环境存在的某些物质吸收光能形成激发态后,再诱导有机污染物产生一系列的氧化降解反应,它在处理环境中难生物降解的有机污染物时更为有效 臭氧氧化法 臭氧的氧化能力极强,除分散染料外,它能够破坏有机染料的发色或助色基团而具有 一定的脱色作用。但是,臭氧的使用会产生一些副产品,尤其要重视的是羰基化合物中的 实验十 超细二氧化钛光催化降解染料 10.1 实验目的 (1) 了解超细二氧化钛的作为光催化剂的原理和应用; (2) 掌握光反应器的应用和光反应的原理; (3) 掌握超细二氧化钛光催化降解染料的基本操作。 10.2 实验原理 印染行业是工业废水排放大户,据不完全统计,全国印染废水排放量为3~4百万立方米/天。染料废水是目前难降解的工业废水之一,对环境的危害日益严重。对于染料废水目前采用的处理方法主要有三种:物理法、化学法和生化法。物理法主要是利用活性炭、硅藻土和煤渣等吸附处理,特点是费用低、脱色效果好,缺点是产生大量泥渣,进一步处理难。化学法主要是混凝沉淀法和混凝气浮法等,混凝法的工艺流程简单,设备投资少,缺点是运行费用高,泥渣量多。生化法目前是染料废水的主要处理方法,但是色度和COD 去除率不高。 近年来,利用半导体粉末光催化处理难降解废水的研究日益引起人们的注意。本实验就是考察超细二氧化钛光催化降解染料的能力。 10.3 试剂: 超细二氧化钛 自制;亚甲基蓝溶液 COD Cr =300mg/l 。 10.4 仪器: NDC-3型光学反应仪;紫外-可见分光光度计。 10.5 实验步骤: 10.5.1 光降解操作: 将200ml 的某一浓度的染料亚甲基蓝溶液和1.5%的超细二氧化钛催化剂加入光催化反应器中,开通冷却水,关闭暗箱门,开启汞灯,待汞灯工作稳定时开始计时,每隔5min 取样5ml 进行分析测定。 10.5.2 染料降解率的测定: 染料降解率按下式计算: D=(A 0-A) / A 0×100% 式中:A 0、A 分别染料溶液光照前和光照t 时间后染料溶液在最大吸收波长下的吸 光度。 10.5.3 COD 值的测定 取一定量试液置于回流锥形瓶中,加入重铬酸钾标准溶液、硫酸—硫酸银溶液和硫酸汞,加热回流2h (自开始沸腾时计时)。冷却后加入蒸馏水至溶液体积不少于140ml 。以试亚铁灵为指示剂用硫酸亚铁氨标准溶液滴定,溶液颜色由黄色经蓝绿色至红褐色即为终点。 测定水样时,用蒸馏水按同样操作步骤做空白试验。 COD 值的变化用重铬酸钾法(COD Cr )来测定: V C V V L mg O 10008)()/,(CO D 102Cr ???-= 式中: C ——硫酸亚铁铵标准溶液的浓度(mol/L ); 1.5可见光响应光催化剂的研究进展 1.5.1TiO2光催化剂可见光化的研究 针对TiO2光催化剂的量子效率很低,且只能利用太阳光中的紫外辐射(约占太阳光能量的4%)而无法利用可见光(约占太阳光能量的43%)的缺点,研究者们通过掺杂、光敏化、复合半导体等方法使Ti02的吸收波长红移到可见光区,以便充分利用太阳光,并对提高光催化过程的量子效率进行了系统深入的研究,尤其是近年来在Ti02掺杂改性方面取得了重要进展。 1.5.1.1金属离子掺杂 金属离子掺杂就是将一定量的金属离子引入到半导体晶格中,影响光生载流子的产生、迁移/复合及其转化过程,从而影响半导体的光催化活性。由于金属离子的能级位于半导体的禁带中,从而将半导体吸收光波长的范围扩展到可见光区。用于掺杂的离子主要包括过渡金属离子和稀土金属离子。国内外许多研究者作了大量金属离子掺杂TIO:的研究,结果显示金属离子的掺杂不同程度地影响了Tio:的光催化活性[22一26]。有些金属离子的掺入提高了TIO:的光催化活性,有些金属离子的掺入影响很小,有些反而降低了TIO:的光催化活性。还有在不同的实验条件下,相同的金属离子掺杂却得到了相反的结论。总的来说,影响金属离子掺杂TIO:光催化活性的因素比较复杂,主要有掺杂离子的种类、能级、化合价、半径、浓度以及掺杂光催化剂的制备方法等。在这方面,WChoi的研究工作很有代表性。wchof采用sol一gel法将和Ti4+离子半径接近的21种金属离子掺入到TiO2中[27],系统研究掺杂对Tio:光催化活性的影响。结果如图1一3所示,当掺杂离子的电位与Tio:的价带、导带相匹配且离子半径与Ti4十相近时,具有全充满或半充满电子构型的过渡金属离子,如Fe3+、Co十和Cr3+等,掺杂后的光催化活性要好于具有闭壳层电子构型金属离子的掺杂,如Zn2+、Ga3+、Zr+、Nb5+、Sn4+、Sb5+和Ta5+等。另外高价离子,如w6+的掺杂,要好于低价离子。虽然其研究未涉及可见光方面的内容,但讨论了掺杂离子的种类、浓度、分散度、d轨道电子构型以及光照强度等多种因素对TIO:光催化活性的影响。多年的研究己经证明金属离子掺杂的TIOZ,虽然能够显著降低其禁带宽度,实现可见光的激发,但这些掺杂离子不论是作为填隙离子,还是代位离子,实际上都是在TIO:的晶格中增设了电子一空穴复合位点,大多数情况下载流子在分离和迁移到表面过程中,几乎都被这些位点所捕获。虽然Tio:有了可见光催化活性,但同时也显著降低了TIOZ在紫外辐射下的光催化活性。当然,并非所有金属离子的掺杂都被证明导致Tio:活性降低。 光催化剂论文纳米催化剂 液相法制备纳米TiO2光催化剂的研究进展论文 [摘要]论述不同的液相法制各纳米二氧化钛的过程,并且分析不同制备方法的优缺点、以及许多影响样品的粒径大小和分散性、结晶度和纯度等性质的因素(原料、水解方法、沉淀剂、元素掺杂、反应温度和压力、焙烧温度等);并且论述不同的方法的操作条件和复杂程度以及工业化应用前景。 [关键词]纳米二氧化钛粉体液相法制备 一、前言 纳米TiO2一般有三种晶体结构类型:板钛型、锐钛型和金红石型:纳米TiO2具有表面活性大,光催化、吸收性能好,分散性好,悬浮液稳定等优点,因此在环境保护、光电材料等方面具有广泛的应用前景。 液相法制各纳米TiO2具有其他的制备方法所不具有的优点:合成温度低、所得样品的粒径较小、连续性强、易操作和设备简单、成本低、反应时间短等;目前实验室和工业上广泛应用的液相法制备纳米TiO2粉体。纳米TiO2颗粒的粒度分布和均匀性、形貌、几何形态、分散性对于其光催化活性影响较大,分析不同的制各纳米粉体的液相法优缺点以及提出新的可能的研究领域是很有必要的。 二、液相法制备纳米二氧化钛 液相法是目前研究最广泛的制各纳米TiO2的方法:它又一般分为沉淀法、水热法、W/O微乳液法、溶胶一凝胶法等几种方法:它一般以TiCl4、Ti(SO4)2、钛的醇盐等为原料水解生成TiO2水合物,经干燥、高温焙烧后得到纳米二氧化钛粉体。同时纳米TiO2粉体在制备的过程中也存在一些缺点:反应器局部存在浓度和温度不均匀、粉体颗粒易发生团聚现象、难分离、成本高,以及某些表面湿润性、光性和反应特性较差。 (一)沉淀法制备纳米二氧化钛粉体 沉淀法是制各纳米TiO2的一种简便方法,一般以无机钛盐和有机钛盐为原料,向反应体系中加入沉淀剂(如(NH4)2CO3、NH4OH)后,于一定温度下使溶液发生水解,形成不溶性的氢氧化钛,将生成的TiO(OH)2沉淀物过滤、洗涤、干燥,然后,经高温煅烧即可得到所需要的TiO2粉体。 沉淀法制备纳米二氧化钛粉体的优点是工艺简单、可实现反应物在分子和原子水平上的均匀混合、易设定反应条件、可以控制所得产品的纯度和相组成、所得粉体性能稳定等等。改变纳米粉体制各过程中的某些环节对于缩短制各时间、提高样品的纯度和粒径的均匀性、实现样品颗粒的改性等方面具有重要的意义:张凌云等采用反萃沉淀法制各了纳米TiO2的前驱体:反萃沉淀法制各的纳米TiO2的最佳煅烧温度为350℃,此时样品已结晶完好,并且随着氨水浓度的降低,催化剂的晶粒粒径和颗粒粒度减小;同时乙醇助剂浓度越高有利于生成更小的催化剂颗粒。张美红等以尿素为均相沉淀剂和使用TIC14、SnC14作为原料,采用微波加热、均相沉淀法合成出了一系列sn掺杂纳米TiO2介孔材料:样品的颗粒为平均粒径20hm的球体:XRD分析表明反应前驱体为非晶态,400℃以上转变为锐钛矿结构。均匀沉淀法制各纳米TiO2的过程中沉淀剂离子是通过化学反应均匀缓慢生成的,沉淀的生成速度均匀,并且可以获得的粒度均匀、致密、性能优良的纳米粒子。沉淀法在制各粉体的实际操纵过程中也会遇到一些问题:直接沉淀法制备粉体的过程中容易引入杂质:共沉淀法控制各个工序的工艺参数的过程比较复杂;均匀沉淀法作为工业化前景最好的一种制备方法,但是必须通过液固分离才能得到沉淀物,需反复洗涤来除去杂离子,同时也存在工艺流程长、废液多、产物损失较大的现象[6],也需要考虑怎样减少反应时间来提高效率。 (二)水热法制备纳米粉体 水热法是制备纳米材料的常用方法,是用前驱体在高温、高压环境下,采用水作反应介质,使得通常难溶的物质溶解的并且得到晶态纳米颗粒。水热法制备纳米粉体的一般过程为:首先制各钛的氢氧化物凝胶,然后将凝胶转入高压釜内,升高到适宜的温度,以形成高温、高压的环境,使难溶或不容的物质溶解并且重结晶,恒温一段时间,卸压后,经洗涤、干燥即可得到纳米级的TiO2粉体。水热法可直接得到分散且结晶良好的粉体,不需作高温灼热处理,避免了微粒硬团聚的形成;水解条件下粉体的制备有水热结晶法、水热合成法、水热分解法,近年来发展了微波水热合成法。 光催化降解染料甲基橙 一、目的要求 1、掌握确定反应级数的原理和方法; 2、测定甲基橙光催化降解反应速率常数和半衰期; 3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。 二、实验原理 光催化始于1972年,Fujishima和Honda发现光照的TiO2单晶电极能分解水,引起人们对光诱导氧化还原反应的兴趣,由此推动了有机物和无机物光氧化还原反应的研究。 1976年,Cary等报道,在近紫外光照射下,曝气悬浮液,浓度为50μg/L 的多氯联苯经半小时的光反应,多氯联苯脱氯,这个特性引起了环境研究工作者的极大兴趣,光催化消除污染物的亚牛日趋活跃。国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2 H2O,而污染物中含有的卤原子、硫原子、磷原子和氮原子等则分别转化为X-,SO42-,PO43-,PO43-,NH4+,NO3-等离子。因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。 光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。 光催化以半导体如TiO2,ZnO,CdS,Fe2O3,WO3,SnO2,ZnS,SrTiO3,CdSe,CdTe,In2O3,FeS2,GaAs,GaP,SiC,MoS2等作催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点,帮TiO2是目前广泛研究、效果较好的光催化剂。 半导体之所以能作为催化剂,是由其自身的光电特性所决定的。半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。研究证明,当pH=1时锐钛矿型TiO2的禁带宽度为,半导体的光吸收阈值λg与禁带宽度Eg的关系为 λg(nm)=1240/Eg(eV) 当用能量等于或大于禁带宽度的光(λ<388nm的近紫外光)照射半导体光催化剂时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e-),在价带上产生带正电的光生空穴(h+),形成光生电子-空穴对。空穴的能量(TiO2)为 eV,具有强氧化性;电子则具有强还原性。 当光生电子和空穴到达表面时,可发生两类反应。第一类是简单的复合,如果光生电子与空穴没有被利用,则会重新复合,使光能以热能的形式散发掉 光催化原理及应用 起源 光触媒,是一个外来词,起源于日本,由于日本文字写成“光触媒”,所以中国人就直接把她命名为“光触媒”。其实日文“光触媒”翻译成中文应该叫“光催化剂”翻译成英文叫“photo catalyst”。光触媒于1967年被当时还是东京大学研究生的藤岛昭教授发现。在一次试验中对放入水中的氧化钛单结晶进行了光线照射,结果发现水被分解成了氧和氢。这一效果作为“ 本多· 藤岛效果” (Honda-Fujishima Effect)而闻名于世,该名称组合了藤岛教授和当时他的指导教师----东京工艺大学校长本多健一的名字。 这种现象相当于将光能转变为化学能,以当时正值石油危机的背景,世人对寻找新能源的期待甚为殷切,因此这一技术作为从水中提取氢的划时代方法受到了瞩目,但由于很难在短时间内提取大量的氢气,所以利用于新能源的开发终究无法实现,因此在轰动一时后迅速降温。 1992年第一次二氧化钛光触媒国际研讨会在加拿大举行,日本的研究机构发表许多关于光触媒的新观念,并提出应用于氮氧化物净化的研究成果。因此二氧化钛相关的专利数目亦最多,其它触媒关连技术则涵盖触媒调配的制程、触媒构造、触媒担体、触媒固定法、触媒性能测试等。以此为契机,光触媒应用于抗菌、防污、空气净化等领域的相关研究急剧增加,从1971年至2000年6月总共有10,717件光触媒的相关专利提出申请。二氧化钛 TiO 2 光触媒的广泛应用,将为人们带来清洁的环境、健康的身体。 催化剂是加速化学反应的化学物质,其本身并不参加反应。典型的天然光催化剂就是我们常见的叶绿素,在植物的光合作用中促进空气中的二氧化碳和水合成为氧气和碳水化合物。 光触媒是一种纳米级的金属氧化物材料,它涂布于基材表面,在光线的作用下,产生强烈催化降解功能:能有效地降解空气中有毒有害气体;能有效杀灭多种细菌,并能将细菌或真菌释放出的毒素分解及无害化处理;同时还具备除臭、抗污等功能。光催化是在光的辐照下使催化剂周围的氧气和水转化成极具活性的氧自由基,氧化力极强,几乎可以分解所有对人体或环境有害的有机物质总的来说纳米光触媒技术是一种纳米仿生技术,用于环境净化,自清洁材料,先进新能源,癌症医疗,高效率抗菌等多个前沿领域。 早在1839 年, Becquere 就发现了光电现象, 然而未能对其进行理论解释。直到1955 年, Brattain 和Gareet才对光电现象进行了合理的解释, 标志着光电化学的诞生。1972 年, 日本东京大学Fu jishmi a和H onda研究发现[ 3] , 利用二氧化钛单晶进行光催化反应可使水分解成氢和氧。这一开创性的工作标志着光电现象应用于光催化分解水制氢研究的全面启动。在过去30 年里, 人们在光催化材料开发与应用方面的研究取得了丰硕的成果。 以二氧化钛为例, 揭示了其晶体结构、表面羟基自由基以及氧缺陷对量子效率的影响机制; 采用元素掺杂、复合半导体以及光敏化等手段拓展其光催化活性至可见光响应范围; 通过在其表面沉积贵金属纳米颗粒可以提高电子- 空穴对的分离效率, 提高其光催化活性。尽管人们对光催化现象的认知与应用取得了长足的进步, 然而受认知手段与认知水平的限制, 目前对光催化作用机理的研究成果仍不足以指导光催化技术的大规模工业化应用, 亟待大力开展光催化基本原理研究工作以促进这一领域的发展。另一方面, 现有光催化材料的光响应范围窄, 量子转换效率低, 太阳能利用率低, 依然是制约光催化材料应用的瓶颈。寻找和制备高量子效率光催化材料是实现光能转换的先决条件, 也是光催化材料研究者所需要解决的首要任务之一。 光催化机理: 半导体材料在紫外及可见光照射下,将光能转化为化学能,并促进有机物的合成与分解,这一过程称为光催化。当光能等于或超过半导体材料的带隙能量时,电子从价带(VB)激发到导带(CB)形成光生载流子(电子-空穴对)。在缺乏合适的电子或空穴捕获剂时,吸收的光能因为载流子复合而以热的形式耗散。价带空穴是强氧化剂,而导带电子是强还原剂。大多数有机光降解是直接或间接利用了空穴的强氧化能力。 例如TiO2是一种半导体氧化物,化学稳定性好(耐酸碱和光化学腐蚀),无毒,廉价,原料来源丰富。 TiO2在紫外光激发会产生电子-空穴对,锐钛型TiO2激发需要3.2 eV的能量,对应于380 nm左右的波长。光催化活性高(吸收紫外光性能强;能隙大,光生电子的还原性和和空穴的氧化性强)。因此其广泛应用于水纯化,废水光催化降解甲基橙
TiO2可见光催化的研究进展
染料废水处理
光催化材料研究进展概要
TiO2光催化降解染料废水的研究进展
光催化降解甲基橙实验报告
实验16-光催化降解甲基橙
光催化研究发展综述性报告
光催化剂
半导体光催化综述
染料废水处理方法
超细二氧化钛光催化降解染料
光催化综述
光催化剂
光催化降解甲基橙实验报告
光催化原理及应用