
收稿日期:2007207211
基金项目:国家自然科学基金(No.20575047,39970206,29575206,20775058)
3通讯联系人:张华山,男,教授,博士生导师,研究方向:分子探针与检测试剂,现代分离.
第24卷第2期
Vol.24 No.2分析科学学报J OU RNAL OF ANAL YTICAL SCIENCE 2008年4月Apr.2008文章编号:100626144(2008)022*******
近红外荧光探针及其在生物分析中的应用进展
傅妮娜1,2,王 红1,张华山31
(1.武汉大学化学与分子科学学院,武汉430072;
2.南京邮电大学公共基础课学部,南京210003)
摘 要:本文评述了自1999年以来近红外荧光探针和标记试剂及其在生物分析中的应
用进展。包括:菁染料、噻嗪和噁嗪染料、含四吡咯基团染料(酞菁和卟啉)、罗丹明类、
BODIP Y 、稀土离子配合物和量子点等。描述了它们在荧光测定和毛细管分离荧光检
测以及免疫荧光分析方面的应用。引用文献75篇。
关键词:近红外荧光探针;荧光检测;生物分析
中图分类号:O657.33 文献标识码:A
1 前言
荧光光谱法由于其灵敏度高、选择性好,获得的信息直观、准确,能科学表达解释复杂样品的结构、分布、含量及生理功能等诸多问题,所以在生物分析及造影方面应用广泛。荧光染料或荧光试剂作为分子探针在生命科学领域备受瞩目。许多生物体及其组织在可见光的激发下自身会发射荧光,严重干扰生物样品的荧光检测和造影,如血浆中血清蛋白的荧光波长范围为325~350nm ,还原性烟酰胺腺嘌呤二核苷酸磷酸酶(NADP H )和胆红素的荧光波长范围为430~470nm ,故使得可见光区荧光分析的灵敏度和准确性受到了很大的影响。近红外荧光探针的最大吸收波长和发射波长为600~900nm ,可避免背景干扰。所以,近红外荧光检测在生物样品分析中有明显的优越性。
二极管激光器的问世,打破了由于传统的激发光源无法在近红外区激发而使近红外荧光染料的应用长期以来一直受到的限制。以此为基础发展起来的新的、近红外荧光试剂及检测技术广泛地应用于核酸、蛋白质、生物造影、免疫分析等领域,在生物分析中显示出巨大的潜力。当然,近红外荧光染料也存在着不足之处,如染料种类不多,合成困难,染料的光、热、化学性质不稳定等。对此文献[1]曾作过评述。本文主要对1999年以来近红外荧光探针及其应用进展进行评述。
2 菁染料(Cyanine)
近红外区的菁染料一般都是指五甲川和七甲川菁染料。另一方面,菁染料光稳定性较差,易发生光氧化漂白。菁染料的光氧化具有以下特点:(1)在溶液中的光氧化反应符合一级反应动力学过程;(2)菁染料中甲川链结构相同时,杂环母核上取代杂原子增大,稳定性降低,即吲哚>噁唑>噻唑>硒唑;(3)当杂环母核结构相同时,甲川链越长,光稳定性越差。这些对于设计光稳定较好的近红外菁染料具有非常重要的指导意义。
菁染料标记生物样品主要有静电/疏水作用非共价、共价形式以及通过活性基团与一些生物分子形成生物结合物(Bioconjugate ),用于标记核酸、蛋白质、免疫分析和造影等。
用于DNA 分析的近红外菁染料中最重要的就是噻唑橙及噁唑橙二聚体和单聚体。二聚体叫TO TO 3
32
第2期傅妮娜等:近红外荧光探针及其在生物分析中的应用进展第24卷
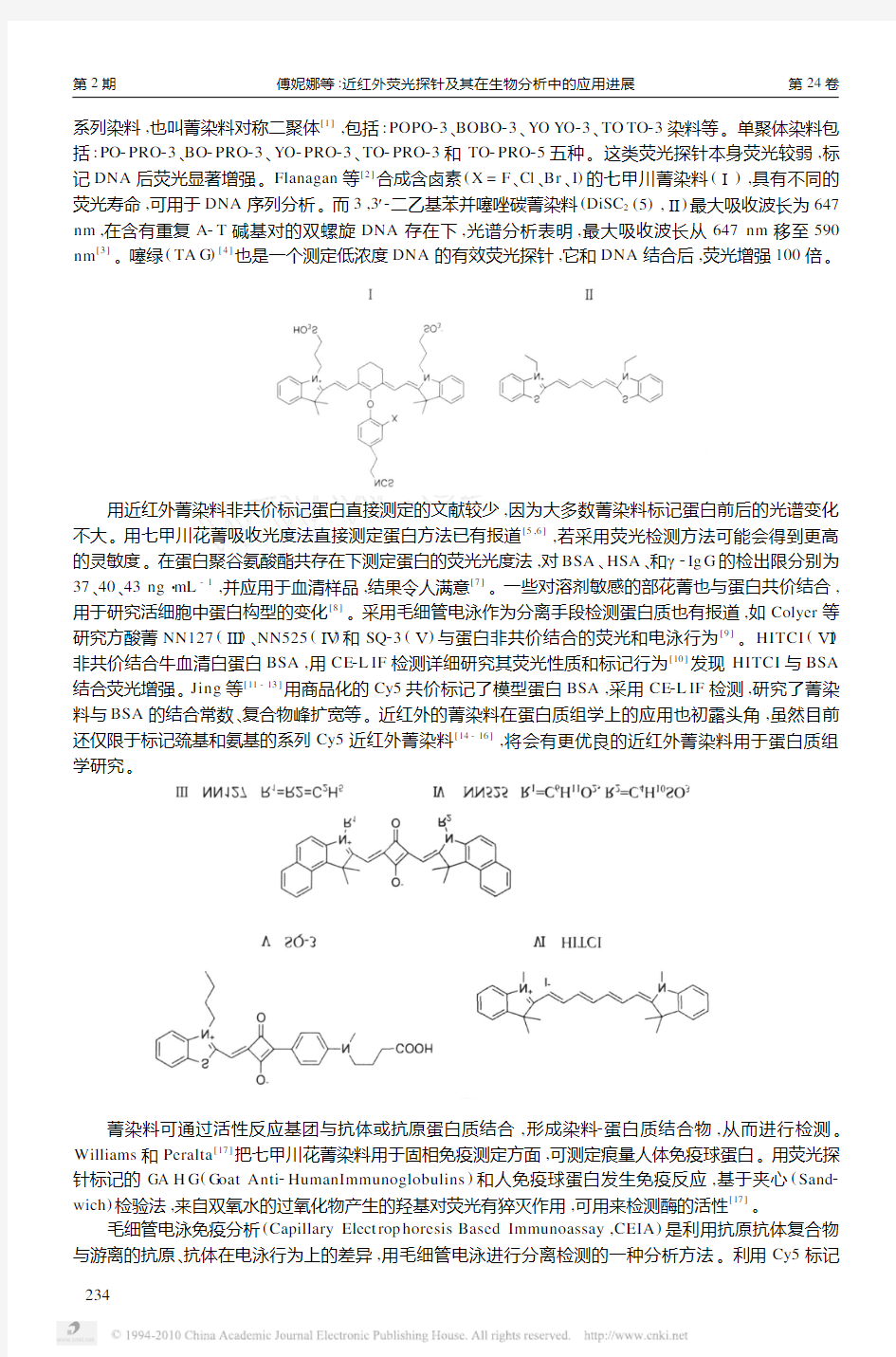
系列染料,也叫菁染料对称二聚体[1],包括:POPO23、BOBO23、YO YO23、TO TO23染料等。单聚体染料包括:PO2PRO23、BO2PRO23、YO2PRO23、TO2PRO23和TO2PRO25五种。这类荧光探针本身荧光较弱,标记DNA后荧光显著增强。Flanagan等[2]合成含卤素(X=F、Cl、Br、I)的七甲川菁染料(Ⅰ),具有不同的荧光寿命,可用于DNA序列分析。而3,3′2二乙基苯并噻唑碳菁染料(DiSC2(5),Ⅱ)最大吸收波长为647 nm,在含有重复A2T碱基对的双螺旋DNA存在下,光谱分析表明,最大吸收波长从647nm移至590 nm[3]。噻绿(TA G)[4]也是一个测定低浓度DNA的有效荧光探针,它和DNA结合后,荧光增强100倍。
用近红外菁染料非共价标记蛋白直接测定的文献较少,因为大多数菁染料标记蛋白前后的光谱变化不大。用七甲川花菁吸收光度法直接测定蛋白方法已有报道[5,6],若采用荧光检测方法可能会得到更高的灵敏度。在蛋白聚谷氨酸酯共存在下测定蛋白的荧光光度法,对BSA、HSA、和γ2Ig G的检出限分别为37、40、43ng?mL-1,并应用于血清样品,结果令人满意[7]。一些对溶剂敏感的部花菁也与蛋白共价结合,用于研究活细胞中蛋白构型的变化[8]。采用毛细管电泳作为分离手段检测蛋白质也有报道,如Colyer等研究方酸菁NN127(Ⅲ)、NN525(Ⅳ)和SQ23(Ⅴ)与蛋白非共价结合的荧光和电泳行为[9]。HITCI(Ⅵ)非共价结合牛血清白蛋白BSA,用CE2L IF检测详细研究其荧光性质和标记行为[10]发现HITCI与BSA 结合荧光增强。Jing等[11-13]用商品化的Cy5共价标记了模型蛋白BSA,采用CE2L IF检测,研究了菁染料与BSA的结合常数、复合物峰扩宽等。近红外的菁染料在蛋白质组学上的应用也初露头角,虽然目前还仅限于标记巯基和氨基的系列Cy5近红外菁染料[14-16],将会有更优良的近红外菁染料用于蛋白质组学研究。
菁染料可通过活性反应基团与抗体或抗原蛋白质结合,形成染料2蛋白质结合物,从而进行检测。Williams和Peralta[17]把七甲川花菁染料用于固相免疫测定方面,可测定痕量人体免疫球蛋白。用荧光探针标记的GA H G(G oat Anti2HumanImmunoglobulins)和人免疫球蛋白发生免疫反应,基于夹心(Sand2 wich)检验法,来自双氧水的过氧化物产生的羟基对荧光有猝灭作用,可用来检测酶的活性[17]。
毛细管电泳免疫分析(Capillary Elect rop horesis Based Immunoassay,CEIA)是利用抗原抗体复合物与游离的抗原、抗体在电泳行为上的差异,用毛细管电泳进行分离检测的一种分析方法。利用Cy5标记
432
第2期分析科学学报第24卷
免疫球蛋白形成的免疫传感器进行兽医诊断检测,可用于B rucell a s p.疾病感染的测定,患病绵羊血清中B rucell a s p.抗体含量在0.005mg?mL-1到0.11mg?mL-1,均可进行定量分析[18]。Cy5标记测定人唾液中分泌的免疫球蛋白A也有报道[19],采用含有150mmol?L-1硼酸,1%C HA PS,p H8.5的硼酸缓冲溶液进行分离,抗原抗体复合物与游离的抗原的分离效果最佳,并用于正常人和病人唾液样品测定。
MeCy52OSu(Ⅶ)是新近合成的菁染料近红外荧光标记试剂,以生物多胺作为分析对象,建立了毛细管电泳分离/激光诱导荧光检测生物多胺的新方法,线性范围在10~200nmol?L-1,检出限0.8~3.0 nmol?L-1。该方法已用于正常人和膀胱癌病人血红细胞中生物多胺的测定[20]。
近红外光谱区的荧光检测比可见光区的更加适合生物组织造影分析,对活体组织进行光学造影的基础在于光能渗透到组织内部,这种光渗透的深度和光的波长密切相关。采用大于600nm的光时,光渗透组织的深度可达数厘米,因而可以对一些比较大体积的组织进行造影,从而进行疾病诊断。在生物组织造影中用的最多、最著名的就是吲哚菁绿IC G(Indocyanine Green,Ⅷ),多用于临床活体组织的荧光造影。近年来更是作为动物中[21,22]和人体[23]癌症组织的检测。其它的一些花菁也被用于体内癌症的检测[25]。
Weissleder等[25]用活性蛋白酶2近红外花菁的生物结合物来检测癌症。由于许多癌症都会过多地表达一些小肽的受体(Receptors),如生长激素抑制素(Somatostain)等,因此Licha等人合成了用五甲川和七甲川花菁与生长激素抑制剂的结合物,并用于癌症造影[26,27]。叶酸(Folate)受体也是许多癌症特异性表达的,因此花菁2叶酸结合物也被用于癌细胞的检测[28]
3 含四吡咯(T etrapyrrole2based)基团的近红外荧光染料
含有四吡咯基团染料如卟啉、酞菁等是另一类重要的近红外荧光探针。卟啉探针主要用于研究生物大分子如DNA和蛋白质的结构、性能与功能,卟啉小分子与它们作用,通过荧光、磷光等光谱技术,测定其性能和结构的改变。卟啉与DNA的作用中可能有3种作用模式[29]:(1)外部作用模式,通过静电作用与范德华力在碱基富集的小沟区;(2)混合作用模式,既有插入又有外部作用模式;(3)一些容易聚合的卟啉在较高浓度及高盐浓度下在DNA表面发生长程堆积作用。
酞菁荧光光谱位于600~700nm,与卟啉相比酞菁对光、氧和热有较好的稳定性。水溶性酞菁以其独特的吸收和荧光特性在生化分析中的应用正日趋广泛。陈小兰等[30]以四胺基铝酞菁为红区荧光底物,建立了测定过氧化物酶和过氧化氢的荧光分析方法。许金钩研究组[31]以四磺酸基铝酞菁为荧光探针,建立了血清蛋白、白蛋白及球蛋白连续测定的方法,并研究了酞菁与牛血清白蛋白的相互作用。在疾病诊断组织造影方面,为了提高选择性,也将四吡咯的荧光探针与一些生物分子相连形成生物结合物,这些生物分子包括抗体[32],抗体片断[33,34],多肽[35],血清蛋白[36],雌激素[37]等。酞菁类染料的缺点是合成中溶解度小、体积大,会影响生物分子其他性能,这些都限制了它们在生物分析上更广泛的应用。
4 呫吨类荧光染料
呫吨类的染料主要包括荧光素和罗丹明两类经典的荧光染料。萘环荧光素是处于近红外光谱区[38]。一些新型的近红外罗丹明荧光染料如罗丹明800(Ⅸ)和德克萨斯红(Ⅹ),在生物分析上得到应用,罗丹明800曾用于对鸡肉组织进行荧光偏振示踪[39],它也被用于研究小鼠线粒体膜电势[40]。得克萨斯红在生物分析上也有一些应用[41-43]。美国的分子探针公司推出了一系列的Alex Fluoro[44,45]的呫吨类荧光探针,其波长范围可从可见光区到近红外光区。由于这类Alex Fluoro荧光探针中含有磺酸基,因此水溶性好,
532
第2期傅妮娜等:近红外荧光探针及其在生物分析中的应用进展第24卷适合生物样品的标记和分析。另外磺酸基的引入提高了分子的极性,降低了其在水中的聚集。
5 噻嗪类和噁嗪类近红外荧光染料
噻嗪类染料和噁嗪类染料均含有可用来进行标记的氨基基团,目前常用的这类染料主要有耐尔蓝
(Ⅺ)[47]、耐尔红[48,49]、亚甲基蓝(Ⅻ)[50,51]、噁嗪750[52]等。耐尔蓝(ⅩⅢ)衍生物用于羧酸的HPL C2L IF分析,检出限可达到3.98×10-11mol?L-1,对于血浆中芳香酸检出限为7.33×10-11mol?L-1。噻嗪类和噁嗪类近红外荧光探针具有合成较容易、分子较小等优点,但其不足之处在于它们的荧光量子产率偏低,故
限制了其应用。
6 近红外稀土配合物荧光探针
稀土配合物荧光探针主要是Eu3+和Tb3+的配合物荧光探针,其Stock’s位移大,且荧光寿命可达到
毫秒级,因此普遍应用于生物技术及时间分辨荧光检测技术上。Tb3+主要的发射峰大约在550nm附近,
而Eu3+的主要的发射峰大约在620nm附近。稀土配合物荧光探针还对外部环境的p H、共存离子如碱金
属离子、卤素离子等敏感,因此也常用于化学和生物传感器[53]。用Eu3+2四环素配合物直接荧光光度法测定卵磷脂的检出限达到3.9×10-8mol?L-1,并成功的用于血清样品中卵磷脂的测定[54]。这种配合物还用于检测烟碱二核苷酸腺嘌呤[55]。Eu3+2土霉素配合物测定三磷酸腺苷的灵敏度可达到2.67×10-9 mol?L-1[56]。Eu3+的配合物还用于灵敏的检测核酸,在Eu3+2苯甲酰丙酮2十六烷基溴化铵的体系中,核酸的存在会使荧光增强,因此这个体系被用于检测青鱼精子DNA、小牛胸腺DNA以及酵母RNA,检出
限分别为0.33、0.21、0.99ng?mL-1[57]。
稀土配合物荧光探针在活体检测癌症也有报道[60]。一种复杂的Eu3+配合物也被合成并用于细胞核
的染色和标记,且显示出对细胞核的高选择性标记[61]。
7 BODIPY类
二氟化硼2二吡咯甲烷(BODIP Y)荧光染料具有较高的摩尔吸光系数(ε>80000L?moL-1?cm-1)、较高的荧光量子产率、荧光对溶剂的极性和p H均不敏感、荧光光谱峰窄、荧光寿命长和光稳定性好等特点。在染料母体的3位上引入了苯乙烯基(ⅩⅣ)和在1,3位上引入了两个苯基(XV),合成出两种波长超过600nm的长波长荧光染料,采用邻苯二羰基化合物为原料,与羟胺反应,生成了异吲哚二甲烯化合物,然后与三氟化硼络合,形成了大共扼体系的BODIP Y(ⅩⅥ)。这类荧光染料的最大发射波长甚至超过了700nm。
近年来一些含有不同活性功能基团的BODIP Y也相继被合成,如活性酯类[62,63]、羧酸类等[64-66]。
632
第2期分析科学学报第24卷
8 近红外量子点荧光探针
1998年,Nie[67]和Weiss[68]两个研究小组分别发表论文,证明量子点可作为生物探针并且适用于活细胞体系,处于近红外光区的量子点可能为CdSe、Cd Te、Cd Hg Te/ZnS、Cd Te/CdSe、InP以及InAs等。通过改变量子点尺寸大小(图1),不同类型的量子点可以处于不同的波长范围并被应用[69-73]。量子点做为一种新兴的生物探针,其应用范围还在不断的扩大。但是它无法取代传统的有机小分子荧光探针,只能作为现有的有机小分子荧光探针的有力补充。因为它对活体组织的潜在毒性,生物相容性都有待进一步的探讨。关于量子点荧光探针综述见文献[74,75]
图1 量子点的代表性图示
Fig.1 R epresentative schemes of qu antum dots[75]
未来设计合成新的近红外荧光染料探针的方向是提高现有荧光试剂的荧光量子产率与近红外染料的长波长发射即低背景干扰相结合,同时要求新合成的荧光染料激发波长与激光光源相匹配,以获得最大的荧光强度。
参考文献:
[1] L IU Xin(刘 欣),WAN G Hong(王 红),ZHAN G Hua2shan(张华山).J.of Analytical Science(分析科学学报)[J],
2001:17(4):346.
[2] Flanagan J H J r,Owens C V,Romero S E,Waddell E,Kahn S H,Hammer R P,Soper S A.Anal.Chem.[J],1998,70:
2676.
[3] Seifert J L,Connor R E,Kushon S A,Wang M,Armitage B A.J.Am.Chem.Soc.[J],1999,121:2987.
[4] Owens C V,Davison Y Y,Kar S,Soper S A.Anal.Chem.[J],1997,69:1256.
[5] Li W R,Wang H,Yang T X,Zhang H S.Anal.Bioanal.Chem.[J],2003,377:350.
[6] Zheng H,Mao Y X,Li D H,Zhu C Q.Anal.Biochem.[J],2003,318:86.
[7] Zhu C Q,Wu Y Q,Zheng H,Chen J L,Li D H,Li S H,Xu J G.Anal.Lett.[J],2004,37:1115.
732
第2期傅妮娜等:近红外荧光探针及其在生物分析中的应用进展第24卷
[8] Toutchkine A,Kraynov V,Hahn K.J.Am.Chem.Soc.[J],2003,125:4132.
[9] Welder F,Paul B,Nakazumi H,Yagi S,Colyer C L.J.Chromatogr.B[J],2003,793:93.
[10]Yan W Y,Colyer C L.J.Sep.Sci.[J],2005,28:1409.
[11]Jing P,Kaneta T,Imasaka T.Electrophoresis[J],2002,23:2465.
[12]Jing P,Kaneta T,Imasaka T.J.Chromatogr.A[J],2002,959:281.
[13]Jing P,Kaneta T,Imasaka T.Electrophoresis[J],2002,23:550.
[14]Greengauz2Roberts O,Stoeppler H,Nomura S,Yamaguchi H,G oldenring J R,Podolsky R H,Lee J R,Dynan W S.Pro2
teomics[J],2005,5:1746.
[15]Karp N A,Kreil D P,Lilley K S.Proteomics[J],2004,4:1421.
[16]David W S.Proteome Analysis[M].Hanlon W A,Griffin P R,Chapter3,p75,Willy,2004.
[17]Williams R J,Peralta J M,Tsang V C W,Narayanan N,Casay M,Lipowska M,Strekowski L,Patonay G.Appl.Spec2
trosc[J],1997,51:1435.
[18]Silva M,Cruz H,Rossetti O,Arese A,Oliva A.Biotechnol.Lett.[J],2004,26:993.
[19]Liu C M,Tung K H,Chang T H,Chien C C,Yen M H.J.Chromatogr.B[J],2003,791:315.
[20]Fu N N,Zhang H S,Wang H.Electrophoresis[J],2007.28:822.
[21]Gurfinkel M,Thompson A B,Ralston W,Troy T L,Moore A L,Moore T A,Gust D,Tatmann D,et al.Photochem.
Photobiol.[J],2000,72:94.
[22]Licha K,Rief ke B,Ntziachristos V,Becker A,Chance B,Semmler W.Photochem.Photobiol.[J],2000,72:392.
[23]Ntziachristos V,Y odh A G,Schnall M,Chance B.Proc.Nat.Acad.Sci.[J],2000,97:2767.
[24]Becker A,Riefke B,Ebert B,Sukowski U,Rinneberg H,Semmler W,Licha K.Photochem.Photobiol.[J],2000,72:234.
[25]Weissleder R,Tung C H,Mahmood U,Bogdanov A J r.Nat.Biotechnol.[J],1999,17:375.
[26]Becker A,Hessenius C,Licha K,Ebert B,Sukowski U,Semmler W,Wiedenmann B,Grotzinger C.Nat.biotechnol.[J],
2001,19:327.
[27]Licha K,Hessenius C,Becker A,Henklein P,Bauer M,Wisniewski S,Wiedenmann B,Semmler W.Bioconjugate Chem.
[J],2001,12:44.
[28]Moon W K,Lin Y,O’Loughlin T,Tang Y,K im D E,Weissleder R,Tung C H.Bioconjugate Chem.[J],2003,14:539.
[29]Pasternack R F,Ewen S,Rao A,Meyer A S,Freedman M A,Collings P J,Frey S L,Ranen M C,de Paula J C.Inorg.
Chim.Acta[J],2001,317:59.
[30]Chen X L Li D H,Yang H H,Zhu Q Z,Zheng H,Xu J G.Anal.Chim.Acta[J],2001,434:51.
[31]CH EN Xiao2lan(陈小兰),L I Dong2hui(李东辉),XU Jin2gou(许金钩).Chem.J.Chinese University(等学校化学学
报)[J],2001,22:1120.
[32]Vrouenraets M B,Visser G W,Loup C,Meunier B,Stigter M,Oppelaar H,Stewart F A,Snow G B,van Dongen G A.
Int.J.Cancer[J],2000,88:108.
[33]Birchler M,Viti F,Zardi L,Spiess B,Neri D.Nat.Biotechnol.[J],1999,17:984.
[34]Duska L R,Hamblin M R,Bamberg M P,Hasan T Br.J.Cancer[J],1997,75:837.
[35]Bisland S K,Singh D,G ariepy J.Bioconjugate Chem.[J],1999,10:982.
[36]Brasseur N,Langlois R La,Madeleine C,Ouellet R,van LierJ E.Photochem.Photobiol.[J],1999,69:345.
[37]J ames D A,Swamy N,Paz N,Hanson R N,Ray R.Bioorg.Med.Chem.Lett.[J],1999,9:2379.
[38]Hussain Sarpara G,Hu S J,Miller J N,Palmer D A,French M T,Evans M https://www.doczj.com/doc/c517921444.html,mun[J],1999,36:19.
[39]Gryczynski Z,Abugo O O,Lakowicz J R.Anal.Biochem.[J],1999,273:204.
[40]Jilkina O,K ong H J,Hwi L,Kuzio B,Xiang B,Manley D,J ackson M,Kupriyanov V V I.J.Biomed.Opt.[J],2006,11:
014009/1.
[41]Horneffer V,Forsmanna A,Strupat K,Hillenkamp F,Kubitscheck U.Anal.Chem.[J],2001,73:1016.
[42]Arakawa H,Tsuji A,Maeda M,Kamahori M,Kambara H.J.Pharm.Biomed.Anal.[J],1997,15:1537.
[43]Ji J,Rosenzweig N,Griffin C,Rosenzweig Z.Anal.Chem.[J],2000,72:3497.
[44]Panchuk2Voloshina N,Haugland R P,Bishop2Stewart J,Bhalgat M K,Millard P J,Mao F,Leung W Y,Haugland R P.
J.Histochem.Cytochem.[J],1999,47:1179.
[45]Berlier J E,Rothe A,Buller G,Bradford J,Gray D R,Filanoski B J,Telford W G,Yue S,Liu J,Cheung C Y,Chang W,
Hirsch J D,Beechem J M,Haugland R P.J.Histochem.Cytochem.[J],2003,51:1699.
832
第2期分析科学学报第24卷
[46]Aguilar2Caballos M P,G omez2Hens A,Perez2Bendito D.J.Agric.Food Chem.[J],2000,48:312.
[47]Chen Q Y,Li D H,Zhao Y,Yang H H,Zhu Q Z,Xu J G.Analyst[J],1999,124:901.
[48]Polverini E,Cugini G,Annoni F,Abbruzzetti S,Viappiani C,Gensch T.Biochemistry[J],2006,45:5111.
[49]Hungerford G,Rei A,Ferreira M I C.FEBS J.[J],2005,272:6161.
[50]D’Amico F.Biotech.Histochem.[J],2005,80:207.
[51]Hu Y J,Liu Y,Zhao R M,Dong J X,Qu S S.J.Photochem.Photobio.A[J],2006,179:324.
[52]Kaneta T,Saito Y,Imasaka T.J.Chromatogr.A[J],1999,831:285.
[53]Parker D,Senanayake P K,Williams J A G.J.Chem.Soc.Perkin.Trans.[J],1998,2:2129.
[54]Wang T,Jiang C.Anal.Chim.Acta[J],2006,561:204.
[55]Peng Q,Hou F,G e X,Jiang C,G ong S.Anal.Chim.Acta[J],2005,549:26.
[56]Hou F,Miao Y,Jiang C.Spectrochim.Acta A[J],2005,61A:2891.
[57]Wu X,Guo C,Yang J,Wang M,Chen Y,Liu J.J.Fluoresc.[J],2005,15:655.
[58]Houlne M P,Hubbard D S,K iefer G E.,Bornhop D J.J.Biomed.Opt.[J],1998,3:145.
[59]Bornhop D J,Hubbard D S,Houlne,M P,Adair C,K iefer G E,Pence,B C,Morgan D L.Anal.Chem.[J],1999,71:
2607.
[60]Faulkner S,Beeby,A,Dickins,R S,Parker,D.,Williams,J A G.J.Fluoresc.[J],1999,9:45.
[61]Yu J,Parker D,Pal R,Poole R A,Cann M J.J.Am.Chem.Soc.[J],2006,128:2294.
[62]L uo Y,Prestwich G D.Bioconjugate Chem.[J],2001,12:1085.
[63]L uo Y,Prestwich G D.Bioconjugate Chem[J],1999,10:755.
[64]Basaric N,Baruah M,Qin W,Metten B,Smet M,Dehaen W,Boens https://www.doczj.com/doc/c517921444.html,.Biomol.Chem.[J],2005,3:2755.
[65]Mikhalyov I I,Molotkovsky J G.Russ.J.Bioorg.Chem.[J],2003,29:168.
[66]Z ou Z,Tong F,Faergeman N J,Borsting C,Black P N,DiRusso C C.J.Bio.Chem.[J],2003,278:16414.
[67]Chan W C,Nie S.Science[J],1998,281:2016.
[68]Bruchez M J r,Moronne M,G in P,Weiss S,Alivisatos A P.Science[J],1998,281:2013.
[69]Cao Y,Banin U,J.Am.Chem.Soc.[J],2000,122:9692.
[70]Bailey R E,Nie S.J.Am.Chem.Soc.[J],2003,125:7100.
[71]K im S,Fisher B,Eisler H J,Bawendi M.J.Am Chem.Soc[J],2003,125:11466.
[72]Tsay J M,Pflughoefft M,Bentolila L A,Weiss S Hybrid.J.Am Chem.Soc.[J],2003,126:1926.
[73]Yu W W,Falkner J C,Shih B S,Colvin V L.Chem.Mater.[J],2004,16:3318.
[74]Qun Huo.A Colloids and Surfaces:Biointerfaces[J],2007,59:1.
[75]Michalet X,Pinaud F F,Bentolila L A,Tsay J M,Doose S,Li J J,Sundaresan G,Wu A M,G ambhir S S,Weiss S.Sci2
ence[J],2005,307:538.
Progress in N ear2infrared Fluorescent Probe
and Its Bioanalytical Application
FU Ni2na,WAN G Hong,ZHAN G Hua2shan3
(1.College of Chemist ry and M olecul ar S ciences,W uhan Universit y,W uhan430072;
2.N anj i ng U ni versit y of Posts and Telecom m unications,N anj i n g210003)
Abstract:The near2inf rared fluorescent probe and it s application in biological analysis are reviewed.The indodicarbocyanines,tet rapyrrrole dyes(p ht halocyanine and porp hyrine),oxazine and t hiazine dyes, rhodamine dyes(rhodamine800,Alexa dyes etc),BODIP Y,lant hanide probes,quant um dot s,etc.are int roduced,and t heir biological and analytical applications are described.
K eyw ords:Near2inf rared fluorescent p robe;Fluorescence detection;Biological analysis
932
1 荧光定义 某些化学物质从外界吸收并储存能量而进入激发态,当其从激发态回到基态时,过剩的能量以电磁辐射的形式放射出去即发光,称之为荧光。可产生荧光的分子或原子在接受能量后引起发光,供能一旦停止,荧光现象随之消失。 2 荧光分类 由化学反应引起的荧光称为化学荧光,由光激发引起的荧光称为光致荧光,课题主要研究光致荧光。按产生荧光的基本微粒不同,荧光可分为原子荧光、X 射线荧光和分子荧光,课题主要研究分子荧光。 3 光致荧光机理 某一波长的光照射在分子上,分子对此光有吸收作用,光能量被分子所吸收,分子具有的能量使分子的能级由最低的基态能级上升至较高的各个激发态的不同振动能级,称为跃迁。分子在各个激发态处于不稳定的状态,并随时在激发态的不同振动能级下降至基态,在下降过程中,分子产生发光现象,此过程为释放能量的过程,即为光致荧光的机理。光致荧光的过程按照时间顺序可分为以下几部分。 分子受激发过程 在波长为10~400nm的紫外区或390~780nm的可见光区,光具有较高的能量,当某一特征波长的光照射分子时,是的分子会吸收此特征波长的光能量,能量由光传递到分子上,此过程为分子受激发过程。分子中的电子会出现跃迁过程,在稳定的基态向不稳定的激发态跃迁。跃迁所需要的能量为跃迁前后两个能级的能量差,即为吸收光的能量。分子跃迁至不稳定的激发态中即为电子激发态分子。 在电子激发态中,存在多重态。多重态表示为2S+1。S为0或1,它表示电子在自转过程中,具有的角动量的代数和。S=0表示所有电子自旋的角动量代数和为0,即所有电子都是自旋配对的,那么2S+1=1,电子所处的激发态为单重态, 用S i 表示,由此可推出,S 即为基态的单重态,S 1 为第一跃迁能级激发态的单重 态,S 2 为第二跃迁能级激发态的单重态。S=1表示电子的自旋方向不能配对,说明电子在跃迁过程中自旋方向有变化,存在不配对的电子为2个,2S+1=3,电子 在激发态中位于第三振动能级,称为三重态,用T i 来表示,T 1 即为第一激发态中 的三重态,T 2 即为第二激发态中的三重态,以此类推。
7 前 言 荧光比率技术是荧光分析中的一项重要技术。该技术在生物染色剂中,可被紫外线或蓝紫光(短波长光)激发而发射荧光的染料,称为荧光染料(荧光色素)。可被长波长光激发,这些荧光色素常称为荧光探针。荧光探针通常用于固定组织和细胞的染色,以及或活细胞中的应用, 此外还包括应用于体内荧光探针。 分子荧光探针按用途分类包括离子探针、极性探针、粘度探针、PH值探针、膜荧光探针、细胞活性探针、细胞器探针、位点特异性荧光探针等等。探针通过与分析物(如生命金属离子)进行结合后,引起荧光特性发生变化,通过测定荧光的激发波长、发射波长、荧光强度、峰位、荧光寿命、荧光量子产率和各向异性等,获得相关信息。 荧光方法测定中,荧光探针在与反应物结合后,出现激发或发射光谱移位的探针,可使用在两个不同波长测定的荧光强度比率进行测定,称为比率测量。因为通过二个选择性的波长的荧光强度变化可作为定量的依据, 通常指在波长范围内有荧光强度明显的变化。同普通荧光探针相比,比率测量探针可以被分为两部分。 一种是荧光比率效果是通过原来荧光谱的迁移。通常,这些迁移的背景是荧光探针激发态的电子转移。它被激发通过改变发色团同周围分子或原子交互作用的能量改变(溶剂化显色迁移),同外部电场的交互作用(电致显色迁移)和在发色团中的双电弛豫(双电弛豫迁移)。 另外一种结合探针,荧光谱包括2个或更多的谱带。通常,是这些谱带相对强度的改变,激发态同荧光探针发色团反应。这些反应在不连续的能量状态。 荧光比率探针及其应用研究进展 杨柳* ,郭成海,张国胜 (防化研究院第四研究所,北京 102205) 摘要 本文介绍了荧光比率探针,包括阳离子探针、阴离子探针、pH值探针、极性探针、氧化性和分子的比率测量探针的应用及近几年的研究进展。关键词 荧光分析,比率测量 *作者简介:杨柳(1975-),男,助理研究员,博士研究生,E-mail:yangliujinjin@sina.com 所以在初始和产物状态都随着能量转移而发射荧光。 荧光比率测定法可消除光漂白和探针负载和留存及设备因素(照明稳定性)引起的数据的失真。如阴离子探针可通过有机离子载体从细胞排除,如AM酯可被P糖蛋白多药载体排出荧光比率测定法可减少探针渗漏对实验结果的影响。探针与离子结合后,出现激发或发射光谱移位的探针可使用在两个不同波长测定的荧光强度比率校准,可克服由于离子浓度的变化而造成的荧光信号人工假象。 Bright等(1989)发现比率测量减少或消除几种决定因素的变化对测量荧光强度的影响,包括探针浓度、激发光的光路长度、激发强度、和检测效率。消除的人工假象包括光漂白、探针渗漏、细胞厚度、探针在细胞内(区室化作用引起)或不同细胞群之间(负载效率差异造成)的不均匀分布。 比率测量探针已经应用于不同的测量领域:离子探针(阳离子探针Ca2+、Mg2+,Zn2+,Ag+等)阴离子探针(Cl-,CN-,F-等),膜探针、活性氧和一氧化氮探针,极性探针、PH值探针等等。 1应用比率测量的阳离子探针: 各种各样的阳离子在生命活动中起重要的作用, 如构成细胞和生物体某些结构的重要成分,参与并调节生物体的代谢活动等,荧光方法通常用来测定阳离子在生物体不同组织的含量和分布。阳离子比率测量探针也在不断发展。 1.1 Ca2+检测的比率测量探针: 探针与Ca2+结合后出现光谱移位的探针可进行比率测量。主要包括:Fura-2、双- Fura-2、Fura-4F、Fura-5F、Fura-6F、 indo-1、indo-5F、mag-Fura-2
荧光化学传感器是建立在光谱化学和化学波导与量测技术基础上的将分析对象的化学信息以荧光信号表达的传感装置。其主要组成部件有三个(图 1.1):1.识别结合基团(R),能选择性地与被分析物结合,并使传感器所处的化学环境发生改变。这种结合可以通过配位键,氢键等作用实现。2.信号报告基团(发色团, F),把识别基团与被分析物结合引起的化学环境变化转变为容易观察到的输出信号。信号报告基团起到了信息传输的作用,它把分子水平上发生的化学信息转换成能够为人感知(颜色变化)或仪器检测的信号(荧光等)。3.连接基团(S),将信号报告基团和识别结合基团连接起来,根据设计的不同连接基团可有多种选择,一般用做连接基团的是亚甲基等短链烷基。连接基团的合适与否将直接影响是否有输出信号的产生。信号表达可以是荧光的增强或减弱、光谱的移动、荧光寿命的变化等。 图1.1 荧光探针的结构 1.1.1 荧光探针的一般设计原理 (1) 结合型荧光探针[21] +
Analyte Signalling subunit Space Binding subunit Output signal 图1.2 共价连接型荧光探针 结合型荧光探针是利用化学共价键将识别基团和荧光基团连接起来的一类荧光探针,是比较常见的一类荧光探针。该类探针通过对比加入分析物前后荧光强度的变化、光谱位置的移动或荧光寿命的改变等实现对分析物的检测。在该类荧光化学传感器的设计中,必须充分考虑下列三个方面的因素。(a) 受体分子的荧光基团设计、合成:考虑到用于复杂环境体系的荧光检测,要求荧光基团要有强的荧光(高荧光量子产率,有利于提高检测的灵敏性),Stokes 位移要大(可有效消除常规荧光化合物如荧光素等具有的自猝灭现象),荧光发射最好要在长波长区(最好位于500 nm 以上,可避免复杂体系的常位于短波长区的背景荧光的干扰,另外由于长波长区发射的荧光能量的降低可减少荧光漂白现象的发生而延长传感器的使用寿命)。(b) 受体分子的识别基团:受体分子的识别基团设计以软硬酸碱理论、配位作用以及超分子作用力(如氢键、范德华力等)作为理论指导,多选择含氮、硫、磷杂环化合物作为识别分子。(c) 荧光超分子受体的组装:组装荧光超分子受体就是利用一个连接基将识别基团和荧光基团通过共价键连接在一起,要充分考虑到识别基团和荧光
1.Fluo-3 AM (钙离子荧光探针) 原理Fluo-3 AM是一种可以穿透细胞膜的荧光染料。Fluo-3 AM的荧光非常弱,进入细胞后可以被细胞内的酯酶剪切形成Fluo-3,从而被滞留在细胞内,和细胞内游离 的钙离子结合,结合钙离子后可以产生较强的荧光。 生理意义细胞内钙离子增多是细胞损伤的结果,因此此探针能表征细胞损伤程度 激发波长506nm 发射波长526nm (绿色) 备注推荐使用 2.Mag-fura-2 AM(钙离子荧光探针) 原理Fura-2 AM是一种可以穿透细胞膜的荧光染料。Fura-2 AM进入细胞后可以被细胞内的酯酶剪切形成Fura-2,从而被滞留在细胞内。Fura-2可以和钙离子结合,结合 钙离子后在330-350nm激发光下可以产生较强的荧光,而在380nm激发光下则会 导致荧光减弱。这样就可以使用340nm和380nm这两个荧光的比值来检测细胞内 的钙离子浓度,可以消除不同细胞样品间荧光探针装载效率的差异,荧光探针的渗 漏,细胞厚度差异等一些误差因素。 生理意义细胞内钙离子增多是细胞损伤的结果,因此此探针能表征细胞损伤程度 激发波长为340nm和380nm 发射波长510nm (蓝色) 备注仪器滤光片不适用 3Fluo-4-AM (钙离子荧光探针) 原理Fluo 4 是一种将Fluo 3结构中的Cl替换成F的钙荧光探针。由于将Cl替换成了电子吸引力更强的F,它的最大激发波长会向短波长处偏离10 nm左右。所以用氩 激光器激发时,Fluo 4的荧光强度比Fluo 3强1倍。由于Fluo 4与钙离子的亲和力 和Fluo 3近似,所以使用上和Fluo 3也基本相同 生理意义细胞内钙离子增多是细胞损伤的结果,因此此探针能表征细胞损伤程度 激发波长494nm 发射波长516nm (绿色) 备注用激光器激发时荧光强度强,因此不推荐 4.DCFH-DA (活性氧荧光探针) 原理DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,被细胞内的酯酶水解生成DCFH。而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF。 生理意义检测细胞内活性氧表征细胞损伤程度 激发波长485nm 发射波长520nm (绿色) 备注推荐使用 5.DHR 123 (活性氧荧光探针) 原理本身无荧光, 在超氧化酶存在时可被过氧化氢(H2O2)氧化, 转变成发射绿色荧光的罗丹明123 (Rhodamine 123), 因此广泛应用于检测细胞内活性氧(ROS), 如过氧化物, 次氯酸和过氧亚硝基阴离子等。 生理意义检测细胞内活性氧表征细胞损伤程度 激发波长507nm 发射波长529nm (绿色) 备注氧化后成罗丹明123,荧光强度可能受到线粒体膜电位的影响 6.RhodamineI23 (线粒体膜电位荧光探针) 原理细胞膜通透的阴离子绿色荧光染料, 能够迅速被活线粒体摄取, 而无细胞毒性。 生理意义标记线粒体膜电位 激发波长488nm 发射波长515 ~ 575nm (绿色) 生理意义检测线粒体膜电位
《生物工程进展》2000,Vol.20,No.2 荧光探针研究新进展 章晓波 徐 洵 (国家海洋局第三海洋研究所,厦门 361005) 摘要 自从Southern(1975)首次进行DNA探针杂交后,至今核酸分子杂交已成为分子生物学的最基本方法。Matthews和Kricka[1]总结了各种杂交方法,将其归为两大类:一是异相杂交(hetero2 geneous assay)即固相杂交,目的核酸结合于不溶性支持物上;二是同相杂交(homogeneous assay)即液相杂交,一般同时使用两个探针。为了检测杂交,寡核苷酸探针需要标记,探针的标记物有放射性同位素和非放射性标记物。固相杂交常使用放射性同位素,荧光素是一种非放射性标记物,它能检测到的DNA浓度比吸收减色测定方法所需DNA浓度低100-1000倍[2],在同相杂交中广泛用于探针的标记。最近,荧光探针研究获得了新的进展,Tyagi和Krammer(1996)建立了一种新的荧光探针-分子信标探针,并得到许多应用,我们实验室也开展了这方面的研究。本文拟对荧光探针的研究进展作一综述。 关键词 荧光探针 分子信标探针 荧光PCR 1 常规荧光探针 固相杂交中,探针非特异结合于支持物表面,降低了灵敏度。Heller等(1982)以及Heller和Morri2 son(1985)[3]最早进行了同相杂交试验,同相杂交不需支持物,减少了固定目的DNA及除去未杂交探针等操作。他们的试验中使用了两个探针,这两个探针分别与目标DNA的两个相邻区域互补,第1探针在3′末端标记,第2探针在5′末端标记,根据标记物的光谱特性,使第1标记物为第2标记物的能量供体。当探针与目标DNA杂交时,二探针彼此靠近,光吸收或化学反应激发供体标记物,通过能量转移引起受体标记物的激发,这样,第1标记物发射光的减少以及(或)第2标记物发射光的增加标志着目标DNA的存在。 后来Morris on等[3]扩展了这一方法,他们使用的两个探针互补且相应于目标DNA上同一碱基序列,一个探针在5′末端标记荧光素,另一互补探针在3′末端标记荧光素发射的淬灭剂芘丁酸(pyrenebutyrate)或磺基若丹明101(sulforhodamine101)。无目标DNA 时,两探针结合,荧光素的能量转移至淬灭剂,不产生荧光。存在目标DNA时,探针与目标DNA之间竞争杂交,由于探针与目标DNA的结合,在494-496nm 光照下,产生荧光,目标DNA浓度越高,荧光信号越强,最低可检测到4pM的目标DNA,此方法得到一些应用[2,4,5]。Cardullo等[4]在应用Morris on方法的同时,提出在两个互补探针的5′末端分别标记荧光素和四甲若丹明(T etramethylrhodamine),因为荧光共振能量转移(fluorescence res onance energy trans ferr FRET)的效率随供体和受体之间距离的-6次方而减少,当两者相距20个核苷酸(70!)即产生不明显的能量转移,因此此方法中所使用的探针长度较短,特异性降低。 2 分子信标探针 同相杂交一般同时采用两个标记探针,Tyagi 和Kramer(1996)[6]首次建立了分子信标探针(molecular beacon probe),在同一寡核苷酸探针的5′末端标记荧光素、3′末端标记淬灭剂(DABCY L)。分子信标探针能形成发夹结构,探针的噜扑环与目的DNA碱基互补,噜扑环两侧为与目的DNA无关的碱基互补的臂。无目的DNA时,探针形成发夹结构,荧光素靠近淬灭剂,荧光素接受的能量通过共振能量转移至淬灭剂,DABCY L吸收能量后以热量形式消失,结果不产生荧光。当探针遇到目的DNA 分子时,形成一个比两臂杂交更长也更稳定的杂交,探针自发进行构型变化,便两臂分开,荧光素和淬灭剂随之分开,此时在紫外照射下,荧光素产生荧光。 影响分子信标探针构型变化的参数主要有[6]:臂长、臂序列GC含量、噜扑环长度和溶液盐浓度,尤其是二价阳离子如Mg2+对两臂形成的杂交茎有较强的稳定作用,在Mg2+存在条件下,4~12个核 41
精心整理 1. Fluo-3AM (钙离子荧光探针) 原理Fluo-3AM 是一种可以穿透细胞膜的荧光染料。Fluo-3AM 的荧光非常弱,进入细胞后可以 被细胞内的酯酶剪切形成Fluo-3,从而被滞留在细胞内,和细胞内游离的钙离子结合,结合钙离子后可以产生较强的荧光。 生理意义细胞内钙离子增多是细胞损伤的结果,因此此探针能表征细胞损伤程度 激发波长506nm 发射波长526nm (绿色) 备注推荐使用 2. Mag-fura-2AM (钙离子荧光探针) 原理Fura-2AM 是一种可以穿透细胞膜的荧光染料。Fura-2 AM 进入细胞后可以被细胞内的酯 3 4. 成5. 原理本身无荧光,在超氧化酶存在时可被过氧化氢(H2O2)氧化,转变成发射绿色荧光的罗丹明 123(Rhodamine123),因此广泛应用于检测细胞内活性氧(ROS),如过氧化物,次氯酸和过氧亚硝基阴离子等。 生理意义检测细胞内活性氧表征细胞损伤程度 激发波长507nm 发射波长529nm (绿色) 备注氧化后成罗丹明123,荧光强度可能受到线粒体膜电位的影响 6. RhodamineI23(线粒体膜电位荧光探针) 原理细胞膜通透的阴离子绿色荧光染料,能够迅速被活线粒体摄取,而无细胞毒性。 生理意义标记线粒体膜电位 激发波长488nm 发射波长515~575nm (绿色) 生理意义检测线粒体膜电位
备注正在使用 7.Hoechst33342(DNA荧光探针) 原理Hoechst33342是一种可对DNA染色的细胞核染色试剂,常用于细胞凋亡检测。Hoechst 染料可透过细胞膜在聚AT序列的富集区域的小沟处与DNA结合并对DNA染色而发出强 烈的蓝色荧光。 生理意义标记双链DNA 激发波长355nm发射波长465nm(蓝色) 备注正在使用 8.FDA 原理FDA可透过细胞膜并作为荧光素积蓄在活细胞内。 生理意义反映细胞膜完整性和细胞活力 9.PI( 倍。 10.EB 11.DAPI 20 12.CalceinAM 原理Calcein-AM由于在Calcein(钙黄绿素)的基础上加强了疏水性,因此能够轻易穿透活细胞膜。当其进入到细胞质后,酯酶会将其水解为Calcein(钙黄绿素)留在细胞内,发出强绿色 荧光,且细胞毒性很低,适合用于活细胞染色。 生理意义检测细胞膜完整性 激发波长494nm发射波长517nm(绿色) 备注跟FDA功能类似,细胞毒性很低,可以长时间标记细胞,但价格比较贵 13.BCECF-AM(pH荧光探针) 原理BCECF-AM是一种可以穿透细胞膜的荧光染料,BCECF-AM没有荧光,进入细胞后被细胞内的酯酶水解成BCECF,从而被滞留在细胞内。BCECF在适当的pH值情况下可以被激发 形成绿色荧光。 生理意义检测细胞内pH
有机化学 Chinese Journal of Organic Chemistry ARTICLE * E-mail: yuhaibo@https://www.doczj.com/doc/c517921444.html, Received September 23, 2014; revised November 18, 2014; published online December 2, 2014. Project supported by the National Natural Science Foundation of China (21302080). Program Funded by Liaoning Province Education Administration (L2014010). 国家自然科学基金(No.21302080),辽宁省教育厅科研项目(No.L2014010)资助项目. DOI: 10.6023/cjo201409036 研究论文 基于EET 机理比率型荧光探针的研究进展 陈忠林a 李红玲a 韦驾a 肖义b 于海波a ,* (a 辽宁大学 环境学院 沈阳 110036) (b 大连理工大学 精细化工国家重点实验室 大连 116024) 摘要 激发态能量转移(Excitation Energy Transfer, EET )作为一类重要的光物理现象,被广泛用于比 率型荧光探针和分子灯标的设计以及DNA 检测等多个领域。影响EET 效率的两个重要因素是供受体间的空间距离和光谱交盖,通过调节供受体间的空间距离或光谱重叠程度来调控能量转移过程,实现对目标客体的双波长比率检测。本文综述了基于不同供受体荧光团的EET 体系、供受体间的连接方式对能量转移效率的影响,以及通过调控供受体间光谱重叠程度或空间距离,获得识别不同客体的比率型荧光探针,并对EET 机理的比率型荧光探针的设计以及未来在生物成像和医学检测等领域的应用进行了展望。 关键词 荧光探针; 激发态能量转移; F?rster 能量转移; 比率型荧光探针; 荧光发色团 Recent Progress in Ratiometric Fluorescent Probes Based on EET Mechanism Chen Zhonglin a Li Hongling a Wei Jia a Xiao Yi b Yu Haibo a * (a College of Environmental Sciences, Liaoning University, Shenyang) (b State Key Laboratory of Fine Chemicals, Dalian University of Technology, Dalian) Abstract Excitation Energy Transfer (EET) is one of the vital photophysical phenomenons, which is wide-ly used in many applications, such as the design of ratiometric fluroesent probes, molecular beacon and DNA analysis, and so on. The process of energy transfer from donor to acceptor can be regulated by two factors: the spatial distance between donor and acceptor, and the spectral overlaps between donor’s emission and acceptor’s absorption, which results that there is a wide variety in the ratio at two different wavelengths of ratiometric fluo-rescent probes. In this review, noticeable EET systems with different donor fluorophore, connection form and energy transfer efficiency between donor and acceptor, and the modulation of spatial distance or spectral overlap are summarized. Finally, as a promising tool, the future developing prospects of EET fluorescent probes in bioi-maging and medical diagnostics are discussed and highlighted. Keywords Fluorescent probe, Excitation energy transfer, F?rster resonance energy transfer, Ratiometric probe, Fluorophore 随着荧光显微成像技术和时间分辨技术的迅速发展,基于超分子化学和有机染料的荧光探针现已成为研究生物学和医学领域相关问题的重要工具。荧光探针在与目标客体相互作用过程中荧光信号会发生改变,借助于荧光信号的变化,荧光探针能够对目标客体进行实时在线的检测或监测,并被广泛用于分析化学,生物化学,医学和环境监测等多个领域[1]。荧光探针主要有三种类型:淬灭型、增强型和比率型。由于增强型荧光探针在与目标客体作用后,荧光输出信号增强,在荧光显微成像中比淬灭型荧光探针更为灵敏,故增强型荧光探针是目前荧光探针领域设计的主流[2]。 与增强型荧光探针相比,比率型荧光探针在定量检测方面具有明显的优势,近些年来,比率型荧光探针的设计
生物化学与分子生物学进展(基础) 概论、目的基因 分子克隆的载体 核酸序列分析 聚合酶链反应(自学) 分子克隆技术常用的工具酶(自学) 肿瘤转移的分子机制 新生血管研究与转化医学 细胞周期与细胞增殖 基因打靶的设计与实现 细胞分化的分子机制 医学系统生物学和蛋白质组学 细胞信号转导 一、1.操纵子那张图 以乳糖操纵子为例,其组成:大肠杆菌乳糖操纵子含Z、Y、A三个结构基因,分别编码半乳糖苷酶、透酶和半乳糖苷乙酰转移酶,此外还有一个操纵序列O,一个启动子P和一个调节基因I 存在诱导物(乳糖)时,mRNA得到转录;不存在诱导物时,mRNA无法转录。 (1)阻遏蛋白的负性调节:没有乳糖存在时,I基因编码的阻遏蛋白结合于操纵序列O处,乳糖操纵子处于阻遏状态,不能合成分解乳糖的三种酶;有乳糖存在时,乳糖作为诱导物诱导阻遏蛋白变构,不能结合于操纵序列,乳糖操纵子被诱导开放合成分解乳糖的三种酶。(2)CAP的正性调节:在启动子上游有CAP结合位点,当大肠杆菌从以葡萄糖为碳源的环境转变为以乳糖为碳源的环境时,cAMP浓度升高,与CAP结合,使CAP发生变构,CAP结合于乳糖操纵子启动序列附近的CAP结合位点,激活RNA聚合酶活性,促进结构基因转录,调节蛋白结合于操纵子后促进结构基因的转录,对乳糖操纵子实行正调控,加速合成分解乳糖的三种酶。 2.概念 (1)基因诊断:利用分子生物学技术,通过检测基因及基因表达产物的存在状态,对人体疾病作出诊断的方法。基因诊断检测的目标分子是DNA、RNA,也可以是蛋白质或者多肽。(2)基因治疗:指将目的基因通过基因转移技术(病毒载体介导或者非病毒载体介导的基因转移技术)导入靶细胞内,目的基因表达产物对疾病起治疗作用。包括直接导入外源正常基因、采用适当的技术抑制细胞内过度表达的基因、将特定的基因导入非病变细胞等。(3)pBR322:大小为4.36kb的环状双链DNA,其碱基序列已经全部清楚,是最早应用于基因工程的大肠杆菌质粒载体之一,有过百个限制性内切酶切点,一种限制性内切酶只有单一切口的位点也多达数十个。 (4)pUC质粒系列:是在pBR322基础上改建成的。大小约2.69kb,去除了pBR322的抗四环素区段,含LacZ基因及其启动子的操纵基因、M13的多聚接头polylinker。含有易于检测是否有外源DNA插入的标记基因LacZα,可利用α互补原理进行蓝白筛选。 3.分子医学的主要研究内容 分子医学是指从基因的角度重新认识疾病,运用基因技术预防、诊断和治疗疾病。研究内容主要包括疾病的分子机理、基因诊断、基因治疗和基因预防这四个方面。 (1)疾病的分子机理:探索疾病的原因,是有效治疗疾病的前提。基因科学的发展,为人类从细胞内部的微观生理学和分子生物学水平上寻找病因提供了新的思路。以尿黑酸症为例,
有机双光子材料的研究进展 随着以光电子学为中心的信息时代的到来,具有特殊信息处理功能和超快响应的光电材料将成为未来信息材料发展的主体,而非线性光学材料就是其中发展较为迅猛的一种。非线性光学是强光光学,研究的是物质在强光作用下产生的输出光强度与原入射光的非线性关系。非线性光学材料在强光作用下,反映介质性质的物理量(如极化强度P等)不仅与场强E的一次方有关,而且还决定于E的更高幂次项,从而导致许多在线性光学中不能解释的新现象,表现出独特的非线性光学性质。双光子吸收属于三阶非线性光学效应的一种,有着独特的光学和电学效益,使得双光子技术在未来光电子集成、生物分子探测、医学诊断等领域具有巨大的应用潜力和广阔前景[1]。 一、双光子吸收的基本概念 双光子吸收属于三阶非线性光学效应,该理论最早是由Goeppert- Mayer于1931年首次提出的。它是指在强激光激发下,利用近两倍于样品的线性吸收波长的光源激发该样品,使其通过一个虚中间态(virtue state)直接吸收两个光子跃迁至高能态的过程,所吸收的两个光子的能量可以相同(ω1=ω2,简并吸收),也可以不同(ω1≠ω2,非简并吸收),其机理如图1所示。 图1 单、双光子吸收和发射机理示意图 和单光子吸收和发射相比,双光子吸收和发射有以下本征特点: (1)在材料中高的穿透深度。单光子荧光过程是短波激发长波发射,吸收和发射所涉及的基元光物理过程服从Stark-Einstein定律。而双光子荧光是长波激发短波发射,所用激发光的波长红移近一倍,一般位于600-900nm,远远低于单光子过程紫外辐照光(波长为250-400nm)的光子能量。这一波段的光具有很好的穿透性,Rayleigh散射小,背景光干扰小,便于观测,并且光损伤、光漂白、光毒性都较小。
荧光分析法的特点及在环境分析中的应用 摘要:论文综述了荧光分析法的特点及在环境分析中的应用。重点分析了荧光分析法的原理、特点,以及常用的荧光分析法的讨论。分析了荧光分析法在环境监测中的应用,测定范围和发展情况。 关键词:荧光分析;环境分析;应用 1.引言 环境中分析、监测的对象往往是微量、超微量的物质,有很多还具有时间性和空间性,因此对分析技术要求越来越高。荧光分析法和分光光度法以其灵敏度高、检测限低、准确性好等优点在近年来得到了迅速发展。荧光分子探针的设计合成以及荧光分析法在环境分析化学中的应用是方兴未艾的研究方向[1]。 分子荧光分析具有检测限低,灵敏度高,选择性好,取样量少,方法简捷快速等特点,是一种重要的光谱化学分析手段,其中荧光分子探针检测技术在环境分析化学中占有重要的地位[2]。因此,在对环境的分析中,荧光分析法应用非常广泛,从天然水、饮用水到废水、污水;从土壤、大气到动植物;从人的头发、骨骼、血液到内脏等各个器官,涉及到的样品和应用范围几乎无所不有[3]。 2.荧光分析法的原理和特点 2.1.荧光分析法 2.1.1荧光及荧光分析 荧光是荧光化合物在受到紫外光、电和化学等能量激发后,电子从基态跃迁到激发态,然后通过辐射衰变释放出光子而回复到基态,即产生荧光。这些物质会在极短的时间内(8-10秒)发射出各种颜色和不同强度的可见光,而当紫外光停止照射时,所发射的光线也随之很快地消失。 荧光分析是指利用某些物质在紫外光照射下产生荧光的特性及其强度进行物质的定性和定量的分析的方法。1852年G.G.斯托克斯(G.G.Strokes)发现荧光,真正的荧光光谱测量则始于本世纪60年代。 2.1.2荧光激发光谱和发射光谱 荧光是一种光致发光现象,由于分子对光的选择性吸收,不同波长的入射光便具有不同的激发效率。如果固定荧光的发射波长不断改变激发光的波长,并记
第46卷第7期2018年4月广 州 化 工 Guangzhou Chemical Industry Vol.46No.7Apr.2018 谷胱甘肽荧光探针的研究进展 * 石 磊1,2,黄 玲3,龚盛昭1,2 (1广东轻工职业技术学院轻化工技术学院,广东 广州 510300;2广东省绿色日用化工工程技术研究中心,广东 广州 510300;3佛山市安安美容保健品有限公司,广东 佛山 528099) 摘 要:谷胱甘肽在生物体的许多生理过程中发挥着重要作用,所以细胞内谷胱甘肽含量的检测对细胞功能研究和病理分 析都具有重要的意义三以荧光探针为基础的荧光分析法因其操作简便二灵敏度高和专一性强等优点而备受大家关注,并且有机小分子荧光探针还可以应用于活体细胞和生物体的成像技术三本文主要综述了近年来谷胱甘肽荧光探针的研究现状,并按照谷胱甘肽与探针识别基团的识别机理分类阐述,同时对谷胱甘肽荧光探针的未来发展趋势进行了展望三 关键词:谷胱甘肽二荧光探针二识别机理二检测 中图分类号:O657.3 文献标志码:A 文章编号:1001-9677(2018)07-0023-06 * 基金项目:广东轻工职业技术学院人才类项目(项目编号:KYRC2017-0031)三第一作者:石磊(1985-),男,博士,讲师,主要从事荧光探针的合成与应用三通讯作者:龚盛昭三 Research Progress on Fluorescent Probes for Glutathione * SHI Lei 1,2,HUANG Ling 3,GONG Sheng -zhao 1,2 (1School of Chemical Engineering and Technology,Guangdong Industry Polytechnic,Guangdong Guangzhou 510300;2Guangdong Engineering Technical Research Center for Green Household Chemicals,Guangdong Guangzhou 510300; 3Foshan Anan beauty &Health products Co,Ltd,Guangdong Foshan 528099,China)Abstract :Glutathione plays an important role in many physiological processes of life system,and the detection of glutathione in cell is significant for the research of cell function and pathological analysis.Fluorometric analysis based on fluorescent probes has attracted much attention due to its advantages,such as simple operation,high sensitivity and specificity.Moreover,the organic fluorescent probes could also be applied to bioimaging technology for living cells and organisms.The research progress on glutathione fluorescent probes was introduced and classified according to the recognition mechanism between glutathione and recognition groups of probes,and the developing trends of fluorescent probes for glutathione were prospected. Key words :glutathione;fluorescence probe;recognition mechanism;detection 谷胱甘肽(Glutathione,缩写GSH)是一种含有巯基二氨基和γ-酰胺键的三肽,主要由谷氨酸二半胱氨酸和甘氨酸组成三谷胱甘肽是细胞内一种重要的调节代谢物质;它不仅能够清除体内的过氧化物及其他自由基,促进肝脏酶活性二解毒和维持红细胞膜完整性等作用,同时还具有维持DNA 的生物合成和细胞免疫等多种生理功能[1-2]因此,检测生物体中的GSH 含量对于一些疾病的预防二研究和治疗都具有十分重要的作用,故而引起了诸多科研工作者的高度关注[3-4]三 相比于分光光度法二色谱法二毛细管电泳法二电化学法等传统检测方法,以荧光探针为基础的荧光分析法具有测试简单二选择性高二响应时间短等优点三更重要的是,荧光探针还能应用于生物体内的实时监测和生物成像研究,故而被广泛应用于生物医学二分析化学和化学生物学等诸多领域[5-6]三 近年来,基于谷胱甘肽的荧光探针得到了迅猛发展;若按照谷胱甘肽与荧光探针识别基团的识别机理进行分类,可以将 其分为加成反应取代反应和还原反应三本文主要综述了近年来谷胱甘肽荧光探针的设计合成与应用进展,并分类阐述如下三 1 加成反应 加成反应是利用GSH 中具有亲核性的巯基与不饱和双键(主要是碳碳双键)发生加成反应,使得探针的荧光发射光谱发生变化,从而实现对检测对象的识别与检测三 1.1 马来酰亚胺类 自Kanaoka [7]首次报道了以马来酰亚胺作为生物硫醇识别基团的荧光探针以来,基于马来酰亚胺的香豆素二BODIPY二喹啉二萘酐等[8-10]荧光探针陆续涌现出来,并成功应用于生物体内GSH 的选择性识别(图1)三然而,按此原理构建的大部分荧光探针对半胱氨酸(Cys)二同型半胱氨酸(Hcy)和GSH 均有响应,很难对这三者进行区分;仅少许报道是例外三其中,
1荧光定义 某些化学物质从外界吸收并储存能量而进入激发态,当其从激发态回到基态时,过剩的能量以电磁辐射的形式放射出去即发光,称之为荧光。可产生荧光的分子或原子在接受能量后引起发光,供能一旦停止,荧光现象随之消失。 2荧光分类 由化学反应引起的荧光称为化学荧光,由光激发引起的荧光称为光致荧光,课题主要研究光致荧光。按产生荧光的基本微粒不同,荧光可分为原子荧光、X 射线荧光和分子荧光,课题主要研究分子荧光。 3光致荧光机理 某一波长的光照射在分子上,分子对此光有吸收作用,光能量被分子所吸收,分子具有的能量使分子的能级由最低的基态能级上升至较高的各个激发态的不同振动能级,称为跃迁。分子在各个激发态处于不稳定的状态,并随时在激发态的不同振动能级下降至基态,在下降过程中,分子产生发光现象,此过程为释放能量的过程,即为光致荧光的机理。光致荧光的过程按照时间顺序可分为以下几部分。 3.1 分子受激发过程 在波长为10~400nm的紫外区或390~780nm的可见光区,光具有较高的能量,当某一特征波长的光照射分子时,是的分子会吸收此特征波长的光能量,能量由光传递到分子上,此过程为分子受激发过程。分子中的电子会出现跃迁过程,在稳定的基态向不稳定的激发态跃迁。跃迁所需要的能量为跃迁前后两个能级的能量差,即为吸收光的能量。分子跃迁至不稳定的激发态中即为电子激发态分子。 在电子激发态中,存在多重态。多重态表示为2S+1 o S为0或1,它表示电子在自转过程中,具有的角动量的代数和。S=0 表示所有电子自旋的角动量代数和为0,即所有电子都是自旋配对的,那么2S+仁1,电子所处的激发态为单重态,用S i 表示,由此可推出,S0 即为基态的单重态,S1 为第一跃迁能级激发态的单重态,S2为第二跃迁能级激发态的单重态。S=1表示电子的自旋方向不能配对,说明电子在跃迁过程中自旋方向有变化,存在不配对的电子为2个,2S+仁3,电子在激发态中位于第三振动能级,称为三重态,用T i 来表示,T1 即为第一激发 态中的三重态,T2即为第二激发态中的三重态,以此类推。 分子跃迁至各个激发态中,状态不稳定,随时会释放出能量,释放能量的类型有两种:一种是辐射跃迁,另一种是非辐射跃迁,释放能量会回到稳定的基态。
医药化工化 工 设 计 通 讯 Pharmaceutical and Chemical Chemical Engineering Design Communications ·204· 第44卷第6期2018年6月香豆素又名苯并-α-吡喃酮,广泛存在于自然界中,并且 在许多植物中也存在大量的香豆素类衍生物[1]。香豆素类化合 物不仅在抗肿瘤药物的开发方面进行研究,并且以香豆素为骨架的基团也常作为荧光探针中最优的荧光团之一,其具有荧光强度高、溶解性与细胞渗透性好、易于合成与修饰、良 好的荧光量子产率和好的光稳定性等特点。本文通过以香豆素为骨架的荧光探针对待测物的选择性不同进行分类,对近几年报道的香豆素类荧光探针进行了概述。 1 二氧化硫衍生物荧光探针 二氧化硫溶于水中,形成亚硫酸盐和亚硫酸氢盐之间的 平衡[2]。高浓度的亚硫酸盐会导致过敏反应、哮喘、胃肠疾病及皮肤过敏等疾病[3]。因此,用荧光探针技术来检测细胞中HSO 3-/SO 32-具有重要意义。Zhao 等将香豆素和苯并咪唑通过C —C 双键连接得到荧光探针1[2],亚硫酸盐与该探针的α,β-不饱和酮之间的发生迈克尔加成反应,导致π共轭被阻断,荧光发生改变。该探针利用单光子荧光成像技术成功的实现了对活细胞中亚硫酸盐的检测。Feng 课题组以氮杂香豆素-半花菁偶联物为母核,设计合成比率型近红外荧光探针2[4]。该探针在条件温和的水溶液中对HSO 3-有好的选择性和高的灵敏度,成功应用于活 细胞中内源性和外源性亚硫酸氢盐的荧光成像研究。Li 课题组设计合成了以香豆素-丙二腈衍生物为骨架,以缺电子的C —C 双键为HSO 3-的反应位点的比率型荧光探针3[5]。该探针对 HSO 3-有高的选择性和敏感性,并且成功应用于对MCF-7细胞中HSO 3-荧光成像的研究。2 活性氧荧光探针活性氧(Reactive Oxygen Species ,ROS )包括了超氧阴离子(O 2-)、过氧化氢(H 2O 2)、羟基自由基(·OH )、次氯酸(HOCl )以及一氧化氮等,这些物质的活性较高,在人类健康和疾病中有着重要的作用[6]。Liu 等以双光子可激发的香 豆素基团为荧光团,苯偶酰为荧光淬灭和H 2O 2的特异性识别基团设计了荧光探针[7]。该探针在H 2O 2的存在下,苯偶酰基团可以通过Baeyer-Villiger 反应转化为苯甲酸酐,然后苯甲酸酐水解得到苯甲酸,并释放荧光团。该探针成功运用单光子和双光子进行了实验,表现出对H 2O 2的选择性要高于其他活性氧分子,具有高灵敏度。运用单光子显微镜和双光子显微镜实现了其在MKN-45细胞中对H 2O 2的成像研究。Yoon 等以香豆素-半花菁染料为骨架,通过C —C 双键连接设计合成了荧光探针[8]。荧光探针中的双键被ONOO -氧化,大的共轭被阻断,从而导致ICT 过程被破坏,并成功应用于细胞中内源性和外源性ONOO -的检测。Zhao 课题组基于FRET 机理以香豆素-苯乙烯基-苯并噻吩为母核设计合成了靶向于线粒体基团的荧光探针[9]。并且该探针可靶向于细胞的 线粒体,成功应用于RAW264.7细胞中内源性和外源性ClO -的检测。Lin 等以苯并吡喃-香豆素为骨架设计合成了选择性检测ClO -的荧光探针[10]。次氯酸盐与该探针的α,β-不饱 和羰基发生反应导致π共轭体系中断从而产生香豆素基团的荧光性质,该探针具有低的细胞毒性及成功应用于Hela 细胞中次氯酸盐的荧光成像研究。3 硫醇化合物荧光探针硫醇类化合物与人类的生活、健康和疾病有着密切的联系。例如,半胱氨酸(Cys )、高半胱氨酸(Hcy )和谷胱甘肽(GSH )等生物小分子硫醇在维持氧化还原稳定、生物催化、结合金属和翻译后的修饰中起着重要的作用[11];硫化氢(H 2S )是一氧化氮(NO )和一氧化碳(CO )之后的第三种气体信号分子[12]。在血管舒张、血管生成、细胞凋亡、炎症、神经调节和保护缺血再灌注的损伤等生理过程中起重要作用[13]。因此,在生理条件下硫醇化合物进行检测具有重要的意义。 Feng 等以香豆素-TCF 骨架为荧光团,丙烯酸酯为反应基团得到荧光探针[14],在GSH/Hcy 存在下该探针也可特异性的检测Cys ,该探针的细胞毒性较低且成功用于对HeLa 细胞中 Cys 的检测和荧光成像研究。Guo 等设计了含有氯基团的香豆素-半花青素荧光探针[15],该探针基于不同的发射波长来检测Cys 和GSH 。Zhang 等以N ,N-二乙基香豆素为荧光团,2,4-二硝基苯磺酰胺为苯硫酚的识别基团和荧光淬灭基团设计 合成了荧光探针10[16]。该结构可以阻断N ,N-二乙氨基的扭曲来增加荧光团的荧光。 4 其他类型荧光探针以香豆素衍生物为骨架的荧光探针在N 2H 4、H +、溶剂极性及金属离子等检测方面也被广泛应用。Y u 等设计了第一个用于 实时监测线粒体pH 的比率型型荧光探针[17]。该探针的酚羟基 是一个pH 敏感的基团,在酸性或中性条件下,羟基是弱的供 电子基团;在碱性条件下羟基去质子化得到O -,是强的供电子基团。因此,酚羟基的质子化和去质子化可导致发射波长的变化。5 结语 以香豆素为骨架的基团作为荧光探针中最优的荧光团之 一,具有荧光强度高、溶解性与细胞渗透性好、易于合成与 修饰、好的荧光量子产率和好的光稳定性。荧光探针对基础 生物学研究以及对疾病的诊断和治疗都具有重要的作用,为 “可视化”提供了可能,因此,对荧光探针的研究受到了越来越多的关注。然而,在荧光探针的研究中也面临着更多的挑战。首先,开发真正高选择性和敏感性的探针仍具有挑战性,例如,摘 要:香豆素类化合物不仅具有广发的生物活性,同时香豆素类化合物具有荧光强度高、溶解性和细胞渗透性好及易于合成的优点。因此,香豆素类化合物也是优良的荧光团之一。综述了近几年利用香豆素片段为荧光团,对待测物进行荧光成像研究的荧光探针,同时对这些荧光探针的设计、机理及特点进行了概述。 关键词:香豆素;荧光探针;荧光成像 中图分类号:O631.3 文献标志码:A 文章编号:1003–6490(2018)06–0204–02 Research Progress of Coumarin Fluorescent Probes Qiu Yang ,Wen Kai ,Wang Zheng-long ,Zhou Xiang Abstract :Coumarin compounds not only have broad biological activity ,but also have the advantages of high fluorescence intensity ,good solubility and cell permeability ,and easy synthesis.Therefore ,coumarin compounds are also one of the excellent fluorophores.In this paper ,fluorescence probes for fluorescence imaging of analytes using coumarin fragments as fluorophores are reviewed.The design ,mechanism and characteristics of these fluorescent probes are summarized. Key words :coumarin ;fluorescent probe ;fluorescence imaging 香豆素类荧光探针研究进展 邱?洋,温?锴,王郑龙,周?湘 (中国药科大学有机化学教研室,江苏南京?210009) 收稿日期:2018–04–10 作者简介: 邱洋(1992—),男,山东淄博人,硕士研究生,主要研 究方向为靶向抗肿瘤小分子药物的设计及合成。