
家兔呼吸运动的调节
实验目的:
1.用气管插管描记呼吸流量间接反映家兔呼吸运动(呼吸频率、节律、幅度)的方法,研究吸入二氧
化碳、静脉注射乳酸溶液、增大解剖无效腔以改变血液中二氧化碳浓度、氧气浓度、[H+]和气道阻力、切断颈部迷走神经、电刺激迷走神经中枢端对呼吸运动的影响并初步探讨其作用部位,并分析机制。
2.掌握气管插管术和神经血管分离术。
实验材料:
对象:家兔;
试剂:20g/L 乳酸溶液,氨基甲酸乙酯;
仪器:RM6240生物信号采集系统,手术器械一套,兔手术台,T型气管插管,注射器,50cm长橡皮管一条,CO2气袋,丝线,铁架台,婴儿秤,呼吸换能器,电刺激连线。
实验方法:
1.麻醉固定:家兔称重后,将氨基甲酸乙酯以5ml/kg 的体重剂量由兔耳缘静脉内缓慢注入,注意观察家兔的反应。待麻醉后,将家兔仰卧固定于兔手术台上,先后固定四肢及兔头。
2.手术:剪去家兔颈部的被毛,沿颈部正中线作一长6~7cm的切口,用止血钳钝性分离皮下组织,暴露并游离气管,并于气管下穿线备用。在气管两侧肌肉深面颈动脉鞘内分离迷走神经,并在其下穿线备用。在甲状软骨下第4~5个气管软骨处作一“⊥”形切口。将T型气管插管向肺的方向插入气管内,用预留备用线线结扎固定。手术完毕后用纸巾擦拭手术伤口部位。
3.观察准备:用皮管连接气管插管和呼吸换能器。打开呼吸换能器,启动计算机RM6240生物信号采集系统,点击“实验”菜单,选择“呼吸运动调节”,双击一通道,调节增益、采样参数,使基线归零,令图形位于屏幕中央,便于观察。
4.观察项目
(1)记录正常呼吸曲线作为对照,辨认曲线上呼气、吸气的波形方向。
(2)在气管插管一个侧管上接一根长50cm胶管(流量法:接通气口),观察和记录呼吸运动的变化。
(3)增加吸入气中CO2浓度:待呼吸曲线恢复正常,将装有CO2气袋的皮管口移近气管插管的侧管,打开皮管夹子,使吸入气中含有较多的CO2。记录并观察吸入高浓度的CO2对呼吸运动的影响。关闭气袋,观察呼吸运动的恢复过程。
(4)增加血液中H+浓度:由耳缘静脉迅速注入20g/L乳酸溶液2mL,记录并观察呼吸运动的变化。
(5)观察迷走神经在调节呼吸运动中的作用:剪断左侧迷走神经,记录并观察呼吸运动的变化。然后剪断右侧迷走神经,记录并观察呼吸运动的变化。
(6)以2V、25Hz,持续10s,波宽2ms的串刺激刺激右侧迷走神经中枢端,记录并观察呼吸运动的变化。
实验结果:1.本组呼吸图(见第一份实验报告)
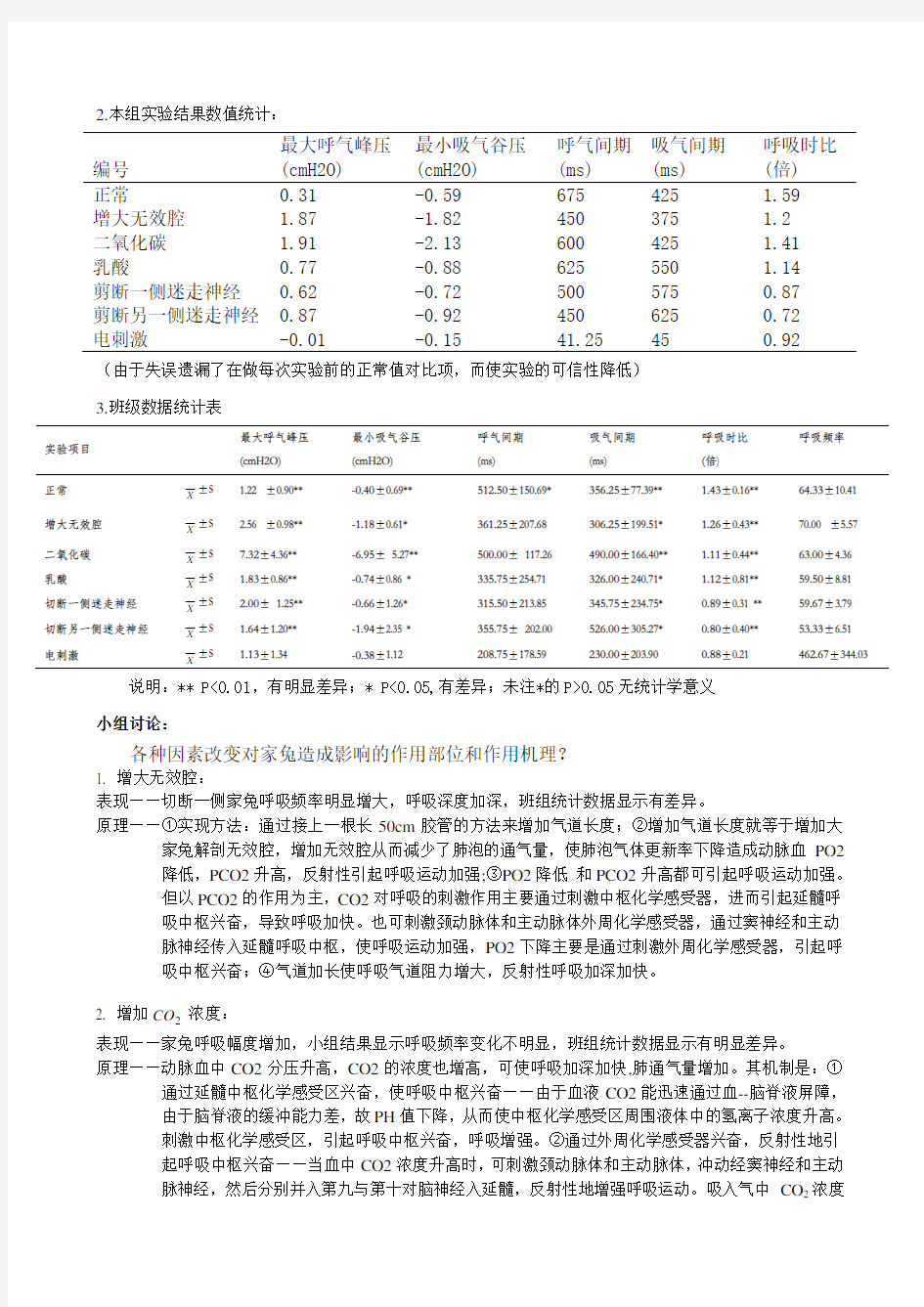
2.本组实验结果数值统计:
编号最大呼气峰压最小吸气谷压呼气间期吸气间期呼吸时比(cmH2O) (cmH2O) (ms) (ms) (倍)
正常0.31 -0.59 675 425 1.59 增大无效腔 1.87 -1.82 450 375 1.2 二氧化碳 1.91 -2.13 600 425 1.41 乳酸0.77 -0.88 625 550 1.14 剪断一侧迷走神经0.62 -0.72 500 575 0.87 剪断另一侧迷走神经0.87 -0.92 450 625 0.72 电刺激-0.01 -0.15 41.25 45 0.92
(由于失误遗漏了在做每次实验前的正常值对比项,而使实验的可信性降低)
3.班级数据统计表
实验项目最大呼气峰压最小吸气谷压呼气间期吸气间期呼吸时比呼吸频率(cmH2O) (cmH2O) (ms) (ms) (倍)
正常
X
±S 1.22 ±0.90** -0.40±0.69** 512.50±150.69* 356.25±77.39** 1.43±0.16** 64.33±10.41
增大无效腔
X
±S 2.56 ±0.98** -1.18±0.61* 361.25±207.68 306.25±199.51* 1.26±0.43** 70.00 ±5.57
二氧化碳
X
±S 7.32±4.36** -6.95±5.27** 500.00±117.26 490.00±166.40** 1.11±0.44** 63.00±4.36
乳酸
X
±S 1.83±0.86** -0.74±0.86 * 335.75±254.71 326.00±240.71* 1.12±0.81** 59.50±8.81
切断一侧迷走神经
X
±S 2.00±1.25** -0.66±1.26* 315.50±213.85 345.75±234.75* 0.89±0.31 ** 59.67±3.79
切断另一侧迷走神经
X
±S 1.64±1.20** -1.94±2.35 * 355.75±202.00 526.00±305.27* 0.80±0.40** 53.33±6.51
电刺激
X
±S 1.13±1.34 -0.38±1.12 208.75±178.59 230.00±203.90 0.88±0.21 462.67±344.03 说明:** P<0.01,有明显差异;* P<0.05,有差异;未注*的P>0.05无统计学意义
小组讨论:
各种因素改变对家兔造成影响的作用部位和作用机理?
1. 增大无效腔:
表现——切断一侧家兔呼吸频率明显增大,呼吸深度加深,班组统计数据显示有差异。
原理——①实现方法:通过接上一根长50cm胶管的方法来增加气道长度;②增加气道长度就等于增加大家兔解剖无效腔,增加无效腔从而减少了肺泡的通气量,使肺泡气体更新率下降造成动脉血PO2
降低,PCO2升高,反射性引起呼吸运动加强;③PO2降低和PCO2升高都可引起呼吸运动加强。
但以PCO2的作用为主,CO2对呼吸的刺激作用主要通过刺激中枢化学感受器,进而引起延髓呼
吸中枢兴奋,导致呼吸加快。也可刺激颈动脉体和主动脉体外周化学感受器,通过窦神经和主动
脉神经传入延髓呼吸中枢,使呼吸运动加强,PO2下降主要是通过刺激外周化学感受器,引起呼
吸中枢兴奋;④气道加长使呼吸气道阻力增大,反射性呼吸加深加快。
2. 增加
2
CO浓度:
表现——家兔呼吸幅度增加,小组结果显示呼吸频率变化不明显,班组统计数据显示有明显差异。
原理——动脉血中CO2分压升高,CO2的浓度也增高,可使呼吸加深加快,肺通气量增加。其机制是:①通过延髓中枢化学感受区兴奋,使呼吸中枢兴奋——由于血液CO2能迅速通过血--脑脊液屏障,
由于脑脊液的缓冲能力差,故PH值下降,从而使中枢化学感受区周围液体中的氢离子浓度升高。
刺激中枢化学感受区,引起呼吸中枢兴奋,呼吸增强。②通过外周化学感受器兴奋,反射性地引
起呼吸中枢兴奋——当血中CO2浓度升高时,可刺激颈动脉体和主动脉体,冲动经窦神经和主动
脉神经,然后分别并入第九与第十对脑神经入延髓,反射性地增强呼吸运动。吸入气中CO2浓度
增加,将导致肺泡气PCO2升高,动脉血CO2浓度也随之升高,呼吸加深加快。
3. 静脉注射乳酸溶液:
表现——呼吸加深,但程度较小,小组结果显示呼吸频率变化不大,班组统计数据显示有差异。
原理——注射乳酸,使家兔血液中的H 浓度升高,刺激外周化学感受器和中枢化学感受器——中枢化学感受器对H+的敏感较外周的高,但H+不易通过血-脑屏障,因而此时H+的效应主要是刺激外周化学感受器, 使膈肌、肋间外肌收缩,肺通气量增加,呼吸加深加快。
4. 切断迷走神经:
表现——切断一侧迷走神经家兔呼吸加深,但呼吸频率变小,班组统计数据显示有差异;切断另一侧迷走神经,家兔呼吸幅度进一步加深,呼吸频率进一步减小,班组统计数据显示有差异。
原理——①迷走神经的作用:迷走神经中含有肺牵张反射传入纤维,当吸气运动使肺扩张时,该神经纤维兴奋,冲动传入中枢后引起吸气切断机制,吸气神经元活动抑制,吸气停止转为呼气运动,从而加速吸气→呼气运动的交替。②当切断迷走神经后,中断了肺扩张反射的传入通路,反射作用减弱,从而出现了呼吸程度加深,呼吸速度减慢的现象。(另外,迷走神经是外周化学感受性反射的传入神经,切断两侧迷走神经,呼吸中枢将不能感受外周的化学性刺激,失去外周的化学感受器反射调节作用)
5. 电刺激迷走神经中枢端:
表现——家兔的呼吸变得浅快,班组统计数据无意义。
原理——①迷走神经中含有肺牵张反射传入纤维,肺的牵张反射包括:肺扩张后引起吸气活动的抑制,呼气加强;肺缩小后引起呼气活动抑制,吸气加强的过程。这两种反射传入神经纤维都经由迷走神经传入中枢,调节呼吸运动。②电刺激迷走神经中枢端,引起这两种纤维成分都同时持续兴奋,故家兔的呼吸运动变得浅快,严重时甚至将导致呼吸运动的暂停。
结论:
增大无效腔、增加
CO浓度、静脉注射乳酸溶液呼吸加深加快;切断迷走神经呼吸加深变慢;电刺激2
迷走神经中枢端呼吸变浅加快。
注意事项:
1.气管插管前,及时清理气管内淤血及异物,保持气管通畅。
2.手术操作应细致,避免损伤血管。
3.勿将气袋皮管与气管插管侧管直接相连,以避免气体流速过急,影响呼吸运动,干扰实验结果。
4.对每次实验结果观察完毕后,应等呼吸运动基本恢复正常后,再进行下一项实验。
5、麻醉时注意家兔是否彻底麻醉,以防手术时家兔感到疼痛或者挣扎影响实验的进行。
参考文献:
1.机能学实验教程陆源,林国华,杨午鸣主编第二版科学出版社2010.6 P160~162
2.生理学张志雄主编上海科技出版社2006.8第五章呼吸P87~111
中央民族大学生命与环境科学学院 生理学实验报告 2011年10月28日 家兔颈部动脉和神经的分离及减压神经放电的引导 和 家兔动脉血压的神经与体液调节
【目的与要求】 1.学习家兔颈部手术与分离主动脉神经的方法。 2.学习在体神经冲动引导与记录的方法,理解主动脉神经的生理功能。 3.掌握记录和测量家兔动脉血压的直接测量方法。 4.观察神经和体液因素改变对家兔动脉血压调节的影响,并分析该些因素的作用机制。【实验原理】 主动脉神经是主动脉弓压力感受器的传入神经,又称减压神经。神经传入冲动的频率,在一定范围内随主动脉血压的升高或降低而相应增加或减少,从而使压力感受性反射增强或减弱,以维持动脉血压的相对稳定。由于家兔主动脉神经独成一束,易于分离,故常用家兔为实验动物,进行主动脉神经冲动的引导与血压实验。 在正常的生理情况下,人和高等动物的动脉血压是相对稳定的。这种相对稳定性是通过神经和体液因素的调节而实现的,其中以颈动脉窦-主动脉弓压力感受器反射尤为重要。此反射即可使升高的血压下降,又可使降低的血压升高,故有血压缓冲反射之称谓。家兔的主动脉神经在解剖上独成一支,易于分离与观察其作用。 【实验动物及器材】 家兔、兔手术台,常用手术器械,止血钳、眼科剪、支架、气管插管、Pc-Lab生物信号采集系统、保护电极、纱布、棉球、丝线、20ml注射器、20%-25%氨基甲酸乙酯,肝素,去甲肾上腺素,生理盐水;RM6240生物信号采集系统,手术剪1把,眼科剪1把,止血钳,镊子,电刺激连线,兔手术台,注射器及针头,血管插管,动脉夹,血压换能器,铁架台,婴儿秤,输液装置,照明灯,有色丝线; 【实验步骤】 1、实验动物准备 1)麻醉:取家兔一只称重,按4-5ml/Kg(1g/Kg)耳缘静脉注射20%-25%氨基甲酸乙酯进行麻醉。 2)固定剪毛:背位固定在兔手术台上,剪去颈部手术视野中的被毛。 3)手术分离血管与神经 A、颈部皮肤切口5-7cm,分离皮下组织 B、分离肌肉层:钝性分离
生理学实验报告 实验题目: 蛙的体循环血压、心肌收缩和心电图(ECG)的同步记录与分析 课程名称:生理学实验 专业:10级生物技术及应用(基地班) 教室:A414 学生姓名:徐棒夏凡女 学号:10350083 10350081 指导老师:龙天澄张碧鱼陈笑霞 日期:2012年5月15日 一.实验目的 1.学习并掌握蛙的体循环血压、心肌收缩和心电图(ECG)的同步记录 2.记录和分析植物神经系统和重要神经递质对血压、心电(心肌的电生理特性)和心搏(心肌的收缩特性)的影响。 二.动物与器械 青蛙;蛙心插管、常用手术器械、计算机采集系统、蛙心夹、YP100压力换能器、三通管、注射器、保护电极、露丝电极、一维位移微调器、固定针、蜡盘、培养皿、污物缸、棉线、纱布、滴管、小烧杯;任氏液、石蜡油、肾上腺素溶液、乙酰胆碱溶液、肝素溶液;
三.实验原理 神经与体液因素对心血管功能的调节可通过心肌收缩力、心电图和血压的变化反映出来。尤其是血压的指标直接反映了心输出量和外周阻力的变化,可以较好的评价整体的心血管功能。 本实验用青蛙主动脉插管法,直接测量血压,并同步记录心搏和心电图。记录和分析植物神经系统和重要神经递质对血压、心电(心肌的电生理特性)和心搏(心肌的收缩特性)的影响。 四.实验步骤 1. 分离迷走交感混合神经干 按常规方法用探针刺毁蟾蜍的脑和脊髓,将动物背位放在蛙板上。把左侧下颌角与前肢间的皮肤纵向剪开,用镊子紧贴下颌角分离皮下组织。找到体轴走向的提肩胛肌,小心地将提肩胛肌横向剪断,即可见到其下方的血管神经束(皮动脉,颈静脉和迷走-交感混合干)。在迷走—交感混合干下方穿一线,用玻璃分针分离开神经,用湿生理棉球暂将神经覆盖,以避免神经干燥。 2. 暴露心脏 在胸骨柄后方的皮肤上先剪开一小的切口,再自切口处向左右两侧锁骨外侧方向剪开皮肤,切口成V形,把切开的皮肤掀向头端。在胸骨柄后方的腹肌上也剪一小切口,沿身体正中方向剪开剑突和胸骨(剪子尖向上翘以免损伤血管和心脏),剪断左右乌喙骨和锁骨及提臂肌,使胸部创口也呈V形。可见到心包和心脏。用眼科剪剪开心包膜,在心脏舒张时夹上蛙心夹。蛙心夹拴线的另一端与张力换能器相连(换能器的输出端与生理信号采集处理系统的一个输入通道相连)。 3. 主动脉插管 YP100压力换能器的直端和侧端管上加装三通管。从侧管注入液体石蜡,将系统内气泡赶净。用装有50%柠檬酸钠溶液(肝素-任氏液)的注射器连接于侧端管上,直端管上连接心脏插管。 用线结扎动脉的远心端,在左主动脉分叉处穿线备用。用手术剪在结扎处与穿线处剪一V形口,将插管经V形口插入动脉圆锥适当深度。穿线结扎并固定于插管上。
生医2012秋生理学实验报告 指导教师: 实验员: 学号: 联系方式:
实验一骨骼肌的观察及骨骼肌的单收缩与强直收缩 【目标要求】 1.掌握蛙类动物单毁髓的实验方法。 2.掌握坐骨神经-腓肠肌标本和坐骨神经干标本的制备方法。 3.学习肌肉收缩的记录方法。 4.观察与分析肌肉单收缩的三个时相,分析骨骼肌收缩形式与刺激频率之间的关系。 【基本原理】 蛙类动物的某些基本生命活动,如神经的生物电活动、肌肉收缩等与哺乳动物相似。其离体组织所需的生活条件比较简单,易于控制和掌握,而且动物来源丰富,因此在生理学实验中常用蟾蜍的坐骨神经—腓肠肌标本永和坐骨神经标本来观察组织的兴奋性、刺激与反应的规律以及骨骼肌收缩的特点等。 肌肉受到一次阈上刺激而产生的一次收缩为单收缩,其过程可分为三个时相,即潜伏期、缩短期与舒张期。肌肉收到连续的阈上刺激时,如果刺激间隔小于单收缩的时程,相邻两单收缩的时相会出现融合,表现为强直收缩现象。如果表现为每次收缩的开始发生在上次收缩的舒张期,称不完全强直收缩,如果表现为每次收缩的开始发生在上次收缩的缩短期,称完全强直收缩。躯体运动是以骨为杠杆,以关节为枢纽,由肌肉收缩产生动力完成的。 【材料与器械】 蟾蜍或蛙,蛙类手术器械(手术剪、手术镊、眼科剪、眼科镊、金冠剪、毁髓针、玻璃针、固定针),蛙板,玻璃板,锌铜弓,小烧杯,滴管,纱布,细棉线,任氏液。 BL-420生物机能实验系统(或其他生理记录仪),张力换能器。 【实验步骤】 1.双毁髓的方法 一手握蟾蜍,食指按压头部前端,拇指压住躯干背部,令其背部向上,头向前俯;另一手持毁髓针在左右耳后腺之间,背部的凹陷处将毁髓针垂直刺入,然后将针尖向前刺入颅腔,搅动以捣毁脑组织,此时的动物为单毁髓动物。彻底捣毁脊髓时,可见蟾蜍后肢突然蹬直,然后瘫软。如动物仍表现四肢肌肉紧张或活动自如,表明未毁坏脊髓,必须重新毁髓。 2.剥制后肢标本 将双毁髓的蟾蜍背面向上放在蛙板上,一手持手术镊轻轻提起两前肢之间背部的皮肤,另一手持手术剪横向剪开皮肤,暴露脊柱。用金冠剪横向剪断脊柱。一首持手术镊提起断开的脊柱后端,另一手用金冠剪沿脊柱两侧剪开体壁,再剪断下腹壁肌肉,使头部、前肢及内脏自然下垂,将其自腹后壁剪除。然后用蘸有任氏液的左手捏住断开的脊柱后端,右手向后方撕剥皮肤,将剥干净的后肢放入盛有任氏液的培养皿中。弃其头部、内脏及剥下的皮肤,清洗手及手术器械上的污物。 3.分离两后肢 左手托起去皮的标本,右手持金冠剪直接剪开耻骨联合,随后剪开两后肢相连的肌肉组
实用文档专业:应用心理学 : 学号:日期:地点:汪加诚3110102422 2016.1024 医学楼 C512 实验报告 课程名称:实验名称: 神经生理学指导老师:成绩: 同组学生:神经干不应期的测定实验类型:模拟实验 一、实验目的 了解蛙类坐骨神经干产生动作电位后其兴奋性的规律性变化。学习绝对不应期和相对不 应期的测定方法。 二、实验原理 神经组织和其他可兴奋组织一样,在接受一次刺激产生兴奋以后,其兴奋性将会发生规 律性的变化,依次经过绝对不应期、相对不应期,超常期和低常期,然后再回到正常的兴奋 水平。 采用双脉冲刺激的方法。将两刺激脉冲间隔由最小逐渐增大时,开始只有第一个刺激脉 冲刺激产生动作电位(action potential, AP),第二个刺激脉冲刺激不产生 AP,当两刺激脉 冲间隔达到一定值时,此时第二个刺激脉冲刚好能引起一极小的 AP,这时两刺激脉冲间隔即 为绝对不应期。继续增大刺激脉冲间隔,这时由第二个刺激脉冲刺激产生的 A P逐渐增大,当 两刺激间隔达到某一值时,此时由第二个刺激脉冲刺激产生的 AP,其振幅刚好和由第一个刺 激产生的 A P相同,这时两刺激脉冲间隔即为相对不应期。 三、材料和方法 【材料】:蟾蜍或蛙;标本屏蔽盒、任氏液、微机生物信号采集处理系统。 【实验方法】: 1.系统连接和仪器参数设置 (1)RM6240 系统:点击“实验”菜单,选择“肌肉神经”或“生理科学实验项目”菜 单中的“神经干兴奋不应期的测定”或“神经干兴奋不应期的自动测定”项目。系统进入该 实验信号记录状态。仪器参数:1通道时间常数 0.02s、滤波频率 1KHz、灵敏度 4mV,采样频率 80KHz,扫描速度 1ms/p。双刺激激模式,最大刺激强度,刺激波宽 0.1ms,起始波间隔 30 ms,延迟 2ms,同步触发。
生理学实验报告 一、实验题目: 1.实验员:马冰(0941054) 2.时间:2011年10月10日 3.组号:第二组 4.班级:09生科 二、实验目的 1.熟悉并掌握生物信号采集处理系统 2.掌握蛙类坐骨神经腓肠肌标本和坐骨神经干标本的制备技术 3.观察不同刺激强度、刺激频率对骨骼肌收缩形式的影响 4.观察电刺激对神经兴奋性、兴奋传导的影响 5.熟悉阈强度、最适刺激强度及单收缩、完全强直收缩之间的关系 三、实验原理 兴奋性:可兴奋组织对外界刺激发生反应的能力(或细胞受刺激时产生动作电位的能力)。 兴奋:也就是动作电位,指可兴奋细胞受阈刺激或阈上刺激时,细胞在静息电位的基础上发生一次迅速的、短暂的并可扩布的电位变化。 阈强度:在刺激持续时间和刺激强度-时间变化率固定时,引起可兴奋细胞产生动作电位的最小刺激强度,也叫阈值或阈刺激。 阈刺激或阈上刺激产生动作电位,其特点:①“全或无”现象;②进行长距离无衰减传递(神经纤维、骨骼肌细胞等)。 阈下刺激引起局部电兴奋,其特点:①幅度在阈下刺激的范围内,随刺激强度的增大而升高;②在细胞膜上可进行电紧张性扩布,即衰减性传播;③可以相互融合(时间总和、空间总和)。 最适刺激强度:引起肌肉产生最大收缩时的最小刺激强度。 单收缩:肌肉受到一次短促的刺激时,会产生一次机械性收缩和舒张的过程。 兴奋性作为三大基本生命现象(新陈代谢、兴奋性、生殖)具有重要的生理意义。那么,什么叫兴奋性呢?它是指可兴奋组织对外界刺激发生反应的能力。所有可兴奋组织产生兴奋
(也就是动作电位)都必须有一个条件:刺激。 刺激包括三方面的内容:刺激强度、刺激时间、刺激强度-时间变化率。其中,刺激强度就是电刺激的脉冲电压,刺激时间就是某个单刺激所持续的时间。 刺激强度对骨骼肌收缩形式的影响(固定刺激的时间和刺激强度-时间变化率):单根神经纤维或肌纤维对刺激的反应是“全或无”式的。但在神经纤维肌肉标本中,则表现为当刺激强度很小时(阈下刺激),不能引起神经纤维动作电位的产生和肌肉的收缩;当刺激强度在一定范围内变动时,肌肉收缩的幅度与之成正比。因为坐骨神经干中含有数千万条粗细不等的神经纤维,其兴奋性各不相同。弱刺激只能使其中少量兴奋性高的神经纤维先兴奋,并引起它所支配的少量肌纤维收缩。随着刺激强度逐渐增大,发生兴奋的神经纤维数目逐渐增多,其所引起收缩的肌纤维数目亦增多,结果肌肉收缩幅度随刺激强度的增加而增强。当刺激达到某一强度时,神经干中全部神经纤维兴奋,它们所支配的全部肌纤维也都发生兴奋和收缩,从而引起肌肉的最大收缩。此后,若再增加刺激强度,肌肉收缩幅度将不再增加。我们把引起肌肉产生最大收缩时的最小刺激强度叫最适刺激强度。 刺激频率对骨骼肌收缩形式的影响(把刺激强度固定在最适刺激强度,把单刺激改为连续单刺激):刺激频率就是单位时间内连续刺激的次数。随着刺激频率的增高,肌肉的反应依次表现为单收缩、不完全强直收缩和完全强直收缩: ⑴如果刺激频率很小时,每相邻两个刺激的间隔时间很大,当其大于肌肉收缩的收缩期和舒张期之和时,肌肉表现为一个个的单收缩。单收缩包括收缩期及舒张期。前者占时较后者为短。 ⑵当逐渐增加刺激频率,使新的刺激引起的肌肉收缩落在前一个刺激引起肌肉收缩的舒张期,这样,肌肉在连续未完全舒张的基础上就开始新的收缩,形成锯齿样的不完全强直收缩张力曲线。 ⑶当刺激频率继续增大时,新的刺激引起肌肉收缩落在前一次刺激引起肌肉收缩的收缩期,这样,肌肉在连续收缩不全的基础上出现新的收缩,形成一个类似方波的完全强直收缩张力曲线。 四、实验方法和步骤 (见生理学实验指导P36,P40,P44) 五、实验对象 蟾蜍
实验16 膈神经放电 【实验目的】 1.观察与呼吸运动节律同步的膈神经集群的放电现象。 2.加深认识呼吸中枢的节律性兴奋的传出途径。 3.了解传出神经自发放电的记录方法。 【实验原理】 脑干呼吸中枢发放的节律性冲动,通过支配呼吸肌的膈神经和肋间神经引起膈肌和肋间肌的节律性舒缩活动,从而引起节律性的呼吸运动。体内外各种刺激对呼吸运动的影响,能从引导膈神经传出纤维的放电活动上反映出来。因此,膈神经放电常作为观测呼吸运动的一个指标。 【实验对象】 家兔。 【实验器材与药品】 生物信号采集处理系统、呼吸换能器、哺乳动物手术器械(包括手术刀、粗剪、手术剪、眼科剪、止血钳、镊子)、气管插管、引导电极及固定架、玻璃分针、10 ml及20 ml注射器各一支、20 %氨基甲酸乙酯溶液(或1 %戊巴比妥钠溶液)、5 %尼克刹米溶液、生理盐水、液状石蜡。 【实验方法和步骤】 1.称重后,按5 ml/kg体重的剂量于耳缘静脉注射20 %氨基甲酸乙酯溶液(或1%戊巴 比妥钠溶液3 ml/kg)。注意麻醉剂不宜过量,注射速度不宜过快,且注意家兔的呼吸频率。 2.将家兔仰卧放于兔台上,先用四根绳子一端打好扣结,缚扎于四肢踝关节的上方,将绳 子拉紧并缚于免台的铁柱上,再用一根棉绳钩住兔的门齿,将兔头固定在铁杆上。剪去颈部手术野兔毛,从甲状软骨沿正中线向下做5~6 cm皮肤切口至胸骨上缘,行气管插管。 3.分离膈神经: 方法1:在颈外静脉和胸锁乳突肌之间向纵深分离,直至气管旁可见到较粗的臂丛神经向后外方向行走。膈神经较细,紧靠臂丛内侧向后内侧行走,在臂丛腹面横过形成交叉。 认清膈神经后,用玻璃分针将膈神经向上分离出1~2 cm穿线备用。 方法2:将兔右侧胸壁去毛,沿胸骨右缘做一约3~4 cm长纵切口,钝性分离肌层,充分暴露7、8,9肋骨,肌肉渗血较多时可用盐水纱布压迫止血或结扎止血。用大止血钳平行地靠紧胸骨右缘自10、9肋间插入,于7、6肋问穿出并夹紧,并按此方法平行另夹一把止血钳。在两钳问剪断上述3根肋骨,打开右侧胸腔,将镊子柄或刀柄插入切口内向左轻轻推开心脏,深部可见走行于下腔静脉下方的膈神经。 用血管钳把神经周围的皮肤提起,做成人工皮兜,向皮兜内注入38 o C的液体石蜡,浸
临床机能实验讨论题 运动、体位变化对人体动脉血压的影响 离体心肌动作电位(模拟实验) 离子与药物对离体蟾蜍心脏活动的影响(模拟实验) MedLab生物信号采集处理系统使用 蟾蜍坐骨神经腓肠肌标本的制备 不同刺激强度和频率对骨骼肌收缩的影响 心室期前收缩与代偿间歇及不应期的测定 家兔实验基本操作胸内负压和气胸的观察 生理因素及药物对呼吸运动及膈肌放电的影响 神经、体液因素及药物对动脉血压的影响 左心室内压的测定 减压神经放电及其影响因素红细胞渗透脆性的测 定 尿生成的影响因素胃肠运动观察 1.钙离子、肾上腺素、乙酰胆碱对离体蛙心活动有何影响?为什么? 2.心室肌动作电位的分期和产生机制? 3.运动前后血压有何不同?机理如何? 4.何谓期前收缩与代偿间歇? 5.从不同刺激强度引起的反应,讨论刺激与反应的关系,出现的现象如何解释? 6.复合收缩引起的条件? 7为何吸入气中CO2浓度增加会使呼吸运动加强? 8.何吸入纯氮气后会影响呼吸运动? 9.增加无效腔,呼吸运动会有何变化,为什么? 10.注射乳酸后影响呼吸运动? 11切断两侧迷走神经后对呼吸有何影响,为什么? 12实验所记录到的群集型减压冲动发放是代表血压的一级波还是二级波?试说明之。13总结减压神经放电与动脉血压的关系。 14夹闭颈总动脉,血压如何变化?为什么? 15刺激完整减压神经及其中枢端以及外周端,动脉血压变化?为什么? 16刺激迷走神经末梢外周端,引起血压?为什么? 17静脉注射去甲肾上腺素,血压?为什么? 18静脉注射大量生理盐水,尿量?为什么? 19静脉注射1:10000去甲肾上腺素,尿量?为什么? 20静脉注射20%葡萄糖液,尿量?为什么? 21连续间断刺激迷走神经外周端,尿量?为什么? 22静脉注射速尿,尿量?为什么? 23静脉注射垂体后叶素,尿量?为什么?
·论著· 电刺激和磁波刺激法评价膈肌功能的比较 郑则广1 陈荣昌1 张秀燕2 李寅环1 黎毅敏1 郑劲平1 钟南山1 1广州医学院第一附属医院广州呼吸疾病研究所(广东广州 510120);2广州市第二人民医院麻醉科 【摘要】 目的 比较经皮双侧膈神经电刺激和颈部磁波刺激法评价膈肌功能的简便性及其诱发的电、磁刺激颤搐性跨膈压[Pdi (t )e 、Pdi (t )m ]的差异。方法 对13例正常人和12例慢性阻塞性肺疾病(COPD )患者观察两种刺激方法的定位时间及其诱发的Pdi (t )e 和Pdi (t )m 。结果 22例非机械通气者电刺激法的定位时间长于颈部磁波刺激法(P <0.01);正常组的Pdi (t )m 高于Pdi (t )e (P <0.01),但两者接近且明显相关(r =0.92,P <0.01),C OPD 组的Pdi (t )m 与Pdi (t )e 无统计学差异(P >0.05);两组Pdi (t )m 的变异系数均低于Pdi (t )e ( P <0.05)。结论 颈部磁波刺激法测定膈肌功能优越于电刺激法。【关键词】 电刺激; 磁波刺激; 膈神经; 颤搐性跨膈压 The comparison of the cervical magnetic stimulatio n to the conventional supramaximal bilateral percuta -neous electrical stimulation of the phrenic nerves ZHENG Zeguang *,CH EN Ro ngchang ,ZHA NG Xiuyan ,et al . * G uangzhou Institute of Respirator y Disease ,First Affiliated H ospital ,Guang zhou M edical College .G uangzhou ,G uangdong 510120,China 【Abstract 】 Objective To compare the cervical magnetic stimulation to conventional supramaximal bi -lateral percutaneous electrical stimulation of the phrenic nerves in the simplification of operation and the assess -ment of diaphragmatic strength in humans .Methods 13normal subjects ,9s ubjects of chronic obstructive pul -monary disease (COPD )and 3patients with COPD and respiratory failure received mechanical ventilation were studied .We meas ured the time taken to locate the phrenic nerves for conventional supramaximal bilateral percuta -neous electrical stimulation or the place for cervical magnetic stimulation in all individuals and twitch transdi -aphragmatic pressure following electric stimulation of the phrenic nerves [Pdi (t )e ]and cervical magnetic stimula -tion [Pdi (t )m ]were obtained in the 13n ormal s ubjects and 12COPD patients .Results In 13normal subjects and 9COPD patients ,the ti me taken to locate the phrenic nerves by percutaneous electrical stimulation and the place for cervical magnetic stimulation was respectively (6.6±5.1)min and (1.0±0.2)min .They were signifi -cantly different (P <0.01).The mean Pdi (t )m was 24.5cm H 2O ,higher than Pdi (t )e (22.9cm H 2O )(P <0.01)in the normal group .But in the COPD group ,there was not different between them (P >0.05).The within occasion coefficient of variation for Pdi (t )e was higher than that for Pdi (t )m in both the normal group and the COPD group .Conclusions Cervical magnetic stimulation is a simple ,reproducible technique in the assessment of the diaphragmatic strength in both COPD patients and normal subjects . 【Key words 】 Electric stimulation ; Magnetic stimulation ; Phrenic nerves ; Twitch transdiaphrag -matic pressure 基金项目:广州市科委重点攻关项目(980448631) 高压线圈放电时产生磁场,传导性组织受到随时间而变化的磁场作用时,会产生电场,电场强度与磁场的时间变化率和传导组织表面的几何形状有关;当电场改变的幅度和时间合适时,产生的电流可刺激局部的神经肌肉组织,即磁波刺激法。与电刺激相比,磁波刺激法有以下优点[1,2]:(1)无痛、易于 操作、容易定位;(2)可刺激深部或难以达到的神经;(3)不需要处理刺激局部的皮肤,亦可透过衣服刺激神经;(4)磁刺激的刺激强度易于控制在稳定的水平。 本研究的目的是比较膈神经电刺激法与磁波刺激法操作的简便性及其诱发的跨膈压差别和可重复性。 对象与方法 一、对象 纳入试验的对象共25例,其中肺功能正常者
华南师范大学实验报告学生姓名:谭晓东学号:20102501024 专业:生物科学年级、班级:10科四 课程名称:动物生理学实验实验项目:心脏生理 实验类型:验证实验时间:2013年5月7日 实验指导老师:实验评分: 1 实验目的 1.1分析蛙心起搏点,蛙心搏的观察与描记、期外收缩与代偿间歇 2 实验原理 两栖类动物的心脏为两心房、一心室,心脏的起搏点是静脉窦。静脉窦的节律最高,心房次之,心室最低。正常情况下心脏的活动节律服从静脉窦的节律,其活动顺序为:静脉窦、心房、心室。这种有节律的活动可以通过传感器或计算机采集系统记录下来,称为心搏曲线。 3 实验工具 常用手术器械、蛙板、蛙心夹、计算机采集系统、张力传感器、支架、双凹夹、秒表、滴管、培养皿(或小烧杯)、纱布、棉线、任氏液 4 实验步骤 4.1 暴露动物心脏 取蟾蜍(或蛙)一只,双毁髓(毁髓要彻底)后背位置于蛙板上(或蜡盘内)。一手持手术镊提起胸骨后方的皮肤,另一手持金冠剪剪开一个小口,然后将剪刀由开口处伸人皮下,向左、右两侧下顿角方向剪开皮肤。将皮肤掀向头端,再用手术镊提起胸骨后方的腹肌,在腹肌上剪一口,将金冠剪紧贴体壁向前伸人(勿伤及心脏和血管),并沿皮肤切口方向剪开体壁,剪断左右乌喙骨和锁骨,使创口呈一倒三角形。一手持眼科镊,提起心包膜,另一手用眼科剪剪开心包膜,暴露心脏。 4.2 观察心脏的结构 从心脏的腹面可看到一个心室,其上方有两个左右主动脉心房,房室之间有房室沟。心室右上方有一动脉圆锥,是动脉根部的膨大,动脉干向上分成左右两分支。用蛙心夹夹住少许心尖部肌肉,轻轻提起蛙心夹,将心脏倒吊,可以看到心脏背面有节律搏动的静脉窦。在心房与静脉窦之间有一条白色半月形界线,称为窦房沟。前、后腔静脉与左右肝静脉的血液流人静脉窦。 4.3 观察心搏过程 仔细观察静脉窦、心房及心室收缩的顺序和频率。在主动脉干下方穿一条线,将心脏翻向头端,看准窦房沟,沿窦房沟作一结扎,称为斯氏第一结扎。观察心耻各部分搏动节律的变化,用秒表计数每分钟的搏动次数。待心房和心室恢复搏动后,计数其搏动频率。然后在房室交界处穿线,准确地结扎房室沟,此称为斯氏第二结扎。待心室恢复搏动后,计数每分钟心脏各部分搏动次数。
实验二十一 家兔减压神经放电 Rabbit depressor neural discharges 【实验目的】 学习引导减压神经放电的电生理学实验方法;观察动脉血压变化与减压神经放电的关 系。 【实验原理】 当动脉血压升高或降低时, 压力感受器的传入冲动也随之增加或减少, 通过中枢机制引 起心率、心肌收缩力、心输出量、血管阻力等发生相应变化,使动脉血压降低或回升,从而 调节血压相对稳定,这一反射称为减压反射。家兔降压反射的主动脉弓压力感受器的传入神 经在颈部单独成一束,称为主动脉神经或减压神经。它是减压反射的传入神经,可将感受器 感受血压变化的传入冲动传送到中枢。用电生理学实验方法可引导、显示、记录减压神经放 电,并用监听器监听减压神经放电的声音。 【实验对象】 家兔。 【实验材料】 哺乳类动物手术器械,兔手术台,BL-410 生物信号采集处理系统,压力换能器、引导 电极,电极架,注射器,玻璃分针,烧杯,棉球及丝线,纱布,滴管,液体石蜡,生理盐水, 1.5%戊巴比妥钠,1:10000 肾上腺素溶液,1:10000 乙酰胆碱溶液。 【实验步骤】 1.手术 (1)麻醉和固定 用 1.5%戊巴比妥钠,按 2ml/kg的剂量从兔耳缘静脉缓慢注入,待动 物麻醉后,取仰卧位固定于兔手术台上。 (2)分离减压神经 颈部剪毛,在颈部正中切开皮肤(约 6~8cm),钝性分离皮下组织及 肌肉,暴露气管。沿气管两侧小心分离减压神经(如头发粗细)和颈总动脉,穿线备用。减压 神经分布(图 21-1、-2、-3) (3)颈总动脉插管。 (4)安置电极 向内滴入温热的液体石蜡,浸没神经和电极,以防神经干燥,并起绝缘、 保温作用。 将引导电极固定在电极架上, 用备用线提起减压神经并搭到引导电极的神经钩上, 注意神经不可牵拉过紧。引导电极应悬空并固定于支架上,不能触及周围组织,将接地线就 近夹在皮肤切口组织上。神经放电引导电极参见图 21-4。 2.连接实验仪器装置 (1)神经放电引导电极接到生物信号采集处理系统第 1 通道上,记录减压神经放电。 (2)颈总动脉插管通过压力换能器输入到生物信号采集处理系统第 2 通道上,记录动脉 血压曲线变化。 (3) 打开计算机启动生物信号采集处理系统,点击菜单“输入信号/1 通道/神经放 (图21-5) ,按开始按钮记录实验数据。 、 “输入信号/2通道/压力” 电”
兔膈神经和膈肌的传出放电 一、实验目的 用膈神经与膈肌放电作为观察呼吸运动的指标,加深对节律性呼吸运动的中枢起源和外界环境改变对呼吸运动的反射性调节作用的认识。 二、实验原理 脑干呼吸中枢的节律性冲动发放,通过脊髓的膈神经及肋间神经下行传导到膈肌与肋间肌,从而产生节律性的呼吸运动。因此,引导膈神经传出纤维的放电和膈肌放电,可直接反映脑干呼吸中枢的活动。同时,膈神经与膈肌放电活动的变化也能反映体内外各种刺激对呼吸运动的反射性影响。 膈肌放电→膈肌收缩→引起吸气 膈肌停止放电→膈肌舒张→引起呼气 三、实验对象 家兔 四、实验器材 哺乳动物手术器械,兔解剖台,20%氨基甲酸乙酯,20ml注射器,约1m长内径0.7cm橡皮管一根,CO2气囊,N2气囊,0.9%氯化钠生理盐水,监听器,引 导电极支架,刺激电极及相连的刺激线,BL—410生物机能实验系统。 五、实验步骤 1、称重 2、麻醉耳缘静脉氨基甲酸乙酯5ml/kg 麻醉药:20% 麻醉指征:肌张力下降、角膜反射消失、呼吸平稳、痛觉明显减退或消失 3、仰卧固定 4、气管插管术:颈前正中纵切口倒“T”型切口 5、分离双侧迷走神经并各穿一细线打松结备用 6、暴露膈肌并安置记录电极:在上腹部正中找到剑突所在部位,在剑突下方3-4cm的地方依次剪去皮肤,沿腹白线在剑突下剪2-3cm切口,打开腹腔,用止血钳夹持剑突尖部并向动物头端翻转剑突,在剑突内表面可见贴附的膈肌,将两根刺激电极平行插入膈肌恢复剑突至原位。 7、安放引导电极:将引导电极支架置于适当的位置,用玻璃分针轻轻挑起膈神经放在电极上,稍稍提高电极,使之悬空与周围组织脱离接触,但切不可将神经拉得过紧,防止损伤。接地电极置于皮肤切口,随仪器并联接地。 六、实验观察 1、BL-410操作:打开电脑,进入BL-410生物机能实验系统,1通道选择肌 电,点击开始按钮,正常呼吸时的膈神经放电:观察动物正常呼吸时的胸廓的运动、呼吸运动和膈神经放电曲线的关系,通过监听器监听与吸气运动相一致的膈神经放电声。 2、于一侧气管插管上连接长橡皮管,待放电活动稳定后堵住插管的另一侧开口一分钟,观察解剖无效腔明显增加时,放电的变化。 3、通过气管插管向气管内缓慢注入CO2,观察吸入气中CO2浓度增加时放电 的变化。
减压神经放电实验 2012级临七3班廖梦宇2012021320 一、实验原理: 颈动脉窦和主动脉弓压力感受性反射,(carotid sinus-arotic arch baroreceptor reflex):即压力感受性反射(baroreceptor reflex),亦称为降压反射(depressor reflex)。动脉压力感受器是位于颈动脉窦和主动脉弓的外膜与中膜之间的一些裸露的神经末梢,可以感受血管壁的牵张度,反应血压的变化。来自压力感受器的冲动通过传入神经窦神经传导到舌咽神经,通过主动脉神经加入迷走神经,在家兔该神经则游离的较长,称为减压神经,传入神经进一步传导冲动先到达孤束核再与心血管中枢联系。减压反射是一种负反馈调节机制。它在平时经常起作用,使动脉血压维持在比较恒定的水平。 二、实验目的: 1、观察减压神经传入冲动的发放特征。 2、动脉血压变动时与减压神经传入冲动发放的相互关系。 三、实验步骤: 1.麻醉和固定 (1)麻醉:25%乌拉坦溶液(1g/kg), 4ml/kg 注射部位:耳缘静脉 注意:①速度----缓慢!!! ②原则:“一快,二慢,三看看(观察)” 观察:肌张力、角膜反射 (2)仰卧位固定 2. 手术 (1)颈部剪毛,颈正中切口约5~7cm, (2)用止血钳纵向钝性分离颈部肌肉, (3)分离一侧减压神经 血管神经鞘:颈总动脉、迷走、交感和减压神经。 分离出一段的减压神经(长约3~5cm),清除附着的脂肪或结缔组织;加温石蜡油以防止干燥,穿线备用。 3.引导 把已游离的减压神经轻轻悬挂在引导电极上。 注意:勿过度牵拉 4.仪器调试 引导电极连接于BL420实验系统。打开计算机,从BL420实验系统主界面的“实验模块”→“循环实验”→“减压神经放电”,开始记录。 四、观察项目: 1. 记录正常减压神经冲动特征并监听声音。 2. 夹住未插管的颈总动脉15~20秒,观察减压神经冲动、监听的声音的变化。 3. 牵拉插管一侧颈总动脉15~20秒,观察减压神经冲动、监听的声音的变化。
实验题目:生理因素及药物对呼吸运动及膈神经放电的影响实验报告 摘要: 【实验目的】 1.学习用计算机生物信号系统记录呼吸及膈神经放电的方法。 2.观察血液化学成分改变对呼吸运动及膈神经放电的影响。 3.观察肺牵张反射以及迷走神经在此反射中的作用。 【实验方法】气管插管法、空白对照法 【实验结论】机体通过呼吸调节血液中的O2、CO2、H+水平,动脉血中O2、CO2、H+ 的变化又通过化学感受器调节呼吸,维持机体内环境的相对稳定。 引言: 呼吸运动能够有节律地进行,并能适应机体代谢的需要,有赖于呼吸中枢的调节作用。体内外各种刺激可以直接作用于呼吸中枢或通过不同的感受器反射性地作用呼吸运动,由此调节呼吸运动的频率和深度,使肺通气能适应机体代谢需要。 材料与方法: 一、实验对象:家兔。 二、器材药品:哺乳动物手术器械一套、兔手术台、气管套管、注射器(20ml、5ml各一副)、30cm长的像皮管一根、纱布、线、引导电极固定架、三维调节器、玻璃分针、输液夹、压力换能器或张力换能器、BL-410计算机生物信号采集处理系统、20%氨基甲酸乙酯溶液、3%乳酸溶液、生理盐水和液体石蜡(加温38~40°C)、10%尼可刹米注射剂、氮气、CO2。 【实验步骤】 1.准备描记装置二道生理记录仪参考参数:灵敏度2mv/cm,滤波30Hz,时间常数DC,基线中线。 2.手术 (1)麻醉固定家兔称重后,用20%乌拉坦5ml/Kg由耳缘静脉缓慢注入,麻醉后仰卧固定于手术台上。 (2)颈部手术颈部剪毛,在喉头下缘至胸骨上凹作正中切口,钝性分离肌肉至气管,作气管插管,在气管插管一侧管置呼吸传感器,通过计算机实时分析系统记录呼吸;也可用弯缝针在兔的剑突上皮肤穿一条线并固定,线的另一端连张力换能器,通过记录仪器记录呼吸。分离出两侧迷走神经穿线备用。 3.观察项目 (1)吸入增加CO2的气体将装有CO2的气袋(可用呼出气体)的管口对准气管插管的一侧开口(中间留有间隙),并作标记,观察描记呼吸曲线的变化。 (2)缺氧待呼吸恢复正常后,将氮气气袋的管口对准气管插管的一侧开口(中间留有间隙),并作标记,观察描记呼吸曲线的变化。 (3)增大无效腔待呼吸恢复正常后,将一根50cm长胶管接在气管插管侧管上,并作标记,观察描记呼吸曲线的变化。 (4)乳酸酸中毒待呼吸平稳后,由耳缘静脉注射3%乳酸2ml/Kg,并作标记,观察描记呼吸曲线的变化。
[目的与要求] 1 学习直接测定家兔动脉血压的急性实验的方法 2观察神经,体液因素对心血管活动的影响 [基本原理] 在正常人体内,任何高等动物的动脉血压时相对稳定的.这种相对稳定是通过神经和体液调节来实现的,其中以静动脉窦-主动脉弓压力感受性反射最为重要.此反射即可使升高的血压下降,又可使降低血压升高,故有血压缓冲反射之称.家兔的主动脉神经在解剖上独成一支,易于分离与观察起作用 本实验是应用液导系统直接测定动脉血压,即由动脉插管与压力传感器连通,其内充满抗凝液体,构成液导系统,将动脉插管插入动脉,动脉内的压力及其变化,可通过封闭的液导系统传导压力感受器,由计算机采集系统记录下来 [动物与器材] 家兔,手术台, 常用手术器械, 止血钳,眼科剪,支架,双凹管, 气管插管,动脉插管,三道管, 动脉夹,计算机采集系统,压力传感器,保护电极,照明灯,纱布,棉球,丝线,注射器(1ml,5ml,20ml),生理盐水,4%柠檬酸钠,20%-25%氨基甲酸已酯,肝素(200U/ml),肾上腺素(1:5000),已酰胆碱(1:10000) 【方法与步骤】 1、实验仪器的准备 打开计算机采集系统,接通压力传感器。从显示器的“实验项目”中找出“循环实验”的“家兔血压的调节”条,使显示器显示压力读数。 2、连通液导系统并制压 将压力传感器的下方支管,通过输液管连接三通管,再连接动脉插管。上侧管供制压时排除管内空气使用。先用装有20ml 4%柠檬酸钠的注射器,通过三通管向连接动脉插管的输液管内推注,使之充满液体(不要使动脉插管高过压力传感器的上方支管)后,再用止血钳夹住动脉插管端的输液管。然后继续向三通管内推注,直至充满压力传感器的上方支管,并用塞子塞住(注意:液导系统内不可有
药物与神经调节对动脉血压的影响 一、实验目的 1.掌握家兔动脉血压的描记和分析方法。 2.掌握家兔减压神经放电的引导方法和影响因素。 3.观察分析神经和体液因素对血压和心率的调节。 二.实验原理 1.动脉血压的影响因素: 心脏射血(每搏输出量),心率,外周阻力,血液充盈,大动脉管壁弹性。 2.心血管活动的调节 神经调节:压力感受性反射、心肺感受性反射、化学感受性反射 体液调节:RAAS,Adr,NE,ADH,内皮素),内皮舒血管因子(EDRF,NO),激肽,前列腺素(PGs)等。 3.减压反射: 血压↑→刺激压力感受器(颈动脉窦与主动脉弓)→传入神经(窦神经、减压神经)→传入冲动↑→心血管中枢整合作用→传出神经(心迷走神经兴奋,心交感神经抑制,交感缩血管纤维抑制)→心输出量和外周阻力↓→血压↓。 意义:此反射对血压变化及时纠正,对维持正常血压发挥着重要作用。 4.动脉血压的长期调节 肾-体液控制系统:细胞外液量增加→Q增多→-Bp升高→肾排水、排钠增加→-细胞外液总量减少→Bp下降。反之亦然。 影响因素:ADH、肾素—血管紧张素—醛固酮系统 三.实验步骤 1.兔称重、麻醉和固定。 2. 手术操作 (1)分离右侧减压神经、迷走神经和颈总动脉, (2)左侧颈总动脉分离、插管,记录血压。 (3)耳缘静脉留置头皮针,以备连续给药。 3.仪器连接 1道:引导电极 2道:血压换能器,动脉血压,心率 刺激输出:刺激电极与BL-420E系统的前面板相应插孔连接。 四、观察指标 1. 正常动脉血压、心率
2. 神经体液因素对血压、心率的影响 (1)减压神经放电 (2)乙酰胆碱,0.5ml,神经放电,血压 (3)去甲肾上腺素,0.5ml,神经放电,血压,撤除引导电极。 (4)牵拉左颈总动脉,5-10s, 2-5次/s, 血压、心率 (5)夹闭右颈总动脉, 5-10s,血压、心率 (6)肾上腺素,0.4ml,血压、心率 (7)刺激迷走神经外周端、中枢端,血压、心率。 五,实验注意事项 1. 保护耳缘静脉,先从耳远端进针。 2. 先分减压神经,再分颈动脉、迷走神经。 3. 每项实验后,等血压和心率恢复,再进行下一项目。 4. 注射药品后,再推注少量生理盐水,防止药物残留在局部静脉。 六,分析思考 1.注射NE、Ach时,血压、心率变化?结论? 2.牵拉左颈总动脉,血压、心率变化?结论? 3.夹闭右侧颈总动脉,血压的变化?结论? 4.刺激右迷走神经外周端、中枢端,血压、心率的变化?神经调控机制? 七、实验结果 不同因素对动脉血压的影响 刺激因素血压心率 牵拉颈总动脉↓↓ 夹紧颈总动脉↑↑ 减压神经↓↓ 迷走神经↓↓ 去甲肾上腺素↑↑ 肾上腺素↑↑ 乙酰胆碱↓↓
家兔动脉血压的神经体液调节 实验报告 [目的与要求] 1 学习直接测定家兔动脉血压的急性实验的方法 2观察神经,体液因素对心血管活动的影响 [基本原理] 在正常人体内,任何高等动物的动脉血压时相对稳定的.这种相对稳定是通过神经和体液调节来实现的,其中以静动脉窦-主动脉弓压力感受性反射最为重要。 本实验应用液导系统直接测定动脉血压,即由动脉插管与压力传感器连通,其内充满抗凝液体,构成液导系统,将动脉插管插入动脉,动脉内的压力及其变化,可通过封闭的液导系统传导压力感受器。 [动物与器材] 家兔 ,手术台, 常用手术器械, 止血钳,眼科剪,支架,双凹管, 气管插管,动脉插管,三道管, 动脉夹,计算机采集系统 ,压力传感器,保护电极,照明灯,纱布,棉球,丝线,注射器(1ml,5ml,20ml),生理盐水,4%柠檬酸钠,20%-25%氨基甲酸已酯,肝素(200U/ml),肾上腺素(1:5000),已酰胆碱(1:10000) 【方法与步骤】 1、实验仪器的准备 打开计算机采集系统,接通压力传感器。从显示器的“实验项目”中找出“循环实验”的“家兔血压的调节”条,使显示器显示压力读数。 2、连通液导系统并制压 将压力传感器的下方支管,通过输液管连接三通管,再连接动脉插管。上侧管供制压时排除管内空气使用。先用装有20ml 4%柠檬酸钠的注射器,通过三通管向连接动脉插管的输液管内推注,使之充满液体(不要使动脉插管高过压力传感器的上方支管)后,再用止血钳夹住动脉插管端的输液管。然后继续向三通管
内推注,直至充满压力传感器的上方支管,并用塞子塞住(注意:液导系统内不可有气泡)。继续向三通管内推注,同时观察显示器上压力变化。当加压到120mmHg时既可关闭三通管。观察压力是否变化,如果压力下降,则需要检查液导系统的漏液原因,并重新制压。调节血压显示器的灵敏度,使30~130mmHg的变化都能在显示器上明显的反映出来。将动脉插管端的导管内充满肝素溶液。 3、动物的准备 (1)按照实验4-9方法,麻醉家兔并进行颈部手术,插入气管插管、分离主动脉神经。同时分离迷走神经并穿线备用。再将止血钳从颈总动脉下方穿过,轻轻张开止血钳,分离出2~3cm长的颈总动脉。分离出的颈总动脉外壁应该十分光洁,外面并无结缔组织及脂肪等物。在动脉上穿两条备用棉线,分别打上活结。将两线分别拉至分离出的动脉两端备用。同样方法分离另一侧血管与神经(一侧动脉用于插管侧压,另侧动脉实验用)。由于家兔的品种不同,个体之间也有差异,常发现3条神经的解剖位置有些变异。主动脉神经的最后确认,蓄意对血压的影响为准。 (2)动脉插管首先用5ml注射器从耳缘静脉注入肝素(200U?kg体重)以防凝血。然后在一侧动脉行动脉插管术以记录血压。其方法如下:将动脉头端的备用线尽可能靠头端结扎(务必扎紧,以防渗血),然后在另一备用线的向心侧(尽可能近心端),用动脉夹夹闭。轻轻提起动脉头端的结扎线,用锐利的眼科剪在靠近扎线的稍后方,沿向心方向斜向剪开动脉上壁(注意:不可只剪开血管外膜,也切勿剪断整个动脉,剪口大小约为管径的一半)。一手持弯头眼科镊,将其一个弯头从剪口处插进动脉少许,轻轻挑起剪开的动脉上壁,另一手将准备好的动脉插管由开口处插入动脉管内。如果插入较浅,可用一手轻轻捏住进入插管的动脉管壁,另一手拿住动脉插管,顺势轻轻推进至6~8mm左右(如果手感滞涩,说明插管并未进入动脉,必须退出插管,重新剪口再插),用备用线将动脉连同进入的插管扎紧(插管不可因扎线松动而滑出,亦不可漏液),并将余线系在插管的固定侧支上,以免滑脱。注意:插管应与动脉血管的方向一致,以防插管尖端扎破动脉管壁。轻轻取下向心端动脉夹,可见动脉血与插管内液体混合。再取下通向压力传感器的止血钳,此时显示器上出现血压的波动曲线。 4、实验观察