
理学院 物理系 陈强
第一章 热力学系统的平衡态及状态方程
3. 温度的本质 由理想气体状态方程 pV = νRT ,其压强可表为 2 ν νN A p = nε 比较,得 p = RT = k T = nk BT , 与 3 V V B (即气体分子平均动能与温度的关系) 2 其中R=NAkB, 3 ε ε = k BT 或 T = n=νNA/V 3k B 2 ? 微观: 温度只与气体分子的平均平动动能有关. 或:温度表征物体内部分子无序运动的剧烈程度。 ? 是统计规律, 只能用于大量分子构成的系统。 ? 温度相同而种类不同(μ不同)的理想气体分子 都具有相同的平均平动动能.
41
1
理学院 物理系 陈强
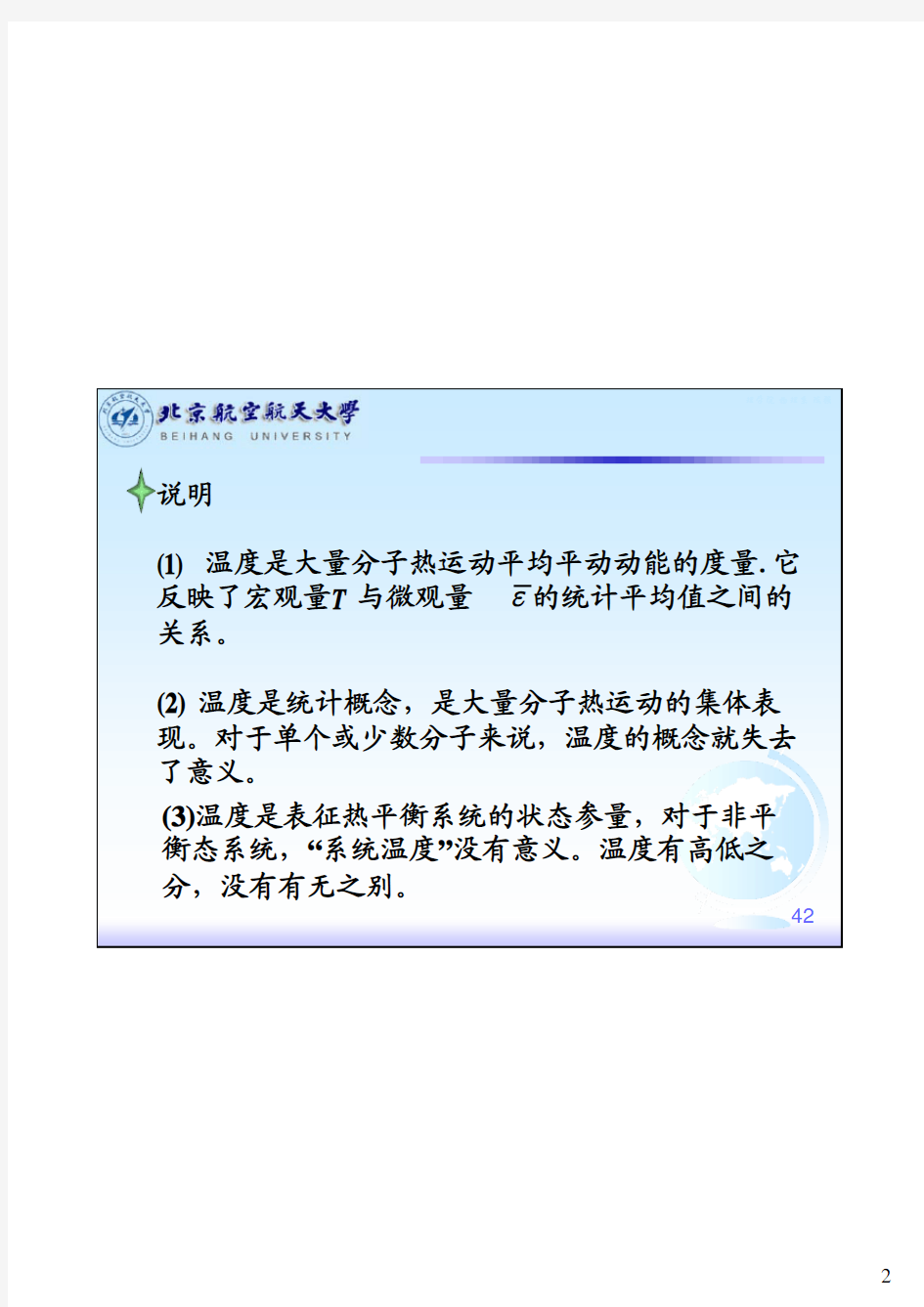
说明 (1) 温度是大量分子热运动平均平动动能的度量.它 反映了宏观量T 与微观量 ε的统计平均值之间的 关系。 (2) 温度是统计概念,是大量分子热运动的集体表 现。对于单个或少数分子来说,温度的概念就失去 了意义。 (3)温度是表征热平衡系统的状态参量,对于非平 衡态系统,“系统温度”没有意义。温度有高低之 分,没有有无之别。
42
2
理学院 物理系 陈强
例 一容积为 V=1.0m3 的容器内装有 N1=1.0×1024 个 氧分子N2=3.0×1024 个氮分子的混合气体, 混合气体的压强 p =2.58×104 Pa 。 求 (1) 分子的平均平动动能; (2) 混合气体的温度 解 (1) 由压强公式 , 有 p 3p 3 = ε = = 9.68 × 10 ? 21 J 2 n 2 ( N1 + N2 ) V (2) 由理想气体的状态方程得 p p T= = = 467 K nk B ? N 1 + N 2 ? ?kB ? ? ? V
44
3
理学院 物理系 陈强
例 有一容积为10cm3的电子管,当温度为300K时用真 空泵抽成高真空,使管内压强为5×10-6 mmHg。 求 (1) 此时管内气体分子的数目; (2) 这些分子的 总平动动能。 解 (1) 由理想气体状态方程得 pV 5 × 10 ?6 × 133.3 × 10 ? 5 = N= = 1 . 61 × 10 k BT 1.38 × 10 ? 23 × 300 3 (2) 每个分子平均平动动能 ε = k BT 2 3 N 个分子总平动动能为 Nε = N ? k BT = 10 ? 8 J 2
12
45
4
理学院 物理系 陈强
四.实际气体状态方程简介
由于实际气体分子有大小,并且分子之间存在有相 互作用,使得理想气体状态方程不完全符合实际气 体的状态变化规律.通过对理想气体状态方程的修 正,可以得出更接近实际气体性质的状态方程. 实际气体的等温P-V线偏离双曲线 1. Van de Waals方程 低温高压下实际气体不再遵从 理想气体状态方程 (1) 分子体积所引起的修正 1mol 理想气体的状态方程为 pv = RT 考虑气体分子本身有大小,将上式修改为 p(v ? b) = RT
b 为常数,可由实验测定或理论估计。
46
5
理学院 物理系 陈强
(2) 分子间引力引起的修正 当分子间距离大于某一值r时,引力可忽略不计。 该距离r称为分子引力的有效作用距离;对每个分 子来说对它有作用力的分子分布在一个半径为r的 球体内(分子作用) 。 r ?远离器壁的分子受其它分 r 子的平均作用力为零 ? F
? 靠近器壁而位于厚度为 r 的表面层内的任一分子, 将受到一个指向气体内部 的分子引力的合力。
?
r F
?
r
47
6
理学院 物理系 陈强
考虑到分子间的引力,将上式修改为 RT p= ? pi (v ? b )
( p + pi )(v ? b ) = RT
a 其中内压强 pi 为 pi = 2 (a 为常数) v
考虑两种修正后,1mol 气体的范德瓦尔斯方程为
(p+ a )(v ? b ) = RT 2 v
48
7
理学院 物理系 陈强
任意质量气体的范德瓦尔斯方程为
M2 a M M ( p + 2 2 )(V ? b ) = RT μ V μ μ
a, b为van de Waals修正量 a—气体分子间引力引起的内压强参数. b —1mol非理想气体在不能继续压缩极限下的体积 约为1mol气体分子总体积的四倍.
49
8
理学院 物理系 陈强
第一章 热力学系统的平衡态及状态方程
2. Onnes方程 1mol理想气体的状态方程为 pv = RT
pv = RT [1 +
B(T ) C (T ) + 2 + L] v v
pv = A +
B C D + 2 + 3 +L v v v
pv = A′ + B′p + C ′p 2 + D′p 3 + L
A,B,C,…及A‘,B’,C‘ …分别称为第一、第二、第三、 … …位力系数。
50
9
§2.1内能、焓、自由能和吉布斯函数的全微分 热力学函数中的物态方程、内能和熵是基本热力学函数,不仅因为它们对应热力学状态描述第零定律、第一定律和第二定律,而且其它热力学函数也可以由这三个基本热力学函数导出。 焓:自由能: 吉布斯函数: 下面我们由热力学的基本方程(1) 即内能的全微分表达式推导焓、自由能和吉布斯函数的全微分 焓、自由能和吉布斯函数的全微分 o焓的全微分 由焓的定义式,求微分,得, 将(1)式代入上式得(2) o自由能的全微分 由得 (3) o吉布斯函数的全微分 (4)
从方程(1)(2)(3)(4)我们容易写出内能、焓、自由能和吉布斯函数的全微分dU,dH,dF,和dG独立变量分别是S,V;S,P;T,V和T,P 所以函数U(S,V),H(S,P),F(T,V),G(T,P)就是我们在§2.5将要讲到的特性函数。下面从这几个函数和它们的全微分方程来推出麦氏关系。 二、热力学(Maxwell)关系(麦克斯韦或麦氏) (1)U(S,V) 利用全微分性质(5) 用(1)式相比得(6) 再利用求偏导数的次序可以交换的性质,即 (6)式得(7) (2) H(S,P) 同(2)式相比有 由得(8) (3) F(T,V)
同(3)式相比 (9) (4) G(T,P) 同(4)式相比有 (10) (7),(8),(9),(10)式给出了热力学量的偏导数之间的关系,称为麦克斯韦(J.C.Maxwell)关系,简称麦氏关系。它是热力学参量偏导数之间的关系,利用麦氏关系,可以从以知的热力学量推导出系统的全部热力学量,可以将不能直接测量的物理量表示出来。例如,只要知道物态方程,就可以利用(9),(10)式求出熵的变化,即可求出熵函数。 §2.2麦氏关系的简单应用 证明 1. 求 选T,V为独立变量,则内能U(T,V)的全微分为 (1) 熵函数S(T,V)的全微分为( 2)
描述热力学系统的重要态函数之一。熵的大小反映系统所处状态的稳定情况,熵的变化指明热力学过程进行的方向,熵为热力学第二定律提供了定量表述。 为了定量表述热力学第二定律,应该寻找一个在可逆过程中保持不变,在不可逆过程中单调变化的态函数。克劳修斯在研究卡诺热机时,根据卡诺定理得出,对任意循环过程都有,式中Q是系统从温度为T的热源吸收的微小热量,等号和不等号分别对应可逆和不可逆过程。可逆循环的表明存在着一个态函数熵.对于绝热过程Q=0,故S≥0,即系统的熵在可逆绝热过程中不变,在不可逆绝热过程中单调增大。这就是熵增加原理。由于孤立系统内部的一切变化与外界无关,必然是绝热过程,所以熵增加原理也可表为:一个孤立系统的熵永远不会减少。它表明随着孤立系统由非平衡态趋于平衡态,其熵单调增大,当系统达到平衡态时,熵达到最大值。熵的变化和最大值确定了孤立系统过程进行的方向和限度,熵增加原理就是热力学第二定律。 能量是物质运动的一种量度,形式多样,可以相互转换。某种形式的能量如内能越多表明可供转换的潜力越大。熵原文的字意是转变,描述内能与其他形式能量自发转换的方向和转换完成的程度。随着转换的进行,系统趋于平衡态,熵值越来越大,这表明虽然在此过程中能量总值不变,但可供利用或转换的能量却越来越少了。内能、熵和热力学第一、第二定律使人们对与热运动相联系的能量转换过程的基本特征有了全面完整的认识。 从微观上说,熵是组成系统的大量微观粒子无序度的量度,系统越无序、越混乱,熵就越大。热力学过程不可逆性的微观本质和统计意义就是系统从有序趋于无序,从概率较小的状态趋于概率较大的状态。 读了该篇论文后,我知道了,在信息论中,熵还可用作某事件不确定度的量度。信息量越大,体系结构越规则,功能越完善,熵就越小。利用熵的概念,可以从理论上研究信息的计量、传递、变换、存储。此外,熵在控制论、概率论、数论、天体物理、生命科学等领域也都有一定的应用。而我们在大学物理中学到的热力学第二定律体系的熵总是增加理论,发现除了孤立系统熵是不变的以外,其他情况下,熵总是在增加的,更不可能有熵为负数的情况出现。而麦克斯韦提出的一个理想系统,提出了“麦克斯韦妖”存在的假说,这种可能是有生命的物质使得熵为负数成为了可能。物理学与生物学的链接由此打开。使我感到知识正在不断地跨学科交融,在普遍联系的基础上衍生出促进社会进步的新思想。我们要不断探索,在探索中学求真知,从而造福人类。
热学:(10学时,29题) 第一章热力学系统的平衡态及状态方程 1. 在标准状态下,容积为10m x 10m x 3m的房间内空气的质量为多少千克?(空气的平 均摩尔质量是29 x 10_3kg/mol) 2. 截面积为S的粗细均匀的U形管,其中储有水银,高度如图所示。今将U形管的右侧 与大气相通,左侧上端封闭,其屮空气柱的温度为300K。若要使空气柱长度变为60cm,需加热到多少K?己知大气压强保持为75cmHgo 第2题 3. 在矿井入风巷道的某一截面处空气的压强p = 0.9xl05Pa,温度t= 17°C,流速v = 5m/s,该处 截面积S = 8m2,问每秒钟流经该处的空气的质量为多少千克?(已知空气的平均摩尔质量是28.9 x 10-3kg/mol) 4. 一篮球在室温为AC时打入空气,使其达到1,5atm,试计算: ⑴赛球时,篮球温度升高到30°C,这时球内的压强有多大? (2)在球赛过程中,球被扎破了一个小洞,开始漏气,问当球赛结束后,篮球恢复到室温时,球内剩下的空气是原有空气的百分之几?(篮球体积不变,室内外均为latm)5. 深海潜水员要在四周都是水的压力下呼吸空气,因为在0.2MPa的分压强下的氧气是有 毒的所以在一定的水深以下必须使用特殊的气体混合物。已知海水的密度为p = 1.025 x 103kg/m3,试问: ⑴按照含氧21%的体积百分比计算,在什么深度下空气中氧的分压强等于0.2MPa? (2)在深水作业中使用含3%的氧和97%的氮(体积百分比)的气体混合物,在水深200m吋,这种气体混合物中氧的分压强是多少? 6. 近代物理学中常用电子伏(eV)作为能量单位,试问在多高温度下分子的平均平动动能
目录 第一章热力学系统的平衡态和物态方程 (1) 第二章热力学第一定律 (3) 第三章热力学第二定律与熵 (7) 第四章均匀物质的热力学性质 (10) 第五章相变 (14) 第六章近独立粒子的最概然分布 (17) 第七章玻耳兹曼统计 (21) 第八章玻色统计和费米统计 (22)
第一章热力学系统的平衡态和物态方程 基本要求 1.掌握平衡态、温度等基本概念; 2.理解热力学第零定律; 3.了解建立温标的三要素; 4.熟练应用气体的物态方程。 主要内容 一、平衡态及其状态参量 1.平衡态 在不受外界条件影响下,系统各部分的宏观性质长时间不发生变化的状态称为平衡态。注意: (1) 区分平衡态和稳定态.稳定态的宏观性质虽然不随时间变化,但它是靠外界影响来维持的. (2) 热力学系统处于平衡态的本质是在系统的内部不存在热流和粒子流。意味着系统内部不再有任何宏观过程. (3) 热力学平衡态是一种动态平衡,常称为热动平衡。 2.状态参量 用来描述系统平衡态的相互独立的物理量称之为状态参量。其他的宏观物理量则可以表达为状态参量的函数,称为状态函数。在热力学中需要用几何参量、力学参量、化学参量和电磁参量等四类参量来描述热力学系统的平衡态。简单系统只需要两个独立参量就能完全确定其平衡态. 二、温度与温标 1.热力学第零定律 与第三个物体处于热平衡的两个物体,彼此也一定处于热平衡。这个实验规律称为热力学第零定律。由该定律可以得出温度的概念,也可以证明温度是态函数. 2.温标 温标是温度的数值表示法分为经验温标(摄氏温标、华氏温标、理想气体温标等)和热力学温标两类.
三、物态方程 物态方程就是给出温度与状态参量之间的函数关系。具有n 个独立参量的系统的物态方程是 ()12,, ,0n f x x x T = 或 ()12,,n T T x x x = 简单系统(均匀物质)物态方程为 ()0,,=T V p f 或 (),T T p V = 物态方程有关的反映系统属性的物理量 (1) 等压体胀系数 p T V V ??? ????= 1α (2) 等体压强系数 V T p p ??? ????= 1β (3) 等温压缩系数 T T p V V ???? ????-=1κ 由于p 、V 、T 三个变量之间存在函数关系,其偏导数之间将存在偏微分循 环关系式 1-=??? ? ?????? ???????? ????p V T V T T p p V 因此α、β、κT 满足 p T βκα= 解题指导 本章题目主要有四类: 一、有关温度计量的计算; 二、气体物态方程的运用; 三、已知物态方程,求α、β、κT .可以由物态方程求偏微分,利用偏微分循环关系式会使问题容易;
第2章. 化学热力学与化学平衡 2.1 化学热力学基本知识 1. 研究内容:化学热力学研究的对象是宏观系统。 化学反应的能量变化;化学反应的方向;化学的反应限度。 2. 一些相关的重要的基本概念 (1)系统、环境和相: 热力学中研究的对象为系统;称系统以外的其他密切相关部分为环境。 相是系统中物理性质和化学性质完全相同的均匀部分,相与相之间存在明显的界面。通常把只含有一个相的系统称为均相系统;含两个或两个以上相的系统称为多相系统。(2)系统的分类: 按系统与环境之间能量和物质交换有无交换分三类: 重点讨论的是封闭系统。 (3)状态和状态函数: 状态:系统的宏观性质的综合表现。
状态函数:描述系统性质的物理量(如:n、p、V、T、U、H、G、S ……) 广度性质:具有加和性的系统性质,如体积、质量等。 强度性质:不具有加和性的系统性质, 如温度。 状态函数的特点:其量值只取决系统所处的状态;其变化值仅取决于系统的始态和终态,而与变化的途径无关。(4)过程和途径: 系统状态所发生的任何变化称为过程。系统经历一个过程,由始态变化到终态,可以采用多种不同的方式,通常把完成某一过程的具体方式称为途径。 根据过程发生时的条件不同,可分为以下几类: (1)等温过程:系统的始态温度与终态温度相同。 (2)等压过程:系统始态的压力与终态的压力相同。 (3)等容过程:系统的体积无变化的过程称为等容过程。 (4)循环过程:如果系统由某一状态出发,经过一系列变化又回到原来的状态,这种过程就称为循环过程。 无机化学重点讨论等温等压等压过程。 3. 标准状态、标准状况 热力学标准状态:
第二部分工质的热力性质 六热力学函数的一般关系式 由热力学基本定律引出的一些基本热力学状态函数(如能U、熵S)及其为某一研究方便而设的组合函数(如焓H、自由能F、自由焓G等)许多都是不可测量,必须将它们与可测量(如压力p、体积V、温度T等)联系起来,否则我们将得不到实际的结果,解决不了诸如上一章讲的最大功计算等一些具体的问题。 这就需要发展热力学的数学理论以将热力学基本定律应用到各种具体问题中去。 热力学函数一般关系式 全微分性质+基本热力学关系式6.1 状态函数的数学特性 对于状态参数,当我们强调它们与独立变量的函数关系时,常称它们为状态函数。从数学上说,状态函数必定具有全微分性质。这一数学特性十分重要,利用它可导出一系列很有实用价值的热力学关系式。下面我们扼要介绍全微分的
一些基本定理。 设函数),(y x f z =具有全微分性质 dy y z dx x z dz x y ???? ????+??? ????= (6-1) 则必然有 (1) 互易关系 令式(6-1)中 ),(y x M x z y =???? ????, ),(y x N y z x =???? ???? 则 y x x N y M ???? ????=? ??? ???? (6-2) 互易关系与?=0dz 等价。它不仅是全微分的必要条件,而且是充分条件。因此,可反过来检验某一物理量是否具有全微分。 (2) 循环关系 当保持z 不变,即0=dz 时,由式(6-1),得 0=???? ????+??? ????z x z y dy y z dx x z
则 x y z y z x z x y ???? ???????? ????- =???? ???? 故有 1-=???? ???????? ???????? ????y z x z x x y y z (6-3) 此式的功能是:若能直接求得两个偏导数,便可确定第三个偏导数。结果也很容易记忆,只需将三个变量依上、下、外次序,即))()((xzy yxz zyx 循环就行了。 (3) 变换关系 将式(6-1)用于某第四个变量ω不变的情况,可有 ωωωdy y z dx x z dz x y ? ??? ????+??? ????= 两边同除以ωdx ,得 ω ω??? ???????? ????+??? ????=??? ????x y y z x z x z x y (6-4) 式中:y x z ??? ????是函数),(y x z 对x 的偏导数;ω??? ????x z 是以),(ωx 为独 立变量时,函数),(ωx z 对x 的偏导数。上面的关系可用于它们之间的变换。这一关系式对于热力学公式的推导十分重要。
第四章均相敞开系统热力学及相平衡准则 §4-1 引言本章提要(教师录像) 第3章的研究对象是均相封闭系统,由此可以解决纯物质或均相定组成混合物的物性计算问题。非均相系统由两个或两个以上的均相系统组成,在达到相平衡状态之前,其中的每个相都是均相敞开系统,通过相之间的物质和能量传递,才能使系统达到平衡,所以,均相敞开系统的热力学关系,对于确定非均相系统相平衡十分重要。 从热力学原理上来看混合物性质计算,应该有两种方法:一是将混合物作为均相封闭系统(即定组成混合物);二是将混合物看作是均相敞开系统(即变组成混合物),得到混合物性质随着组成的变化关系。这两种方法得到的结果应该是一致的,在实际应用中,前者常用的模型一般是状态方程及其混合法则,而后者所用的模型一般是一个液体溶液模型(如G E)。研究非均相体系的基础是均相敞开体系的热力学基本关系式。 §4-2 均相敞开系统的热力学基本关系 公式 4-1 公式4-2 公式4-3 公式4-4化学势的定义为 公式 4-5§4-3 非均相系统的相平衡准则
公式 4-6 公式 4-7 公式 4-8 §4-4 偏摩尔性质 1 偏摩尔性质的定义 2 摩尔性质和偏摩尔性质之间的关系 公式 4-9 公式 4-10对于二元系统有 公式 4-11 §4-5 Gibbs-Duhem方程 Gibbs-Duhem方程表达了混合物中各组分的偏摩尔性质的相互联系,其通式为
公式 4-13 在恒定T、p条件下,式(4-13)则变成 公式 4-14 低压下的液体混合物,在温度一定时近似满足4-14式(因为压力对液体的影响较小)。 Gibbs-Duhem方程在检验偏摩尔性质模型、热力学实验数据等方面有重要作用。 式(4-13)是Gibbs-Duhem方程的通式,它有许多具体形式。 §4-6 混合过程性质变化 混合过程性质变化,可以表示为 公式4-15其中,M i是与混合物同温、同压下的纯组分的摩尔性质。 对于理想气体混合物,其混合过程性质变化可以由纯物质的性质和组成来表示,如 公式4-16 §4-7 混合物中的组分逸度和组分逸度系数 纯物质的逸度和逸度系数,为研究纯物质的相平衡提供了方便;同样,为了研究混合物相平衡的方便,从偏摩尔吉氏函数,引入了混合物中组分逸度和组分逸度系数的概念。
1.1 热力学概论(1)状态与状态函数 1.1.1体系和环境 我们用观察、实验等方法进行科学研究时,必须先确定所要研究的对象,把要研究的那部分物质与其余的分开(分隔面可以是实际的,也可以是想象的),这种被划定的对象就称为体系,而体系以外,与体系密切相关,影响所及的部分则称为环境。 例如:一个热机气缸中的气体,一个反应器中的物质,一个原电池中的物料,这些都是热力学体系,而这些体系以外的部分为环境。体系又可分为如下几种: (1)隔离体系(或孤立体系):体系和环境之间既没有物质交换,也没有能量交换。 (2)封闭体系:体系和环境之间没有物质交换,但有能量交换。 (3)敞开体系:体系和环境之间既有物质交换,也有能量交换。 如一个盖着的热水瓶可近似地认为是一个隔离体系;一个盖着的,但不保温的热水瓶可认为是一个封闭体系;一个没盖的,也不保温的热水瓶可认为是一个敞开体系。 1.1.2 状态和状态函数 1.1. 2.1 状态函数与状态函数法 ? 状态:某一热力学系统的状态指体系的物理性质和化学性质的综合表现。 ? 体系的性质:描述体系状态的一些变量,如体积、压力和温度等称为性质。这些性质又可分为两类: (1)广度性质(或容量性质):广度性质的数值与体系物质的数量成正比,如体积、内能和熵等。广度性质具有加和性。 (2)强度性质:强度性质的数值与体系物质的数量无关,如温度、压力、密度和粘度等。强度性质不具有加和性。 两个广度性质相除就成了强度性质,如摩尔体积和密度等。 ? 状态函数:在热力学中,把体系的性质称为状态变量或状态函数. 如:温度、压力、体积、密度和粘度等。 状态函数的特点:状态函数的数值只与体系现在所处的状态有关,而与其过去的历史无关。如:一大气压下25℃的水,它的密度和粘度都有确定的值,不管这水是由0℃升温来的,还是由100℃降温来的。 1.2.2.2 状态函数法:状态函数的增量只与体系的始末态有关,而与状态变化的过程无关。如果体系状态变化循环一周,则状态函数的增量为0。从数学上来说,状态函数的微分是全微分,全微分沿封闭路径积分一周结果为0。 ?=-=?0 (12dV V V V 体积) ?=-=?0(dU V V U 初态 末态内能) X X X X X X X X X ?=-==??始末末 始末始)(途径)(途径对于任意状态函数:d 2d 1
至今讨论中常应用的八个热力学函数--p、V、T、U、H、S、A、G。其中 U 和 S 分别由热力学第一定律和第二定律导出;H、A、G 则由定义得来。而 U、H、A、G 为具有能量量纲的函数。这些热力学函数间通过一定关系式相互联系着。基本热力学关系式共有十一个(以下分别用公式左边括弧中的数字标明)。从这十一个基本关系式出发,可以导出许多其它衍生关系式,它们表示出各不同物理量间的相互关系,利用它们可以帮助我们由易于直接测量的物理量出发以计算难于直接测量的物理量的数值。 由定义可得如下三个关系式: (1) (3-136) (2) (3-137) (3) (3-138) 又由热力学第一定律、第二定律联合公式,在无非膨胀功条件下: 将它和式(3-136)、(3-137)、(3-138)联系起来: 即可得以下四个一组被称为恒组成均相封闭系统的热力学基本方程。又称 Gibbs 方程。 (4) (3-139) (5) (3-140) (6) (3-141) (7) (3-142) 这四个基本方程均不受可逆过程的限制,因为 U、H、A、G 等随着相应两个独立的状态函数变化而变化,因而与变化的具体途径(可逆或不可逆)无关,自然亦
可用于不可逆过程。公式虽然是四个,但式(5)、(6)、(7)实际上是基本公式(4)在不同条件下的表示形式。根据全微分定义可有如下关系: (3-143) (3-144) (3-145) (3-146) 式(3-139)与式(3-143)对比、式(3-140)与式(3-144)对比、 式(3-141)与式(3-145)对比、式(3-142)与式(3-146)对比,可得如下关系(或称"对应系数式"): (3-147) (3-148) (3-149) 和 (3-150) 如分别将尤拉(Euler)定则: 应用于热力学基本方程(4)、(5)、(6)、(7)可得如下四式: (8) (3-151)
第五章 热力学基础 一、基本要求 1.掌握理想气体的物态方程。 2.掌握内能、功和热量的概念。 3.理解准静态过程。 4.掌握热力学第一定律的内容,会利用热力学第一定律对理想气体在等体、等压、等温和绝热过程中的功、热量和内能增量进行计算。 5.理解循环的意义和循环过程中的能量转换关系。掌握卡诺循环系统效率的计算,会计算其它简单循环系统的效率。 6.了解热力学第二定律和熵增加原理。 二、本章要点 1.物态方程 理想气体在平衡状态下其压强、体积和温度三个参量之间的关系为 RT M m PV = 式中是m 气体的质量,M 是气体摩尔质量。 2.准静态过程 准静态过程是一个理想化的过程,准静态过程中系统经历的任意中间状态都是平衡状态,也就是说状态对应确定的压强、体积、和温度。可用一条V P -曲线来表示 3.内能 是系统的单值函数,一般气体的内能是气体温度和体积的函数),(V T E E =,而理想气体的内能仅是温度的函数)(T E E =。 4.功、热量 做功和传递热量都能改变内能,内能是状态参量,而做功和传递热量都与过程有关。气体做功可表示为 ?=2 1 V V PdV W 气体在温度变化时吸收的热量为 T C M m Q ?= 5.热力学第一定律 在系统状态发生变化时,内能、功和热量三者的关系为 W E Q +?= 应用此公式时应注意各量正负号的规定:0>Q ,表示系统吸收热量,0 6.摩尔热容 摩尔热容是mol 1物质在状态变化过程中温度升高K 1所吸收的热量。对理想气体来说 dT dQ C V m V = , dT dQ C P m P =, 上式中m V C ,、m P C ,分别是理想气体的定压摩尔热容和定体摩尔热容,两者之差为 R C C m V m P =-,, 摩尔热容比:m V m P C C ,,/=γ。 7.理想气体的几个重要过程 8.循环过程和热机效率 (1)循环过程 系统经过一系列变化后又回到原来状态的过程,称为循环过程。 (2)热机的效率 吸 放吸 净Q Q Q W - == 1η (3)卡诺循环 卡诺循环由两个等温过程和两个绝热过程组成。其效率为 1 2 1T T - =η 工作在相同的高温热源和相同低温热源之间的热机的效率与工作物质无关,且以可逆卡诺热机的效率最高。 第七章统计热力学基础 热力学: 基础:三大定律 研究对象:(大量粒子构成的)宏观平衡体系 研究方法:状态函数法 手段:利用可测量量p-T-V+C p,m和状态方程 结果:求状态函数(U,H,S,G,等)的改变值,以确定变化过程所涉及的能量和方向。 但是,热力学本身无法确定体系的状态方程,需借助实验。很显然,体系的宏观热力学性质取决于其微观运动状态,是大量粒子微观运动的统计平均结果。 热力学宏观性质体系的微观运动状态 统计热力学 统计热力学: 基础:微观粒子普遍遵循的(量子)力学定律 对象:大量粒子所构成的体系的微观运动状态 工具:统计力学原理 目的:大量粒子某一性质的微观统计平均的结果(值)与系统的热力学宏观性质相关联。 7.1概述 统计热力学是宏观热力学与量子化学相关联的桥梁。通过系统粒子的微观性质(分子质量、分子几何构型、分子内及分子间作用力等),利用分子的配分函数计算系统的宏观性质。 微观运动状态有多种描述方法: 经典力学方法是用粒子的空间位置(三维坐标)和表示能量的动量(三维动量)描述; 量子力学用代表能量的能级和波函数描述。 由于统计热力学研究的是热力学平衡系统,不考虑粒子在空间的速率分布,只考虑粒子的能量分布。这样,宏观状态和微观状态的关联就转化为一种能级分布(宏观状态)与多少微观状态相对应的问题,即几率问题。 Boltzmann给出了宏观性质—熵(S)与微观性质—热力学几率(Ω)之间的定量关系:S k =Ω。 ln 热力学平衡系统熵值最大,但是通过概率理论计算一个平衡系统的Ω无法做到,也没有必要。因为在一个热力学平衡系统中,存在一个微观状态数最大的分布(最概然分布),摘取最大项法及其原理可以证明,最概然分布即是平衡分布,可以用最概然分布代替一切分布。因此,有了数学上完全容许的ln ln W D,max。 第十二章 往复式空压机的工作理论 一、学习目的和要求 通过本章学习,掌握往复式空压机的工作性能、工作参数及两级压缩理论。 二、重点与难点 (1)空压机的工作循环、热力学基础、保持空压机工作性能的途径。 (2)空压机的工作参数及两级压缩理论。 三、课程内容 第一节 热力学基础 一、气体的状态参数 在热力学中,我们用压力p 、比容v 、温度T 来描述气体状态,称p 、v 、T 为气体的状态参数,又称其为基本状态参数。 1.压力p 容器内气体分子对容器壁单位面积上的垂直作用力,称为压强(本书称为压力),也就是气体的绝对压力。2.比容v 单位质量的气体所占有的容积,称为比容。比容的单位为m 3/kg 。显然,比容的倒数就是密度。 若M (kg)质量的气体,占有的容积为V(m 3),则 M V v = ;V M =ρ ν ρ1= 3.温度T 温度是标志物体冷热程度的参数。温度的高低,反映了气体内部分子热运动的强弱程度。在热力学计算中,采用热力学温度T (又称绝对温度),其单位为K 。它与摄氏温度t ℃的关系为 T =t +273, 二、理想气体状态方程式 1.波义耳—马略特定律 一定质量的气体,当温度保持不变时,其体积和压力成反比。即 2 112p p V V =或=pV 常数 式中 V ——质量为M (kg)的气体所具有的体积,V=Mv ,m 3。 对1kg(单位质量)气体而言 2 112p p v v =或=pv 常数 2.盖-吕萨克定律 一定质量的气体,当压力保持不变时,其体积与绝对温度成正比,即 2 1 21T T V V = 对1kg(单位质量)气体而言 2 1 21T T v v = 3.理想气体状态方程式 2 2 111T v p T v p = 或=T v p 常数 对1kg 气体进行研究时,常数用R 表示,所以 =T v p R 或RT pv = 式中 R ——气体常数。它表示在一定压力下,1kg 气体被加热后,温度升高1K 时所做的膨 胀功,其单位为J/(kg ·K)。对于不同的气体,R 有不同的数值;但对于同一种气体,不论压力、温度、比容如何变化,其值都是相同的。空气的气体常数为287J/(kg ·K)。 对于质量为M kg 的气体,公式的两边应乘以M ,因而得 MRT pvM = MRT pV = 三、内能 气体内部所具有的各种能量的总和,称为气体的内能。理想气体的内能u 只与温度T 有关,即 )(T f u = 内能的单位是焦耳,用J 表示。它与功的单位相同。 四、热力学第一定律 热力学第一定律是能量守恒与能量转换定律在热力工程中的具体应用,即热能与机械能可以相互转换,但转换前后的总能量保持不变。 l u u q +-=12 (18-8) 式中 q —— 加给气体的热量,J/kg ,气体从外界获得热量时,q 取正值,反之取负值; u 1——初始状态时气体的内能,J/kg ; u 2——终了状态时气体的内能,J/kg ; l ——气体膨胀功J/kg ,气体对外作功时,l 取正值,反之取负值。 对于质量为M(kg)的气体,则 L U U Q +-=12 就是热力学第一定律的数学表达式,它适用于任何气体的任何热力过程,所以又称为热 1 流体相平衡的热力学基础 本书主要针对化工类专业的研究生,我们假设读者至少已学过物理化学,已经熟悉了诸如封闭系统、敞开系统、环境、可逆过程、平衡态、状态函数、强度性质、广延性质、独立变量、相律等基本概念,初步掌握了热力学诸定律。能正确运用热Q、功W、热力学能U、焓H、恒容热容C V、恒压热容C P、熵S、亥氏函数(自由能)A、吉氏函数(自由焓)G、化学势 i、逸度f i 和活度a i等概念,来讨论相平衡和化学平衡问题。为避免重复太多,本章只对本书所需的经典热力学基础内容作简要介绍,其中大部分内容在面向本科生的物理化学、化学热力学和化工热力学教材中均有介绍。石油、煤焦油、页岩油以及它们的馏分、植物和动物油脂、高分子溶液或共混物等多分散系统,其组成通常利用某一种或几种性质的连续分布函数来表征,例如相对分子质量分布、芳香度等。组分分布差异对多分散系统的某些性质(如气液平衡、液液平衡、临界性质等)有显著的影响,对其热力学处理方法需要考虑这种连续分布的特点。同时,在实际应用中(特别是在高压相平衡及超临界现象等)常常涉及系统的稳定性。有鉴于此,本章在对一般物理化学和化工热力学著作中较少介绍的流体稳定性理论和多分散系统的连续热力学理论作比较详细的介绍,特别是多分散系统的相平衡和稳定性理论是近几年才逐步建立起来的,尚在不断完善之中。关于本章内容读者可以进一步参阅有关著作[1~6]。 1.1 热力学基本概念 系统(System)或称热力学系统,是指所研究的对象,包括物质和空间。 环境(Surroundings)系统以外有关的物质和空间。 分界面(Boundary)将系统和环境分隔开的想象的或真实的界面。 封闭系统(Closed system)通过分界面有能量得失、但没有物质进出的系统。 敞开系统(Open system)通过分界面既有能量得失、又有物质进出的系统。 孤立系统(Isolated system)通过分界面既没有能量得失、也没有物质进出的系统。 第一章 气体的pVT 关系 主要公式及使用条件 1. 理想气体状态方程式 nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m 式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。 m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。 R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。 此式适用于理想气体,近似地适用于低压的真实气体。 2. 气体混合物 (1) 组成 摩尔分数 y B (或x B ) = ∑A A B /n n 体积分数 /y B m,B B * =V ?∑*A V y A m ,A 式中∑A A n 为混合气体总的物质的量。A m,* V 表示在一定T ,p 下纯气体A 的摩 尔体积。∑*A A m ,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。 (2) 摩尔质量 ∑∑∑===B B B B B B B mix //n M n m M y M 式中 ∑=B B m m 为混合气体的总质量,∑=B B n n 为混合气体总的物质的量。上 述各式适用于任意的气体混合物。 (3) V V p p n n y ///B B B B * === 式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。* B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。 3. 道尔顿定律 p B = y B p ,∑=B B p p 上式适用于任意气体。对于理想气体 V RT n p /B B = 4. 阿马加分体积定律 */B B V n RT p = 此式只适用于理想气体。 第二章 热力学第一定律 主要公式及使用条件 1. 热力学第一定律的数学表示式 W Q U +=? 或 'a m b δδδ d δd U Q W Q p V W =+=-+ 规定系统吸热为正,放热为负。系统得功为正,对环境作功为负。式中 p amb 为环境的压力,W ’为非体积功。上式适用于封闭体系的一切过程。 2. 焓的定义式 3. 焓变 (1) )(pV U H ?+?=? 式中)(pV ?为pV 乘积的增量,只有在恒压下)()(12V V p pV -=?在数值上等于体积功。 (2) 2 ,m 1d p H nC T ?=? 此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。 4. 热力学能(又称内能)变 此式适用于理想气体单纯pVT 变化的一切过程。 5. 恒容热和恒压热 V Q U =? (d 0,'0V W == p Q H =? (d 0,'0)p W == 6. 热容的定义式 (1)定压热容和定容热容 pV U H +=2 ,m 1 d V U nC T ?=? 热力学?统计物理 (汪志诚) 概 念 部 分 汇 总 复 习 热力学部分 第一章 热力学的基本规律 1、热力学与统计物理学所研究的对象:由大量微观粒子组成的宏观物质系统 其中所要研究的系统可分为三类 孤立系:与其他物体既没有物质交换也没有能量交换的系统; 闭系:与外界有能量交换但没有物质交换的系统; 开系:与外界既有能量交换又有物质交换的系统。 2、热力学系统平衡状态的四种参量:几何参量、力学参量、化学参量和电磁参量。 3、一个物理性质均匀的热力学系统称为一个相;根据相的数量,可以分为单相系和复相系。 4、热平衡定律(热力学第零定律):如果两个物体各自与第三个物体达到热平衡,它们彼此 也处在热平衡. 5、符合玻意耳定律、阿氏定律和理想气体温标的气体称为理想气体。 6、范德瓦尔斯方程是考虑了气体分子之间的相互作用力(排斥力和吸引力),对理想气体状 态方程作了修正之后的实际气体的物态方程。 7、准静态过程:过程由无限靠近的平衡态组成,过程进行的每一步,系统都处于平衡态。 8、准静态过程外界对气体所作的功:,外界对气体所作的功是个过程量。 9、绝热过程:系统状态的变化完全是机械作用或电磁作用的结果而没有受到其他影响。绝 热过程中内能U 是一个态函数:A B U U W -= 10、热力学第一定律(即能量守恒定律)表述:任何形式的能量,既不能消灭也不能创造, 只能从一种形式转换成另一种形式,在转换过程中能量的总量保持恒定;热力学表达式: Q W U U A B +=-;微分形式:W Q U d d d += 11、态函数焓H :pV U H +=,等压过程:V p U H ?+?=?,与热力学第一定律的公 式一比较即得:等压过程系统从外界吸收的热量等于态函数焓的增加量。 12、焦耳定律:气体的内能只是温度的函数,与体积无关,即)(T U U =。 13.定压热容比:p p T H C ??? ????=;定容热容比:V V T U C ??? ????= 迈耶公式:nR C C V p =- 14、绝热过程的状态方程:const =γpV ;const =γTV ;const 1 =-γγT p 。 15、卡诺循环过程由两个等温过程和两个绝热过程组成。正循环为卡诺热机,效率 211T T -=η,逆循环为卡诺制冷机,效率为2 11T T T -=η(只能用于卡诺热机)。 16、热力学第二定律:克劳修斯表述:不可能把热量从低温物体传到高温物体 而不引起其他变化(表明热传导过程是不可逆的); V p W d d -=?E 表示内能增加,0W 系统对外界做功,0
统计热力学
第十八章-热力学基础汇总
1流体相平衡的热力学基础分析
热力学公式总结
热力学统计物理概念概括 _总复习