
钼及其化合物的性质
1 金属钼的性质
金属钼主要有物理性质、力学性质和化学性质,表现如下:
1.1物理性质
1.1.1 原子和原子核特性
钼是一种具有高沸点及高熔点的难熔金属,处于元素周期表的第五周期第ⅥB族。它具有两个末被电子充满的外电子层(N和O层)。
钼有七个同位素,在天然混合物中同位素的质量数及含量见表1。据文献钼还有第八个同位素,在天然混合物中的含量为2-3%。
表1 钼的同位素及含量
同位素的质量数92 94 95 96 97 98 100
天然混合物含量/% 15.86 9.12 15.7 16.5 9.45 23.75 9.62
原子序数为42,原子量为95.95,原子体积为9.42cm3/g,密度为10.2g/cm3,钼的自由原子电子层结构为1S22S22P63S23P63d104S24P64d55S1。钼的原子半径为0.139nm,Mo4+和Mo6+的离子半径分别为0.068nm和0.065nm。其原子的电离电位值见表2。
表2 钼原子的电离电位值
外层电子ⅠⅡⅢⅣⅤⅥⅦⅧ
电离电位7.2 15.17 27.00 40.53 55.6 71.7 132.7 153.2
钼原子的热中子捕获面小,等于2.4±0.2巴恩,这使它能用作核反应堆中心的结构材料。
1.1.2 晶体结构
1)晶格常数:钼是A2型体心立方结构,空间群为O h9(1m3m).,钼无同素异构转变。其晶格常数范围为3.1467-3.1475,随着温度的变化稍有不同。不同的研究方法所得的数据有差异,似乎与被研究的钼试样中溶解的碳含量不同有关系。固溶体中的碳含量提高到0.02%,晶格常数则增高了0.0012。由于氧在钼中的溶解度极低,因此试样氧含量的变化对钼的晶格常数没有多大影响。
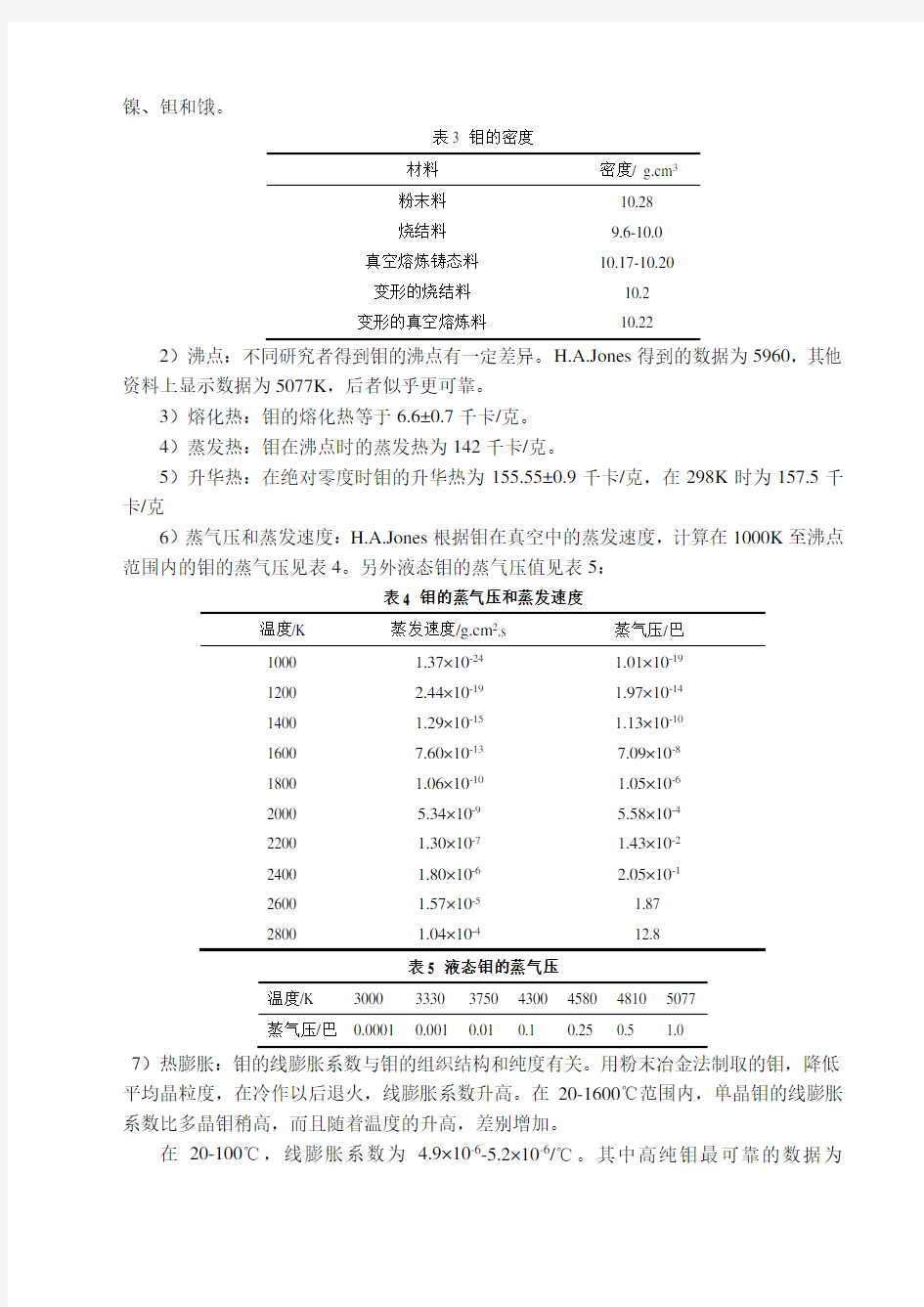
2)密度:钼的密度按X-射线数据计算等于10.23g/cm3.试验所得的密度值与钼的制取方法有关,其数据见表3。
1.1.3 热性质
1)熔点:不同方法测出钼的熔点不同,最可靠的数据为2895±10K。仅次于碳、钨、
镍、钽和饿。
表3 钼的密度
材料密度/ g.cm3
粉末料10.28
烧结料9.6-10.0
真空熔炼铸态料10.17-10.20
变形的烧结料10.2
变形的真空熔炼料10.22
2)沸点:不同研究者得到钼的沸点有一定差异。H.A.Jones得到的数据为5960,其他资料上显示数据为5077K,后者似乎更可靠。
3)熔化热:钼的熔化热等于6.6±0.7千卡/克。
4)蒸发热:钼在沸点时的蒸发热为142千卡/克。
5)升华热:在绝对零度时钼的升华热为155.55±0.9千卡/克,在298K时为157.5千卡/克
6)蒸气压和蒸发速度:H.A.Jones根据钼在真空中的蒸发速度,计算在1000K至沸点范围内的钼的蒸气压见表4。另外液态钼的蒸气压值见表5:
表4 钼的蒸气压和蒸发速度
温度/K 蒸发速度/g.cm2.s 蒸气压/巴
1000 1.37×10-24 1.01×10-19
1200 2.44×10-19 1.97×10-14
1400 1.29×10-15 1.13×10-10
1600 7.60×10-137.09×10-8
1800 1.06×10-10 1.05×10-6
2000 5.34×10-9 5.58×10-4
2200 1.30×10-7 1.43×10-2
2400 1.80×10-6 2.05×10-1
2600 1.57×10-5 1.87
2800 1.04×10-412.8
表5 液态钼的蒸气压
温度/K 3000 3330 3750 4300 4580 4810 5077
蒸气压/巴0.0001 0.001 0.01 0.1 0.25 0.5 1.0
7)热膨胀:钼的线膨胀系数与钼的组织结构和纯度有关。用粉末冶金法制取的钼,降低平均晶粒度,在冷作以后退火,线膨胀系数升高。在20-1600℃范围内,单晶钼的线膨胀系数比多晶钼稍高,而且随着温度的升高,差别增加。
在20-100℃,线膨胀系数为 4.9×10-6-5.2×10-6/℃。其中高纯钼最可靠的数据为
4.9×10-6/℃。钼的线膨胀系数约为一般铜材的三分之一到二分之一。这种低的膨胀系数使得钼材在高温下尺寸稳定,减少了破裂的危险。
在293-2273K 范围内钼的相对伸长率用下列经验公式计算:
46920/110 5.0210(273)110(273)l l T T ---?=-?+?-+?-
未退火钼丝的平均线膨胀系数见表6
表6 钼丝的平均线膨胀系数 温度/K
773 1273 1773 2273
平均线膨胀系数×106 5.1
5.5
6.2
7.2
在0-2895K 之间退火钼的平均线膨胀系数与温度的关系式为:
63
6210 5.050.3110273)0.3610(273)T T α--?=+?-+?-平均(
低温下不同纯度钼的热膨胀系数测量结果列于表7:
表7 纯度为99.9%的钼在低温下的实际线膨胀系数
温度,K 线膨胀系数×105,K -
1 温度,K 线膨胀系数×105,K -
1
284.8 5.16 60 1.12 255.6 5.05 55 0.89 234.6 4.89 50 0.80 196.8 4.60 45 0.60 166.9 4.37 40 0.45 144.9 3.98 35 0.35 128.5 3.70 30 0.20 114.4 3.45 25 0.15 102.5 3.01 20 0.12 90.7 2.64 15 0.05 83.3 2.24 10 0.03 70
1.82
8)比热和热力学性质:钼在25℃时的比热等于0.058卡/克.度。钼的高温比热的各种研究结果示于图1,在2000K 以下不同作者的数据之间的差别基本上在5%以内,但是在更高的温度下,数据之间的差异明显加大。图2是根据图1的数据分析结果而建立的比热最可能值的温度函数关系。钼的低温比热列于表8中。
表8钼的低温比热
温度,K 比热,卡/克.度 温度,K
比热,卡/克.度
温度,K 比热,卡/克.度 1 0.0000055 30 0.00229 120 0.040 3 0.0000178 40 0.0056 160 0.048 6 0.000046 60 0.0148 200 0.053 10 0.000119 80 0.025 240 0.056 20
0.00069
100
0.033
钼的比热与温度有着密切的关系。固态和气态钼的热焓及其他热力学数据分别列于表9和表10。
表9 固体钼的热力学性质
温度/K 焓H T -H 298.15/卡.克-1.℃ 熵S T /卡.克-1.℃ 自由能函数/卡.克-1.℃
298 0 6083 6.83 400 595 8354 7.06 800 3100 12.85 8.98 1200 5790 15.47 10.75 1600 8780 17.71 12.23 2000 12040 19.53 13.51 2400 15580 21.24 14.65 2800 19400 22.61 15.69 2900(液体) 26990 26.46 17.16 3000(液体)
27990
28.80
17.47
图 2 钼的比热最可能值的温度函数关系,
虚线表示可误差范围
图1 钼的高温比热
表10 理想单原子气态钼的热力学性能
温度/K 焓H T-H298.15/卡.
克-1.℃
熵S T/卡.克
-1.℃
自由能函数/
卡.克-1.℃
生成焓ΔH f/卡.
克-1.℃
生成自有能ΔG f/
卡.克-1.℃
lgK P
298 0 43.46 43.46 157500 146578 -107.449 400 506 44.92 43.66 157411 142859 -78.061 800 2493 48.37 45.26 156893 128477 -35.101 1200 4481 50.38 46.65 156191 114419 -20.840 1600 6472 51.81 47.77 155192 100632 -13.745 2000 8492 52.94 48.70 153952 87132 -9.520 2400 10598 53.90 49.49 152518 73894 -6.728 2800 12878 54.77 50.18 150978 60930 -4.755 2900 13487 54.99 50.34 143997 61260 -4.616 3000 14116 55.20 50.50 143626 58426 -4.256 9)导热率钼的热导率数倍于许多高温合金,大约为铜的一半。在室温下钼的导热率一般为0.34卡/厘米.秒.度。不同作者得到的钼的高温导热率与温度关系特性方面都有明显的不同,结果列于图3。温度对导热率有着明显的影响,钼的低温导热率列于表11中。高热导率与低热容的结合使钼能快速加温和冷却,较多数其他金属形成的热应力低。
表11 钼的低温导热率
温度/K λ卡/厘米.秒.度温度/K λ卡/厘米.秒.度
2 0.141 40 0.860
6 0.203 60 0.646
8 0.299 80 0.501
10 0.359 100 0.410
15 0.537 150 0.342
20 0.668 200 0.332
35 0.897 250 0.225
另外在1300-2700K之间,单晶钼的导热率与晶体的取向无关,而且与含等量杂质的多晶钼的导热率没有差异。W.J.Wbeeler在测量具有变形结构钼板试样导热率时发现(热流垂直于轧制方向),1800~1900K的导热率由于再结晶生成等轴晶结构,比1400~1800K 之间的导热率几乎降低了25%。
当用少量钛、锆添加剂使钼合金化时(总重量不超过0.5%),导热率略有下降(比较图3上的曲线14和15),但是下降的幅度似乎不超过10%。杂质碳(0.02%以下)使钼的导热率略有下降。
1.1.4 电磁性
1)电阻:工业纯多晶钼的室温电阻率为5.7微欧.厘米,在0-100℃之间的电阻温度系数为0.00423。钼的电阻与金属的组织有关,强烈变形状态钼的电阻比退火态的高10-15%。钼的电导率较高(约为铜的三分之一),而且随温度的升高而下降,这使钼很适合于电气用途。含碳0.016%和0.019%的真空电弧熔炼钼的电阻与温度的关系见图4。
A.G.Worthing指出不同温度下钼的电阻是不同的。结果列于表12。
表12 钼的电阻和光学特性
试样温度
/K
温度/K 黑度
全发射率伏特/
厘米2
电阻率/微欧.
厘米
亮度(0.665微
米)
颜色辐射
光谱(λ=0.665
微米
积分
273 0.420 5.14 300 0.419 5.78 400 0.415 8.15 600 0.406 13.2 800 0.398 18.6 1000 958 1004 557 0.390 0.096 0.55 23.9 1200 1139 1207 708 0.382 0.121 1.43 29.5 1400 1316 1411 864 0.375 0.145 3.18 35.2 1600 1489 1616 1024 0.367 0.168 6.30 41.1 1800 1658 1823 1187 0.360 0.189 11. 47.0 2000 1824 2032 1354 0.353 0.210 19.2 53.1 2200 1986 2244 1523 0.347 0.230 30.7 59.2 2400 2143 2456 1693 0.341 0.248 47.0 65.5 2600 2297 2672 1866 0.336 0.265 69.5 71.8 2800 2448 2891 2039 0.331 0.281 98.0 78.2 2895 2519 2997 2122 0.328 0.290 116.0 81.4 区域熔炼法制取的钼单晶室温电阻率是5.37-5.43微欧·厘米。在目前能达到的测量精度范围内,不存在钼单晶电阻的各向异性现象。在2400K以下,钼单晶的电阻比多晶丝材的低2~3%。
纯度为99.99%的单晶体在4.2K时的电阻率是4.5~10.2×10-3微欧·厘米。电弧熔炼钼和一般纯度的单晶钼的比值约为103,而经过区域提纯的(真空度为10-9毫米汞柱)高纯单晶体的P203K/P4.2K比值为8×103~104。少量钛和锆添加剂(总重量低于0.5%)稍许提高钼的室温电阻率(不超过10~15%)。钼的超导转变温度是0.93K。
2)磁化率:钼是顺磁体,纯度为99.95%的钼在25℃时的比磁化率为0.93×10-6,并随温度的升高而增大。到1825℃时为1.11×10-6
3)霍尔常数:800℃以下钼的霍尔常数为1.8×10-10米3/安.秒,与温度无关。钼具有很高的弹性模量,是工业金属中弹性模量最高者之一。钼的弹性模量较少受温度的影响,甚至在800℃下其数值仍高于普通钢在室温下的数值。
1.1.5 光和电子的性质
表13列出了钼的热电子发射数据。
表13 钼的电子性能
材料逸出功电子伏理查逊常数/厘米2.度2离子发射电子伏从经过特殊净化的
板材上切下的细条
4.2 55 8.6
工业丝材 4.37 115 8.3
其中热电子发射流的特性值与温度的关系如表14:
表14热电子发射流的电子特性
温度/K 1273 1900 2500
热电子发射流/毫安/厘米21×10-90.83 800
二次发射的δ
最大
(一次电压为400伏时)为1.23。
1.2 钼的力学性能
1.2.1抗拉性能
抗拉性能受许多因素的影响,热处理对室温和高温抗拉性能的影响以及试验方向对室温抗拉性能的影响分别列于表16和表17
表16 热处理对室温和高温抗拉性能的影响(注:1psi=6.9kPa)
热处理试验温度/℃抗拉强度/psi 屈服强度/ psi 伸长率/%断面收缩率/%
加工态27.2 102200 78800 40 61.1 400 79300 53400 20 82.4 650 69600 49800 18 84.2 760 52000 37000 24 88.6
消除应力(980℃,1h)27.2 97200 82900 42 69.0 400 62400 57200 20 81.2 650 65200 48100 22 86.1 760 52400 33400 24 88.6
再结晶(1150℃,1h)27.2 68200 55900 42 37.8 400 39200 21000 60 84.7 650 33600 11000 57 84.8 760 25100 7600 60 84.6 表17 试验方向对室温抗拉性能的影响
试验方向相对于轧向热处理抗拉强度/ psi 屈服强度/ psi 伸长率/%平行消除应力91300~105500 79700~90800 20~27
垂直消除应力91500~106200 82700~95800 16~24
平行再结晶62200~66500 45500~61300 40~53
垂直再结晶58200~66000 43700~58500 16~57
其他一些影响钼抗拉性能的因素见图5-图8,这些图分别表示25℃时应变速率对未合金化的电弧熔炼钼强度的影响,温度和应变速率对未合金化的粉冶态钼韧性、屈服强度和脆性强度的影响,温度对钼抗拉强度的影响,温度对钼丝抗拉强度的影响以及温度对未合金化的电弧熔炼态钼短时抗拉强度的影响。
图5 25℃时应变速率对未合 金化的电弧熔炼强度的影响
图6 温度和应变速率对未合金化的粉 冶态钼韧性、屈服强度和脆性强度的影响
图7 温度对钼抗拉强度的影响
图8 温度对钼丝抗拉强度的影响
图8 温度对未合金化的电弧熔炼态钼短时抗拉强度的影响
1.2.2 硬度
温度对钼硬度的影响示于图9,不管是室温或高温,钼的硬度值都能大致转换成抗拉强度,这种关系见图10。
1.2.3 蠕变
末合金化的粉冶态钼的短时蠕变性能见图11,图12和图13示出了末合金化的电弧熔炼态钼消除应力(980℃,1h)和再结晶(1150℃,lh)条件下应力断裂的曲线,未合金化的粉冶态钼的低温断裂性能见图14,图15示出了温度对l 535℃再结晶(20mtn)后晶粒尺寸为ASTM6/7(横向)和3/6(纵向)的末台金化电弧熔炼态钼疲劳极限、疲劳比和抗拉强度的影响。
图9 温度对未合金化的电弧熔炼钼硬度的影响(载荷为10kg )
图10 钼的维氏硬度于抗拉强度间的关系(基于室温和高温试验)
图11 未合金化的粉液态钼的短时蠕变性能
图12 未合金化的电弧熔炼态钼消除应力(980℃,1h)条件下的应力断裂曲线
图13 未合金化的电弧熔炼态钼再结晶(1150℃,1h)条件下的应力断裂曲线
图14 未合金化的粉液态钼的低温断裂性能
图15 温度对疲劳极限、疲劳比和抗拉强度的影响
1.2.4 低温脆性
和大多数体心立方结构的金属一样,钼在一个窄的温度范围内随温度的降低发生韧性向脆性的转变,即具有塑性-脆性转变温度(DBTT),钼的室温力学性能在很大程度上受转变温度值的控制,而塑性-脆性转变温度又取决于组成、热力作用过程、应变速度和应力。加工和试验方法的微小变化可能会极大地改变转变温度,以致“室温”试验显示出韧性或脆性行为。图16-图18分别示出了未金化的电弧熔炼态钼充分再结晶后应力对转变温度的影响,末合金化的电弧熔炼态钼加工对冲击转变温度、拉伸转变温度的影响,所给样品的韧性随温度的升高、应变速率的下降、二轴或三轴拉伸约束作用的下降而增加,因此,尽管塑性向脆性的转变发生在一个相对窄的温度范围内,由于测定转变温度的标准不同,特定批次样品的转变温度可能会在几百摄氏度或更高温度变化,高于此转变温度,钼具有足
够的韧性。
图16 未合金化的电弧熔炼态钼充分再结晶后应力对转变温度的影响
图17 未合金化的电弧熔炼态钼加工对冲击转变温度的影响
1.2.5 断裂
钼的断裂类型有以下几种:(1)高于塑性-脆性转变温度,预示着韧性条件,表现出不规则的穿晶断裂;(2)低于塑性-质性转变温度,表现出晶间脆性断裂或解理断裂。晶体取向相对于附加应力和纯度是决定脆性断裂是前者或后者的两个因素,多晶铸态钼很容易通过晶间断裂方式发生断裂,除非碳和氧的含量异常低。然而,当个别晶体从材料中分离出来后,可能会展示良好的韧性。高纯铸态钼,在温度低于转变温度,附加应力的方向与正常晶轴方向倾斜大约35度时,发生解理断裂,倾斜角度很大时,可能会发生部分晶间断裂和解理断裂的混合断裂。
金属断面的显微镜观察是研究铸态或再结晶钼断裂方式的常用技术,是检查电弧熔炼态去氧钼的标准方法。铸态或再结晶钼在室温下急速敲击会发生断裂,铸态材料通常拥有大晶组织,很容易通过肉眼或低倍显微镜观察到晶间断裂或穿晶断裂。
图18 未合金化的电弧熔炼态钼加工对拉伸转变温度的影响
图19 辐照对钼性能的影响
1.2.6 辐照对钼力学性能的影响
辐照一般会增加钼的屈服强度,提高其塑性-脆性转变温度。在很多情况下,辐照硬化是适度的,并且不会表现出明显的脆性。原则上,如果辐照不产生足够高的温度,也不会发生这些变化。辐照对钼性能的影响见图19。
1.3钼的化学性质
1)与氧的作用
在钼的化合物中,钼可以呈0、+2、+3、+4、+5、+6价。+5和+6价是其最常见的价态。与钨类似,钼的低氧化态化合物呈碱性,而高氧化态化合物呈酸性。钼的最稳定价态为+6,次稳定的低价态为+5、+4、+3和+2。钼在干燥和潮湿的空气中只在适中的温度下稳定。未经保护的钼在高温下不能抗氧化是其主要弱点,钼在大约400℃时开始轻微氧化,高于600℃时钼在空气和氧化性气氛下氧化速度迅速增加,形成的三氧化物开始升华,使氧化更加强烈,这限制了钼在空气中和氧化性气氛下的应用。在高于700℃时,钼被水蒸气迅速氧化成二氧化钼(Mo+2H20=Mo02+2H2)。
2)与氢的作用
但在真空中则不一样,未被覆的钼使用寿命非常长。钼在纯氢、氩气和氦气中完全稳定。钼与氢气一直到它的熔化温度都不发生化学反应。但钼在氢气中加热时,能吸收一部分氢气生成固溶体。例如在1000℃时,100克金属钼中能溶解0.5厘米3氢。钼在许多电炉中的应用充分证明了这点。
3)与碳、氮气的作用
高于1500℃,钼与氮发生化学反应生成氮化物。假如氮的压力很低(大约0.01毫米汞柱),到2400℃都还看不到。在二氧化碳、氨和氮气中,直至约1100℃钼仍具有相当的情性。在更高的温度下,在氨和氮气中钼的表面可能形成氮化物薄膜。在高于1100℃时,能被含碳气体(如碳氢化合物和一氧化碳)碳化。
4)与硫的作用
在含硫气氛中,钼的行为取决于含硫气氛的性质。在还原气氛下,甚至在高温下钼也能耐硫化氢的侵蚀。这时候在钼的表面上会形成黏附性好的硫化物薄层。但是在氧化性气氛下,含硫气氛能迅速腐蚀钼。硫蒸气需高于440℃,硫化氢则需高于800℃才能与钼发生化学反应生成二硫化钼,含硫气体在700-800℃也能氧化金属钼。
5)与卤素的作用
钼在暴露于卤素中的行为也变化多端,在低于800℃时能耐碘的腐蚀,低于450℃时能耐溴的腐蚀,低于200℃时能耐氯的腐蚀。而氟可以在室温下腐蚀钼。
6)与酸的作用
钼的表面状态对其在电化序中的位置起决定作用。经在浓铬酸溶液中钝化处理后,其电位值为0.66V;而当在苛性碱中做阴极处理活化后,电位值为-0.74V。
在室温下钼能抗盐酸和硫酸的侵蚀。但在80-100℃的温度下钼在盐酸和硫酸中有一定
数量的溶解。在冷态下钼能缓慢地溶于硝酸和王水中,在高温时溶解迅速。氢氟酸本身不腐蚀钼,但当氢氟酸与硝酸混合后,腐蚀相当迅速。5体积硝酸、3体积硫酸和2体积水的混合物,是钼的有效溶剂。钼在酸性介质中的行为还受是否有其他化学试剂存在的影响。例如,三氯化铁可加速钼在盐酸中的溶解,二氯化铁却没有这种作用。因此,在氧化气氛下,对有钼存在的体系中使用含铁的组分是不当的。
7)与碱的作用
在室温下苛性碱的水溶液几乎不腐蚀钼,但在热态下会发生轻微腐蚀。在熔融的苛性碱中情况完全不同,特别是在有氧化剂存在时,金属钼迅速被腐蚀。熔融的氧化性盐类,如硝酸钾和碳酸钾,能强烈侵蚀钼。
8)钼的腐蚀性
钼对许多熔融金属具有很好的耐蚀性。在高熔点金属中,钼对熔融态的铋和钠的耐蚀性很强。钼不与汞作用,所以在水银开关中得到应用。在熔融金属中,对钼腐蚀严重的有锡、铜、镍、铁、钻。钼对熔融的锌具有适度的耐蚀能力,与钨合金化有助于提高其耐蚀能力。钼对其他介质的耐腐蚀能力,值得一提的是钼与许多类型的玻璃、有色金属炉渣,以及在惰性气氛下与氧化钼、氧化锆、氧化铍、氧化镁和氧化钍兼容。
2 钼的化合物及其性质
2.1钼的氧化物
钼与氧形成一系列化合物,如Mo03(斜方层状α相)、MoO2.89。(单斜的β相和三斜的ε相)、MoO2.875(单斜的β相)、MO4O11(MoO2.75,单斜的η相)和Mo02(单斜的δ相),其中最稳定且常见的是MoO3和MoO2。MoO3是酸酐,而MoO2是碱性氧化物。与钨和氧形成的氧化物有些类似,中间氧化物MoO2.89和M04O1l,与WO2.90和WO2.72有些相当,但MoO2.89,和Mo4O11的稳定性不如WO2.90和WO2.72,很难制得它们的纯样品,钼-氧系二元相图如图20所示。
三氧化钼和二氧化钼的某些性质列于表18中。三氧化钼是钼冶金中最重要的中间体,大多数钼的化合物都是直接或间接地以它为原料制得的。它能与强酸,特别是浓硫酸反应,形成MoO22+和Mo2O44+复合阳离子,这些离子本身又能形成可溶性盐。碱的水溶液、碱的熔体和氨能够与三氧化钼迅速反应,形成钼酸盐。将钼或其化合物进行强烈氧化,得到的最终产物总是三氧化钼。在工业上500℃以上的温度用氢气还原三氧化钼,是制取金属钼粉的方法。粗三氧化钼可用在空气中焙烧辉钼矿(MoS2)的方法制得。由于三氧化钼在较低的温度下即具有显著的蒸气压,所以可用升华法对它进行净化。在升华作业的操作条件下,通常与之共生的杂质或不具有挥发性(如硅酸盐等)或不能冷凝而被除去。
图20 钼-氧系二元相图
表18三氧化钼与二氧化钼的某些性质
性质表征
三氧化钼二氧化钼
颜色白色结晶粉末深棕色粉末
熔点/℃795
沸点/℃1155
升华温度/℃700
生成热/kJ. mol-1744±6 589
密度/g.cm-1 4.6 6.34 水中溶解度/g.L-10.4~2 不溶于水
水溶液pH值4~4.5
结晶类型斜方晶系单斜晶系在约1770℃和无空气存在的情况下,二氧化钼会歧化为挥发性的三氧化钼和金属钼:3MoO2→2MoO3十Mo。在有空气存在的情况下,二氧化钼在高温下会迅速氧化成三氧化钼。二氧化钼在碱金属氢氧化物水溶液、非氧化性酸和熔盐中稳定。硝酸能将二氧化钼氧化成三氧化钼。
2.2 钼酸
当氧化钼的硝酸溶液蒸发时,会得到白色结晶粉末钼酸(H2MoO4)。当钼酸铵溶液用硝酸中和并将溶液自然蒸发时,得到水合钼酸(H2MoO4·H20)。水合钼酸在温度低于61℃时稳定,而钼酸在61-120℃温度范围内稳定。钼酸在高于120℃时脱水,生成MoO3。钼酸微溶于水,但是它能迅速溶于无机强酸和碱中。随着温度的升高,钼酸在水中的溶解度增加,见表19。在酸中钼酸的溶解度随酸度的变化而变化,在pH=1-2范围内其溶解度最小,这是溶液中沉钼的重要理论依据。
表19 钼酸在水中的溶解度(以Mo03计)
温度/℃
18
30
36.8
45
52
60
70
80
溶解度/ g.L -1 0.106 0257 0.328 0.365 0.417 0.421 0.466 0.518
钼酸可与Mo03结合生成同多酸。同多酸的通式未M 2O.nMoO 3,式中m 2.3 钼酸盐 钼酸的盐类称为钼酸盐,而多钼酸的盐类称为多钼酸盐。单钼酸盐的分子式为M 2O .MoO 3或M 2MoO 4,式中M 2O 代表一价金属氧化物。在多钼酸盐中,n(M 2O):n(MoO 3)<l ,其数值变化范围相当宽。例如,已知的多钼酸盐有二钼酸盐(M 2O .2MoO 3)、仲钼酸盐(3M 2O .7MoO)、五钼酸盐(M 2O.5MoO 3)、八钼酸盐(也称8/3钼酸盐)(3M 2O .8MoO 3·3H 2O)和四钼酸盐(M 2O .4MoO)等。 A.琴纳德等人测得的MoO 3-NH 3-H 2O 系在25℃和85℃的等温线(图21和图22). 当碱金属钼酸盐用酸中和,或当MoO 3溶于钼酸盐溶液中时,会形成多钼酸盐。溶液的pH 值对钼酸根的形态有很大影响。在pH 值大于或等于6.5时,溶液中只有钼酸根阴离子存在。在pH 值为6.5-2.5的区间内,发生聚合反应,生成各种多钼酸根离子。在溶液的pH 值小于2.5时,生成MoO 22+或更为复杂的阳离子。在pH 值低于1时,阳离子是主要的存在形式。碱金属的单钼酸盐在水中的溶解度高,而碱土金属、铅、铁、铜、锌等的单钼酸盐的溶解度低。 徐志昌给出了钼酸铵溶液中各种络合物分布随酸与钼的物质的量比变化的关系,见图23。 图21 MoO 3-NH 3-H 20系在25℃的等温线 图22 MoO 3-NH 3-H 20系在85℃的等温线 图23 钼络合物组成随酸与钼的物质的量比的变化 以下是常见单钼酸盐和多钼酸盐的性质. 1) 单钼酸钠(Na2MoO4) 从n(Na2O):M(Mo03)大于l的溶液中,可以结晶出单钼酸钠。在10-100℃温度区间内结晶的是二水钼酸钠(Na2MoO4.2H2O),而在低于10℃时生成的是十水合物。无水Na2MoO4的熔点是627℃,密度为3.28g/m3。NaMoO4在15℃时的溶解度为39.27%,在100℃时的溶解度为45.27%。 2) 单钼酸铵(NH4)2MoO4 单钼酸铵主要用在化学和催化剂工业。将工业级或纯MoO3溶于氨水,经过滤和蒸发后可制得单钼酸铵。 3) 钼酸钙(CaMoO4) 钼酸钙在自然界以钼酸钙矿形式产出。钼酸钙是白色晶体,向钼酸盐水溶液添加氯化钙可制得钼酸钙。钼酸钙的密度为3.28g/cm3,在1520℃时熔化。 4)钼酸铁 有两种钼酸铁,一种是三价铁的钼酸盐Fe(MoO4)3.nH2O,另一种是亚铁钼酸盐FeMoO4。在pH值约为3.5时,向钼酸盐水溶液添加氯化高铁或硫酸高铁,会沉淀出黄色的钼酸高铁。在更高pH值下得到的沉淀物含有氢氧化铁,呈棕色。在pH值低于3.5时,沉淀物含有钼酸。当加热至600℃以上时,钼酸高铁分解为Fe2O3和MoO3。钼酸亚铁不能从钼酸盐水溶液中获得,因为亚铁离子能还原MoO42-。在隔绝空气下将FeO和MoO3的混合物加热到500-600℃,可得到钼酸亚铁。 5)钼酸铅(PbMo04) 钼酸铅是一种白色微溶于水的钼酸盐,在自然界以钼酸铅矿形式产出。它既可以从碱金属钼酸盐的溶液中析出,也可以用将PbO和MoO3的混合物加热到500-600℃的方法来合成。钥酸铅的密度为6.92g/cm3,在1065℃时熔化。 6)钼酸铜(CuMoO4) 无水钼酸铜是一种黄绿色的粉末,它可用将CuO和MoO3的混合物加热到500-700℃ 的方法来合成。钼酸铜在820℃时熔化并分解。亮绿色的碱式钼酸铜可用向钼酸钠水溶液添加铜盐的方法来制备。随沉淀的条件不同,得到的沉淀物的分子式或为CuO.CuMoO4·5H2O,或可能具有天然矿物2CuMoO4.Cu(OH)2的组成。 7)仲钼酸钠(5Na20.12MoO3·38H20) 仲钼酸钠是最有代表性的一种多钼酸钠盐。将单钼酸钠溶液中和至pH值大约为5时,结晶出仲钼酸钠。这种水合物的溶解度在30℃时为157g/l00g(H2O)。仲钼酸钠的无水盐微溶于水。 8) 仲钼酸铵(3(NH4)20.7Mo03·4H2O) 仲钼酸铵可以从NH3:MoO3物质的量比(原摩尔比或分子比)为6:7或稍高的氨性溶液中析出。为获得上述物质的量比(原摩尔比或分子比),可采用蒸发驱氨的方法或中和掉部分氨的方法。仲钼酸铵在空气中稳定,20℃时在水中的溶解度约为300g/L,在80-90℃时约为500g/L。仲钼酸铵在150℃时开始分解,放出氨并形成四钼酸铵(NH4)2O.4Mo05,在350℃时失去全部氨而剩下MoO3。铵盐是工业上常见的钼化合物,是生产纯MoO3和金属钼粉的中间品。 9) 四钼酸铵((NH4)2Mo4O13·xH20) 四钼酸铵是用含钼酸的氨性溶液通过酸沉法生产的,其分子式为(NH4)2Mo4013·xH20。无水四钼酸铵按其结晶形态可分为四钼酸铵、α-四钼酸铵、β-四钼酸铵、微晶型四钼酸铵和无定形五种。常见的形态为四钼酸铵、α-四钼酸铵、β-四钼酸铵。 10)二钼酸铵((NH4)2)Mo2O7·xH20) 当高浓度的钼酸铵溶液随着pH值降低时,将分别结晶出二钼酸铵、仲钼酸铵和四钼酸铵(或八钼酸铵)等晶体。将浓的钼酸铵溶液加热蒸发,使其中大部分的游离氦蒸发除去,同时使溶液得到进一步的浓缩,并使NH3:Mo03分子比为1:1时,溶液中的钼将以二钼酸铵的形态结晶析出,它也是一种重要的多钼酸盐。 2.4 钼的杂多酸和杂多酸盐 在酸性溶液中,钼酸或其盐类能与中心原子P、As、S1、B、Se等形成杂多酸和杂多酸盐,如H3[P(Mo3O10)4)]·nH2O、H45Si(Mo3O10)4.nH2O等,其杂多酸根离子可用以下通式表示: [X n+.Mo6O24](12-n)-,[X n+.Mo12O42](12-n)- (X表示P、As、Si等中心原子) 当有金属阳离子存在时,形成相应的杂多酸盐。钼的杂多酸和杂多酸盐广泛用于制取催化剂、缓蚀剂等。钼酸根也能与钨形成络合物,该络合物中W:Mo分子比为1:1,当溶液中W (Ⅵ)+Mo(Ⅵ)=0.01mol/L时,在25℃和60℃时络合物的稳定常数分别为59×104和4.5×104。 2.5 钼蓝 当用一种还原剂(如SO2、H2S、Zn、葡萄糖等)与钼酸或酸性钼酸盐溶液作用时,形成了所谓的“钼蓝”而使溶液带深蓝色。在氧化还原过程中容易出现钼蓝,特别是在生产中反