
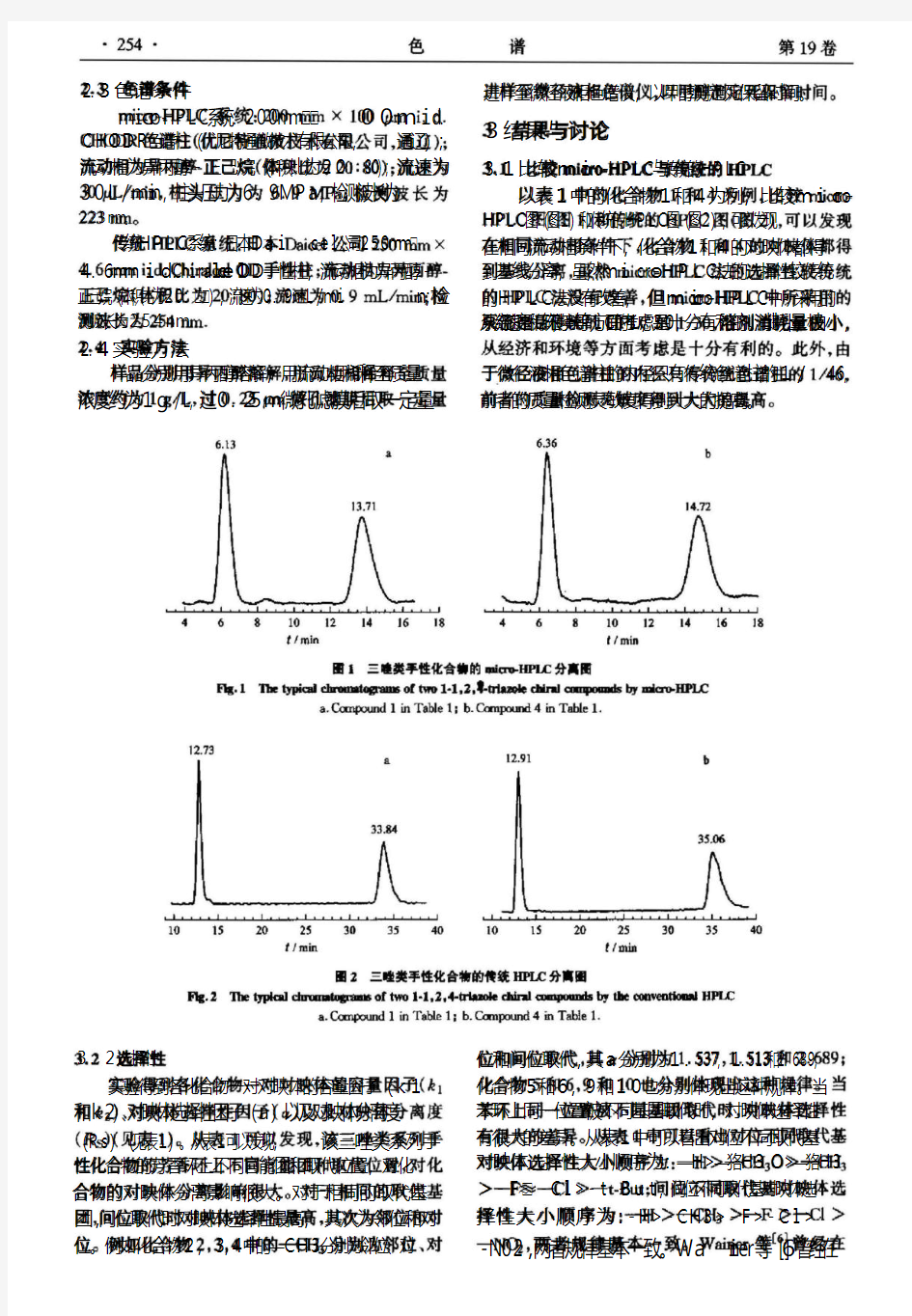
手性分子的拆分技术 Document serial number【LGGKGB-LGG98YT-LGGT8CB-LGUT-
手性分子的拆分技术 郝婷玉 57 15级材料工程 摘要:对外消旋体实施拆分是获得手性物质的重要途径。本文综述了外消旋体的拆分方法,主要有直接结晶拆分法、化学拆分法、动力学拆分法、色谱拆分法( 含毛细管电泳法) 和手性膜拆分法等五大类。其中, 包括目前作为手性拆分主要方法的色谱技术在内的前 4 类方法, 由于批处理能力小、工业放大成本高 ,不适合大规模生产 ; 相反,膜分离技术具有能耗低、易于连续操作等优点 ,被普遍认为是进行大规模手性拆分非常有潜力的方法之一,具有良好的应用前景。 关键词:手性分子;拆分;对映体;外消旋化合物 手性是自然界存在的一种普遍现象, 在药物化学领域尤为突出 ,已知药物中有 30 %~ 40 %是手性的。手性是生物体系的一个基本特征, 很多内源性大分子物质,如酶、蛋白、核酸、糖, 以及各种载体、受体等都具有手性特征。此外,手性还在医药、食品添加剂、杀虫剂、昆虫性信息素、香料和材料等领域有着深刻影响。特别是在医药行业,手性药物对映体通过与体内大分子的立体选择性结合, 产生不同的吸收、分布、代谢和排泄过程, 可能具有不同的药理毒理作用。随着医药行业对手性单体需求量的增加和对药理的探究,如何获得高纯度手性单体已成为一个令人困扰的问题。因此 ,手性药物的分离分析就显得尤为重要。随着对手性分子认识的不断深入,人们对单一手性物质的需求量越来越大,对其纯度的要求也越来越高。 单一手性物质的获得方法大致有以下三种:(1)手性源合成法:是以手性物质为原料合成其它手性化合物,这是最常用的方法。但由于天然手性物质的种类有限,要合成多种多样的目的产物会遇到很大困难,而且合成路线步骤繁多,也使得产物成本十分高昂。(2)不对称合成法:是在催化剂或酶的作用下合成得到过量的单一对映体化合物的方法。化学不对称合成高旋光收率的反应仍然有限,即使如此,所得产物的旋光纯度对于多
手性药物的合成与拆分的研究进展 手性是自然界的一种普遍现象,构成生物体的基本物质如氨基酸、糖类等都是手性分子。手性化合物具有两个异构体,它们如同实物和镜像的关系,通常叫做对映异构体。对映异构体很像人的左右手,它们看起来非常相似,但是不完全相同。 目前市场上销售的化学药物中,具有光学活性的手性药物约占全部化学药40% } 50%,药物的手性不同会表现出截然不同的生物、药理、毒理作用,服用对映体纯的手性药物不仅可以排除由于无效(不良)对映体所引起的毒副作用,还能减少药剂量和人体对无效对映体的代谢负担,对药物动力学及剂量有更好的控制,提高药物的专一性,因而具有十分广阔的市场前景和巨大的经济价值[Dl 1由天然产物中提取 天然产物的提取及半合成就是从天然存在的光活性化合物中获得,或以价廉易得的天然手性化合物氨基酸、菇烯、糖类、生物碱等为原料,经构型保留、构型转化或手性转换等反应,方便地合成新的手性化合物。如用乳酸可合成(R)一苯氧基丙酸类除草剂[}z}。天然存在的手性化合物通常只含一种对映体用它们作起始原料,经化学改造制备其它手性化合物,无需经过繁复的对映体拆分,利用其原有的手性中心,在分子的适当部位引进新的活性功能团,可以制成许多有用的手性化合物。 2手性合成 手性合成也叫不对称合成。一般是指在反应中生成的对映体或非对映体的量是不相等的。手J险合成是在催化剂和酶的作用下合成得到过量的单一对映体的方法。如利用氧化还原酶、合成酶、裂解酶等直接从前体化合物不对称合成各种结构复杂的手性醇、酮、醛、胺、酸、酉旨、酞胺等衍生物,以及各种含硫、磷、氮及金属的手性化合物和药物,其优点在于反应条件温和、选择性强、不良反应少、产率高、产品光学纯度高、无污染。 手性合成是获得手性药物最直接的方法。手J险合成包括从手性分子出发来合成目标手性产物或在手性底物的作用下将潜在手性化合物转变为含一个或多个手性中心的化合物,手性底物可以作为试剂、催化剂及助剂在不对称合成中使用。如Yamad等和Snamprogetti 等在微生物中发现了能催化产生N-氨甲酞基一D-氨基酸的海因酶( Hy-dantoinase)。海因酶用于工业生产D一苯甘氨酸和D一对轻基苯甘氨酸。D一苯甘氨酸和D一对轻基苯甘氨酸是生产重要的临床用药半合成内酞胺抗生素(氨节青霉素、轻氨节青霉素、氨节头炮霉素、轻氨节头炮霉素)的重要侧链,目前国际上每年的总产量接近SOOOto 3外消旋化合物的拆分 外消旋拆分法是在手性助剂的作用下,将外消旋体拆分为纯对映体。外消旋体拆分法是一种经典的分离方法,在工业生产中己有100多年的历史,目前仍是获得手性物质的有效方法之一。拆分是用物理化学或生物方法等将外消旋体分离成单一异构体,外消旋体拆分法又可分为结晶拆分法;化学拆分法;生物拆分法;色谱拆分法;膜拆分和泳技术。 3. 1结晶拆分法 3.1.1直接结晶法 结晶法是利用化合物的旋光异构体在一定的温度下,较外消旋体的溶解度小,易拆分的性质,在外消旋体的溶液中加入异构体中的一种(或两种)旋光异构体作为晶种,诱导与晶种相同的异构体优先(分别)析出,从而达到分离的目的。在。一甲基一L一多巴的工业生产中就是使两种对映体同时在溶液中结晶,而母液仍是外消旋的,把外消旋混合物的过饱和溶液通过含有各个对应晶种的两个结晶槽而达到拆分的目的[3]。结晶法的拆分效果一般都不太理想,但优点是不需要外加手性拆分试剂。若严格控制反应条件也能获得较纯的单一对应体。 3. 1. 2非对映体结晶法
在有机合成中产生手性化合物的方法有4种: 1.使用手性的底物 2.使用手性助剂 3.采用手性试剂 4.使用不对称催化剂 常常需要使用天然产物,如:氨基酸、生物碱、羟基酸、萜、碳水化合物、蛋白质等。 1.使用手性的底物 这种方法局限于比较有限的天然底物 如图,该化合物的硼氢化反应中,由于羟基的作用产生另外新的立体中心(反应从分子的背后发生) 以下两个反应,第一个是由于羧基的控制得到相应的手性产物..另一个则是由于反应中间体烯醇阴离子的构象决定了构型 2.使用手性助剂 如图,在第一步使用LDA去质子化时,为了使得上边的醇锂和下边的烯醇锂相距最远,Z-异构体占优势,在下一步与EtI的反应中得以产生了立体中心。 类似地,用烯醇锆替代烯醇锂(使用LDA,ZrCp2Cl2)确保烯醇的构型,再和醛反应产生不对称中心。 这些反应多数通过手性助剂的金属原子和底物中已有手性的O、N等原子络合,之后再加入其他试剂实现不对称中心的形成。这其中手性唑啉环是一个非常不错的手性助剂,它水解后可以生成一个羧基(潜在官能团) 另外一个试剂是手性的3-烷基哌嗪-2,5-二酮(一个环状二肽,可由两个氨基酸环合生成),如图 在羰基的α位进行不对称烷基化使用的是以下两种试剂A和B(B称为SAMP),如图,对环己酮的反应中采用A得到S异构体而采用B得到R异构体.
在氨基的α位进行不对称烷基化使用的试剂如下二图,用胺和它们作用后再用LDA、MeI甲基化,最后用N2H4脱去助剂得到产物. 还有一些有趣的反应如脯氨酸的α烷基化,涉及到一个立体化学的"存储"问题,经历了一个消失和再产生的过程:: 手性亚砜的作用:分离得到手性亚砜试剂和卤代烷作用后在下一步反应中诱导手性基团的产生,Al/Hg可以方便地除去亚砜基团。 3.采用手性试剂 通过铝锂氢化物与手性二胺或氨基醇作用可以得到一个用于不对称还原的试剂。如图。 利用α-蒎烯和9-BBN作用得到的试剂是一个很好的不对称还原试剂.如图 不对称硼氢化反应也是一个很好的构造立体化学中心的反应。这里需要利用α-蒎烯(图中的反应是针对三取代烯烃的,对于双取代烯烃应采用条件温和的双取代硼烷)
手性化合物的拆分技术研究进展 许多药物具有光学活性。一般显示光学活性的药物分子,其立体结构必定是手性的,即具有不对称性。手性是指其分子立体结构和它的镜像彼此不能重合。互为镜像关系而又不能重合的一对分子结构称为对映体。虽然对映异构体药物的理化性质基本相同,但由于药物分子所作用的受体或靶位是由氨基酸、核苷、膜等组成的手性蛋白质和核酸大分子等,后者对与之结合的药物分子的空间立体构型有一定的要求。因此,对映异构体在动物体内往往呈现出药效学和药动学方面的差异。鉴于此,美国食品药品监督管理局规定,今后研制具有不对称中心的药物,必须给出手性拆分结果,欧盟也提出了相应的要求。因此,手性拆分已成为药理学研究和制药工业迫切需要解决的问题。 1.生成非对映体拆分 此方法是利用外消旋混合物与手性试剂反应后生成有不同性质的非対映体,从而利用生成物的不同物理性质(溶解度、蒸汽压、结晶速率等)将其分离,再将分离后的物质分别还原成之前的対映体。 还可以使用拆分剂家族代替单一拆分剂进行拆分,所谓拆分剂家族是指有类似结构的2~3个手性剂拆分剂。组合拆分提高了产品收率和纯度。 2.动力学拆分 利用两个対映体和手性试剂发生反应的速度不一样,在混合物中添加不足量的手性试剂。一个対映体与手性试剂结合,从而得到纯的反应慢的対映体。可以分为经典动力学拆分和动态动力学拆分,动态动力学拆分是指将经典动力学拆分和底物消旋化相结合的拆分方法,理论产率可以达到100%。底物消旋化分为化学消旋化和酶消旋化,由于酶消旋化具有操作条件温和、产率高、副反应少等优点而具有广泛的工业应用价值[4]。 3.液膜拆分 将具有手性识别功能的物质溶解在溶剂中制备液膜,利用内外向间推动力(浓度差、pH 差等)使待分离物中的某种物质得到富集。液膜分离方法又分为本体液膜、乳化液膜、支撑液膜3种类型。 4.固体膜拆分 此方法是基于対映体间亲和力的差异,利用推动力(浓度差、压力差、电势差)进行分
手性高效液相色谱法检测恩替卡韦中光学异构体杂质的含量 王文娜 邓桂凤 张玲娣 姚彤炜 3 (浙江大学药学院药物分析和药物代谢研究室,杭州310031) 摘 要 采用Chiral pak AD 2H 手性柱(250mm ×416mm,5μm ),建立了正相高效液相色谱(NP 2HP LC )法直接拆分恩替卡韦与其光学异构体的方法。考察了流动相组成、酸碱性对柱效、分离度、保留时间等参数的影响。经优化,以正己烷2异丙醇2乙醇2三氟乙酸2三乙胺(70∶12∶18∶0105∶0105,V /V )为流动相,流速 015mL /m in;检测波长261n m 。在此条件下,恩替卡韦与光学异构体分离度>412;光学异构体的检出限为0112mg/L ,在0125~410mg/L 浓度范围内有良好的线性关系;日内与日间精密度RS D <410%;按标准加入 法计算,加样回收率在8710%~10018%之间;RS D <310%;按外标法计算,加样回收率在9812%~11014%之间;RS D <310%。本方法可作为恩替卡韦原料药中光学异构体杂质限量的控制方法。关键词 恩替卡韦,光学异构体,高效液相色谱法,手性拆分 2008212229收稿;2009204229接受3E 2mail:rethe m@https://www.doczj.com/doc/b715243454.html, 1 引 言 慢性乙肝病毒感染一直是全球公共卫生的难题,开发抗乙肝病毒药物也一直是个热点。目前,我国临床上应用的抗病毒治疗药物主要有两类:α2干扰素和核苷或核苷酸类似物,主要包括拉米夫定、阿德 福韦和阿昔洛韦[1,2] 。2005年3月美国F DA 批准了新一代抗HBV 核苷类似物恩替卡韦(entecavir, 图1 恩替卡韦及其光学异构体的化学结构 Fig .1 Structures of entecavir and its op tical is omer ET V,商品名Baraclude )上市[3] 。恩替卡韦是一种鸟嘌呤核苷类似物(图1),在磷酸激酶的作用下在体内形成活性三磷酸化合物,拮抗HBV 所需天然底物脱氧鸟苷三磷(dGTP ),抑制HBV 2DNA 聚合酶和逆转录酶,阻断HBV 复制。细胞内作用 半衰期为15h,在人体内不被肝细胞代谢,主要从 肾脏排出体外。同时,其耐药性好,可有效治疗慢 性乙型肝炎,临床应用前景良好[4,5] 。 由于手性药物在合成过程中可能引入光学异构体杂质,故采用手性分离方法检查合成产品中光学异构体含量。恩替卡韦及其光学异构体手性分离方法未见报道。本研究采用直接手性HP LC 法拆分两光学异构体,建立恩替卡韦中光学异构体杂质限量检查方法。 2 实验部分 211 仪器、试剂及材料 LC 210A 型高效液相色谱仪、SP D 210A 型紫外可见光检测器(日本岛津公司);Chiral pak AD 2H 手性 柱(250mm ×416mm ,5μm ,日本D iacel 公司)。乙醇(TE D I A )、正己烷(Burdick &Jacks on )及异丙醇(TE D I A )均为色谱纯;三氟乙酸(国药集团化学试剂有限公司);三乙胺(分析纯,上海化学试剂采购供应五联化工厂);恩替卡韦及其光学异构体(99187%,浙江医药股份有限公司新昌制药厂)。212 色谱条件 色谱柱:Chiral pakAD 2H 手性柱;流动相:正己烷2异丙醇2乙醇2三氟乙酸2三乙胺(70∶12∶18∶0105∶0105,V /V );流速015mL /m in;检测波长261nm;柱温:室温;灵敏度:01005AUFS;进样量20μL 。 第37卷 2009年8月 分析化学(FE NX I HUAXUE ) 研究简报Chinese Journal of Analytical Chem istry 第8期 1206~1210
收稿日期:2003-05-25 作者简介:寿崇琦(1963-),男,山东省济南市人,济南大学化学化工学院教授,硕士研究生导师,中国科学院兰州化学物理研究所博士研究生。 高效液相色谱手性固定相研究进展 寿崇琦1,张志良2,赵春宾2,邢希学2,李关宾1,陈立仁1 (11中国科学院兰州化学物理研究所,甘肃兰州 730000; 21济南大学化学化工学院,山东济南 250022) 摘要:对近年来高效液相色谱手性固定相的研究进行了综述。重点介绍了手性固定相的分类、拆分机理 和应用的新进展。讨论了各类手性固定相优缺点,提出了目前存在的问题、今后的研究方向和重点。 关键词:高效液相色谱;手性固定相;拆分机理中图分类号:O658 文献标识码:A 文章编号:1004-4280(2004)01-0069-05 随着生物工程和生物科学的发展,手性拆分和测定引起了人们的普遍关注。尽管对映体间物理化学性质几乎完全相同,但它们的生化和药理作用却往往不同。这是因为生物本身内部的核酸、蛋白质及多糖都具有与其功能相适应的结构,它们常常对扬长避短一化合物的两种对映体表现出不同的响应。例如具有镇静作用的反应停(thalidomide ,酞胺哌啶酮),其有效成分是R 构型,而S 构型则具有致畸作用[1]。据统计,常用的200种药物中,大约有120种至少含有一个手性中心。而这些手性药物中有80%~90%以外消旋体形式在市场销售,存在巨大的潜在危险性[2]。因此,对映体的拆分与识别对于生命科学和药物化学研究以及人类的健康具有十分重要的意义。 目前用于手性分离的方法主要有毛细管电泳法、薄层色谱法、亚临界及超临界流体色谱法、气相色谱法和液相色谱法[3]。近年来,高效液相色谱法取得了令人瞩目的进展,已成为对映体拆分强有力的手段之一。而其中所用的手性固定相的是能否进行手性分离的关键。1 手性固定相的分类 虽然液相色谱常被分为不同的分离模式,但实质上所有的分离模式都基于两个最基本的因素:即固定相的结构和组成,以及决定分离机理的固定相与流动相相互作用的性质。因而手性固定相(CSP )的制备则是手性分离的关键。目前所研究的HP LC -CSP 主要可分为下列几类[4]: 1.1 蛋白质手性亲和固定相 多数蛋白质CSP 的分离机理目前尚不十分清楚,但是蛋白质CSP 的手性识别能力可以归结为它们独特的空间立体结构特征[4]。尤其是在对映体的手性识别过程中,三级结构所造成 第18卷第1期 2004年3月山 东 轻 工 业 学 院 学 报JOURNA L OF SHANDONG INSTIT UTE OF LIGHT INDUSTRY Vol.18No.1Mar.2004
浅谈手性化合物与现代医学 一、手性化合物简介 手性化合物(chiral compounds)是指分子量、分子结构相同,但左右排列相反,如实物与其镜中的映体。人的左右手、结构相同,大姆至小指的次序也相同,但顺序不同,左手是由左向右,右手则是由右向左,所以叫做“手性”。也就是指一对分子。由于它们像人的两只手一样彼此不能重合,又称为手性化合物。判断分子有无手性的可靠方法是看有没有对称面和对称中心。 手性问题与我们的日常生活密切相关。天然存在的手性化合物品种很多,并且通常只含有一种对映体,手性问题还牵涉到农业化学、食品添加剂、饮料、药物、材料、催化剂等诸多领域。它的研究已经成为科学研究和很多高科技新产品开发的热点。在过去20年里,手性研究具有戏剧性的发展,已从过去的少数几个专家的学术研究发展到大面积科学研究的需要,在一些领域并已带来了巨大的经济效益。物质的手性已经变成越来越需要考虑的问题,其对我们的日常生活正在起到越来越重要的作用。 手性化合物主要从天然来源、不对称合成和外消旋体拆分3个方面得到。由天然来源获得手性化合物,原料丰富,价廉易得,生产过程简单,产品的纯度一般都较高,因此很多量大的产品都是从天然物中获得。在药物工业中由于对手性药物的要求不断增加,其大大激发了不对称有机合成的发展,使一些生物技术、生物催化剂也迅速扩展到该领域产生纯的的手性中间体和手性产品。 二、手性药物 由于自然界的生命体存在有手性,因而也就产生了手性药物。手性药物指分子结构中存在手性因素的药物。通常是指由具有药理活性的手性化合物组成的药物,或者是只含有效对映体或是以有效对映体为主的药物。按药效方面的简单划分,手性药物可能存在以下几种不同的情况:①只有一种对映体具有所要求的药理活性,而另一种对映体没有药理作用或活性很小。②一对对映体中的两个化合物具有等同或近乎等同的同一药理活性。③一对对映体具有完全不同的药理活性。 ④一对对映体之间一个有药理活性,另一个不但没有活性,甚至表现出一定的毒副作用。⑤一对对映体之间药理活性相近,但存在个体差异。⑥一对对映体中,一个有活性,另一个却发生拮抗作用。 三、手性药物未来展望 手性制药是医药行业的前沿领域,2001年诺贝尔化学奖就授予在分子不对称催化反应中做出杰出贡献的三位科学家。目前,世界单一对映体手性药物的销售额持续增长。1998年销售额已达到964亿美元。2000年的销售额为1330亿美元,并估计2008年达到2000亿美元。手性药物以其疗效高、毒副作用小、用药量少的优点满足了市场的需求,因而成为未来新药研发的方向。
手性药物拆分技术的研究进展 摘要:简要阐述了手性药物的世界销售市场。综述了目前实验室和工业生产领域手性药物的拆分方法,包括:结晶拆分法,化学拆分法,动力学拆分法,生物拆分法,色谱拆分法,手性萃取拆分法和膜拆分法等,并简要介绍了每种方法的应用情况及优缺点。 关键词:手性药物; 外消旋体; 手性拆分 自然界存在各种各样的手性现象,比如蛋白质、氨基酸、多糖、核酸、酶等生命活动重要基础物质,都是手性的。据统计,在研发的1200种新药中,有820种是手性的,占世界新药开发的68%以上[ 1 ]。美国FDA在1992年发布了手性药物指导原则,该原则要求各医药企业今后在新药研发上,必须明确量化每一对映异构体的药效作用和毒理作用,并且当两种异构体有明显不同作用时,必须以光学纯的药品形式上市。随后欧共体和日本也采取了相应的措施。此项措施大大促进了手性药物拆分技术的发展,手性药物的研究与开发,已经成为当今世界新药发展的重要方向和热点领域[ 2 ]。当前大多数药物是以外消旋体的形式出现,即药物里含有等量的左右两种对映体。但是近年来单一对映体药物市场每年以20%以上的速度增长。1993年全球100个热销药中,光学纯的药物仅仅占20%;然而到了1997年, 100个中就有50个是以单一对映体形式存在,手性药物已占到世界医药市场的半壁江山。在1993年,手性药物的全球销售额只有330亿美元;到了1996年,手性药物世界市场已增长到730亿美元; 2002年总销售额更是达到1720亿美元, 2010年可望超过2500亿美元[ 3~5 ]。广阔的应用前景和巨大的市场需求触发了更多的医药企业和学者探索更新更高效地获得单一手性化合物的方法。 不同的立体异构体在体内的药效学、药代动力学和毒理学性质不同,并表现出不同的治疗作用与不良反应,研究与开发手性药物是当今药物化学的发展趋势。随着合理药物设计思想的日益深入,化合物结构趋于复杂,手性药物出现的可能性越来越大;另一方面,用单一异构体代替临床应用的混旋体药物,实现手性转换,也是开发新药的途径之一[ 1 - 3 ]。1985~2004年上市的550个新化学合成药物中,有313个药物具有手性中心,其中以单一异构体上市的手性药物为167个,手性药物数量呈逐年上升趋势; 2005年世界药物的销售总额为6 020亿美元,而手性药物的销售总额为 2 250亿美元,占全球制药市场销售总额的37% , 2010年可望超过 5 000亿美元[ 4 - 6 ]。总之, 手性药物大量增长的时代已经来临,手性药物制备技术的发展亦日趋完善,这为以制备和生产手性药物为主要内涵的手性工业的建立和发展奠定了基础。 手性药物的制备技术由化学控制技术和生物控制技术两部分组成。手性药物的化学控制技术可分为普通化学合成、不对称合成和手性源合成3类;手性药物的生物控制技术包括天然物的提取分离技术和控制酶代谢技术。以前手性化合物为原料,经普通化学合成可得到外消旋体,再将外消旋体拆分制备手性药物中间体或手性药物,这是工业生产手性药物的主要方法。1985~2004年上市的58个含有一个手性中心的手性药物中,有27个手性药物是通过手性拆分法生产的[ 4 ]。 1结晶法拆分 结晶法拆分包括直接结晶法拆分( direct crys ta llization resolution )和非对映异构体拆分( dias te reom er crys tallization resolution) ,分别适用于外消旋混合物( conglom e rate)和外消旋化合物( racem ic compound)的拆分。在一种外消旋混合物的过饱和溶液中,直接加入某一对映体的晶种,即可得到一定量的该对映体,这种直接结晶的拆分方法仅适用于外消旋混合物,其应用几率不到10%。外消旋化合物较为常见,大约占所有外消旋体的90%。通过与非手性的酸或碱成盐可以使部分外消旋化合物转变为外消旋混合物,扩大直接结晶法拆分的应用范围。 对于外消旋化合物,可采用与另一手性化合物(即拆分剂, reso lving agent)形成非对映异
高效液相色谱法在生命科学中的应用 高效液相色谱在生命科学中的应用范围越来越广,高效液相色谱由于具有高选择性、高灵敏度,并可同时用于有关物质检查与含量测定的特点,已成为医药研究的有力工具。如在中草药有效成分的分离和纯度测定、人工合成药物成分的定性和定量测定、新型高效手性药物中手性对映体含量的测定以及药物代谢物的测定等方面都需要用到HPLC的不同测定方法予以解决。而目前高效液相色谱的蒸发现了它在生命科学中的重要地位。光散射检测器的应用更体现了它在生命科学中的重要地位。1天然药物分析 天然药物的来源有动物、植物和矿物之分,其中以植物类为主。由于天然药物的化学成分复杂,其有效成分,可能有一个,也可以有多个,这对于控制药品质量,建立质量标准来说比较困难,HPLC可通过对天然药物的有效成分进行分离鉴定,再测定有效成分的含量;通过指纹图谱建立识别模式,可以判定药材的质量高低。 2 天然药物及复方成药分析 复方制剂、杂质或辅料干扰因素多的品种多采用高效液相色谱法。增免扶正片系由当归、党参、黄芪(图3)等十几味天然药物精制而成,具有益气生津、活血养血、滋补肝肾、健脾开胃之功效,主要用于抗缺氧、抗疲劳、抗衰老,长期服用可扶正祛邪,提高机体免疫功能,健身强体,益寿延年。该药对心、肝、脾、肾虚、纳差、心脑血管疾病、神经衰弱、
慢性肝炎、脂肪肝等都有较好的防治作用。 由于化学药品的开发费用昂贵,而且毒副作用大,近年来人们已把目光转向自然、民族传统医药、草药、植物药等天然药物,据世界卫生组织统计,当前全世界60多亿人口中80%的人使用过天然医药。在全世界药品市场中,天然物质制成的药品已占30%,国际上植物药市场份额已达300亿美元,且每年以20%以上的速度增长。HPLC分析必定能为我国传统中医药实现现代化,走向世界提供强有力的技术支持。 3 抗生素分析 抗生素是由微生物或其他方法产生的化学物质,在高度稀释的情况下仍具有抑制或杀灭其他微生物的性能。抗生素的分离、分析和定量测定是药物分析中较困难的领域。采用较多的方法是微生物法、分光光度法和化学方法,但所需时间较长、专一性较差。 HPLC分析技术近年来在抗生素的质量控制中已广泛应用。对结构、组分等较清楚的药物,HPLC分析将逐步取代传统的生物测定。目前,各国药典中应用HPLC技术对抗生素进行质量控制的项目包括鉴别、组分分析、含量测定和相关物质测定等。 4 在鉴别中的应用 在HPLC法中,保留时间与组分的结构和性质有关,是定性的参数,可用于药物的鉴别.如中国药典收载的药物头孢羟氨苄的鉴别项下规定:在含 量测定项下记录的色谱图中,供试品主峰的保留时间应与对照品主峰的保留时间一致.头抱拉定,头孢噻酚钠等头孢类药物以及地西泮注射液,曲安奈德注射液等多种药物均采用HPLC法进行鉴别.
1 手手性性高高效效液液相相色色谱谱法法 **手手性性药药物物分分析析的的概概念念 **常常用用手手性性高高效效液液相相色色谱谱法法 手手性性衍衍生生化化试试剂剂法法 手手性性固固定定相相法法 手手性性流流动动相相添添加加法法 2 手手性性的的概概念念::一一种种镜镜像像反反射射的的对对称称性性
3 手性分子:组成相同但空间结构上互成镜像的分子,称之为对映异构体。 分子结构中含有不对称碳原子是最常见的手性结构。 根据对偏振光的作用不同可分为R、S体,两者的等量混合物称之为消旋体。 OH COOH H CH 3 OH COOH H CH 3 4 Mirror Mirror
手手性性异异构构体体在在药药理理学学效效应应上上的的差差异异 ● Pfeiffer 规则: ● 对映异构体之间的生物活性存在着差异; ● 不同的对映体之间活性的差异是不同的; 当手性药物的有效剂量越低,即药效强度越高时,则对映体之间的药理作用的差别越大。 外消旋体和其两种单一对映体是不同的3种实体! 5 对对映映体体与与生生物物大大分分子子的的三三点点作作用用 c a b d a b d c α γβ α β γ 手性分子的a 、b 、c 结合,是高活性对映体(优映体)。 手性分子的a 、b 、c 三个基团中只有a 和b 与受体分子的活性作用点 6 在未研究清楚两种单一对映体之间的生物学差异时,以消旋体给
药往往会影响药物质量,甚至会严重损害人体健康。 “反应停”(Thalidomide)作为人工合成药,当时投入使用时是两种 对映体的混合物。 7 反应停:五十年恩怨 发展趋势: 劣映体本身或其代谢物产生毒副作用,不再使用外消旋体。外消旋体转换成单一对映体,不仅提高质量,还延长药物寿命。 如:氧氟沙星的左旋异构体活性更强,左旋氧氟沙星临床使用剂量是消旋体的一半。
5.方茴说:“那时候我们不说爱,爱是多么遥远、多么沉重的字眼啊。我们只说喜欢,就算喜欢也是偷偷摸摸的。” 6.方茴说:“我觉得之所以说相见不如怀念,是因为相见只能让人在现实面前无奈地哀悼伤痛,而怀念却可以把已经注定的谎言变成童话。” 7.在村头有一截巨大的雷击木,直径十几米,此时主干上唯一的柳条已经在朝霞中掩去了莹光,变得普普通通了。 8.这些孩子都很活泼与好动,即便吃饭时也都不太老实,不少人抱着陶碗从自家出来,凑到了一起。 9.石村周围草木丰茂,猛兽众多,可守着大山,村人的食物相对来说却算不上丰盛,只是一些粗麦饼、野果以及孩子们碗中少量的肉食。 手性药物的结晶拆分方法--直接结晶法---逆向结晶法 在优先结晶法中,通过加入不溶的添加物即晶种形成晶核,加快或促进与之晶型或立体构型相同的对映异构体结晶的生长。而逆向结晶法则是在外消旋体的饱和溶液中加入可溶性某一种构型的异构体[如(R)—异构体],添加的(R)—异构体就会吸附到外消旋体溶液中的同种构型异构体结晶体的表面,从而抑制了这种异构体结晶的继续生长,而外消旋体溶液中相反构型的(S)—异构体结晶速度就会加快,从而形成结晶析出。例如在外消旋的酒石酸钠铵盐的水溶液中溶入少量的(S)—(—)—苹果酸钠铵或(S)—(—)—天冬酰胺时,可从溶液中结晶得到(R,R)—(十)—酒石酸钠铵。 逆向结晶中的添加物必须和溶液中的化合物在结构和构型上有相关之处。这样所添加的物质才能嵌入生长晶体的晶格中,取代其正常的晶格组分并能阻止该晶体的生长。逆向结晶是一种晶体生长的动力学现象,添加物的加入造成了结晶速度上的差别。由于逆向结晶是晶体生长的动力学的现象,因此当结晶时间无限制的延长下之,最终得到的仍是外消旋的晶体。从化合物的性质上来看,逆向结晶只能用于能形成聚集体的化合物。在结晶法的拆分过程中,若能将优先结晶法中“加入某种单—对映异构体晶体可诱导相同构型结晶生长”的原理和逆向结晶中“加入另一个对映异构体溶液可抑制相同构型的对映异构体生长”的原理相结合,可使结晶拆分的效率大大提高 手性药物的结晶拆分方法--直接结晶法---优先结晶法 优先结晶方法(preferential crystallization)是在饱和或过饱和的外消旋体溶液中加入一个对映异构体的晶种,使该对映异构体稍稍过量因而造成不对称环境,结晶就会按非稍的过程进行,这样旋光性与该晶种相同的异构体就会从溶液中结晶出来。优先结晶方法是在巴士德的研究基础上发现的。文献最早报道的优先结晶方法是用于肾上腺素的拆分。1934年Duschinsky第一次用该方法分离得到盐酸组氨酸,使人们认识到该方法的实用性。但直到1963年工业化学家Secor对该方法进行综述后,才引起人们关注并逐渐发展成为众所周知的科学实用方法。Secor根据优先结晶法是聚集物的结晶的原理,可用其溶解度曲线的相图来进行结晶分离过程的分析。20世纪60~70年代,优先结晶方法在工业生产上大规模的用于由丙烯腈制备L—谷氨酸的拆分,每年的产量可达1.3万吨。这一技术不仅在工业生产上有非常显著的应用价值,在'实验室也可用于拆分数克到数十克的光学活性的化合物。应当指出的是,优先结晶方法仅适用于拆分能形成聚集体的外消旋体,而且该聚集体是稳定的结晶形式。换句话讲,假若该外消旋体可以是以聚集物或外消旋化合物的形式存在,但在某一定的温度范围内,只可以以聚集物的形式结晶出来,而刁;是产生外消旋化合物的结晶。例如盐酸组氨酸在45℃以上温度进行的优先结晶拆分。减肥药物芬氟拉明(fenfluramine,6)及其前体去乙基芬氟拉明(7)的拆分研究说明了优先结晶拆分的局限性。在对(6)和(7)与非手性的有机酸形成的50多个盐进行聚集物性质研究时,发现只有五个(6)的盐和三个(7)的盐是聚集体,但其中有两个盐不能使用优先结晶法结晶,这两个盐是(6)的苯氧乙酸盐和(7)的二氯乙酸盐。(6)的苯氧乙酸盐在室温下以不稳定的聚集体和稳定的外消旋化合物的形式发生共结晶,而(7)的二氯乙酸盐在结晶过程中会发生异手性(heterochiral growth)生长,即—种对映异构体的晶体生长在另一种异构体晶体的表面,得到晶体的光学纯度很低。聚集体通常在一定的温度范围内是稳定的,一旦超过该温度范围则叫咱S形成聚集体的亚稳态的形式,这种亚稳态的形式也可以用优先结晶的方法拆分,但得到的将是亚稳态多晶型的形式。例如盐酸组氨酸在25℃时的结晶。也有些化合物,例如外消旋的3—(3—氯苯基)—3—羟基丙酸(8),可以形成热力学稳定的聚旧体的形式,但在溶剂中结晶时总是生成亚稳态的外消旋化合物,而且该外消旋化合物的溶解度约是其对映异构体的7倍,这种情况难以用优先结晶法进行结晶。优先结晶法是一种高效、简单而又快捷的拆分方法,晶种的加入造成两个对映异构体具有不同的结晶速率是该动态过程控制的关键。延长结晶时间可提高产品的产率,但产品的光学纯度有所下降。从优先结晶法中得到晶体后,如要进一步提高产物的光学纯度,可 1.“噢,居然有土龙肉,给我一块!” 2.老人们都笑了,自巨石上起身。而那些身材健壮如虎的成年人则是一阵笑骂,数落着自己的孩子,拎着骨棒与阔剑也快步向自家中走去。
高效液相色谱法 高效液相色谱法系采用高压输液泵将规定的流动相泵人装有填充剂的色谱柱,对供试品进行分离测定的色谱方法。注人的供试品,由流动相带入色谱柱内,各组分在柱内被分离,并进入检测器检测,由积分仪或数据处理系统记录和处理色谱信号。 1. 对仪器的一般要求和色谱条件 高效液相色谱仪由高压输液泵、进样器、色谱柱、检测器、积分仪或数据处理系统组成。色谱柱内径一般为3.9?4.6 mm,填充剂粒径为3?10μm。超高效液相色谱仪是适应小粒径(约2μm) 填充剂的耐超高压、小进样量、低死体积、高灵敏度检测的高效液相色谱仪。 (1) 色谱柱 反相色谱柱:以键合非极性基团的载体为填充剂填充而成的色谱柱。常见的载体有硅胶、聚合物复合硅胶和聚合物等;常用的填充剂有十八烷基硅烷键合硅胶、辛基硅烷键合硅胶和苯基键合硅胶等。 正相色谱柱:用硅胶填充剂,或键合极性基团的硅胶填充而成的色谱柱。常见的填充剂有硅胶、氨基键合硅胶和氰基键合硅胶等。氨基键合硅胶和氰基键合硅胶也可用作反相色谱。 离子交换色谱柱:用离子交换填充剂填充而成的色谱柱。有阳离子交换色谱柱和阴离子交换色谱柱。 手性分离色谱柱:用手性填充剂填充而成的色谱柱。 色谱柱的内径与长度,填充剂的形状、粒径与粒径分布、孔径、表面积、键合基团的表面覆盖度、载体表面基团残留量,填充的致密与均匀程度等均影响色谱柱的性能,应根据被分离物质的性质来选择合适的色谱柱。 温度会影响分离效果,品种正文中未指明色谱柱温度时系指室温,应注意室温变化的影响。为改善分离效果可适当提髙色谱柱的温度,但一般不宜超过60°C。残余硅羟基未封闭的硅胶色谱柱,流动相pH值一般应在2?8之间。残余硅羟基已封闭的硅胶、聚合物复合硅胶或聚合物色谱柱可耐受更广泛pH值的流动相,适合于pH值小于2或大于8的流动相。
手性分子的合成方法及研究进展 学号: 班级: 姓名:
摘要:本文主要将手性药物的合成方法分为了两大类,并分别列举了一些方法,其中详细介绍了手性源合成以及酶法获得手性化合物两种方法,并通过对方法的介绍简述了手性化合物的研究进展。 关键词:手性化合物、合成、研究进展 手性是自然界最重要的属性之一,分子手性识别在生命活动中起着极为重要的作用。同一化合物的两个对映体之间不仅具有不同的光学性质和物理化学性质,而且它们具有不同的生物活性,比如在药理上,药物作用包括酶的抑制、膜的传递、受体结合等,均和药物的立体化学有关;手性药物的对映体的生物学活性、毒性、代谢和药物素质完全不同。获得手性化合物的方法,不外乎非生物法和生物法两种。 一、非生物法 非生物催化主要是指采用化学控制等手段来获得手性化合物,它主要包括不对称合成法、手性源合成、选择吸附拆分法、结晶法拆分、化学拆分法、动力学拆分、色谱分离等。下面主要介绍手性源合成: 手性源合成或者手性底物的诱导,该方法被称为第一代手性合成方法,亦称为底物控制法。它是通过底物中原有手性的诱导,在产物中形成新的手性中心。可简略表述为:原料为手性化合物A*,经不对称反应,得到另一手性化合物B*,即手性原料转化为反映产物。 美国Scripps 研究所Wong等曾报道了利用阿拉伯糖来合成L-N-乙酰神经氨酸的方法,该方法便是极其巧妙的利用了手性源合成。 阿拉伯糖是一个醛糖,它开环后的醛基与氨基化合物得到Schiff 碱中间体,硼酸衍生物上的乙烯基以富电子碳原子于Schiff碱上的碳原子发生亲核进攻,得到烯烃衍生物中间体,氨基用酸酐保护,总产率55%, de%为99%。烯烃衍生物中间体与硝酮衍生物进行1,3偶极环加成,得到氮氧五元环化合物,加成过程立体选择性较好,90%的产物是立体控制的。氮氧物五元环化合物经过脱质子化得到西佛碱中间体,水解后即得到L-N-乙酰神经氨酸(如图)。
手性拆分 手性拆分(Chiral resolution),亦称光学拆分(Optical resolution)或外消旋体拆分,为立体化学上,用以分离外消旋化合物成为两个不同的镜像异构物的方法。[1]为生产具有光学活性药物的重要工具。 与不对称合成法比较,手性拆分的缺点为尽有50%的产率。有时在拆分的同时将不需要的对映异构体外消旋化,使其不断转化为需要的一个对映体,将拆分和外消旋化同时进行,从而使拆分的产率超过50%。这种方法称为动态动力学拆分。酮的烯醇化是常用的外消旋化反应。 拆分方法 结晶拆分法 晶种结晶法:也称优先结晶法。是向热的饱和或过饱和的外消旋溶液中,加入一种纯光活性异构体的晶种,创造出不对称的环境。冷却到一定的温度。这时稍微过量的与晶种相同的异构体就会优先结晶出来。滤去晶体后,在剩下的母液中再加入水和消旋体制成的热饱和溶液,再冷却到一定的温度。这时另一个稍微过剩的异构体就会结晶出来。理论上讲,如果原料能形成聚集体的外消旋体,那么将上述过程反复进行就可以将一对对映体转化为纯的光学异构体。 没有纯对映异构体晶种的情况下,有时用结构相似的手性化合物,甚至用非手性的化合物作晶种,也能成功进行拆分。 晶种结晶法是在路易·巴斯德的工作的基础上发现的。文献上最早报道的应用是肾上腺素的拆分。 路易·巴士德首先发现酒石酸有右旋和左旋现象,并于1849年第一次进行手性拆分以分离两者。直到1882年,他示范了借着引晶技术从过饱和的酒石酸钠铵溶液中生成d-晶体及l-晶体,相反的手性晶体将会排列成相反的形状。 直接结晶拆分法:也称自发结晶拆分法。这是巴斯德最早发现的拆分方法。是指外消旋体在平衡时结晶自发形成聚集体(conglomerate),两个对映体都自发析出等量的互为镜像的对映结晶。对映结晶可以人工分开。 外消旋美沙酮可以通过这种方法拆分。[2]以50g的dl-美沙酮为起始原料,溶于石油醚并浓缩,加入两个毫米大小d-和l-晶体,在40°C下搅拌125小时后便可得到两个大的d-和l-晶体,产率各为50%。
手性化合物的合成和分离方法研究进展 摘要:手性问题与我们的生活密切相关,它涉及到生命、动植物、药物、食品、香料、农药等诸多领域,本文介绍了手性化合物的一些用途,合成和分离方法及发展方向。手性化合物的制备已成为当前国内外较热门的研究课题之一。本文从非生物法和生物法两个方面较全面地综述了手性化合物的制备方法, 希望为相关研究者提供参考。 关键词:手性化合物;手性药物;制备;生物合成 1.1用途 手性化合物(chiral compounds)是指分子量、分子结构相同,但左右排列相反,如实物与其镜中的映体。人的左右手、结构相同,大姆至小指的次序也相同,但顺序不同,左手是由左向右,右手则是由右向左,所以叫做“手性”。也就是指一对分子。由于它们像人的两只手一样彼此不能重合,又称为手性化合物。判断分子有无手性的可靠方法是看有没有对称面和对称中心[1]。 手性问题与我们的日常生活密切相关。天然存在的手性化合物品种很多,并且通常只含有一种对映体,手性问题还牵涉到农业化学、食品添加剂、饮料、药物、材料、催化剂等诸多领域。它的研究已经成为科学研究和很多高科技新产品开发的热点。在过去20年里,手性研究具有戏剧性的发展,已从过去的少数几个专家的学术研究发展到大面积科学研究的需要,在一些领域并已带来了巨大的经济效益。物质的手性已经变成越来越需要考虑的问题,其对我们的日常生活正在起到越来越重要的作用。 手性化合物主要从天然来源、不对称合成和外消旋体拆分3个方面得到。由天然来源获得手性化合物,原料丰富,价廉易得,生产过程简单,产品的纯度一般都较高,因此很多量大的产品都是从天然物中获得。在药物工业中由于对手性药物的要求不断增加,其大大激发了不对称有机合成的发展,使一些生物技术、生物催化剂也迅速扩展到该领域产生纯的的手性中间体和手性产品[2]。 1.生物制药 在合成中引入生物转化在制药工业中已成为关键技术。如Merck公司开发的酰胺酶抑制剂西司他丁的生产就是一个实例。西司他丁是一种N-取代的(S)-2,2-二甲环丙烷羰酰胺衍生物,它可以从易得原料合成消旋2,2-二甲基环丙羰腈开始,通过不同途径合成。 2.生物农药 拟除虫菊酯类杀虫剂是70年代中期开始大量使用的新型农药,是天然除虫菊酯的模拟物,生物降解性好,对环境影响小。拟除虫菊酯具高效安全杀虫谱广等优点。在世界农药市场占有一定的地位。手性化合物在生物农药方面也有广扩的前景,此杀虫剂占全球杀虫剂市场的20%。 3.香料、添加剂和酶技术 香精香料和其他行业占手性市场总值的4.7%;如人工合成一些甜味剂癸内酯具有强烈的果香香气。 酶技术的一个新方向是美国Altus Biologics的交联酶结晶(cross - linked enzyme
手性药物的结晶拆分方法--直接结晶法---逆向结晶法 在优先结晶法中,通过加入不溶的添加物即晶种形成晶核,加快或促进与之晶型或立体构型相同的对映异构体结晶的生长。而逆向结晶法则是在外消旋体的饱和溶液中加入可溶性某一种构型的异构体[如(R)—异构体],添加的(R)—异构体就会吸附到外消旋体溶液中的同种构型异构体结晶体的表面,从而抑制了这种异构体结晶的继续生长,而外消旋体溶液中相反构型的(S)—异构体结晶速度就会加快,从而形成结晶析出。例如在外消旋的酒石酸钠铵盐的水溶液中溶入少量的(S)—(—)—苹果酸钠铵或(S)—(—)—天冬酰胺时,可从溶液中结晶得到(R,R)—(十)—酒石酸钠铵。 逆向结晶中的添加物必须和溶液中的化合物在结构和构型上有相关之处。这样所添加的物质才能嵌入生长晶体的晶格中,取代其正常的晶格组分并能阻止该晶体的生长。逆向结晶是一种晶体生长的动力学现象,添加物的加入造成了结晶速度上的差别。由于逆向结晶是晶体生长的动力学的现象,因此当结晶时间无限制的延长下之,最终得到的仍是外消旋的晶体。从化合物的性质上来看,逆向结晶只能用于能形成聚集体的化合物。在结晶法的拆分过程中,若能将优先结晶法中“加入某种单—对映异构体晶体可诱导相同构型结晶生长”的原理和逆向结晶中“加入另一个对映异构体溶液可抑制相同构型的对映异构体生长”的原理相结合,可使结晶拆分的效率大大提高 手性药物的结晶拆分方法--直接结晶法---优先结晶法 优先结晶方法(preferential crystallization)是在饱和或过饱和的外消旋体溶液中加入一个对映异构体的晶种,使该对映异构体稍稍过量因而造成不对称环境,结晶就会按非稍的过程进行,这样旋光性与该晶种相同的异构体就会从溶液中结晶出来。优先结晶方法是在巴士德的研究基础上发现的。文献最早报道的优先结晶方法是用于肾上腺素的拆分。1934年Duschinsky第一次用该方法分离得到盐酸组氨酸,使人们认识到该方法的实用性。但直到1963年工业化学家Secor对该方法进行综述后,才引起人们关注并逐渐发展成为众所周知的科学实用方法。Secor根据优先结晶法是聚集物的结晶的原理,可用其溶解度曲线的相图来进行结晶分离过程的分析。 20世纪60~70年代,优先结晶方法在工业生产上大规模的用于由丙烯腈制备L—谷氨酸的拆分,每年的产量可达1.3万吨。这一技术不仅在工业生产上有非常显著的应用价值,在'实验室也可用于拆分数克到数十克的光学活性的化合物。应当指出的是,优先结晶方法仅适用于拆分能形成聚集体的外消旋体,而且该聚集体是稳定的结晶形式。换句话讲,假若该外消旋体可以是以聚集物或外消旋化合物的形式存在,但在某一定的温度范围内,只可以