药物的主要作用靶点:酶、受体、离子通道、核酸
药物的名称:商品名,通用名,化学名
<2>中枢神经系统药物
1 镇静催眠药
1-1 苯并二氮?类
【基本结构】苯二氮?体系-苯环和七元亚胺内酰胺环并合的母核
【作用机制】GABAA受体上有苯二氮?受体,当苯二氮?类药物占据苯二氮?受体时,则GABA受体就更易打开Cl通道,促进Cl离子内流,产生超极化而致中枢神经系统抑制,导致镇静、催眠、抗焦虑,抗惊厥和中枢性肌松等药理作用。
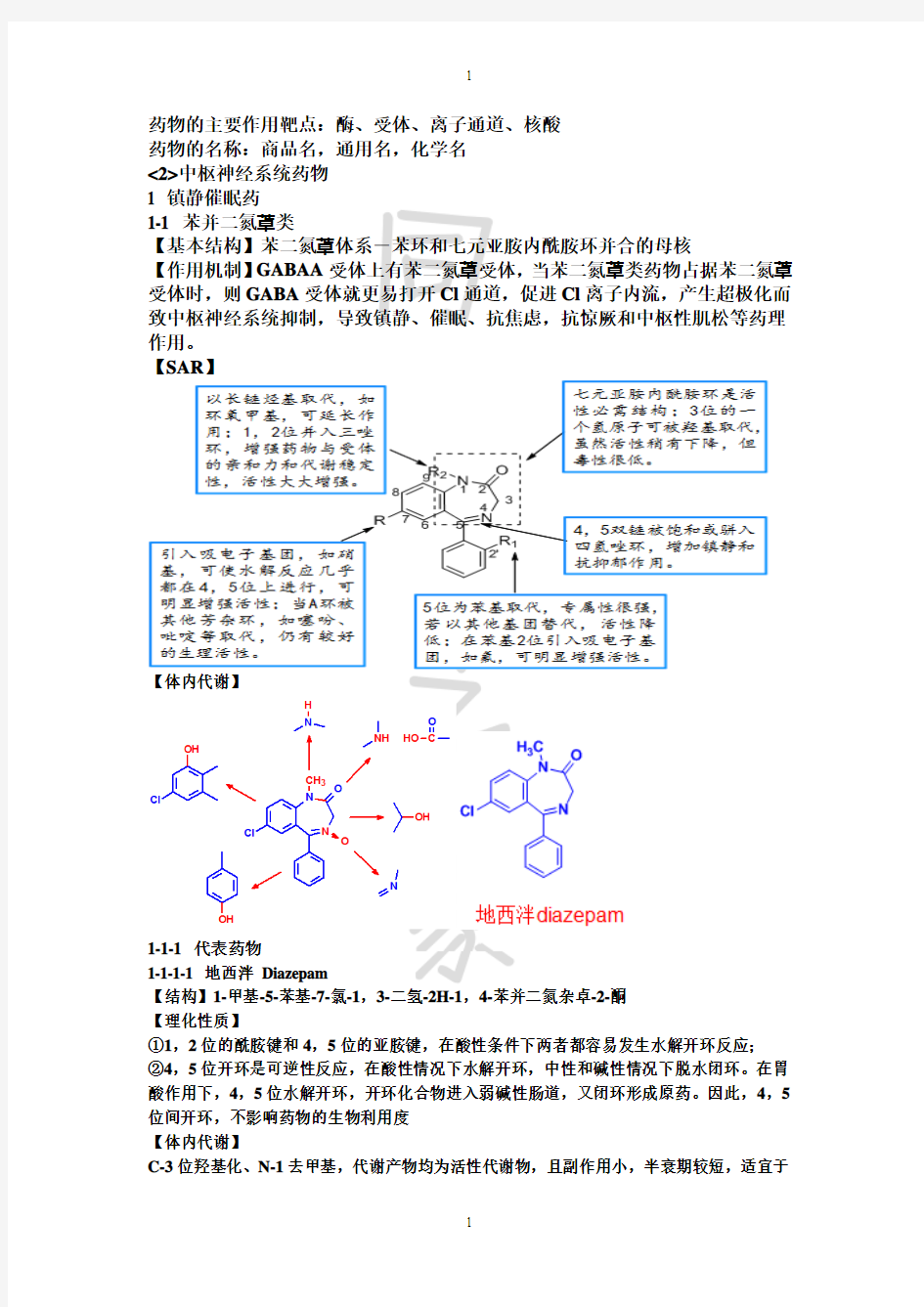
【SAR】
【体内代谢】
1-1-1 代表药物
1-1-1-1 地西泮Diazepam
【结构】1-甲基-5-苯基-7-氯-1,3-二氢-2H-1,4-苯并二氮杂卓-2-酮
【理化性质】
①1,2位的酰胺键和4,5位的亚胺键,在酸性条件下两者都容易发生水解开环反应;
②4,5位开环是可逆性反应,在酸性情况下水解开环,中性和碱性情况下脱水闭环。在胃酸作用下,4,5位水解开环,开环化合物进入弱碱性肠道,又闭环形成原药。因此,4,5位间开环,不影响药物的生物利用度
【体内代谢】
C-3位羟基化、N-1去甲基,代谢产物均为活性代谢物,且副作用小,半衰期较短,适宜于
N
H O O O R 1R 2
H N
1
3
5
NH 2CONH 2CH
3CH 2ONa
H
N N H O O O
R 1R 2O O O O R 1R 2
O O O O CH 3CH 2ONa R 1Br O
O O
O R 1
CH 3CH 2ONa R 2Br 老年人和肝肾功能不良者使用,已广泛用于临床;最终以葡萄糖醛酸结合反应排出体外 【合成路线】
【用途】安定、镇静、催眠、肌内松弛及抗惊厥作用 ,主要用于治疗神经官能症。目前已
完全取代了巴比妥类等传统镇静催眠药物
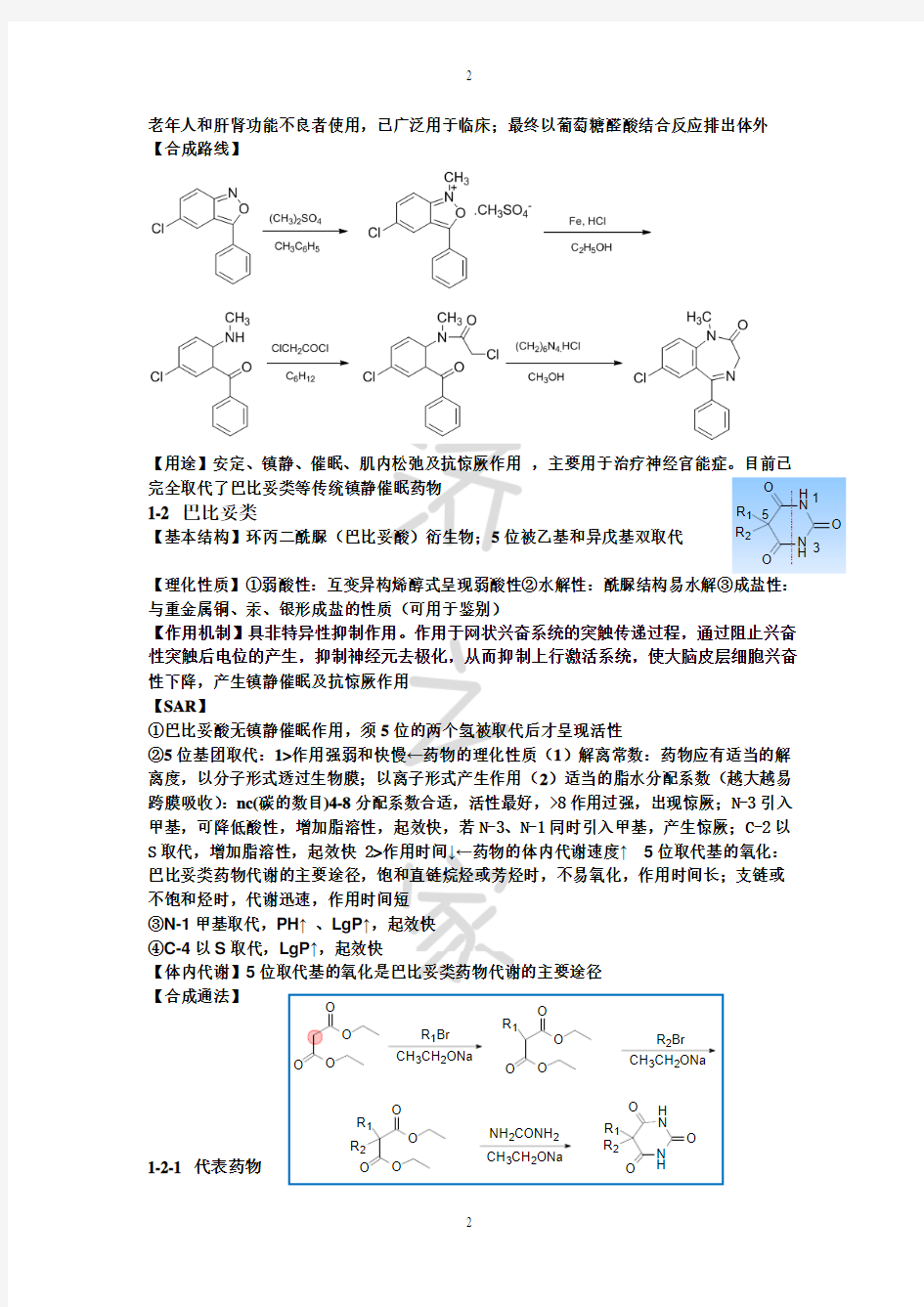
1-2 巴比妥类
【基本结构】环丙二酰脲(巴比妥酸)衍生物;5位被乙基和异戊基双取代
【理化性质】①弱酸性:互变异构烯醇式呈现弱酸性②水解性:酰脲结构易水解③成盐性:与重金属铜、汞、银形成盐的性质(可用于鉴别)
【作用机制】具非特异性抑制作用。作用于网状兴奋系统的突触传递过程,通过阻止兴奋性突触后电位的产生,抑制神经元去极化,从而抑制上行激活系统,使大脑皮层细胞兴奋性下降,产生镇静催眠及抗惊厥作用 【SAR 】
①巴比妥酸无镇静催眠作用,须5位的两个氢被取代后才呈现活性
②5位基团取代:1>作用强弱和快慢←药物的理化性质(1)解离常数:药物应有适当的解离度,以分子形式透过生物膜;以离子形式产生作用(2)适当的脂水分配系数(越大越易跨膜吸收):nc(碳的数目)4-8分配系数合适,活性最好,>8作用过强,出现惊厥;N-3引入甲基,可降低酸性,增加脂溶性,起效快,若N-3、N-1同时引入甲基,产生惊厥;C-2以S 取代,增加脂溶性,起效快 2>作用时间↓←药物的体内代谢速度↑ 5位取代基的氧化:巴比妥类药物代谢的主要途径,饱和直链烷烃或芳烃时,不易氧化,作用时间长;支链或不饱和烃时,代谢迅速,作用时间短 ③N-1甲基取代,PH ↑ 、LgP ↑,起效快 ④C-4以S 取代,LgP ↑,起效快
【体内代谢】5位取代基的氧化是巴比妥类药物代谢的主要途径 【合成通法】
1-2-1 代表药物
N
N O
N
1
3
6H
N
N H O O O R 1R 2
H N N H O O
R 1R 2H
N N O
O R 1
R 2
R 3N O O R 1R 2O R 3N O O R 1R 2
R 3失2位氧失6位羰基失3、4位酰胺基加3位氧失3、4位酰胺基加3位亚甲基氢化嘧啶二酮类
乙内酰脲类噁唑酮类丁二酰亚胺类 扑米酮
R 1 = -C 2H 5
R 2 = -C 6H 5 苯妥因 R 1 = -C 6H 5
R 2 = -C 6H 5R 3 = -H 三甲双酮R 1 = -CH 3R 2 = -CH 3
R 3 = -CH 3
苯琥胺R 1 = -H R 2 = -C 6H 5R 3 = -CH 3
N H
N O ONa 15
1-2-1-1 异戊巴比妥
1-3 非苯二氮?类GABAA 受体激动剂
【作用机制】选择性地作用于苯二氮?类GABA A 受体的ω1亚型, 与ω2 、ω3受体亚型亲和力很差,对外周苯二氮?类受体无亲和力,故有高度中枢选择性。
【作用特点】具较强的镇静、催眠作用,对呼吸系统无抑制作用,抗惊厥和肌肉松弛作用较弱;在正常治疗周期内,极少产生耐受性和身体依赖性
1-3-1代表药物 唑吡坦 zolpidem 2 抗癫痫药
【癫痫病理】阵发性暂时大脑功能失调综合症,由于大脑局部神经元兴奋性过高,产生阵发性放电而引起脑功能异常
【作用机制】中枢抑制:通过防止或减轻中枢病灶神经元过度放电,或提高正常脑组织兴奋阈来减弱病灶兴奋地扩散,或调节GABA 系统来抑制GABA 浓度,以此预防和控制发作
2-1 环内酰脲类
【基本结构】环内酰脲为母核
【理化性质】酸性、水解性
【体内代谢】如果用量过大或短时内反复用药,可使代谢酶饱和,代谢将显著减慢,并易产生毒性反应,具“饱和代谢动力学”的特点;主要代谢产物无活性 【代表药物】苯妥英钠 sodium phenytoin 【附注】与苯巴比妥类似,可与之参考
2-2 苯二氮?类(参考前述)
2-2-1 代表药物
2-3 二苯并氮杂?类
2-3-1 代表药物
【结构】2个苯环与氮杂环骈合而成的二苯并氮杂?类化合物:二个苯环通过烯键相连形成共轭体系,具有尿素的结构
2-4 GABA 衍生物(从GABA 的结构出发设计而成的与GABA 神经能有关的药物)
【基本结构】载体联结前药:由一个活性药物(原药)和一个可被酶除去的载体部分联结的前药,通常在体内经酶水解释放出原药。(前药:前体药物(简称前药)是一类体外活性较小或无活性,在体内经酶或非酶作用释放出活性物质(即原药,又称母药)以发挥药理作用的化合物)
【作用机制】拟GABA 药,直接激动GABA 受体而降低脑部兴奋 【代表药物】普洛加胺 Progabide
OH
F
N
Cl NH 2
O 活性部分
载体部分
2-5 其他结构类药物:氨基羧酸类、磺酰胺类、氨基甲酸酯类、苯基三嗪类等
3 抗精神病药
【病理】精神分裂症可能与脑内多巴胺(dopamine ,DA )神经系统功能亢进,多巴胺过多或多巴胺受体过敏
【机制】本类药物为DA 拮抗剂,能阻断中脑-边缘系统及中脑-皮质通路的DA 受体,减低DA 功能
【副作用】可阻断运动神经多巴胺受体,产生锥体外副反应,损害运动功能。以类帕金森症最为常见,表现为震颤、麻痹、呼吸吞咽困难、静坐不能,动作怪异等。
N
S
R 2
109
8
7
6
5
4
3
21
3-1 吩噻嗪类
【基本结构】以吩噻嗪为母核
【理化性质】①还原性:吩噻嗪母环,易被氧化而变色、变质,防止可注射剂加抗氧剂②光化毒反应:患者服用后在日光照射下,分解为自由基与体内蛋白氧化作用,发生严重过敏反应,防止可注射剂加抗氧剂
【SAR 】①2位取代:有取代为活性必需,R2吸电子能力↑,活性↑;-COCH3 比其他基团毒性低;硫取代锥体外副反应减轻。②10位取代:R1与N 之间相隔3个碳原子活性最强,任何延长、缩短或分支活性↓;R1含哌嗪时作用更强;R1若有-OH 成酯,可延长作用时间。 ③吩噻嗪母核的改变:母核硫原子、母核氮原子作生物电子等排转换后,产生新结构类型。 【体内代谢】主要在肝脏经微粒体药物代谢酶氧化,代谢极复杂,可检测的代谢物有100多种,有硫原子氧化,苯核羟化,侧链去N-甲基和侧链的氧化等
3-1-1 代表药物
【结构】盐酸氯丙嗪 N ,N-二甲基-2-氯-10H-吩噻嗪-10-丙胺
盐酸盐
.
HCl
N
S
Cl
N
25
10
3-2 噻吨类
【基本结构】噻吨类与吩噻嗪类结构相似,10位N 换为C=
【代表药物】氯普噻吨具有与氯丙嗪相同的侧链,但其抗精神病作用较后者弱而镇静催眠作用较氯丙嗪强,并有较强的抗抑郁症和抗焦虑作用(Z:E =7:1)
3-2 丁酰苯类
【药理特点】比吩噻嗪类活性强,且具抗焦虑作用,有锥体外系的副作用及致畸作用 【SAR 】
【代表药物】氟哌啶醇Haloperidol S CHCH 2CH 2R
X
N
N
N
N H
Cl
3-3 二苯并二氮?类
【基本结构】
【SAR 】
8
5
2
N N
N
X
R 1
R 2R
以氯、溴、甲基、氢等基团取代,保留中枢神经抑制剂的非典型性质。
以电子O 、S 等排体取代,为抗精神病药。
以氯、溴、甲基、氢等基团取代,具有典型抗精神病药抗多巴胺能活性。
【机制】非典型抗精神病药物,具拮抗DA 、5-羟色胺(5-HT )受体作用
【药理特点】锥体外系副反应很轻;在微粒体或嗜中性白血球和骨髓细胞中产生硫醚类代谢物,从而产生毒性
【代表药物】氯氮平Clozapine
4 抗抑郁药
【病征】情感活性发生障碍的精神失常,情绪异常低落,常有强烈的自杀倾向,自主神经或躯体性伴随症状
【病理】脑内神经递质浓度的降低或其受体功能下降有关,如去甲肾上腺素(NE )5-羟色胺(5-HT )
【机制】①去甲肾上腺素重摄取抑制剂(三环类抗抑郁药)②选择性5-羟色胺重摄取抑制剂(SSRIs )③单胺氧化酶抑制剂(MAOIs )
4-1 去甲肾上腺素重摄取抑制剂
【基本结构】二苯并氮杂卓类、二苯并氧氮杂卓类、二苯并环庚二烯类
852N R 1
R
2
1
34
6
7
91011
【代表药物】盐酸丙咪嗪 Imipramine Hydrochloride
N
N
HCl
N ,N-二甲基-10,11-二氢-5H-二苯并[b ,f]氮杂卓-5-丙胺盐酸盐
【理化性质】稳定性:本品固体及水溶液稳定,加速试验中发生降解
【体内代谢】主要在肝脏中代谢,生成活性代谢物-地昔帕明(desipramine ),都能进入血脑屏障,丙咪嗪起效较慢(地昔帕明,是一个强效的去甲肾上腺素重摄取抑制剂,抗抑郁作用更强,目前已经单独成药)
【用途】本品适用于治疗内源性、反应性、更年期抑郁症,也可用于小儿遗尿
4-2 选择性5-羟色胺(5-HT)重摄取抑制剂
【代表药物】氟西汀 Fluoxetine
【附注】用外消旋体,S 体的活性较强;选择性强,副作用明显低于三环类;在肝脏代谢成活性的去甲氟西汀
4-3 单胺氧化酶抑制剂
【机制】可抑制MAO 活性,减少脑内5-HT
和NE 的氧化脱氨降解
【代表药物】选择性MAO-A (有A 、B 两种亚型,A 为抗抑郁药的主要靶酶)可逆抑制剂
5 镇痛药
【分类】按来源:吗啡生物碱类(吗啡及其衍生物)、半合成和全合成镇痛药三大类 按机理:阿片受体激动剂、混合的激动-拮抗剂(阿片受体部分激动剂)、阿片受体拮抗剂 【靶点】阿片受体分型及其效应μ、κ、δ、σ μ:显著镇痛,抑制呼吸,缩瞳,欣快和成瘾 κ:镇痛、镇静,略烦躁
δ:镇痛,抑制呼吸强,降压,欣快 σ:致幻,扩瞳,烦躁不安
5-1 吗啡及其衍生物
【基本结构】
O
H N
F F
F HCl
*
N 为镇痛活性的关键,可被不同取代基取代,可从激动剂转为拮抗剂酚羟基被醚化、酰化,
活性及成瘾性均下降,
酚羟基为必需基团双键可被还原,活
性及成瘾性均增加羟基被烃基化、酯化、
氧化成酮或去除,活性及成瘾性均增加
1
23
45
6
78
91011
121314
1516N O RO H R 2R 1
O
【SAR 】(改造目的:克服Morphine 易上瘾、呼吸抑制等副作用)
①3、6位改造:3位[药效部位]-OH 烷基化活性、成瘾性↓,-0-为活性必需(如可待因中度镇痛,镇咳,轻度成瘾);6位[疏水部位]-OH 烷基化活性、成瘾性↑;3、6位同时乙酰化,活性、成瘾性↑↑(如被乙酸酯化的海洛因)
②7、8位改造:7、8位双键氢化,活性、成瘾性↑
③17位改造:N-CH3 用其他烷基、链烯烃或芳烃基取代,活性↑,其中镇痛活性最强的是苯乙基吗啡;N-CH3 用烯丙基、小环甲基取代,为吗啡拮抗剂,可拮抗其全部生理作用 ④6、14位改造:引入桥链乙烯基,活性↑↑↑(埃托啡,为吗啡的6000倍),但副作用大;桥链乙烯基氢化,活性↑↑↑(二氢埃托啡,为吗啡的12000倍),副作用小,良好的癌症镇痛剂
【机制】μ阿片受体强激动剂
5-1-1 代表药物
【结构】盐酸吗啡 Morphine hydrochloride
结构特征:1、五个环组成的刚性分子 2、两个羟基 3、一个叔胺
4、5个手性碳(
5、
6、9、13、14)
5、B/C 环呈顺式,C/D 环呈反式,C/E 环呈顺式
【理化性质】①酸碱两性:吗啡结构中3位有酚羟基,呈弱酸性,17位的叔氮原子呈碱性,临床上常用其盐酸盐 ②稳定性:3位酚羟基的存在,使吗啡及其盐的水溶液不稳定,放置过程中,受光催化易被空气中的氧氧化变色,生成毒性大的双吗啡(或称伪吗啡)和N-氧化吗啡;吗啡的稳定性受pH 和温度影响:pH=4最稳定,中性和碱性条件下极易被氧化(吗啡注射液,pH=3-5,充入氮气,加焦亚硫酸钠、亚硫酸氢钠等抗氧化剂)。吗啡酸性条件加
热,经分子重
排可生成阿扑吗啡-多巴胺受体的激动剂,可兴奋中枢的呕吐中心,作为催吐剂 【机制】μ阿
片受体强激动剂(镇痛作用强,还有一些镇咳作用,
成瘾性强,滥用危害极大)
【代谢】口服后在胃肠道吸收,但肝脏中的首过效应显著,生物利用度低,常皮下注射使用
5-2 合成镇痛药
【分类】1. 哌啶类2. 氨基酮类3. 苯并吗喃类4. 吗啡喃类
5-2-1 哌啶类
【基本结构】
【机制】典型μ阿片受体激动剂
【代表药物】盐酸哌替啶Pethidine Hydrochloride (苯基哌啶酯)
【理化性质】虽为酯类药物,但由于4-苯基的空间位阻,水溶液短时间煮沸不致水解
【附注】又名度冷丁(Dolantin),镇痛活性弱于吗啡(1/10),起效快,维持时间短,但成瘾性也弱,呼吸抑制较小,不良反应较少,口服效果比吗啡好。临床上广泛用于外伤性疼痛和平滑肌痉挛,分娩时镇痛及癌症患者晚期缓解疼痛
5-2-2 氨基酮类(开链类)
【代表药物】
【附注】μ受体激动剂,左旋体镇痛活性大于右旋体(约20倍),临床用其外消旋体。镇痛作用与吗啡相当,并可镇咳,可口服。成瘾性较小,作戒毒药物
5-2-3苯并吗喃类
【代表药物】喷他佐辛Pentazocine
【附注】作用于k受体,小剂量时,镇痛作用好,大剂量时,轻度拮抗吗啡的作用,是一个混合的激动-拮抗剂;镇痛作用为吗啡的1/3,哌替啶的3倍,成瘾性极小,称为“非麻醉性镇痛药”
6 神经退行性疾病治疗药物
6-1 抗帕金森病药
【病理病征】又称震颤麻痹,是一种中枢神经系统锥体外系功能障碍的慢性进行性疾病(DA 和乙酰胆碱之间的平衡打破,最终表现为DA的功能减弱,乙酰胆碱的功能相对亢进),主要症状是受累肢体自主运动时肌肉震颤不止,并表现肌肉强直或僵硬以及运动障碍,并伴有知觉、识别和记忆障碍,是中老年人的常见病
【分类】根据作用机制:拟多巴胺药、外周脱羧酶抑制剂、多巴胺受体激动剂、多巴胺加强剂和其他药物
6-1-1 拟多巴胺药
【代表药物】左旋多巴levodopa
【附注】前药,大部分代谢为DA,仅有1%~3%的原形药物能通过血脑屏障进入中枢转化为DA而发挥作用,外周不良反应多,主要有恶心、呕吐、食欲减退等胃肠道反应
6-1-2 外周脱羧酶抑制剂
【附注】外周脱羧酶抑制剂不易进入中枢,可抑制外周多巴胺脱羧酶,阻止levodopa在外周降解,使循环中的levodopa的量增加5~10倍,促使DA进入中枢神经系统而发挥作用。与levodopa合用,既可减少levodopa的用量,又可降低levodopa对心血管系统的不良反应
6-1-3 多巴胺受体激动剂
【附注】多巴胺受体激动剂能选择性地激动多巴胺受体,特别是选择性地激动D2受体,从而发挥作用
6-1-4 多巴胺加强剂及其他药物
【附注】DA的体内代谢主要通过单胺氧化酶(MAO)、多巴胺-β-羟基化酶(DBH)和儿茶酚-O-甲基转移酶(COMT)进行。这三种酶的抑制剂都能够降低脑内DA的代谢,从而提高脑内DA水平,称为多巴胺加强剂或多巴胺保留剂,对帕金森病有治疗作用。目前临床使用的主要是单胺氧化酶和儿茶酚-O-甲基转移酶抑制剂
6-2 抗阿尔茨海默病(AD)药物
【病理病征】AD是一种与年龄高度相关的、以进行性认知功能障碍和记忆力损害为主的中枢神经系统退行性疾病。表现为记忆力、判断力及抽象思维等一般智力的丧失,但视力、运动能力等则不受影响。目前治疗主要基于增强中枢胆碱能神经的策略
6-2-1 乙酰胆碱酯酶抑制剂(AChEI )
【附注】目前唯一一类明确用于AD 治疗的药物,为胆碱能增强剂
<3>外周神经系统药物
1 拟胆碱药
【分类】胆碱受体激动剂、乙酰胆碱酯酶抑制剂
1-1 胆碱受体激动剂
1-1-1 胆碱酯类M 受体激动剂 【基本结构及SAR 】
(改造目的:①ACh 对所有胆碱能受体部位无选择性,导致产生副作用②ACh 为季铵结构,不易透过生物膜,因此生物利用度极低③ACh 化学稳定性较差,在水溶液、胃肠道和血液中均易被水解或胆碱酯酶催化水解,失去活性)
【代表药物】氯贝胆碱 Bethanechol Chloride (±)-氯化N ,N ,N-三甲基-2-氨基甲酰氧基-1-丙铵
O O H 2N
N +(CH 3)3 Cl -
CH 3
【作用特点】对胃肠道和膀胱平滑肌的选择性较高,对心血管系统的作用几无影响;不易被胆碱酯酶水解,作用较乙酰胆碱长
【用途】临床主要用于手术后腹气胀、尿潴留以及其他原因所致的胃肠道或膀胱功能异常
1-1-2 生物碱类M 受体激动剂 【代表药物】毛果芸香碱
【理化性质】内酯环在碱性条件下可被水解开环,生成无药理活性的毛果芸香酸钠盐而溶解;
在碱性条件下,C3位发生差向异构化,生成无活性的异毛果芸香碱
【附注】叔胺类化合物,但在体内仍以质子化的季铵正离子为活性形式;具有M胆碱受体激动作用,对汗腺、唾液腺的作用强大,造成瞳孔缩小,眼内压降低;临床用其硝酸盐或盐酸盐制成滴眼液,用于治疗原发性青光眼
【衍生物改造】
1-1-3 选择性M受体亚型激动剂
西维美林(M1/M3 )2000年上市,口腔干燥症;呫诺美林(M1 ),治疗阿尔茨海默病
1-2 乙酰胆碱酯酶抑制剂(AChEI)
【机制】可逆性抑制AChE将导致乙酰胆碱的积聚,从而延长并增强乙酰胆碱的作用
【代表药物】溴新斯的明Neostigmine Bromide N,N,N-三甲基-3-[(二甲氨基)甲酰氧基]苯铵
O N
O N+
氨甲酸酯芳环部分
季铵碱部分
. X-
X = -Br, -CH3SO4
【结构特点】化学结构由三部分组成:季铵碱阳离子部分、香环部分、氨基甲酸酯部分,阴离子部分可以是Br-或CH3SO4-
【附注】非经典的抗胆碱酯酶药-抗AD药(不是胆碱酯酶的底物,只是可逆性占据酶活性部位使之不能催化ACh水解)
2 抗胆碱药
2-1 M受体拮抗剂
2-1-1 生物碱类M受体拮抗剂
【代表药物】硫酸阿托品Atropine Sulphate
N
1234
56
78
【结构特点】
1、托品(莨菪醇,骨架为托烷)和托品酸(莨菪酸)酯化(这样的酯化得莨菪碱)
2、莨菪醇:1、
3、5位3个C*,内消旋化,无旋光性 3、莨菪酸:1个C*,2个光学异构体
(天然:S-(-)-托品酸,在分离提取过程中极易发生消旋化,故Atropine 为外消旋体。虽然左旋体抗M 胆碱作用比消旋体强2倍,但左旋体的中枢兴奋作用比右旋体强8~50倍,毒性更大,所以临床用更安全、也更易制备的外消旋体)
【理化性质】①碱性:叔胺碱性较强,pKa 为9.8,水溶液可使酚酞呈红色 ②稳定性:酯键在pH3.5-4.0稳定,碱性下分解成莨菪醇和消旋莨菪酸 ③Vitali 反应(莨菪碱类特征性反应)
【附注】具有外周及中枢M 受体拮抗作用,但对M1和M2受体缺乏选择性。解除平滑肌痉挛、抑制腺体分泌、抗心律失常、抗休克,临床用于治疗各种内脏绞痛、麻醉前给药、盗汗、心动过缓及多种感染中毒性休克。眼科用于治疗睫状肌炎症及散瞳。还用于有机磷酸酯类中毒的解救。毒副作用:中枢兴奋性。
【生物碱类中枢作用】氧桥使中枢抑制作用增强,而羟基使分子极性增强,中枢作用减弱
2-2 合成M 受体拮抗剂
2-2-1 M 受体亚型非选择性拮抗剂
【基本结构】药效基本结构:氨基乙醇酯,酰基上的大基团:阻断M 受体功能
NCH 3
O C O CH
CH 2OH
Atropine
【SAR 】①R1、R2:为较大基团,通过疏水性力或范德华力与M 受体结合,阻碍乙酰胆碱与受体的接近和结合,当R1和R2为碳环或杂环时,可产生强的拮抗活性,两个环不一样时活性更好。R1和R2也可以稠合成三元氧蒽环,但环状基团不能过大,如R1和R2为萘基时,可能因立体位阻而无活性
②R3:可以是H ,OH ,CH2OH 或CONH2。由于R3为OH 或CH2OH 时,可通过形成氢键使与受体结合增强,比R3为H 时抗胆碱活性强,所以大多数M 受体强效拮抗剂的
R3为OH
③X:可以是-COO-、-O-、去X等,并非活性必需,亲脂性↑→中枢作用↑
④氨基部分:通常为季铵盐或叔胺结构,与M受体负离子部位结合,R4、R5通常以甲基、乙基或异丙基等较小的烷基为好,N上取代基也可形成杂环
⑤n=2最好,碳链长度一般在2~4个碳原子之间,再延长碳链则活性降低或消失
【代表药物】溴丙胺太林Propantheline Bromide
【附注】Propantheline中枢副作用小,外周抗M胆碱作用与Atropine类似,弱的神经节阻断作用。特点是对胃肠道平滑肌有选择性,主要用于胃肠道痉挛和胃及十二指肠溃疡的治疗
2-2-2 M受体亚型选择性拮抗剂
M1:哌仑西平、替仑西平,治疗胃及十二指肠溃疡
M2:奥腾折帕、喜巴辛,窦性心动过缓,心传导阻滞
M3:索非那新、达非那新,治疗尿频、尿失禁
2-3 N受体拮抗剂
【分类】N1受体拮抗剂、N2受体拮抗剂
2-2-1 N2受体拮抗剂(神经肌肉阻断剂)
【机制】去极化型:肌松药与N2受体结合并激动受体,使终板膜及邻近肌细胞膜长时间去极化,阻断神经冲动的传递,导致骨骼肌松弛,临床少用;非去极化型:肌松药和乙酰胆碱竞争,与N2受体结合,因无内在活性,不能激活受体,但是又阻断了乙酰胆碱与N2受体的结合及去极化作用,使骨骼肌松弛,因此又称为竞争性肌松药,可给予抗胆碱酯酶药逆转
2-2-1-1 四氢异喹啉类N2受体拮抗剂(非去极化型肌松药)
【代表药物】苯磺阿曲库铵Atracurium Besylate
(以分子内对称的含四氢异喹啉的双季铵结构为母体,在季铵氮原子β位引入吸电子酯基)
【体内代谢】生理条件下即可发生Hofmann消除反应,酯水解反应,代谢产物均无活性(因此避免了对肝、肾代谢的依赖性,解决了其它神经肌肉阻断剂应用中的一大缺陷-蓄积中毒问题。其非去极化型肌松作用强,起效快(1~2 min),维持时间短(约半小时),不影响心、肝、肾功能,无蓄积性,是比较安全的肌松药)
2-2-1-2 甾类N2受体拮抗剂 (非去极化型肌松药)
【代表药物】泮库溴铵 Pancuronium Bromide (雄甾烷双季铵衍生物)
+
+H N
H
H
H
O N CH 3
CH 3
H 3C
O
H 3C
H 3C O H 3C O . 2Br -
【附注】结构中环A 和环D 部分,各存在一个乙酰胆碱样的结构片段,属于双季铵结构的肌松药。虽为雄甾烷衍生物,却无雄性激素作用。肌松作用较高,无神经节阻滞作用,不促进组胺释放,治疗剂量时对心血管系统影响较小
3 肾上腺素受体激动剂
【Adr 生物合成】
【受体功用】
a1受体激动剂:升高血压和抗休克
a2受体激动剂:治疗鼻粘膜充血、止血和降低眼压 中枢a2受体激动剂:降血压 b1受体激动剂:强心和抗休克
b2受体激动剂:平喘和改善微循环,及防止早产
b3受体激动剂:尚在研究中,可调节人体内热量平衡、葡萄糖代谢、能量消耗,纠正产热不足,临床有望用于治疗糖尿病和肥胖症
3-1 拟肾上腺素药
【基本结构】β-苯乙胺衍生物 【作用模式】肾上腺素受体激动剂与其受体的三点结合模式
【作用方式】A.直接作用:直接与肾上腺素受体结合,兴奋受体而产生作用,即肾上腺素受体激动剂 B. 间接作用:不与肾上腺素受体结合,但能促进肾上腺素能神经末梢释放递质,增加受体周围去甲肾上腺素浓度而发挥作用 C. 混合作用:兼有直接和间接作用的药
3-1-1 肾上腺素 adrenaline
【结构】(R )-4-[2-(甲氧基)-1-羟基乙基]-1,2-苯二酚
【理化性质】氧化性:分子中存在邻苯二酚结构,遇空气或其他弱氧化剂、日光、热及微量金属离子均能使其氧化生失活,加入抗氧剂如焦亚硫酸钠可防止氧化,储藏时应避光且避免与空气接触;旋光性:β碳上的醇羟基通过形成氢键与受体相互结合,其立体结构对活性有显著影响,肾上腺素R 构型是S 构型的12倍,肾上腺素水溶液在室温放置或加热后,易发生消旋化反应,使活性降低,pH4以下消旋化反应速度较快 【合成】
【用途】肾上腺素对α和β受体均有较强的激动作用,主要用于治疗过敏性休克、心脏骤停的急救、支气管哮喘等。肾上腺素口服无效,常用剂型为盐酸肾上腺素注射液
3-1-2 盐酸麻黄碱 ephedrine hydrochloride 【结构】(1R,2S)-2-甲氨基-苯丙烷-1-醇盐酸盐
.HCl
CH 3H
H N H
CH 3
OH
【结构特点】(属于混合作用型药物)苯环上不带有酚羟基,不受COMT 的影响,虽作用强度较肾上腺素为低,但作用时间比后者大大延长,且具有较强的中枢兴奋作用;a-碳上带有一个甲基,空间位阻不易被MAO 代谢脱胺,也使稳定性增加,作用时间延长,但a-碳上烷基亦使活性降低,中枢毒性增大;有2个手性中心,4个光学异构体,只有(-)-麻黄碱(1R ,2S)有显著活性,为左旋体
【附注】主要从麻黄中分离提取得到;对α-和β-受体都有激动作用;极性降低,亲脂性增加,易透过血脑屏障进入CNS ,具有较强的中枢兴奋作用;口服有效,治疗支气管哮喘、过敏性反应、鼻塞及低血压等,冰毒原料
3-2 β-受体激动剂
3-2-1 β1-受体激动剂
HO HO
H N
CH 3OH
【代表药物】多巴酚丁胺 Dobutamine
【附注】S(-):a1、b1-受体激动剂 ,R(+):a1-受体阻断剂,弱b1-受体激动活性,外消旋体a1效应抵消,呈现b1激动效应;Dobutamine 易被COMT 代谢失活,作用时间短,不能口服;主要用于治疗心脏手术后的排出量低的休克或心肌梗死并发心力衰竭
3-2-2 β2-受体激动剂
【代表药物】沙丁胺醇
Salbutamol
【附注】选择性β2受体激动剂,对心脏β1受体激动作用弱(不同的取代基对β受体的亚型有选择性,如叔丁基只对β2受体有作用,而异丙基对一般的β受体都有作用,如异丙肾上腺素,沙丁胺醇结构中的叔丁氨基对其作用的选择性至关重要);口服有效,作用时间较长;临床上用于治疗支气管哮喘,哮喘型支气管炎和肺气肿患者的支气管痉挛,疗效肯定,安全可靠,剂型齐全,属于重镑炸弹药物
【SAR 】苯醇胺类拟肾上腺素药物的构效关系
4 组胺H1受体拮抗剂
【组胺生理】组胺是由组氨酸脱羧酶催化使组氨酸脱羧形成的,是体内重要的神经递质,参与很多复杂的生理过程,通常与肝素蛋白质形成粒状复合物存在于肥大细胞中,受到外界刺激时,向细胞间液中释放组胺。分布于肺、胃肠道和皮肤;当变态反应或理化刺激(如食物,动物毛发,花粉,灰尘或多糖蛋白质等)时,释放组胺,肝素,蛋白水解酶,5-HT 等,引起变态反应性或过敏性反应;这是由于游离组胺与肌体中相应的受体作用而产生的生理反应
【受体功用】
H1-R:存在于支气管、胃肠道平滑肌及其他多种组织。影响肠道、子宫、支气管等平滑肌收缩,毛细管壁舒张,血管壁渗透压增加,产生水肿和痒感,变态反应
H2-R:存在于胃及十二指肠细胞膜。促使胃酸增加,溃疡形成
H3-R:存在于脑神经细胞及肥大细胞上,作用机制尚未完全确定
【用途】H1-受体拮抗剂:用于治疗变态反应性疾病如过敏性哮喘,鼻炎和荨麻疹以及晕动症如晕车、船等;H2-受体拮抗剂:用于胃溃疡的治疗,与质子泵抑制剂一起构成抗消化性溃疡药
【替代】经典的抗组胺药物(第一代):脂溶性很高,通过血脑屏障进入中枢,产生中枢抑制的副作用,另外对H1受体的针对性不强,出现了抗其他神经递质的副作用;非镇静的H1受体拮抗剂(第二代):中枢抑制作用很小或没有
【基本结构】
亲脂性芳环部分N
N
O
N
C
N
乙二胺类,哌嗪类
氨基醚类
丙胺类、哌啶类、三环类
【结构特点】
4-1 乙二胺类H1受体拮抗剂
【结构特点】Ar可为苯基、对位取代苯基或噻吩基;Ar' 常为苯基或2-吡啶基,R及R' 常为甲基,也可环合成杂环
【附注】抗组胺作用弱于其他结构类型,并具有中等程度的中枢镇静作用,还可引起胃肠道功能紊乱,局部外用可引起皮肤过敏
4-2 氨基醚类H1受体拮抗剂
【结构特点】Ar (Ar ’)CHO-代替乙二胺类的ArCH2(Ar ’)N-部分就成为氨基醚类 【附注】第一代氨基醚类H1受体拮抗剂有明显的中枢镇静作用和抗胆碱作用,常见嗜睡、头晕、口干等不良反应,但胃肠道反应的发生率较低。部分药物在常用量时就可治疗失眠;第二代氨基醚类中非镇静性抗组胺药,对外周H1受体有较高的选择性
4-3 丙胺类H1受体拮抗剂
【代表药物】马来酸氯苯那敏 Chlorphenamine Maleate
.
N
Cl
N
O O OH
OH
【附注】右旋体为S 构型活性强于左旋体R 构型,药用外消旋体;代谢主要N-去甲基;用作抗过敏药,副作用小,适用于小儿,副作用为嗜睡,口渴和多尿等
4-4 三环类H1受体拮抗剂
【代表药物】氯雷他定 loratadine
【附注】为强效选择性H1受体拮抗剂,但没有抗胆碱能活性和中枢神经系统抑制作用,属于第二代非镇静性抗组胺药。与其他三环类抗组胺药的主要区别是,用中性的氨基甲酸酯代替了碱性叔胺结构,此变化被认为直接导致其中枢镇静作用的降低。在肝脏迅速而广泛地代谢,代谢产物主要为去乙氧羧基氯雷他定(地氯雷他定),仍具有H1受体拮抗作用,结合后经肾消除
4-5 哌嗪类 H1受体拮抗剂
【代表药物】盐酸西替利嗪 Cetirizine Hydrochloride
【附注】由于Cetirizine 易离子化,不易透过血脑屏障,进入中枢神经系统的量极少,属于非镇静性抗组胺药,是第二代抗组胺药的代表药物之一。服药后,cetirizine 很快和很好地被吸收,作用时间长。绝大部分未起变化而经肾消除。未见心脏毒副作用
4-6 哌啶类H1受体拮抗剂
(前述的Clemastine (氨基醚类)、Acrivastine (丙胺类)、Loratadine (三环类)和Cetirizine (哌嗪类)都属于非镇静性H1受体拮抗剂。Acrivastine 和Cetirizine 就是通过引入亲水性
基团使药物难以通过血脑屏障进入中枢,克服镇静作用的。而Clemastine和Loratadine则是对外周H1受体有较高的选择性,避免中枢副作用。其他的非镇静性抗组胺药大多属于哌啶类选择性外周H1受体拮抗剂)
【代表药物】咪唑斯汀Mizolastine
【附注】不具中枢镇静作用,但优于其他第二代H1受体拮抗剂:外周H1受体拮抗剂,有效抑制其他炎性介质的释放。不良反应极少,特别是当剂量增加达推荐剂量的4倍也未发现明显的心脏副作用。主要代谢途径为在肝中的葡萄糖醛酸化,不经P450代谢,且其代谢物无抗组胺活性
5 局部麻醉药
【定义】局部麻醉药是指当局部使用时能够阻断神经冲动从局部向大脑传递的药物
【科普】麻醉药分为全身麻醉药和局部麻醉药。全身麻醉药作用于中枢神经系统,包括吸入性麻醉药和静脉注射麻醉药,使其受到可逆性抑制,从而使意识、感觉特别是痛觉消失和骨骼肌松弛。局部麻醉药作用于神经末梢或神经干,可逆性地阻断感觉神经冲动的传导,在意识清醒的条件下引起局部组织暂时痛觉消失,以便顺利地进行外科手术
【分类】苯甲酸酯类,酰胺类,氨基醚类,氨基酮类,氨基甲酸酯类,脒类等
【SAR】
天然药物化学 总论 1、主要生物合成途径 醋酸——丙二酸(AA-MA):脂肪酸、酚类、蒽酮类 脂肪酸:碳链奇数:丙酰辅酶A、支链:异丁酰辅酶A、α-甲基丁酰辅酶A、甲基丙二酸单酰辅酶A、碳链偶数:乙酰辅酶A 甲戊二羟酸途径(MVA) 桂皮酸途径和莽草酸途径 氨基酸途径 复合途径 2、分配系数:两种相互不能任意混溶的溶剂 K=C U/C L(C U溶质在上相溶剂的浓度、C L溶质在下相溶剂的浓度) 3、分离难易度:A、B两种溶质在同一溶剂系统中分配系数的比值 β=K A/K B(β>100一次萃取分离;10<β<100萃取10-12次;β<2一百以上;β=1不能分离) 4、分配比与PHPH=pKa+lg[A-]/[HA](pKa=[A-][H3O+]/[HA]) 当PH<3酸性物质为非解离状态[HA],碱性物质为解离状态[BH+] 当PH>12酸性物质为解离状态[A-],碱性物质非解离状态[B] 5、离子交换树脂 阳离子交换树脂:交换出阳离子,交换碱性物质 阴离子交换树脂:交换出阴离子,交换酸性物质 糖和苷 1、几种糖的写法: D-木糖(Xyl)、D-葡萄糖(Glc)、D-甘露糖(Man)、D-半乳糖(Gal)、D-果糖(Flu)、L-鼠李糖(Rha) 2、还原糖:具有游离醛基或酮基的糖 非还原糖:不具有游离醛基或酮基的糖 3、样品鉴别:样品+浓H2SO4+α-萘酚—→棕色环 4、羟基反应: 醚化反应(甲醚化):Haworth法—可以全甲基话、Purdic法—不能用于还原糖、Kuhn 法—可以部分甲基化、箱守法—可以全甲基化、反应在非水溶液中5、酸水解难易程度:N>O>S>C 芳香属苷较脂肪属苷易水解:酚苷>萜苷、甾苷 有氨基酸取代的糖较-OH糖难水解,-OH糖较去氧糖难水解 (2,6二去氧糖>2-去氧糖>3-去氧糖>羟基糖>2-氨基糖)易→难 呋喃糖苷较吡喃糖苷易水解 酮糖较醛糖易水解 吡喃糖苷中:C5取代基越大越难水解(五碳糖>甲基五碳糖>六碳糖>七碳糖) C5上有-COOH取代时最难水解 在构象中相同的糖中:a键(竖键)-OH多则易水解 苷元为小基团—苷键横键比竖键易水解;即e>a 苷元为大基团—苷键竖键比横键易水解;即a>e 6、smith降解(过碘酸反应):Na2SO4、NaBH4,易得到苷元(人参皂苷—原人参二醇) 7、乙酰解反应:β-苷键的葡萄糖双糖的反应速率(乙酰解反应的易难程度) (1——6)》(1——4)》(1——3)》(1——2)这一页空白没用的,请掠过
天然药物化学总结归纳 第一节总论 一、绪论 1.天然药物化学研究内容:结构特点、理化性质、提取分离方法及结构鉴定 ⑴有效部位:具有生理活性的多种成分的组合物。 ⑵有效成分:具有生理活性、能够防病治病的单体物质。 2.天然药物来源:植物、动物、矿物和微生物,并以植物为主。 3.天然药物化学在药学事业中的地位: ⑴提供化学药物的先导化合物; ⑵探讨中药治病的物质基础; ⑶为中药炮制的现代科学研究奠定基础; ⑷为中药、中药制剂的质量控制提供依据; ⑸开辟药源、创制新药。 二、中草药有效成分的提取方法 1.溶剂提取法:据天然产物中各成分的溶解性能,选用对需要的成分溶解度大而对其他成分溶解度小的溶剂, ⑴常用的提取溶剂: 各种极性由小到大的顺序如下: 石油醚﹤苯﹤氯仿﹤乙醚﹤二氯甲烷﹤乙酸乙酯﹤正丁醇﹤丙酮﹤乙醇﹤甲醇﹤水 亲脂性有机溶剂亲水性有机溶剂 ⑵各类溶剂所能溶解的成分: 1)水:氨基酸、蛋白质、糖类、生物碱盐、有机酸盐、无机盐等 2)甲醇、乙醇、丙酮:苷类、生物碱、鞣质等极性化合物 3)氯仿、乙酸乙酯:游离生物碱、有机酸、蒽醌、黄酮、香豆素的苷元等中等极性化合物 石油醚:脱脂,溶解油脂、蜡、叶绿素等小极性成分;正丁醇:苷类化合物。 ⑶溶剂提取的操作方法: 1)浸渍法:遇热不稳定有效成分,出膏率低,(水为溶剂需加入适当的防腐剂) 2)渗漉法: 3)煎煮法:不宜提取挥发性成分或热敏性成分。(水为溶剂) 4)回流提取法:不适合热敏成分;(乙醇、氯仿为溶剂) 5)连续回流提取法:不适合热敏性成分。 6)超临界流体萃取技术:适于热敏性成分的提取。超临界流体:二氧化碳;夹带剂:乙醇; 7)超声波提取技术:适用于各种溶剂的提取,也适用于遇热不稳定成分的提取 2.水蒸气蒸馏法:挥发性、能随水蒸气蒸馏且不被破坏的成分。(挥发油的提取。) 3.升华法:具有升华性的成分(茶叶中的咖啡因、樟木中的樟脑) 三、中草药有效成分的分离与精制 1.溶剂萃取法: ⑴正丁醇-水萃取法使皂苷转移至正丁醇层(人参皂苷溶在正丁醇层,水溶性杂质在水层)。 ⑵乙酸乙酯-水萃取法使黄酮苷元转移至乙酸乙酯层 2.沉淀法: ⑴溶剂沉淀法: 1)水/醇法:多糖、蛋白质等水溶性大分子被沉淀; 2)醇/水法:除去树脂、叶绿素等脂溶性杂质。 ⑵酸碱沉淀法: 1)碱提取酸沉淀法:黄酮、蒽醌、有机酸等酸性成分。 2)酸提取碱沉淀法:生物碱。 ⑶盐析法:三颗针中提取小檗碱就是加入氯化钠促使其生成盐酸小檗碱而析出沉淀的。 第二节苷类 1.定义:苷类(又称配糖体):是指糖或糖的衍生物端基碳原子上的羟基与非糖物质脱水缩合而形成的一类化合物。
药物化学必考点: 1.抗肿瘤药 1.烷化剂(环磷酰胺、白消安、卡莫司汀等) 2.抗代药物(氟尿嘧啶、阿糖胞苷、氟达拉滨、巯嘌呤、甲氨蝶呤等) 3.抗肿瘤天然药物及其半合成衍生物(多柔比星、紫杉醇、多西他赛、碱) 4.基于肿瘤生物学机制的药物(蛋白激酶抑制剂伊马替尼、吉非替尼、厄洛替尼) 5.激素类药物(他莫昔芬、托瑞米芬,芳香酶抑制剂来曲唑和阿那曲唑,雄激素拮抗剂氟他胺) 2.平喘药按作用机制分五类:(31章) 一、β2肾上腺素受体激动剂(第15章沙美特罗等) 二、M胆碱受体拮抗剂(第14章异丙托溴铵等) 三、影响白三烯的药物(孟鲁司特等“司特”词干及齐留通) 四、肾上腺皮质激素药物(丙酸倍氯米松等糖皮质激素类) 五、磷酸二酯酶抑制剂(茶碱及衍生物) 3.考点解析:心血管药物按机制分类,主要有如下6类: 1.抗心绞痛药物主要分3类 ①硝酸酯及亚硝酸酯(NO供体,硝酸甘油、硝酸异山梨酯等) ②β-受体阻断剂(普萘洛尔、阿替洛尔等) ③钙通道阻滞剂(见后) 2.钙通道阻滞剂类 抗高血压药、抗心绞痛、抗心率失常 ①二氢吡啶类(XX 地平,硝苯地平等) ②芳烷基胺类(维拉帕米) ③苯噻氮(盐酸地尔硫) ④三苯哌嗪(桂利嗪) 3.中枢性降压药(作用于α肾上腺素受体,如可乐定,咪唑啉受体选择性激动剂,如莫索尼定) 4.血管紧素转化酶抑制剂类降压药(普利类,卡托普利等) 5.作用于交感神经的降压药(利血平) 6.降血脂药:羟甲戊二酰辅酶A还原酶抑制剂(他汀类,如洛伐他汀等) 4.二氢叶酸还原酶抑制剂 A.甲氨蝶呤抗代类抗肿瘤药 C.乙胺嘧啶2,4 - 二氨基嘧啶类抗疟药 D.培美曲塞多靶点抑制作用抗肿瘤药物 E.甲氧苄啶抗菌增效剂 5.抗变态反应药 本章:只涉及H受体拮抗剂(可统一记忆),用于皮肤黏膜变态反应疾病,还可用于止吐,防治晕动症、镇静催眠、预防偏头痛等。(抗过敏)机制:抗组织胺、白三烯、缓激肽等。 分类: 第一代,经典的(产生中枢抑制和镇静不良反应) 第二代,非镇静的组胺H1受体拮抗剂 9个代表药按结构类型分五类: 1.氨基醚类:盐酸苯海拉明
N H O O O R 1R 2H N 135若R 1R 2为氢原子则无活性,应有2~5贪链取代,或有一为苯环取代,R 1R 2的总碳数为4~8最好 直链烃或芳烃:长效 支链烃或不饱和烃:短效 H 若被甲基取代起效快 O 若被S 取代起效快 第一章 绪论 1.药物的概念: 药物,无论是天然药物(植物药、抗生素、生化药物)、合成药物和基因工程药 物,就其化学本质而言都是一些如C 、H 、O 、N 、S 等化学元素组成的化学品。然 而药物不仅仅是一般的化学品,它们是人类用来预防、治疗、诊断疾病,或者为 了调节人体功能、提高生活质量,保持身体健康的特殊化学品。 2.药物的命名 1) 通用名:又称国际非专利名(INN ),在世界范围内使用不受任何限制,不能 取得专利和行政保护。 2) 化学名:以药物的化学结构命名,一个化学物质只有一个化学名,在新药报 批和药品说明中都要用到化学名,化学名复杂难记,与药理作用毫无联系, 医生跟药师一般不易掌握和记忆。 3) 商品名:一般针对药物的上市产品而言,通常是由药品的制造企业所选定的 名称,并在国家商标或专利局注册,受行政和法律的保护。商品名多于通用 名。 PS.新药开发者在向政府主管部门提出新药申报时,三种名称都需要提供。通用 名和化学名主要针对原料药,也是上市药品主要成分的名称;商品名是指批准上 市后的药品名称,常用于医生的处方中,临床医生和药师都很熟悉。 第二章 中枢神经系统药物 1.镇静催眠药-巴比妥类 1) 巴比妥类药物的理化性质 ? 巴比妥酸在水溶液中存在三酮式(原形)、单内酰亚胺、双内酰亚胺和三内酰 亚胺之间的平衡 ? 酸性:互变异构烯醇式呈现弱酸性,可溶于氢氧化钠和碳酸钠溶液中生成钠 盐。 ? 水解性:酰脲结构,其钠盐水溶液放置易水解 2) 巴比妥类药物的构效关系
1.天然药物有效成分提取方法有几种?采用这些方法提取的依据是什么? 1. 答:①溶剂提取法:利用溶剂把天然药物中所需要的成分溶解出来,而对其它成分不溶解或少溶解。②水蒸气蒸馏法:利用某些化学成分具有挥发性,能随水蒸气蒸馏而不被破坏的性质。③升华法:利用某些化合物具有升华的性质。 2.常用溶剂的亲水性或亲脂性的强弱顺序如何排列?哪些与水混溶?哪些与水不混溶? 石油醚>苯>氯仿>乙醚>乙酸乙酯>正丁醇|不|>| 丙酮>乙醇>甲醇>水 3.溶剂分几类?溶剂极性与ε值关系? 3. 答:溶剂分为极性溶剂和非极性溶剂或亲水性溶剂和亲脂性溶剂两大类。常用介电常数(ε)表示物质的极性。一般ε值大,极性强,在水中溶解度大,为亲水性溶剂,如乙醇;ε值小,极性弱,在水中溶解度小或不溶,为亲脂性溶剂,如苯。 4.溶剂提取的方法有哪些?它们都适合哪些溶剂的提取? 4. 答:①浸渍法:水或稀醇为溶剂。②渗漉法:稀乙醇或水为溶剂。③煎煮法:水为溶剂。④回流提取法:用有机溶剂提取。⑤连续回流提取法:用有机溶剂提取。 5.两相溶剂萃取法是根据什么原理进行?在实际工作中如何选择溶剂? 5. 答:利用混合物中各成分在两相互不相溶的溶剂中分配系数不同而达到分离的目的。实际工作中,在水提取液中有效成分是亲脂的多选用亲脂性有机溶剂如苯、氯仿、乙醚等进行液‐液萃取;若有效成分是偏于亲水性的则改用弱亲脂性溶剂如乙酸乙酯、正丁醇等,也可采用氯仿或乙醚加适量乙醇或甲醇的混合剂。 6.萃取操作时要注意哪些问题? 6. 答:①水提取液的浓度最好在相对密度1.1~1.2之间。②溶剂与水提取液应保持一定量比例。第一次用量为水提取液1/2~1/3, 以后用量为水提取液1/4~1/6.③一般萃取3~4次即可。④用氯仿萃取,应避免乳化。可采用旋转混合,改用氯仿;乙醚混合溶剂等。若已形成乳化,应采取破乳措施。 7.萃取操作中若已发生乳化,应如何处理? 7. 答:轻度乳化可用一金属丝在乳层中搅动。将乳化层抽滤。将乳化层加热或冷冻。分出乳化层更换新的溶剂。加入食盐以饱和水溶液或滴入数滴戊醇增加其表面张力,使乳化层破坏。 8.色谱法的基本原理是什么? 8. 答:利用混合物中各成分在不同的两相中吸附、分配及其亲和力的差异而达到相互分离的方法。 9.凝胶色谱原理是什么? 9.答:凝胶色谱相当于分子筛的作用。凝胶颗粒中有许多网眼,色谱过程中,小分子化合物可进入网眼;大分子化合物被阻滞在颗粒外,不能进入网孔,所受阻力小,移动速度快,随洗脱液先流出柱外;小分子进入凝胶颗粒内部,受阻力大,移动速度慢,后流出柱外。 10.如何判断天然药物化学成分的纯度? 10.答:判断天然药物化学成分的纯度可通过样品的外观如晶形以及熔点、溶程、比旋度、色泽等物理常数进行判断。纯的化合物外观和形态较为均一,通常有明确的熔点,熔程一般应小于2℃;更多的是采用薄层色谱或纸色谱方法,一般要求至少选择在三种溶剂系统中展开时样品均呈单一斑点,方可判断其为纯化合物。 11.简述确定化合物分子量、分子式的方法。 11.答:分子量的测定有冰点下降法,或沸点上升法、粘度法和凝胶过滤法等。目前最常用的是质谱法,该法通过确定质谱图中的分子离子峰,可精确得到化合物的分子量;分子式的确定可通过元素分析或质谱法进行。元素分析通过元素分析仪完成,通过测定给出化合物中除氧元素外的各组成元素的含量和比例,并由此推算出化合物中各组成元素的含量,得出化合物的实验分子式,结合分子量确定化合物的确切分子式。质谱法测定分子式可采用同位素峰法和高分辨质谱法。 12.在研究天然药物化学成分结构中,IR光谱有何作用? 12.答:IR光谱在天然药物化学成分结构研究中具有如下作用;测定分子中的基团;已知化合物的确证;未知成分化学结构的推测与确定;提供化合物分子的几何构型与立体构象的研究信息。 13.简述紫外光谱图的表示方法及用文字表示的方法和意义。 13.答:紫外光谱是以波长作横座标,吸收度或摩尔吸收系数做纵座标作图而得的吸收光谱图。紫外可见光谱中吸收峰所对应的波长称为最大吸收波长(λmax),吸收曲线的谷所对应的波长称谓最小吸收波长(λmin),若吸收峰的旁边出现小的曲折,称为肩峰,用“sh”表示,若在最短波长(200nm)处有一相当强度的吸收却显现吸收峰,称为未端吸收。如果化合物具有紫外可见吸收光谱,则可根据紫外可见吸收光谱曲线最大吸收峰的位置及吸收峰的数目和摩尔吸收系数来确定化合物的基本母核,或是确定化合物的部分结构。 1.苷键具有什么性质,常用哪些方法裂解? 1.答:苷键是苷类分子特有的化学键,具有缩醛性质,易被化学或生物方法裂解。苷键裂解常用的方法有酸、碱催化水解法、酶催化水解法、氧化开裂法等。 2.苷类的酸催化水解与哪些因素有关?水解难易有什么规律? 2.答:苷键具有缩醛结构,易被稀酸催化水解。水解发生的难易与苷键原子的碱度,即苷键原子上的电子云密度及其空间环境有密切关系。有利于苷键原子质子化,就有利于水解。酸催化水解难易大概有以下规律:(1)按苷键原子的不同,酸水解的易难顺序为:N-苷﹥O-苷﹥S-苷﹥C-苷。(2)按糖的种类不同1)呋喃糖苷较吡喃糖苷易水解。2)酮糖较醛糖易水解。3)吡喃糖苷中,吡喃环的C-5上取代基越大越难水解,其水解速率大小有如下顺序:五碳糖苷﹥甲基五碳糖苷﹥六碳糖苷﹥七碳糖苷﹥糖醛酸苷。C-5上取代基为-COOH(糖醛酸苷)时,则最难水解。4)氨基糖较羟基糖难水解,羟基糖又较去氧糖难水解。其水解的易难顺序是:2,6-去氧糖苷﹥2-去氧糖苷﹥6-去氧糖苷﹥2-羟基糖苷﹥2-氨基糖苷。 1.简述碱溶酸沉法提取分离香豆素类成分的基本原理,并说明提取分离时应注意的问题。 1.答:香豆素类化合物结构中具有内酯环,在热碱液中内酯环开裂成顺式邻羟基桂皮酸盐,溶于水中,加酸又重新环合成内酯而析出。 在提取分离时须注意所加碱液的浓度不宜太浓,加热时间不宜过长,温度不宜过高,以免破坏内酯环。碱溶酸沉法不适合于遇酸、碱不稳定的香豆素类化合物的提取。 2.写出异羟肟酸铁反应的试剂、反应式、反应结果以及在鉴别结构中的用途。 试剂:盐酸羟胺、碳酸钠、盐酸、三氯化铁 反应式:反应结果:异羟肟酸铁而显红色。 应用:鉴别有内酯结构的化合物。 1.醌类化合物分哪几种类型,写出基本母核,各举一例。 答: 醌类化合物分为四种类型:有苯醌,如2,6-二甲氧基对苯醌;萘醌,如紫草素;菲醌,如丹参醌Ⅰ;蒽醌,如大黄酸。 2.蒽醌类化合物分哪几类,举例说明。 蒽醌类分为1)羟基蒽醌类,又分为大黄素型,如大黄素,茜素型如茜草素。2)蒽酚.蒽酮类:为蒽醌的还原产物,如柯亚素。3)二蒽酮和二蒽醌类:如番泻苷类。 3.为什么β-OH蒽醌比α-OH蒽醌的酸性大。 3.β-OH与羰基处于同一个共轭体系中,受羰基吸电子作用的影响,使羟基上氧的电子云密度降低,质子容易解离,酸性较强。而α-OH处在羰基的邻位,因产生分子内氢键,质子不易解离,故酸性较弱。 4.比较下列蒽醌的酸性强弱,并利用酸性的差异分离他们,写出流程。 A. 1,4,7-三羟基蒽醌 B. 1,5-二OH-3-COOH蒽醌 C. 1,8-二OH蒽醌 D. 1-CH3蒽醌 答:酸性强弱顺序:B>A>C>D 5.显色反应区别:(1)大黄素与大黄素-8-葡萄糖苷(2)番泻苷A与大黄素苷(3)蒽醌与苯醌 (1)将二成分分别用乙醇溶解,分别加Molish试剂,产生紫色环的为大黄素-8-葡萄糖苷,不反应的为大黄素。(2)将二成分分别加5%的氢氧化钠溶液,溶解后溶液显红色的是大黄素苷,溶解后溶液不变红色的为番泻苷A。(3)将二成分分别用乙醇溶解,分别滴于硅胶板上加无色亚甲蓝试剂,在白色背景上与呈现蓝色斑点为苯醌,另一个无反应的是蒽醌。 1.试述黄酮类化合物的基本母核及结构的分类依据,常见黄酮类化合物结构类型可分为哪几类? 1.答:主要指基本母核为2-苯基色原酮的一类化合物,现在则是泛指具有6C-3C-6C为基本骨架的一系列化合物。其分类依据是根据中间三碳链的氧化程度,三碳链是否成环状,及B环的联接位置等特点分为以下几类:黄酮类.黄酮醇类.二氢黄酮类.二氢黄酮醇类.查耳酮类.二氢查耳酮类.异黄酮类.二氢异黄酮类.黄烷醇类.花色素类.双黄酮类。 2.试述黄酮(醇)多显黄色,而二氢黄酮(醇)不显色的原因。 2.答:黄酮(醇)类化合物分子结构中具有交叉共轭体系,所以多显黄色;而二氢黄 酮(醇)不具有交叉共轭体系,所以不显色。 3.试述黄酮(醇)难溶于水的原因。 3.答:黄酮(醇)的A.B环分别与羰基共轭形成交叉共轭体系,具共平面性,分子间 紧密,引力大,故难溶于水。 4.试述二氢黄酮.异黄酮.花色素水溶液性比黄酮大的原因。 4.答:二氢黄酮(醇)由于C环被氢化成近似半椅式结构,破坏了分子的平面性,受 吡喃环羰基立体结构的阻碍,平面性降低,水溶性增大;花色素虽为平面结构,但以离子形式存在,具有盐的通性,所以水溶性较大。 5.如何检识药材中含有黄酮类化合物? 5.答:可采用(1)盐酸-镁粉反应:多数黄酮产生红~紫红色。(2)三氯化铝试剂反应:在滤纸上显黄色斑点,紫外光下有黄绿色荧光。(3)碱性试剂反应,在滤纸片上显黄~橙色斑点。 6. 简述黄芩中提取黄芩苷的原理。 6. 答:黄芩苷为葡萄糖醛酸苷,在植物体内多以镁盐的形式存在,水溶性大,可采用 沸水提取。又因黄芩苷分子中有羧基,酸性强,因此提取液用盐酸调pH1~2可析出黄芩苷。 7.(1)流程中采用的提取方法是:碱提取酸沉淀法 依据:芸香苷显酸性可溶于碱水。 (2)提取液中加入0.4%硼砂水的目的:硼砂可以与邻二羟基络合,保护邻二羟基不被氧化。 (3)以石灰乳调pH8~9的目的:芸香苷含有7-OH,4'-OH,碱性较强可以溶于pH8~9的碱水中。如果pH>12以上,碱性太强,钙离子容易与羟基、羰基形成难溶于水的鳌合物,降低收率。 (4)酸化时加盐酸为什么控制pH在4-5足以是芸香苷析出沉淀,如果pH<2以上容易使芸香苷的醚键形成金羊盐,不易析出沉淀。
天然药化考试总结集团公司文件内部编码:(TTT-UUTT-MMYB-URTTY-ITTLTY-
天然药物化学:是运用现代科学理论与方法,研究天然药物中化学成分的一门学科。 研究对象:天然药物中化学成分 研究内容:各类天然药物中的结构特点、理化性质、提取分离方法以及主要类型化学成分的结构鉴定等 研究的目的及意义:1.阐明天然药物中的药效物质基础,探索中药防治疾病的原理;2.促进药理药效理论研究的深入;3.促进建立和完善中药的质量评价标准;4.扩大药源,为研制开发新药提供理论与实践基础天然药物来源:植物、动物、矿物、微生物和海洋生物 一次代谢(初生代谢):指对维持植物生命活动必不可少的过程 一次代谢物:由一次代谢产生的维持植物生命最基本的,不可缺少的物质 二次代谢:在特定的条件下,一些重要的一次代谢产物作为原料或前体,又进一步经历不同的代谢过程 二次代谢产物:由二次代谢产生的物质叫做二次代谢产物 乙酸—丙二酸途径:通过这一途径可以合成脂肪酸、酚类和蒽酮类化合物 甲戊二羟酸途径:萜类和甾体化合物均由这一途径生成 桂皮酸及莽草酸途径:具有C6-C3基本骨架的苯丙素、 C6-C3-C6结构的黄酮类化合物均由此途径合成而来 氨基酸途径:大多数生物碱类成分由此途径生成 复合途径:结构复杂的化合物可由多种生物合成途径复合完成
有效成分的提取方法:溶剂提取法、水蒸气蒸馏法、超临界流体萃取法[溶剂提取法]:煎煮法、浸渍法、渗漉法、回流提取法、连续回流提取法 作用原理:溶剂穿透药材粉末的细胞膜,溶解溶质,形成细胞的内外浓度差,将溶质渗出细胞膜,达到提取目的。 溶剂的选择(相似相溶原理) (1)分类:溶剂按极性大小可以分为三类,即亲脂性溶剂、亲水性溶剂和水。 (2)极性:常用溶剂极性由强到弱石油醚<四氯化碳<苯<二氯甲烷<氯仿<乙醚<乙酸乙酯<正丁醇<丙酮<甲醇(乙醇)<水。 (3)选择要点:根据相似相溶原理,以最大限度提取所需的化学成分,溶剂沸点应适中易回收,低毒、安全。 影响溶剂提取的因素:要选择合适的溶剂与方法,对药材的粉碎度、提取温度及时间也有要求,在工业生产中药对这些因素进行优化选择。影响有效成分的提取因素:粉碎度、温度、时间、其他原因 煎煮法:将药物粗粉加水加热煮沸提取。特点:方法简便,大部分成分可被不同程度的提取出来。缺点是温度高,对挥发性成分及受热易被破坏的成分不适用。另外,水煎后的药液大多黏度大,滤过困难。 浸渍法:将药物粗粉放在容器中,加入水或稀醇浸泡一定时间,反复多次合并浸提液,减压浓缩即可。特点:不用加热,适用于遇热易破坏或挥发性成分,以及粘液质和淀粉较多的成分。但提取时间长,效率低。以水为溶剂时,要防止发霉变质。
药物化学重点 重点 第一章绪论 1药物的概念 药物是用来预防、治疗、诊断疾病,或为了调节人体功能、提高生活质量、保持身体健康的特殊化学品。 2药物化学是一门发现与发明新药、合成化学药物、阐明药物化学性质、研究药物分子与机体细胞之间相互作用规律的综合性学科。 3药物化学的研究内容及任务 既要研究化学药物的化学结构特征,与此相联系的理化性质,稳定性状况,同时又要了解药物进入体内后的生物效应、毒副作用及药物进入体内的生物转化等化学内容。为了设计、发现和发明新药,必须研究和了解药物的构效关系,药物分子在生物体中作用的靶点以及药物与靶点结合的方式。 (3) 药物合成也是药物化学的重要内容。 第二章中枢神经系统药物 一、巴比妥类 1 异戊巴比妥 H N N H O O O 中等实效巴比妥类镇静催眠药, 【体内代谢】巴比妥类药物多在肝脏代谢,代谢反应主要是5位取代基上氧化和丙二酰脲环的水解,然后形成葡萄糖醛酸或硫酸酯结合物排出体外。 异戊巴比妥的5位侧链上有支链,具有叔碳原子,叔碳上的氢更易被氧化成羟基,然后与葡萄糖醛酸结合后易溶于水,从肾脏消除,故为中等时效的药物。 【临床应用】本品作用于网状兴奋系统的突触传递过程,阻断脑干的网状结构上行激活系统,使大脑皮质细胞的兴奋性下降,产生镇静、催眠和抗惊厥作用。久用可致依赖性,对严重肝、肾功能不全者禁用。 二、苯二氮卓类 1. 地西泮(Diazepam, 安定,苯甲二氮卓) 【结构】
N N O Cl 结构特征为具有苯环和七元亚胺内酰胺环并合的苯二氮卓类母核 【体内代谢】本品主要在肝脏代谢,代谢途径为N -1去甲基、C -3的羟基化,代谢产物仍有活性(如奥沙西泮和替马西泮被开发成药物)。形成的3-羟基化代谢产物再与葡萄糖醛酸结合排出体外。 第三节 抗精神病药 1. 盐酸氯丙嗪(Chlorpromazine Hydrochloride) 【结构】 . HCl N S Cl N 【体内代谢】主要在肝脏经微粒体药物代谢酶氧化代谢,体内代谢复杂,尿中存在20多种代谢物,代谢过程主要有N -氧化、硫原子氧化、苯环羟基化、侧链去N -甲基和侧链的氧化等,氧化产物和葡萄糖醛酸结合通过肾脏排出。 【临床应用】本品具有多方面的药理作用,其作用机制主要是阻断神经递质多巴胺与受体的结合从而发挥作用,临床上常用于治疗精神分裂症和躁狂症,大剂量时可用于镇吐、强化麻醉和人工冬眠。主要副作用有口干、上腹部不适、乏力、嗜睡、便秘等。对产生光化毒反应的病人,在服药期间要避免阳光的过度照射。 第五节 镇痛药 盐酸美沙酮(Methadone Hydrochloride) 【结构】 N O . HCl 开链类氨基酮 【临床应用】本品为阿片μ受体激动剂,镇痛效果强于吗啡、杜冷丁,其左旋体的作用=右旋体的20倍。适用于各种剧痛疼痛,并有显著镇咳作用。但毒性较大,有效剂量与中毒剂量接近,安全性小,成瘾性也小,临床上主要
糖 邻二羟基--银镜反应、斐林反应、硼酸形成络合物 糠醛衍生物+芳胺或酚类 缩合 显色 Molish 反应:样品+浓硫酸+α萘酚-------棕色环(多糖、低聚糖、单糖、苷类均阳性) 香豆素: 试剂: Gibb ——2,6-二氯(溴)苯醌氯亚胺 Emerson ——氨基安替匹林和铁氰化钾 条件:有游离酚羟基,且其对位无取代者——呈阳性 异羟肟酸铁反应(识别内酯) 醌类 颜色反应 ①Feigl 反应:醌类化合物在碱性加热条件下与醛类及临二硝基苯反应生成紫色化合物(反应前后醌类化合物无变化,只起到电子传作用) ②Borntr?ger 反应: 羟基蒽醌类遇碱显红-紫红色 羟基醌类遇碱颜色加深,呈橙、红、紫红及蓝色 蒽酚、蒽酮、二蒽酮需氧化成羟基蒽醌后才显色 ③无色亚甲蓝反应:苯醌及萘醌,用于PC,TLC 的喷雾剂,显蓝色斑点 ④与活性次甲基试剂的反应: 苯醌及萘醌类:醌环上有未被取代的位置,可在氨碱性条件下与活性次甲基试剂(乙酰醋酸酯、丙二酸酯等)反应生成蓝绿或蓝紫色。 ⑤与金属离子的络合反应:具有α-OH 或临二酚OH 的蒽醌,与Pb2+、Mg2+络合显色 与醋酸镁络合具有一定的颜色-----鉴定 黄酮类 HCl-Mg 反应 含黄酮(醇)、二氢黄酮(醇) (+)橙红色-紫红色 查耳酮、橙酮、黄烷(醇)类 (-)不显色 操作方法:1ml 样品 + Mg 粉 + 几滴浓HCl (花色素及部分橙酮、查耳酮在浓盐酸中会变色,故需做对照) 香豆素Gibb Emerson 试剂与酚羟基对位活性氢缩合蓝色红色
铝盐:1% AlCl3或Al (NO2)3 黄色 定性、定量 铅盐:1%醋酸铅或碱式醋酸铅 黄~红色 沉淀 锆盐: 2%ZrOCl2的甲醇溶液 黄色 游离的3,5-羟基 锆-枸橼酸反应: 黄绿色 荧光 镁盐: 二氢黄酮(醇)类 天蓝色 5-酚羟基 色泽更明显 氯化锶: 氨性甲醇溶液 (具有邻二酚羟基 ) 绿色~棕色~黑色 沉淀 三氯化铁:酚类显色剂 三氯化铁-铁氰化钾 碱性试剂显色反应: (碱:氨蒸汽 可逆; 碳酸钠水溶液 不可逆) 二氢黄酮类 开环 橙色~黄色 黄酮醇类 黄色~棕色(通入空气)其他黄酮无次反应 含有邻二羟基或3,4’-二羟基取代的黄酮类 不稳定 易氧化 黄色~深红色~绿棕色 萜类 不饱和萜类与亚硝酰氯反应;生成的氯化亚硝基衍生物多呈蓝色至绿色结晶 挥发油功能团的鉴定: 酚类:三氯化铁乙醇溶液——蓝色、蓝紫或绿色 羰基化合物:硝酸银氨溶液——银镜反应——醛类 挥发油的乙醇溶液+2,4-二硝基苯肼、氨基脲、羟胺等试剂——结晶性衍生物 沉淀——醛或酮类 不饱和化合物和薁类衍生物:挥发油的三氯甲烷+溴的三氯甲烷溶液——红色褪去——含有不饱和化合物,继续滴加,如果产生蓝、紫、绿——含有薁类化合物 挥发油的无水甲醇溶液加浓硫酸——蓝色、紫色——含有薁类衍生物 内酯类化合物:挥发油的吡啶溶液+亚硝酰氰化钠及氢氧化钠溶液——出现红色并逐渐消失——含有不饱和内酯类化合物 三萜化合物(萜类)显色反应 强心苷:1)甾体母核颜色反应与三萜类相同(但全饱和的甾体、C3无羟基的呈阴性) 2)不饱和内酯环产生的反应: 样品 硼酸 草酸 枸橼酸 黄色并有绿色荧光 黄色,无荧光 丙酮
1.天然药物化学:是应用现代理论、方法与技术研究天然药物中化学成分的学科。 2.天然药化的研究内容:主要包括:天然药物中各类型化学成分的结构特点、理化性质、提取分离的方法与技术以及各类型化学成分的结构检识、鉴定、测定和修饰等。 3.有效成分:天然药物中含有多种化学成分,具有一定生理活性的成分称为有效成分。 4.无效成分:无生理活性的成分称为无效成分。 5.有效部位:将含有一种主要有效成分或一组结构相近的有效成分提取分离部位称为有效部位。 6.提取:是指选用适宜的溶剂和适当的方法将所需药物提出而杂质尽可能少地被提出的过程,通常所得的提取物是多种成分的混合物。 7.分离:是选用适当的方法再将其中所含各种成分逐一分开,并把所得单体加以精制纯化的过程。 8.研究天然药物有效成分的意义:⑴控制天然药物及其制剂的质量;⑵探索天然药物治病的原理;⑶开辟和扩大药源、促进新药开发;⑷改进药物制剂、提高临床疗效;⑸为中药炮制提供现代科学依据。 9.天然药物中各类化学成分的名称:糖和苷类;生物碱;醌类;黄酮;香豆素类;有机酸类;挥发油和萜类;甾体类化合物;鞣质类;氨基酸、蛋白质和酶;树脂;植物色素。 10.溶剂提取法的原理:“相似相溶”原理。 11.常用溶剂的极性大小规律:石油醚<四氯化碳<苯<二氯甲烷<三氯甲烷<乙醚<乙酸乙酯<正丁醇<丙酮<甲醇(乙醇)<水。 12.亲水性有机溶剂:主要为甲醇、乙醇、丙酮等,其中以乙醇最为常用,此类溶剂对植物细胞穿透力较强,溶解范围广泛,有提取黏度小、沸点低、不易霉变等特点。 13.亲脂性有机溶剂:如:石油醚、苯、乙醚、三氯甲烷、乙酸乙酯等,这类溶剂沸点低,浓缩回收方便,但这类溶剂易燃,有毒,价贵,设备要求较高,穿透药材组织的能力较差,提取时间较长。 14.溶剂提取的方法:⑴浸渍法;⑵渗漉法;⑶煎煮法;⑷回流提取法;⑸连续回流提取法。(详见课本P10) 15.水蒸气蒸馏法的定义:将水蒸气通入含有挥发性成分的药材中,使药材中挥发性成分随水蒸气蒸馏出来的一种提取方法。原理:当水和与水互不相溶的液体成分共存时,根据道尔顿分压定律,整个体系的总蒸汽压等于两组分蒸汽压之和,虽然各组分自身的沸点高于混合液的沸点,但当总蒸汽压等于外界大气压时,混合物开始沸腾并被蒸馏出来。适用范围:适用于具有挥发性,难溶或不溶于水,能随水蒸气蒸馏而不被破坏的天然产物成分的提取。天然产物中挥发油成分的提取多用此法。 16.超临界流体的性质:超临界流体是处于临界温度(Tc)和临界压力(Pc)以上,介于气体和液体之间的流体。这种流体同时具有液体和气体的双重特性,它的密度与液体相似,黏度与气体相似,扩散系数虽不及气体大,但比液体大100倍。 17.可作为超临界流体的物质:CO2、NH3、C2H6、C7H16等,其中CO2应用较多,原因:CO2的临界温度(Tc=31.4℃)接近室温,临界压力(Pc=7.37Pa)也不太高,易操作,且本身呈惰性,价格便宜,是中药超临界流体萃取中最常用的溶剂。 18.分离纯化的方法:⑴系统溶剂分离法 ⑵两项溶剂萃取法:①简单萃取法;②逆流连续萃取法:移动相(或分散相):相对密度小的相液,固定相(或连续相):相对密度大的相液;③逆流分溶法:条件:当混合物各成分的分配系数很接近时,一般不宜分离,可选择此法,极性过大或过小,或分配系数受温度或浓度影响过大及抑郁乳化的溶剂试剂均不宜采用此法;④液滴逆流分配法 ⑶沉淀法:①酸碱沉淀法;②试剂沉淀法(选择判断):雷氏铵盐可与水溶性的季铵碱生成
药物化学重点总结 给结构写名称和作用靶点(10*1分)单独列出 给通用名写结构(5*1分)单独列出 选择(20*1)构效关系重点 填空(30个空*0.5分) 简答(4-5道,20分) 合成(2-3个,10分) 第一章绪论 第二章药物的结构和生物活性 产生药效的两个主要因素(药物的理化性质以及药物与受体之间的相互关系) 1、药效团:药效团是与受体结合产生药效作用的药物分子中在空间分布的最基本的结构特征(三维结构) 2、药动团:是指药物结构中决定药物的药代动力学性质且参与体内吸收、分布、代谢和排泄过程的基团。(与药效团以化学键结合,是药效团的载体) 3、天然氨基酸:L-氨基酸或二肽在体内可被主动转运,可作为药动基团连接于药效团上,以利于其吸收和转运。 4、毒性基团:是指药物分子中产生毒性以及致突变或致癌等作用的结构基团。(毒性集团一般都有亲电性质,与体内核酸,蛋白交联)其药物分子中的主要亲电基团: ①含有环氧类的基团 ②可生成正碳离子的基团 ③β-内酯及醌类的基团 ④烷基硫酸酯或磺酸酯及β-卤代硫醚类的基团 ⑤N-氧化物、N-羟胺、胺类以及在体内可转化为含胺类的基团等。 5、药物生物转化反应
①Ⅰ相反应:水解反应氧化反应还原反应(羰基的还原反应硝基和偶氮基的还原反应) ②Ⅱ相反应:结合反应:1.与葡萄糖醛酸结合(最常见、最重要) 2.与硫酸结合 3.与谷胱甘肽结合 4.与乙酰基结合 5.与甲基结合 6、前药:是一类经结构修饰将原药分子中的活性基因封闭起来而本身没有活性的药物。 进行前药修饰的作用(一般出选择): ①改善药物的吸收性②延长药物的作用时间③提高药物的选择性④提高药物的稳定性 ⑤提高药物的水溶性⑥降低药物的刺激性⑦消除药物的不良味觉⑧发挥药物的配伍作用 7、软药:软药是容易代谢失活的药物,使药物在完成治疗作用后,按预先设定的代谢途径和可以控制的速率分解、失活并迅速排出体外,从而避免药物的蓄积毒性。 8、电子等排体:是指外层电子数目相等的原子、离子、分子,以及具有相似立体和电子构型的基团。如亚甲基与氧原子 9、生物电子等排体:是指具有相似的理化性质,又能产生相似生物学活性的基团或分子。 第三章镇静催眠药和抗癫痫药物 第一节、镇静催眠药 镇静催眠药按化学结构可分为巴比妥类,苯二氮卓类,咪唑并吡唑类 一.苯二氮卓类(地西泮,奥沙西泮,阿普唑仑) 结构特征为具有苯环和七元亚胺内酰胺环骈合的苯二氮卓类母核
国家药品标准是《中国药典》(缩写Ch.P)和局颁标准。 药品质量标准:是药品现代化生产和质量管理的重要组成部分,是药品生产、经营、使用和行政、技术监督管理各部门应共同遵循的法定技术依据。 药典内容分:凡例、正文、附录、索引。 药品质量管理规范(5个G)《药品非临床研究质量管理规定GLP》《药品生产质量管理规范GMP》《药品经营质量管理规范GSP》《药品临床试验质量管理规范GCP》《中药材生产质量管理规范GAP》。 标准品:用于生物检定、抗生素或生化药品中含量或效价测定的标准物质,按效价单位计,以国际标准品进行标定。 对照品除另有规定外,均按干燥品(或无水物质)进行计算后使用。 药品检验工作的基本程序一般为取样、鉴别、检查、含量测定、写出检验报告。 杂质两个来源:一是由生产过程中引入,二是贮藏过程中引入。 杂质按照来源分:一般杂质和特殊杂质;按毒性分:毒性杂质和信号杂质;按理化性质分:有机杂质、无机杂质和残留杂质。 杂质限量:药物中含杂质的最大允许量。 杂质限量%=杂质最大允许量/供试品量*100% 杂质限量%=标准溶液的浓度*标准溶液的体积/供试品量*100%即L=CV/S*100% 1.氯化物检查,在硝酸酸性条件下与硝酸银反应,生成氯化银胶体微粒而显白色浑浊,与一定量的标准氯化钠溶液在相同条件下产生的氯化银浑浊程度比较,浊度不得更大。加硝酸目的:避免弱酸银盐如碳酸银、磷酸银及氧化银沉淀的干扰,且可加速氯化银沉淀的生产并产生较好的乳浊,酸度以50ml供试溶液中含稀硝酸10ml为宜。 2.硫酸盐检查,在稀盐酸酸性条件下与氯化钡反应,与一定量标准硫酸钾溶液在相同条件下产生的硫酸钡浑浊程度比较。 3.铁盐检查,硫氰酸盐法,铁盐在盐酸酸性与硫氰酸盐作用生产红色可溶性硫氰酸铁配离子 4.重金属检查,硫代乙酰胺法适用于溶于水、稀酸和乙醇的药物;炽灼后的硫代乙酰胺法适
精品资料
第一章 总论
1.常用的天然化学成分的提取、分离、鉴定方法
提取
溶剂提取法 水蒸气蒸馏法 超临界流体提取法 升华法、超声波提取法、微波提取法
分离纯化
㈠ 两相溶剂萃取法: 溶剂法、逆流分配法 萃取操作要尽量防止乳化,破坏乳化的方法:①轻度乳化可用金属丝在乳 化层搅拌使之破坏;②乳化层加热或冷冻使之破坏;③长时间放置使之自 然分层;④将乳化层抽滤;⑤加入表面活性更大的表面活性剂;⑥乳化离 心
㈡ 系统溶剂分离法:适用于有效成分为未知的药材 ㈢ 结晶法:根据溶解度差别分离
操作:加热溶解、趁热过滤、放冷析晶、再抽滤 结晶纯度的判断:①形状和色泽:形状一致,色泽均一
②熔点和熔距:熔点不下降、熔距<2℃ ③TLC:3 种不同系统的展开剂、单一圆整的斑点 ㈣ 沉淀法:根据溶解度差别分离 ① 溶剂提取法:水提醇沉法、醇提水沉法;②酸碱沉淀法 ㈤ 色谱法:P22
2.溶剂提取法与水蒸气蒸馏法的原理、操作及其特点 ⑴溶剂提取法 ·根据被提取成分的性质和溶剂性质
浸渍法、渗漉法:热不稳定,不能加热 煎煮法:提取原生苷类,杀酶保苷
不宜用于遇热易被破坏或具有挥发性的化学成分的提取 提取方法
回流提取法:溶剂用量较大且含受热易被破坏有效成分的天然药物不宜用此法 连续回流提取法:提取效率最高且与虹吸次数有关
1、水(可提出氨基酸、糖类、无机盐等水溶性成分) 2、亲水性有机溶剂:丙酮或乙醇、甲醇(可提出苷类、生物碱盐以及鞣质 等极性化合物 3、亲脂性有机溶剂: 石油醚或汽油(可提取油脂、蜡、叶绿素、挥发油、游离甾体及三萜化合物) 三氯甲烷或乙酸乙酯(可提取游离生物碱、有机酸及黄酮、香豆素的苷元等 中等极性化合物)
医药企业工作总结 即将成为过去的**年,是我们**药业公司发展史上具有开创性意义的一年。在过去的一年里,公司面临着抢抓机遇加快实施中药现代化工程建设,推动认证和千方百计确保公司外部市场产品需求两大中心工作任务。一方面,国家对未通过认证的药品生产企业实施的停产措施,迫使我们抓紧时间完成公司认证所需相关硬件设施的建设和软件的配套完善。另一方面,公司外部市场的成熟和发展,也对我们的药品生产、质量保障和服务水平提出了严苛的要求。所有这一切,都给我们带来了无形的压力和动力。一年来,我们紧紧围绕中心工作,从强化公司内部管理上入手,以全面提升员工队伍的综合素质为依托,以突破重点工程项目建设为核心,以科技项目申报为着力点,在强化开拓能力和创新能力上下功夫,全面提高企业的生存能力和核心竞争能力。 一年来,我们主要完成了以下几项工作任务: 第一,在保运转,保市场供应的思想指导下。一年来,我们及时向市场供应益心酮片件,圆满地保障了公司外部市场的发展。在此基础上,我们还提取山楂叶总黄酮公斤。 第二,是在国家土地政策日益严格的情况下,先后办理了公司现址临近振兴街的亩土地和公司原租用的亩土地的征用手续,办理了国有土地使用证,彻底解决了公司自成立以来长期悬而未决的用地问题,为公司的发展奠定了坚实的基础。 第三,在公司资金严重短缺的情况下,开创性地运用现代房地产开发管理模式引进资金,使**综合楼破土动工,一层已接近封顶,公司筹备近三年的**花园建设进入实质性实施阶段。
第四,是在公司中药现代化工程建设陷入困境的情况下,解玉武经理临危受命,采取积极的合作与协作方式,顺利完成了工程主体车间封顶的年内工作目标。 第五,是通过县、市及省科技主管部门,成功将我公司的大孔树脂吸附法生产山楂叶总黄酮项目申报为国家级星火计划项目,从而使我公司成为国家级重点科技项目实施单位,大大提高了公司的知名度和美誉度,进一步拓宽了公司的发展空间。 第六,是克服了资料欠缺、没有科目先列等一系列困难,多方收集资料,成功申报了**省重大科技攻关项目——绛县道地药材连翘基地建设项目,争取回万元的项目资金,并为公司的良性发展和当地农民脱贫致富创造了良好条件。同时我们还成功地将公司的大孔树脂吸附法生产山楂叶总黄酮项目申报了**省专利推广资助项目,成功地将绛县道地药材连翘基地建设项目申报了运城市科技局技术开发项目。 值得说明的是,这些成绩是在公司生产经营陷于困境,资金极度短缺的条件下取得的。这些成绩中饱含了我们**药业一班人艰辛的心血汗水,是我们**药业公司全体员工自力更生,艰苦奋斗的结晶。 为了完成这些工作任务,我们主要做了以下几项工作: 一、全面加强内部管理,增强企业的核心竞争力。 企业的管理是无止境的,企业管理的效益也是无止境的。一年来,面对公司的生产处于基本停顿的现状,我们越是加大了公司内部管理工作的力度。通过严格规范的内部管理,增强了企业的核心竞争力和员工队伍的凝聚力。 在日常工作中,我们注重发挥监督检查的作用,经常性地组织现场管理、安全管理、岗位责任制管理等方面的专项检查。通过不间断的检查评比,使广大员工
4.挥发油的分离方法 (1)冷冻法:薄荷油析出薄荷脑 (2)分馏法: 沸点随分子量增大、双键增多而升高;含氧萜沸点随官能团的极性增大而升高。 第七节甾体及苷类 一、强心苷1.强心苷的结构与分类 (1)强心苷元特点:可分为甾体母核、不饱和内酯环两部分。(2)强心苷元的类型:依据不饱和内酯环的特点分为两类。①23个碳原子组成,C17侧链为五元不饱和内酯环,称强心甾烯类,即甲型强心苷元。大多属于此类。如洋地黄毒苷元。②24个碳原子组成,C17侧链为六元不饱和内酯环,称海葱甾二烯类或蟾蜍甾二烯类,即乙型强心苷元。如海葱苷元等。(3)糖的类型强心苷的糖除了常见的葡萄糖外,还有2,6-二去氧糖,如D-洋地黄毒糖、D-加拿大麻糖等,6-去氧糖如L-黄花夹竹桃糖、D-洋地黄糖等。(4)强心苷元和糖的连接方式Ⅰ型:苷元-(2,6-去氧糖)x-(D-葡萄糖)y,如毛花苷CⅡ型:苷元-(6-去氧糖)x-(D-葡萄糖)y,如真地吉他林Ⅲ型:苷元-(D-葡萄糖)y,如绿海葱苷其中x=1~3,y=1~2。 2.强心苷的物理性质 (1)溶解性:原生苷由于所含糖基数目多且具有葡萄糖,可溶于水、醇等溶剂,次生苷亲水性减弱,可溶于乙酸乙酯、含水氯仿等溶剂。 (2)苷键水解①酸催化水解 水解方法试剂适用类型产物 温和酸水解0.02~0.05mol/L盐酸/硫酸Ⅰ型苷元和低聚糖 强烈酸水解3%~5%无机酸Ⅱ型、Ⅲ型脱水苷元、单糖 ②酶催化水解:如西地兰经酶解可以得到地高辛。 3.强心苷的检识 (1)强心苷因有甾体母核可发生:①醋酐浓硫酸反应;②三氯醋酸反应;③三氯化锑反应。(2)不饱和五元内酯环呈色反应[亚硝酰铁氰化钠(Legal)反应]:若反应呈深红色并逐渐褪去,表示可能存在甲型强心苷。(3)2-去氧糖的鉴别反应[三氯化铁-冰醋酸(Keller-Kiliani)反应]:如有2-去氧糖存在,冰醋酸层逐渐为蓝色,界面处呈红棕色或其他颜色(随苷元不同而异)。 4.典型化合物及生物活性强心苷是治疗心衰不可缺少的药物。 二、甾体皂苷 1.甾体皂苷的结构与分类 (1)结构特征:苷元由27个碳原子组成,基本碳架是螺甾烷。苷元结构中有六个环,其中,A、B、C、D四个环为甾体母核,E环和F环以螺缩酮形式相连接,构成螺甾烷结构。 (2)甾体皂苷的类型:依照螺甾烷结构中F环的环合状态,可将其分为:螺甾烷醇类、异螺甾烷醇类、呋甾烷醇类。蓣皂苷与原薯蓣皂苷是地奥心血康制剂中的主要成分。 2.皂苷的理化性质 (1)表面活性:皂苷水溶液经强烈振摇能产生持久性泡沫,且不因加热而消失。