
病毒载体概述 引言 基因导入系统(gene delivery system)就是基因治疗的核心技术,可分为病毒载体系统与非病毒载体系统。本章主要论述用于人类基因治疗的病毒载体系统。 用于基因治疗的病毒载体应具备以下基本条件: 1、携带外源基因并能包装成病毒颗粒; 2、介导外源基因的转移与表达; 3、对机体不致病。 然而,大多数野生型病毒对机体都具有致病性。因此需要对其进行改造后才能用于人体。原则上,各种类型的病毒都能被改造成病毒载体。但就是由于病毒的多样性及与机体复杂的依存关系,人们至今对许多病毒的生活周期、分子生物学、与疾病发生及发展的关系等的认识还很不全面,从而限制了许多病毒发展成为具有实用性的载体。近20年来,只有少数几种病毒如反转录病毒(包括HIV病毒)、腺病毒、腺病毒伴随病毒、疱疹病毒(包括单纯疱疹病毒、痘苗病毒及EB病毒)、甲病毒等被成功地改造成为基因转移载体并开展了不同程度的应用。 第一节病毒载体产生的原理 病毒载体的产生建立在对病毒的生活周期与分子生物学认识的基础之上。研究病毒载体首先要对病毒的基因组结构与功能有充分的了解,最好能获得病毒基因组全序列信息。病毒基因组可分为编码区与非编码区。编码区基因产生病毒的结构蛋白与非结构蛋白;根据其对病毒感染性复制的影响,又可分为必需基因与非必需基因。非编码区中含有病毒进行复制与包装等功能所必需的顺式作用元件。 各种野生型病毒颗粒都具有一定的包装容量,即对所包装的病毒基因组的长度有一定的限制。一般来说,病毒包装容量不超过自身基因组大小的105~110%。
基因重组技术的发展使病毒载体的产生成为可能。最简单的做法就是,将适当长度的外源DNA插入病毒基因组的非必需区,包装成重组病毒颗粒。比如,本实验室曾将4、5kb的lacZ基因表达盒 (CMV-lacZ-polyA)插入HSV1病毒的UL44(糖蛋白C)基因的XbaI位点中,病毒基因组的其余部分不改变,构建成重组病毒HSV1-lacZ100(吴小兵等,1998)。由于UL44基因产物对于HSV病毒在培养细胞中产毒性感染就是非必需的,因此,该重组病毒可以在细胞中增殖传代。用这种重组病毒感染细胞,能将lacZ基因带入细胞并高效表达。用同样的方法,将AAV-2病毒的rep与cap基因片段(4、3kb)插入HSV1病毒的UL2(编码尿嘧啶DNA糖基化酶)或UL44(编码糖蛋白C)基因中,构建成具有提供重组AAV载体复制与包装所需的全部辅助功能的辅助病毒rHSV-rc(伍志坚等,1999)。 然而,这样的重组病毒作为基因转移载体有许多缺点。首先,许多野生型病毒通过在细胞中产毒性复制而导致细胞裂解死亡;或带有病毒癌基因而使细胞发生转化。因此必须经过改造使其成为复制缺陷性病毒并且删除致癌基因后才能用于基因治疗。其次,插入外源DNA的长度受到很大限制,尤其对于基因组本身较小的病毒如腺病毒伴随病毒(AAV,4、7kb)、反转录病毒(8~10kb)、腺病毒(36kb),如果不去除病毒基因,可供外源DNA插入的容量就十分小。因此,必须删除更多的病毒基因以腾出位置插入较大的外源DNA。为了增加病毒载体插入外源DNA的容量,除了可以删除病毒的非必需基因外,还可以进一步删去部分或全部必需基因,这些必需基因的功能由辅助病毒或包装细胞系反式提供。 病毒载体大体上可分为两种类型: 重组型病毒载体:这类载体就是以完整的病毒基因组为改造对象。一般的步骤就是选择性地删除病毒的某些必需基因尤其就是立早基因或早期基因,或控制其表达;缺失的必需基因的功能由互补细胞反式提供;用外源基因表达单位替代病毒非必需基因区;病毒复制与包装所需的顺式作用元件不变。这类载体一般通过同源重组方法将外源基因表达单位插入病毒基因组中。如在传统的重组腺病毒构建方法中,将外源基因表达盒(exogenous gene expression cassette)插入穿梭质粒(如pXCX2或pFGdX1)的腺病毒同源序列中,与辅助
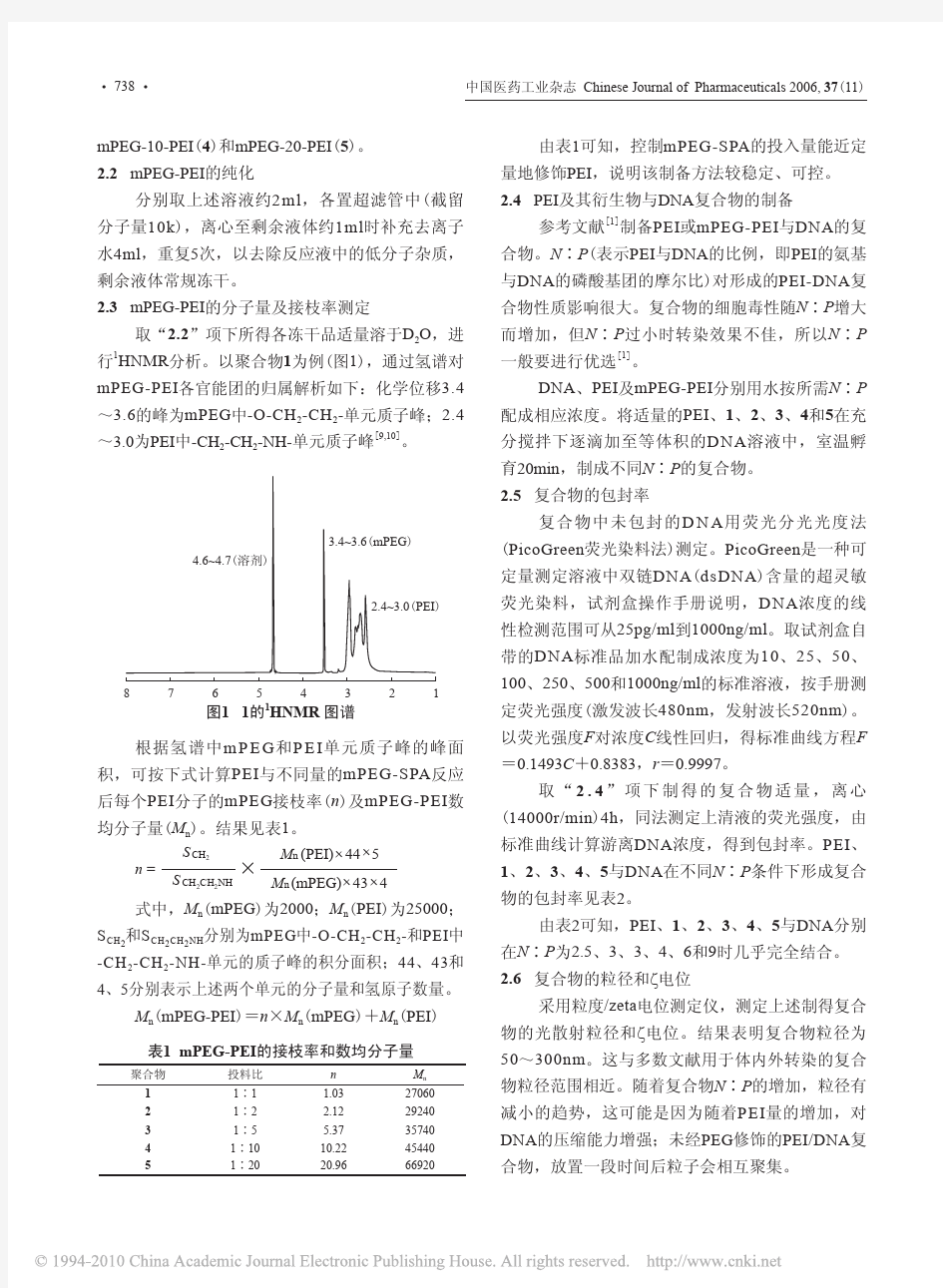
概述 定义 非病毒载体是利用非病毒的载体材料的物化性质来介导基因的转移。 特点 非病毒载体具备无传染性,没有载体容量限制,材料来源广泛,化学结构可控制,且易于大量制备,在表达质粒、反义寡核苷酸或反义表达质粒真核细胞的靶向转移中,有着病毒载体不可替代的作用。 与病毒载体相比较,具有毒性低、免疫反应低,而且所携带的基因不整合至宿主细胞基因组等优点。 然而,非病毒载体的转导效率低,目的基因只能实现瞬间表达,其运送系统的颗粒较大,容易引发免疫反应和被机体所清除。 2常用材料 脂质体或脂类复合物 脂质体包括阳性、中性和阴性脂质体,其中阳性脂质体研究的最为广泛。自从1987年以来, 众多学者相继合成出许多阳离子脂质体。所有的阳离子脂质体的一端皆拥有1~2条由12~ 18个碳原子组成的疏水链, 使其在水性介质中形成双层结构, 并包裹DNA;另一端为亲水性的N+, 通过静电力与DNA结合以形成脂质复合物。 脂质体或脂质复合物经静脉注射后,很快被血浆清除并在肺组织中积蓄, 蛋白质主要在肺内皮细胞中表达,通常表达时间较短,一般在给药后4~ 24h即达峰, 1周后消失。因此,阳离子脂质载体在治疗一些肺部疾病如肺代谢性疾病、门脉高压和急性呼吸窘迫综合征等有较好前景。脂质体或脂质复合物也可直接应用于病变部位以避免静脉给药选择性差的缺点。 目前虽然在阳离子脂质体构效关系研究的基础上,合成了一些新的脂质载体, 但离理想的脂质载体还相距较远,其主要困难在于体内外转染条件的差别, 而且转染效果还取决于给药途径。因此, 只有根据实际的临床应用来个性化设计才能获得较为理想的载体, 这无疑给载体的开发带来困难。脂质体或脂质复合物并没有长期安全性报道。 阳离子多聚物 1、多聚赖氨酸:聚L-赖氨酸和去唾液酸糖蛋白连接的聚合物用于细胞的基因靶向转移, 其基因转染效果较阳离子脂质体差。有研究表明,在有或无靶向配体的情况下,多聚赖氨酸与DNA的聚合物的细胞摄取率和基因转染率都依赖于聚合复合物正电性的存在。 2、聚乙烯亚胺( polyethylenimine, PEI) :PEI阳离子聚合物表面的正电荷与DNA上带负电荷的磷酸基团产生静电作用形成复合物。这种复合物的超分子结构可以描述为一种核-壳结构, 疏水核是部分中和的DNA,外壳则是亲水的阳离子聚合物链段。这种核-壳结构,增加了体系在血液循环中的稳定性, 保护DNA在传递过程中不受DNA酶或巨噬细胞的降解。PEI阳离子聚合物由于其自身具有缓冲容量, 在不需要加入吞噬细胞或溶酶体溶解剂的情况下就显示出较好的基因转染效果。 3、树突状聚合物:树突状聚合物系一定Mr 范围的聚酰胺和含磷树状聚合物的末端氨基通过静电力与DNA结合形成的一种阳离子多聚物非病毒基因载体,聚酰胺树状聚合物的酰胺键在水或乙醇中的水解,可使基因转染率增加50倍, 其原因可能是水解增加了聚合物的柔韧性。故一些可水解的聚酰胺树状聚合物对体内颈动脉的基因转染比支链PEI更有效。 壳聚糖载体聚合物 壳聚糖作为一种天然阳离子聚合物,通过与DNA以静电方式作用使壳聚糖-DNA体系不被降解, 完全进入细胞。作为基因载体, 壳聚糖具有细胞毒性低、生物相容性好、基因免疫性低和转染效率较高等特点。 壳聚糖-DNA复合物按制备方法主要分壳聚糖及其衍生物的DNA复合物、壳聚糖-DNA纳
用于基因治疗的慢病毒载体(一) 基因治疗有望成为治疗遗传病、肿瘤、病毒感染及其它难治性疾病的有效手段,但目前基因转移方法的局限性成为实现这一希望的最大障碍。非病毒学的基因转移方法效率较低;已用于人体试验的基因治疗方案绝大多数是以病毒学方法进行基因转移的,其中以逆转录病毒载体和腺病毒载体最为成熟。常用的逆转录病毒载体从小鼠白血病病毒(MLV)改造而来,虽可使目的基因整合至靶细胞基因组、实现稳定表达,但只能转导分裂细胞,目前主要用于基因治疗的离体方案;腺病毒载体既能转导分裂细胞,亦可转导静止细胞,转导效率也较高,但目的基因不整合至靶细胞基因组,仅能短暂表达,而且腺病毒本身某些抗原的表达可引起人体免疫反应,阻止其重复转导;其它一些病毒载体如腺相关病毒(AAV)载体、单纯疱疹病毒(HSV)载体亦因各种原因不能令人满意。 理想的病毒载体能同时提供高效的基因转移、长期稳定的基因表达及生物安全性。近来,一些研究者把目光投向了以Ⅰ型为人免疫缺损病毒(HIV-1)为代表的慢病毒。研究表明〔1-5〕,以HIV-1为基础构建的这类慢病毒载体具有可感染非分裂细胞、目的基因整合至靶细胞基因组长期表达、免疫反应小等优点,适于体内基因治疗,因此有望成为理想的基因转移载体。本文即对该类载体的研究进展做一简介。 1HIV-1基因组的基本结构〔6〕 HIV-1DNA前病毒的主要结构基因及其排列形式与其它逆转录病毒相同,均为5'LTR-gag-pro-pol-env-3'LTR。其中gag基因编码病毒的核心蛋白,pol基因编码病毒复制所需的酶类,env基因编码病毒的包膜糖蛋白,pro基因则编码切割蛋白前体所需的蛋白酶。与其它逆转录病毒不同的是,HIV-1基因组尚有较多调节基因,其中属于HIV-1基因复制所必需的tat基因和rev基因,分别编码两个反式激活因子Tat蛋白和Rev蛋白,前者在HIV-1基因组复制和转录延伸过程中发挥重要作用,后者则可促使HIV-1基因的表达由早期向晚期转化。非HIV-1复制所必需的调节基因有nef、vif、vpr和vpu。这些基因的编码产物都有各自的功能,有些尚未完全阐明,在此不一一赘述。 2构建HIV-1载体系统的基本原理〔7〕 HIV-1载体系统由两部分组成,即包装成分和载体成分。包装成分由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白;载体成分则与包装成分互补,即含有包装、逆转录和整合所需的HIV顺式作用序列,同时具有异源启动子控制下的多克隆位点及在此位点插入的目的基因。为降低两种成分同源重组恢复成野生型病毒的可能,需尽量减少二者的同源性,如将包装成分上5'LTR换成巨细胞病毒(CMV)立即早期启动子、3'LTR换成SV40polyA等。包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能。图1所示为Trono等建立的HIV-1载体系统中的一种〔1〕。将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒。 3HIV-1载体系统的改进 近年来,已有多个实验室建立了复制缺陷的HIV-1载体系统,用于不同目的的研究,如分析病毒的感染力〔8〕、筛选抗病毒药物〔9〕、评价Env糖蛋白的不同区域在介导病毒进入细胞中的作用〔10〕等。而目前对于以基因治疗为目的的HIV-1载体系统,研究的焦点集中在如何扩大其嗜性范围、确保其安全性及提供其滴度和转导能力上。1996年以来,Trono领导的课题组发表了一系列令人鼓舞的研究结果〔1~3〕,主要包括以下几方面的改进。 3.1包膜蛋白 最初的HIV-1载体颗粒,均由其本身的包膜蛋白Env所包裹,仅对CD4+的细胞具有亲嗜性。1996年,Trono课题组的Naldini等〔1〕设计的HIV-1载体系统(见图1)采用表达水疱性口炎
基因治疗时代到来:常用基因治疗载体的介绍与选择 摘要:1989年Rosenberg等利用逆转录病毒载体实施第一例人类基因治疗实验,此后基因治疗研究在全球范围内逐渐展开。2017年,基因治疗在癌症和罕见遗传病的治疗 中接连取得了巨大成功,本文梳理了这一系列的标志性事件,重点讲述基因治疗中的载体选择。2017年11月8日,Nature 发表论文:Regeneration of the entire human epidermis using transgenic stem cells,通过逆转录病毒载体基因治疗,一位7岁的交界性大疱性表皮松解症(JEB)患者全身约80%的皮肤获得重建,且皮肤功能完全正常(图1)。图1 2017年11月2日,NEJM发表论文:Single-Dose Gene-Replacement Therapy for Spinal Muscular Atrophy,以腺相关病毒9型(AAV9)为载体的基因疗法成功延长了15位1型脊髓性肌萎缩症(SAM1)患儿的生命(图2)。图22017年8月30日,诺华公司治疗B细胞急性淋巴细胞白血病的以慢病毒为载体的CAR-T疗法Kymriah获FDA批准上市,成为FDA批准的第一款基因疗法(图3)。图3以上三个基因治疗的标志性案例,使用了三种不同的基因治疗载体,分别是逆转录病毒(RV)、腺相关病毒(AAV)、慢病毒(LV)。基因治疗载体分为两大类:病毒载体(主要包括慢 病毒、腺病毒、逆转录病毒、腺相关病毒等),非病毒载体
(主要包括裸露DNA、脂质体、纳米载体等)在讲基因治疗载体前,我们先讲一下基因治疗中的两个概念:in vivo和ex vivo。in vivo:活体直接转移,将带有遗传物质的载体直接注射到实验动物或人体内。适用载体:腺相关病毒、腺病毒、非病毒载体等。ex vivo:在体转移,将实验对象的细胞取出,体外培养并导入重组基因,而后将这些经遗传修饰的细胞重新输回实验动物体内。适用载体:慢病毒、腺病毒、逆转录病毒等。接下来我们介绍以下常用的基因治疗载体基因治疗中的病毒载体 逆转录病毒(RV):单链RNA病毒,可高效地感染多种类型细胞,可以将外源基因随机插入并稳定整合到宿主细胞基因组中持续表达。其中γ-逆转录病毒载体最早被改造的且广泛地被应用到基因治疗中,并取得了不少巨大的成功。不足之处:①不能感染非分裂细胞;②转录终止能力相对较弱,从而有可能造成转录通读;③可能产生有复制能力的病毒; ④可能造成插入性突变,例如使用逆转录病毒载体治疗的10例X连锁重度复合型免疫缺陷病(X-SCID)患者中,有4例因载体整合在原癌基因LMO2等的附近,激活下游基因的表达而罹患白血病。逆转录病毒的插入位点是随机的,但更偏向于插人基因的第一个内含子和转录起始位点。此后人们开始重新审视基因治疗载体的使用所带来的风险,此次使用逆转录病毒治疗JEB后,研究团队通过全基因测序确定了插入位
基因治疗载体的最新研究进展 在生命进化的漫长历程中,生物体通过基因的突变来适应环境的改变,所以说生物突变是生物体进化的基础[1]。同时,不利的突变会造成细胞形状和功能的改变,从而导致疾病甚至死亡。人类的某些疾病是由于其本身的基因的核苷酸发生变化有关,从而就引起了人们考虑从基因的角度来治疗某些用常规方法无法治疗的疾病。基因治疗(genethrapy)是向靶细胞引入正常有功能的基因,以纠正或补偿致病基因所产生的缺陷,从而达到治疗疾病的目的,通常包括基因置换、基因修正、基因修饰、基因失活等。20世纪80年代初,Anderson首先阐述了基因治疗的概况;1990年美国国立卫生研究院的Blease等成功地进行了世界上首例临床基因治疗,即腺脱氨酶(ADA)缺陷病的人体基因治疗;1991年我国首例基因治疗B型血友病也获得成功。近年来,一领域的研究取得了重大进展,基因治疗作为安全新的疾病治疗手段,将在一定程度上改变人类疾病治疗的历史进程。纵观基因治疗的整过程,目的基因导入靶细胞并使之表达是其关键环节,因此介导的载体选择便显得格外有意义了。本文介绍了基因治疗的常用载体以及其最新的研究进展。 1 常用的基因治疗的方法 基因治疗常用方法有两种,即体内疗法(in vivo)和体外疗法(ex vivo)。体内疗法是将外源基因导入受体体内有关的器官组织和细胞内,以达到治疗目的,这是一种简便易行的方法,如肌肉注射、静脉注射、器官内灌输、皮下包埋等,但其缺点是基因转染率较低。研究和应用较多的还是体外疗法,即先在体外将外源基因导入载体细胞,然后将基因转染后的细胞回输给受者,使携有外源基因的载体细胞在体内表达治疗产物,以达到治疗目的。最常用的技术则有三种:(1)体外处理疗法:将有基因缺陷的体细胞取出后,引入正常的基因拷贝后再送回体内;(2)原位疗法:使用载体将目的基因直接导入靶细胞;(3)体内疗法:将基因载体注入血液,定向寻找靶细胞并将基因安全有效地导入。 2 基因 治疗常用的载体有效的基因治疗依赖于外源基因在受体中高效、稳定的表达,而这在很大程度上取决基因治疗所采用的载体系统。基因治疗载体可分两大类:病毒性载体[2]和非病毒性载体[3]。 2.1 病毒性载体病毒性载体如逆转录病毒retrovirus、腺病毒adenovirus、腺相关病毒、痘苗病毒、疱疹病毒等。逆转录病毒应用最早,研究也相当深入,目前仍被广泛应用。慢病毒lentivirus
基因治疗中的非病毒载体 周芬程时远* (湖北大学化学与材料科学学院武汉 430062) 摘要基因运送是基因治疗中非常关键的技术。作为运送工具,非病毒载体由于能避免病毒载体的安全性问题受到广泛关注。本文介绍了一些目前主要研究的非病毒载体体系,包括改性的天然高 分子和合成高分子。此外还介绍了非病毒载体应用所面临的挑战,通过比较希望能找出一些更好的应 用于基因治疗的载体系统。 关键词基因治疗运送载体非病毒载体细胞吸收 Non-viral Gene Vectors in Gene Therapy Zhou Fen, Cheng Shiyuan* (School of Chemistry and Materials Science, Hubei University, Wuhan 430062) Abstract Gene delivery is very important in gene therapy. The non-viral vectors have been paid more and more attention because they are more safe than virus as carriers. This review focus on the non-viral vectors developed recently, including natural and synthetic polymer, and the challenges met in the way, in search of more suitable vector systems for gene therapy. Key words Gene therapy, Delivery systems, Non-viral vectors, Cell uptake 人类基因组DNA序列工作框架图的完成,标志着功能基因组时代的到来。人类对自身基因的功能,特别是与疾病相关的基因的了解更加深入,这对基因治疗的研究将产生巨大的推动作用。1990年美国科学家成功地进行了ADA(腺苷脱氨酶)缺陷患者的人体基因治疗,我国也在1991年进行首例基因治疗B型血友病获得成功。目前基因治疗的范围已经从遗传病领域扩展到肿瘤、心血管疾病、神经系统疾病、传染病(包括AIDS)等领域。但无论基因治疗对人类健康的潜力如何,由于运送载体的局限性使得目前对疾病基因治疗的目标无法完美实现。因此,研究和开发新型有效的基因运送载体是众多研究人员及临床医生的关注热点。 目前进行研究的载体主要有两类:病毒载体和非病毒载体。病毒可以高效率地进入特定的细胞类型,复制所携带DNA并表达自身蛋白产生新的病毒粒子,因此首先被改造作为基因治疗的载体。据统计,目前已经采用基因治疗的病例中,约有80%所选用的是病毒载体,如逆转录病毒(retrovirus)、腺病毒(adenovirus)、单纯疱疹病毒(herpes simplex virus,HSV)、腺病毒相关病毒(adeno-associated virus,AA V)以及痘病毒(poxvirus)等。虽然病毒作为基因运送载体已经使用很多,但仍然存在着危险性,如免疫原性(immunogenicity)和病毒性重组(viral recombination)等安全性问题。1999年9月一名美国患者在腺病毒介导基因治疗的研究中不幸死亡,给以病毒载体为基础 周芬女,23岁,硕士生,现从事基因载体研究。*联系人,E-mail: scheng@https://www.doczj.com/doc/a412201023.html, 2005-03-17收稿,2005-06-20接受