
HTRF 技术介绍
快速、稳定、不需洗涤、操作简单、易于自动化和微型化。上述优势使得Cisbio 的HTRF 技术一直是药物研发领域的领先技术之一,并广泛用于信号转导研究和免疫检测。该技术已经在知名医药公司、生物技术公司和学术研究机构应用了15年以上。
HTRF (均相时间分辨荧光,Homogeneous Time-Resolved Fluorescence )是用来检测纯液相体系中待测物的一种常用方法。
该技术结合了荧光共振能量转移(FRET ,
Fluorescence Resonance Energy Transfer )
和时间分辨荧光 (TRF, Time-Resolved
Fluorescence))两种技术。这种结合将FRET
的均相实验方式和TRF 的低背景特点融合在一
起,使得HTRF 技术拥有如下优势:操作简单、
灵敏度高、通量大、实验数据稳定可靠、假阳
性率较低。HTRF 是基于TR-FRET 的化学技术,拥有与其它TR-FRET 技术相似的特征,包括使
用镧系元素(铕和铽),具有非常长的半衰期,很大的Stroke's shift (如图1所示,Eu 3+ Stroke’s shift > 300 nm )等。除此之外,它还有其独特的性质,从而与其它技术区分开来。这主要表现在HTRF 的镧系元素与络合的穴相结合,而不是像其它所有TR-FRET 技术使用螯合物。螯合物在溶液中是一种动态平衡,在特定条件下不稳定;而HTRF 中应用的穴与镧系元素是永久地嵌合,非常稳定,可耐受较宽的pH 范围、二价金属离子如Mn 2+等、螯合剂如EDTA 等。HTRF 的独特之处还包括对数据的专利的比值处理方法,其能校正样品基质不同等带来的干扰。 FRET 技术简介
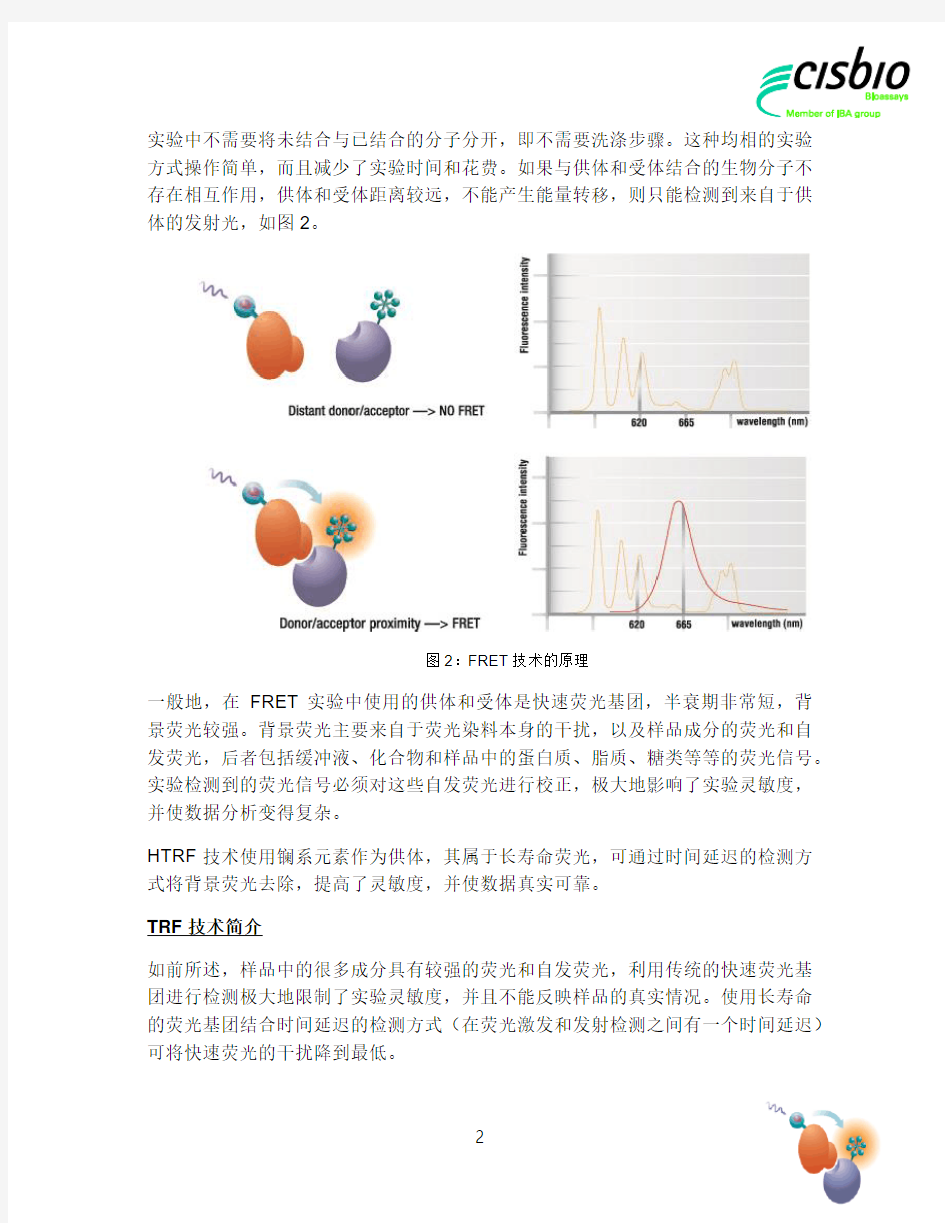
FRET 技术利用了两种荧光基团的能量转移,这两种荧光基团分别称为(能量)供体和(能量)受体,前者的发射光谱与后者的激发光谱重叠。供体被外来能源激发(例如闪光灯或激光),如果它与受体在足够近的距离之内,可以将能量共振转移到受体上。受体受到激发,发出特定波长的发射光。
将供体和受体分别与相互作用的两个生物分子结合,生物分子的结合可以将受体和供体拉到足够近的距离,产生能量转移。这时,我们可以检测到两个发射光,分别
为受体和供体的发射光。由于受体分子的发射光来自于能量转移,所以在
图1:铕穴状化合物的激发和发射光谱
实验中不需要将未结合与已结合的分子分开,即不需要洗涤步骤。这种均相的实验方式操作简单,而且减少了实验时间和花费。如果与供体和受体结合的生物分子不存在相互作用,供体和受体距离较远,不能产生能量转移,则只能检测到来自于供体的发射光,如图2。
一般地,在FRET 实验中使用的供体和受体是快速荧光基团,半衰期非常短,背景荧光较强。背景荧光主要来自于荧光染料本身的干扰,以及样品成分的荧光和自发荧光,后者包括缓冲液、化合物和样品中的蛋白质、脂质、糖类等等的荧光信号。实验检测到的荧光信号必须对这些自发荧光进行校正,极大地影响了实验灵敏度,并使数据分析变得复杂。
HTRF 技术使用镧系元素作为供体,其属于长寿命荧光,可通过时间延迟的检测方式将背景荧光去除,提高了灵敏度,并使数据真实可靠。
TRF 技术简介
如前所述,样品中的很多成分具有较强的荧光和自发荧光,利用传统的快速荧光基团进行检测极大地限制了实验灵敏度,并且不能反映样品的真实情况。使用长寿命的荧光基团结合时间延迟的检测方式(在荧光激发和发射检测之间有一个时间延迟)可将快速荧光的干扰降到最低。
图2:FRET 技术的原理
时间延迟的检测方式,是通过时间分辨荧
光(TRF )技术实现的,其利用稀土元素中
镧系元素的独特性质。在TRF 中常用的镧
系元素是钐(Sm )、铕(Eu )、铽(Tb )和
镝(Dy )。与传统荧光基团相比,它们具有
大的Stoke's shifts 和非常长的发射半衰期(从微秒到毫秒)。镧系元素的Stoke's
shifts 通常为300 nm ,检测的发射光中没
有来自于激发波长的干扰。HTRF 技术中镧系元素的半衰期大于1毫秒,与普通荧光纳
秒级的半衰期相差6个数量级。当延迟50微秒读数时,普通荧光的信号近似于零,镧系元素的信号改变很小。所以,HTRF 技术的数据真实可靠,假阳性低。
为了能够成功应用于生物学检测中,稀土元素复合物应该具有特定的性质,包括较强的稳定性、较高的发射光产率,并且能够与生物分子连接。除此之外,当直接在生物溶液中检测时,能够耐受荧光淬灭就显得尤为重要。稀土元素螯合物在特定条件下稳定性较差,并且有的化合物与螯合物活性基团发生反应,产生竞争,增加了其不稳定因素。HTRF 技术应用穴状化合物,整个体系非常稳定,没有光漂白现象,可在至少48小时内反复多次检测。
HTRF 技术的能量供体(Donor )和能量受体(Acceptor )
HTRF 的供体是铕穴状化合物(Eu 3+ cryptate )或Lumi4?铽穴状化合物(Tb 2+ cryptate ),后者是近年与Lumiphore 公司合作的结果,激发效率更高。两者的能量受体(Acceptor )均可为XL665和d2。XL665和d2激发波长为620 nm ,发射波长为665 nm ,位于近红外光区,进一步降低了样品本身对实验的影响(生物学样品很少在近红外光区有自发荧光)。对于铽穴状化合物来说,其受体也可以是Fluorescin 、GFP 等发绿色荧光的分子,所以可以进行双标记测量。XL665是改良过的别藻蓝蛋白(APC ),其将APC 的亚基偶联,使其不能解离,增加了稳定性。d2是第二代受体,光谱学特征与XL665相同,但是分子量较小,约为1KD ,可减少空间位阻对实验的可能影响。
当由于生物分子相互作用导致两个荧光基团接近时,在激发时被穴状化合物捕获的能量部分释放,发射波长为620 nm ;另一部分能量共振转移到XL665或d2,使其发光,发射波长为665 nm 。665 nm 的发射光仅仅由穴状化合物作为能量供体的FRET 产生。所以,当生物分子相互作用时,有两个激发光620 nm 和665 nm ;
图3:TRF 技术的原理 图3:TRF 技术的原理
图5:铕穴状化合物的结构 专利号:US Patent US 5,527,684由于在该结构上的贡献,Prof. J.M. Lehn’s 在1987年获得了诺贝尔奖。 当不存在相互作用时,只有620nm 一个激发光(见图2)。
HTRF 的数据分析
HTRF 有来自于能量供体和能量受体的两个发射光,可采用Cisbio 专利的比值法来分析数据,从而去除由于溶液通透率、细胞大小、细胞数量等不同引起的误差。如图4 所示,溶液通透率不同,分别为100%通透和50%通透,由此导致对同样样品信号值的不同,后者是前者的一半。这种不同是由于溶液对光的吸收程度不同引起的,并不是样品的不同所致。如果我们不用比值来处理数据,仅仅看信号值,很可能得出错误的结论。
穴状化合物简介
穴状化合物的形成是将一个阳离子纳入到一个立体笼中。
笼能收集光然后将能量转移到核心的镧系元素。大环的性
质有利于跟镧系元素紧密相连,这种不可破的连接会形成
异常稳固的复合体。穴结构能耐受一些特殊的实验条件如
二价阳离子(Mg 2+和Mn 2+等)、螯合物(EDTA )、极
性较强的溶剂或者较高的温度。从HTRF 能应用到临床
诊断(TRACE?技术和Kryptor ?工作站技术)就能看出它
也适用于浓度高的血清(50%)。在读板前或者孵育时加
入氟离子能增强该化合物的抗干扰性。 穴没有光漂白性,多次读数后信号没有损失,因此能按照需要的次数去读,所以可以进行动力学检测。 HTRF 技术的优势
图4:HTRF 比值法数据分析可去除样品干扰
?操作非常简单实验过程不需要繁琐的洗板,只需要混匀孵育后检测
?体系非常稳定穴状化合物非常稳定,可耐受较宽的pH范围、二价金属离子、螯合物等,并且可以在至少48小时内反复多次检测
?数据真实可靠背景低,受到样品的干扰非常少,假阳性假阴性均低,尤其可去除由于天热产物自发荧光等引起的干扰
?应用灵活多样 HTRF可以看作是不需洗涤的ELISA,应用范围很宽
?易于实现微型化,通量高
HTRF的应用
HTRF技术从产生以来,已经被广泛应用于免疫检测和细胞信号转导的研究,在药物研发中被应用于不同的阶段,从实验方法的建立、高通量筛选(HTS),lead
到hit,一直到临床前研究。HTRF技术非常灵敏而且稳定,可以进行细胞实验和
生化实验,并且可以使用384和1536孔板。HTRF的很多应用是基于抗体的检测,包括GPCR(受体配体结合,受体二聚化,cAMP 和IP-1 的检测,以及磷酸化
ERK和AKT的定量)、激酶、细胞因子和生物标志物、生物过程(治疗性抗体和
蛋白药物的生产)等,以及蛋白和蛋白、蛋白和多肽、蛋白和DNA/RNA相互作用的研究。HTRF具有与ELISA同等的检测范围和检测极限,但是它不需要洗板,
可以极大地减少实验时间,所以HTRF技术可以取代大部分ELISA实验,为均相ELISA。图6对HTRF的应用领域作了一个概括。
图6: HTRF的应用领域
高通量药物筛选平台成为药物筛选者首选,多靶点美罗凯从中脱颖而出 众所周知,创新药物的研究在于药物的发现。但是,药物的发现则是不可控的过程,具有很大的随机性。而药物筛选是指对可能作为药用的物质进行初步药理活性的检测和试验。相比之下,偶然发现并不可靠,药物筛选才是药物研究中极其重要的部分。 从一般药物筛选到高通量药物筛选 随着基因组,合成化学的高通量方法的出现,药物筛选者面临着愈来愈多的新靶标或潜在的有效成分。而传统的药理实验方法,耗时长,劳动强度大,不能适应大量样品的同时筛选,已经无法跟上时代的节奏。 在医学及其相关学科的发展下,大量分子细胞水平的药物筛选模型不断出现,并应用到药物筛选和研究中,使细胞分子筛选方法逐渐实现一物多筛和多物一筛,再配合先进的技术最后形成了高通量药物筛选技术。 高通量药物筛选,可以在同一时间对数以千万的样品进行检测,并以相应的数据库支持整体系运转的技术体系。它的实现,大幅度地缩短了新药发现的时间,提高筛选频率,增加高特异性高生物活性药物的发现率。
美罗凯——抗肿瘤高通量药物筛选平台筛选出的多靶点抗癌产品 在癌症治疗上,中药在近些年来备受推崇,目前有多种植物的抗癌功效已成为国际研究热点。但是,中药单纯地通过熬制,其有效成分并不能完全溶解到药汤中,也不能很好地被人体吸收,抗肿瘤效果微乎其微。只有对中药通过精确的分离和提纯,才能使其真正发挥作用。高通量筛选技术正是中药现代化研究的尝试的技术保障。 拥有世界一流的中药活性组分及单体分离技术的美国克利夫兰癌症研究中心,以HER2、EGFR、STAT3、NF-kB、p53 和Wnt等信号转到关键分子为切入点,建立用于肺癌、肝癌、乳腺癌、前列腺癌及白血病等抗肿瘤药物的高通量药物筛选平台。 该平台筛选了本草纲目的400余种明确其有抗肿瘤功效的天然植物后,得到了一种天然多靶点抗肿瘤天然单体MCBM即美罗凯的主要成分。而MCBM是由紫苏、耳叶牛皮、杜仲雄花、狭基线纹香茶菜、青钱柳叶、茶树花等多种抗癌植物的提取物和纯净水共同组成。 MCBM通过作用于肿瘤信号转到网络中的多个靶点,把几种导致肿瘤的信号及时关闭,扼断肿瘤激活基因,从根部阻断肿瘤细胞传到信号。目前,美罗凯已经在临床上广泛运用,在肺癌的一直效果上尤为显著。
高通量筛选技术简要综述 药物高通量筛选(HTS)技术,是发现创新药物的重要技术手段之一,已受到药学同行的极大关注。现将近年来药物高通量筛选技术的研究进展做一综述。 发展中的高通量筛选技术 高通量筛选的组合模式近年来,由于自动化技术特别是机器人的应用,在新药研究中出现了高通量筛选技术,该技术将化学、基因组研究、生物信息,以及自动化仪器等先进技术,有机组合成一个高程序、高自动化的新模式,从而创造了发现新药的新程序。由于该技术具有快速、高效等特点,因而成为新药发现的主要手段。 高通量筛选的实验方法分子水平和细胞水平的实验方法(或称筛选模型)是实现药物高通量筛选的技术基础。由于药物高通量筛选要求同时处理大量样品,实验体系必须微量化,而这些微量化的实验方法应根据新的科研成果来建立。第四军医大学周四元研究认为,药物高通量筛选模型的实验方法,根据其生物学特点,可分为以下几类:受体结合分析法;酶活性测定法;细胞分子测定法;细胞活性测定法;代谢物质测定法;基因产物测定法。这些实验方法,均已广泛用于药物高通量筛选中。 高通量筛选的特色效用高通量筛选技术是将多种技术方法有机结合而形成的一种新技术体系,它以微板形式作为实验工具载体,以自动化操作系统执行实验过程,以灵敏快速的检测仪器采集实验数据,以计算机对数以千计的样品数据进行分析处理,从而得出科学准确的实验结果和特色效用。英国学者AlanD研究提示,一个实验室采用传统的方法,借助20余种药物作用靶位,1年内仅能筛选75000个样品;1997年高通量筛选技术发展初期,采用100余种靶位,每年可筛选100万个样品;1999年高通量筛选技术进一步完善后,每天的筛选量就高达10 万种化合物。 高通量筛选技术采用的先进检测方法 光学测定技术:近年来,美、英两国研究人员在高通量筛选检测中,努力进行了光学测定方法的研究,建立了大量的非同位素标记测定法,如用分光光度检测法筛选蛋白酪氨酸激酶抑制剂、组织纤溶酶原激活剂等,均获得成功。
蛋白质组学与高通量药物筛选 作者:王海娣, 杜冠华, 刘艾林 作者单位:中国医学科学院北京协和医学院,药物研究所国家药物筛选中心,北京 100050 本文读者也读过(10条) 1.陈伟.王莉莉走在药物发现前沿的高内涵药物筛选[期刊论文]-国外医学(药学分册)2007,34(3) 2.吕秋军.徐天昊.吴祖泽药物筛选技术的研究进展[期刊论文]-国外医学(药学分册)2003,30(3) 3.张莉.杜冠华.ZHANG Li.DU Guan-hua高内涵药物筛选方法的研究及应用[期刊论文]-药学学报2005,40(6) 4.杨根庆.廖飞药靶发现和药物筛选[期刊论文]-重庆医科大学学报2007,32(z1) 5.吴根福.WU Gen-fu以RNA为靶标的药物筛选新技术[期刊论文]-药学学报2005,40(12) 6.张琪药物筛选技术的研究与应用[期刊论文]-江苏科技信息2007(8) 7.徐志红.蒋志胜药物筛选新方法--高通量筛选[期刊论文]-生物学通报2003,38(3) 8.杜冠华.张莉.方莲华.刘艾林.王月华高通量药物筛选研究进展[会议论文]-2004 9.徐培平.朱宇同.张美义.朱元晓.Xu Peiping.Zhu Yutong.Zhang Meiyi.Zhu Yuanxiao多目标优化技术在中药复方药物筛选及组方优化中的应用[期刊论文]-世界科学技术-中医药现代化2005,7(2) 10.田光辉.刘存芳.辜天琪高通量药物筛选在新药开发中的应用[期刊论文]-内江科技2009,30(1) 引用本文格式:王海娣.杜冠华.刘艾林蛋白质组学与高通量药物筛选[会议论文] 2008
AlphaScreen技术在高通量筛选研究的现况分析 本文介绍了AlphaScreen和AlphaLISA在基础药物研发研究和高通量筛选(HTS)方面的技术现状。AlphaScreen用于HTS 第二信使检测 Gs偶联的GPCR被激活后,可激活细胞内的cAMP 释放,并引起下游的信号转导。AlphaScreen技术用于cAMP检测采用了竞争性实验(Competition Assay),示意图如下: 反应体系内供体珠包被了亲和素,用于偶联上生物素化的cAMP;受体珠表面为anti-cAMP 抗体;通过生物素化的cAMP可将供体珠和受体珠拉近,单体氧分子得以传递至受体珠,发生化学反应,产生光信号。 将细胞裂解液加入反应体系内,胞内含有的游离cAMP同生物素化的cAMP竞争性结合抗体,体系产生的光信号降低。 蛋白激酶检测 蛋白激酶是一类磷酸转移酶,将ATP的磷酸基团转移至靶标底物。蛋白激酶主要分为2大家族,其中一族将磷酸基团转移至蛋白的酪氨酸残基上,称为酪氨酸激酶;另一族将磷酸基团转移至蛋白的丝氨酸/苏氨酸残基上,称为丝氨酸/苏氨酸激酶。 针对酪氨酸激酶检测,AlphaScreen利用了酪氨酸磷酸化抗体,这些特异性的抗体已偶联于受体珠表面。作为激酶作用的蛋白底物,已经过生物素化处理,能连接于供体珠表面。 激酶有活性状态下,利用蛋白底物的磷酸化基团能将供体珠与受体珠的距离拉近,单体氧分子得以传递至受体珠,发生化学反应,产生光信号。 通常意义上,丝氨酸/苏氨酸激酶特异性高于酪氨酸激酶,因此进行检测时,对于抗体的特异性要求更高。在这里,受体珠表面包被上Protein A(Protein A是一种分离自金黄色葡萄球菌的细胞壁蛋白,主要通过Fc片断结合哺乳动物IgG),用于偶联鼠源或兔源磷酸化抗体;供体珠可以通过表面包被的亲和素偶联生物素化的磷酸化多肽或者是通过表面包被的谷胱甘肽(GSH)偶联GST标签蛋白底物。一旦多肽或蛋白底物被磷酸化,将拉近抗磷酸化抗体,产生光信号。 常见的激酶检测方法都需要特异性的抗体用于检测磷酸化多肽,新近又有一些方法采用Lewis 金属螯合物用于螯合底物上的磷酸基团。在这里,磷酸化的激酶底物可以通过生物素化或是加上GST标签而偶联在供体珠上,供体珠表面包被了Lewis金属螯合物。一旦磷酸化的底物被Lewis螯合将拉近供体珠和受
HTRF 技术介绍 快速、稳定、不需洗涤、操作简单、易于自动化和微型化。上述优势使得Cisbio 的HTRF 技术一直是药物研发领域的领先技术之一,并广泛用于信号转导研究和免疫检测。该技术已经在知名医药公司、生物技术公司和学术研究机构应用了15年以上。 HTRF (均相时间分辨荧光,Homogeneous Time-Resolved Fluorescence )是用来检测纯液相体系中待测物的一种常用方法。 该技术结合了荧光共振能量转移(FRET , Fluorescence Resonance Energy Transfer ) 和时间分辨荧光 (TRF, Time-Resolved Fluorescence))两种技术。这种结合将FRET 的均相实验方式和TRF 的低背景特点融合在一 起,使得HTRF 技术拥有如下优势:操作简单、 灵敏度高、通量大、实验数据稳定可靠、假阳 性率较低。HTRF 是基于TR-FRET 的化学技术,拥有与其它TR-FRET 技术相似的特征,包括使 用镧系元素(铕和铽),具有非常长的半衰期,很大的Stroke's shift (如图1所示,Eu 3+ Stroke’s shift > 300 nm )等。除此之外,它还有其独特的性质,从而与其它技术区分开来。这主要表现在HTRF 的镧系元素与络合的穴相结合,而不是像其它所有TR-FRET 技术使用螯合物。螯合物在溶液中是一种动态平衡,在特定条件下不稳定;而HTRF 中应用的穴与镧系元素是永久地嵌合,非常稳定,可耐受较宽的pH 范围、二价金属离子如Mn 2+等、螯合剂如EDTA 等。HTRF 的独特之处还包括对数据的专利的比值处理方法,其能校正样品基质不同等带来的干扰。 FRET 技术简介 FRET 技术利用了两种荧光基团的能量转移,这两种荧光基团分别称为(能量)供体和(能量)受体,前者的发射光谱与后者的激发光谱重叠。供体被外来能源激发(例如闪光灯或激光),如果它与受体在足够近的距离之内,可以将能量共振转移到受体上。受体受到激发,发出特定波长的发射光。 将供体和受体分别与相互作用的两个生物分子结合,生物分子的结合可以将受体和供体拉到足够近的距离,产生能量转移。这时,我们可以检测到两个发射光,分别 为受体和供体的发射光。由于受体分子的发射光来自于能量转移,所以在 图1:铕穴状化合物的激发和发射光谱
什么是高通量筛选技术 高通量筛选(high—throughout screening)是近年来迅速发展起来的药物筛选技术。高通量药物筛选就是应用分子细胞水平的药物活性评价方法(模型),通过自动化手段,对大量样品进行生物活性或药理作用的检测,发现新药的过程。高通量药物筛选的规模至少为每日筛选数千个样品。同时它通过运用基因科学、蛋白质科学、分子药理学、细胞药理学、微电子技术等多学科理论和技术,以及与疾病相关的酶和受体为作用靶点。对天然或合成化合物进行活性测试,并在此基础上进行筛选。高通量筛选具有快速、高效、经济、高特异性等优点,其中所用的样品量甚少的特点尤其适用于天然化合物的活性筛选。 高通量筛选可以根据待测样品的种类分为非细胞相筛选、细胞相筛选、生物表型筛选。其中非细胞相筛选常用的方法有Microbead—FCM 联合筛选、放射免疫性检测、荧光检测(FA)、闪烁接近检测、酶连接的免疫吸附检测(ELISA)等;细胞相筛选常用的方法有选择性杀死策略、离子通道检测、报告基因检测等;生物表型筛选可以有目的敲除或屏蔽掉某些未知功能的基因等等。 高通量筛选在抗病毒药物筛选中有很大的应用,介绍一些抗病毒药物筛选方法:利用亲合闪烁分析对HIV逆转录酶活性测定、HCV NS5B 活性测定、HCV NS3(nonstructural protein 3,NS3)解旋酶活性的测定;利用荧光共振能量转移对SARS—CoV病毒3CL 蛋白酶活性测定;
抗病毒药物的其它高通量筛选模型如病毒与宿丰细胞结合的细 胞模型、HCV NS3/4A蛋白酶活性测定、HIV整合酶(integrase,IN)活性的测定等等。 高通量筛选体内药动学模型中传统的药动学研究以测定药物在 体内的浓度及分布为主要手段。高通量筛选体外药动学模型中常用的筛选模型建立在组织、器官水平和细胞及亚细胞水平,观察的是药物与分子靶点的相互作用,能够直接体现药物的基本作用机制。高通量筛选的体内和体外筛选模型是互为补充、相辅相成的。体内药动学筛选模型可以很好地预测药物在体内的吸收、分布、代谢等药动学性质,但存在样品需求量大、筛选费用高、较难达到高通量筛选水平等缺陷。体外筛选模型可以对大量的候选化合物进行筛选,但它却忽略了生物的整体性,有时用其预测体内药动学参数并不一定理想,必须借助 于体内筛选模型。 高通量筛选技术极大地提高了对目标分子、活性物质以及前导药物的筛选速度,当前HTS技术进一步向着高内涵筛选(HCS)技术发展。HCS技术是生物学、分析软件、自动化控制以及显微观测技术最新发展的综合运用,HCS的出现彻底改变了以细胞为基础的靶目标的确认、二次筛选、前导化合物优化和结构活性分析的传统方法引。随着科技的发展,HTS/HCS技术将不断向着微型化、自动化、高效化、低廉化和微量化方向发展。
高通量药物筛选一,概念高通量筛选(High throughput screening,HTS)技术是指以分子水平和细胞水平的实验方法为基础,以微板形式作为实验工具载体,以自动化操作系统执行试验过程,以灵敏快速的检测仪器采集实验结果数据,以计算机对实验数据进行分析处理,同一时间对数以千万样品检测,并以相应的数据库支持整体系运转的技术体系。二. 高通量筛选技术体系的组成 1. 化合物样品库化合物样品主要有人工合成和从天然产物中分离纯化两个来源。其中,人工合成又可常规化学合成和组合化学合成两种方法。 2.自动化的操作系统自动化操作系统利用计算机通过操作软件控制整个实验过程。操作软件采用实物图像代表实验用具,简洁明了的图示代表机器的动作。自动化操作系统的工作能力取决于系统的组分,根据需要可配置加样、冲洗、温解、离心等设备以进行相应的工作。 3.高灵敏度的检测系统检测系统一般采用液闪计数器、化学发光检测计数器、宽谱带分光光度仪、荧光光度仪等。 4.数据库管理系统数据库管理系统承担4个方面的功能: 样品库的管理功能;生物活性信息的管理功能; 对高通量药物筛选的服务功能; 药物设计与药物发现功能。三. 高通量筛选模型常用的筛选模型都在分子水平和细胞水平,观察的是药物与分子靶点的相互作用,能够直接认识药物的基本作用机制。 1.分子水平的药物筛选模型:受体筛选模型;酶筛选模型;离子通道筛选模型 1.1受体筛选模型:指受体与放射性配体结合模型。以受体为作用靶的筛选方法,包括检测功能反应、第二信使生成和标记配体与受体相互作用等不同类型。 1.2酶筛选模型:观察药物对酶活性的影响。根据酶的特点,酶的反应底物,产物都可以作为检测指标,并由此确定反应速度。典型的酶筛选包括1) 适当缓冲液中孵化;(2)控制反应速度,如:温度,缓冲液的pH值和酶的浓度等;(3)单时间点数器, 需测量产物的增加和底物的减少。 1.3离子通道筛选模型: (1)贝类动物毒素的高通量筛选,其作用靶为Na+通道上的蛤蚌毒素结合位点,用放射性配体进行竞争性结合试验考察受试样品。(2)用酵母双杂交的方法高通量筛选干扰N型钙通道β3亚单位与α1β亚单位相互作用的小分子,寻找新型钙通道拮抗剂。 2.细胞水平药物筛选模型观察被筛样品对细胞的作用,但不能反映药物作用的具体途径和靶标,仅反映药物对细胞生长等过程的综合作用。包括: 内皮细胞激活; 细胞凋亡; 抗肿瘤活性; 转录调控检测; 信号转导通路; 细菌蛋白分泌; 细菌生长。高通量筛选技术与传统的药物筛选方法相比有以下几个优点:反应体积小;自动化;灵敏快速检测;高度特异性。但是,高通量筛选作为药物筛选的方法,并不是一种万能的手段,特别是在中药研究方面,其局限性也是十分明显的。首先,高通量筛选所采用的主要是分子、细胞水平的体外实验模型,因此任何模型都不可能充分反映药物的全面药理作用;其次,用于高通量筛选的模型是有限的和不断发展的,要建立反映机体全部生理机能或药物对整个机体作用的理想模型,也是不现实的。但我们应该相信,随着对高通量筛选研究的不断深入,随着对筛选模型的评价标准、新的药物作用靶点的发现以及筛选模型的新颖性和实用性的统一,高通量筛选技术必将在未来的药物研究中发挥越来越重要的作用。高通量筛选技术采用的先进检测方法光学测定技术。近年来,美、英两国研究人员在高通量筛选检测中,努力进行了光学测定方法的研究,建立了大量的非同位素标记测定法,如用分光光度检测法筛选蛋白酪氨酸激酶抑制剂、组织纤溶酶原激活剂等,均获得成功。放射性检测技术。美国学者GanieSM在高通量药物筛选研究中,应用放射性测定法,特别是亲和闪烁(SPA)检测方法,使在96孔板上进行的样本量实验得到发展。该方法灵敏度高,特异性强,促进了高通量药物筛选的实现,但存在环境污染问题。荧光检测技术。美国学者GiulianokA研究认为,采用FLIPR(fluor ometricimaging readet)荧光检测法,可在短时间内同时测定荧光的强度和变化,对测定细胞内钙离子流及测定细胞内pH和细胞内钠离子流等,是非常理想的一种高效检测方法。多功能微板检测系统。由西安交通大学药学院研制的1536孔板高通量多功能微板检测系统,是目前国际上先进的高通量检测系统,它可使筛选量进一步提高,现已在该院投入使用。1.基
高通量筛选技术 高通量筛选(high—throughout screening)是近年来迅速发展起来的药物筛选技术。高通量药物筛选就是应用分子细胞水平的药物活性评价方法(模型),通过自动化手段,对大量样品进行生物活性或药理作用的检测,发现新药的过程。高通量药物筛选的规模至少为每日筛选数千个样品。同时它通过运用基因科学、蛋白质科学、分子药理学、细胞药理学、微电子技术等多学科理论和技术,以及与疾病相关的酶和受体为作用靶点。对天然或合成化合物进行活性测试,并在此基础上进行筛选。高通量筛选具有快速、高效、经济、高特异性等优点,其中所用的样品量甚少的特点尤其适用于天然化合物的活性筛选。 高通量筛选可以根据待测样品的种类分为非细胞相筛选、细胞相筛选、生物表型筛选。其中非细胞相筛选常用的方法有Microbead—FCM 联合筛选、放射免疫性检测、荧光检测(FA)、闪烁接近检测、酶连接的免疫吸附检测(ELISA)等;细胞相筛选常用的方法有选择性杀死策略、离子通道检测、报告基因检测等;生物表型筛选可以有目的敲除或屏蔽掉某些未知功能的基因等等。 高通量筛选在抗病毒药物筛选中有很大的应用,介绍一些抗病毒药物筛选方法:利用亲合闪烁分析对HIV逆转录酶活性测定、HCV NS5B 活性测定、HCV NS3(nonstructural protein 3,NS3)解旋酶活性的测定;利用荧光共振能量转移对SARS—CoV病毒3CL 蛋白酶活性测定;
抗病毒药物的其它高通量筛选模型如病毒与宿丰细胞结合的细 胞模型、HCV NS3/4A蛋白酶活性测定、HIV整合酶(integrase,IN)活性的测定等等。 高通量筛选体内药动学模型中传统的药动学研究以测定药物在 体内的浓度及分布为主要手段。高通量筛选体外药动学模型中常用的筛选模型建立在组织、器官水平和细胞及亚细胞水平,观察的是药物与分子靶点的相互作用,能够直接体现药物的基本作用机制。高通量筛选的体内和体外筛选模型是互为补充、相辅相成的。体内药动学筛选模型可以很好地预测药物在体内的吸收、分布、代谢等药动学性质,但存在样品需求量大、筛选费用高、较难达到高通量筛选水平等缺陷。体外筛选模型可以对大量的候选化合物进行筛选,但它却忽略了生物的整体性,有时用其预测体内药动学参数并不一定理想,必须借助于体内筛选模型。 高通量筛选技术极大地提高了对目标分子、活性物质以及前导药物的筛选速度,当前HTS技术进一步向着高内涵筛选(HCS)技术发展。HCS技术是生物学、分析软件、自动化控制以及显微观测技术最新发展的综合运用,HCS的出现彻底改变了以细胞为基础的靶目标的确认、二次筛选、前导化合物优化和结构活性分析的传统方法引。随着科技的发展,HTS/HCS技术将不断向着微型化、自动化、高效化、低廉化和微量化方向发展。
生药活性成分的高通量筛选技术 高通量筛选(High throughput screening,HTS)技术是20世纪80年代后期发展起来的一种药物筛选新技术。它集计算机控制、自动化操作、高灵敏度检测、数据结果自动采集和处理于一体,实现了药物筛选的快速、微量、灵敏和大规律,日筛选量达到数万甚至数十万样品次,是新药发现技术和方法的一大进步。 传统的药物筛选方法是采用药理学的实验方法,通过体内、体外的多种实验方法,评价药用样品的药理活性。但是,由于传统的药理实验方法需要消耗大量样品,使用大量实验动物,参加实验的技术人员具有较熟练的操作技能,而且筛选样品量有限,劳动强度大,不能适应大量样品的同时筛选。高通量药物筛选是在传统的筛选技术基础上,应用先进的分子生物学、细胞生物学、计算机、自动化控制等高新技术,建立的一套更适合于药物筛选的技术体系。 本文试对高通量筛选技术的基本原理及其在生药活性成分筛选中的应用做一简单论述。 1.基本原理 高通量药物筛选技术是将多种技术方法有机结合而形成的新的技术体系,它以分子水平和细胞水平的实验方法为基础,以微板形式作为实验工具载体,以自动化操作系统执行实验过程,以灵敏快速的检测仪器采集实验数据,以计算机对实验获得的数据进行分析处理。它的正常开展需要有一个高容量的化合物库、自动化的操作系统、高灵敏度的检测系统、高效率的数据处理系统以及高特异性的药物筛选模型。 1.1 化合物样品库 高通量筛选是一种利用已有的化合物进行的体外随机筛选。因此通过高通量药物筛选发现先导化合物(leading compounds)的有效性取决于化合物样品库中化合物的数量及其质量。化合物样品的数量是指不同样品的数量。化合物样品的质量主要由化合物结构的多样性决定的。许多活性反应基团(reactive groups)使初筛的假阳性大量增加,剔除这些化合物可以提高化合物样品库的质量。 化合物样品主要有人工合成和从天然产物中分离纯化两个来源。 人工合成又可分为常规化学合成和组合化学合成两种方法。采用常规化学合成的纯化合物一直是国外制药企业建立化合物样品库的主要来源。它们通过长年积累的化合物建立化合物样品库,通过购买和化合物交流使化合物样品库的数量和质量大幅度提高。 组合化学(combinatorial chemistry)的出现为大量增加化合物的数量提供另外一种来源。组合化学的基本原理是采用适当的化学方法,在特定的分子母核上加入不同的基团,在同样条件下,产生大量的新化合物。这种方法在化合物的结构改造和优化方面已经表现出强大的优势。但是,由于该方法是基于母核结构的改造,因此产生的大量化合物在结构多样性方面尚有极大的不足。解决组合化学产物结构多样性的问题,已经成为化学研究人员的研究课题。 从天然产物中分离出来的化合物,母核结构和活性基团是长期的自然选择形成的,它们通过高通量筛选所表现出来的生物活性在药物发现中具有人工合成化合物所不能比拟的优势。因此,增加样品库中具结构多样性的天然化合物及其衍生物是提高样品库质量的一个重要途径。跨国制药企业为了增加高通量筛选的阳性率,已经或正在寻求助买我国的天然产物单体。 1.2 自动操作系统 高通量药物筛选每天要对数千化台物样品进行检测,工作枯燥、步骤单一,人工操作容易疲劳、出错。自动化操作系统采用微孔板作为反应容器,具有固定的分布模式(format);不同的微孔板通过条形码加以标记。自动化操作系统通过光电阅读器对特定的微孔板上的特定位置进行操作,并将操作结果及相关数据存贮在计算机内,使筛选结果准确,实验过程快速。
高通量筛选简介 高通量筛选(High throughput screening,HTS)技术是指以分子水平和细胞水平的实验方法为基础,以微板形式作为实验工具载体,以自动化操作系统执行试验过程,以灵敏快速的检测仪器采集实验结果数据,以计算机分析处理实验数据,在同一时间检测数以千万的样品,并以得到的相应数据库支持运转的技术体系,它具有微量、快速、灵敏和准确等特点。简言之就是可以通过一次实验获得大量的信息,并从中找到有价值的信息。高通量筛选技术 高通量筛选特点 高通量筛选时每天要对数以千万的样品进行检测,工作枯燥,步骤单一,操作人员容易疲劳、出错。自动化操作系统由计算机及其操作软件、自动化加样设备、温孵离心设备和堆栈4个部分组成。自动化操作系统代替人工操作显然有诸多优势,它利用计算机通过操作软件控制整个实验过程,编程过程简洁明了。高通量筛选的应用 高通量筛选技术将化学、基因组研究、生物信息,以及自动化仪器等先进技术,有机组合成一个高程序、高自动化的新模式,并以此为模型创造了发现新药的新程序。高通量筛选技术的研究 发展中的高通量筛选技术 高通量筛选的实验方法高通量筛选的实验方法分子水平和细胞水平的实验方法(或称筛选模型)是实现药物高通量筛选的技术基础。由于药物高通量筛选要求同时处理大量样品,实验体系必须微量化,而这些微量化的实验方法应根据新的科研成果来建立。第四军医大学周四元研究认为,药物高通量筛选模型的实验方法,根据其生物学特点,可分为以下几类:受体结合分析法;酶活性测定法;细胞分子测定法;细胞活性测定法;代谢物质测定法;基因产物测定法。这些实验方法,均已广泛用于药物高通量筛选中。高通量筛选的特色效用高通量筛选的特色效用高通量筛选技术是将多种技术方法有机结合而形成的一种新技术体系,它以微板形式作为实验工具载体,以自动化操作系统执行实验过程,以灵敏快速的检测仪器采集实验数据,以计算机对数以千计的样品数据进行分析处理,从而得出科学准确的实验结果和特色效用。英国学者AlanD研究提示,一个实验室采用传统的方法,借助20余种药物作用靶位,1年内仅能筛选75000个样品;1997年高通量筛选技术发展初期,采用100余种靶位,每年可筛选100万个样品;1999年高通量筛选技术进一步完善后,每天的筛选量就高达10万种化合物。高通量筛选技术检测方法光学测定技术近年来,美、英两国研究人员在高通量筛选检测中,努力进行了光学测定方法的研究,建立了大量的非同位素标记测定法,如用分光光度检测法筛选蛋白酪氨酸激酶抑制剂、组织纤溶酶原激活剂等,均获得成功。放射性检测技术美国学者GanieSM在高通量药物筛选研究中,应用放射性测定法,特别是亲和闪烁(SPA)检测方法,使在96孔板上进行的样本量实验得到发展。该方法灵敏度高,特异性强,促进了高通量药物筛选的实现,但存在环境污染问题。荧光检测技术美国学者GiulianokA研究认为,采用FLIPR(fluorometricimagingreadet)荧光检测法,可在短时间内同时测定荧光的强度和变化,对测定细胞内钙离子流及测定细胞内pH和细胞内钠离子流等,是非常理想的一种高效检测方法。多功能微板检测系统由西安交通大学药学院研制的1536孔板高通量多功能微板检测系统,是目前国际上先进的高通量检测系统,它可使筛选量进一步提高,现已在该院投入使用。我国高通量筛选技术的进展
什麼是高通量藥物篩選技術 現代藥品開發是一個非常複雜以及多科目牽涉的過程,其活動核心是辨別分子標靶( 研究對象) 的各類生物活性化合物。高通量藥物篩選技術越來越受到重視,它是結合藥理實驗、樣品管理、高靈敏度檢測以及數據採集和處理的一套自動化操作系統,確保能夠同時進行大量化合物檢索。在生物機制、細胞功能和基因研究方面,早已被廣泛應用,能夠解構有關化學組成與生物活動之間的關係。 在競爭激烈的藥業界,由藥物開發至臨床測試的時間越來越緊迫,傳統的藥物研究方法,即通過醫學方法和實驗動物進行藥物篩選,已不能滿足現代製藥的時間表。高通量藥物篩選技術運用實驗室自動化系統,搜集大量藥理學數據,例如,酵素活動,免疫分析(ELISA)以及生物活動幅度等,並整合成為一個龐大化學資料庫。 依據化學資料庫與自動化生物檢定方式,系統可於二十四小時內合成及測試過百甚至千種化合物。透過這套篩選技術,研究員可快捷而有效地認證一些具有特定生物活性的化合物、抗體或基因。因此,大大地增加藥品開發的成功率,並節省時間及成本。更重要的是,這套龐大的細胞生物及化學資料庫,可大大提高有關藥物臨床效用的預測。 頁頂利用高通量藥物篩選技術發展西藥 篩選新型藥品包括三大要素:生物標靶( 研究對象)、化合物及生物檢定法。由於基因研究及組合化學的發展,可供篩選的生物標靶和化合物已使一般生物檢定法不勝負苛。因此研究員專注於研發各種檢定方法,目的是為了增加篩選量,減少所需樣本量和增強檢測各項生物現象的靈敏度。 在50、60 年代,藥品的開發仍大多是意外發現的。至80 年代,新型藥品則透過系統地研究藥物的拮抗與受體間的相互作用而來。目前藥品開發方向,則朝向針對各類疾病為本,科學家試圖進一步了解疾病與它們的成因,利用這些知識來篩選某些合適的化合物。 高通量藥物篩選技術常用於藥品的初期開發,特別是當生物標靶被確認後,利用這項技術能有效節省篩選候選化合物所需的時間。因此,高通量藥物篩選技術已被各大醫藥發展研究公司廣泛應用。 頁頂高通量藥物篩選技術於中醫藥的應用 高通量藥物篩選技術亦用於傳統中草藥天然成分的分類及鑑定。首先將各類藥材初步提
高通量药物筛选模型* 姚佳杨建波杨洁* (南京大学生命科学院生物化学系,医药生物技术国家实验室,南京210093) 摘要:本文介绍了可用于药物筛选的三种新的快速高通量筛选方法,包括基于反酵母双杂交的筛选系统;细胞平台伤的高通量筛选系统以及动物水平的筛选系统。并对其应用原理,应用情况和有缺点进行了阐述。 关键词:高通量筛选(HTS),酵母双杂交,靶点,受体 Abstract: This article mainly deals with three new dominant plat forms of HTS(High-Throughput Screen) which are fairly useful in drug screen——the reverse yeast two hybrid system, the cell-based screen and the animal platform, including their principles, their appliance and their advantages together with disadvantages. Key Words: High-Throughput Screen, yeast two-hybrid system, target, receptor 学科分类号:Q7 药物筛选模型研究经历了三个不同的发展阶段:最初意义上的筛选方法、分子生物学筛选方法和高通量筛选方法,而每一个阶段都源于一种新技术的诞生。最初的药物筛选是直接利用动物组织或天然产物进行的,并不涉及到疾病发生的分子机制。在这样粗略的筛选系统中只有有限的样品得到筛选,而且大多数样品只是基于疾病表征而非靶点的筛选。因此,药物的发现会带有偶然性。1980年以来,随着有机化学和分子生物学的发展,更加系统化的筛选方法应用到药物研究与开发中。一方面,有机化学的飞速发展为筛选提供了庞大的人工合成小分子库;另一方面,分子生物学为筛选提供了靶蛋白。通过比较正常人群与疾病患者间在机体组织细胞分子上的差异以及阐明模型组织中相应蛋白质的功能,从而正确地选择、描述并确认某些靶蛋白,有助于更加理性地进行药物筛选,不足的是上述过程往往费时耗财。而基因组学的发展对这个问题提供了很好的解决方法,基因组学能够更加有效地验证潜在的靶蛋白,并通过功能基因组研究能够快速有效地确认与特定疾病有关的靶蛋白[ 1 ]。 *本课题为国家自然科学基金资助项目(项目编号30171094和30271497)。联系人:杨洁,南京大学生命科学学院,医药生物技术国家重点实验室,南京210093,中国;电话:86-25-3594060,传真:86-25-3324605;Email:luckyjyj@https://www.doczj.com/doc/ae10667444.html,。
HTRF 产品纵览 HTRF 的优势 HTRF 是不需要洗涤的ELISA 。其优势如下: ? 操作非常简单 ? 体系非常稳定 ? 反映样品的实际情况,假阳性假阴性率低,可去除由于天热产物自发荧光引起的背景 HTRF 原理 HTRF 技术基于时间分辨荧光(TRF )和荧光共振能量转移(FRET )两大技术原理 时间分辨荧光 (TRF ) TRF 利用稀土元素中镧系元素的独特性质。它们与普通荧光的主要区别是荧光的持续时间不同。普通荧光的半衰期为纳秒级,镧系元素的半衰期是毫秒级,有6个数量级的 差别。所以,在检测时,TRF 有一个时间延迟---50微秒。经过这个时间延迟,普通荧光的信号几乎为零。所以,TRF 的背景非常低,反映样品的实际情况。 荧光共振能量转移(FRET )FRET 技术利用了两种荧光基团的能量转移,这两种荧光基团分别称为能量供体(Donor )和能量受体(Acceptor )。Donor 被外来光源激发(例如氙灯或激光),如果它与Acceptor 比较接近,可以将能量共振转移到Acceptor 上,使其受到激发,发出特定波长的发射光。 将Donor 和Acceptor 分别与相互作用的两个生物分子结合,生物分子的结合可以将Donor 和Acceptor 拉到足够近的距离,产生能量转移。由于Acceptor 的发射光来自于能量转移,所以在实验中不需要将未结合与已结合的分子分开,即不需要洗涤步骤。 HTRF 的能量供体 HTRF 的能量供体是铕(Eu )和铽(Tb )的穴状化合物。在这个穴状化合物里,Eu 和Tb 被永久地嵌合在一个笼子里,结构非常稳定。这个结构是由 J.M. Lehn’s 教授发明的,并由此在1987年获得了诺贝尔奖。 图1:时间分辨荧光技术原理 Donor 与Acceptor 距离较远, 无FRET Donor 与Acceptor 距离较近,产生FRET
药物筛选 药物筛选是现代药物开发流程中检验和获取具有特定生理活性化合物的一个步骤,系指通过规范化的实验手段从大量化合物或者新化合物中选择对某一特定作用靶点具有较高活性的化合物的过程。药物筛选的过程从本质上讲就是对化合物进行药理活性实验的过程,随着药物开发技术的发展,对新化合物的生理活性实验从早期的验证性实验,逐渐转变为筛选性实验,即所谓的药物筛选。作为筛选,需要对不同化合物的生理活性做横向比较,因此药物筛选的实验方案需具有标准化和定量化的特点。随着组合化学和计算化学的发展,人们开始有能力在短时间内大规模合成和分离多种化合物,因而在现代新药开发流程中药物筛选逐渐成为发现先导化合物的主要途径之一。 筛选模型: 筛选模型就是在药物筛选实验中所应用的药理实验模型,由于药物筛选要求实验方案有标准化和定量化的特征,因而在传统药理实验中常见的动物实验在药物筛选中较少应用,根据实验模型的不同,药物筛选可以分为生化水平的筛选和细胞水平的筛选。 生化水平的药物筛选用拟开发药物作用的靶点设计实验,一般而言这种作用靶点是具有特定生理功能的蛋白质,如酶和受体等,此外一些编码功能明确的DNA也越来越多地成为药物作用的靶点。候选化合物与靶点混合后,可以通过酶连免疫、荧光显色、核磁共振等方法定量测定化合物与靶点的相互作用,从而成为筛选化合物的依据。 细胞水平的药物筛选是更接近生理条件的一种药物筛选模型,其模型是拟设计药物作用的靶细胞,应用细胞培养技术获取所需细胞,将这些细胞与候选化合物相互作用,通过与生化水平筛选类似的检测技术测定化合物的作用能力,从而对化合物进行筛选。 生化水平的药物筛选操作相对简单,成本较低,但是由于药物在体内的作用并不仅仅取决于其与靶酶的作用程度,吸收、分布、代谢、排泄均会对药物的作用产生极大的影响,仅仅一道薄薄的细胞膜就能够阻挡住许多候选化合物成为药物的道路,因而生化水平的药物筛选不确定因素更多,误筛率更高。细胞水平的药物筛选模型更接近生理条件,筛选的准确率更高,但是需要建立细胞模型,操作更复杂,成本更高,数据之间的平行形较差,另外由于技术的限制,有些靶标还不能进行细胞水平的药物筛选。 高通量筛选 高通量筛选最初是伴随组合化学而产生的一种药物筛选方式。1990年代末,组合化学的出现改变了人类获取新化合物的方式,人们可以通过较少的步骤在短时间内同时合成大量化合物,在这样的背景下高通量筛选的技术应运而生。高通量筛选技术可以在短时间内对大量候选化合物完成筛选,经过近十年的发展,已经成为比较成熟的技术,不仅仅应用于对组合化学库的化合物筛选,还更多地应用于对现有化合物库的筛选。目前世界各大药物生产商都建立有自己的化合物库和高通量筛选机构,对有潜力形成药物的化合物进行篦梳式的筛选。 一个高通量药物筛选体系包括微量和半微量的药理实验模型、样品库管理系统、自动化的实验操作系统、高灵敏度检测系统以及数据采集和处理系统,这些系统的运行保证了筛选体系能够并行操作搜索大量候选化合物。高通量筛选技术结合了分子生物学、医学、药学、计算科学以及自动化技术等学科的知识和先进技术,成为当今药物开发的主要方式。完整的高通量筛选体系由于高度的整合和自动化,因而又被称作“药物筛选机器人系统”
关键词]:高通量筛选,设计,实施,综述 健康网讯: 利用计算机模拟技术、组合化学及高通量筛选技术发现新药的研发模式,带动了新药发现技术方法的重要变革。高通量筛选(high throughput screening, FITS)又称大规模集群式筛选,是由一些有特定靶点的微量生物筛选方法、自动化/机器人技术和完整数据处理技术有机组合而成,是一种新型的、高自动化、高灵敏度、高通量的筛选发现新药的技术。目前,世界上大型制药企业都无一例外地将其作为驱动新药发现的强力引擎,纷纷引进新药研发领域,使FITS的形式和内容不断丰富发展,并日益呈现出向超高通量筛选发展的趋势。 1 HTS系统的组成 1.1 高容量的样品库系统高容量的样品库及其数据库管理系统是开展HTS的先决条件。它们可以是生物样品(包括植物、动物和微生物的样品)、从生物样品中提取的活性部位或单体化合物以及人工合成(传统化学合成、组合化学合成)的化合物,化合物数量越多,结构多样性越高,筛选的命中率也越高。 1.2 自动化的操作系统自动化操作系统利用计算机,通过操作软件控制整个筛选过程,一般包括计算机及其操作软件、自动化加样设备、温孵离心设备及堆栈4个部分,也可以选取不同的组合应用。 1.3 高灵敏度检测系统 HTS检测系统一般采用液闪计数器、化学发光检测计数器、宽谱带分光光度仪、荧光光度仪以及闪烁亲和分析( scintillation proximity assay,SPA)等检测方法。检测灵敏度越高,则所需的样品量越少,效果越好。 1.4 高特异性的药物筛选系统 HTS常用的筛选模型都是建立在分子水平和细胞水平上,观察的是药物与分子靶点的相互作用,能够直接认识药物的作用机制。常用的筛选模型可分为受体结合分析法、细胞因子测定法、细胞活性测定法、代谢物质测定法以及基因产物
高通量药物筛选的及其在中国的发展趋势 高通量筛选的含义 近年来,由于自动化技术特别是机器人的应用,在新药研究中出现了高通量筛选技术(High throughput screening, HTS),该技术将化学、基因组研究、生物信息,以及自动化仪器等先进技术,有机组合成一个高程序、高自动化的新模式,从而创造了发现新药的新程序。由于该技术具有快速、高效等特点,因而成为新药发现的主要手段。简而言之,高通量筛选技术是将多种技术方法有机结合而形成的一种新技术体系,它以微板形式作为实验工具载体,以自动化操作系统执行实验过程,以灵敏快速的检测仪器采集实验数据,以计算机对数以千计的样品数据进行分析处理,从而得出科学准确的实验结果和特色效用。英国学者AlanD研究提示,一个实验室采用传统的方法,借助20余种药物作用靶位,1年内仅能筛选75000个样品;1997年高通量筛选技术发展初期,采用100余种靶位,每年可筛选100万个样品;1999年高通量筛选技术进一步完善后,每天的筛选量就高达10万种化合物。 高通量药物筛选主要由五个部分组成: 1.自动化操作系统它主要是指计算机控制的实验室自动化工作站,又称实验室机器人。该工作站可以代替人工进行自动加样、稀释、转移、洗脱、混合、温孵、检测等操作,使实验遵守程序化,减少人工误差,结果更准确可靠。在国外,高通量自动化筛选系统主要由制药企业构建和使用。高通量自动化筛选系统建立以后,主要课题是如何保障不断需求的大量的筛选资源的问题。因此,发达国家的大型制药企业从企业竞争和自身发展的战略利益出发,纷纷建立高通量自动化的筛选系统,同时,投以巨资通过合作或共同研究等方式,谋求获得发展中国家的大量资源。 2.高灵敏度的检测系统该系统是为了适应HTS而出现的新检测仪器。由于HTS在96孔或更多孔的微板中进行实验,样品量小,因而要求仪器灵敏度高,而且能够对96孔微板进行快速检测。现在用于HTS的检测仪器已可以进行可见光、紫外光、荧光比色,也可以进行同位素放射活性测定和生物发光、化学发光等多方面的测定,使现有的体外实验方法多数可用于HTS。 2.1分光光度法近年来,美、英两国研究人员在高通量筛选检测中,努力进行了光学测定方法的研究,建立了大量的非同位素标记测定法,如用分光光度检测法筛选蛋白酪氨酸激酶抑制剂、组织纤溶酶原激活剂等,均获得成功。为了适应高通量药物筛选,许多公司都生产了具备计算机接口并能对多孔板进行同时检测的分光光度计。以Molecular Device 公司的spectra 190为例,它采用8条光导纤维同时对8孔进行测定。测定波长以2nm为间隔,可以在190nm一850nm间进行选择。对未知物质,可在该范围内进行扫描以确定其特征吸收光谱。因此,大大增加了建立模型的多样性。检测数据以不同文件格式输出,可用随机软件或通用数据处理软件进行处理。方便、快速、准确、自动化程度高。分光光度法高灵敏仪器同自动化操作系统的连接,使得基于紫外、可见光谱的高通量药物筛选模型成为主要模型种类。 2.2 放射性检测技术美国学者GanieSM在高通量药物筛选研究中,应用放射性测定法,特别是亲和闪烁(SPA)检测方法,使在96孔板上进行的样本量实验得到发展。该方法灵敏度高,特异性强,促进了高通量药物筛选的实现,但存在环境污染问题。 2.3荧光检测技术美国学者GiulianokA研究认为,采用FLIPR(fluorometric imaging reader)荧光检测法(Molecular Devices),可在短时间内同时测定荧光或化学发光的强度和变化,对测定细胞内钙离子流及测定细胞内pH和细胞内钠离子流等,是一种非