图文教程---图片切片链接多个网址的方法
百度pakwell应网友0355特做本图文教程,是用photoshop进行图片切片后做链接,可以按此方法切片成不同的数目做成多个链接,可以应用在网页设计,淘宝装修,个人博客装扮等。
1.安装并打开photoshop软件
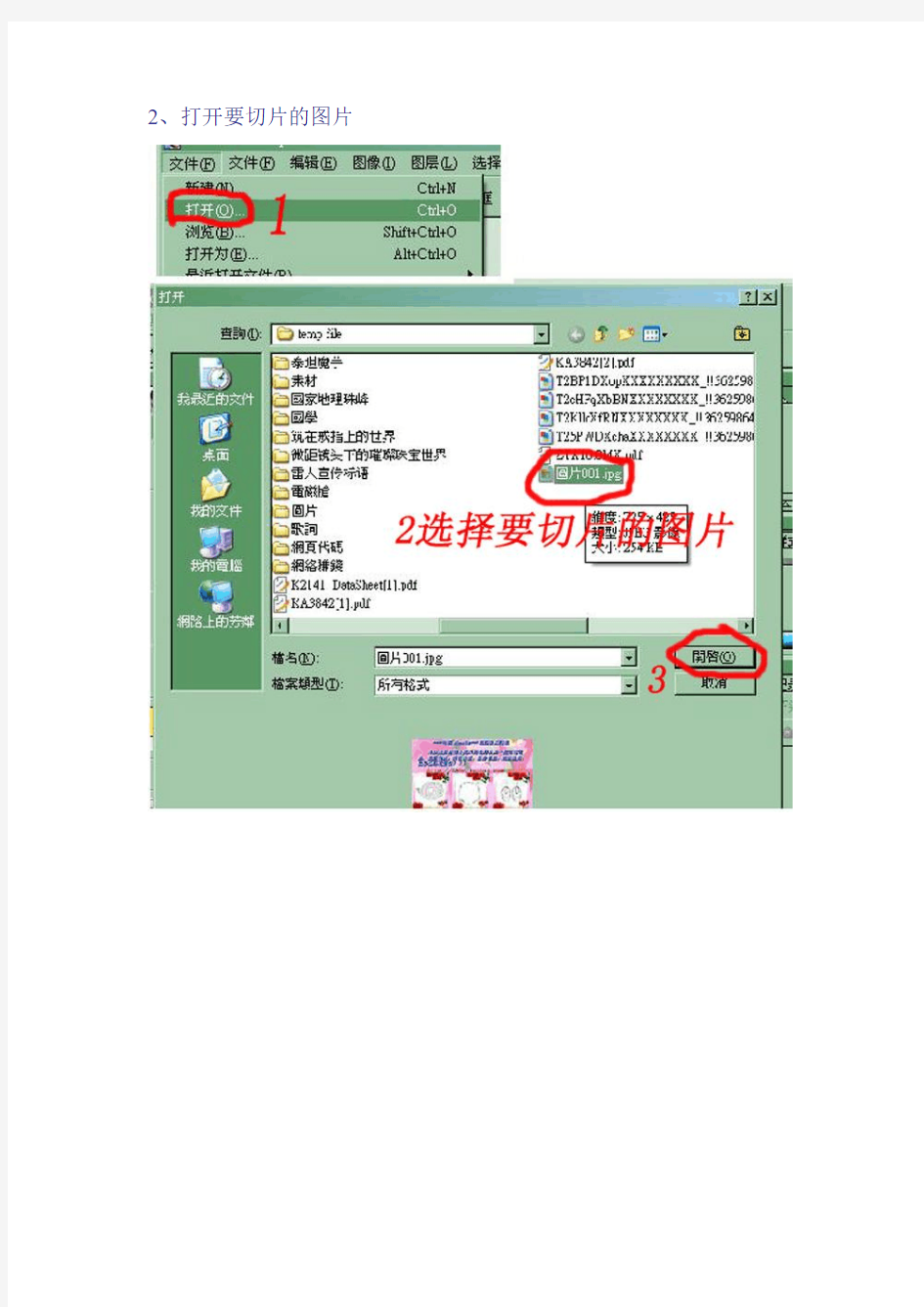
2、打开要切片的图片
3、设置图片要求的像素大少,(如没要求可以忽略)
4、选择切片工具,进行切片操作
5、将图片切片成你想要的数量,并调整好所要尺寸
6、文件另存为WEB格式,设置好你想要的参数,或选默认的,格式建议用JPG的,后点保存。
7、选择好路径保存即可
8、打开刚保存的文件如下图
9、将Images文件夹里的图片上传你的网络相册或图片空间,在网页编辑时直接插入各片图块,用超链接插入要链接的网址即可以了。
或用Dreamweaver编辑好网页代码再做,操作方法如下
10、按装并用Dreamweaver打开.html文件,点设计项,分别点选每片图片在源文件栏输入上传网络的图片地址,在链接栏输入要链接到所在网页的网址,目标栏选blank(在打开链接的网页时为新窗口打开)
11、选代码项,将所有代码复制到你要编辑网页的模块保存即可以。(注意编辑网页的模块要选代码编辑模式)
版权为
淘宝pakwell,https://www.doczj.com/doc/9e15200056.html,
百度pakwell,https://www.doczj.com/doc/9e15200056.html,/new/pakwell
网易pakwell,https://www.doczj.com/doc/9e15200056.html,/
所有
石蜡切片免疫组化染色步骤 1、载玻片的处理: 抗原修复过程中,由于高温、高压、辐射等诸多因素的影响,极易造成脱片。为保证试验的正常进行,可选用我公司提供的ZLI-9001 APES、ZLI-9003 Histogrip TM或ZLI-9005 Poly-L-Lysine等几种试剂,对已清洗的载玻片进行处理。具体方法如下: 1.1 APES:现用现配。将洗净的玻片放入以1:50比例丙酮稀释的APES中,停留20~30秒钟,取出稍停片刻,再入纯丙酮溶液或蒸馏水中涮去未结合的APES,置通风橱中晾干即可。用此载玻片捞片时应注意组织要一步到位,并尽量减少气泡的存在,以免影响染色结果。 1.2 Histogrip TM:将洗净的玻片放入以1:50比例丙酮稀释的Histogrip液中,停留1~2分钟,然后用双蒸水快速清洗三次,室温干燥或60o C烤箱烘烤一小时,装盒备用。 1.3 Poly-L-Lysine:将洗净、干燥的载玻片放入以1:10比例去离子水稀释的多聚赖氨酸溶液中,浸泡5分钟,60o C烤箱烘烤一小时或室温过夜干燥。装盒备用。试验中使用的器具均为非玻璃制品。 2、常用酶消化: 2.1 胰蛋白酶:一般使用浓度为0.05%~0.1%,消化时间为37℃、10~40分钟,主要用于细胞内抗原的显示。 2.2 胃蛋白酶:一般使用浓度为0.4%,消化时间为37℃、30~180分钟,主要用于细胞间质抗原的显示,如:Laminin(层粘蛋白),Collagen IV(IV型胶原)等。 2.3 皂素(Saponin):一般使用浓度为2~的saponin溶液,消化时间为室温孵育30分钟。 3、抗原热修复: 可根据实验室的具体条件,选用微波炉抗原修复、高压锅抗原修复或水浴高温抗原修复。抗原热修复可选用各种缓冲液,如TBS、PBS、重金属盐溶液等,但实验证明,以0.01M枸橼酸盐缓冲液(pH6.0)效果最好。请选用我公司提供的ZLI-9064 枸橼酸盐缓冲液(粉剂)配制,取该粉剂一包溶于1000ml 的蒸馏水中,混匀,其pH值在6.0 0.1,如因蒸馏水本身造成的pH值偏差,请自行调整。 3.1 石蜡切片微波炉抗原修复操作方法:切片脱蜡至水后,3%H2O2处理10分钟,蒸馏水洗2分钟×3。将切片放入盛有枸橼酸盐缓冲液(工作液)的容器中,置微波炉内加热使容器内液体温度保持在92℃~98℃之间并持续10~15分钟(注意:无论是使用医用或家用微波炉,请根据具体机型酌情设置条件,务必满足以上步骤中对温度和时间的要求)。取出容器,室温冷却10~20分钟(注意:不可将切片从缓冲液中取出冷却,以便使蛋白能够恢复原有的空间构型)。PBS洗,下接免疫组化染色步骤。 3.2 石蜡切片高压抗原修复操作方法:切片脱蜡至水。将1500ml~3000ml的枸橼酸盐缓冲液(工作液)注入不锈钢压力锅中加热至沸腾。切片置于金属架上,放入锅内,使切片位于液面以下,盖锅压阀。当压力锅开始慢慢喷气时(约加热5~6分钟后),计时1~2分钟,然后将压力锅端离热源,冷水冲至室温后,取下气阀,打开锅盖,取出切片,蒸馏水洗后,PBS洗2分钟×3,下接免疫组化染色步骤。 3.3 石蜡切片电炉煮沸抗原修复操作方法:切片脱蜡至水后,放入盛有枸橼酸盐缓冲液(工作液)的容器中,并将此容器置于盛有一定数量自来水的大器皿中,电炉上加热煮沸,从小容器的温度到达92℃~98℃起开始计时15~20分钟,然后端离电炉,室温冷却20~30分钟,蒸馏水冲洗,PBS洗,下接免疫组化染色步骤。 4、免疫组化染色步骤: (以美国ZYMED公司SP试剂盒为例) 4.1石蜡切片脱蜡至水。 4.2 3%H2O2室温孵育5~10分钟,以消除内源性过氧化物酶的活性。 4.3蒸馏水冲洗,PBS浸泡5分钟,(如需采用抗原修复,可在此步后进行)。
L e i c a C M1950冰冻切片机使用说明 一、开机 1.利用主机右侧的开关开启电源,用箱体温度设置按钮将切片机温度设置到切片所需温 度,当设置温度时温度显示窗口显示设置温度,设置停止5秒后显示实际温度。只要按下箱体温度设置按钮,即可随时检查设置温度。样品头温度设置按同样方法进行。 若样品头设为最低温度(-50度),则按样品头最低温度设置按钮即可。 二、切片 1.利用切片机的厚度调节按钮调节切片厚度,调整切片角度,安装切片刀。如是一次性 刀片,请利用刀架的左右移动来使用不同的刀口,勿移动刀片 2.将样品放到样品托上,利用包埋剂固定,放到冷台上冷冻,在即将完全冷透前用热交 换装置压平。 3.将冷却透的样品放到样品头上,设置样品头温度,用样品快进按钮将样品移近刀口, 调整要切的平面,利用慢进按钮开始修片,修好后即可放下防卷板切片,如有需要可调节防卷板的上下位置,使切出的样品平整的进入防卷板与刀片的狭缝,取出后染色观察。 三、注意事项 1.切片后为防止别人改变参数,可利用控制面板上的键盘锁定按钮将键盘锁定,即按下 键盘锁定按钮5秒钟左右,时间窗口中间的两个点停止闪烁,表示键盘锁定,此时再按键盘锁定按钮5秒钟即可解除键盘锁定。 2.当停机时,应将玻璃窗打开,再次开机前应先检查切片机内是否有水,如有应吹干后 再开机,并取出隔板检查切片机箱体底部是否有水,如有需拔开底部的塞子,将水排除,吹干后再开机。 3.如常年开机,夜晚可将切片机温度设到零下十度以下,不能高于零下十度。由于切片 机冷却到工作温度大约需两个小时,如关机后第二天有样品,应提前一天开机制冷,以免影响第二天的工作。 4.若要关闭压缩机,按一下锁定开关,再按一下样品头温度设置按钮,则样品头压缩机 关闭,若按箱体温度设置按钮则箱体压缩机关闭,重复以上步骤,压缩机又打开。
全部实验步骤 1 取新鲜组织于4%多聚甲醛固定24小时 2 30%蔗糖脱水48小时以上 3 -250C包埋(冰冻切片机内) 4冰冻切片 冰冻切片步骤 冰冻切片免疫组化染色步骤: 冰冻切片4~8μm,室温放置30分钟后,入4℃丙酮固定10分钟,PBS洗,5分钟×3次。用3%过氧化氢孵育5~10分钟,以消除内源性过氧化物酶的活性。PBS冲洗,5分钟×2次。下接石蜡切片免疫组化染色操作步骤。(见我发的前面的帖子) 你确定你是冰冻切片吗??? 冰冻切片不能用热修复啊!!! 以下是我的步骤: 1 冰冻切片室温放置30分钟后,入4℃丙酮固定10分钟,PBS洗,5分钟×3。用3%过氧化氢孵育5~10分钟,PBS洗,5分钟×2。 2 5~10%正常山羊血清(PBS稀释)封闭,室温孵育10分钟。倾去血清,勿洗,滴加适当比例稀释的一抗或一抗工作液,37℃孵育1~2小时或4℃过夜。 3 PBS冲洗,5分钟×3次。 4 滴加滴加第二代生物素标记二抗工作液,37℃或室温孵育30分钟。 PBS冲洗,5分钟×3次。 5 滴加辣根酶标记链霉卵白素工作液,37℃或室温孵育10~30分钟。 6 PBS冲洗,5分钟×3次。 7 显色剂显色(DAB)。 8 自来水充分冲洗,复染,封片。 冰冻切片免疫组化染色用的灭活内源性过氧化物酶,最好是用3%H2O2/甲醇溶液,室温20分钟。此配方不易产生脱片。 配制方法是在9ml甲醇中加30%H2O2 1ml,混匀后使用,每次新鲜配制。 冰冻切片免疫组化染色步骤 冰冻切片4~8mm,室温放置30分钟后,入4℃丙酮固定10分钟,PBS洗,5分钟×3。用3%过氧化氢孵育5~10分钟,消除内源性过氧化物酶的活性。PBS洗,5分钟×2。 下接免疫组化染色操作步骤。
冰冻切片的免疫组化染色步骤 速冻组织 将组织块平放于软塑料盖或特制小盒内(直径2cm),如组织块小可适量加OCT包埋剂浸没组织,然后将特制小盒缓缓平放入盛有液氮的小杯内,当盒底部接触液氮时即开始气化沸腾,此时小盒保持原位切勿浸入液氮内,大约 10-20秒组织即迅速冰冻成块。取出组织冰块立即置入-80℃冰箱储存备用,或置于恒冷切片机冰冻切片。 冰冻切片4~8mm,冰冻切片后如不染色,必须吹干,储存低温冰箱内,或进行短暂预固定后储存冰箱内保存。 室温放置30分钟后,入4℃丙酮固定10分钟。也可根据需要选择其它的固定方式。 PBS洗,5分钟×3。 用3%过氧化氢孵育5~10分钟,消除内源性过氧化物酶的活性。 PBS洗,5分钟×3。 下接石蜡切片免疫组化染色操作步骤(滴加一抗开始)。 石蜡切片免疫组化染色步骤 三步法(以SP试剂盒为例) 1. 石蜡切片脱蜡至水。 2. 蒸馏水冲洗,PBS浸泡5分钟,如需采用抗原修复,可在此步后进行。 3. 3%H2O2室温孵育5~10分钟,以消除内源性过氧化物酶的活性,PBS 冲洗,2分钟×3次。 4. 5~10%正常山羊血清封闭,室温孵育10分钟。倾去血清,勿洗,滴加适当比例稀释的一抗或一抗工作液,37℃孵育1~2小时或4℃过夜。 5. PBS冲洗,2分钟×3次。 6. 滴加适当比例稀释的生物素标记二抗(1%BSA-PBS稀释),37℃孵育10~30分钟;或滴加第二代生物素标记二抗工作液,37℃或室温孵育10~20分钟。 7. PBS冲洗,2分钟×3次。 8. 滴加适当比例稀释的辣根酶标记链霉卵白素(PBS稀释),37℃孵育10~30分钟;或第二代辣根酶标记链霉卵白素工作液,37℃或室温孵育10~20分钟。 9. PBS冲洗,2分钟×3次。 10. 显色剂显色(DAB或AEC)。
冰冻切片与漂片免疫组化 以前做冰冻切片,总是遇到问题,后来查文献,自己又做实验比较,总算找到了又快又好地办法, 拿出来和大家分享一下. 1. 取脑一定要在冰上操作,液体也一定用冷的 2. 30%蔗糖一定要充分,最好中间换液一次, 20%的可以不做 3. 沉淀后冻存,一定要快冻, 最好在干冰上操作. 4. 最重要的一点, 灌注的时候, 不要用0.1M PB, 用0.01M PBS. 以前不知道,很多书上写的都是0.1M PB,后来自己用了发现还是有洞. 为了这个,我还专门作了对照实验,结果0.01M PBS更好一些, 原因不知道为什么, 但是事实如此. (理论上高浓度液体更利于保护细胞不会因为冰冻损伤) 5. 如果做磷酸化的抗体,一定记得在灌注液里加一定的抑制剂,如NaF等. 蔗糖俺用25%/PBS 的,不用换液,只要过夜12个小时就能沉下去了。包埋的时候不用冲洗,但是要注意一定要用吸水纸擦干蔗糖溶液,否则切片有麻烦 我做切片的时候,先用20%蔗糖(PB配)沉底,再用30%蔗糖沉底,这样脱水比较充分。一般是等切片机温度达到-22度之后,再将包埋好的脑组织放入。脱水不充分也会导致切片有洞,而且片子容易向内卷,很不好贴。一直这样做了很久,效果都还不错。 取脑后,直接投到液氮??我试过,由于脑组织水分多,下液氮后直接就碎了~~ 防止脑袋冻碎办法: 先准备好一个保温杯,倒入适量的液氮,然后在杯身中放一个纸杯(塑料或玻璃杯禁用),再在杯中放一金属片,以防止纸杯翻倒,动物脑袋取好后,先放在一张小锡箔纸上,然后连锡箔纸一起转移至杯中的金属片上面,盖上保温杯盖,3-5分钟后,见大脑表片颜色变白,表示冷冻完全,随即将大脑用锡箔纸包好,转入-80度冰箱长期保存。 脑片切好后保存方法: 1、先用手指在玻片(已挂好胶)后均匀轻轻过一下,将脑片组织贴在玻片上。 2、37度干燥箱中烘干。 3、放入切片盒中,盖紧盒盖,并用胶带将切片盒封严,外用样品袋包扎严实,即可防止水汽进入。于-20度可保存半年以上,于-80度可保存一年以上。 切忌经常打开盒子。
免疫组化方法(冰冻切片) A. 所需溶液和试剂 1.二甲苯 2.无水乙醇(100% 和95%,变性无水乙醇,组织学级) 3.苏木精(可选) 4.固定剂:请参考产品说明书选取合适的固定剂。 a.10%中性福尔马林 b.丙酮 c.甲醇 d.3%甲醛溶液:配制时,将18.75 ml 16%甲醛溶液加入到81.25 ml 1X PBS中。 5.10X Tris缓冲盐水(10X TBS):在800 ml蒸馏水中加入24.2 g 三羟甲基氨基甲烷(Trizma base ,C4H11NO3)和80 g 氯化钠(NaCl)。用浓盐酸将pH调节到7.6。 6.漂洗(缓冲)液:1 X Tris缓冲盐水(TBS)。100 ml 10 X TBS加900 ml水至1L。 7.甲醇/过氧化氢:配制时,将10 ml 30% H202加入到90 ml甲醇中。保存在-20°C。 8.封闭液:1X TBS / 0.3% Triton-X 100 / 5%正常山羊血清。 9.配制时,将500 μl山羊血清和30 μl Triton-X 100加入到9.5 ml 1X TBS中。 10.检测系统:根据厂家说明书使用。已有的检测系统*。 11.DAB试剂或合适的底物:按产品说明配制。 B. 切片 1.对于保存在-80°C的样品:切片前先从冰箱中取出放在-20°C平衡15分钟左右。这可以避免切 片时样品断裂。 2.将样品切成大约6-8 μm厚,铺在带正电性的玻片上。 3.固定前,可以把切片摊开放在实验台上风干几分钟。(这有助于切片贴紧玻片) C. 固定 注意:参考产品说明书(抗体)选择合适的固定剂 1.玻片上的切片风干后,选用如下合适的固定剂进行固定。 a.10%中性福尔马林:室温10分钟。立即进行染色操作。 b.冰丙酮:-20°C 10分钟。风干。立即进行染色操作。 c.甲醇:-20°C 10分钟。立即进行染色操作。 d.3%甲醛溶液:室温15分钟。立即进行染色操作。
( 机械原理课程设计说明书 设计题目:糕点切片机 . 学院:车辆与能源学院 班级: 14级车辆工程1班 学生姓名:郝益王玉杰李泽众 指导教师:宜亚丽 ]
2016 年 6月 22 日
数据 糕点厚度。10~20mm; 糕点切片长度(亦即切片的高)范围。5~80 mm; 切刀切片时最大作用距离(亦即切片的宽度方向)300 mm; 切刀工作节拍。40次/min; 电动机可选用(或)、1390/min。 设计要求 1)通过调整进给的距离,达到切出不同厚度糕点的需要; 2)要确保进给机构与切片机构协调工作,全部送进运动应在切刀返回过程中完成,输送运动必须在切刀完全脱离切口后方能开始进行; 3)选用的机构简单、轻便、运动灵活可靠。 项目组成员及分工
目录 一.工作原理......................................................................... .. (1) 二.运动循环图 (1) 三.各部分机构选型.评定及选择 (2) 1、切刀往返运动设计 (2) 2、传送带的间歇移动 (3) 3、减速方案设计 (3) 四.传动机构的尺寸设计及计算 (3) 1、切刀设计与数据 (3) 2、糕点间歇运动设计 (4) 3、切刀与棘轮的协调运动计算 (4) 4、减速传动设计 (5) 5、糕点传送带设计 (6) 五.机构运动学分析 (7) 六.误差分析 (15) 七.参考文献 (15) 八.心得......................................................................... .. (15) 附件1 自评分
Leica CM 1950冰冻切片机使用说明 一、开机 1.利用主机右侧的开关开启电源,用箱体温度设置按钮将切片机温度设置到切片所需温度,当设置温度时温度显示窗口显示设置温度,设置停止5秒后显示实际温度。只要按下箱体温度设置按钮,即可随时检查设置温度。样品头温度设置按同样方法进行。若样品头设为最低温度(-50度),则按样品头最低温度设置按钮即可。 二、切片 1.利用切片机的厚度调节按钮调节切片厚度,调整切片角度,安装切片刀。 如是一次性刀片,请利用刀架的左右移动来使用不同的刀口,勿移动刀片 2.将样品放到样品托上,利用包埋剂固定,放到冷台上冷冻,在即将完全冷透前用热交换装置压平。 3.将冷却透的样品放到样品头上,设置样品头温度,用样品快进按钮将样品移近刀口,调整要切的平面,利用慢进按钮开始修片,修好后即可放下防卷板切片,如有需要可调节防卷板的上下位置,使切出的样品平整的进入防卷板与刀片的狭缝,取出后染色观察。 三、注意事项 1.切片后为防止别人改变参数,可利用控制面板上的键盘锁定按钮将键盘锁定,即按下键盘锁定按钮5秒钟左右,时间窗口中间的两个点停止闪烁,表示键盘锁定,此时再按键盘锁定按钮5秒钟即可解除键盘锁定。 2.当停机时,应将玻璃窗打开,再次开机前应先检查切片机内是否有水,如有应吹干后再开机,并取出隔板检查切片机箱体底部是否有水,如有需拔开底部的塞子,将水排除,吹干后再开机。 3.如常年开机,夜晚可将切片机温度设到零下十度以下,不能高于零下十度。由于切片机冷却到工作温度大约需两个小时,如关机后第二天有样品,应提前一天开机制冷,以免影响第二天的工作。
4.若要关闭压缩机,按一下锁定开关,再按一下样品头温度设置按钮,则样品头压缩机关闭,若按箱体温度设置按钮则箱体压缩机关闭,重复以上步骤,压缩机又打开。
大鼠肾脏冰冻切片的体会 发表时间:2016-03-01T14:17:27.000Z 来源:《中国综合临床》2015年9月供稿作者:张丽娥[导读] 福建省南平市第二医院病理科福建建阳354200冰冻切片不仅要求病理技师在短时间内制出高质量的切片,还需要病理技师具有娴熟的技术,对冰冻切片机功能的熟练掌握合理应用. 张丽娥 福建省南平市第二医院病理科福建建阳354200 【中图分类号】R587.2【文献标识码】B 【文章编号】1001-5302(2015)09-0857-01 0.引言由于肾脏组织质地柔软,含水量高,或在取材过程中肾组织与水分接触, 突遇低温,易形成冰晶,快速冷冻切片的制作难度大,我们通过对大鼠肾脏的冰冻制片,总结经验如下. 1材料使用德国产Leica—CM1950型冰冻切片机,Leica一次性刀片,冷冻组织包埋剂(O.C.T.),AF固定液,改良Gill苏木素染色液,2%碳酸氢钠返蓝液,逐级梯度酒精,中性树胶. 2方法2.1取材及包埋2.1.1取新鲜大鼠肾脏标本常规取材,标本要新鲜,无需固定,严禁浸入甲醛, 酒精,生理盐水等液,尤其是不可以用酒精固定,酒精固定后组织将无法冷冻.2.1.2将样本托放入冰冻切片机的冻台上预冷,加少许O.C.T.,在OCT 未完全冻结前快速的将组织放于样本托上,在组织周围适量的补充O.C.T,待包埋剂约1/3未冻结时压上冷冻锤,打开加强冷冻,使组织快速冷冻.2.1. 3冰冻切片机温度设定在-16oC—-18oC为宜.冷冻时间一般为1min~2min.冷冻时间过长,组织易变硬变脆,细胞结构会发生改变,难于切片.2.1.4包埋组织时应将组织周边多留出O.C.T.用于牵引展开切片,O.C.T.中的小气泡应尽量去除,以免切片时挤压旁边组织产生皱褶,影响切片效果. 2.2切片组织切片厚度设定为5um-6um.刀具提前安放好,调整好刀具角度,切片时控制好操作窗,以利保温.肾脏组织细胞比较致密,若时间过长会变脆且易碎,在冰冻切片时可用手指轻压组织回温,再进行切片. 2.3固定切片后立即放入AF固定液固定30s—1min,不可待切片干后再固定,这样会造成细胞核染色质不清晰,呈现毛玻璃样改变,细胞胞浆边界不清等组织细胞的退变现象. 2.4染色封片固定好的冰冻切片在苏木素染液中染色30s—50s,经1%盐酸分化,2%碳酸氢钠水溶液返蓝,伊红染色,梯度酒精脱水,二甲苯透明,中性树胶封片. 制好的切片核浆对比分明,红蓝适度,颜色鲜艳,达到理想染色效果. 3讨论与分析:3.1冰晶是由于冷冻缓慢,冷冻时间过长,胞质内与组织间隙未结合的水分析出形成的.肾脏因其组织结构,在组织冷冻过程中,组织内易产生大量的冰晶影响冰冻切片的诊断,为了防止组织内冰晶的产生,最佳的办法一是使用冻锤:新鲜标本包埋后放入冷冻台时,不能将冻锤马上按压在组织上,那样会使组织受挤压变形.应该待O.C.T.凝固60%~70%时,再将冻锤轻压在组织上, 这样既能防止冰晶的产生,又能得到较平整的切面;另一种方法为使用液氮冷冻,可将组织放入液氮中2s-3s,待组织冻至80%时即可取出制片,否则过冻会引起组织发脆,冻头与组织分离[2]. 3.2将包埋剂放入-10OC或-4OC冰箱内保存,包埋剂要使用OCT,而不能用胶水等替代,因OCT 的主要成分为PVP,其能通过渗透的作用将细胞内的水分移出,减少冰晶形成. 3.3冰冻的速度与样品的表面积和体积成正比,取材时组织块尽可能薄,0.2cm 为宜,扁平状冷冻速度快,切片的前几张冰晶少,越后冰晶越多,切片不能求快,而要确保切片质量,力争一次完成一张高质量的切片[1]. 3.4可预先做好OCT冻头,将冻头上的OCT 修平,有利于将组织放平,再在冰冻机内在肾组织上滴加OCT,有利于OCT迅速降温,避免组织复温,减少冰晶形成. 3.5肾脏冰冻制片时易产生不规则裂痕,与切片时温度和切片速度有关,操作时应注意操作窗不要开太大,免工作箱的温度升高;OCT的用量太少易产本皱褶,滴加OCT时要上下俩端多,俩侧少,同时要注意OCT不要有小气泡. 3.6冰冻切片机应安放在冷室内,避免压缩机反复工作,仪器要定期维护,除霜,清洁消毒. 总之,冰冻切片技术是病理科最重要的常规工作之一,也是较难掌握的病理实验技术.要做好一张冰冻切片需要病理技术人员具有严格的责任心、严谨的工作态度、丰富的工作实践经验[3]在日常的工作中还需不断摸索经验提高切片质量,冰冻切片不仅要求病理技师在短时间内制出高质量的切片,还需要病理技师具有娴熟的技术,对冰冻切片机功能的熟练掌握合理应用. 参考文献[1] 陈乐真,徐庆中,陈国璋手术中病理诊断图鉴1版北京:科学技术文献出版社,2005:2(还需卷数期数页码等现在还没查询查询后补上)[2] 范慧,陈立华,刘宇冷冻切片的制作体会及常见问题分析.诊断病理学杂志,2008,138(还需卷数期数页码等现在还没查询查询后补上)[3] 吴艳霞.冰冻切片的制作方法分析.吉林医学,2009,30(6):493.
冰冻切片是指将组织在冷冻状态下直接用切片机切片。它实际上是以水为包埋剂,将组织进行冰冻至坚硬后切片的。在冰冻切片前组织不经过任何化学药品处理或加热过程,大大缩短了制片时间。同时,由于此法不需要经过脱水、透明和浸蜡等步骤,因而较适合于脂肪、神经组织和一些组织化学的制片,并作为快速切片的方法应用在临床诊断。 1.取材: 应尽可能快地采取新鲜的材料,防止组织发生死后变化。 2.速冻: 为了较好地保存细胞内的酶活性或尽快制成切片标本的需要,一般在取材后就要立刻对组织块进行速冻,使组织温度骤降,缩短降温的时间,减少冰晶的形成。 液氮速冻切片法是实验室最常用的速冻切片方法。具体做法是将组织块平放于软塑瓶盖或特制小盒内(直径约2cm),如组织块小可适量加OCT包埋剂浸没组织,然后将特制小盒缓缓平放入盛有液氮的小杯内,当盒底部接触液氮时即开始气化沸腾,此时小盒保持原位切勿浸入液氮中,大约10-20s组织即迅速冰结成块。在制成冻块后,即可置入恒冷箱切片机冰冻切片。若需要保存,应快速以铝箔或塑料薄膜封包,立即置入-80℃冰箱贮存备用。 3.固定: 样品托上涂一层OCT包埋胶,将速冻组织置于其上,4℃冰箱预冷5-10min 让OCT胶浸透组织。取下组织置于锡箔或者玻片上,样品托速冻。 组织置于样品托上,其上再添一层OCT胶,以完全覆盖为宜,速冻架(PE)上30min。 4.切片: 恒温冰冻切片机为较理想的冰冻切片机,其基本结构是将切片机置于低温密闭室内,故切片时不受外界温度和环境影响,可连续切薄片至5-10μm。切片时,低温室内温度以-15℃~-20℃为宜,温度过低组织易破碎,抗卷板的位置及
Leica CM1950 冷冻切片机操作规程一. 控制键盘说明
二. 调节部件 1.切片厚度调节旋钮 2.调节切片平面的旋钮,松开后可调节切片平面切片时要拧紧 3.夹紧样品托的旋钮 4.调节切削刀口的压杆,松开后,刀架可左右移动,选择切片刀口 5.调节切片角度的压杆,松开后可调节切片角度,右侧有角度指示 6.刀座夹紧压杆,松开后刀座可前后移动 7.防卷板上下移动旋钮,移动时防卷板要离开刀刃 8.装卸刀片压杆 三操作说明 (一)开机 1.利用主机右侧的开关开启电源,用箱体温度设置按钮将切片机温度设置到切片 所需温度,当设置温度时温度显示窗口显示设置温度,设置停止5秒后显示实际温度。只要按下箱体温度设置按钮,即可随时检查设置温度。样品头温度设置按同样方法进行。若样品头设为最低温度(-50度),则按样品头最低温度设置按钮即可。
2.第一次开机时利用基准时间设置按钮设置一个基准时间,一般为北京时间,利 用除霜时间设置按钮设置一除霜时间,一般为晚上12时左右,如果在该时间切片,应将时间推迟,当设置除霜时,时间显示窗口显示除霜时间,5秒后显示基准时间。手动除霜时先按下手动除霜按钮,听到峰鸣音后,按箱体温度设置按钮,则箱体手动除霜;如按箱体温度设置按钮,箱体手动除霜,按此顺序再按一次可关闭手动除霜,如按样品头温度设置按钮,则样品头除霜,按此顺序在按一次关闭。 (二)切片 1.利用切片机的厚度调节按钮调节切片厚度,调整切片角度,安装切片刀。如是 一次性刀片,请利用刀架的左右移动来使用不同的刀口,勿移动刀片 2.将样品放到样品托上,利用包埋剂固定,放到冷台上冷冻,在即将完全冷透前 用热交换装置压平。 3.将冷却透的样品放到样品头上,设置样品头温度,用样品快进按钮将样品移近 刀口,调整要切的平面,利用慢进按钮开始修片,修好后即可放下防卷板切片,如有需要可调节防卷板的上下位置,使切出的样品平整的进入防卷板与刀片的狭缝,取出后染色观察。 (三)注意事项 1.切片后为防止别人改变参数,可利用控制面板上的键盘锁定按钮将键盘锁定, 即按下键盘锁定按钮5秒钟左右,时间窗口中间的两个点停止闪烁,表示键盘锁定,此时再按键盘锁定按钮5秒钟即可解除键盘锁定。 2.当停机时,应将玻璃窗打开,再次开机前应先检查切片机内是否有水,如有应 吹干后再开机,并取出隔板检查切片机箱体底部是否有水,如有需拔开底部的塞子,将水排除,吹干后再开机。 3.如常年开机,夜晚可将切片机温度设到零下十度以下,不能高于零下十度。由 于切片机冷却到工作温度大约需两个小时,如关机后第二天有样品,应提前一天开机制冷,以免影响第二天的工作。
L e i c a C M冰冻切片机使 用说明 The latest revision on November 22, 2020
Leica CM 1950冰冻切片机使用说明 一、开机 1.利用主机右侧的开关开启电源,用箱体温度设置按钮将切片机温度设置到切片 所需温度,当设置温度时温度显示窗口显示设置温度,设置停止5秒后显示实际温度。只要按下箱体温度设置按钮,即可随时检查设置温度。样品头温度设置按同样方法进行。若样品头设为最低温度(-50度),则按样品头最低温度设置按钮即可。 二、切片 1.利用切片机的厚度调节按钮调节切片厚度,调整切片角度,安装切片刀。如是 一次性刀片,请利用刀架的左右移动来使用不同的刀口,勿移动刀片 2.将样品放到样品托上,利用包埋剂固定,放到冷台上冷冻,在即将完全冷透前 用热交换装置压平。 3.将冷却透的样品放到样品头上,设置样品头温度,用样品快进按钮将样品移近 刀口,调整要切的平面,利用慢进按钮开始修片,修好后即可放下防卷板切片,如有需要可调节防卷板的上下位置,使切出的样品平整的进入防卷板与刀片的狭缝,取出后染色观察。 三、注意事项
1.切片后为防止别人改变参数,可利用控制面板上的键盘锁定按钮将键盘锁定, 即按下键盘锁定按钮5秒钟左右,时间窗口中间的两个点停止闪烁,表示键盘锁定,此时再按键盘锁定按钮5秒钟即可解除键盘锁定。 2.当停机时,应将玻璃窗打开,再次开机前应先检查切片机内是否有水,如有应 吹干后再开机,并取出隔板检查切片机箱体底部是否有水,如有需拔开底部的塞子,将水排除,吹干后再开机。 3.如常年开机,夜晚可将切片机温度设到零下十度以下,不能高于零下十度。由 于切片机冷却到工作温度大约需两个小时,如关机后第二天有样品,应提前一天开机制冷,以免影响第二天的工作。 4.若要关闭压缩机,按一下锁定开关,再按一下样品头温度设置按钮,则样品头 压缩机关闭,若按箱体温度设置按钮则箱体压缩机关闭,重复以上步骤,压缩机又打开。
免疫组化实验步骤 细胞和组织的固定 (一)固定 为了更好的保持细胞和组织原有的形态结构,防止组织自溶,有必要对细胞和组织进行固定。固定的作用不仅是使细胞内蛋白质凝固,终止或抑制外源性和内源性酶活性,更重要的是最大限度的保存细胞和组织的抗原性,使水溶性抗原转变为非水溶性抗原,防止抗原弥散。不同抗原,其稳定性也不相同,因而对固定剂的耐受性差异较大 (二)固定剂 用于免疫组织化学的固定剂种类较多,性能各异,在固定半稳定性抗原时,尤其重视固定剂的选择,介绍如下。 1.醛类固定剂双功能交联剂,其作用是使组织之间相互交联,保存抗原于原位,其特点是对组织穿透性强,收缩性小。有人认为它对IgM、IgA、J链、K 链和λ链的标记效果良好,背景清晰,是常用的固定剂。 1)4%多聚甲醛为我们常用固定剂 2)Bouin’s液 该固定液为组织学、病理学常用固定剂之一,对组织穿透力较强而收缩性较小,比单独醛类固定更适合免疫组化染色。Kayhko认为用于标记B细胞的J链较好,但Bullock则认为它可导致Igg γ重链变性,故必需加大第一抗体的浓度。 2.丙酮及醇类固定剂 系最初免疫细胞化学染色的固定剂,其作用是沉淀蛋白质和糖,对组织穿透性很强,保存抗原的免疫活性较好。但醇类对低分子蛋白质、多肽及胞浆内蛋白质保存效果较差,解决的办法是和其它试剂混合使用,如加冰醋酸、乙醚、氯仿、甲醛等。 丙酮的组织穿透性和脱水性更强,常用于冰冻切片及细胞涂片的后固定,保存抗原性较好,平时4。C低温保存备用,临用时,只需将涂片或冰冻切片插入冷丙酮内5-10min,取出后自然干燥,贮存于低温冰箱备用。 以上介绍了免疫组织化学中常用的固定液,用于免疫组化的固定剂种类很多,不同的抗原和标本需经过反复试验,选用最佳固定液,迄今尚无一种标准固定液可以用于各种不同的抗原固定。而且同一固定液固定的组织,免疫组化染色标记
创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王* 1.做冰冻切片用的固定后样品能在蔗糖溶液放多久? 问:本人将样品固定过后冲洗过后,放入蔗糖溶液,因有事耽搁,放了一个星期了,不知是否还可切片.还有固定过后冲洗用普通蒸馏水冲洗可以吗?我是做免疫组化答:1、不知道你放置的蔗糖浓度是多少,如果是30%最好是三天之内,50%的浓度可以方久一点,一两个月应该没什么问题。因为蔗糖是高渗环境,不会影响实验结果。祝好运吧! 2、我认为组织在20%蔗糖放一周还是可以切片的,至于固定后的冲洗,可以免掉,也可用0.01MPBS涮洗一下,蔗糖液的量要多加一些 2、关于冰冻切片的问题(冰冻切片,免疫荧光,蔗糖,脱水) 问:请拟准备做免疫荧光的标本,经前固定灌注后取全脑,后固定4小时后,30%的蔗糖脱水过夜,再用OCT包埋后保存在-80的冰箱,冰冻切片后HE染色,发现整个视野都是大小
不等的圆形洞洞,不知道是什么原因. 答:1、个人认为可能是以下几个方面的问题: 30%的蔗糖脱水过夜---- 一般我所采取的是灌注固定后取脑,然后放入30%蔗糖的多聚甲醛溶液中,待脑下沉到底后(大约2天)再切片,用这样的高渗糖既可以防止冰晶又可以继续后固定.单纯的蔗糖过夜应该是不够 的. 从30%蔗糖的多聚甲醛溶液中捞出脑后应放入液氮迅速冷冻然后进行切片,不建议用-80度冰箱,曾经用过-80度冰箱结果脑片出现许多冰晶孔. 2、用0.01M的PBS配置的4%多聚甲醛灌注固定后,20%蔗糖(沉底)→30%蔗糖(沉底),然后直接进冰冻切片机急冻15~20min,我们实验室的技术员曾说过,脑标本千万不能用OCT包埋、液氮冷冻。只要蔗糖脱水彻底,是不会形成冰晶的;而用OCT包埋、液氮冷冻,你没做过,时间不好把握——时间长了,组织会冻裂;时间不够,冷冻效果不好,切片不好切。 3、这个就是实验室和实验室操作方法有所区别了,我说的方法肯定是没有问题的,我们都是这样操作没有出现过冰晶,不用OCT包埋,但确实用液氮,冻10秒,不会冻裂,效果良好.
冰冻切片机的使用指南 及注意事项 WEIHUA system office room 【WEIHUA 16H-WEIHUA WEIHUA8Q8-
冰冻切片机使用步骤 1、按电源开关I/O侧的I(开)侧,接通仪器电源。待仪器进行短暂时间的初 始化(屏幕上将显示一个沙漏标志)后,请检查上方显示屏是否亮起,是否显示语言选择菜单。 2、请检查速冻台、冷冻箱及其切片厚度是否为实验所需要的相关数据,通 常速冻台为-35℃,冰冻箱为-20℃,切片厚度为6μm。如若不是,在屏幕 或调节到需要的数据。调节好后,等待机器降到所调节的温度。 3、将手轮手柄旋转到12点钟的位置,然后进行制动。将样品利用冰冻胶固定 在样本托上,并放于速冻台上降温。10min后,将带样品的样本托从速冻台取出,然后用样本夹钳将其固定在切片机头上。 4、取下护刀架,如果样本运行指示器上显示有足够“剩余移动距离”,那么, 您可以使用仪器左侧控制面板上的样本推进按键,使样本向刀架方向前 进。另外您也可以采用,将手轮旋转到3点钟,并且将其锁定在该位置。 将刀架左下方(黑色)的操控杆拉向你,然后小心地将刀架底座沿着滑槽向远离你的方向(前方)滑动,直至刀片快要接触到样本。将操控杆沿着远离你的方向推动,将刀架锁定在适当位置上。如果需要,可使用控制旋钮将样本精确定位在靠近刀架的位置。每旋转控制钮一个刻度,可将样本移动8μm。 5、打开手轮柄锁,顺时针(朝前)均力旋转摇手柄轮一圈,即出一张相应厚 度的切片。待切到样品位置时,放下防卷板再次切片。切好后,请将手轮锁定在6点或12点位置,使样本头移动到最低或最高位置便于取出切 片,掀起玻璃防卷板用载玻片上靠,切片立即附着在载玻片上。玻璃防卷板可以用螺丝左右调节平行。如刀上或防卷板上粘有脏东西,可用冷冻台内的毛笔刷干净。 6、当把最后一个组织切片取走后,请放好刀片护刀架,然后握住样本托的手 柄将其从夹钳处取出。锁定手轮,使用冰冻台内的刷子扫除多余组织碎 片,将其清扫到后面的废物铲上,并清理出冰冻箱体。
蘑菇切片机的操作说明及注意事项 1.概述 PMG-500型蘑菇切片机是根据市场需求开发研制的产品,用于软类蔬菜、食用菌和新鲜海带的加工,可切制成丝或片状,是蔬菜加工行业制作保鲜蔬菜和脱水蔬菜较理想的加工设备。 本机采用人工切削原理,将软类蔬菜、食用菌和新鲜海带的加工成丝或片状,且形状规则,切面光滑,深受用户青睐,同时该机切菜效率高、操作方便、能耗低、卫生、安全、高效,是蔬菜加工行业的理想设备。 2.结构 本机由机架、刀组合、托辊组合、胶辊组合、主、从动滚及传动系统组成。(结构简图如图1) 本机主要部件由不锈钢制作、传送带由无毒橡塑制作。符合食品加工机械安全标准要求。 工作原理 当传送带运转时物料向前运动,在与刀组接触时,物料被切断。被切断的物料落到用户自备的容器内 传动原理 本机传动系统采用了皮带传动,齿轮传动,链轮传动等多种形式. 3.安装、调试 3.1 使用前将机器放置在干燥、通风的水平地面上,确保机器工作平稳、可靠。 3.2 使用前对各部位进行检查,紧固件是否在运输途中松动,开关及电源线是否因运输而破损,输送带上是否有异物。 3.3 检查电源电压是否与本机使用电压相符合。
3.4 将电源软线上的密封式插头插入相符合(按标准安装)的插座中,视刀轴与胶辊转动方向是否与(图2)所示方向相同,否则调整三相插头线芯至运转方向正确后,空载试运转。 3.5 空车运转时不应有冲击振动或不正常的声音,否则应检查,待故障排除后,接通水源,方可试机。 3.6产品在出厂时已按用户要求调整好间距,在使用时严禁将金属或蔬菜以外的其它杂物混入,否则将损坏刀具。 安全保护装置及注意事项 为安全起见,在刀具组合及电机上方分别安装了防护罩,在没有安装好任一防护措施的情况下,请不要进行工作,以免发生意外伤害。 4.注意事项 4.1 机器运转中,切勿将手或硬物置于输送带上,以免造成人身伤害和损坏机 器。 4.2 在拆卸或清洗刀具过程中,不要用手直接触摸刀刃,以免造成人身伤害。 4.3机器运转中,切勿打开刀护罩。在停机后打开护罩时,切勿启动机器,以免高速旋转的切刀危害人身安全。 4.4机器运转中,不要进行任何形式的维护和保养,以免造成人身伤害。 5.保养、维修 所有的维护和保养工作都必须在切断电源的情况下进行。电动机和机件都会逐渐磨损,定期对机件进行清洁,对传动皮带、轴承、齿轮、链轮等运行零件进行保养都能保证机件不致于过早损坏。 5.1 每次用完后,对该机认真清洁一次,确保清洁卫生,清洁时不得用锐器清理切刀与输送带,严禁用喷水管直接冲洗。 5.2 每班往齿轮、链轮上加注润滑油一次,选用20号机油,每次加注量以十滴为宜。轴承内润滑脂半年更换一次,选用钙基脂。 5.3 在工作过程中,如果机器声音不正常,必须立即停机检查,待故障排除后方能继续工作。
冰冻切片的制备 一、冰冻切片技术的概述 (一)优点: 1.简便,可以不需要对组织固定、脱水、透明、包埋等手续即可进行切片,减少了一些中间环节。 2.快速,用时短。 3.组织变化不大。 4.能很好保存脂肪,类脂等成分。 5.能够比较完好地保存各种抗原活性及酶类,特别是对于那些对有机溶剂或热的温度耐受能力较差的细胞膜表面抗原和水解酶保存较好。 (二)缺点: 1.不容易做连续切片。 2.切取的组织不能过大,组织过大不容易冻结或者组织冻结不均,影响切片及染色效果。3.不容易制作较薄的切片。 4.组织块在冻结过程中容易产生水的结晶而影响细胞的形态结构及抗原物质的定位,并且组织结构也不如石蜡切片清晰。 (三)主要应用于: 1.用于有些水解酶的定位的组织化学方法以及免疫组织化学方法等。 2.用于证明脂肪及类脂和神经组织髓鞘的染色时的切片。 3.用于临床手术的快速病理诊断。 二、冰冻切片机的使用及注意事项 (1)新鲜的组织制备 组织尽可能新鲜、骤冷愈快愈好,才能避免冰晶,常用的骤冷剂有:①CO2气(-78℃)②丙酮干冰冷却的轻石油醚、乙烷和庚烷(-80℃)③液氮(-190℃)④液氮冷却的丙烷(-19℃)。液氮适用于组织化学,较安全。缺点:组织块易发生龟裂。(2)固定组织的制备 为防止水解酶和其他物质的移位、弥散,常用4℃、24小时的甲醛固定能很好地保存酶类。但对许多脱氢酶和转移酶能灭活。故不宜使用,低温,冷甲醛短时间固定(10分钟左右)固定,可显示琥珀酸脱氢酶。 电镜出现后,需要保存细胞的超微结构,以4%缓冲戊二醛(25%戊二醛16ml;0.1M二甲胂酸(pH7.)84ml;蔗糖8g)固定较好。这些固定液主要用于水解酶,而不适于许多氧化还原酶和转移酶。 (3)恒冷箱温度 一般在冷冻后10分钟,到接近冷室温度时再切,一般组织在-15~-20℃切片最易成功。每种组织有其合适的切片温度、刀的温度和冷室温度,Pearse及Bancroft的经验如下:组织刀温度组织温度恒冷箱温度 肝-18 -10 -5
免疫组化操作方法、原理、步骤以及常见问题处理大总结 1、方法操作不难,最大的难处是出现异常结果时如何解决?这就需要掌握免疫组化实验原理,每一步知道为什么这样做,这样你才敢大胆地改革先前的不对的方法步骤。如抗体孵育条件主要是抗体浓度、温度、时间,这三者一般是相互成反比的(相对),其中浓度是最重要的先决条件,温度决定反应的速度、时间决定反应的量。就拿温度来说,可以有4度、室温、37度,我推荐4度最佳,反应最温和,背景较浅;而37度反应速度较快,时间较短;室温我不太提倡,除非你每次都把环境温度控制在一定的范围,否则,尽量选择前两者。 2、免疫组化最大的优势是定位和定性。相比于其他蛋白检测方法,免疫组化具有定性灵敏度高、定位较直接准确,是定位检测分析首选方法。尤其对于有些因子的转位研究十分有用。 3、免疫组化结果定量分析的前提是高质量的染色切片。免疫组化结果也能定量分析,但必须是背景染色浅而特异性染色较深的情况下,分析最为准确,这种原则可能也是我们日常审稿时判定研究结果的必备条件。 4、免疫组化实验一定要设置阳性对照和阴性对照。阳性对照一般是用肯定表达这种抗原的切片来做;阴性对照一般是用PBS或非一抗替代一抗来进行反应,其余步骤均一致。前者是排除方法和实验系统有无问题;后者是排除有无一抗外的非特异性染色。 5、免疫组化的应用广泛,是当前实验研究的最重要方法之一。如今发SCI论文时,明显感觉仅靠量化的数据来发文章很难,加一些形态学数据或图片,老外十分欢迎,可能是怕你学术造假吧。当然也不能做假阳性或假阴性结果。 6、免疫组化技术掌握与否的鉴定标准是同一切片或不同切片中不同抗原均从摸索浓度或条件而做出优良的染色切片。我在平时带教中就发现许多研究生把我已经摸索很成熟的反应条件、浓度、方法步骤,重复运用于同一性质的切片和同一种抗体,做出来后就觉得自己已经掌握了免疫组化方法,更换一种抗体后,居然连二抗的种属来源都拿错了。失败往往促进你去思考试验原理和过程,成功有时也加快你自傲。 7、实验方法需要动手+动脑。如今我还不敢说我在免疫组化什么都知道。我只所以今天敢在这里说这说那,这是因为我经过了反复的动手+动脑,把理论原理运用于实践,在把实践中发现的问题带到理论知识中去解决,最终把理论与实践融会贯通。 一、概念和常用方法介绍 1、定义用标记的特异性抗体对组织切片或细胞标本中某些化学成分的分布和含量进行组织和细胞原位定性、定位或定量研究,这种技术称为免疫组织化学(immunohistochemistry)技术或免疫细胞化学(immunocytochemistry)技术。 2、原理根据抗原抗体反应和化学显色原理,组织切片或细胞标本中的抗原先和一抗结合,再利用一抗与标记生物素、荧光素等的二抗进行反应,前者再用标记辣根过氧化物酶(HRP)或碱性磷酸酶(AKP)等的抗生物素(如链霉亲和素等)结合,最后通过呈色反应或荧光来显示细胞或组织中化学成分,在光学显微镜或荧光显微镜下可清晰看见细胞内发生的抗原抗体反应产物,从而能够在细胞爬片或组织切片上原位确定某些化学成分的分布和含量。 3、分类 1)按标记物质的种类,如荧光染料、放射性同位素、酶(主要有辣根过氧化物酶和碱性磷酸酶)、铁蛋白、胶体金等,可分为免疫荧光法、放射免疫法、免疫酶标法和免疫金银法等。2)按染色步骤可分为直接法(又称一步法)和间接法(二步、三步或多步法)。与直接法相比,间接法的灵敏度提高了许多。3)按结合方式可分为抗原-抗体结合,如过氧化物酶-抗过氧化物酶(PAP)法;亲和连接,如卵白素-生物素-过氧化物酶复合物(ABC)法、链霉菌抗生物素蛋白-过氧化物酶连结(SP)法等,其中SP法是比较