
2014年上海市17个区县高考二模化学试题分类汇编
基础理论综合
说明:试题摘选自2014年上海二模试卷 四.(2014年3月浦东二模)(12分)
23.在含Mg 2+、Al 3+、H +、Cl -的混合溶液中滴加NaOH 溶液,与OH -发生反应的顺序为:_____、_____、Mg 2+和___________。
在NaOH 滴加过量后的澄清溶液中,浓度最高的离子是____。 24.加热条件下,一氧化碳与硫反应可生成硫氧化碳(COS)。
(1)写出S 原子核外最外层电子排布式_________
(2)每摩尔COS 气体中含电子____N A (阿佛加得罗常数)个。 (3)写出COS 的电子式。__________
25.海水中含量较高的金属元素有Na 、Mg 、Ca 等,地壳中含量最高的Al 、Fe 在海水中的含量却极低,以至食盐提纯过程一般无需考虑除Fe 3+、Al 3+或AlO 2-。为什么海水中Al 元素的含量极低?_________________________________________________________
26.某些非金属单质可与水发生置换反应,如2F 2+2H 2O→4HF+O 2。非金属单质与水发生置换反应的另一个熟知实例是(用热化学方程式表示,热值用Q
表示,Q>0):
_________________________________________________
27.一银制摆件因日久在表面生成硫化银而变黑。使银器复原的一种方法是利用原电池原理:在一铝锅中盛盐水,将该银器浸入,并与锅底接触,放置一段时间,黑色褪去。 (1)构成原电池负极的材料是______。
(2)操作后可闻盐水微有臭味,估计具有臭味的物质是_____。 四.(12分)
23.H +、Al 3+Al(OH)3 Na + (3分) 24.(1)3s 23p 4 (2)30 (3) (3分)
25.海水为中性或极弱的碱性,Al 3+、AlO 2-均不能显量存在 (2分)
26.C(s)+H 2O(g)??→
?高温
CO(g)+H 2(g)-Q (2分) 27(1)铝(2)H 2S 五.(2014年3月浦东二模)(12分)
28.将新制氯水逐滴滴入FeBr 2溶液中,写出最初发生的反应的离子方程式,并标出电子转移的方向和数目。
______________________________________________________
29.在硫酸铝铵(NH 4Al(SO 4)2)溶液中滴加少量Ba(OH)2溶液并不断搅拌。用一个 离子方程式表示最初发
生的反应。
________________________________________________
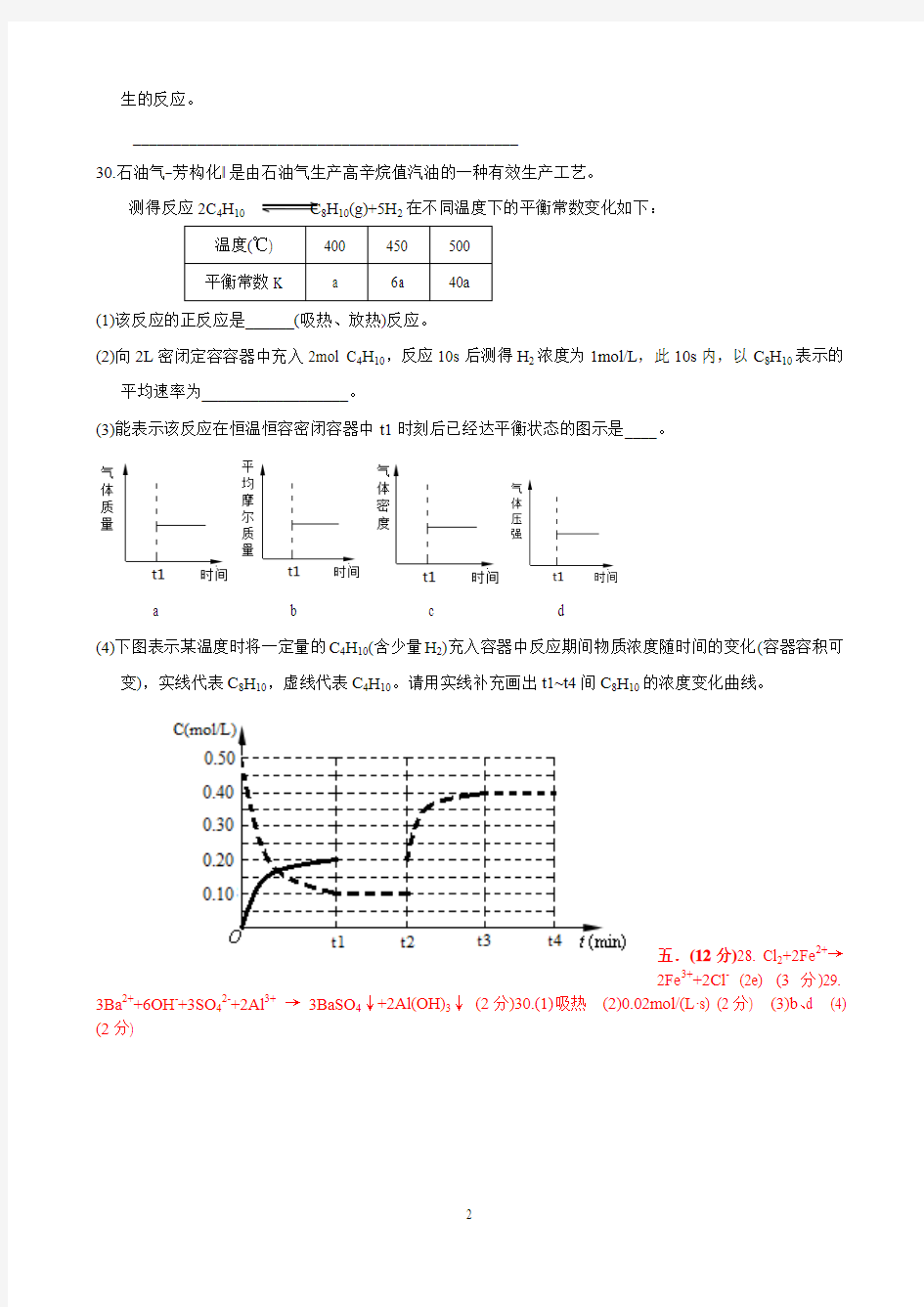
30.石油气―芳构化‖是由石油气生产高辛烷值汽油的一种有效生产工艺。
测得反应2C4H10C8H10(g)+5H2在不同温度下的平衡常数变化如下:
(1)该反应的正反应是______(吸热、放热)反应。
(2)向2L密闭定容容器中充入2mol C4H10,反应10s后测得H2浓度为1mol/L,此10s内,以C8H10表示的
平均速率为__________________。
(3)能表示该反应在恒温恒容密闭容器中t1时刻后已经达平衡状态的图示是____。
a b c d
(4)下图表示某温度时将一定量的C4H10(含少量H2)充入容器中反应期间物质浓度随时间的变化(容器容积可
变),实线代表C8H10,虚线代表C4H10。请用实线补充画出t1~t4间C8H10的浓度变化曲线。
五.(12分)28. Cl2+2Fe2+→
2Fe3++2Cl-(2e) (3分)29. 3Ba2++6OH-+3SO42-+2Al3+→3BaSO4↓+2Al(OH)3↓(2分)30.(1)吸热(2)0.02mol/(L·s) (2分) (3)b、d (4) (2分)
AA
四、(2014年3月崇明二模)阅读下列材料,完成相应填空,答案写在答题纸上。(共12分)
合金是建造航空母舰的主体材料。如:航母舰体可由合金钢制造,航母升降机可由铝合金制造;航母螺旋桨主要用铜合金制造。
23.Al 原子核外电子占据 个纺锤形轨道;
Fe 原子核外电子排布式为22626621S 2S 2P 3S 3p 3d 4S ,铁原子核外有 种能量不同的电子。 24.下列事实可用作比较Al 和Fe 金属性强弱依据的是……………………………………( ) A .Al 的导电性、导热性比Fe 更好
B .3Al (OH)可溶于NaOH 溶液,3Fe (OH)不溶于NaOH 溶液
C .相同质量的Al 片和Fe 片,投入到等浓度的稀硫酸溶液中,Al 片产生氢气更多
D .在野外利用铝热剂焊接铁轨
25.航母在海洋中行驶时,舰体发生的电化学腐蚀类型为: ,
其中正极发生的电极反应式为: 。
26.取a 克Cu-Al 合金样品用酸完全溶解后,加入过量NaOH ,过滤、洗涤、烘干、灼烧得a 克固体,则
合金中Cu 的质量分数为 。
27.Al-Mg 合金焊接前用NaOH 溶液处理铝表面Al 2O 3膜,其化学方程式为:
。
28.取适量Al-Mg 合金样品置于烧杯中,加入20mL 1 mol/L 的NaOH 溶液,恰好完全反应。
下列叙述正确的是…………………………………………………………………………( ) A .Mg 作负极,Al 作正极
B .该反应速率比纯铝与NaOH 溶液的反应速率快
C .若把NaOH 中的H 换成
D (D 为重氢),生成的氢气中D 与H 物质的量之比为1:2
D .若加入的是20mL 1 mol/L 的盐酸,则放出的氢气的物质的量减少
2
3
四、(共12分)
23.4 (1分) , 7种 (1分) 24.D (2分)
25.吸氧腐蚀(1分), O 2 +2H 2O+4e →4OH ― (1分)26.0.80 (2分) 27. Al 2O 3 + 2NaOH → 2NaAlO 2 +H 2O (2分)28.BD (2分)
五、(2014年3月崇明二模)阅读下列材料,完成相应填空,答案写在答题纸上。(共12分)
我们学过的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,且均符合勒夏特列原理。 一定温度下,向1 L 密闭容器中加入1 mol HI(g),发生反应 有关物质的量随时间的变化如图所示。
29.0~2 min 内的平均反应速率 (HI)v = 11mol L min --??
平衡常数表达式为K = 。
30.相同温度下,若开始加入HI (g)的物质的量是原来的2倍,则 是原来的2倍。
A .平衡常数
B .HI 的平衡浓度
C .达到平衡的时间
D .平衡时体系压强
31.下列措施肯定能使平衡向逆反应方向移动的是的………………………………………( ) A .充入少量氨气
B .降温至0℃
C .充入少量硫化氢
D .加压
32.常温下,将pH 3=的盐酸a L 分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为311.010mol L --??的氨水b L ; ②31 (OH ) 1.010mol L c ---=??的氨水c L ;
③31 (OH ) 1.010mol L c ---=??的氢氧化钡溶液d L 。
则a 、b 、c 、d 之间由大到小的关系是: 。 33.常温下,取pH 2=的盐酸和醋酸溶液各100 mL ,向其中分别加入
适量的Zn 粒,反应过程中两溶液的pH 变化如右图所示。则图中 表示醋酸溶液中pH 变化曲线的是 (填―A‖或―B‖);设 盐酸中加入的Zn 质量为1m ,醋酸溶液中加入的Zn 质量为2m , 则1m 2m 。(选填―<‖、―=‖、―>‖)
34.某温度时,在25mL 0.1mol/L NaOH 溶液中逐滴加入0.2mol/L CH 3COOH 溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是………………………………………………( )
A .在A 、
B 间任一点,溶液中一定都有
3 (Na ) (CH COO ) (OH ) (H )c c c c +--+>>>
B .在B 点,12.5a >,且有
3 (Na ) (CH COO ) (OH ) (H )c c c c +--+===
V
(CH 3COOH)/mL
C .在C 点:3 (CH COO ) (Na ) (OH ) (H )c c c c -+-+>>>
D .在D 点:33 (CH COO ) (CH COOH)2 (Na )c c c -++=
五、(共12分)
29.0.1mol/(L·min) (1分) (1分)30.BD (2分)
31.A (2分)32.b>a=d>c (2分)33.B ,< (各1分)34.D (2分)
四、(2014年3月奉贤二模)(12分)
石棉矿是天然纤维状硅酸盐类矿物的总称,可分为蛇纹石石棉矿(又称温石棉矿)和闪石类石棉矿两大类。蛇纹石石棉矿具有优良的性能,在工业中应用广泛,在国防和航天工业中亦有许多用途。 23、―蛇纹石石棉‖的氧化物形式为6MgO?4SiO 2?4H 2O ,其中原子半径最大的元素在周期表中的位置是______________________。Si 原子的核外有_____种能量不同的电子,其最外层电子的运动状态有____种。SiO 2与NaOH 溶液反应的化学方程式为_____________________。
24、能材料是当今科学研究的热点。氢气作为一种清洁能,必须解决它的储存问题,C
60(结构见右图)可用作储氢材料。继C 60后,科学家又合成了Si 60、N 60,下列有关说法正确的是_____。
a. C 60、Si 60、N 60都属于新型化合物
b. C 60、Si 60、N 60互为同分异构体
c.已知N 60结构与C 60相似,由于N-N 键能小于N≡N ,故N 60的稳定性弱N 2
d. 已知金刚石中C -C 键长154pm ,C 60中C -C 键长145~140pm ,故C 60熔点高于金刚石
常温下,将a mL 三种一元酸分别和NaOH 溶液等体积混合,实验数据如下:
25、丙组实验发生反应的离子方程式为, 所得溶液中由水电离出的c (OH -
) =mol/L ;
比较此时HX 、HY 、HZ 三种酸的酸性强弱_________>_______>______ 26、部分实验反应过程中的pH 变化曲线如下图:
①表示乙组实验的pH变化曲线是________________(填图1或图2)
②上图中表示溶液呈中性的点为_________,表示溶液恰好完全反应的点是_______
四、(12分)23.第三周期第IIA族;5种;4种(每空1分);
SiO2 + 2NaOH →Na2SiO3 + H2O(1分)
24.c(1分)25.HZ +OH-→ H2O + Z-(2分);1×10-5(1分);HY>HZ>HX(1分)
26.①图1(1分)②BD,BE(各1分,全对才给分共2分)
五、(2014年3月奉贤二模)(12分)
(Ⅰ)空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
27、上述3种气体直接排入空气后会引起酸雨的气体有(填化学式)。
28、早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g)SO3(g)+NO(g)
①若已知2SO2(g)+O2(g)2SO3(g) + Q12NO(g)+O2(g)2NO2(g) + Q2
则SO2(g)+NO2(g)SO3(g)+NO(g)+ Q3 , Q3=kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:
SO2(g)+NO2(g)SO3(g)+NO(g)。下列事实中不能
..说明该反应达到平衡状态的是____(选填序号)。
a.体系压强保持不变b.混合气体的颜色保持不变
c.NO的物质的量保持不变d.每生成1 mol SO3的同时消耗1 mol NO2
29、矿石燃料的燃烧是造成酸雨的主要因素之一。而甲醇日趋成为
重要的有机燃料,通常利用CO和H2 合成甲醇,其反应的化学方程
式为CO(g)+2H2(g)CH3OH(g)。今在一容积可变的密闭容器中,
充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)
与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为反应(填―放热‖或―吸热‖)。
②A、B、C三点的平衡常数K A、K B、K C的大小关系为。
(Ⅱ)铁是人体中必需微量元素中含量最多,体内缺失会引起贫血。含FeO42-离子的盐具有强氧化性,能杀菌消毒,如高铁酸钾是一种新型、高效的消毒剂及绿色净水剂。铁及其化合物之间的相互转化可用下式表示:
,
请回答下列有关问题:
30、Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。
可选用的试剂是_________(选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
31、上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+→Cu2++5Fe2++2S,
则下列说法正确的是_________(选填序号);
a.反应中,所有铁元素均被还原
b.从物质的组成看,黄铜矿属于复盐
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol 电子时,有46 g CuFeS2参加反应
32、下列是工业制取高铁酸钾的一种方法,请在方框内填上合适的微粒符号并配平该离子方程式:
__Fe3+ +__+ __Cl2 →__FeO42- + __Cl- +___
五、(12分)
27.SO2、NO2(1分,全对给分)
28. (2分);②a 、d(2分);
29.①放热②K A=K B>K C(每空1分)
30.d(1分)
31.d (2分)
32._2_Fe3++_16_OH-+_3_Cl2→_2_FeO42-+_6_NO3-+ 6Cl- +8H2O
四、(2014年3月黄埔二模)(本题共12分)
沸石是一大类天然结晶硅铝酸盐的统称。自然界中已发现的沸石有30多种,较常见的有方沸石NaAlSi2O6·H2O、钠沸石Na2Al2Si3O10·2H2O和钙沸石CaAl2Si3O10·3H2O等。
完成下列填空:
23.钠原子核外共有种不同能量的电子,这些电子分占种不同的轨道。
24.常温下,下列5种钠盐浓度均为0.1mol·L-1的溶液,对应的pH如下:
上述盐溶液中的阴离子,结合H+能力由强到弱的顺序是____________________________。25.NaOH在实验室中常用来进行洗气和提纯,当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________________________。
26.金属铝与一般的金属比较,在化学性质上表现出的三大特性为:
。
27.晶体硅、金刚石和金刚砂(SiC)硬度由大到小的顺序是。
28.钙沸石CaAl2Si3O10·3H2O改写成氧化物的形式为。
四、(本题共12分)
23. 4 6 (2分)
24. CO32-> CN- > ClO-> HCO3- >CH3COO-(2分)
25. c(Na+) >c(HCO3-) >c(CO32-) > c(OH-) > c(H+)(2分)
26.高温下能与一些金属氧化物发生铝热反应;常温下遇浓硫酸或浓硝酸产生钝化现象;能与强碱溶液反
应生成盐并放出氢气。(3分)
27. 金刚石>金刚砂>晶体硅(1分)
28. CaO·Al2O3·3SiO2·3H2O(2分)
五、(2014年3月黄埔二模)(本题共12分)
氮化硅(Si3N4
SiO2
2
(g) 3N4(s) +
29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是,其还原产物是。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。32.该反应的平衡常数表达式为K
‖或―不变‖)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆渐变的原因是,t3引起变化的因素为,t5时引起v逆大变化、v正小变化的原因是。
五、(本题共12分)
29.
SiO2Si3
高温
12e
高温
(配平1分,标明电子转移方向和数目共1分) 30. 氮气 氮化硅(化学式同样给分) (2分)
31. 起点、终点与原图像一致(1分),波峰的高度比原图像低(1分)。图示答案略。 32. K =[c (CO)]6/[c (N 2)]2 (1分) 减小(1分)
33. 增大了氮气的浓度(1分) 加入(使用)了(正)催化剂(1分) 升高温度或缩小容器体积(2分)
四、(2014年3月普陀二模)(本题共12分)
硅是重要的半导体材料,构成现代电子工业的基础。请回答下列问题:
23、硅原子中能量最高的电子处在电子层上(填写电子层符号),该层电子占有的原子轨道数为。 24、单质硅存在与金刚石结构类似的晶体,其中硅原子之间以相结合(选填编号)。14克单晶硅中存在个Si-Si 键。
a .极性键
b .非极性键
c .离子键
d .范德华力 25、写出SiH 4在氧气中燃烧的化学方程式:; 26、SiH 4的热稳定性不如CH 4,其原因是。
工业上硅铁可以用于冶镁。以煅白(CaO?MgO )为原料与硅铁(含硅75%的硅铁合金)混合,置于密闭设备中于1200℃发生反应:
2(CaO?MgO)(s) + Si(s)
Ca
2SiO 4 (l) + 2Mg(g)
27、常温下镁的还原性强于硅。上述方法能够获得镁的原因是___________________________________________________。
28、若上述反应在容积为a L 的密闭容器中发生,一定能说明反应已达平衡的是(选填编号)。 a .反应物不再转化为生成物 b .炉内Ca 2SiO 4与CaO?MgO 的质量比保持不变 c .反应放出的热量不再改变 d .单位时间内,n(CaO?MgO)消耗 : n(Ca 2SiO 4)生成 = 2 : 1 若b g 煅白经t min 反应后转化率达50%,该时段内Mg 的生成速率是。 四、(本题共12分)
23、M (1分);3 (1分) 24、b (1分); N A (1分)
25、SiH 4 + O 2??→
?点燃
SiO 2 + 2H 2O (1分) 26、 非金属性C ﹥Si ,它们的气态氢化物的热稳定性CH 4﹥SiH 4(1分)
27、1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动。(2分) 28、b 、c (2分);(0.5b/96at) mol/(L.min) (2分)
五、(2014年3月普陀二模)(本题共12分)
硫、氯及其化合物有广泛的用途。
29、工业上通过电解饱和食盐水生产氯气。在立式隔膜式电解槽中铁电极上的电极反应式为。
30、―氯氧化法‖是指在碱性条件下用Cl 2将废水中的CN - 氧化成无毒的物质。用化学符号写出CN - 被氧化后的产物。
31、―氯胺(NH 2Cl )消毒法‖是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl 2 + NH 3 → NH 2Cl + HCl ,生成的NH 2Cl 能部分水解生成强氧化性的物质,起消毒杀菌的作用。 ①氯胺能用于消毒杀菌的原因是(用化学方程式表示)。
②经氯胺消毒法处理后的水中,氮元素多以NH 4+ 的形式存在。已知:
NH 4+(aq) + 1.5O 2(g) → NO 2-(aq) + 2H +(aq) + H 2O (l) + 273 kJ NH 4+(aq) + 2O 2(g) → NO 3-(aq) + 2H +(aq) + H 2O (l) + 346 kJ NO 2-(aq)被O 2氧化成NO 3-(aq)的热化学方程式为。
A. 在水产养殖中,可以用Na 2S 2O 3将水中残余的微量Cl 2除去,发生反应时氧化剂与还原剂的物质的量
之比为。
下图所示装置和药品可用来制备Na 2S 2O 3。
运用上述资料回答:
33、通入一定量SO 2后,在B 处检测到有新的气体生成。判断B 处排出的气体中是否可能有H 2S ?并说明理由。 34、为获得较多的Na 2S 2
O 3,当溶液的pH 接近7时,应立即停止通入SO 2,其原因是 。
五、(本题共12分)29、2H + +2e →H 2 (1分)30、HCO 3-(或者CO 32-)、N 2 (2分) 31、① NH 2Cl+ H 2O
NH 3 + HClO (2分)
② 2NO 2- (aq) + O 2(g) → 2NO 3-(aq)+ 146 kJ (2分)32、4:1(2分)
33、可能有H 2S ,因为由电离常数可知H 2SO 3酸性强于H 2S ,溶液中的S 2-与H 2SO 3反应能生成H 2S 。
或可能没有H 2S ,因为S 2-还原性较强,能被SO 2氧化生成单质硫。(合理即可,2分) 34、通入过多SO 2会使溶液的pH 小于7,S 2O 32-在酸性溶液中不能稳定存在。(1分,合理给分) 四、(2014年3月长宁二模)(本题共12分)
微型化学实验可以有效实现化学实验绿色化的要求。如下图所示在
一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好。
根据上述描述涉及到的元素,回答23-26题
23. KMnO4中Mn元素的化合价为:_______________,
Fe在周期表中的位置是:_________________________。
24. 第三周期原子半径最小的原子共有______ 种不同能量的电子;长周期主族元素形成化合物的电子式为:__________________。
25.结合已学知识分析a、c处的可能出现的现象:
a:_____________________________ c:_________________________________
26.b处可能发生反应的离子方程式:
_______________________________________________________________________________
已知溶液中,还原性为HSO3?>I-,氧化性为IO3?>I2>SO42?.
在含3molNaHSO3的溶液中逐滴加入KIO3溶液,
加入的KIO3和析出的I2的物质的量的关系曲线如右图所示.
请回答27、28两题:
27.a点处的还原产物是:____________(填离子符号);
b点→c点反应的离子方程式是:_________________________________________
D.当溶液中的I-为0.5mol时,加入的KIO3可能是:____________________ mol.
四、(共12分)
23 +7 第四周期Ⅷ族(2分)24. 5 (2分)
25.溶液变为蓝色红色褪去(或红色变浅)(2分)
26.2Fe2++Cl2→2Fe3+ +2 Cl- Fe3+ +3SCN-→Fe(SCN)3(2分)
27. I- ;IO3-+6H++5I-→3H2O+3I2 (2分)28. 0.5或1.1 (2分)
五、(2014年3月长宁二模)(本题共12分)
BCl3是重要的化工原料,其沸点12℃。500℃时,向2L的密闭容器中按一定比例投入B2O3、C、Cl2,模拟工业制取三氯化硼。
29、配平模拟工业制取三氯化硼的反应方程式:
B
O3(s) + C(s) + Cl2(g) BCl3 (g) + CO(g)
2
30、若上述反应转移了0.3mol电子,则生成了mol的BCl3。
31.反应至4min时达到平衡,则下列说法正确的是。
A.3min时,CO的消耗速率大于氯气的消耗速率
B.2min至4min时BCl3的生成速率比0至2min时的快
C.反应起始至平衡,气体的密度不断增大
D .达到平衡后,容器内的压强不再变化
32.达到平衡后,若向容器内加入少量的B 2O 3 ,则氯气的转化率将______(填:增大、减小、不变);若提高反应体系的温度,容器内的气体平均分子量减小,则该反应为_____(填:―吸‖、―放‖)热反应。 33.若要提高单位时间内BCl 3的产量,且保持平衡常数不变,下列做法正确的是_____ 。 A . 增大反应容器的体积
B .将混合气体经冰水浴冷却后,再将气体升温至500℃循环进入反应容器
C .加入适当的催化剂
D . 升高反应体系的温度
34、反应起始至3min 时固体质量减少了15.84克,则氯气的平均反应速率为_____________。 五.(共12分)
29、1、3、3、2、3(2分) 30、0.1(2分) 31、 CD (2分);32、不变;吸;(2分) 33、C (2分) 34、0.075 mol/(L·min)(2分,单位不写扣1分);
四、(2014年3月闸北二模)(本题共12分)
某离子反应中涉及N 2、H 2O 、ClO —、H +、NH 4+、Cl —六种微粒。其中N 2的物质的量随时间变化的曲线如右图所示
23.该反应涉及到H 、O 、Cl 、N 四种元素。其中O 元素在元素周期表中的位置是,它的原子核外有种能量不同的电子,Cl 原子最外层上有种运动状态不同的电子。
24.该离子反应中还原剂与氧化剂的物质的量之比为,每生成1mol 还原产物,转移电子 mol ,反应后溶液的pH (填―增大‖、―减小‖、―不变‖)
25.由这四种元素中任意3种所形成的常见化合物中属于离子晶体的有(填化学式,写出一个即可),该化合物的水溶液显_____(填―酸性‖、―碱性‖或―中性‖),试用离子方程式表示其原因
26.请用一个事实证明氯气的氧化性比氮气的氧化性强:______________________________。 四、填空题1(本题共12分)
23.第二周期ⅥA 族、3、7(各1分,共3分)24.2:3、2、减小(各1分,共3分) 25.(共4分)NH 4Cl 或NH 4NO 3(1分)酸性(1分) NH 4+ + H 2
O NH 3·H 2O + H +(2分)26.3
Cl 2+8NH 3→6 NH 4Cl +N 2 或3 Cl 2+2NH 3→6 HCl +N 2(合理即可)(2分) 五、(2014年3月闸北二模)(本题共12分) 以焦炭为原料,制取乙二醇的过程如下:
27.草酸二甲酯―催化还原‖制乙二醇的反应原理如下:
CH 3OOC-COOCH 3(g)+4H 2
(g)
HOCH 2-CH 2OH(g)+2CH 3OH(g)
此反应的平衡常数表达式K =_______________________
将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,可以发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到三组数据(见下表)。
28.实验1达平衡时,CO(g)的浓度为mol/L。
29.实验3跟实验2相比,改变的条件可能是(答出一种情况即可)。
草酸二甲酯的水解产物草酸(H2C2O4)为二元中强酸。常温下,向10mL 0.1 mol/LH2C2O4溶液中逐滴加入0.1 mol/L KOH溶液,所得滴定曲线如右图所示。
30.在草酸氢钾溶液中存在如下平衡:
种二维结构属于(选填编号)。
a. 离子晶体
b. 原子晶体
c. 分子晶体
d. 其它类型 25.与硫元素的相关性质比,以下不能..
说明P 的非金属性比S 弱的是(选填编号)。 a. 磷难以与氢气直接化合 b. 白磷易自燃 c. P –H 的键能更小 d. H 3PO 4酸性更弱
26.次磷酸钠(NaH 2PO 2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。
化学镀镍的溶液中含有Ni 2+ 和H 2PO 2-
,在酸性条件下发生以下镀镍反应:
Ni 2+ + H 2PO 2-
+ → Ni+ H 2PO 3-
+
(1)请配平上述化学方程式。
(2)上述反应中,若生成1 mol H 2PO 3-
,反应中转移电子的物质的量为。
27.NaH 2PO 4、Na 2HPO 4和Na 3PO 4可通过H 3PO 4与NaOH 溶液反应获得,含磷各物种的分布分数(平衡时
某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示。 (1)pH=8时,溶液中主要含磷物种浓度大小关系
为_________________________________。 (2)为获得尽可能纯的NaH 2PO 4,pH 应控制在。 四、(本题共12分)
23.15;垂直;6;60(共4分,各1分) 24.d.(1分)
25.b (1分,多选不给分)
26.(1)Ni 2+ + H 2PO 2-
+ 1H 2O → Ni+1H 2PO 3-
+ 2 H +(2分)(2)2mol (1分)
27.(1)[HPO 42-
]>[H 2PO 4-
](1分);
(2)4~5.5(介于此区间内的任意值或区间均可)(2分) 五、(2014年3月静安二模)(本题共12分)
最近有科学家提出
―绿色自由‖的构想:把含有CO 2的空气吹入K 2CO 3溶液中,然后再用高温水气分解出CO 2,经与H 2化合后转变为甲醇燃料。
28.在整个生产过程中饱和K 2CO 3溶液的作用是;不用KOH 溶液的理由是。
29.在合成塔中,每44g CO 2与足量H 2完全反应生成甲醇时,可放出49.5 kJ 的热量,试写出合成塔中发
生反应的热化学方程式;转化过程中可循环利用的物质除了K 2CO 3外,还有。 30.请评述合成时选择2×105Pa 的理由。
31.BaCO3的溶解平衡可以表示为BaCO3(s)Ba2++ CO32-
(1)写出平衡常数表达式;
(2)用重量法测定空气中CO2的体积分数时,选用Ba(OH)2而不是Ca(OH)2为沉淀剂,原因之一是:25℃时,BaCO3的溶解平衡常数K=2.58×10-9,而CaCO3的溶解平衡常数K=4.96×10-9;原因之二是_____________________________________________________。
32.某同学很快就判断出以下中长石风化的离子方程式未配平:
4Na0.5Ca0.5Al1.5Si2.5O6+ 6CO2+ 17H2O→2Na++ 2Ca2++ 5HCO3-+ 4H4SiO4+ 3Al2SiO5(OH)4
该同学判断的角度是。
33.甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2+4KOH→2K2CO3+ 6H2O
该电池负极的电极反应式为:CH3OH–6e+ 8OH-→CO32-+ 6H2O
则正极的电极反应式为:。
五、(本题共12分)
28.富集CO2(1分);生成的K2CO3难分解产生CO2(1分)
29.CO2(g)+3H2(g)→ CH3OH(g)+H2O(g)+49.5kJ(2分);水蒸气(1分)
30.适当加压有利于提高反应速率和原料利用率(2分),但压强太高增大成本(1分)。
31.K= c(Ba2+)c(CO32-)(1分);BaCO3的式量大,相对误差小(1分)
32.未配平两边电荷数(1分)
33.O2+ 2H2O+ 4e→4 OH-(1分)
四、(2014年3月闵行二模)(本题共12分)
氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。含氮元素的化合物在工业生产和国防建设中都有广泛的应用。
23.氮元素原子核外有个未成对电子,最外层有种能量不同的电子。
PH3分子的空间构型为,是分子。(填极性或非极性)
24.氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是(填编号)
a.NH3比PH3稳定性强
b.硝酸显强氧化性,磷酸不显强氧化性
c.氮气与氢气能直接化合,磷与氢气很难直接化合
d.氮气常温是气体,磷单质是固体
亚硝酸盐是食品添加剂中急性毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。
25.亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色变为绿色,反应如下,补上缺项物质并配平:____Cr2O72-+ _____NO2-+_________ → _____Cr3+ + _____NO3-+________
26.上题反应中每消耗0.6mol NO2-,转移电子数为__________。
27、氮氧化物(NO和NO2)污染环境。若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式为。
四.(共12分)
23.(4分)32 三角锥形极性
24.(2分)a c
25.(2分)Cr2O72-+ 3NO2-+ 8H+→2Cr3+ + 3NO3-+ 4H2O
26.(2分)1.2N A
27.(2分) 2NO2+CO32-→NO2-+NO3-+CO2
五、(2014年3月闵行二模)(本题共12分)
工业制硫酸的过程中利用反应2SO2(g)+O2(g)2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
28.写出该可逆反应的化学平衡常数表达式;
29.一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,下列说法中,正确的是(填编号)。
a.若反应速率υ正(O2)=2υ逆(SO3),则可以说明该可逆反应已达到平衡状态
b.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
c.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
d.平衡后升高温度,平衡常数K增大
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
30.实验1从开始到反应达到化学平衡时,υ(SO2)表示的反应速率为;
T1T2 (选填―>‖、―<‖或―=‖),理由是_______________________________。
尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
31.该溶液中c(Na+)与c(OH-)之比为。
该溶液中c(OH—)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
32.如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是(用编号排序)
A.Na2SO3B.Ba(NO3)2 C.Na2S D.酸性KMnO4
五.(共12分)
28.(1分)K=[SO3]2/([SO2]2[O2])
29.(1分)c
30.(2分)0.2mol/(L·min)
(2分)>;反应放热,温度升高平衡向左移动,反应物转化率低
31.(2分)2×105 ;
(2分)c(HSO3-)+2c(H2SO3)
32.(2分)B>C = D>A
四、(2014年3月徐汇二模)(本题12分)
液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
23.写出羰基硫的电子式,羰基硫分子属于____________(选填―极性‖、―非极性‖)分子。
24.下列能说明碳与硫两元素非金属性相对强弱的是。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
25.羰基硫在水存在时会缓慢水解生成H2S,对钢铁设备产生电化学腐蚀。写出正极的电极反应式____________________,负极的反应产物为_____________(填化学式)。
为除去羰基硫,工业上常采用催化加氢转化法,把羰基硫转化为H2S再除去:
COS + H2CO + H2S
26.已知升高温度,会降低羰基硫的转化率。则升高温度,平衡常数K________,反应速率____________(均选填―增大‖、―减小‖、―不变‖)。
27.若反应在恒容绝热密闭容器中进行,能说明该反应已达到平衡状态的是______。
a.容器内气体密度保持不变b.容器内温度保持不变
c.c(H2) = c(H2S) d.υ(H2)正= υ(H2S)正
28.已知该反应的平衡常数很大,说明______________________。
【参考答案】四、(本题12分)
23.O S,极性(各1分,共2分)
24.a c (2分)
25.H2S + 2e →H2↑+S2-(或2H+ + 2e →H2↑)(2分)FeS(1分)
26.减小,增大(各1分,共2分)
27.b (2分)
28.正反应进行程度很大(1分。其他合理答案也给分)。
五、(2014年3月徐汇二模)(本题共12分)
铁及其化合物在生产、生活中存在广泛用途,完成下列填空。
29.右图所示为铁元素在周期表中的信息,方格中―55.85‖的意义为:______。铁原子核外有________种运动状态不同的电子。
30.二茂铁[Fe(C 5H 5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于__________晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为右图中的_____(选填―a‖或―b‖)。
31.绿矾(FeSO 4·7H 2O )可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,写出发生变质反应的离子方程式_______________。
32.无水FeCl 3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl 3·6H 2O)。制备无水FeCl 3的试剂是________________。
33.高铁酸盐也是常用的水处理剂。高铁酸钠(Na 2FeO 4)可用如下反应制备:
2FeSO 4 + 6Na 2O 2 → 2Na 2FeO 4 + 2Na 2O + 2Na 2SO 4 + O 2↑
若生成2mol Na 2FeO 4,则反应中电子转移的物质的量为____________mol 。
34.高铁酸盐可将水体中的Mn 2+氧化为MnO 2进行除去,若氧化含 Mn 2+ 1 mg 的水体样本,需要1.2 mg/L 高铁酸钾__________L 。
【参考答案】五、(本题共12分)
29.铁元素的相对原子量(或铁元素的原子量)(1分) 26种(1分) 30.分子晶体(1分) b (1分)
31.12Fe 2++ 6H 2O + 3O 2 → 8 Fe 3++ 4Fe(OH)3(2分) 32.铁和氯气(2分) 33.10mol (2分) 34.2 L (2分)
a b
Fe
2020年高考化学试题分类汇编——化学反应速率和化学平衡 化学反应速率和化学平稳 〔2018天津卷〕6.以下各表述与示意图一致的是 A .图①表示25℃时,用0.1 mol·L -1 盐酸滴定20 mL 0.1 mol·L - 1 NaOH 溶液,溶液的pH 随加入酸体积的变化 B .图②中曲线表示反应2S O 2(g) + O 2(g) 2S O 3(g);ΔH < 0 正、逆反应的平稳常数 K 随温度的变化 C .图③表示10 mL 0.01 mol·L -1 KM n O 4 酸性溶液与过量的0.1 mol·L -1 H 2C 2O 4溶液混合时,n(Mn 2+) 随时刻的变化 D .图④中a 、b 曲线分不表示反应CH 2=CH 2 (g) + H 2(g)?? →C H 3C H 3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 解析:酸碱中和在接近终点时,pH 会发生突变,曲线的斜率会专门大,故A 错;正逆反应的平稳常数互为倒数关系,故B 正确;反应是放热反应,且反应生成的Mn 2+对该反应有催化作用,故反应速率越来越快,C 错;反应是放热反应,但图像描述是吸热反应,故D 错。 答案:B 命题立意:综合考查了有关图像咨询题,有酸碱中和滴定图像、正逆反应的平稳常数图像,反应速率图像和能量变化图像。 〔2018重庆卷〕10.()()()22COCl g CO g +Cl g ;0.H ??→?←??> 当反应达到平稳时,以下措施:①升温 ②恒容通入惰性气体 ③增加CO 的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl 2转化率的是 A .①②④ B .①④⑥ C .②③⑥ D .③⑤⑥ 10. 答案B 【解析】此题考查化学平稳的移动。该反应为体积增大的吸热反应,因此升温顺减压均能够促使反应正向移动。恒压通入惰性气体,相当于减压。恒容通入惰性气体与加催化剂均对平
2010高考化学试题分类汇编:化学计算 1.(2010全国卷1).下列叙述正确的是 A .在醋酸溶液的pH a =,将此溶液稀释1倍后,溶液的pH b =,则a b > B .在滴有酚酞溶液的氨水里,加入4NH Cl 至溶液恰好无色,则此时溶液的pH 7< C .31.010mol/L -?盐酸的pH 3.0=,81.010mol/L -?盐酸的pH 8.0= D .若1mL pH 1=的盐酸与100mL NaOH 溶液混合后,溶液的pH 7=则NaOH 溶液的pH 11= 【解析】A 若是稀醋酸溶液稀释则C(H +)减小,pH 增大,b >a ,故A 错误;B 酚酞的变色范围是pH= 8.0~10.0(无色→红色),现在使红色褪去,pH 不一定小于7,可能在7~8之间,故B 错误;C 常温下酸的pH 不可能大于7,只能无限的接近7;D 正确,直接代入计算可得是正确,也可用更一般的式子:设强酸pH=a ,体积为V 1;强碱的pH=b ,体积为V 2,则有10-a V 1=10-(14-b)V 210142 1-+=?b a V V ,现在V1/V2=10-2,又知a=1,所以b=11 【答案】D 【命题意图】考查弱电解质的稀释,强酸的无限稀释,指示剂的变色范围,强酸与强碱的混合pH 的计算等基本概念 【点评】本题在第一轮复习至第三轮复习无时不在强调的基本问题考查就是第二册第三章的问题,这次居然没有考离子浓度大小比较,而考这些,很简单,大家都喜欢! 2.(2010全国卷1)12.一定条件下磷与干燥氯气反应,若0.25g 磷消耗掉314mL 氯气(标准状况),则产物中PCl 3与PCl 5的物质的量之比接近于 A .1:2 B .2:3 C .3:1 D .5:3 【解析】设n(PCl 3)=X mol, n(PCl 5)=Y mol ,由P 元素守恒有:X+Y=0.25/31≈0.008……①;由Cl 元素守恒有3X+5Y=(0.314×2)/22.4≈0.028……②,联立之可解得:X=0.006,Y=0.002故选C 【命题意图】考查学生的基本化学计算能力,涉及一些方法技巧的问题,还涉及到过量问题等根据化学化学方程式的计算等 【点评】本题是个原题,用百度一搜就知道!做过多遍,用的方法很多,上面是最常见的据元素守恒来解方程法,还有十字交叉法,平均值法、得失电子守恒等多种方法,此题不
专题18 物质结构与性质(选修) 1.[2019新课标Ⅰ]在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题: (1)下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号 )。 A.B.C.D. (2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别 是、。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填“Mg2+”或“Cu2+”)。 (3)一些氧化物的熔点如下表所示: 氧化物Li2O MgO P4O6SO2 熔点/°C 1570 2800 23.8 ?75.5 解释表中氧化物之间熔点差异的原因。 (4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离= pm,Mg原子之间最短距离y= pm。设阿伏加德罗常数的值为N A,则MgCu2的密度是 g·cm?3(列出计算表达式)。 【答案】(1)A (2)sp3sp3乙二胺的两个N提供孤对电子给金属离子形成配位键Cu2+ (3)Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O。分子间力(分子量)P4O6>SO2 (4 23 330 A 824+1664 10 N a- ?? ? 【解析】(1)A.[Ne]3s1属于基态的Mg+,由于Mg的第二电离能高于其第一电离能,故其再失去一个电子所需能量较高; B. [Ne] 3s2属于基态Mg原子,其失去一个电子变为基态Mg+; C. [Ne] 3s13p1属于激发态
1(2019金山二模). 函数4)(-=x x f 的定义域是 2(2019徐汇二模). 已知点(2,5)在函数()1x f x a =+(0a >且1a ≠)的图像上,则()f x 的反函数1()f x -= 3(2019崇明二模). 设函数2()f x x =(0x >)的反函数为1()y f x -=,则1(4)f -= 3(2019松江二模). 已知函数2()log f x x =的反函数为1()f x -,则1(2)f -= 4(2019黄浦二模). 若函数()f x 的反函数为112()f x x -=,则(3)f = 7(2019长嘉二模). 设函数()f x =a 为常数)的反函数为1()f x -,若函数1()f x -的图像经过点(0,1),则方程1()2f x -=解为________ 9(2019青浦二模). 已知a 、b 、c 都是实数,若函数2()1x x a f x b a x c x ?≤?=?+<?在区间[0,)+∞上单调递增,则实数m 的取值范围为 10(2019金山二模). 已知函数x x f sin )(= 和()g x [,]ππ-,则它们的图像围成的区域面积是 10(2019徐汇二模). 已知函数4()1f x x x =+-,若存在121,,,[,4]4 n x x x ???∈使得 121()()()()n n f x f x f x f x -++???+=,则正整数n 的最大值是 11(2019青浦二模). 已知函数2()f x x ax b =++(,a b ∈R ),在区间(1,1)-内有两个零点,则22a b -的取值范围是 11(2019崇明二模). 已知函数9()||f x x a a x =+-+在区间[1,9]上的最大值是10,则实数a 的取值范围是 11(2019松江二模). 若函数||||2()4(2||9)29||18x x f x x x x =+-+-+有零点,则其所有零点的集合为 (用列举法表示) 11(2019金山二模). 若集合2{|(2)20,A x x a x a =-++-<∈x Z }中有且只有一个元素,则正实数a 的取值范围是 12(2019长嘉二模). 已知定义在R 上的奇函数()f x 满足:(2)()f x f x +=-,且当01x ≤≤时,2()log ()f x x a =+,若对于任意[0,1]x ∈,都有221()1log 32 f x tx -++≥-,则实数t 的取值范围为________ 12(2019浦东二模). 已知2()22f x x x b =++是定义在[1,0]-上的函数,若[()]0f f x ≤在定义域上恒成立,而且存在实数0x 满足:00[()]f f x x =且00()f x x ≠,则实数b 的取值范
2009年高考化学试题分类汇编:电化学基础 1.(09广东理科基础25)钢铁生锈过程发生如下反应: ①2Fe+O2+2H2O=2Fe(OH)2; ②4Fe(OH)2+O2+2H2O=4Fe(OH)3; ③2Fe(OH)3=Fe2O3+3H2O。 下列说法正确的是 A.反应①、②中电子转移数目相等 B.反应①中氧化剂是氧气和水 C.与铜质水龙头连接处的钢质水管不易发生腐蚀 D.钢铁在潮湿的空气中不能发生电化学腐蚀 答案:A 解析: ①②反应中消耗O2的量相等,两个反应也仅有O2作为氧化剂,故转移电子数是相等的,A 项正确。①中H2O的H、O两元素的化合价没有变,故不作氧化剂,B项错;铜和钢构成原电池,腐蚀速度加快,C项错;钢铁是铁和碳的混合物,在潮湿的空气的中易发生吸氧腐蚀,属于电化学腐蚀,故D项错。 2.(09安徽卷12)Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O 。下列说法正确的是 A.石墨电极上产生氢气 B.铜电极发生还原反应 C.铜电极接直流电源的负极 D.当有0.1mol电子转移时,有0.1molCu2O生成。 答案:A 解析: 由电解总反应可知,Cu参加了反应,所以Cu作电解池的阳极,发生氧化反应,B选项错误;石墨作阴极,阴极上是溶液中的H+反应,电极反应为:2H++2e-=H2↑,A选项正确;阳极与电源的正极相连,C选项错误;阳极反应为2Cu+2OH--2e-=Cu2O+H2O,当有0.1mol 电子转移时,有0.05molCu2O生成,D选项错误。 3.(09江苏卷12)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
2020高考化学试题分类汇编电化学基础 1.〔2018全国卷1〕右图是一种染料敏化太阳能电池的示意图。电池的一个点极由有机光敏燃料〔S〕涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为: TiO2/S h TQ2/S 〔激发态〕 TiO 2/S TiO 2/S+ +e- l3+2e 3I 2TiO 2/S 3I 2TiO2/S+I3 以下关于该电池表达错误的选项是: A. 电池工作时,是将太阳能转化为电能 B. 电池工作时,I离子在镀铂导电玻璃电极上放电 C. 电池中镀铂导电玻璃为正极 D. 电池的电解质溶液中I-和I 3-的浓度可不能减少 【解析】B选项错误,从示意图可看在外电路中电子由负极流向正极,也即镀铂电极做 正极,发生还原反应:13-+2e-=3I -; A选项正确,这是个太阳能电池,从装置示意图可看出是个原电池,最终是将光能转化为化学能,应为把上面四个反应加起来可知,化学物质并没 有减少;C正确,见B选项的解析;D正确,此太阳能电池中总的反应一部分实质确实是: 还原. 氧化 I「3I-的转化〔还有I 2+| 一二|「〕,另一部分确实是光敏有机物从激发态与基态的 相互转化而已,所有化学物质最终均不被损耗! 【答案】B 【命题意图】考查新型原电池,原电池的两电极反应式,电子流向与电流流向,太阳能 电池的工作原理,原电池的总反应式等,还考查考生变通能力和心理素养,能否适应生疏的 情境下应用所学知识解决新的咨询题等 【点评】此题立意专门好,然而考查过为单薄,而且取材不是最新的,在3月份江苏省 盐都市高三第二次调研考试化学试题第17题〔3〕咨询,与此题极为相似的模型,这对一些考生显得不公平!
历年高考各地化学试题分类汇编和解析 九、几种重要的金属 1.(09全国卷Ⅰ8)下列表示溶液中发生反应的化学方程式错误.. 的是 A.22222223Al NaOH H O NaAlO H ++=+↑ B.4242222KMnO HCOOK KOH K MnO CO H O ++=+↑+ C 22224(2MnO HCl MnCl Cl H O ?+=+↑+浓) D.22742424324324267()3()7K Cr O FeSO H SO Cr SO Fe SO K SO H O ++=+++ 答案:B 解析:在碱性条件下,不可能产生CO 2气体,而应是CO 32 -,故B 项错。 2.(09江苏卷3)下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是 a b c A Al AlCl 3 Al (OH )3 B HNO 3 NO NO 2 C Si SiO 2 H 2SiO 3 D CH 2=CH 2 CH 3CH 2OH CH 3CHO 答案:B 解析:A 项:3Al AlCl → (322623Al HCl AlCl H +=+↑或者24243223()3Al H SO Al SO H +=+↑, 33()AlCl Al OH →(332343()3AlCl NH H O Al OH NH Cl +?=↓+),33()Al OH AlCl →(332()33Al OH HCl AlCl H O +→+),3()Al OH Al →的转化必须经过 323 ()Al OH Al O →(反应方程式为:32322()3Al OH Al O H O +灼烧)和23Al O Al →(232243Al O Al O +↑通电)这两步,所以A 项不选; B 项:3HN O N O →(3322833()24HNO Cu Cu NO NO H O +=+↑+),2NO NO →(2222NO O NO +=),2N O N O →(22332NO H O HNO NO +=+),23NO HNO →(22332NO H O HNO NO +=+),所以B 项正确; C 项:2S i S i O →(22Si O SiO +=),223SiO H SiO →必须经过两步
01.宝山区 76.近年人们欢度新春佳节的方式不尽相同。有些人喜欢在家里聚会,有些人喜欢在餐馆聚餐,还有些人喜欢出国过年...... 请给你的父母写一封邮件,告诉他们你更喜欢哪种方式。你的文章必须包括: ●简单陈述你喜欢的过年方式 ●建议明年家里过年的方式,并说明理由 注意:请勿透露本人真实姓名和学校名称 02.崇明区 76. 在新冠病毒疫情期间,各校都在通过网络进行线上教学。中华中学在学校网站的贴吧里,就如何提高线上学习的有效性开展了大讨论。假设你是该校学生王平,有意在贴吧中发表你的观点,你所写的内容应包括: ?学生该怎么做及其理由; ?你期望老师怎么做及其理由。 注:文中不得提及你的真实姓名或学校。 03.奉贤区 Directions:Write an English composition in 120-150 words according to the instructions given below in Chinese. 请简要描述图片内容,并结合生活或学习中的例子谈谈你对该图的理解。 04.虹口区 Directions: Write an English composition in 120-150 words according to the instructions given below in Chinese.
假如你是明启中学的学生李华。为了推动校园文化建设,展现当代学生风采,校学生会正策划学生“校园之星”评选活动。学生会初步拟定了“学习之星”、“才艺之星”和“运动之星”三个评选项目。请你给学生会写一封电子邮件,要求增加一个评选项目,并就这个评选项目谈谈你的看法。你的邮件必须包含以下内容: ●你要求增加的评选项目; ●你的理由; ●你对此项目评选的具体实施建议。 注意:作文中不得出现你本人的姓名、班级及学校等真实信息。
专题9 有机化合物 Ⅰ—生活中常见的有机物 1.(2017?北京-7)古丝绸之路贸易中的下列商品,主要成分属于无机物的是 A.瓷器B.丝绸C.茶叶D.中草药 A.A B.B C.C D.D 【答案】A 【解析】含有碳元素的化合物为有机物,有机物大多数能够燃烧,且多数难溶于水;无机 物指的是不含碳元素的化合物,无机物多数不能燃烧,据此分析。 A、瓷器是硅酸盐产品,不含碳元素,不是有机物,是无机物,故A正确; B、丝绸的主要成分是蛋白质,是有机物,故B错误; C、茶叶的主要成分是纤维素,是有机物,故C错误; D、中草药的主要成分是纤维素,是有机物,故D错误。 【考点】无机化合物与有机化合物的概念、硅及其化合物菁优网版权所有 【专题】物质的分类专题 【点评】本题依托有机物和无机物的概念考查了化学知识与生活中物质的联系,难度不大,应注意有机物中一定含碳元素,但含碳元素的却不一定是有机物。 Ⅱ—有机结构认识 2.(2017?北京-10)我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下。下列说法不正确的是 A.反应①的产物中含有水 B.反应②中只有碳碳键形式
C.汽油主要是C5~C11的烃类混合物 D.图中a的名称是2﹣甲基丁烷 【答案】B 【解析】A.从质量守恒的角度判断,二氧化碳和氢气反应,反应为CO2+H2=CO+H2O,则产物中含有水,故A正确; B.反应②生成烃类物质,含有C﹣C键、C﹣H键,故B错误; C.汽油所含烃类物质常温下为液态,易挥发,主要是C5~C11的烃类混合物,故C正确;D.图中a烃含有5个C,且有一个甲基,应为2﹣甲基丁烷,故D正确。 【考点】碳族元素简介;有机物的结构;汽油的成分;有机物的系统命名法菁优网版权【专题】碳族元素;观察能力、自学能力。 【点评】本题综合考查碳循环知识,为高频考点,侧重考查学生的分析能力,注意把握化 学反应的特点,把握物质的组成以及有机物的结构和命名,难度不大。 C H, 3.(2017?新课标Ⅰ-9)化合物(b)、(d)、(p)的分子式均为66 下列说法正确的是 A. b的同分异构体只有d和p两种 B. b、d、p的二氯代物均只有三种 C. b、d、p均可与酸性高锰酸钾溶液反应 D. b、d、p中只有b的所有原子处于同一平面 【答案】D 【解析】A.(b)的同分异构体不止两种,如,故A错误 B.(d)的二氯化物有、、、、、, 故B错误 KMnO溶液反应,故C错误 C.(b)与(p)不与酸性4 D.(d)2与5号碳为饱和碳,故1,2,3不在同一平面,4,5,6亦不在同 一平面,(p)为立体结构,故D正确。 【考点】有机化学基础:健线式;同分异构体;稀烃的性质;原子共面。 【专题】有机化学基础;同分异构体的类型及其判定。 【点评】本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把 握有机物同分异构体的判断以及空间构型的判断,难度不大。 Ⅲ—脂肪烃
图像试题 (2011烟台毕业)19.下列四个图像能正确反映其对应实验操作的是 ①②③④ (A)①高温煅烧一定质量的石灰石 (B)②用等质量、等浓度的双氧水分别制取氧气 (C)③向一定体积的稀盐酸中逐滴加入氢氧化钠溶液 (D)④某温度下,向一定量饱和硝酸钾溶液中加人硝酸钾晶体 (2011潍坊毕业)16.下图是对四个实验绘制的图像,其中实验结果与图像对应正确的是 A.某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体 B.将稀H2SO4滴入一定量的BaCl2溶液中 C.将一定质量的氯酸钾和二氧化锰放入试管中充分加热 D.向pH=13的NaOH溶液中加水稀释 (2011南宁)19.下列图象与对应实验完全吻合的是 A.①往一定量的盐酸中滴加NaOH溶液至过量 B.②将一定量的不饱和KNO3溶液恒温蒸发水 C.③向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液 D.④用两份等质量等溶质质量分数的过氧化氢溶液制取氧气(甲加少量MnO2) (2011遂宁)32.下列四个图象分别对应四种操作(或治疗)过程,其中图象能正确表示对
应操作(或治疗)的是 A B C D A .将一定质量的硝酸钾不饱和溶液恒温蒸发水份,直至有少量晶体析出 B .常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸充分反应 C .向硫酸和硫酸铜的混合溶液中加入氢氧化钠溶液直至过量 D .服用胃舒平[主要成分Al(OH)3]治疗胃酸过多 (2011绥化)13.下列图像能正确反映其对应关系的是( ) A.向一定量pH=3的硫酸溶液中不断加水稀释 B.向一定量的饱和石灰水中不断加入生石灰 C.向盛有相同质量的镁和氧化镁的烧杯中分别加入相同溶质质量分数的稀盐酸至过量 D.将一定量的木炭放在盛有氧气的密闭容器中加热至燃烧 (2011黑龙江龙东地区)14.下列图像能正确反映所对应叙述关系的是 ( ) A.向pH=3的溶液中不断加水 B.向锌粒中逐渐加入稀硫酸 C.向H 2SO 4和CuSO 4混合液中滴加NaOH 溶液 加水的量/g A 反应时间/s B NaOH 溶液质量/g C 反应时间/s D A B C D
新课标三年高考化学试题分类解析——氧化还原反应1.(2021模拟年山东理综·15)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的 KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为 提示:①H2C2O4是二元弱酸 ②10KHC2O4·H2C2O4+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O A.0.02021模拟889 B.0.2021模拟000 C.0.1200 D.0.2400 答案:B 解析:此题类型属于信息给予题,据题意并结合提示,H2C2O4为二元弱酸,可写出氢氧化钠与KHC2O4·H2C2O4·2H2O反应的方程式: 6NaOH+2KHC2O4·H2C2O4·2H2O=3Na2C2O4+K2C2O4+8H2O; 10[KHC2O4·H2C2O4]+8KMnO4+ 17H2SO4=8MnSO4+9K2SO4+40CO2+32H2O 。可得关系式:6NaOH~2KHC2O4·H2C2O4·2H2O,10[KHC2O4·H2C2O4]~8KMnO4 ;综合以上两式可得: 15NaOH ~ 4KMnO4 , 结合题意:V(NaOH)=3V(KMnO4)可得出关系: 15NaOH ~ 4KMnO4 15 4 3V(KMnO4)×0.1000mol·L-1V(KMnO4)×c(KMnO4) 列式得:15×V(KMnO4)×c(KMnO4)=4×3V(KMnO4)×0.1000mol·L-1,整理得:0.2021模拟000mol·L-1,答案选B。 2.(2021模拟年广东化学·5)氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3 =N2+6HCl检查氯气管道是否漏气。下列说法错误 ..的是 A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性 C.该反应属于复分解反应 D.生成1molN2有6mol电子转移 答案:C 解析:本题原理大多同学已在平时练习中接触过,2021模拟年高考题实验题21题⑵考到:
2013届(2012学年)上海市高三英语二模——翻译 (黄浦) 1. 这个故事激励年轻人为更美好的生活奋斗。(inspire) 2. 时光飞逝,尤其当你聚精会神地读一本好书时。(absorb) 3. 安全系统不会允许你进入大楼,除非你有正确的密码。(unless) 4. 我从未想到过会在机场遇到多年未曾谋面的老朋友。(It) 5. 无用信息的传播会对人类社会产生不利影响的事实已经引起公众的注意。(that) 1. The story inspires/inspired the youth /young people to struggle/strive for a better life. 2. Time passes/flies quickly, especially when you are absorbed in reading a good book. 3. The security system will not permit/allow you to enter the building unless you have the correct password. 4. It never occurred to me that I would meet my old friend (who/whom) I hadn’t seen for quite a few years at the airport. 5. The fact that the spread of useless information can have a bad effect on human society has attracted the attention/awareness of the public. (闵行) 85. 这款电子词典值得买吗?(worth) 86. 这孩子年龄太小,无法应对这么复杂的局面。(too…to…) 87. 当我心情不佳时,我常听听音乐来去除烦恼。(mood) 88. 经过热烈讨论,我们一致同意再为那所小学捐赠一台电脑。(agree) 89. 事实证明网络购物存在风险,因此下定单之前一定要深思熟虑。(exist) 85. Is this electronic dictionary worth buying? 86. The child is too young to deal with such complicated situation. 87. When I am in bad mood, I often listen to music to remove troubles. 88. After a heated discussion, we all agreed to donate another computer for the primary school. 89. Evidence has proved that risks exist in on-line shopping, so you have to think carefully before (浦东) 1. 他下定决心要实现抱负。(determine) 2. 居民们都希望有朝一日能更方便地享受图书馆的优质服务。(access)
专题05 元素及其化合物 1.[2019新课标Ⅰ] 固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课 题。下图为少量HCl 气体分子在253 K 冰表面吸附和溶解过程的示意图。下列叙述错误的是 A .冰表面第一层中,HCl 以分子形式存在 B .冰表面第二层中,H +浓度为5×10?3 mol·L ?1(设冰的密度为0.9 g·cm ?3) C .冰表面第三层中,冰的氢键网络结构保持不变 D .冰表面各层之间,均存在可逆反应HCl 垐?噲?H ++Cl ? 【答案】D 【解析】 【分析】由示意图可知,在冰的表面第一层主要为氯化氢的吸附,第二层中氯化氢溶于水中并发生部分电离,第三层主要是冰,与氯化氢的吸附和溶解无关。 【详解】A 项、由图可知,冰的表面第一层主要为氯化氢的吸附,氯化氢以分子形式存在,故A 正确; B 项、由题给数据可知,冰的表面第二层中氯离子和水的个数比为10—4:1,第二层中溶解的氯化氢分子应少于第一层吸附的氯化氢分子数,与水的质量相比,可忽略其中溶解的氯化氢的质量。设水的物质的量为1mol ,则所得溶液质量为18g/mol× 1mol=18g ,则溶液的体积为18g/mol 1m 0.9ol g/mL ?×10—3L/ml=2.0×10—2L ,由第二层氯离子和水个数比可知,溶液中氢离子物质的量 等于氯离子物质的量,为10 —4 mol ,则氢离子浓度为-4-2102.l 010L mo ?=5×10—3mol/L ,故B 正确;
C项、由图可知,第三层主要是冰,与氯化氢的吸附和溶解无关,冰的氢键网络结构保持不变,故C正确; D项、由图可知,只有第二层存在氯化氢的电离平衡HCl H++Cl—,而第一层和第三层均不存在,故D错误。 故选D。 【点睛】本题考查氯化氢气体在冰表面的吸附和溶解。侧重考查接受、吸收、整合化学信息的能力及分析和解决化学问题的能力,注意能够明确图像表达的化学意义,正确计算物质的量浓度为解答关键。 2.[2019江苏]下列有关物质的性质与用途具有对应关系的是 A.NH4HCO3受热易分解,可用作化肥 B.稀硫酸具有酸性,可用于除去铁锈 C.SO2具有氧化性,可用于纸浆漂白 D.Al2O3具有两性,可用于电解冶炼铝 【答案】B 【解析】A.NH4HCO3受热易分解和用作化肥无关,可以用作化肥是因为含有氮元素; B.铁锈的主要成分为Fe2O3,硫酸具有酸性可以和金属氧化物反应,具有对应关系; C.二氧化硫的漂白原理是二氧化硫与有色物质化合成不稳定的无色物质,不涉及氧化还原,故和二氧化硫的氧化性无关; D.电解冶炼铝,只能说明熔融氧化铝能导电,是离子晶体,无法说明是否具有两性,和酸、碱都反应可以体现Al2O3具有两性。 故选B。 3.[2019江苏]下列有关化学反应的叙述正确的是 A.Fe在稀硝酸中发生钝化B.MnO2和稀盐酸反应制取Cl2 C.SO2与过量氨水反应生成(NH4)2SO3D.室温下Na与空气中O2反应制取Na2O2 【答案】C 【解析】 【分析】相同的反应物,条件不同(如温度、浓度、过量与少量),反应有可能也不同; A.钝化反应应注意必须注明常温下,浓硝酸与Fe发生钝化; B.实验室制备氯气的反应中应注意盐酸的浓度和反应温度; C.过量与少量问题应以少量物质为基准书写产物;
09年高考化学试题分类汇编——物质的量 1.(09年福建理综·8)设N A为阿伏伽德罗常数,下列叙述正确的是 A.24g镁的原子量最外层电子数为N A B.1L0.1mol·L-1乙酸溶液中H+数为0.1N A C.1mol甲烷分子所含质子数为10N A D.标准状况下,22.4L乙醇的分子数为N A 答案:C 2.(09年广东化学·6)设N A 代表阿伏加德罗常数(N A )的数值,下列说法正确的是A.1 mol 硫酸钾中阴离子所带电荷数为N A B.乙烯和环丙烷(C3H6 )组成的28g混合气体中含有3N A 个氢原子 C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为N A D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1N A Fe3+ 答案:C 3.(09年广东理基·20)设N A代表阿伏加德罗常数(N A)的数值,下列说法正确的是A.22.4 L Cl2中含有N A个C12分子 B.1 L 0.1 mol·L-1 Na2SO4溶液中有0.1 N A个Na+ C.1 mol H2与1 mol C12反应生成N A个HCl分子 D.1 mol Ca变成Ca2+时失去的电子数为2N A 答案:D 4.(09年海南化学·8)下列叙述正确的是(用N A代表阿伏加德罗常数的值)A.2.4g金属镁变为镁离子时失去的电子数为0.1N A B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 N A D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 答案:C 5.(09年江苏化学·4)用N A表示阿伏加德罗常数的值。下列叙述正确的是A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2N A B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2N A C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5N A
2013年高考化学试题分类解析汇编:有机化学 (2013大纲卷)13、某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O。它可能的结构共有(不考虑立体异构) A.4种 B.5种 C.6种 D.7种 【答案】B 【解析】根据题意,可先解得分子式。设为CnH2nOX,氧最少为一个,58-16=42,剩下的为碳和氢,碳只能为3个,即为C3H6O,一个不饱和度。设有两个O,那么58-32=2 6,只能为C2H4OX,x不可能为分数,错。由此可得前者可以为醛一种,酮一种,烯醇一种,三元碳环一种,四元杂环一种。 (2013福建卷)7.下列关于有机化合物的说法正确的是 A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别B.戊烷(C5H12)有两种同分异构体C.乙烯、聚氯乙烯和苯分子均含有碳碳双键D.糖类、油脂和蛋白质均可发生水解反应【答案】A 【解析】B应该是三种同分异构体,分别是正戊烷、异戊烷、新戊烷;C由于聚氯乙烯没有,错误;D糖类中的单糖不行。 (2013江苏卷)12.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得: 下列有关叙述正确的是 A.贝诺酯分子中有三种含氧官能团 B.可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应 D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 【参考答案】B 【解析】该题贝诺酯为载体,考查学生对有机化合物的分子结构、官能团的性质等基础有机 ☆能熟练区分醇羟基、酚羟基、酸羟基的性质上的差异: 醇中的羟基连在脂肪烃基、环烷烃基或苯环的侧链上,由于这些原子团多是供电子基团, 使得与之相连的羟基上氢氧原子间的电子云密度变大,氢氧共价键得到加强,氢原子很难 电离出来。因此,在进行物质的分类时,我们把醇归入非电解质一类。 酚中的羟基直接连在苯环或其它芳香环的碳原子上,由于这些原子团是吸电子基团, 使得与之相连的羟基上氢氧原子间的电子云密度变小,氢氧共价键受到削弱,氢原子比醇 羟基上的氢容易电离,因此酚类物质表现出一定的弱酸性。 羧酸中的羟基连在上,受到碳氧双键的影响,羟基氢原子比酚羟基上的氢原子容 易电离,因此羧酸(当然是短链)的水溶液呈明显的酸性,比酚溶液的酸性要强得多。 Na NaOH Na2CO3 NaHCO3 醇羟基√╳╳╳ 酚羟基√√√╳ 羧羟基√√√√ 相关对比: 酸性强弱对比:CH3COOH>H2CO3>C6H5OH>HCO3- 结合H+能力大小:CH3COO-<HCO3-<C6H5O-<CO32- 故:C6H5OH+Na2CO3→C6H5ONa+NaHCO3 A.苯环不属于官能团,仅羧基、肽键二种官能团。
II. Grammar and Vocabulary Section A Directions:After reading the passage below, fill in the blanks to make the passage coherent and grammatically correct. For the blanks with a given word, fill in each blank with the proper form of the given word; for the other blanks, use one word that best fits each blank. The Best Way of Losing Weight Forget what the skinny movie stars and the TV adverts say - losing weight is hard work. (21)______ you do it through exercise, diet, or a bit of both, it’s extremely challenging to lose those pounds and then to keep them off. Sometimes it can involve (22)_______ (change) huge parts of your day-to-day life and it can mean breaking decades-old habits. But it turns out there’s one little thing you (23)_______ do to help you achieve your goal and it’s got nothing to do with food or exercise. The experts at Weight Wat chers did research which shows many of their members were more successful and (24)_______ (discouraged) when they shared regular updates on their new healthy lifestyle online. They found people who shared a diary of their daily lives with friends and followers were stimulated and inspired by positive feedback (25)______ they lost some pounds and kept them off. More than 50 per cent of people said the support of a weight loss community was crucial when it came (26)______ changing their eating habits and 53 per cent shared photos of their meals on social media. With this knowledge under their belts, Weight Watchers (27)______ (launch) a series of short films lately which show people recording their daily weight loss journey. One of the members who shared her journey was Danielle Duggins, and her video shows her enjoying a range of healthy meals and a few treats, while (28)______ (play) with her children. The company’s marketing director Claudia Nicholls said: “The support of a community has always proved to be an effective way of forming and sustaining healthy habits, but there has never been an easier or more affordable way (29)______ (tap) into the power of the crowd for support and inspiration with the explosion of online communities. Weight Watchers owns a social community for members, Connect, (30)______ sees over 14,000 daily posts in the UK alone, and provides our members with instant access to a community of people who are on similar journeys to them.
2018年高考化学真题分类汇编 专题2 化学物质及其变化(必修1) Ⅰ—离子共存、离子反应与离子方程式 1.[2018江苏卷-4]室温下,下列各组离子在指定溶液中能大量共存的是 L-1KI 溶液:Na+、K+、ClO-、OH- A. 0. 1 mol· L-1Fe2(SO4)3溶液:Cu2+、NH4+、NO3-、SO42- B. 0. 1 mol· L-1HCl 溶液:Ba2+、K+、CH3COO-、NO3- C. 0. 1 mol· L-1NaOH溶液:Mg2+、Na+、SO42-、HCO3- D. 0. 1 mol· 【答案】B 【解析】A.I-与ClO-发生氧化还原反应: I-+ClO-=IO-+Cl-,不能大量共存,A错误; B. Fe3+、SO42-、Cu2+、NH4+、NO3-、SO42-在溶液中相互间不反应,能大量共存,B正确; C.CH3COO-能与H+反应生成CH3COOH,在HCl溶液中CH3COO-不能大量存在,C错误;D项,Mg2+、HCO3-都能与OH-反应,Mg2+、HCO3-与OH-不能大量共存,D错误。 【考点】次氯酸盐的强氧化性;醋酸为弱电解质;氢氧化锰难溶于水;碳酸氢盐与碱 反应。注意:离子间不能大量共存有如下几点原因:①离子间发生复分解反应生成水、沉 淀或气体,如题中C、D项;②离子间发生氧化还原反应,如题中A项;③离子间发生双 水解反应,如Al3+与HCO3-等;④离子间发生络合反应,如Fe3+与SCN-等;⑤注意题中的 附加条件。 2.[2018浙江卷-13]下列离子方程式正确的是 A. 大理石与醋酸反应:CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑ B. 高锰酸钾与浓盐酸制氯气的反应:MnO4-+4Cl-+8H+==Mn2++2Cl2↑+4H2O C. 漂白粉溶液吸收少量二氧化硫气体:SO2+H2O+ClO-=SO42-+Cl-+2H+ D.氢氧化钠溶液与过量的碳酸氢钙溶液反应:OH-+Ca2++HCO3-==CaCO3↓+2H2O 【答案】D 【解析】大理石与醋酸反应,离子方程式为:CaCO3+2CH3COOH=Ca2++2CH3COO- +H2O+CO2↑,A错误;高锰酸钾与浓盐酸制氯气的反应,离子方程式为:2MnO4-+10Cl - +16H+=2Mn2++5Cl2↑+8H2O,B错误;漂白粉溶液吸收少量二氧化硫气体,离子方程 式为:SO2(少量)+H2O+3ClO-=SO42-+Cl-+2H ClO,C错误; D.氢氧化钠溶液与过量 的碳酸氢钙溶液反应,离子方程式为:OH-+Ca2++HCO3-=CaCO3↓+2H2O,D正确。 【考点】离子反应与离子方程式 3.[2018浙江卷-25]某绿色溶液中含有H+、Na+、Mg2+、Fe2+、Cu2+、SO42—、Cl—、CO32—和HCO3—离子中的若干种,取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于酸) ①向溶液中滴加Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B; ②取滤液B,先用HNO3酸化,再滴加0.001mol/LAgNO3溶液,有白色沉淀生成。 下列说法不正确的是 A.溶液A中一定存在H+、SO42-和Cl— B.溶液A中不存在Mg 2+、CO32-和HCO3—,不能确定Na+的存在 C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3 D.溶液中存在Fe2+与Cu2+中的一种或两种,且可以用NaOH溶液判断 【答案】B