
pH值对水热合成H A晶须形貌的影响*
高家诚,陈飞宏,张 敏
(重庆大学材料科学与工程学院,重庆400030)
摘 要: 研究了不同pH值条件下水热法制备羟基磷灰石晶须的形貌特征。采用X射线衍射仪(XRD),场发射扫描电子显微镜(FESEM)等分析了pH值对H A晶须组成、形貌和结构的影响。结果表明,在水热条件下,可以成功地合成结晶度高、组成均一的羟基磷灰石晶须。随着pH值的提高,a轴方向尺寸上升,c 轴方向基本不变,长径比减小。在微观形貌上羟基磷灰石逐渐由针状向球状形态转变。在pH值=7~8之间,合成的羟基磷灰石晶粒尺寸变化不大,稳定性较高,适合工业化生产。还初步讨论了H A的生长机制。关键词: pH值;水热;羟基磷灰石;形貌;生长机制
中图分类号: R318.08文献标识码:A 文章编号:1001-9731(2010)08-1447-03
1 引 言
羟基磷灰石(hydrox yapatite,H A)是人体硬组织的主要无机成分,具有良好的生物相容性和生物活性,在临床医学领域中有广泛的应用前景[1-3]。研究显示[4-7],晶须状的H A不但具有良好的生物相容性,而且具有更好的力学性能,更加适宜用于生物复合材料的增强体,因此纳米羟基磷灰石晶须的制备引起了越来越多学者的兴趣。
羟基磷灰石晶须的制备研究始于20世纪80年代末、90年代初[8]。目前制备纳米H A的方法主要有水热法[9]、共沉淀法[10]、溶胶-凝胶法[11]和微乳液法[12]等。水热法生产的特点是颗粒纯度高、分散性好、晶形好且可控制,生产成本低,因而得到了人们的广泛关注。1972~1973年,日本的H.Ao ki等研究了水热条件下pH值等对羟基磷灰石粉末合成的影响[13]。1991年,M.Yo shim ura等研究了氢氧化钙和磷酸在200℃下针状H A的制备[14]。但是,迄今为止,关于纳米羟基磷灰石晶须的研究报道还很少。
本文以硝酸钙和磷酸氢二钾为原料,采用水热法制备了羟基磷灰石晶须,研究了不同pH值条件羟基磷灰石晶须的形貌、尺寸以及结晶度等特征,探索了pH值对晶体生长过程中的影响规律。
2 实验材料及方法
硝酸钙(Ca(NO)3·4H2O),分析纯,重庆北碚化学试剂厂;磷酸氢二钾(K2H PO4·3H2O),分析纯,重庆北碚化学试剂厂;氨水(NH3·H2O),分析纯;乙醇,分析纯。
将浓度为0.1mo l/L的硝酸钙水溶液与浓度为0.1mol/L的磷酸盐水溶液按Ca/P原子比1.67混合。滴加氨水,使溶液pH值分别为5、7、8、9、10,充分搅拌后,混合溶液置于反应釜内加热反应。加热温度200℃,搅拌转速200r/min,保温3h,然后随釜冷却至室温。反应完成后,反应釜内沉淀经过滤、洗涤、干燥,得到羟基磷灰石晶须。
用日本理学DM AX1200X射线衍射仪(XRD)对羟基磷灰石晶须进行物相表征,衍射参数为CuKα1,管压40kV,管流250mA,步长0.02°,扫描速率0.24°/ min;用场发射扫描电子显微镜(FESEM&EDS)表征了复合材料的形貌及成分。
3 结果与讨论
3.1 XRD分析
图1是羟基磷灰石晶须的XRD图谱。由图1可知,在不同pH值条件下,得到的均为H A,无其它物相,其衍射峰与标准卡片74-0566一致。结构为密排六方,对称群为P63/m
。
图1 羟基磷灰石晶须的XRD图谱
Fig1XRD spectra of hy dro xyapatite w hisk
根据公式(1)计算出HA的晶格常数a和c。由Scherrer谢乐公式(2)计算出H A的晶粒尺寸,其中D 是晶粒尺寸,λ是X射线的波长,β是半高宽,θ是衍射角。由Jade软件模拟,经公式(3)得到各种pH值条件下的HA结晶度。不同pH值得到的羟基磷灰石数据如表1所示。
1
d2
=4
3
h2+hk+k2
a2
+l2
c2
(1)
1447
高家诚等:pH值对水热合成H A晶须形貌的影响
*基金项目:国家自然科学基金资助项目(30670562)
收到初稿日期:2010-01-12收到修改稿日期:2010-06-17通讯作者:陈飞宏作者简介:高家诚 (1947-),男,重庆人,教授,博士生导师,主要从事生物材料研究。
D=0.9λ
βcosθ
(2)
结晶度(X c)=衍射峰强度
总强度
×100%(3)
表1 H A的晶格常数、晶粒尺寸、结晶度Table1Cell parameters,cry stallite size,crystallinity
pH
D(nm)
(300)(002)
X c
(%)
晶格常数
a=b(nm)c(nm)
528.062.083.090.9373870.683698
731.564.085.740.9402970.686686
831.565.787.770.9404920.685093
955.458.484.730.9394030.686707
1041.645.287.140.939690.68666
从表1可以看到,随着pH值的增加,在(300)方向上晶粒尺寸逐渐增大,由最开始pH=5时的28nm 上升到了55.4nm,尤其是在pH=8和9之间有一个急剧上升的过程,晶粒尺寸直接从31.5nm过渡到55.4nm,而从pH值5~7和从7~8变化比较温和。在pH值=9的时候晶粒尺寸达到顶峰55.4nm,随后pH值继续增加时,晶粒尺寸反而有所降低。在(002)方向上,晶粒尺寸先是缓慢增加,在pH=8时达到峰值65.7nm,但是在碱性条件下,随着碱性强度的增加,晶粒尺寸再度减小,但是减小的幅度相对之前增加的幅度要大得多,之前pH值从5~8也只增加了几个纳米,后来碱性条件下pH值从8~10之间晶粒尺寸就降低了20nm左右。最后在pH=10时c轴方向比a 轴方向的晶粒尺寸小,形成球状颗粒的羟基磷灰石
。
结合c轴方向和a轴方向晶粒尺寸的变化,可以发现
长径比逐渐降低,晶粒从针状逐渐向球状转变。总体
上来说,水热法制备出的羟基磷灰石晶须结晶度较高,
随着pH值的上升,结晶度也随之有小幅度的增加。
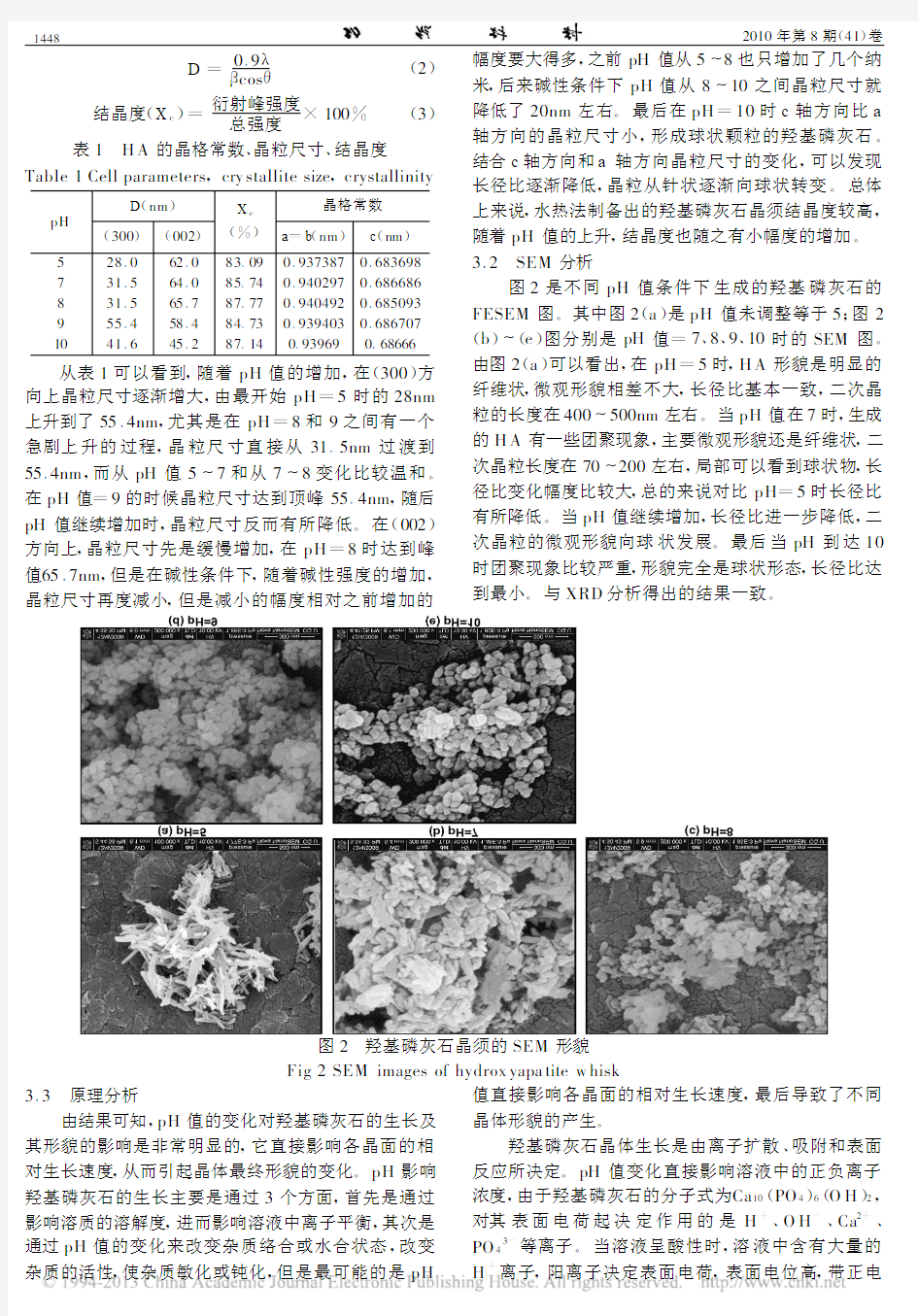
3.2 SEM分析
图2是不同pH值条件下生成的羟基磷灰石的
FESEM图。其中图2(a)是pH值未调整等于5;图2
(b)~(e)图分别是pH值=7、8、9、10时的SEM图。
由图2(a)可以看出,在pH=5时,H A形貌是明显的
纤维状,微观形貌相差不大,长径比基本一致,二次晶
粒的长度在400~500nm左右。当pH值在7时,生成
的H A有一些团聚现象,主要微观形貌还是纤维状,二
次晶粒长度在70~200左右,局部可以看到球状物,长
径比变化幅度比较大,
总的来说对比pH=5时长径比
有所降低。当pH值继续增加,长径比进一步降低,二
次晶粒的微观形貌向球状发展。最后当pH到达10
时团聚现象比较严重,形貌完全是球状形态,长径比达
到最小。与XRD分析得出的结果一致。
图2 羟基磷灰石晶须的SEM形貌
Fig2SEM images of hydrox yapa tite w hisk
3.3 原理分析
由结果可知,pH值的变化对羟基磷灰石的生长及
其形貌的影响是非常明显的,它直接影响各晶面的相
对生长速度,从而引起晶体最终形貌的变化。pH影响
羟基磷灰石的生长主要是通过3个方面,首先是通过
影响溶质的溶解度,进而影响溶液中离子平衡,其次是
通过pH值的变化来改变杂质络合或水合状态,改变
杂质的活性,使杂质敏化或钝化,但是最可能的是pH
值直接影响各晶面的相对生长速度,最后导致了不同
晶体形貌的产生。
羟基磷灰石晶体生长是由离子扩散、吸附和表面
反应所决定。pH值变化直接影响溶液中的正负离子
浓度,由于羟基磷灰石的分子式为Ca10(PO4)6(O H)2,
对其表面电荷起决定作用的是H+、O H-、Ca2+、
PO43-等离子。当溶液呈酸性时,溶液中含有大量的
H+离子,阳离子决定表面电荷,表面电位高,带正电14482010年第8期(41)卷
荷;pH 值上升,OH -
浓度随之升高,阴离子决定表面
电荷,表面电位下降,带负电荷。同理,Ca 2+和PO 3-4
离子也对表面电荷有影响,Ca 2+浓度高,表面电位上
升,Ca 2+浓度低,表面电位下降;PO 3-4离子浓度高,表
面电位下降,PO 3-4离子浓度低,表面电位上升。其它正负离子相对来说对表面电位所起影响不大。
在晶体生长的研究上,仲维卓等提出了“负离子配位多面体生长基元模型”[15-21],该模型从晶体结构出发,通过数学计算和模拟,在不同的晶体外部生长条件中,最终可以得出不同的晶体形貌。通过负离子配位多面体生长基元模型计算表明,在羟基磷灰石的生长体系中,可能存在多种负离子配位多位体,其中稳定性最高的是Ca -P 6O 24,根据其理论,在a 轴方向即径向方向上,生长基元主要是OH -Ca 6,带正电荷;而c 轴上主要生长基元是Ca -P 6O 24,带负电荷。在c 轴方向上,Ca 2+
与生长基元Ca -P 6O 24的连接数量多于a 轴方向,因此c 轴方向上生长速率明显高于a 轴方向,最终形成了针状的羟基磷灰石。在pH 值=5的时候,由于H +
的相对大量存在,羟基磷灰石的表面带的是正电荷,带负电荷的Ca -P 6O 24很容易被吸附到羟基磷灰石的c 轴方向表面,参与生长反应。而在a 轴方向,生长基元OH -Ca 6带正电荷,相对于c 轴方向上吸附被抑制,直接决定了生长的相对缓慢。于是得到的就是具有较高长径比的针状羟基磷灰石。而随着pH 值的增加,溶液酸性降低,碱性增加,O H -离子逐渐占主导地位,对表面电位起决定作用,表面电位下降。于是带负电荷的Ca -P 6O 24离子团吸附速率降低,而带正电荷的O H -Ca 6相对吸附速率增加,直接造成的结果就是c 轴方向上生长缓慢,而a 轴方向上生长加速。随着pH 值的增加,这种效果越来越明显,于是对最终生成的羟基磷灰石形貌来说就是长径比越来越小了,而晶体也就由针状慢慢向球状转变。最终在pH 值=9、10左右时,得到的就是差不多球状的羟基磷灰石。
4 结 论
(1) 在水热条件下,能成功合成结晶度高、组成
均一的羟基磷灰石。
(2) 在本实验的pH 值变化范围内,随着pH 值的提高,在a 轴方向晶粒尺寸有一个稳步上升的趋势,而在c 轴方向上基本上不变,长径比减小。在微观形貌上羟基磷灰石逐渐由针状向球状形态转变。
(3) 在pH 值=7~8之间,合成的羟基磷灰石晶粒尺寸变化不大,稳定性较高,适合工业化生产。参考文献:
[1] Wa ng Y L ,Jian X C ,Xia Y N .[J ].J A m Chem So c ,
2003,125:16176.
[2] N ath M ,Cho udhry A ,K undu A .[J ].A dv M ater ,2003,
15:2098.
[3] Zho u G T ,W ang X C ,Y u J C .[J ].Cry st G ro wth Des ,
2005,5:969.
[4] 靳治良,李胜利,李 武.[J ].盐湖研究,2003,11(4):57-66.[5] Bouye r E ,Gitzhofe r F ,Boulo s I .[J ].J M ater Sci :M a te r
M ed 2000,Ⅱ:523-53l .
[6] F ujishiro Y ,Yabuki H ,K aw amur a H .[J ].Chem tech Bio -technol ,1993,57:349-353.[7] 高卫民,阮承祥,陈运法.[J ].材料科学与工程学报,2006,
24(5):646-648.
[8] 张 勇.羟基磷灰石晶须的水热法制备及其针状生长机
理研究[D ].武汉:武汉理工大学,2002.2.[9] 汪晓霞,张海黔.[J ].南京航空航天大学学报,2005,10
(5):37.
[10] 徐跃萍,郭景坤.[J ].硅酸盐学报,1993,21(3):280-284.[11] L ayr olle P ,I to A ,T ateishi T .[J ].J A m Ceram So c ,
1998,81:1421-1428.
[12] Li Yubao ,G ro ot K ,Wijn J .[J ].J M ater Sci :M ater M ed ,
1994,5:326-331.
[13] Ao ki H ,Kato K ,Shiba M .[J ].J A m Ce ram Soc ,1990,73
(6):1803-1805.
[14] Suchanek W ,Yoshiimur a M .[J ].M aterial Reso urce ,
1998,13:94-117.
[15] 仲维卓,华素坤,唐鼎元,等.[J ].结构化学,1995,14(5-6):463-468.
[16] 仲维卓,华素坤.[J ].人工晶体学报,1998,27(4):305-308.
[17] 仲维卓,张学华,罗豪甦,等.[J ].硅酸盐学报,2004,32
(3):239-244.
[18] 仲维卓,罗豪甦,华素坤,等.[J ].人工晶体学报,2004,33
(4):475-478.[19] 仲维卓,华素坤.[J ].硅酸盐学报,1995,23(4):464-469.[20] 仲维卓,罗豪甦,许桂生,等.[J ].人工晶体学报,2000,29
(5):241.
[21] Z ho ng Weizhuo ,Luo Haosu ,H ua Sukun ,e t al .[J ].Jour -nal of Sy nthetic Cry stals ,2004,33(4):471-474.
Influence of pH value on the morphology of hydrotherm al synthetical H A w hiskers
GAO Jia -cheng ,C HEN Fei -hong ,ZHANG M in
(Co lleg e of M aterials Science and Engineering ,Cho ng qing University ,Chongqing 400030,China )A bstract :The objective of this w o rk is the research on the cry stal structure of hy dro xy apatite (H A )w hisker syn -thesized by hydro thermol metho d at variable pH conditio ns .The com position ,mo rpholo gy and structure of hy dro xy apatite w hiske r w ere characterized by X -ray diffraction (XRD ),and field emissio n scanning electron mi -croscopy (FESEM ).The results show that under hydrotherm al conditions ,hydro xyapatite w ith unifo rm m or -pholog y and high crystallinity w as obtained .With the increase of pH v alue ,g rain size o f the a -axis directio n in -creases w hile that o f the c -ax is direction size basically unchang es ,w hich results in the decrease in the aspect ra -tio .Also ,the m orpho logy of HA g radually chang ed from needle -like to sho rt rod -like ,until ball -like .Within the pH range of 7-8,hy dro xy apatite w ith narrow size sco pe has been achiev ed suitable fo r industrial production .And the g row th mechanism o f H A w as prim arily discussed .Key words :pH value ;hydrothermal ;process hydroxyapatite ;morphology ;growth mechanism
1449
高家诚等:pH 值对水热合成H A 晶须形貌的影响
水的pH值调整及计算 碳酸化合物的一级电离 [ H+][HCO3] CO2 = K1 推导公式为: CO2 [ H+] = K1 [HCO3] 已知25℃时,K1=4.45×10-7,Pk = 6.35 ,可以得出 pH = 6.35+Lg[HCO3] - Lg[CO2] 如果pH值大于8.3,产生二级电离 [HCO3] [ H+] = K2 [CO32-] 已知25℃时,K2=4.69×10-11,Pk = 10.329 ,可以得出pH = 10.329+Lg[HCO3]- Lg[CO32-] 1、原水中CO2二氧化碳的计算 CO2 = 注:式中pH(R) 为原水 的pH值 举例运算:如用户填入HCO3(以CaCO3计)为350mg/L(以CaCO3计),那么原水中的CO2二氧化碳含量计算为: CO2 =350÷(10 7.0-6.3)=350÷100.7=69.83 mg/L(以CO2计) 注:用户没有进行pH值的调整的需求,可直接根据公式计算输出结果。如果用户调整pH 值,则需重新计算。因为加入硫酸和盐酸后会改变HCO3、SO4、Cl 的离子含量,影响CO2含量。所以当用户需要调整pH值,则Feed CO2含量需重新计算。 原理如下:H2SO4+2HCO3- 2CO2+2H2O+SO42- HCl+HCO 3- CO 2 +H 2 O+Cl- 以盐酸为例: HCl+HCO 3- CO 2 +H 2 O+Cl- 36.5 61 44 18 35.5 每加1mg/L的盐酸(100%)产生1.205mg/L的CO2,同时减少1.37mg/L的HCO3(以CaCO3计)。 推导公式为: [HCO3] pH=6.35+Lg R = 6.35+Lg [CO2] CO2= [HCO3] ×10 6.3-pH 代入公式中 [HCO3]-1.37[HCL] HCO3(以CaCO3计)
水质管理——PH值的调整方法 调整PH的目的 养鱼先养水,这句话大家不陌生,但是怎么理解这句话的真正含义呢?我的理解是:养水是指养殖用水的内在质量。我们用来“养水”的办法很多,比如,建立健全的硝化系统,培养出优质硝化细菌,水中添加氧气,和各类营养成分,通过检测毒素和微量元素而达到控制水中各种物质的含量,我们也可以借助其他一些手段间接观测水的质量。比如pH值(KH GH NH3+NH4 NO2 NO3 )测量。 那我们测量pH值得目的是什么呢?为什么要测量ph值?如果pH值不合乎我们鱼类的最佳生存要求怎么办?是不是直接调节pH值或是加入一些物质调节就可以呢?下面我与大家一起思考。 在我们养鱼水中,如果pH值出现了波动,那肯定是水质出现了变化而带动了pH值发生了变化,如果此时直接调节pH值再标准也不能解决水质的问题,虽然pH值调到了正常,但是水中的硝酸盐或其他有毒物质不但不会减少的,相反有的会因为pH的变动而加速累计。 关于水质的好坏与pH值的测量,我引用一句话说明,可能不是很恰当,但愿能说明白问题,——“醉翁之意不在酒,而在于水体之中”。我们监测pH值的目的也不是在于单纯调节指数的高和低,,而是通过其指数的高低知道水质的变化情况,从而调整好水质,用调整好的水来改变pH值。所以现在很多鱼友测量pH值的目的,是为了调节pH值而调节pH值,是非常错误的,是不懂其养水的原理而为之。 尤其是调节跌酸水质,更不能单单的从pH值上下手,他需要一个有主有次综合的办法去调理水质,首先要弄明白在养殖水中跌酸的的根本原因是什么,再从根本上下手。看看是否因为硝化细菌数量增多,氧化作用下生成的硝酸过多,溶于水后产生H+使水质变酸,最终积累下硝酸盐水质老化的原因,还是因为其他什么原因。只有找到根本原因才能对症下药。 硝化系统引起的跌酸 在弄明白了跌酸的主要原因后,针对其做出动作,而不是一概而论的。 先谈谈主要的吧——硝化系统过强而引起的跌酸: 在治理本质的基础上(降低硝化作用)的同时,还要注意一些辅助手段,减少氨源,(换水)加强水体KH值,KH值不等于暂时硬度,他是形成暂时硬度的必要条件,它在水中的作用主要是缓冲PH值的变化,KH值之所以起到缓冲作用,是因为HCO3能发生可逆的水解平衡反映。 请看:HCO3-+H2O ---> H2CO3+OH- KH值与水的硬度更没有关系。 比如饲养密度,喂食量,以及适量的换水等等,从根本上调理水质达到各项指标,只要把水质慢慢的调理到我们所要的地步,pH值也会慢慢的到达我们预期的数值。(我说的这些,是
水的电离与溶液pH 值的计算 一、水的电离 水是极弱的电解质,发生微弱的(自偶)电离。 H 2O + H 2O →H 3O + + OH - 简写: H 2O → H + + OH - 实验测定:25℃ c (H +)=c (OH -)=17 10-?mol/L 100℃ c (H +)= c (OH -)= 1610-?mol/L 二、水的离子积(K w ) 实验测定:25℃ K w = c (H +)·c (OH -)=11410 -?(定值)(省去单位) 100℃ K w = c (H +)·c (OH -)=112 10 -? 影响因素: 1)温度:温度越高,K w 越大,水的电离度越大。 对于中性水,尽管K w 温度升高,电离度增大,但仍是中性水,[H +]=[OH -]. 2)溶液酸碱性:中性溶液,c (H +)=c (OH -)=17 10-?mol/L 酸性溶液:c (H +)> c (OH -),c (H +)>1?10-7mol/L c (OH -)<1?10-7mol/L 碱性溶液:c (H +)< c (OH -),c (H +)<1?10-7mol/L c (OH -)>1?10-7mol/L c (H +)越大,酸性越强;c (OH -)越大,碱性越强。 三、溶液pH 值的计算 1.pH 的计算公式: (1)c (H +)=C 酸α酸(弱酸) c (H +)= nC 酸 c (OH -)=C 碱α 碱(弱碱) c (OH -)= nC 碱 (2) K w = c (H +)c (OH -),c (H +)= )(OH K c w c (OH -)=) (+H Kw c (3) pH=-lgc (H +) pOH=-lgc (OH -) (4) pH + pOH = 14(25℃) 2.酸或碱溶液及稀释后的p H 值的计算(25℃) 1) 酸强碱溶液(单一溶液)p H 值的计算 例1.求0.1mol/L 的H 2SO 4的pH 值。 例2. 0.1mol/L 醋酸溶液中的c (OH -)?(25℃,已知该醋酸的电离度为1.32%)
关于循环水pH调节和加酸量问题 加酸调pH是帮助循环水有效阻垢的辅助措施,当补充水为高硬、高碱水系(如北方地下水)和要求浓缩倍数高的循环水系统、药剂阻垢难以达到理想的效果时,目前普遍采用此处理方法,以保证水质的稳定。美国Nalco,Betz等世界知名水处理公司,过去和现在为中石化、化工部大化肥等厂提供的配方仍以加酸处理配方为主、其处理效果为各厂所认同。 贵厂加酸量可根据循环水每天碱度(CaCO3)测定值计算投加,方法有二,可任选其一。 循环冷却水调pH时加酸量的计算 循环冷却水用硫酸调pH时,其硫酸加入量有两种计算方法,可以选任一种方法计算投加。 (1)根据分析室测定循环水酚酞碱度时,盐酸标准溶液的耗量计算为系统硫酸投加量: 硫酸(98%)投加量=(V1C/2×100)×1000×98×(V/1000)×(100/98)=( V1CV/2) (kg)(6-2-1) 式中:V1—测定酚酞碱度时,盐酸标准溶液消耗的体积,ml; C—盐酸标准溶液的浓度,mol/L; V—冷却水系统容积,m3; 100—测定酚酞时取样体积,mL; 100/98—由100%换算为98%硫酸的系数;98-硫酸摩尔质量,g。 贵厂用30%盐酸时,则将公式 盐酸(30%)投加量
=(V1C/×100)×1000×36.5×(V/1000)×(100/30) =(1.22 V1CV)(kg) 贵厂保有水量按400 m3计,则加首次30%盐酸量为488V1C(kg) 例:系统容积V=8000 m3,测定酚酞碱度盐酸耗量V1=1.3 mL,盐酸标准溶液浓度C=0.05 mol/L,求硫酸(98%)加入量。 解:硫酸(98%)加入量(kg)=( V1CV/2)=1.3×0.05×8000/2=260 答:根据该系统酚酞碱度测定值,其硫酸(98%)加入量为260 kg。 说明: ⑴以酚酞碱度测定值作为加酸量的依据是较合理的。因此时酚酞由红色变无色,水的pH大约为8.3。当pH值﹤8.3时,水中只有HCO3-碱度存在,碳酸盐(如CaCO3)成垢趋势极微。 ⑵根据上述计算,现场实际加硫酸(98%)250 kg,pH值由8.65降至8.4,碱度由325 mg/L降至285 mg/L,硫酸实际加入量与计算量基本相符。但此硫酸加入量仅为系统首次加入量,未考虑飞溅、排污等损失的硫酸量。所以上述加酸量实际偏低,而排污等损失的酸量计算见本节第二例。 (2)循环冷却水系统的加酸量 循环冷却水加酸调pH值,是为提高浓缩倍数及阻垢的需要。根据酸碱中和原理,理论上加酸量等于碱度降低量。如果循环水加酸前后的碱度差△M,则: △M=M 前-M 后 M前为循环水调pH值前的碱度,M后为调pH值后的碱度,M前、M后可由现场实测或由“自然pH值与碱度计算”相关公式计算求得。如用98%硫酸调pH值,循环水单位用量为: A=49△M/(50×0.98×1000)=△M/1000 (6-2-2)
水的PH值 PH值得定义是水中氢离子浓度的负对数。通俗讲,PH值时表示水中酸碱性强弱的一项指标。 对于纯水,用精密仪器仍可测出它有微弱的导电能力,即可电离很小浓度的H+和OH-,在22℃时,测的纯水中氢离子浓度和氢氧根离子浓度都是10-7mol/L。水溶液中氢离子浓度和氢氧根离子浓度的乘积为一常数,叫做水的离子积,其值为10-14.水溶液中氢离子增加,氢氧根离子就减少,氢离子大于氢氧根离子时,叫酸性溶液。氢离子等于氢氧根离子时,叫中性溶液。当氢离子小于氢氧根离子时,叫碱性溶液。为了方便,常用PH值来表示溶液的酸碱度。 在纯水中,PH小于7时为酸性溶液,大于7为碱性溶液,等于7为中性溶液。由于不同温度下水的电离作用不一样,因而同一水样在不同温度下测得的PH值时不同的,所以规定25℃为测定温度值,通常用PH值测量仪都没有温度补偿装置。 锅炉水PH值偏高是什么原因 在汽包炉中,又是炉水的PH值显著上升到超过PO43-浓度所对应的PH理论值。测定的碱度中,酚酞碱度大于甲基橙碱度。很明显,炉水中存在着大量的游离NaOH。游离NaOH的来源之一是补给水,来源之二是凝结水,当炉水中游离NaOH过高时,应查明原因,使制水系统尽量减少漏钠。如凝汽器泄露,应及早堵漏。采取措施后,若PH值仍过高时,可向炉水中添加磷酸氢二钠来调节水的PH值。 PH值不符合标准,对锅炉的危害 炉水的PH值应不低于9.0,这是因为:(1)当PH值低时,金属表面的保护膜遭到破坏,水对金属的腐蚀加剧;(2)当炉水的PH值相当高是,磷酸根与钙离子才能生成容易排出的水渣;(3)PH值高,才能抑制炉水中硅酸盐的水解,使炉水中硅酸盐维持在最低水平,这样可减少蒸汽中硅酸盐溶解携带量。 3-浓度在规定范围时,如但锅炉水中的PH值也不能太高,因为当卤水中PO 4 炉水的PH值仍很高,这表明炉水中游离的NaOH较多,容易引起碱性腐蚀和应力腐蚀。这可能使炉水产生泡沫而影响蒸气品质。对于铆接和胀接锅炉。碱度过高还会引起苛性脆化。因此,需对炉水的碱度进行监督。 炉水磷酸盐含量不合格,是什么原因造成?如何处理? 如发现炉水磷酸盐浓度不合格,可能是以下原因引起的: (1)由于磷酸盐的加入量过大或不足引起的,有时也因加药设备管路的堵塞,或是加药设备不完善造成的。处理此类故障时,首先要检查好加药设备,疏通管道,调整好磷酸盐的加量。当磷酸根过高时,应注意对蒸气质量的监督,并加大锅炉排污量。(2)有时,由于给水硬度较高,消耗了部分磷酸盐而引起磷酸根不足,此时,首先要消除或降低给谁的硬度,以使磷酸盐的消耗不致过多,在增加药量以提高锅炉水的磷酸根浓度。(3)磷酸三钠纯度不够,含Na2CO3量过多,应加强药品纯度化验和监督。(4)注意观察该炉运行中是否存在磷酸盐暂时消失现象,如有在机组启动和停运时较为明显,磷酸盐的加入量应适当控制,否则,等机组运行正常后会使磷酸根含量升高。
水的电离及pH的计算 1、常温下,某溶液中由水电离出的c(H+)和c(OH-)的乘积是1×10-20,该溶液的pH是______________。 2、常温下,等体积的①pH=0的H2SO4溶液、②0.05 mol·L-1的Ba(OH)2溶液发生电离的水的物质的量之比是__________。 3、已知NaHSO4在水中的电离方程式为:NaHSO4===Na++H++SO2-4。某温度下,向pH =6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,对于该溶液,水电离出来的c(H+)=_________mol·L-1,该温度下加入等体积pH=______的NaOH溶液可使反应后的溶液恰好呈中性。 4、常温时,纯水中由水电离的c(H+)=a,pH=1的盐酸中由水电离的c(H+)=b,0.2 mol·L-1的盐酸与0.1 mol·L-1的氢氧化钠溶液等体积混合后,由水电离的c(H+)=c,则a、b、c的关系是_________。 5、按要求回答下列各题: (1)在25 ℃时,某溶液中由水电离出的c(H+)=1×10-12mol·L-1,则该溶液的pH为________。 (2)已知在100 ℃的温度下,水的离子积K W=1×10-12,该温度下,将pH=10的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。 ①若所得混合液为中性,则a∶b=________; ②若所得混合液的pH=2,则a∶b=________。 6、现有常温下的六份溶液: ①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥ 0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。 (1)其中水的电离程度最大的是________(选填序号,下同),水的电离程度相同的是________; (2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②________③(选填“>”、“<”或“=”); 7、在不同温度下的水溶液中c(H+)=10x mol·L-1,c(OH-)=10y mol·L-1,x与y的关系如图 所示。请回答下列问题: (1)曲线Ⅰ代表的温度下,水的离子积为________,曲线Ⅰ 所代表的温度________(填“高于”、“低于”或“等于”) 曲线Ⅱ所代表的温度。你判断的依据是 _________________________________________。 (2)曲线Ⅰ所代表的温度下,0.01 mol·L-1的NaOH溶液的pH为________。
PH调节工操作规程 1、接班检查古灰贮存量和各池液位及碱水、酸水总沟格栅拦堵塞情况,每班至少清理一次,若堵塞情况严重可适当增加清理次数。 2、调节酸水、碱水以恒定的酸碱比输送到吹脱池,将水量控制在吹脱池的4/5,以便于进行曝气。 3、调节石灰水流量,控制老线中和池PH为5-8,一沉池为7-10,新线中和池为5-8,一沉池为7-10,当报警装置铃响时,看仪表显示值偏高或偏低,来决定关小或开大阀门,使PH值在允许范围内波动。 4、检查酸碱泵出水管压力和各泵运转情况,各泵每班至少清理一次,视情况增加清理次数。 5、将化好的石灰打入石灰贮桶约2/3处,开压缩空气进行搅拌,取石灰水样于100mL量筒中,静置半小时,沉降比为20%,则石灰浓度为5%左右,如沉降比高于20%,则往石灰贮桶中加水稀释,若沉降比低于20%,则往石灰贮桶中投加生石灰。直至沉降比为20%为止。 二00八年一月拟制:唐丽娟审核:徐金祥批准:吴玉芳
生化操作规程 1、吹脱池按工艺要求控制进水流量,并做好记录。 2、吹脱池曝气阀门控制气水比为10﹕1。 3、每小时用PH计检查中和池、一沉池和PH值,发现PH异常及时与PH调节工联系。 4、发现一沉池的PH超标,按应急方案处理。 5、根据进水的流量,按要求调节药剂的流量,如水量为0.06m/S,则药剂流量为1500转/秒。 6、每小时用PH计检测按触氧化池的DO值,并做好记录。 7、每小时检查加药池、二沉池、反应池的加药量,并检测二沉池的PH值和出水DO值,并做好记录。 8、每两小时检查罗茨风机的运转情况,油位控制在1/2-2/3,电流控制90KW风机小于164A,75KW风机小于139.7A,表压控制为0.06-0.07Mpa,并做好记录。 附:PH计、溶氧仪的使用方法。 (一)PH计: 1、打开保护盖,并将电极拉出(注:请轻轻拉出电极,以免拉断连线)。 2、用蒸馏水清洗电极并揩干。 3、将电极置于待测溶液中,稍搅动后静止放置至显示值稳定,即为该溶液的PH值。
循环水系统中PH值的调整 PH值是循环水系统的主要运行指标之一,一般煤气站循环水的pH值是在6.5~7.5之间。所以基本上属于中性的,但在用加酸进行煤气站循环水处理时,其PH值就要明显下降,一般在处理水中加酸调整到PH值=3~4时,效果就明显的提高,此水返回系统,势必造成系统pH值下降。 当系统内PH值下降时,需要较长时间才能恢复,因为PH值的调整不是简单的代数加和的平均值,如1吨PH=7的水和1吨PH=5的水加和后,不会达到2吨PH=6的水,经试验,当PH下降至3时,需要用15倍PH=7的水加入,才能使混合液的PH值恢复到PH=6.1。 由此可见,在投酸时应严格根据水系统的PH值而定,当系统的PH值下降时,应适当减少投酸的水处理量,使系统维持到PH=6以上。 PH值是循環水系統的主要運行指標之一,一般煤氣站循環水的pH值是在6.5~7.5之間。所以基本上屬於中性的,但在用加酸進行煤氣站循環水處理時,其PH值就要明顯下降,一般在處理水中加酸調整到PH值=3~4時,效果就明顯的提高,此水返回系統,勢必造成系統pH值下降。 當系統內PH值下降時,需要較長時間才能恢復,因為PH值的調整不是簡單的代數加和的平均值,如1噸PH=7的水和1噸
PH=5的水加和後,不會達到2噸PH=6的水,經試驗,當PH下降至3時,需要用15倍PH=7的水加入,才能使混合液的PH值恢復到PH=6.1。 由此可見,在投酸時應嚴格根據水系統的PH值而定,當系統的PH值下降時,應適當減少投酸的水處理量,使系統維持到PH=6以上。 PH值是循环水系统的主要运行指标之一,一般煤气站循环水的pH值是在6.5~7.5之间。所以基本上属于中性的,但在用加酸进行煤气站循环水处理时,其PH值就要明显下降,一般在处理水中加酸调整到PH值=3~4时,效果就明显的提高,此水返回系统,势必造成系统pH值下降。 当系统内PH值下降时,需要较长时间才能恢复,因为PH值的调整不是简单的代数加和的平均值,如1吨PH=7的水和1吨PH=5的水加和后,不会达到2吨PH=6的水,经试验,当PH下降至3时,需要用15倍PH=7的水加入,才能使混合液的PH值恢复到PH=6.1。 由此可见,在投酸时应严格根据水系统的PH值而定,当系统的PH值下降时,应适当减少投酸的水处理量,使系统维持到PH=6以上。 PH值是循環水系統的主要運行指標之一,一般煤氣站循環水的
计算项目符号项目数据单位处理水量Q6500m3/d 270.833m3/h 变化系数Kz11无水温T25℃原水中的碱度0.1mmol/L 原水中的碳酸物总量C mmol/L 原水中的PH值PH09无需要调整到的PH值PH17无原水中[H+]浓度0.000001mmol/L 原水中[OH-]浓度0.01mmol/L 二、需要的酸碱量 原水中比例常数a0.96 原水中的碳酸物总量C0.1mmol/L 调整到PH1时水中比例常数a 1.224 调整到PH1时水中总碱度0.08mmol/L 调整到PH1碱度变化值ΔA0.02mmol/L 所需的酸量0.02mmol/L 所需的碱量0mmol/L 三、盐酸投加量计算 盐酸密度(30%)1149.00kg/m3每升水中投加的盐酸量0.730mg/L 每日需要的盐酸摩尔量130mol/d 每日需要的盐酸量(100%) 4.75kg/d 每小时投加量(30%)659.03mg/h 每小时投加体积量(30%)V10.0006L/h 每日需要的盐酸量(30%)V20.01m3/d 药品贮存天数15.00d 药品需贮存总量V0.216m3四、碱投加量计算 氢氧化钠密度(32%)1354.00kg/m3投加的氢氧化钠量0.000mg/L 每日需要的NaOH(100%)0mol/d 每日需要的NaOH(100%)0.00kg/d 每小时投加量(32%)0.00mg/h 每小时投加体积量(32%)V10L/h 每日需要的NaOH量(32%)V20.00m3/d 药品贮存天数15.00d 药品需贮存总量V0m3 C=[H2CO3]+[HCO3-]+[CO32-] C=a([碱]+[H]+[OH]);当[碱]≥1.0mmol/L而5 pH值调节计算理论知识培训 水的硬度和pH的关系 水的硬度是由水中所溶解的各种盐离子(阳离子和阴离子)的数量决定的。阳离子主要是指钙、镁离子,钙离子的含量是最主要的,要比镁离子多3-10倍。阴离子主要是指碳酸氢根离子、硫酸根离子和氯离子。虽然水的硬度并不直接决定水的pH值,但在通常情况下软水的pH值低、偏酸性;硬水的pH值高、偏碱性。 水的硬度(KH值)决定了水pH的缓冲能力。水中碳酸硬度(KH)是稳定水pH值的最重要指标,硬度高的水含各种离子的数量非常多,其中碳酸氢根离子在水中和碳酸一起构成了水体最主要的缓冲系统~碳酸氢盐缓冲体系,这个缓冲体系的作用是在一定范围内,抵抗(中和)外来的酸碱对pH值的改变,保持pH值的稳定。碳酸氢根离子浓度越高、KH值越大,水抗酸碱的能力就越强。调pH会出现反弹是为什么?就是这些缓冲体系在起作用,虽然当时把pH调下来了,但是这些缓冲体系会慢慢地把水的pH值再“拉回”到原来的水平上。 软水和硬水的缓冲能力差别很大。软水所含离子较少缓冲能力差,水质越软缓冲能力越差,软水KH值过低时(小于4时),会使pH值快速下降,造成酸跌。硬水所含离子较多缓冲能力强,水质越硬缓冲能力越强。硬水KH值高(大于8),高KH值会导致pH值升高,所以一般情况下硬水显碱性。做过化学试验的人应该知道:在软水里加一滴酸,就能引起pH的较大下降;在同体积的硬水里加十滴酸,pH值可能只会轻微下降或者不变。这是一个很普通的化学常识,但对我们来说却非常重要,因为pH就是要以它做为理论基础来调整的。 1、基本知识: 1.1酸性pH调节剂: 盐酸:一元无机酸,常用。浓度36%~38%(W/W),1mol=36.46g 0.1mol/L(pH=1.0): 9ml (3.65g)→1000ml 硫酸:二元无机酸。浓度95%~98%,d=1.84 1mol=98.08g 0.05mol/L(pH=1.0): 3ml (4.9g)→1000ml。仅用于含硫酸盐的制剂中。 磷酸:三元无机酸。仅用于地塞米松磷酸钠注射液等含磷酸盐的制剂中。 枸橼酸、酒石酸:属有机酸。用于在强电解质溶液中不稳定的制剂,如利血平注射液。 1.2碱性pH调节剂: 氢氧化钠:强碱,最常用。1mol=40g 常用百分比浓度0.1%~2%(W/W),或采用摩尔浓度:0.1mol/L (pH=13.0): 4.0g→1000ml 碳酸钠、碳酸氢钠:碳酸钠为强碱弱酸盐;碳酸氢钠为酸式盐,其碱性较弱,常用于遇强碱发生分解的制剂中调节pH值。 磷酸氢二钠:弱碱性,1%水溶液pH值为8.8~9.2。常与磷酸二氢钠组成缓冲溶液使用。 氨水:弱碱性,浓度25%~28%。用于在强电解质中不稳定的制剂调节pH值。 1.3pH调节基本要求 调节pH值时采用与主药酸根离子相同的酸,以不增加其它杂质为原则。如硫酸阿米卡星注射液使用硫酸调节,地塞米松磷酸钠注射液使用磷酸调节。 按照工艺规定的酸碱浓度调节pH,并不得超过规定的酸碱用量。若工艺中未同时标出酸碱2种调节剂,一般不允许随意回调!以免产生的氯化钠引起渗透压改变。 调节pH时必须分次缓缓加入酸碱,防止局部酸性或碱性过强引起分解。越是靠近控制范围越应小心加入,防止调节过头。 若pH 值必须回调,加入量应经过计算,且加入时先要进行小试,观察药液颜色、澄清度等 (四)溶液 PH 的计算 例1、求0.1 mol / L 盐酸溶液的pH ? 例2、25mLPH=10的氢氧化钾溶液跟 50mLPH=10的氢氧化钡溶液混合,混合液的PH 是( ) A 、9.7 B 、10 C 、10.3 D 、10.7 例3、1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的 pH 等于( ) A 。9.0 B 。9.5 C 。10.5 D 。11.0 例4、室温下,下列溶液等体积混合后,所得溶液的 pH 一定大于7的是 A 。 0.1mol/L 的盐酸和0.1mol/L 的氢氧化钠溶液 B 。 0.1mol/L 的盐酸和0.1mol/L 的氢氧化钡溶液 C 。pH = 4的醋酸溶液和pH = 10的氢氧化钠溶液 D 。pH = 4的盐酸和pH = l0的氨水 练习 1 ?相同温度下等物质的量浓度的下列溶液中, pH 值最小的是 A , NH 4CI B NH 4HCO 3 C , NH 4HSO 4 D, (NH 4)2SO 4 2 .用 0.01mol / L NaOH 溶液完全中和 pH = 3的下列溶液各 100 mL 需NaOH 溶液体积最大的是 ( ) A 盐酸 B 硫酸 C 高氯酸 D 醋酸 3. 室温时,若0 1 mo1 ? L J 的一元弱碱的电离度为 I %,则下 列说法正确的是 A .该溶液的pH = 11 B .该溶液的pH = 3 C .加入等体积0 1 mo1 ? L d HCI 后所得溶液的pH = 7 D .加入等体积0 1 mo1 ? L J HCI 后所得溶液的pH > 7 4. pH = 5的盐酸和pH = 9的氢氧化钠溶液以体积比 11 : 9混合,混合液的pH A .为72 B .为8 C .为6 D .无法计算 5. pH = 13的强碱溶液与 pH = 2的强酸溶液混合,所得混合液的 pH = 11,则强碱与强酸的体积比是 ( ) 7 .某一元强酸稀溶液和某一弱碱稀溶液等体积混合后,其pH 等于70 ,则以下叙述正确的是 A .酸溶液的物质的量浓度大于碱溶液 C .酸溶液的物质的量浓度小于碱溶液的物质的量浓度 D .酸溶液中H +的浓度小于碱溶液中 OH 的浓度 8 .把80 mL NaOH 溶液加入到120 mL 盐酸中,所得溶液的 pH 值为2.如果混合前 NaOH 溶液和盐酸的物 质的量浓度相同,它们的浓度是 A , 0 5 mol / L B, 01 mol / L C, 0 05 mol / L D, 1 mol / L 9 .某雨水样品刚采集时测得 pH 为4 82,放在烧杯中经2小时后,再次测得pH 为468,以下叙述正确的是 A. 11 : 1 B. 9 : 1 C. 1 : 11 D. 1 : 9 6.某强酸溶液 pH = a ,强碱溶液 碱溶液体积V (碱)的正确关系为 A. V (酸)=10 V (碱) C. V (酸)=2V (碱) pH = b ,已知 a + b = 12, 酸碱溶液混合后 pH = 7,则酸溶液体积 V (酸)和 ( ) 2 B. V (碱)=10 V (酸) B .酸溶液中H +的浓度大于碱溶液中 OH P 勺浓度 E .两种溶液的物质的量浓度相等 1池水PH值的调节。 南美白对虾养殖适宜的池水PH值范围是7.9-8.5,整个养殖过程都要求池水PH 值保持稳定,PH值过高或过低均会影响虾的生长。 5.pH 7.4~9.0,最适8.2~8.6,日变化不超过0.5个单位。 解决方案:池水PH值过高,可施用降碱菌(醋酸菌及乳酸菌制剂)或工业醋酸调节;PH值过低,可施用熟石灰调节;若PH值不稳定,上午和下午变化差值太大,可施用大理石粉、白云石粉(硫酸钙)和小苏打,以提高水体的缓冲能力(增加水体中二氧化碳的浓度). 南美白对虾最适合的放养规格是体长0.8cm-1.2cm的仔虾,此时用肉眼即可清楚地观察到虾苗的形态和活动状态,(下转第34页)(上接第29页)而品质优良的虾苗应具有以下特点:(1)虾苗个体大小均匀,体色透明,活力强。 (2)虾苗的触须要并在一起尖挺向前,尾扇要完全打开,腹节要较长。 (3)虾苗体表干净,无寄生生物和损伤。 (4)虾苗的肠胃饱满,胃呈橙红色,腹节肌肉宽度与肠道宽度之比应大于4:1。 (5)在静止状态下大部分虾苗呈伏底状态,受到水流刺激后有顶水现象。 调节PH的主要方法是泼洒生石灰和滑石粉,PH值低于7.8时,用生石灰调节,每亩用量5~15kg,pH高于8.5时用滑石粉调节,用量为每亩1—2kg。 1、水瘦 1早期出现水清见底现象。原因有三种情况:① 有的养殖户不注重肥水这一关,急着放苗造成“先天性”水清;②有的养殖户越施肥塘水反而越清,铺满塘底的藻吸收肥料,有益藻无法生长;④有的是藻相不稳定又不及时追肥造致水清。①和③情况都应适当换水并抽取周边水色靓的水纳入藻种,全塘均匀泼洒3ppm单胞藻促长素和有机肥,并施5ppm光合细菌和经化酵的2ppm利生素调水繁殖基础饵料,并注意每隔2-4天追一次肥,水色会培养起来。在没有放苗前出现第二种情况,应排干水彻底清理干净有害藻,然后再进水肥塘。 2中后期水清。①环境突变(如暴雨)使浮游生物大量死亡,应换水或从别的塘抽进藻相好的水;②水中pH值过低也会造成浮游生物死亡,水呈清,应换水,下10-20ppm石灰,以及EM菌和有机肥造水;③水中无浮游植物,存在大量轮虫、桡足类等浮游动物也会使水变清,通过换水,施有益菌和适量肥料造水。 2、水肥 1中后期水浓太肥,透明度小于30cm,主要原因投料超量和粪便等排泄物多,残饵和粪浸出物富营养化,促使水中浮游生物大量繁殖,使水太肥沃。改进措施:掌握正确的投饵量,遵循宁少勿多的原则,通过观察网了解吃料情况。根据对虾生理状况、天气情况,调整下餐投喂量。这种方法是目前比较科学的投料方法。尽量做到每餐料都吃完,没有剩料就不会污染水质、败坏水质。经常开 溶液PH值计算习题 1.在温度25度下,在pH=12的某溶液中,则c(H+)为()。 A1.0×10-7 mol·L-1 B1.0×10-6 mol·L-1 C1.0×10-2 mol·L-1 D1.0×10-12 mol·L-1 2.25℃时,某溶液中,c(H+)=1×10-10 mol·L-1,则该溶液的pH是()。 (A)10 (B)7 (C)6 (D)2 3.给蒸馏水中滴入少量盐酸后,下列说法中正确的是()。 (A)[H+ ][OH- ]乘积不变(B)pH增大了(C)[OH- ]增加了(D)水电离出的[H+ ]增加了 4.常温下,下列溶液中酸性最弱的是()。 A)pH=4 (B)[H+ ]=1×10-3 mol·L-1 (C)[OH- ]=1×10-11 mol·L-1 (D)[H+ ] = 1×10-7 5.某酸溶液的pH=3,则该酸溶液的物质的量浓度为()。 (A)一定大于0.001 mol·L-1 (B)一定等于0.001 mol·L-1 (C)一定小于0.001 mol·L-1 (D)以上说法均欠妥 6.在室温下,等体积的酸和碱的溶液混合后,pH一定少于7的是()。 (A)pH=3的HNO3跟pH=11的KOH溶液(B)pH=3的盐酸跟pH=11的氨水 (C)pH=3硫酸跟pH=11的氢氧化钠溶液(D)pH=3的醋酸跟pH=11的氢氧化钡溶液7 25℃时,纯水中加入少量酸后,水的离子积_________________ 1×10-14 溶液的pH值 ____________ 7 (填大于,小于,等于) 8 20mL溶液中有0.4g NaOH , [OH- ]= ____________ , 溶液的pH值=____________ 9 某溶液的pH值从8变到6,则[H+ ]是原来的____________倍 10.将pH=3的弱酸(HAc)溶液稀释100倍,该溶液的pH范围为:__________________。 11 写出水的电离方程式:____________ ______。 水的电离平衡和pH计算 知识温习 1.将25g胆矾溶于水配成250mL溶液,此溶液中CuSO4的物质的量浓度是多少?取出10mL此溶液, 其中含CuSO4多少克? 【答案】0.4mol/L;0.64g 2.对于反应A+B→C,下列条件的改变一定使化学反应加快的是() A.增加A的物质的量B.升高体系的温度 C.减少C的物质的量D.增加体系的压强 【答案】B 3.对于是CO2(g)+C(s)?2CO(g)+Q,下列各条件变化时两项均能使平衡向右移动的() A.加压、升温B.加压、降温C.减压、降温D.减压、升温 【答案】C 4.下列说法正确的是() A.可逆反应的特征是正反应速率等于逆反应速率 B.在其他条件不改变时,增大压强对溶液间反应几乎无影响 C.温度升高,可以使可逆反应正反应速率加快,但逆反应速率可以不变 D.使用催化剂可以使原来不能发生的反应变为可能发生了 【答案】B 5.下列溶液中,酸性最强的溶液是() A.pH=3的盐酸溶液B.[H+]=5×10-5mol/L的溶液 C.[OH-]=1×10-12mol/L的溶液D.0.01mol/L的硫酸溶液 【答案】D 6.下列电离方程式书写正确的是() A.NaHSO4→Na++H++SO42-B.Ba(OH)2→Ba2++(OH)2- C.NH3·H2O→NH4++OH-D.NaHCO3→Na++H++CO32- 【答案】A 一、水的电离 溶液的酸碱性与水的电离有着密切的关系, 根据精确的实验表明,由于水分子的相互作用,水能微弱的电离出水和氢离子(H 3O +)和氢氧根离子(OH - )。 水是一种极弱的电解质,常温下大约每5亿个水分子中有1个水分子电离(如下图) 水电离方程式常简写为H 2O ?H ++OH - 1.纯水的离子积(K W ) 从纯水的导电试验测得,常温下(25℃),1L 纯水中只有1×10-7 molH 2O 电离,因此纯水中H +浓度和OH - 浓度都等于_________,c(H +)×c(OH - )=_________,这是一个很重要的常数, 被称为水的离子积(用Kw 表示):W K c(H ) c(OH )+- =g 【答案】1×10-7mol/L 1×10-14 【小结】 a.水的离子积反映了一定温度下水中H +浓度和OH - 浓度之间的关系,只与温度有关。 b.Kw 不仅适用于纯水,还适用于酸、碱、盐的稀溶液 c.由于水的离子积存在,非中性溶液稀释时,溶液中总有一种浓度增大的离子,比如弱酸稀释 时,c (OH - )增大;弱碱稀释时,c (H +)增大 2.影响水的电离平衡因素 (1)温度 水的电离过程吸热,因此温度越高,水的电离平衡______移动,K W ______(填增大、减小或不变)。此时纯水中,c(H +)=c(OH - )____1×10-7mol/L ,水的离子积K W ____1×10-14,纯水的pH 值____7(填>、=、<);100摄氏度时,c(H +)=c(OH - )=1×10-6mol/L ,K W =1×10-12。 【答案】正向;增大;>;>;< (2)加酸或者碱 ①水中存在电离平衡H 2O ?H ++OH - ; 知识梳理pH值调节计算理论知识培训
7、水溶液ph计算和溶解平衡
池水PH值的调节
12水的 电离 PH值计算习题
高中化学-水的电离平衡和pH计算(教师版)