
生物技术进展
2011年第1卷第2期105 111
Current Biotechnology ISSN 2095-櫅櫅櫅櫅櫅櫅櫅櫅櫅櫅櫅櫅櫅櫅殯
殯
殯
殯
2341
进展评述
Reviews
收稿日期:2011-06-07;接受日期:2011-06-25基金项目:云南省自然科学基金项目(2008CD180)资助。
作者简介:刘丽,博士,主要从事作物遗传育种研究。E-
mail :liuliliulidouble@gmail.com 蛋白质组技术在小麦品质研究中的应用
刘
丽,杨金华,胡银星,程
耿
云南省农业科学院粮食作物研究所,昆明650205摘
要:人类基因组草图测定的完成,宣告了“后基因组时代”的到来。功能基因组学成为研究的重心,蛋白质组学的
研究受到了空前的关注。介绍了蛋白质组研究技术的基本原理,全面综述了蛋白质组研究技术在小麦品质研究中的应用进展,包括:麦谷蛋白亚基的鉴定、面团流变学特性的遗传改良、籽粒发育过程中面筋蛋白的表达和累积、高温胁迫对面筋品质的影响、籽粒硬度蛋白分析及淀粉品质研究等,还分析了蛋白质组技术在小麦遗传育种应用研究中存在的问题与发展前景。
关键词:小麦;蛋白质组技术;品质DOI :10.3969/j.issn.2095-2341.2011.02.05
Application of Proteomic Technologies in the Improvement of Wheat Quality
LIU Li ,YANG Jin-hua ,HU Yin-xing ,CHENG Geng
Institute of Food Crops ,Yunnan Academy of Agricultural Sciences ,Kunming 650205,China
Abstract :The completion of human genome seguence declares the entering the proteomics era that concentrates on functional
genomics research and concerns on the hot points of proteomics.This paper introduces the principles of the proteomics techniques and reviewes their application in the improvement of wheat quality ,including the identification of glutenin subunits ,improvement of dough rheological characteristics ,the expression and accumulation of gluten protein before immature ,effect of high temperate on the gluten strength ,analysis of puroindoline a and b related with grain hardness ,and studies on starch quality.The disadvantages and the potentials of proteomic technologies in wheat genetic studies are discussed as well.Key words :wheat ;proteomic technologies ;quality
提高作物品质,培育市场需求的优质高产品种是品质育种的主要目标任务。通过导入优质基因并进一步筛选优良基因型的育种工作已取得一定进展,然而生态环境对品质的影响是当前品质改良面临的重要挑战。与DNA 和mRNA 相比,蛋白质较稳定,而且基因型与环境的互作最终皆反应在蛋白质水平上,因此蛋白质组成是蛋白组学的重要研究内容之一。
2001年美国著名杂志《Science 》把蛋白质组学列为六大研究热点之一,其“热度”仅次于干细胞;2003年3月《Nature 》以专题形式刊登了多篇蛋白质组学的综述;在短短6年间(1999-2005年),蛋白质组相关研究论文已从0篇飙升至
2500多篇,可见蛋白质组学的研究受到了空前的
关注。目前蛋白质组技术已开始应用于小麦遗传学研究领域并取得明显进展,主要包括以下几个方面的研究:面团流变学特性改良、籽粒发育过程中蛋白质的累积与表达分析、淀粉品质研究,籽粒硬度蛋白分析、高温胁迫对面筋蛋白的影响研究、小麦品种鉴定、面筋蛋白编码基因的染色体定位
研究以及虫害对品质的影响研究等
[1,2]
。1蛋白质组概述
随着生物技术的发展,生命科学研究已步入
“组学(omics )时代”。系统生物学技术如基因组
学、转录组学、蛋白质组学及生物信息学分别从DNA、mRNA和蛋白质三个水平对生命有机体进行研究。此后,糖组学和代谢组学也相继产生并迅速发展起来[3 6]。
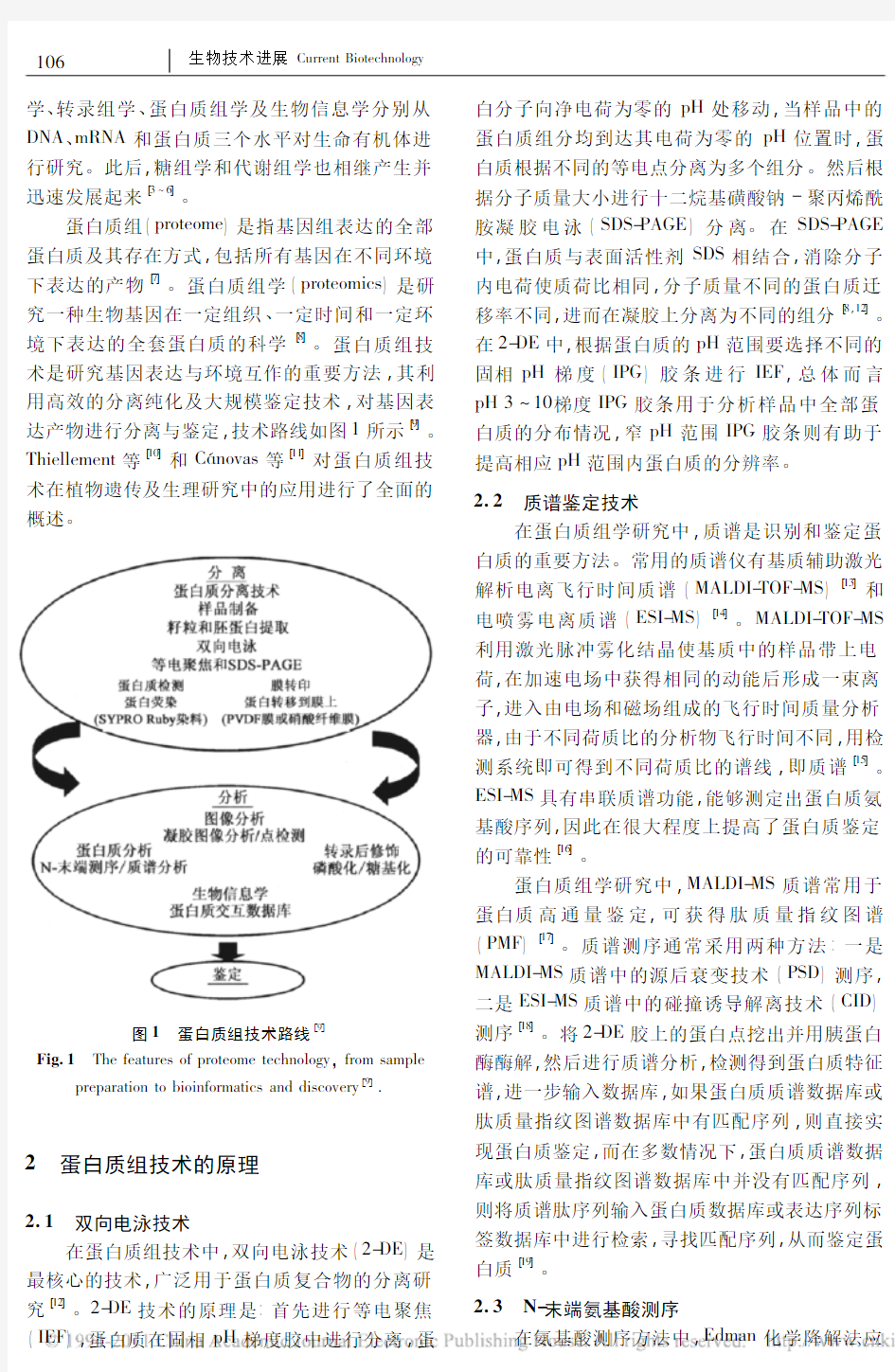
蛋白质组(proteome)是指基因组表达的全部蛋白质及其存在方式,包括所有基因在不同环境下表达的产物[7]。蛋白质组学(proteomics)是研究一种生物基因在一定组织、一定时间和一定环境下表达的全套蛋白质的科学[8]。蛋白质组技术是研究基因表达与环境互作的重要方法,其利用高效的分离纯化及大规模鉴定技术,对基因表达产物进行分离与鉴定,技术路线如图1所示[9]。Thiellement等[10]和Cánovas等[11]对蛋白质组技术在植物遗传及生理研究中的应用进行了全面的概述
。
图1蛋白质组技术路线[9]
Fig.1The features of proteome technology,from sample preparation to bioinformatics and discovery[9].
2蛋白质组技术的原理
2.1双向电泳技术
在蛋白质组技术中,双向电泳技术(2-DE)是最核心的技术,广泛用于蛋白质复合物的分离研究[12]。2-DE技术的原理是:首先进行等电聚焦(IEF),蛋白质在固相pH梯度胶中进行分离,蛋白分子向净电荷为零的pH处移动,当样品中的蛋白质组分均到达其电荷为零的pH位置时,蛋白质根据不同的等电点分离为多个组分。然后根据分子质量大小进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离。在SDS-PAGE 中,蛋白质与表面活性剂SDS相结合,消除分子内电荷使质荷比相同,分子质量不同的蛋白质迁移率不同,进而在凝胶上分离为不同的组分[8,12]。在2-DE中,根据蛋白质的pH范围要选择不同的固相pH梯度(IPG)胶条进行IEF,总体而言pH3 10梯度IPG胶条用于分析样品中全部蛋白质的分布情况,窄pH范围IPG胶条则有助于提高相应pH范围内蛋白质的分辨率。
2.2质谱鉴定技术
在蛋白质组学研究中,质谱是识别和鉴定蛋白质的重要方法。常用的质谱仪有基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)[13]和电喷雾电离质谱(ESI-MS)[14]。MALDI-TOF-MS 利用激光脉冲雾化结晶使基质中的样品带上电荷,在加速电场中获得相同的动能后形成一束离子,进入由电场和磁场组成的飞行时间质量分析器,由于不同荷质比的分析物飞行时间不同,用检测系统即可得到不同荷质比的谱线,即质谱[15]。ESI-MS具有串联质谱功能,能够测定出蛋白质氨基酸序列,因此在很大程度上提高了蛋白质鉴定的可靠性[16]。
蛋白质组学研究中,MALDI-MS质谱常用于蛋白质高通量鉴定,可获得肽质量指纹图谱(PMF)[17]。质谱测序通常采用两种方法:一是MALDI-MS质谱中的源后衰变技术(PSD)测序,二是ESI-MS质谱中的碰撞诱导解离技术(CID)测序[18]。将2-DE胶上的蛋白点挖出并用胰蛋白酶酶解,然后进行质谱分析,检测得到蛋白质特征谱,进一步输入数据库,如果蛋白质质谱数据库或肽质量指纹图谱数据库中有匹配序列,则直接实现蛋白质鉴定,而在多数情况下,蛋白质质谱数据库或肽质量指纹图谱数据库中并没有匹配序列,则将质谱肽序列输入蛋白质数据库或表达序列标签数据库中进行检索,寻找匹配序列,从而鉴定蛋白质[19]。
2.3N-末端氨基酸测序
在氨基酸测序方法中,Edman化学降解法应
601生物技术进展Current Biotechnology
用最广,对于凝胶上直接酶切的蛋白质和电转印到PVDF膜上蛋白质的测序均适用。Edman化学降解法测序的原理是蛋白质中的自由氨基酸与异硫氰酸苯酯(PITC)偶联,经酶切转化成苯乙内酰硫脲(PTH),根据不同氨基酸末端在RP-HPLC中的保留时间不同从而分析蛋白质的氨基酸序列。SDS-PAGE凝胶也可直接电转印到PVDF膜上,用考马斯亮兰R-250染色,然后利用蛋白质自动测序仪测定目标带的氨基酸序列。最后用SWISS-PROT和TrEMBL蛋白质序列交互数据库和FASTA统计软件进行N-末端氨基酸序列分析。
2.4蛋白质组技术改良研究
常用的蛋白质鉴定技术主要有两种,一是基于2-DE和生物质谱的鉴定技术,该技术分辨率较高,能够获得蛋白质等电点和分子质量大小等信息。另一种鉴定方法是用胰蛋白酶和天冬氨酸激酶等特异性酶酶解蛋白质,然后根据等电点与疏水性进行两相分离,该技术称为蛋白质多重鉴定即“鸟枪”技术,又称MudPIT技术[20]。“鸟枪”鉴定技术的分离原理是第一向用盐溶液进行梯度洗脱,通过强阳离子交换柱(SCX)吸附多肽,在第二向反向色谱中用有机溶剂洗脱,收集不同蛋白质组分,然后用质谱进行鉴定,最后进行统计分析及数据库检索,实现蛋白质鉴定。随着质谱技术的飞速发展,MudPIT蛋白质鉴定已实现了自动化分析[21]。
虽然MudPIT蛋白质识别与鉴定技术较2-DE 分离技术更为有效,但2-DE技术具有其独特的优点而应用广泛,例如2-DE分析能够得到可视化凝胶图像,有助于识别和鉴定由于蛋白质加工、水解及转录修饰引起的同分异构现象;此外,2-DE技术还可用于蛋白质糖基化和磷酸化修饰以及蛋白定量分析及功能研究[22],而且用荧光染料染色的2-DE蛋白质定量结果较MudPIT定量更可靠[23]。因此为充分利用2-DE与MudPIT的优势,常将二者联用以提高蛋白质鉴定的效率及准确性[24]。此外,MudPIT技术与色谱-质谱(LC-MS)联用可进行蛋白质定量分析,与LC-MS 联用技术可用于检测某一氨基酸的存在与否。其他用于蛋白质含量分析的联用技术还有质谱与蛋
白酶解联用技术、MALDI-MSS技术以及2-DE与LC-MS联用技术等[25 27]。据报道,2-DE与质谱联用技术PMF是研究蛋白糖基化和磷酸化修饰的主要方法[28]。
3蛋白质组技术在小麦品质研究中的应用
3.1蛋白质组技术在麦谷蛋白亚基鉴定中的应用
在蛋白质组技术中,2-DE是最核心的技术,广泛用于蛋白质复合物的分离研究。Wrigley[29]最早将其用于小麦面筋蛋白的研究,随后,O'Farrell[30]进一步优化2-DE方法并提出2-DE具有分辨成千上万个蛋白质组分的分离潜力。与早期的2-DE分离技术相比,目前用于蛋白质组学研究的2-DE技术分辨率有了显著提高。Mak 等[2]用2-DE分离麦芽蛋白,共检测到612个蛋白点,酶解后进行质谱分析和数据库检索,发现其中有347个蛋白点在数据库中有匹配序列,进一步对其中的301个蛋白点进行功能鉴定与分类,表明在麦芽中有6种重要的代谢酶,其中氧化还原酶、转移酶和水解酶的表达量最高。最近,笔者利用国际上广泛用于麦谷蛋白亚基研究的103份代表性材料建立了小麦LMW-GS的2-DE技术体系,并与SDS-PAGE、MALDI-TOF-MS和PCR的鉴定结果进行比较,建立了一套国际通用的小麦LMW-GS命名系统和标准品种[31]。
随着离子技术的发展,质谱已广泛用于生物大分子的分子质量测定与组成鉴定。据报道,MALDI-TOF-MS质谱技术可用于分析分子质量高达几百kDa的蛋白质和寡核苷酸等生物大分子[32,33]。MALDI-TOF-MS上样量少(1pmol),比其他质谱技术更耐受杂质的干扰,因此能够用于分析含有一定杂质的蛋白质或多肽[32,34,35]。近年来,MALDI-TOF-MS质谱技术已成为小麦谷蛋白亚基结构与功能研究及其品种品质鉴定的重要方法[34,36,37]。与传统分析技术SDS-PAGE、2-DE 和HPLC相比,MALDI-TOF-MS质谱技术具有准确、快速、高通量和自动化程度高等优点,每个样品测试只需几分钟,因此在品种快速鉴定中具有很大的应用潜力。
701
刘丽,等:蛋白质组技术在小麦品质研究中的应用
3.2蛋白质组技术在面团流变学特性遗传改良中的应用
贮藏蛋白对面团流变学特性有重要决定作用,其亚基组成是小麦蛋白质组学研究的主要内容之一。Lindsay和Skerritt[38]研究表明,在面团中高分子量谷蛋白亚基(HMW-GS)呈链状构成聚合体骨架,低分子量谷蛋白亚基(LMW-GS)成簇构成聚合体分枝,分子间二硫键将HMW-GS和LMW-GS连接为麦谷蛋白聚合体。二硫键的交联作用对面团粘弹性有重要决定作用,交联度下降,面团延展性增加,交联度上升,面团弹性增强。Shewry[39]用蛋白质组技术研究蛋白质的生物合成,发现蛋白质二硫键异构酶(PDI)对二硫键的形成具有催化作用。Skylas和Wrigley[40]研究表明,在2-DE图谱中发育籽粒的PDI蛋白点多于成熟籽粒。在耐高温和高温敏感品种的2-DE图谱中无PDI蛋白差异点,说明热激反应不影响PDI蛋白的表达[1]。Clarke等[41]提取小麦灌浆过程中不同发育时期的籽粒总RNA,分析mRNA 的转录时间,研究小麦籽粒mRNA转录本的数量与蛋白质组成之间的关系,表明在抽穗后(DPA)第6d的转录达最高水平,抽穗后18d转录水平显著下降,其他基因则在抽穗后6 8d才开始表达。从抽穗后第8d、10d和12d的胚中提取mRNA,构建cDNA文库,结果表明在发育胚中约有6000个基因具有表达活性。利用2-DE技术研究显示,在抽穗后17d的胚中,只检测到1700个PDI蛋白点,仅占基因转录表达的30%,说明蛋白质组分离与鉴定技术尚需进一步完善。3.3蛋白质组技术在面筋蛋白的表达和累积研究中的应用
Skylas和Wrigley[40]提出,蛋白质组技术是研究小麦籽粒灌浆过程中基因表达及环境效应的重要方法。在籽粒灌浆过程中,面筋蛋白的累积和代谢蛋白的含量与组成对磨粉品质及加工品质有重要影响,对小麦的市场价格有重要决定作用。Shewry[39]研究表明,籽粒灌浆过程中面筋蛋白的正确折叠及二硫键等高级结构的精确组装对面团流变学特性有重要意义,代谢蛋白的正确折叠是蛋白质执行生物功能的基础,对酶活性有重要影响,与淀粉、脂类和多糖等的含量与组成密切相关。
在小麦籽粒发育中,蛋白质成熟与加工过程可能导致蛋白质降解。因此Rathmell等[42]利用Clarke等[41]的方法比较了未成熟与成熟籽粒中的蛋白质差异,表明在未成熟籽粒的2-DE胶上观察到的1700个蛋白点中,只有1120个仍存在于成熟籽粒中,并且其中650个为酸性蛋白,470个为碱性蛋白。进一步研究表明,在小麦籽粒中,大部分在未成熟与成熟籽粒中均表达的蛋白质为麦谷蛋白和醇溶蛋白,在籽粒半熟至完全成熟的发育时期,麦谷蛋白和醇溶蛋白的含量无明显变化。蛋白质功能分析显示,发育籽粒中含有丰富的α-淀粉酶抑制剂、胰蛋白酶抑制剂、热激蛋白、核糖体蛋白和超氧化物歧化酶异构体。部分蛋白质特别是PDI在蛋白质成熟过程中发生了降解,在抽穗后第17d,蛋白质大量合成时可检测到大量的PDI,但在籽粒成熟后,蛋白质合成水平显著下降,部分PDI也随之降解,因此在成熟籽粒中检测不到相应的蛋白点。
3.4蛋白质组技术在高温胁迫对面筋品质的影响研究中的应用
非生物胁迫对植物的生长发育具有重要影响[43],其中高温胁迫对蛋白质表达的影响及与品质的关系研究是小麦蛋白质组学研究的重要内容[44]。Majoul等[45]提出,高温胁迫有助于提高小麦籽粒中热激蛋白和代谢蛋白的含量。此外,高温胁迫与淀粉代谢关系密切,对淀粉合成有显著负面效应,会引起小麦产量下降[46]。30?以上持续高温有助于提高部分品种的蛋白质含量,但其面团流变学特性显著下降。在育种实践中,高温胁迫可作为选择压力进行耐高温小麦品种的筛选[47]。蛋白质组技术能够用于比较同一品种在不同种植地点的蛋白质差异表达,以及耐高温和高温敏感小麦品种籽粒蛋白的差异表达研究。在2-DE图谱中,特定的蛋白质可作为耐高温胁迫的蛋白质标记,用于耐高温品种选育。Skylas等[44]研究显示,与高温敏感小麦品种Wyuna相比,耐高温小麦Fang的热激蛋白较多而且热激反应更强烈。经过热激处理的品种比对照多48个蛋白点,将其从2-DE凝胶上切割并进行PMF鉴定,表明有7个与热激反应有关的蛋白质存在于耐高温品种Fang中,进一步MS/MS鉴定,结果显示它们的分子质量与拟南芥的热激蛋白相近,约为16
801生物技术进展Current Biotechnology
17kDa,说明与热激反应密切相关的蛋白质分子质量皆较低。这些与热激反应有关的蛋白质在高温敏感品种Wyuna中检测不到,因此可作为耐高温小麦品种的鉴定标记[1]。在成熟和发育籽粒中均能够检测到的热激蛋白,可作为小麦在全生育期是否受到高温胁迫的蛋白质标记,并转化为耐高温小麦品种的选择指标应用于育种实践。3.5蛋白质组技术在籽粒硬度蛋白分析中的应用
Amiour等[48]认为,小麦籽粒硬度对面包的发酵与结构等加工品质有重要决定作用。据研究,硬度蛋白与籽粒硬度密切相关[49]。Skylas等[1]提出,蛋白质组技术是研究籽粒蛋白组成与面包加工品质关系的有效方法。2-DE分析表明,硬度蛋白具有PIN-a和PIN-b两个组分。免疫印迹研究显示,PIN-a和PIN-b由多个蛋白点组成,品种间存在显著差异,同一品种在不同地点种植,其PIN-a和PIN-b表达无差异,说明PIN-a和PIN-b 蛋白差异点是由基因型决定的,而且可能是转录后修饰的结果。
3.6蛋白质组技术在淀粉品质研究中的应用小麦造粉体的组成与含量是决定淀粉质量和用途的重要因素。Andon等[50]提取发育籽粒胚乳中的造粉体,然后用pH5 8和pH6 11的IPG胶条进行2-DE分析,共检测到185个蛋白点。进一步分析蛋白质的功能,发现其中有171个蛋白点与核糖体组成、转录调节、能量代谢、蛋白质翻译和组装、抗病性和防御反应有关,有一些蛋白点是造粉体膜蛋白的组成部分,与籽粒灌浆调控有关。
4问题与展望
鉴于蛋白质组学发展前景的重要性和技术的先进性,2001-2003年蛋白质组学研究先后列入我国“863”计划和“973”计划,获得国家重大科技攻关专项资金扶持(http://www.proteomics.com.cn)。目前,国内外应用蛋白质组技术在植物育种、生理、抗逆及转基因检测方面都进行了大量研究[43,51],国内对小麦蛋白质组学的研究较少而且主要集中于方法体系的建立,尚谈不上应用于育
种实践。司晓敏等[52]综述了蛋白质组技术及小麦蛋白质组研究进展。刘伟霞和潘映红[53]报道了适用于小麦叶片蛋白质组分析的样品制备方法。Zhang等[36]提出了HMW-GS的MALDI-TOF-MS质谱鉴定技术体系,但所用实验材料较少。
MALDI-TOF-MS质谱技术在HMW-GS鉴定中的应用尚需选用大量具广泛代表性的小麦品种进行验证,笔者利用250份我国冬播麦区的小麦主栽品种和国际上广泛用于麦谷蛋白亚基研究的100多份代表性材料验证了MALDI-TOF-MS质谱技术在HMW-GS鉴定中应用的可行性[37];此外,还建立了LMW-GS的MALDI-TOF-MS质谱鉴定技术体系[31]。
生物质谱技术为蛋白质组研究奠定了基础,同时蛋白质组学的深入研究对质谱技术的要求推动了生物质谱技术的发展,以进一步提高规模化、灵敏度、分辨率和准确性。目前,生物质谱技术在蛋白质组研究中已有较多应用,但生物质谱技术尚存在不足,例如难以检测低丰度蛋白,质谱数据分析软件有待进一步完善与优化。生物质谱技术在蛋白质组学中的应用仍有赖于蛋白质化学修饰及同位素标记技术的发展。
2-DE是目前蛋白质分离中最有效的方法之一,广泛应用于生物学研究领域。但2-DE尚存在局限性,难以检测膜蛋白、疏水蛋白、低丰度蛋白、极酸性和极碱性蛋白、分子质量较小和较大(10 150kDa范围之外)的蛋白质等。增加低丰度蛋白的相对含量,有助于提高低丰度蛋白的2-DE分辨效果。提高上样量有助于低丰度蛋白的检测,但上样量过高,可能导致麦谷蛋白和醇溶蛋白等高丰度蛋白在凝胶上的蛋白点过大,覆盖了其他蛋白点,影响低丰度蛋白的鉴定。因此,对提高样品中低丰度蛋白的含量有两点建议:①利用抗体专一性及免疫亲和技术提高蛋白质浓度;
②利用单向SDS-PAGE浓缩蛋白,增加上样量,回
收胶上低丰度蛋白,以提高目标蛋白的浓度。
综上所述,蛋白质组学将基因与蛋白质相结合,可以为小麦品质改良提供全面的信息与理论依据,是小麦遗传育种研究的重要组成部分,加强小麦蛋白质组学研究将有助于深入了解环境对其基因表达的影响;另一方面,蛋白质组技术的发展
901
刘丽,等:蛋白质组技术在小麦品质研究中的应用
使从氨基酸到基因这一逆向研究成为可能,蛋白表达差异点可作为标记用以鉴定品种,但是目前蛋白质标记的研究远远落后于基因标记,未来的发展方向要加强寻找与品种鉴定有关的蛋白质标记。
参考文献
[1]Skylas D J,Dyk D V,Wrigley C W.Proteomics of wheat grain [J].J.Cereal Sci.,2005,41:165-179.
[2]Mak Y X,Skylas D J,Willows R,et al..A proteomic approach to the identification and characterization of protein
composition in wheat germ[J].Funct.Integr.Genom.,2006,6:322-337.
[3]Fiehn O.Metabolomics-the link between genotypes and pheno-types[J].Plant Mol.Biol.,2002,48:155-171.
[4]Feizi T,Fazio F,Chai W,et al..Carbohydrate microarrays-a new set of technologies at the frontiers of glycomics[J].Curr.
Opin.Struct.Biol.,2003,13:637-645.
[5]Sumner L W,Mendes P,Dixon R A.Plant metabolomics:large scale phytochemistry in the functional genomics era[J].
Phytochemistry,2003,62:817-836.
[6]Weckwerth W.Metabolomics in systems biology[J].Annu.Rev.Plant Biol.,2003,54:669-689.
[7]Wasinger V C,Cordwell S J,Cerpa-Poljak A,et al..Progress with gene-product mapping of the Mollicutes:Mycoplasma
genitalium[J].Electrophoresis,1995,16:1090-1094.[8]Humphery-Smith I,Cordwell S J,Blackstock W P.Proteome research:complementarity and limitations with respect to the
RNA and DNA worlds[J].Electrophoresis,1997,18:1217
-1242.
[9]Wrigley C W,Batey I L,Skylas D J,et al..Grain quality assessment using proteomics and genomics[J].Food
Australia,2003,55:143-146.
[10]Thiellement H,Bahrman N,Damerval C,et al..Proteomics for genetic and physiological studies in plants[J].Electropho-
resis,1999,20:2013-2026.
[11]Cánovas F M,Dumas-Gaudot E,Recorbet G,et al..Plant proteome analysis[J].Proteomics,2004,4:285-298.
[12]G rg A,Obermaier C,Boguth G,et al..The current state of two-dimensional electrophoresis with immobilised pH gradients
[J].Electrophoresis,2000,21:1037-1053.
[13]Karas M,Hillenkamp F.Laser desorption ionisation of proteins with molecular masses exceeding10000Da[J].Analyt.
Chem.,1988,60:2299-2301.
[14]Fenn J B,Mann M,Meng C K,et al..Electrospray ionisation for mass spectrometry of large biomolecules[J].Science,1989,246:64-71.
[15]Zenobi R,Knochenmuss P.Ion formation in MALDI mass spectrometry[J].Mass Spectrom.Rev.,1998,17:337
-366.
[16]Wilm M,Mann M.Analytical properties of the nanoelectros-pray ion source[J].Analyt.Chem.,1996,68:1-8.[17]Mann M,Hojrup P,Roepstorff P.Use of mass spectrometric molecular weight information to identify proteins in sequence
databases[J].Biol.Mass Spectrom.,1993,22:338-345.[18]Chaurand P,Luetzenkirchen F,Spengler B.Peptide and protein identification by matrix-assisted laser desorption ionisa-
tion(MALDI)and MALDI-post-source decay time-of-flight
mass spectrometry[J].J.Am.Soc.Mass Spectrom.,1999,10:91-103.
[19]Shevchenko A,Wilm M,Mann M.Peptide sequencing by mass spectrometry for homology searches and cloning of genes
[J].J.Protein Chem.,1997,16:481-490.
[20]Link A J,Eng J,Schieltz D M,et al..Direct analysis of pro-tein complexes using mass spectrometry[J].Nat.Biotechnol.,1999,17:676-682.
[21]Washburn M P,Wolters D,Yates J R.Large-scale analysis of the yeast proteome by multidimensional protein identification
technology[J].Nat.Biotechnol.,2001,19:242-247.[22]刘进元,吴雪萍.植物磷酸化蛋白质组学的研究进展[J].中国农业科技导报,2007,9(4):43-48.
[23]Hart C,Schulenberg B,Steinberg T H,et al..Detection of glycoproteins in polyacrylamide gels and on electroblots using
Pro-Q Emerald488dye,a fluorescent periodate Schiff-base
stain[J].Electrophoresis,2003,24:588-598.
[24]Koller A,Washburn M P,Lange B M,et al..Proteomic survey of metabolic pathways in rice[J].Proc.Natl.Acad.
Sci.USA,2002,99:11969-11974.
[25]Mirgorodskaya O A,Kozmin Y P,Titov M I,et al..Quantita-tion of peptides and proteins by matrix-assisted laser desorp-
tion/ionization mass spectrometry using(18)O-labeled inter-
nal standards[J].Rapid Commun.Mass Spectrom.,2000,14:
1226-1232.
[26]Havlis J,Shevchenko A.Absolute quantification of proteins in solutions and in polyacrylamide gels by mass spectrometry[J].
Analyt.Chem.,2004,76:3029-3036.
[27]Lu Y,Bottari P,Turecek F,et al..Absolute quantification of specific proteins in complex mixtures using visible isotope-
coded affinity tags[J].Analyt.Chem.,2004,76:4101
-4111.
[28]Larsen M R,Sorensen G L,Fey S J,et al..Phospho-pro-teomics:evaluation of the use of enzymatic de-phosphorylation
and differential mass spectrometric peptide mass mapping for
site specific phosphorylation assignment in proteins separated by
gel electrophoresis[J].Electrophoresis,2001,22:223-238.[29]Wrigley C W.Gel electrofocusing-a technique for analyzing multiple protein samples by isoelectric focusing[J].Sci.
Tools,1968,15:17-23.
[30]O'Farrell P H.High-resolution two-dimensional electrophoresis of proteins[J].J.Biol.Chem.,1975,250:4007-4021.[31]Liu L,Ikeda T M,Branlard G,et al..Comparison of low molecular weight glutenin subunits identified by SDS-PAGE,2-
DE,MALDI-TOF-MS and PCR in common wheat[J].BMC
Plant Biol.,2010,10:124.
[32]Beavis R C,Chait B T.Rapid sensitive analysis of protein mixtures by mass spectrometry[J].Proc.Natl.Acad.Sci.
011生物技术进展Current Biotechnology
USA,1990,87:6873-6877.
[33]Hillenkamp F,Karas M,Beavis R C,et al..Matrix-assisted laser desorption/ionization mass spectrometry of biopolymers
[J].Analyt.Chem.,1991,63A:1193-1202.
[34]Dworschak R G,Ens W,Standing K G,et al..Analysis of wheat gluten proteins by matrix-assisted laser desorption/ioniza-
tion mass spectrometry[J].J.Mass Spectrom.,1998,33:429
-435.
[35]Chen J,Lan P.Tarr A,et al..Matrix-assisted laser desorp-tion/ionization time-of-flight based wheat gliadin protein peaks
are useful molecular markers for wheat genetic study[J].
Rapid Commun.in Mass Spectrom.,2007,21:2913-2917.[36]Zhang Q,Dong Y M,An X L,et al..Characterization of HMW glutenin subunits in common wheat and related species
by matrix-assisted laser desorption/ionization time-of-flight
mass spectrometry(MALDI-TOF-MS)[J].J.Cereal.Sci.,2008,47:252-261.
[37]Liu L,Wang A L,Appels R,et al..A MALDI-TOF based analysis of high molecular weight glutenin subunits for wheat
breeding[J].J.Cereal Sci.,2009,50:295-301.
[38]Lindsay M P,Skerritt J H.The glutenin macropolymer of wheat flour dough:Structure-function perspectives[J].Trends Food
Sci.Technol.,1999,10:247-253.
[39]Shewry P R.The synthesis,processing and deposition of gluten proteins in the developing grain[J].Cereal Foods World,1999,44:587-589.
[40]Skylas D J,Wrigley C W.Proteomics of grains[A].In:Wrigley,C.,Walker,C.,Corke,H.(Eds)Encyclopedia of
Grain Science[M](Vol.2),UK:Oxford,2004,480-488.[41]Clarke B C,Hobbs M,Skylas D J,et al..Genes active in developing wheat endosperm[J].Funct.Integr.Genom.,2000,1:44-55.
[42]Rathmell W G,Skylas D J,Bekes F,et al..Wheat-grain pro-teomics;the full complement of proteins in developing and
mature grain[A].In:Shewry,P.R.,Tatham,A.S.(Eds)
Wheat Gluten[M].Cambridge,UK:Royal Society of Chemis-
try,2000,117-121.
[43]高飞,王彦平,周宜君,等.植物应答非生物胁迫的蛋白质组学研究进展[J].中国农业科技导报,2008,10(6):9
-15.
[44]Skylas D J,Cordwell S J,Hains P G,et al..Heat shock of wheat during grain filling:characterisation of proteins associated
with heat-tolerance using a proteome approach[J].J.Cereal
Sci.,2002,35:175-188.
[45]Majoul T,Bancel E,Triboi E,et al..Proteomic analysis of the effect of heat stress on hexaploid wheat grain:characteriza-
tion of heat-responsive proteins from non-prolamins fraction
[J].Proteomics,2004,4:505-513.
[46]Stone P J,Nicholas M E.Wheat cultivars vary widely in their responses of grain yield and quality to short periods of post-
anthesis heat stress[J].Aust.Plant Physiol.,1994,21:887-
900.
[47]Lafiandra D,Turchetta T,D'Ovidio R,et al..Conformational polymorphism of high M r glutenin subunits detected by trans-
verse urea gradient gel electrophoresis[J].J.Cereal Sci.,
1999,30:97-104.
[48]Amiour N,Dardevet M,Khelifi D,et al..Allelic variation of HMW and LMW glutenin subunits,HMW secalin subunits and
75K gamma-secalins of hexaploid triticale[J].Euphytica,
2002,123:179-186.
[49]Branlard G,Amiour N,Igrejas G,et al..Diversity of puroin-dolines as revealed by two-dimensional electrophoresis[J].
Proteomics,2003,3:168-174.
[50]Andon N L,Hollingworth S,Koller,et al..Proteomic charac-terization of wheat amyloplasts using identification of proteins by
tandem mass spectroscopy[J].Proteomics,2002,2:1156
-1168.
[51]潘映红.蛋白质组学在转基因生物检测和研究中的应用前景[J].中国农业科技导报,2010,12(1):31-34.[52]司晓敏,李巧云,晏月明.蛋白质组技术及小麦蛋白质组研究进展[J].麦类作物学报,2005,25(3):100-105.[53]刘伟霞,潘映红.适用于小麦叶片蛋白质组分析的样品制备方法[J].中国农业科学,2007,40(10):2169-2176.
111
刘丽,等:蛋白质组技术在小麦品质研究中的应用
植物蛋白质组研究技术 (内部使用)
一、蛋白质提取方法: 直接研磨法:将植物材料剪碎于加有一定量的样品缓冲液(材料g:缓冲液ml=1:4)的预冷的研钵中,冰上进行研磨至匀浆。4o C下15000 rpm离心15 min,上清夜即为蛋白质抽提液。电泳前将该提取液在相同条件下再离心一次即可。该方法适用于极幼嫩的植物组织或幼苗以及白化、黄化苗等。 TCA/丙酮沉淀法:A)植物组织在液氮中研磨成精细的粉末后加入10%TCA(丙酮为溶剂)在-20o C下沉淀1 h以上(可以过夜)。溶液在4o C下15000 rpm离心15 min。沉淀用丙酮清洗三次(至丙酮为无色止),相同条件下离心后,沉淀真空干燥(约5 min 即可)。真空干燥后所得的干粉按每30 mg加1ml样品缓冲液进行溶解(室温下1 h以上)。可以进行振荡或超声波助溶。溶解后的样品4o C下15000 rpm离心15 min后取上清液即为蛋白质提取液。 B)植物组织在匀浆缓冲液中4o C下研磨至匀浆【样品于缓冲液之比(g/ml)随样品的不同而有所不同,一般幼嫩或含水量比较丰富的组织为1:3-4,而生理年龄较老的组织约为1:8-10】。匀浆液4o C下15000 rpm离心15 min后取上清液,往上清中加入50%TCA(水为溶剂)至TCA浓度为10%,冰上沉淀30 min,相同条件下离心,沉淀用丙酮清洗3次,离心后真空干燥即可得蛋白干粉。将蛋白干粉按所需的比例溶于样品缓冲液中(振荡助溶1 h)即可。 酚抽提法:植物组织在匀浆缓冲液中4o C下研磨至匀浆【样品于缓冲液之比(g/ml)随样品的不同而有所不同,一般幼嫩或含水量比较丰富的组织为1:3-4,而生理年龄较老的组织约为1:8-10】。匀浆液4o C下15000 rpm离心15 min后取上清液,往上清夜中加入相同体积的Tris饱和酚(pH 8.0)上下倒置充分混匀后15000 rpm离心5-10 min。取酚相加入5倍体积的0.1 M乙酸胺(甲醇为溶剂)在-20o C下沉淀1 h以上(可以过夜)。离心后沉淀用丙酮清洗3次。再次离心后,沉淀进行真空干燥即可得蛋白干粉。蛋白干粉的溶解与TCA/丙酮沉淀法B的相同。 溶液配方: 样品缓冲液(lysis buffer)8-9 M Urea, 4% NP-40 (Triton X-100, Chaps), 2% Carrier Ampholyte (pH 3-10), 5% (v/v) 2-Me, 5%(w/v) PVP-40 (直接研磨法中必需); 匀浆缓冲液(homogenization buffer) 20 mM Tris-HCl (pH 7.5), 250 mM sucrose, 10 mM
专业文献综述 小麦优质蛋白亚基与小麦品质的研究进展 赵娇娇 农学院 种子科学与工程 种子72班 1127219 ____ 王秀娥 _________ 职称: 教授 ________ 2010年5月31日 题 目: 姓 名: 学 院: 专 业: 班 级: 学 号: 指导教师:
南京农业大学教务处制
小麦优质蛋白亚基与小麦品质的研究进展 赵娇娇指导老师:王秀娥 (南京农业大学农学院种子科学与工程72班,江苏南京210095) 摘要:小麦籽粒蛋白质含量约为8%-20%主要包括谷蛋白和醇溶蛋白,是面团弹性和延伸性的物质基础。蛋白质组分与格组分的分布是影响小麦品质的重要因素,特别是高分子量麦谷蛋白(HMW-GS)因此提高蛋白质含量和改进HMW-GS组成一直是我国小麦加工品质改良的重要途径。目前推广的优质强筋小麦基本都携带优质亚基,然而真正适合烘焙优质面包的强筋小麦并不多,贮藏蛋白组分的含量及比例不合理是主要原因,改进贮藏蛋白亚基的质量组成是进一步提高我国小麦加工品质的有效途径。 关键词:谷蛋白、醇溶蛋白、品质、加工品质 Wheat proteins and their subunits and quality of wheat flour ZHAO Jiaojiao (Seed Science and Engineering 72, College of Agriculture, Nanjing Agricultural University, Nanjing, Jiangsu 210095) Abstract : Key words: 前言(引言):XXXXX (标题用小四号黑体,其它文字用小四宋体)XXXXX XXXXXXXXXXXXX .......................... 正文:XXXXX (标题用小四号黑体,其它文字用小四宋体)XXXXXXXX XXXXXXXXXXXXXX ........................... 结论:XXXXXX(小四宋体)XXXXXXXXXXXXXXXXXXXXXX XXXXXXXXXXXXXX ........................... 参考文献: [1] 作者姓名,作者姓名?参考文献题目?期刊或杂志等名称,年份,(期数). [2] 刘凡丰?美国研究型大学本科教育改革透视[J]. 高等教育研究,2003,(1)
第三节小麦品质的检验方法 一、籽粒硬度的测定(研磨时间法) (1)适用范围本方法适用于快速测定小麦及其他谷物籽粒的硬度。 (2)方法提要本方法利用小麦籽粒的研磨特性来测定其硬度。因为硬麦研磨后得到粗的颗粒粉易于从磨体间隙中流出,而软麦研磨后得到细的颗粒粉不易从磨体间隙中流出,故研磨一定数量不同硬度的小麦所用时间不同,硬麦时间短,软麦时间长。此方法称为研磨时间法(ground time),简称GT法,以秒数表示小麦的硬度。数值越小,籽粒越硬。 (3)仪器设备使用国产ZL Y-1型自动粮食硬度计(牡丹江市机械研究所和北京市粮食科,学研究所联合研制)或联邦德国布拉本德( Brabender)公司制造的微型硬度计(micro-hardness Tester)。 ZI_Y-1型自动粮食硬度计的结构和技术参数:‘ ①结构仪器包括主机和天平两个组成部分。主机由锥形磨体,磨隙调节环,传动机构,电器控制,时间显示器等部分组成,如图2-2所示。 ②技术参数厂_一 380V:圆锥50Hz磨隙可调o.0~1.50mm。电源380V±10%,50Hz,具有水冷却系统可保证磨体工作温度稳定(要另配恒温水浴或使用自来水龙头供水)。 天平:称量范围0-20g,精度±0.Olg。 时间测量:液晶数系显示000.0~999. 9s,精度±0.1s. ③安装。将仪器从包装箱中取出,将底座⑩与主机用6个M8螺钉连接起来,将电源导线与天平信号导线分别接入相应的插孔,天平放在主机下部。将仪器安装在靠近水龙头的地方,但不得靠近振动大的振源,以防影响仪器精度。使用前检查仪器是 (4)样品制备选取有代表性的小麦样品种子,去杂后按四分法缩分,取样量不得少于30g。样品种子要干燥,含水量相对一致。 (5)测定步骤 ①接通电源,将电源开关(12)置于“l”的位置,此时电源开关上指示灯亮,液晶显示器⑤显示数字,天平上的取少灯(13)亮。 ②将天平的一个托盘对准仪器磨体的下斜口,并调整天平的水平位置。在另一天平托盘上放4g砝码。 ③将磨隙调节环的螺丝③放松,把刻度调节到6.O的位置,拧紧固定螺丝。 ④将仪器后面的冷却水管分别与恒温水浴的出水口和入水口连接,或与自来水龙头连接,向仪器通入恒温水20min。 ⑤在正式测定样品前,为了预热和清理仪器,取非供试小麦20g,投入进料口④ 中,按下磨起动钮⑧,研磨完后,按下磨停止钮⑨,使仪器处于待测工作状态。 ⑥按下液晶显示器清零钮(14)使显示器显示ooo.O。 ⑦用精度为0. lg的天平(用户自备)称量6g供试样品,放入仪器进料口④中。 按下起动钮⑥,磨体开始转动,计时器也开始工作。当粉碎物由磨体下口流人天平托(PSD)。此法比较准确,应用最多。研磨功耗法使用硬度一结构仪测定研磨小麦时所需要的力和功,需与粉质/阻力测定仪( farinogranh/resistograph)配合使用。此法更为精确,但用样量大,每次测定需要50g,且费工时。研磨时间法即本书引用的方法,其准确性较差,但有快速,微量的优点,适于大批样品,特别适于育种工作者使用。d.近红外法,它可以快速测定谷物的蛋白质、脂肪、水分含量等。在1680nm处的反射光密度与研磨时间法的GT值或研磨细度法的PSI值都有较好的相关性,因此可用来测定小麦的硬度,已有应用的报道。 ③用研磨时间法测定小麦硬度,其结果会受到样品含水量、环境温度和湿度等的影响。
ProteomeWorks TM System ProteomeWorks TM蛋白质组学解决方案 Bio-Rad蛋白质组系统致力于为科研工作者提供一套完整的系统解决方案:从样品制备->一维等电聚焦->二维蛋白电泳->图像采集->2D图像分析->蛋白点自动切取->质谱分析->生物信息学数据管理。系统的高灵敏度,高分辨率,高重复性,自动化控制的性能保证以及功能强大的专业软件支持是您研究工作的顺利进行的全面保障。
1.样品制备 除传统的层析方法,等电点分离方法等样品提取方法外,Bio-Rad提供了独特的样品序列抽提方案,提高了样品处理的灵敏度和分辨率 2.一维等电聚焦系统及干胶条 Protean IEF系统是一体化的一维等电聚焦系统,它提供了10000V的高电压,以及10-25度的精确温控。同时,IEF可同时容纳12根11,17,18,24cm的胶条,保证了实验的高通量。对于实验室经常进行的7cm的预实验(摸索条件等),它可提供每次跑24根胶的高通量。 我们提供了不同尺寸不同的pH值梯度的IPG(immobilized pH gradient)干胶条。从尺寸分有7,11,17,18cm干胶条,并即将推出24cm干胶条;从pH值梯度分,有宽梯度:3-10线性,3-10非线性;有窄梯度:3-6,4-7,5-8,7-10;有微梯度:3.9-5.1,4.7-5.9,5.5-6.7,6.3-8.3。多种选择满足不同的饿实验需要。同时,PDQuest软件可将多根胶条进行拼接,回复成一张更宽更多信息的“全”胶。 3.二维蛋白电泳 一直以来,Bio-Rad是电泳市场的领先者,我们有多种独特的设计保证电泳系统的稳定可靠,经久耐用。
蛋白质组学研究方法选择及比较 目前研究蛋白组学的主要方法有蛋白质芯片及质谱法,本文将从多方面对两种研究方法进行了解与比较; 蛋白质芯片(Protein Array) 将大量不同的蛋白质有序地排列、固定于固相载体表面,形成微阵列。利用蛋白质分子间特异性结合的原理,实现对生物蛋白质分子精准、快速、高通量的检测。 主要类型: ●夹心法芯片(Sandwich-based Array) ●标记法芯片(Label-based Array) ●定量芯片(Quantitative Array) ●半定量芯片(Semi-Quantitative Array) 质谱(Mass Spectrometry) 用电场和磁场将运动的离子按它们的质荷比分离后进行检测,测出离子准确质量并确定离子的化合物组成,即通过对样品离子质荷比的分析而实现对样品进行定性和定量的一种方法。 主要类型:
●二维电泳+质谱(2D/Mass Spectrometry, MS) ●表面增强激光解吸电离飞行时间质谱(Surface-enhanced laser desorption/ionization- time of flight, SELDI) ●同位素标记相对和绝对定量(Isobaric tags for relative and absolute quantitation, iTRAQ) Protein Array or Mass Spectrometry? 如何选择合适的研究方法?以下将从六个方面进行比较与推荐: 1.筛查蛋白组学表达差异 建议选择:RayBiotech(1000个因子的芯片)+质谱 a)不同的方法学有不同的特点:对于质谱,可以筛查到未知的蛋白,但是对于分子量大、 低丰度的蛋白质,质谱的灵敏度和准确性有一定的限制。 b)不同的方法能筛查到的目标不同:根据Proteome Analysis of Human Aqueous Humor 一文中报道,质谱筛查到的差异蛋白集中在小分子与代谢物。而用RayBiotech芯片筛查到的结果,多是集中在细胞因子、趋化、血管、生长等等。 c)质谱筛查到355个蛋白,而RayBiotech抗体芯片也筛查到328个蛋白,且用定量芯片 验证25个蛋白有差异,这些蛋白是质谱找不到的。目前RayBiotech夹心法抗体芯片已经可以检测到1000个蛋白,采用双抗夹心法,尤其是对于低丰度蛋白,有很好的灵敏度和特异性,很多的低丰度蛋白是抗体芯片可以检测出来,而质谱检测不到的,且样品不经过变性和前处理,保持天然状态的样品直接检测,对于蛋白的检测准确度高。 d)质谱的重复性一直是质谱工作者纠结的问题,不同操作者的结果,不同样品处理条件, 峰值的偏移等影响因素都会产生大的影响;RayBiotech的夹心法芯片重复性高。
青海农林科技?专题综述?2001年第4期 小麦蛋白质品质研究进展 车永和,马晓岗 (青海省农林科学院作物所,青海西宁810016) 摘要:小麦是人类重要的蛋白质来源。小麦蛋白质对小麦营养品质和加工特性都有非常重要的影响,它是 小麦国际贸易和品质评价中的基本指标。本文就小麦蛋白质品质的蛋白质含量、蛋白质质量、麦谷蛋白和麦醇溶蛋白、面筋含量和质量、沉淀值等有关蛋白质品质的几个主要方面研究情况进行了综述和讨论,育种提供参考。 关键词:小麦;蛋白质;品质中图分类号:S152.1+233文献标识码:A()042白质的38.4,35食物,,不仅是小麦商品粮的品质基础,也是专用面粉生产和食品加工企业生产优质食品的重要物质基础,小麦产量和品质的多少与优劣,直接关系到人类食物的满足程度和生产水平的提高,影响着人类的营养平衡。小麦蛋白质品质对小麦营养品质和加工特性都有非常重要的影响,是小麦国际贸易和品质评价中的基本指标,也是目前研究最为广泛和深入的小麦品质指标。本文就小麦有关蛋白质品质的几个主要方面的研究做一综述,以期为小麦品质育种研究工作提供参考。1蛋白质含量 小麦籽粒蛋白质含量与湿面筋含量具有很好的相关性,与加工品质密切相关。不同用途的小麦面粉对小麦蛋白质含量要求不同,对馒头小麦品种的 1〕 面粉粗蛋白含量一般要求以高于12.5±1%为宜〔;中国面条(加碱黄色面条)一般要求小麦中蛋白质与淀粉的含量与质量,以及小麦的各种品质指标都要 2〕 适中,过高、过低都不行(Miskelly,1989)〔。黄东印(1990)指出,面粉蛋白质含量与干面条断裂强度呈 3〕 极显著正相关,林作楫(1994)〔研究也发现,蛋白质含量不仅与煮面强度高度相关,而且与煮熟面条的外观表现和总评价值呈显著负相关。因此,一般认为中国面条适宜的蛋白质含量应为中等,即12%~13%左右;小麦蛋白质含量在8%~20%范围内,蛋白质含量与面包体积呈线性关系,烘烤品质较好(尹应哲,1990;李志西等,1998)。4〕 (1995)对我国小麦种质资源品质现据李鸿恩〔 状分析来看,蛋白质平均含量为15.10%,变异幅度为7.50%~28.90%。我国首批面包小麦品种蛋白 5〕
蛋白质组学研究的完整解决方案 人体内真正发挥作用的是蛋白质,蛋白质扮演着构筑生命大厦的“砖块”角色,随着破译生命密码的人类基因组计划进入尾声,一个以蛋白质和药物基因学为研究重点的后基因组时代已经拉开序幕,蛋白质将是今后的重点研究方向之一。然而,蛋白质的分离和鉴定非常费时,目前测定蛋白质的技术远远落后于破译基因组的工具,最好的实验室每天只能分离和识别出100种蛋白质。据估计,人体内可能有几十万种蛋白质,这大概需要10年时间进行识别。 为了加快蛋白质组学研究进程,以专业生产蛋白质组学研究设备而著称的美国Genomic Solution Inc.公司开发了完整的蛋白质组学解决方案,由一系列机械手臂与软件,并结合了二维电泳实验设备与质谱仪,可以进行高效、自动化且具重复性的试验分析。在Genomic solution值得信赖的技术平台上,你的研究工作将更富成效,重复性更好。在这一整套Investigator平台上,各仪器之间配合无隙,由于它的整合性及标准性,使得研究进程大大加快,原来需要9—12个月才能获得数据结果发表的时间减少到9—12周。这套完整的系统具备蛋白质组研究所需的众多功能:2-D电泳、图像获取、2-D胶分析、蛋白样品切割、蛋白消化、MALDI样品准备、消化及点样、数据分析整合,再加上制备好的胶、试剂及附件,使研究工作可以立即展开。此套设备为进行蛋白质组学研究的利器,大大加速了蛋白质分离和鉴定的速度。该系统主要由以下几部分组成: 一、2-D电泳系统(Investigator? 2-D Electophoresis System) 该系统主要进行2D PAGE第一向等电聚焦凝胶电泳和第二向SDS-PAGE电泳,设备包括2-D电泳系统所需的各种设备,如pHaser?(IPG胶条电泳)、管状制胶设备、二维电泳装置、电源设备、半导体冷却器及各种相关的蛋白纯化试剂盒。 产品特征: * 提供2D PAGE电泳所需的各种设备,使电泳更加简便,大大节约研究时间 * 高分辨率:有效的第一向等电聚焦凝胶电泳和23cm X 23cm第二向SDS-PAGE大面积板胶提供清晰的电泳图像,有效提高单体、磷酸化和糖基化蛋白的分离 * 大容量:可同时容纳15块1mm一维管状胶,或8块2-3mm管状胶;10块IPG胶条和10块二维电泳板胶 * 灵活性:该系统用于管状胶、IPG 胶条、预制胶、自制胶和SDS PAGE胶使用 * 恒温:高效的半导体制冷装置保证电泳体系温度恒定,温度变化< 0.5℃ * 专门为高分辨率2D PAGE而设计的电源系统 * 提供超纯的相关化学试剂和药品
进展评述 比较蛋白质组学研究中的稳定同位素标记技术 刘新1,2 应万涛1,2 钱小红1,23 (1军事医学科学院放射与辐射医学研究所 北京 100850;2北京蛋白质组研究中心 北京 102206) 摘 要 比较蛋白质组学是指在蛋白质组学水平上研究正常和病理情况下细胞或组织中蛋白质表达变化,以期发现具有重要功能的生物标识物,为疾病的早期诊断提供依据。近年来它正成为蛋白质组学研究的热点和发展趋势。比较蛋白质组学的研究方法和策略有多种,本文就最近几年来稳定同位素标记技术(体内代谢标记技术和体外化学标记技术)在比较蛋白质组学研究中的进展进行综述。 关键词 比较蛋白质组学 稳定同位素标记 体内代谢标记 体外化学标记 Application of Stable Isotope Labeling in Comparative Proteomics Liu X in1,2,Y ing Wantao1,2,Qian X iaohong1,23 (1Beijing Institute of Radiation Medicine,Beijing100850; 2Beijing Proteome Research Center,Beijing102206) Abstract C omparative proteomics is the research of protein expression changing between normal and pathological cell or tissue on the proteome level.P otential biomarkers w ould be discovered from the research by comparative proteomics, which will be helpful to the diagnosis and therapy of diseases.In the recent years,it has been becoming the hot spot of the proteomics research and many strategies used in comparative proteomics have been developed.During those approaches,the strategies based on stable is otopic labeling coupled with mass spectrometry have been extensively used and lots of success ful applications have been reported.In contrast to the traditional radioactive is otope labeling method,stable is otope labeling technique was not radioactive and the operation is simple.Metabolic labeling in viv o and chemical labeling in vitro are tw o parts of stable is otope labeling technique,which both have various advantages and disadvantages.This paper reviewed the progress of stable is otope labeling technique in comparative proteomics. K ey w ords C omparative proteomics,S table is otope labeling,Metabolic labeling in viv o,Chemical labeling in vitro 随着人类基因组精确图谱的公布,基因组功能的阐明已经成为生命科学研究中一项极重要的任务[1]。蛋白质是基因的最终产物同时也是基因功能的最终执行体,因而人类基因的表达及其功能有待于在蛋白水平上揭示。蛋白质组学的研究目的是分离和鉴定组织或细胞中的所有蛋白质。生物体在生长发育过程中,基因组是相对稳定的,而蛋白表达是高度动态变化的,并且具有严格调控的时间和空间特异性[2]。为了研究生物体在不同状态下表达的所有蛋白质的动态变化,比较蛋白质组学应运而生,即在蛋白组学水平上,研究在正常生理和病理状态,或受到不同的外部环境刺激下,或在突变等因素影响下,蛋白质表达的变化情况,以期发现生物体内关键的调控分子及与疾病相关的蛋白质标志物,最终为疾病的防诊治、新型疫苗的研发等提供理论依据。 为了研究蛋白质表达的动态变化,基因表达检测技术,如微阵列法[3]、DNA(脱氧核糖核酸)芯片法[4]等曾被广泛使用。这些方法虽然能够实现对mRNA(信使核糖核酸)进行定性和定量分析,但 刘新 男,27岁,博士生,现从事比较蛋白质组学研究。 3联系人,E2mail:qianxh1@https://www.doczj.com/doc/935906928.html, 国家自然科学基金(20505019、20505018)、国家重点基础研究发展规划项目(2004C B518707)和北京市科技计划重大项目(H030230280190)资助项目 2006207220收稿,2006209221接受
小麦质量及储存品质检验 一、质量及储存品质检验流程: 二、质量检验 执行标准:《小麦》GB 1351 —2008。 (一)混合、分样按GB/T 5491—1985执行。 (二)色泽、气味检验按GB/T 5492—2008执行。 注意事项: 1. 环境应符合GB/T10220和GB/T22505的规定,实验室应符合GB/T13868的规定。 2. 试验室应保持通风良好,无异味,避免阳光直射,应在散射光线条件下操作。
3. 检验者色觉、嗅觉应正常,检验前严禁吸烟、喝酒和使用化妆品等。人员搭配应合理,对于色泽、气味不正常的样品,至少应经5人以上检验确认。 (三水分检验按GB/T 5497—1985执行。 注意事项: 1. 水分检验按GB/T5497—1985中规定的105℃恒质法执行,也可以用130℃定温定时法检验,但当检验结果超过本次查库规定的判定标准时,应用105℃恒质法确认。 2. 样品粉碎应使用测水用水分磨,每份样品粉碎前应将磨膛清理干净。样品粉碎过程中磨膛温度明显高于室温时,应停止粉碎,待温度降至室温继续操作。粉碎细度应达到标准规定的要求。称量时应用角匙将样品充分混合。 3. 称量前应将天平调平,称量时应将样品放置于天平托盘中心,天平门应关闭,称量过程中应避免震动,天平、干燥器中的变色硅胶保持蓝色。 4. 选用的烘箱温度均匀性应满足要求。烘盒应围绕烘箱中心位置摆放,一般每次不超过8~10个烘盒并放置在上一层为宜,防止异物掉入烘盒。送取烘盒后应立即关闭烘箱门,放入烘盒后5分钟内将烘箱温度升至所需温度。 5. 称样量应尽量一致,烘盒规格应一致。
(四)杂质检验按GB/T 5492—2008执行。 1. 杂质 除小麦粒以外的其它物质,包括筛下物、无机杂质和有机杂质。 (1)筛下物:通过直径1.5mm 圆孔筛的物质。 筛下物 (2无机杂质:砂石、煤渣、砖瓦块、泥土等矿物质及其他无机类物质。无机杂质 (3有机杂质: 无使用价值的小麦、异种粮粒及其他有机类物质。
专业文献综述 题目: 小麦优质蛋白亚基与小麦品质的研究进展 姓名: 赵娇娇 学院: 农学院 专业: 种子科学与工程 班级: 种子72班 学号: 1127219 指导教师: 王秀娥职称: 教授 2010年5 月31 日 南京农业大学教务处制
小麦优质蛋白亚基与小麦品质的研究进展 赵娇娇指导老师:王秀娥 (南京农业大学农学院种子科学与工程72班, 江苏南京 210095) 摘要:小麦籽粒蛋白质含量约为 8%-20%,主要包括谷蛋白和醇溶蛋白,是面团弹性和延伸性的物质基础。蛋白质组分与格组分的分布是影响小麦品质的重要因素,特别是高分子量麦谷蛋白(HMW-GS),因此提高蛋白质含量和改进 HMW-GS 组成一直是我国小麦加工品质改良的重要途径。目前推广的优质强筋小麦基本都携带优质亚基,然而真正适合烘焙优质面包的强筋小麦并不多,贮藏蛋白组分的含量及比例不合理是主要原因,改进贮藏蛋白亚基的质量组成是进一步提高我国小麦加工品质的有效途径。 关键词:谷蛋白、醇溶蛋白、品质、加工品质 Wheat proteins and their subunits and quality of wheat flour ZHAO Jiaojiao (Seed Science and Engineering 72, College of Agriculture, Nanjing Agricultural University, Nanjing, Jiangsu 210095) Abstract: Key words: 前言(引言):×××××(标题用小四号黑体,其它文字用小四宋体)××××××××××××××××××……… 正文:×××××(标题用小四号黑体,其它文字用小四宋体)××××××××××××××××××××××……… 结论:××××××(小四宋体)××××××××××××××××××××××××××××××××××××……… 参考文献: [1] 作者姓名,作者姓名.参考文献题目. 期刊或杂志等名称,年份,(期数). [2] 刘凡丰. 美国研究型大学本科教育改革透视[J] . 高等教育研究,2003,(1) [3] 作者姓名,作者姓名. 参考文献题目. 期刊或杂志等名称,年份,(期数).
实验四小麦品质分析 一、实验目的 通过练习,初步掌握小麦面筋含量和面筋品质的测定方法及沉降试验的方法。 二、内容说明 面筋即面粉经加水揉成面团后,放入水中静止一段时间,然后在水中反复洗涤,淀粉和麸皮等物质与面团分离,可溶性物质溶于水中,最后剩下具有延展性和粘弹性的物质就是湿面筋。面筋主要由麦胶蛋白和麦谷蛋白组成,其中还含有淀粉、糖类、脂肪、灰分和其它蛋白质等。麦胶蛋白(约占干面筋的40%)不溶于水、乙醇和无机盐溶液,能溶于70%酒精。湿的麦胶蛋白粘力甚强,富有延伸性。麦谷蛋白(约占干面筋的40%),不溶于水、乙醚和无机盐溶液,能溶于稀碱和稀酸溶液,湿的麦谷蛋白凝结力甚强,但无粘力。由于它们不溶于水,吸水力强,吸水后发生膨胀,分子互相连接形成网络状整体,因此测定面筋含量一般采用面团揉洗法获得面筋,然后测定其含量和品质。 面筋是衡量小麦品质的一个重要指标,小麦品质的好坏主要取决于面筋的含量和质量,它既反映小麦的营养品质性状,又反映其加工品质性状。面筋含量多,且其延伸性和弹性都好的小麦面粉能做出疏松多孔的面包和馒头。不同小麦品种面筋含量和品质不同,同一品种栽培在不同生态地区,面筋含量和品质也不同。我国北方麦区小麦品种的湿面筋含量平均为30%,变幅为17~50%,绝大部分小麦品种的湿面筋含量在24~40%之间。加工不同食品对面粉的蛋白质、面筋的含量和质量都有特别的要求,不同专用粉标准中对面筋含量的规定见表4-1。 表4-1 不同专用粉标准中面筋含量 沉淀值或沉降指数,是指沉淀试验中一定量的面粉在弱有机酸溶液中的沉降体积(ml),原理是在一定的条件下,用乳酸处理小麦面粉的悬浮液时,面粉中面筋蛋白颗粒发生膨胀,使悬浮面粉的沉降速度受到影响。面粉的面筋含量较高,面筋质量较好,都会导致沉淀较慢,从而在特定时间内的沉降体积较大,沉淀值较高。沉淀值与小麦的食用加工品质,尤其与面筋含量及烘焙品质呈显著正相关,从而在评价小麦品种品质的
第35卷 第1期2011年1月 南京林业大学学报(自然科学版) Journa l o fN anji n g Forestry Un i v ersity (Natural Sc ience Ed ition) V o.l 35,N o .1Jan .,2011 htt p ://www.n l dxb .com [do :i 10.3969/.j issn .1000-2006.2011.01.024] 收稿日期:2009-12-31 修回日期:2010-10-26 基金项目:国家自然科学基金项目(31000287);江苏省高校自然科学基础研究项目(10KJ B220002) 作者简介:甄艳(1976)),副教授,博士。*施季森(通信作者),教授。E-m ai:l js h @i n jfu .edu .cn 。 引文格式:甄艳,施季森.质谱技术在蛋白质组学研究中的应用[J].南京林业大学学报:自然科学版,2011,35(1):103-108. 质谱技术在蛋白质组学研究中的应用 甄 艳,施季森 * (南京林业大学,林木遗传与生物技术省部共建教育部重点实验室,江苏 南京 210037) 摘要:随着蛋白质组学研究的迅速发展,质谱技术已成为应用于蛋白质组学研究中的强有力工具和核心技术。质谱技术的先进性在于为蛋白质组学研究提供的通量和分子信息。笔者重点概述了基于质谱路线的蛋白质组学研究,介绍了基于质谱的定量蛋白质组学﹑翻译后修饰蛋白质组学、定向蛋白质组学、功能蛋白质组学以及基于串联质谱技术的蛋白质组学数据解析的研究 进展。 关键词:质谱;蛋白质组学;定量蛋白质组学;翻译后修饰;定向蛋白质组学;功能蛋白质组学中图分类号:Q81 文献标志码:A 文章编号:1000-2006(2011)01-0103-06 Application of m ass spectro m etry i n proteo m ics studies Z HEN Yan ,SH I Jisen * (K ey Labo ra t o ry o f F orest G eneti cs and B i o techno l ogy M i n istry o f Educati on , N an ji ng Forestry U n i versity ,N an ji ng 210037,Chi na) Abstrac t :W ith the rap i d develop m ent o f pro teo m i cs ,m ass spec trom etry i s m aturi ng to be a po w erfu l too l and core tech -nology fo r proteo m ics st udies dur i ng the recen t years .The super i or ity o fm ass spectrom etry lies i n providi ng the through -pu t and the m olecu lar infor m ati on ,w hich no other techno logy can be m a tched i n proteom ics .In th i s rev ie w,w e m ade a g lance on the outli ne o fm ass spectrome try -based proteo m ics .A nd then w e addressed on t he advances o f data ana l y si s o f m ass spec trom etry -based proteom ics ,quantitati ve m ass spectro m etry -based pro teom i cs ,post -translati onal m odificati ons based m ass spectrom etry ,targeted proteo m ics and functiona l proteo m ics based -mass spectrome try .K ey word s :m ass spectrome try;proteo m ics ; quantitative pro teom i cs ; post -trans l ation m odifica ti on ; targ eted pro - teo m i cs ;f uncti ona l proteom ics 蛋白质组学(Pr o teo m ics)是从整体水平上研究细胞内蛋白质的组成、活动规律及蛋白质与蛋白质的相互作用,是功能基因组学时代一门新的学科。 目前蛋白质组学的研究主要有两条路线:一是基于双向电泳的蛋白质组学;二是基于质谱的蛋白质组学,其中基于双向电泳的蛋白质组学研究路线最终也离不开质谱技术的应用。自20世纪80年代末,两种质谱软电离方式即电喷雾电离(electro spray ion izati o n,ESI )和基质辅助激光解析离子化(m a -tri x assisted laser desorpti o n i o nization ,MALD I)的发明和发展解决了极性大、热不稳定蛋白质和多肽分 析的离子化和分子质量大的测定问题[1] ,蛋白质组学研究中常用的质谱分析仪包括离子阱(ion trap ,I T),飞行时间(ti m e of fli g h,t TOF),串联飞行时间(TOF -TOF),四级杆/飞行时间(quadr upo le /TOF hybrids),离子阱/轨道阱(I T /orbitrap hybri d )和离子阱/傅里叶变换串联质谱分析仪(I T /Four i e r transfor m ioncyclotron resonance m ass spectro m eters hybr i d s ,I T /FT M S),这些质谱仪具有不同的灵敏度、分辨率、质量精确度和产生不同质量的M S /M S 谱[2] 。质谱作为蛋白质组学研究的一项强有力的工具日趋成熟,并作为样品制备及数据分析的信息学工具被广泛地应用。因此,有学者指出质谱技术 已在蛋白质组学研究中处于核心地位[3] 。目前在通量及所包含的分子信息内容上,基于质谱的蛋白质组学技术在细胞生物学研究中可以鉴定和量化
第35卷 第1期2011年1月 南京林业大学学报(自然科学版) J o u r n a l o f N a n j i n g F o r e s t r y U n i v e r s i t y (N a t u r a l S c i e n c e E d i t i o n ) V o l .35,N o .1 J a n .,2011 h t t p ://w w w .n l d x b .c o m [d o i :10.3969/j .i s s n .1000-2006.2011.01.024] 收稿日期:2009-12-31 修回日期:2010-10-26 基金项目:国家自然科学基金项目(31000287);江苏省高校自然科学基础研究项目(10K J B 220002) 作者简介:甄艳(1976—),副教授,博士。*施季森(通信作者),教授。E -m a i l :j s h i @n j f u .e d u .c n 。 引文格式:甄艳,施季森.质谱技术在蛋白质组学研究中的应用[J ].南京林业大学学报:自然科学版,2011,35(1):103-108. 质谱技术在蛋白质组学研究中的应用 甄 艳,施季森 * (南京林业大学,林木遗传与生物技术省部共建教育部重点实验室,江苏 南京 210037) 摘要:随着蛋白质组学研究的迅速发展,质谱技术已成为应用于蛋白质组学研究中的强有力工具和核心技术。质谱技术的先进性在于为蛋白质组学研究提供的通量和分子信息。笔者重点概述了基于质谱路线的蛋白质组学研究,介绍了基于质谱的定量蛋白质组学﹑翻译后修饰蛋白质组学、定向蛋白质组学、功能蛋白质组学以及基于串联质谱技术的蛋白质组学数据解析的研究 进展。 关键词:质谱;蛋白质组学;定量蛋白质组学;翻译后修饰;定向蛋白质组学;功能蛋白质组学中图分类号:Q 81 文献标志码:A 文章编号:1000-2006(2011)01-0103-06 A p p l i c a t i o n o f m a s s s p e c t r o m e t r y i n p r o t e o m i c s s t u d i e s Z H E NY a n ,S H I J i s e n * (K e y L a b o r a t o r y o f F o r e s t G e n e t i c s a n d B i o t e c h n o l o g y M i n i s t r y o f E d u c a t i o n , N a n j i n g F o r e s t r y U n i v e r s i t y ,N a n j i n g 210037,C h i n a ) A b s t r a c t :W i t ht h e r a p i d d e v e l o p m e n t o f p r o t e o m i c s ,m a s s s p e c t r o m e t r y i s m a t u r i n g t o b e a p o w e r f u l t o o l a n dc o r e t e c h -n o l o g y f o r p r o t e o m i c s s t u d i e s d u r i n g t h e r e c e n t y e a r s .T h e s u p e r i o r i t y o f m a s s s p e c t r o m e t r y l i e s i n p r o v i d i n g t h e t h r o u g h -p u t a n d t h e m o l e c u l a r i n f o r m a t i o n ,w h i c hn o o t h e r t e c h n o l o g y c a n b e m a t c h e di np r o t e o m i c s .I nt h i s r e v i e w ,w e m a d e a g l a n c e o n t h e o u t l i n e o f m a s s s p e c t r o m e t r y -b a s e d p r o t e o m i c s .A n dt h e nw e a d d r e s s e d o n t h e a d v a n c e s o f d a t a a n a l y s i s o f m a s s s p e c t r o m e t r y -b a s e dp r o t e o m i c s ,q u a n t i t a t i v em a s ss p e c t r o m e t r y -b a s e dp r o t e o m i c s ,p o s t -t r a n s l a t i o n a l m o d i f i c a t i o n s b a s e d m a s s s p e c t r o m e t r y ,t a r g e t e d p r o t e o m i c s a n df u n c t i o n a l p r o t e o m i c s b a s e d -m a s s s p e c t r o m e t r y . K e yw o r d s :m a s ss p e c t r o m e t r y ;p r o t e o m i c s ;q u a n t i t a t i v ep r o t e o m i c s ;p o s t -t r a n s l a t i o n m o d i f i c a t i o n ;t a r g e t e d p r o -t e o m i c s ;f u n c t i o n a l p r o t e o m i c s 蛋白质组学(P r o t e o m i c s )是从整体水平上研究细胞内蛋白质的组成、活动规律及蛋白质与蛋白质的相互作用,是功能基因组学时代一门新的学科。目前蛋白质组学的研究主要有两条路线:一是基于双向电泳的蛋白质组学;二是基于质谱的蛋白质组学,其中基于双向电泳的蛋白质组学研究路线最终也离不开质谱技术的应用。自20世纪80年代末,两种质谱软电离方式即电喷雾电离(e l e c t r o s p r a y i o n i z a t i o n ,E S I )和基质辅助激光解析离子化(m a -t r i x a s s i s t e d l a s e r d e s o r p t i o n i o n i z a t i o n ,M A L D I )的发明和发展解决了极性大、热不稳定蛋白质和多肽分 析的离子化和分子质量大的测定问题[1] ,蛋白质组学研究中常用的质谱分析仪包括离子阱(i o n t r a p ,I T ),飞行时间(t i m e o f f l i g h t ,T O F ),串联飞行时间(T O F -T O F ),四级杆/飞行时间(q u a d r u p o l e /T O F h y b r i d s ),离子阱/轨道阱(I T /o r b i t r a ph y b r i d ) 和离子阱/傅里叶变换串联质谱分析仪(I T /F o u r i e r t r a n s f o r m i o n c y c l o t r o nr e s o n a n c em a s s s p e c t r o m e t e r s h y b r i d s ,I T /F T M S ),这些质谱仪具有不同的灵敏度、分辨率、质量精确度和产生不同质量的M S /M S 谱[2] 。质谱作为蛋白质组学研究的一项强有力的工具日趋成熟,并作为样品制备及数据分析的信息学工具被广泛地应用。因此,有学者指出质谱技术 已在蛋白质组学研究中处于核心地位[3] 。目前在通量及所包含的分子信息内容上,基于质谱的蛋白质组学技术在细胞生物学研究中可以鉴定和量化