
2012年上海市长宁区高三化学一模试卷和答案
满分l50分,考试时间120分钟。
相对原子质量:
H-1 C-12 N-14 O-16 P-31 S-32 Cl-35.5 Na-23 Mg-24 Al-27 K-39 Fe-56
第I卷(共66分)
一、选择题(本题共10分,每小题2分,只有一个正确选项,答案涂写在答题卷上)
1. 化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①研发易降解的生物农药;②推广使用节能环保材料。③田间焚烧秸秆;④应用高效洁净的能源转换技术;
⑤加快化石燃料的开采与使用;
A. ①②④
B.②③⑤
C. ①③⑤
D.②④⑤
2.下列有关化学用语表示正确的是A.水分子的球
棍模型:B.S2-的结构示意图:C.质子数为53,
中子数为78的碘原子:131
53I D.N2的电子式:
3. 下列“化学与生活”的说法错误的是
A.硫酸钡可用作白色颜料
B.石膏可用来调节水泥的凝固时间
C.明矾可用于水的消毒、杀菌
D.醋可用于除去暖水瓶中的水垢
4. 下列叙述正确的是
A. 金属晶体的硬度高于离子晶体
B. K、Zn分别与稀硫酸反应所得溶液均呈中性
C. Fe分别与氯气和稀盐酸反应所得氯化物相同
D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强
5.下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
二、选择题(本题共36分,每小题3分,只有一个正确选项,答案涂写在答题卡上)
6. 某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是
A.它是副族元素
B.它是第六周期元素
C.它的原子核内有63个质子
D.它的一种同位素的核内有89个中子
7. 下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生成的是
A. NaHCO3和Al(OH)3
B. BaCl2和NaCl
C. KClO3和K2SO4
D. Na2SO3和BaCO3
8. 下列各组有机物只用一种试剂无法鉴别的是
A.甲苯、乙醇、溴苯B.苯、甲苯、环己烷
C.甲酸、乙醛、乙酸D.苯、苯酚、己烯
9. 下列实验设计和结论相符的是
A. 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
B. 将SO2通入溴水,溴水褪色后加热恢复原色,说明SO2漂白生成的物质不稳定。
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D. 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH 4
10. 硫代硫酸钠溶液与盐酸反应,可用于探究浓度对于反应速率的影响。常温常压下,若该反应产生固体单质16 g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
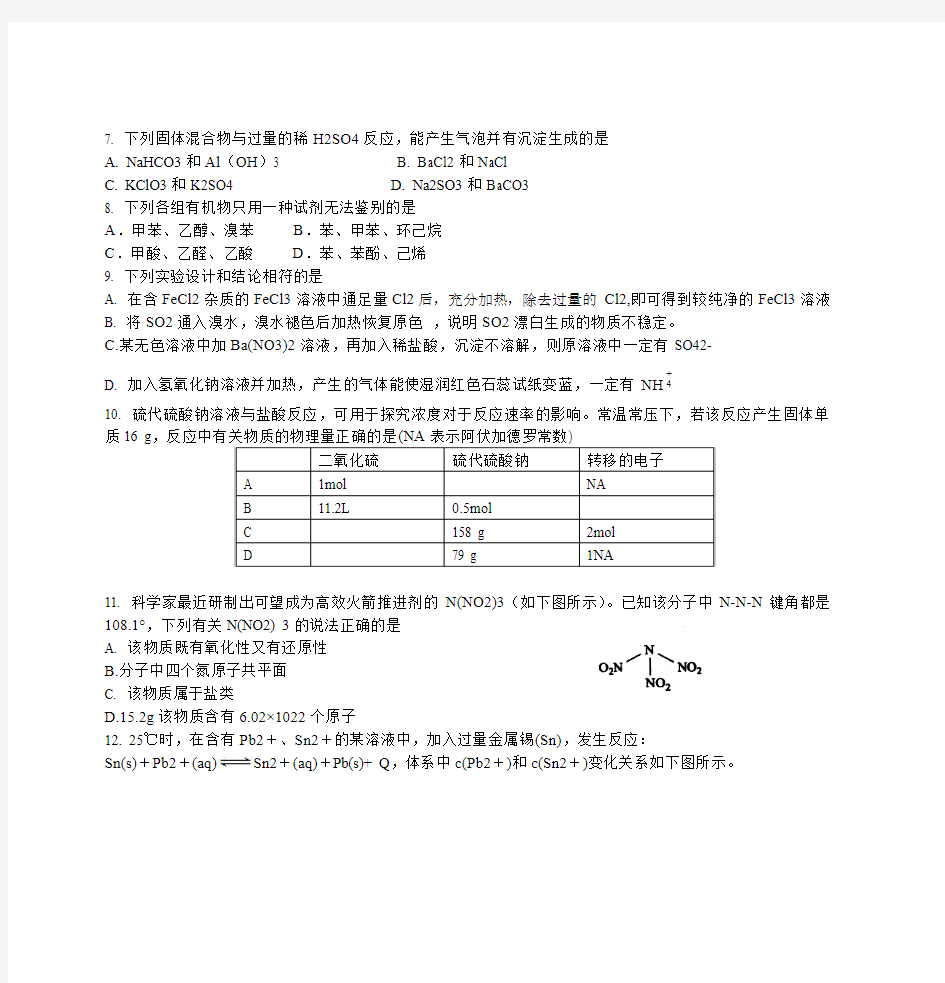
11. 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2) 3的说法正确的是
A. 该物质既有氧化性又有还原性
B.分子中四个氮原子共平面
C. 该物质属于盐类
D.15.2g该物质含有6.02×1022个原子
12. 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s)+ Q,体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
下列判断正确的是
A .往平衡体系中加入金属铅后,c(Pb2+)增大
B .往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)不变
C .升高温度,平衡体系中c(Pb2+)增大,说明该反应Q?0
D .c(Pb2+)一线表示正反应快慢, c(Sn2+)一线表示逆反应的快慢
13.根据右表提供的数据,判断在等浓度的NaClO 、NaHCO3混合溶液中,各种离子浓度关系正确的是 A.c(HCO3-)> c(ClO -)> c(OH -) B.c(ClO -)> c(HCO3-)> c(H+)
C.c(ClO -)+ c(HClO)= c(HCO3-)+ c(H2CO3)
D.c(Na+)+ c(H+)= c(HCO3-)+ c(ClO -)+c(OH -)
14. 中药狼把草的成分之一M 具有消炎杀菌作用,M 的结构如图所示:
下列叙述正确的是 O
H O
H O
O
A. 该化合物属于苯的同系物
B.1 mol M 最多能与2mol
2Br 发生反应
C.M 与足量的NaOH 溶液发生反应时,所得有机产物的化学式为9454C H O Na
D.1mol M 与足量3NaHCO 反应能生成2 mol 2CO
15.常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 与铝反应产生大量氢气的溶液:Na +、K +、CO32-、NO3-
B.甲基橙呈黄色的溶液: I- 、 Ba2+、AlO2-、Cl -
C. c(H +)=1.0×10-13mol/L 溶液中 C6H5O -、K +、SO42-、Br -
D. 1.0 mol·L -1的KNO3溶液:H +、Fe2+、Cl -、SO42- 16. SF6是一种优良的绝缘气体,分子结构中只存在S-F 键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F 键需吸收的能量分别为160kJ 、330kJ 。则S(s)+3F2(g) →SF6(g)+ Q 的反应热Q 为
A. 1780kJ
B. 1220 kJ
C.450 kJ
D. -430 kJ
17. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆
周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是
A.液滴下氧气含量少,发生析氢腐蚀
B.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
C.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e→4OH-
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e→Cu2+
三、选择题(本题共20分,每小题4分,每小题有一个或两个正确选项,只有一个正确选项的,多选不给分,有两个正确选项的,选对一个给2分,选错一个该小题不给分)
第Ⅱ卷(共84分)
18.含有1 mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2后,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=1.5,2Fe2++4Br-+3Cl2→2Br2+2Fe3++6Cl-
B.x=1.2,Fe2++2Br-+2Cl2→Br2+Fe3++4Cl-
C.x=0.6,2Br-+ Cl2→Br2+2Cl-
D.x=0.4,2Fe2++Cl2→2Fe3++2Cl-
19.
20短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第V A族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
A、原子半径:丙>丁>乙
B、单质的还原性:丁>丙>甲
C、甲、乙、丙的氧化物均为共价化合物
D、乙、丙、丁的最高价氧化物对应的水化物能相互反应
21.室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是
A. a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)= c(NH4+)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
22.将NaOH溶液加入到13.2g含有(NH4)2SO4与(NH4)2CO3的固体混合物中,充分反应后,可收集到密度为17 g/22.4 L的气体体积不可能是
A.4.68L B.4.3 L
C.6.16L D.5.2L
四、(本题共24分)
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请
回答下列问题:
23.T的离子结构示意图为_______.
24.元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
25. W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为____ _.
26.原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________ .
27.R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________
I、磷、硫元素的单质和化合物应用广泛。
28.磷元素的原子核外电子排布式是____________。
29.磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为: 2Ca3(PO4)2+6SiO2→6CaSiO3+P4O10 10C +P4O10→P4+10CO 每生成1 mol P4时,就有________mol 电子发生转移。
II 、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。 30.铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O 和NH4Cl 固体混合物的方法来制备。其中NH4Cl 的作用是______________。
31.在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++ H2O2+ H2O → Ce(OH)4↓+ _______ 在溶液中,反应A+2B
C 分别在三种不同实验条件下进行,它们的起始浓度均为()0.100/c A mol L =、
()0.200/c B mol L =及()0/c C mol L =。
反应物A 的浓度随时间的变化如下图所示。
请回答下列问题:
32.与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:②_______________; . ③_______________; .
33.实验②平衡时B 的转化率为_________;实验③平衡时C 的浓度为____________; 34.该反应是________热反应,判断其理由是____________________________; 35.该反应进行到4.0min 时的平均反应速度率: 实验②:
B v =__________________________________;
五、(本题共24分)
工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
36.原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。(填序号)(①饱和Na2CO3溶液②饱和K2CO3溶液③75%乙醇④四氯化碳)
37.题26图是离子交换膜(允许钠离子通过,不允许氢氧根与氯离子通过)法电解饱和食盐水示意图,电解槽阳极产生的气体是;NaOH溶液的出口为(填字母);精制饱和食盐水的进口为(填
字母);干燥塔中应使用的液体是。
多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
38.SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为。
39.SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s)4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为kg。
40.实验室制备H2和Cl2通常采用下列反应:
??MnCl2+Cl2↑+2H2O
Zn+H2SO4→ZnSO4+H2↑;MnO2+4HCl(浓)?→
据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
41. 采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气
3
m(标准状况)。(忽略可能存在的其他反应)
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
42.“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
43.滤渣I的主要成分是。
Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaClO3 →Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S )随温度(T )变化曲线如下图所示:
44.将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
45.按题44中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl 析出,原因是: 。除去产品中该杂质的方法是: 。 六、(本题共20分)
46.的分子式为_________; 47.
48.乙炔3分子聚合的产物为苯。写出丙炔三分子聚合形成的芳香烃分子的键线式______
49.由 以及必要的无机试剂可合成CH 2CH 2CH CH 2
3
,写出第一步合成反应的化学方程式
__________________________________________。
50.的一种同分异构体A ,它的一氯代物有三种。与Br2按1:1加成产物只有一种(不考虑顺反、立体异构),则A 的结构简式为 。
O
H CHO
H 5C 2O
乙基香草醛( )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
51.乙基香草醛分子中的含氧官能团有乙氧基、 、 。核磁共振谱表明该分子中有 种不同类型的氢原子。
乙基香草醛的同分异构体A 是一种有机酸,A 可发生以下变化:
提示:a. RCH2OH RCHO
b. 与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基。 52. A 生成C 的反应类型是 。
53.写出在加热条件下C 与NaOH 水溶液发生反应的化学方程式 。
54.乙基香草醛的另一种同分异构体D (
)是一种医药中间体。
请设计合理方案用茴香醛( )合成D 。用反应流程图表示如下,请将后面一步的反应条件
写在箭号下方,试剂或原料写在箭号上方,中间产物填在下图中的方框内。并写出茴香醛与银氨溶液反应的化学方程式。
七、计算(本题共16分) 将 a mol 的22O Na 和
3NaHCO mol b 固体混合后,在密闭容器中加热到250℃,让其充分反应,假设
3NaHCO 分解产生的2CO 与22O Na 反应完后,O H 2再与22O Na 反应.
CrO3/H2S COOH A (C9H10O3) C (C9H9O2Br ) B (C9H8O3) CrO3/H2SO 4 KMnO4/H3O+
能发生银镜反应 CH 3O COOCH 3CH 3O CHO CH 3O
3O COOCH 3
55.当剩余固体只有
32CO Na ,排出气体中2O 的物质的量为 (用含a 或b 的代数式表示)
56. 当1
b a 时,剩余固体是________,排出气体是________。
57. 当剩余固体为32CO Na ,NaOH ,排出气体为2O ,O H 2时,b a
的值为________. 58.当排出的2O 和O H 2为等物质的量时,则b a
的值为________.
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL 某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L -1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:
59.写出反应过程中的离子反应方程式:
DE 段 , EF 段__________________________________。
60.合金中,铝的质量为 g ,铁的质量为 g 。 61.硝酸溶液的物质的量浓度为 mol·L -1 62. C 的值为 mL 。
2011学年第一学期高三化学参考答案
第I 卷 (共66分)
第Ⅱ卷(共84分)
四、(本题共24分)
23.(1分)
24.(1分)弱
于
25.(2分)S + 2H2SO4(浓) →△
3SO2↑+ 2H2O
26.(2分)2H2O2 ??→?2MnO
2H2O + O2↑(或其他合理答案:)
27(2分)NaNO2
28.(2分)1s22s22p63s23p3; 29.(2分)20;
30.(2分)分解出HCl 气体,抑制CeCl3的水解(或其他合理答案); 31.(2分) 2Ce3++H2O2+6H2O→ 2Ce(OH)4↓+6H +
32.(2分)②加催化剂;达到平衡的时间缩短,平衡时A 的浓度未变③温度升高;达到平衡的时间缩短,平衡时A 的浓度减小(②③各1分,原因错了得0分) 33.(2分)40%(或0.4);0.06mol/L ; 34(2分)吸热;升高温度平衡向正反应方向移动,故该反应是吸热反应
35(2分)0.014mol(L·min)-1; 五、(本题共24分)
36.(2分)③①② ;③
37.(4分)氯气;a ;d ;浓硫酸
38.(2分)①SiCl4+2H2+O2→高温
SiO2+4HCl 39. (2分)0.35 40.(2分)e ;d 41.(2分)134.4,
42(2分)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
43.(2分)Fe(OH)3 Al(OH)3 44.(2分)在某一时NaCl 最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大,NaCl 的溶解度与其他物质的溶解度有一定的差别。
45. (4分)降温前溶液中NaCl 已达饱和,降低过程中NaCl 溶解度会降低 ,会少量析出。重结晶。
六(本题共20分)
46.(1)单烯烃(2分) 47. C10H16(2分)
48.、(各1分),共2分)
49.
+Br 2
Br
Br
(2分)
50. (写出1种即可,2分)
51.醛基 (1分) 酚羟基(或羟基) (1分) 7 (1分)
52.取代反应(1分)
53.
2分)
54. (共4分)
(1分+1分,共2分)
+2Ag(NH3)2OH →△
(2分)
七、计算(本题共16分)
CH CH 2Br COOH CH 2OH COONa CH 3O
CHO
CH3OH 浓硫酸 △ CH 3O COOH
55. (2分) a
mol (写
a mol 或
4
b mol 不给分)
56.(2分)
32CO Na 、NaOH 、22O Na ;排出气体为2O
57. (2分)121<
58. (2分)2/3
59. (2分) NH4++OH -→NH3·H2O Al(OH)3+ OHˉ→AlO2ˉ+2H2O
60. (2分) 0.216 1.344 61. (2分) 1.48 62. (2分) 7
西城区高三统一测试 英语2019.4 本试卷共9页,共120分。考试时长100分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将本试卷和答题卡一并交回。 第一部分:知识运用(共两节,45分) 第一节语法填空(共10小题;每小题1.5分,共15分) 阅读下列短文,根据短文内容填空。在未给提示词的空白处仅填写1个适当的单词,在给出提示词的空白处用括号内所给词的正确形式填空。 A I often help my mom cook and baked chicken is my favorite thing to make. One day, when mom was sick, I tried to make the chicken all by myself. I washed the chicken and put it in a pan in the oven 1 (bake). When the bell rang to tell me the chicken was done, I opened the oven door. Guess what? The chicken was not cooked! I started to laugh. I forgot to turn 2 the oven! Did you know what I did next? I 3 (order) pizza. Mom was happy I “cooked” by myself and we could eat the pizza together. B Chocolate was first used as a drink over 3,500 years ago in Central America. It was very popular with the Mayans and the Aztecs. In fact, cocoa beans were very important to people there. That was 4 they were used as money. In the beginning, cocoa 5 (plant) in Ecuador, which was, for a long time, the world’s number-one producer of cocoa beans. It is still one of the top 6 (producer) of the beans, but nowadays more than 70 per cent of cocoa beans come from West Africa. C Wallace’s giant bee is the world’s 7 (large) bee, with a body the size of a human thumb and wings that can spread to about 2.5 inches. That may sound 8 (frighten), but the bee isn’t likely to hurt anyone. It uses its large jaws (嘴) to collect a sticky goo, called resin, from trees. The bee 9 (make) its home in termite mounds (白蚁丘) found on trees, using the resin to protect its nest from the termites. Until recently, the bee had been seen by scientists only 10 (two), once in 1868 and again in 1981. 第二节完形填空(共20小题;每小题1.5分,共30分) 阅读下面短文,掌握其大意,从每题所给的A、B、C、D四个选项中,选出最佳选项,并在答题卡上将该项涂黑。 We first met Tom and Gee in the early days of our marriage. Someone had been 11 our garbage cans to the garage each garbage day, and Jim and I had wondered 12 . Then one day we 13 him: an elderly man who lived across the street. I baked cookies and left them on a chair outside the garage 14 a thank-you note. When we got home from work that day, a typed letter had replaced the 15 . The letter was
北京市东城区2018-2019学年度第二学期高三综合练习(一)2019.4 理科综合(化学部分) 可能用到的相对原子质量:H 1 C 12 O 16 6. 下列物质的应用中,利用了该物质氧化性的是 A. 氨——作制冷剂 B. 漂粉精——作游泳池消毒剂 C. 甘油——作护肤保湿剂 D. 明矾——我国古时用于除铜锈 7. 右图是制备和收集气体的实验装置,该装置可用于 A.浓硫酸与铜反应制取SO 2 B.浓氨水与生石灰反应制取NH3 C.浓盐酸与二氧化锰反应制取Cl2 D.过氧化钠与水反应制取O2 8.对下列过程的化学用语表述正确的是 A.用硫酸铜溶液除去乙炔中的硫化氢气体:H2S + Cu2+=== CuS↓ + 2H+ B.向氯化铝溶液中滴入过量氨水:Al3+ + 4OH- === AlO2- + 2H2O C.用电子式表示Na和Cl形成NaCl的过程: D.钢铁发生电化学腐蚀的正极反应:Fe-3e- === Fe3+ 9. 为纪念门捷列夫发表第一张元素周期表(部分如下)150周年,联合国宣布2019年为“国 际化学元素周期表年”。关于下表的说法正确的是 A. 表中数字代表元素的原子序数 B. 表中元素的排列依据是元素的原子结构 C. 推测表中“?=70”指代的元素的最高化合价为+4 D. 每一纵行(列)都对应现在常用的元素周期表中的一族
10.凯夫拉是一种高强度、耐腐蚀的芳纶纤维,军事上称为“装甲卫士”,但长期浸渍在强酸或强碱中强度有所下降。下表中是凯夫拉的两种结构: 以下说法不正确... 的是 A .PMTA 和PPTA 互为同分异构体 B .“芳纶1313”、“芳纶1414”中的数字表示苯环上取代基的位置 C .凯夫拉在强酸或强碱中强度下降,可能与“”的水解有关 D .以 和 为原料制备PPTA 的反应为缩聚反应 11. 高炉炼铁过程中发生反应: Fe 2O 3(s)+CO(g) Fe(s)+CO 2(g), 该反应在不同温度下的平衡常数见右表。 下列说法正确的是 A .增加高炉的高度可以有效降低炼铁尾气中CO 的含量 B .由表中数据可判断该反应:反应物的总能量>生成物的总能量 C .为了使该反应的K 增大,可以在其他条件不变时,增大c (CO) D .1000℃下Fe 2O 3与CO 反应,t min 达到平衡时c (CO) =2×10-3 mol/L ,则用CO 表 示该反应的平均速率为 mol/(L ·min) 12. 空气中的硫酸盐会加剧雾霾的形成,我国科学家用下列实验研究其成因:反应室底部盛 有不同吸收液,将SO 2和NO 2按一定比例混合,以N 2或空气为载气通入反应室,相同 时间后,检测吸收液中SO 42-的含量,数据如下: 下列说法不正确... 的是 A. 控制SO 2和氮氧化物的排放是治理雾霾的有效措施 B. 反应室①中可能发生反应:SO 2 + 2NO 2 + 2H 2O === H 2SO 4 + 2HNO 2 C. 本研究表明:硫酸盐的形成主要与空气中O 2有关 D. 农业生产中大量使用铵态氮肥可能会加重雾霾的形成
B . NH 泄露时向空中喷洒水雾 江苏省南通市 2017 届高三高考全真模拟化学试卷(二) 可能用到的相对原子质量:H-1 C-12 O-16 Na -23 S-32 CL -35.5 一、单项选择题(本题包括 10 小题,每小题 2 分,共计 20 分。每小题只有一个选项符合题意) 1.《中华人民共和国安全生产法》指出安全生产工作应当以人为本,坚持安全发展、预防为主、综合治理 的方针。下列做法不正确的是( ) A .面粉生产车间应严禁烟火 3 C .含 Cl 的尾气用碱溶液处理后再排放 2 D .金属钠失火时应立即用大量冷水扑灭 2.下列有关钠元素及其化合物的表示正确的是( ) A .钠原子的结构示意图: B .过氧化钠的电子式: C .小苏打在水中的电离方程式: NaHCO =Na++HC O - 3 3 D .硫化钠的水溶液呈減性的原因:S 2- +2H O H S+2OH - 2 2 3.下列有关物质的性质与用途具有对应关系的是( ) A .氨气具有还原性,可用作制冷剂 B .氢氟酸具有弱酸性,可用于蚀刻玻璃 C .浓硫酸具有脱水性,可用于干燥 C O 2 D .二氧化氯具有强氧化性,可用来漂白织物 4.短周期主族元素 X 、Y 、Z 、W 的原子序数依次递增,四种原子最外层电子数之和为 18,X 与 Z 同主族, Y 原子的最外层电子数等于周期数,W 的单质在常温下为气体。下列说法正确的是( ) A .原子半径的大小顺序: r (Z )>r (Y )>r (X ) B .简单氢化物的稳定性:W>Z C .元素 X 的单质只存在两种同素异形体 D .X 、Y 、W 最高价氧化物对应的水化物两两之间能发生反应 5.下列指定反应的离子方程式正确的是( ) A .向 H O 中通入 NO : 3NO +H O=H + +NO - +2NO 2 2 2 2 3 B .向 Na SiO 溶液中通入少量 S O : Na SiO +SO +H O=H SiO ↓ +2Na + +SO 2 3 2 2 3 2 2 2 3 3 2- C .用饱和纯減溶液洗涤试管中残留的苯酚:CO 3 2- +2 2 + CO ↑ + H O 2 2 D .等体积等物质的量浓度的 NH 4 Fe (SO 4 )2 和 Ba (OH )2 混合:
高三化学模拟试卷 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分。考试时间120分钟。 可能用到的原子量: H :1 C :12 O :16 Na :23 Mg :24 Zn :65 S :32 K :39 Mn :55 Fe :56 一.选择题(本题包括5小题,每小题4分,共20分。每小题只有一个....选项符合题意。) ( )1.近年来,我国许多城市禁止汽车使用含铅汽油,其主要原因是 A 、提高汽油燃烧效率 B 、降低汽油成本 C 、避免铅污染大气 D 、铅资源短缺 ( )2.生物体中细胞膜内的葡萄糖.细胞膜外的富氧液体及细胞膜之间可构成微型的生物原电池,下列有关判断正确的是 ①正极的电极反应可能是:O 2+4e -+2H 2O =4OH — ②负极的电极反应可能是:O 2+4e -+2H 2O =4OH — ③负极的反应主要是C 6H 12O 6(葡萄糖)生成CO 2或HCO 3— ④正极的反应主要是C 6H 12O 6(葡萄糖)生成CO 2或HCO 3 — A .①② B .①③ C .②③ D .②④ ( )3.室温下,在pH=12的某溶液中,由水电离的c(OH —)为 ①1.0×10—7mol ? L —1 ②1.0×10—6mol ? L —1 ③1.0×10—2mol ? L —1 ④1.0×10—12mol ? L —1 A .① B .①③ C .④ D .③④ ( )4.向100mL 的FeBr 2溶液中通入标准状况下的Cl 23.36L 时,Cl 2全部被还原,测得此时溶 液中c(Br —)=c(Cl —),则原FeBr 2溶液的物质的量浓度是 A .0.75mol ? L —1 B .1.5mol ? L —1 C .2mol ? L —1 D .3mol ? L —1 ( )5.已知2H 2S+SO 2=3S+2H 2O,现将等物质的量的SO 2和H 2S 常温下在定容的密闭容器中反应,待充分反应后恢复至常温。容器内的压强是原压强的 A .1/2 B .1/4 C .<1/4 D .>1/4 二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个..... 选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。) ( )6.具有解热镇痛及抗生素作用的药物“芬必得”,其主要成分的结构式如图,它属于 A.芳香族化合物 B.苯甲酸的同系物 C.易溶于水的有机物 D.易升华的物质 ( )7.由CO 2、H 2和CO 组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO 2、H 2和CO 的体积比为 A .29:8:13 B .22:1:14 C .13:8:29 D .26:16:57 ( )8.下列离子方程式中正确的是 A、偏铝酸钾溶液和过量盐酸:AlO 2-+4H +=Al 3++2H 2O B 、醋酸铵溶液和盐酸反应:CH 3COONH 4+H +=CH 3COOH +NH 4+ C 、碳酸氢钙溶液中加入少量氢氧化钙溶液:Ca 2++OH -+HCO 3-=CaCO 3↓+H 2O D 、氢氧化亚铁在空气中氧化:4Fe 2++O 2+2H 2O=4Fe 3++4OH - CH 3CHCH 23CHCH 3
秘密★启用前试卷类型:B 广州市2020 届高三年级阶段训练题 英语 本试卷共10 页,满分120 分。考试用时120 分钟。 注意事项: 1.答卷前,考生务必将自己的姓名和考生号、试室号、座位号填写在答题卡上,并用 2B 铅笔在答题卡的相应位置填涂考生号及试卷类型(B)。因听力另考,试卷从第二部分的“阅读理解”开始,试题序号从“21”开始。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案信息点涂黑。如需 改动,用橡皮擦干净后,再选涂其他答案。写在本试卷上无效。 3.回答非选择题时,必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和涂改液。写在本试卷上无效。 4.考试结束后,将本试卷和答题卡一并交回。 第二部分阅读理解( 共两节,满分40 分) 第一节( 共15 小题;每小题 2 分,满分30 分) 阅读下列短文,从每题所给的A、B、C 和D 四个选项中,选出最佳选项,并在答题卡 上将该项涂黑。 A Mama and I spend mornings cleaning up the dirt that blows into our house. Mama says all the dust is due to the drought. The dirt sifts into everything. It covers our clothes. We have to wash the dishes before each meal. We rarely drive the truck because Papa fears the dust from the road will ruin the motor. When my sister, Faye, and I walk to school, we wear kerchiefs over our mouths so we don’t breathe in the dirt. On days when the air is so bad that they close the school, we stay home and help Mama put wet sheets over the windows. But the dirt always finds a way in. Last Sunday, there was no dirt in the air, only bright spring sunshine and a clear blue sky. After lunch, Papa headed out to the field to check on the cattle while I played with Faye in the yard. The temperature suddenly dropped. I looked to the west and saw a huge black cloud of dust. All the birds flew away. “I must warn Papa,” I thought to myself. To avoid her panicking, I gently told Faye to go back inside where she would be safe, and then headed off to the field.
高三化学模拟试卷及答案 本试卷分第I卷(选择题)和第II卷(非选择题)两部分。共37题,共300分,共12页。考试时间150分钟。考试结束后,将本试题卷和答题卡一并交回。 注意事项: 1.答题前,考生务必将自己的姓名、准考证号码填写清楚、考试科目涂写在答题卡上。 2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案,答在试题卷上无效。 3.本卷共21小题,每小题6分,共126分。 可能用到的相对原子质量:H 1 O 16 P 31 S 32 K 39 Fe 56 I 127 Ba 137 第I卷(选择题共126分) 一、选择题(本题包括13小题,每小题6分,共78分。在每小题给出四个选项中,只有一项是符合题目要求的) 7.化学与社会、生活密切相关。下列现象或事实的解释不正确的是 8.下列离子方程式或化学方程式正确的是 A.向Na2S2O3溶液中加入稀HNO3:S2O32-+2H+=SO2↑+S↓+H2O B.向Al2(SO4)3溶液中滴加Na2CO3溶液:2Al3++3CO32-=Al2(CO3)3↓ C.“侯德榜制碱法”首先需制备碳酸氢钠:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl D.CuSO4溶液中加入过量NaHS溶液:Cu2++HS-=CuS↓+H+ 9.已知气态烃A的产量是一个国家石油化工水平的重要标志,有机物A~E能发生如图所示一系列变化,则下列说法正确的是 A.A→B的反应类型为加成反应 B.常温下有机物C是一种有刺激性气味的气体
C.分子式为C4H8O2的酯有3种 D.l mol D与足量碳酸氢钠反应生成气体的体积为22.4L 10.短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,下列有关说法不正确的是 A.原子半径:M
2018北京市朝阳区高三(一模) 英语 2018.3 (考试时间100分钟满分120分) 本试卷共10页。考生务必将答案答在答题卡上,在试卷上作答无效。 第一部分:知识运用(共两节,45分) 第一节单项填空(共15小题;每小题1分, 共15分) 从每题所给的A、B、C、D四个选项中,选出可以填入空白处的最佳选项,并在答题卡上将该项涂黑。例:It’s so nice to hear from her again. _____, we last met more than thirty years ago. A. What’s more B. That’s to say C. In other words D. Believe it or not 答案是D。 1. Peter has previous experience, ______ I think he’s the right person for the job. A. or B. but C. for D. so 2. ––What did the doctor say about your injury? ––She said I should avoid doing too much exercise ______ it feels better. A. until B. since C. if D. while 3. The meal itself was not so good—______ was boringly brown including vegetables. A. nothing B. everything C. anything D. something 4. Don’t worry. A number of efforts are being made ______ the whole system operating normally. A. being kept B. kept C. keeping D. to keep 5. Hawking believes the earth is unlikely to be the only planet _____ life has developed gradually. A. that B. why C. where D. whose 6. ––Cathy is not coming to your birthday party tonight. ––But she ______! A. promised B. promises C. will promise D. had promised 7. Don’t forget to send ______ attended the conference a follow-up email. A. however B. whatever C. whoever D. wherever 8. Your red coat looks so good. It stood out clearly ______ the snow. A. across B. against C. through D. over 9. Look! Here’s a photo ______ in my classroom at primary school. Can you recognize me in it? A. taken B. taking C. to take D. being taken 10. ––Are the repairs finished yet? ––Yes, they ______ when I came back home. A. would be completed B. would complete C. had completed D. had been completed
一模考试试题 可能用到的相对原子质量:H-1 C-12 O-16 第I 卷(选择题 共126分) 一、选择题:本大题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7、下列各项中,对所描述内容的相关分析不正确的是 8、2SO 2(g)十O 2(g)=2SO 3(g) △H =-198kJ·mol -1,在V 2O 3存在时,该反应机理为: V 2O 3+ SO 2-→+2VO 3+ SO 3(快) 4VO 2+O 2→2 V 2O 3(慢) A.反应速率主要取决于V 2O 3的质量 B.VO 2是该反应的催化剂 C.该反应逆反应的活化能大于198kJ/mol D.升高温度,该反应的△H 增大 9、UrolithinA 是一种含氧杂环化合物,在合成有机材料和药品中有重要应用、其结构如图所示。下 列关于该有机物的说法正确的是 A.分子式为C13H6O4 B.所有原子一定处于同一平面上 C.苯环上的一氯代物有3种 D.1mol 该有机物与H 2反应时,最多消耗6mol H 2 10、短周期主族元素W 、X 、Y 、Z 的原子序数依次增大,W 与X 形成的某种化合物可用作水果的催熟 剂,Y 的氧化物为碱性氧化物,X 、Y 、Z 三种元素的最外层电子数之和为11。下列说法正确的是 A.原子半径:W 11、已知:2FeSO 4·7H 2 O 高温 Fe 2 O 3 +SO 2 ↑+SO 3 ↑+14H 2 O↑,用下图所示装置检验FeSO 4 ·7H 2 O的所有分 解产物,下列说法不正确的是 A.乙、丙、丁中可依次盛装无水CuSO 4、Ba(NO 3 ) 2 溶液、品红溶液 B.实验时应先打开K,缓缓通入N 2 ,再点燃酒精喷灯 C.甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红 D.还应在丁装置后面连接盛有NaOH溶液的洗气瓶 12、工业上通过电化学原理在铝表面形成氧化膜来提高其抗腐蚀能力,工作原理如图所示。下列说法 不正确的是 A.碳棒可用铜棒代替,其作用是传递电流 B.通电一段时间后,溶液的pH减小 C.通电后电子被强制从碳棒流向铝片使铝表面形成氧化膜 D.可通过调节滑动变阻器来控制氧化膜的形成速度 13、常温下。向20.00mL0.1mol/LHA溶液中滴入0.1mol/LNaOH溶液,溶液中由水电离出的氢离子浓 度的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法不正确的是 A.常温下,K a (HA)约为10-5 B.M、P两点容液对应的pH=7 C.b=20.00 D.M点后溶液中均存在c(Na+)>c(A-) 26、(14分)AgNO 3 是中学化学常用试剂,某兴趣小组设计如下实验探究其性质。 浦东新区2014学年度第一学期期末质量测试 高三化学 (2015.1) 考生注意: 1.本试卷满分150分,考试时间120分钟。 2.本考试设试卷和答题纸两部分。试卷包括试题与答题要求;所有答案必须涂(选择题)或写(非选择题)在答题纸上,做在试卷上一律不得分。 3.答题前,考生务必在答题纸上用钢笔或圆珠笔清楚地填写姓名、准考证号,并将核对后的条形码贴在指定位置上。 4.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。 相对原子质量:H -1 N -14 O -16 Na -23 Mg -24 Al -27 S -32 Cl -35.5 K -39 Fe -56 Cu -64 Ag -108 I -127 Ba -137 一、选择题(本题共10分,每小题2分,只有一个正确选项) 1.下列物质的用途利用其物理性质的是 A .草酸用作还原剂 B .生石灰用作干燥剂 C .苯用作萃取剂 D .铁粉用作抗氧化剂 2.下列关于氨分子的化学用语错误的是 A .化学式:NH 3 B .电子式: C .结构式: N H H H D .比例模型: 3.铯(Cs)在自然界中只有一种稳定同位素133 55Cs ,核泄漏事故中会产生人工放射性同位素 134 55Cs 、137 55Cs 。下列有关说法正确的是 A .铯元素的相对原子质量约为133 B .134 55Cs 、137 55Cs 的性质相同 C .134 55Cs 的电子数为79 D .134 55Cs 、137 55Cs 互为同素异形体 4.有关氮原子核外p 亚层中的电子的说法错误的是 A .能量相同 B .电子云形状相同 C .自旋方向相同 D .电子云伸展方向相同 5.已知铍(Be )与铝的性质相似。则下列判断正确的是 A .铍遇冷水剧烈反应 B .氧化铍的化学式为Be 2O 3 C .氢氧化铍能与氢氧化钠溶液反应 D .氯化铍水溶液显中性 H N H . . . . . . H 2018年高中三年级一模 英语参考答案 一、选择题(1-60): 1.C 2.B 3.A 4.C 5.C 6.A 7.B 8.C 9.B 10.A 11.B 12.C 13.B 14.A 15.A 16.C 17.B 18.C 19.A 20.B 21.B 22.C 23.A 24.B 25.D 26.C 27.B 28.D 29.C 30.D 31.B 32.A 33.D 34.D 35.B 36.G 37.E 38.A 39.D 40.B 41.A 42.C 43.B 44.D 45.C 46.B 47.A 48.D 49.B 50.A 51.D 52.C 53.D 54.A 55.B 56.C 57.A 58.D 59.B 60.C 二、英语知识运用第二节(61-70): 61. failure 62. as 63. includes 64. fiercely 65. the 66. to practice 67. winning 68. where 69. backgrounds 70. was defeated 三、短文改错: Hi Sandra, You’ll never guess over I’m writing this email from a cave! We’re on holiday in Spain now. 71 We spent a few days in Barcelona first. It’s a great place but we had a good time though I didn’t 72. and feel well one day. Anyway, after we left Barcelona, we come to spend several days in Granada. 73. came And guess what? We couldn’t find a hotel because there were quite a lot of tourist. Then someone 74. tourists said, “Why not trying the cave dwellings (住宅) here?” We thought he was joking, but here we 75. try were really in a cave dwelling and it’s wonderfully. Tomorrow we’re going to visit a palace 76. are 77. wonderful in Granada. We’re enjoying it very much that we d on’t want to leave this amazed place. We’re 78. so 79. amazing never going to have enough time ∧explore everything! 80. to Take care! Ben (注:第71题若把over改为at或about,第78题若在that前加so或把that改为so,亦可。) 四、书面表达: Possible Version I Hi David, You’re warmly welcome to my city to experience the Spring Festival. Usually, we give our houses a thorough cleaning and decorate them with red couplets and beautifully-designed paper-cuttings before the festival. Gathering for the annual reunion dinner and watching the Spring Festival Gala on the Eve of the New Year is a meaningful moment for us Chinese. During the festival, we visit the elder and relatives to give our greetings and best wishes. When you are here, I want to invite you to make dumplings, watch beautiful fireworks and dragon dance with us. If time permits, I’ll show you around our city. I hope you’ll have a happy 高三一模化学考试总结 2018-01-11 高三一模化学考试总结【一】 通过模拟考试让我对自己近段的教学思路与方法有所反思。考试结果反应的主要问题:学生基础知识不扎实,有的学生不能灵活运用所学知识,有一些类型的题目学生没有见过,不知该从何入手,导致得分太低,主要原因:复习不到位,基础知识不扎实。 一、对学生学习引导的反思 高中的化学是一门很重要的学科,但是“化学难学”的印象可能会使不少学生望而却步。因此初三的教学首先是要正确的引导,让学生顺利跨上主动学习化学这个大的台阶,其次是要让学生建立一个良好的化学知识基础,然后根据学生的具体情况选择提高。通过分期渗透,逐步提高。通过降低台阶,减少障碍,真正能够把学生吸引过来,而不是把学生吓跑了,可是,我并没有很快领会这种意图,因而在实际教学中不注意知识的形成过程,只靠生硬的讲解,只重视告诉结论,讲解题目,这怎么能怪学生对化学产生畏难情绪呢?学生如果对化学失去兴趣,对基本概念搞不清楚、对知识掌握不牢也就不足为怪了!如果我作为引路者有意识的降低化学学习的门槛,先将学生引进门,哪怕先是让学生感觉到“化学好学”的假象,我都是成功的。 二、对教学目标的反思 首先,知识、能力、情意三类教学目标的全面落实。对基础知识的讲解要透彻,分析要细腻,否则直接导致学生的基础知识不扎实,并为以后的继续学习埋下祸根。比如,教师在讲解“如何正确书写化学方程式”时,如果对“配平”讲解的不透彻,学生在后来的学习中就经常出现化学反应方程式不能配平的现象;对学生能力的训练意识要加强,若留给学生思考的时间少,学生的思维能力没有得到有效的引导训练,导致学生分析问题和解决问题能力的没有提高;还有就是要善于创设化学情景,让学生感觉到化学离生活很近。总之我要在教学活动中从一个知识的传播者自觉转变为与学生一起发现问题、探讨问题、解决问题的组织者、引导者、合作者。 其次,对重点、难点要把握准确。教学重点、难点正确与否,决定着教学过程的意义。在化学教学活动开始之前,首先要明确教学活动的方向和结果,即所要达到的质量标准。在教学目标中一节课的教学重点、难点如果已经非常明确,但具体落实到课堂教学中,往往出现对重点的知识没有重点的讲,或是误将仅仅是“难点”的知识当成了“重点”讲。这种失衡直接导致教学效率和学生的学习效率的下降。 三、对教学方法的反思 2020年高考化学模拟试题与答案(一) (试卷满分100分,考试时间60分钟) 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。 2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。 3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。 4.考试结束后,请将本试题卷和答题卡一并上交。 相对原子质量:H 1 N 14 O 16 Na 23 S 32 一、选择题(共7小题,每小题6分,共42分,每小题只有一个选项符合题意) 1. 通常检测SO2含量是否达到排放标准的反应原理是SO2+H2O2 + BaCl2 ===BaSO4↓+ 2HCl。N A表示阿 伏伽德罗常数,下列说法正确的是() A. 0.1 mol BaCl2晶体中所含微粒总数为0.1N A B. 25 ℃时,pH =1的HCl溶液中含有H+的数目为0.1N A C. 17 g H2O2中含有非极性键数目为0.5N A D. 生成2.33 g BaSO4沉淀时,转移电子数目为0.01N A 2. 中国传统文化对人类文明贡献巨大,我国古代的人民在那时候就已经广泛应用了,书中充分记载 了古代化学研究成果.下列关于古代化学的应用和记载,对其说明不合理的是() A. 《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳极”这是利用了 “KNO3的氧化性” B. 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来 C. 我国古代人民常用明矾除去铜器上的铜锈[Cu2(OH)2CO3] D. 蔡伦利用树皮、碎布(麻布)、麻头等为原料精制出优质纸张,由他监制的纸被称为“蔡侯纸”。 “蔡侯纸”的制作工艺中充分应用了化学工艺 3. 下列关于钠及其化合物的说法正确的是() A. 过氧化钠的电子式: B. 金属钠可用来除去苯中的少量水分 高三模拟考试试卷 英语2020.3 (考试时间:100分钟试卷满分:120分) 考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将答题卡交回。 第一部分:知识运用(共两节,45分) 第一节语法填空(共10小题:每小题1.5分,共15分) 阅读下列短文,根据短文内容填空,在未给提示词的空白处仅填写1个适当的 单词,在给出提示词的空白处用括号内所给词的正确形式填空。 A In the early 1800s, Stanislas Baudry built public baths in the center of a town in France. To encourage people to come, Baudry drove a large vehicle around to give people a ride to the baths. He called the vehicle an omnibus, 1 is a Latin word meaning “for everyone”. Then he 2 (notice) that many passengers would get off at stops during the journey to the baths. So Baudry shifted the focus of his omnibus service. He created a permanent route for passengers 3 (board) and get off. Eventually, the omnibus became known 4 (simple) as a bus. B In the film Frozen 2, Elsa and Anna are sisters who live in a kingdom called Arendella. Elsa is born 5 special power s that allow her to create ice and snow. Elsa’s powers are considered dangerous, 6 she must hide them. Eventually she loses control and changes summer to winter. Then Elsa flees from home, and Anna goes on a dangerous journey to find her sister. Along the way, Anna teams up with a man 7 (name) Kristof and his reindeer(驯鹿))Sven. A talking snowman, Olaf also accompanies them. In the end, it’s Anna’s love for her sister that saves the day. C According to the World Wildlife Fund, only about 3,890 tigers are left in the wild. India is home to 70 percent of them, and its role in 8 (ensure) the big cat’s survival can’t be understated. Tiger numbers in India are believed to have dropped from about 40,000 at the beginning of the 9 (19)century to just 1,800 in the early 1970s, when India launched the conservation program Project Tiger. Kanha was one of the original nine 10 (reserve) set up under that program. 12015年浦东新区高三化学一模试卷(含答案)
2018高三英语一模答案
高三一模化学考试总结.
2020年高考化学模拟试题与答案(一)
2020高三一模英语试题