
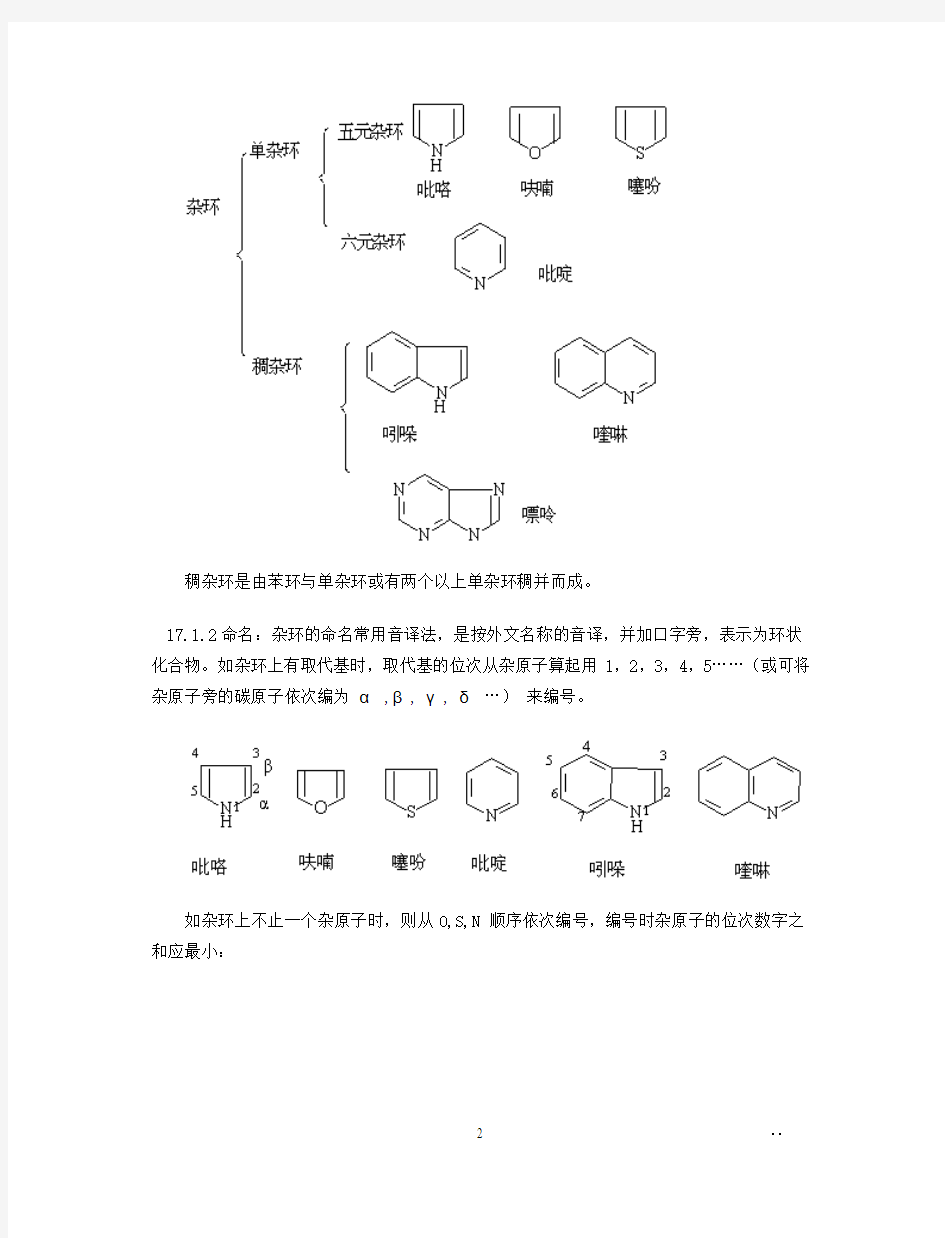
第十七章 杂环化合物
学习要求:
1. 掌握杂环化合物的分类和命名。
2. 掌握杂环化合物的化学性质。
3. 理解杂环化合物的结构与芳香性。 4.理解吡咯、吡啶的结构与性质的关系。 5.了解嘧啶、喹啉、嘌呤及吲哚。
6.了解几种重要生物碱(麻黄素、烟碱、阿托品、咖啡碱和茶碱)。 计划课时数 4课时
重点:杂环化合物的化学性质,杂环化合物的结构与芳香性。 难点:杂环化合物的结构与芳香性。
教学方法 采用模型、多媒体课件和板书相结合的课堂讲授方法。 引言
杂环化合物是指组成环的原子中含有除碳以外的原子(杂原子——常见的是N 、O 、S 等)的环状化合物。
杂环化合物不包括极易开环的含杂原子的环状化合物,例如:
本章我们只讨论芳香族杂环化合物。 杂环化合物是一大类有机物,占已知有机物的三分之一。杂环化合物在自然界分布很广、功用很多。例如,中草药的有效成分生物碱大多是杂环化合物;动植物体内起重要生理作用的血红素、叶绿素、核酸的碱基都是含氮杂环;部分维生素,抗菌素;一些植物色素、植物染料、合成染料都含有杂环。
§17.1 杂环化合物的分类和命名
17.1.1 杂环大体可分为:单杂环和稠杂环两类。
NH O ,
,,O
O O O
O
O 杂环化合物
非芳香杂环芳杂环(符合休克尔规则的杂环)如如
O O NH N N H
O ,…………
,,
稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。
17.1.2命名:杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为α ,β, γ, δ …)来编号。
如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小:
五元杂环中含有两个杂原子的体系叫唑(azole )当环上有取代基时,取代基的位次从杂原子算起依次用1,2,3,… (或α,β,γ…)编号。
如杂环上不止一个杂原子时,则从O 、S 、N 顺序依次编号。编号时杂原子的位次数字之和应最小。例见P 552
17.2杂环化合物的结构与芳香性
呋喃、噻吩、吡咯在结构上具有共同点,即构成环的五个原子都为sp 2杂化,故成环的五个原子处在同一平面,杂原子上的孤对电子参与共轭形成共轭体系,其π电子数符合休克尔规则(π电子数 = 4n+2),所以,它们都具有芳香性。
吡啶的结构
由于吡啶环的N 上在环外有一孤对电子,故吡啶环上的电荷分布不均。
O S
N H
Π56
π为共轭体系
电子= 6
符合4n + 2具有芳性
富电子芳环
N N H 上的孤电子对在 轨道上,参与环内共轭,为富电子芳环。上的孤电子对在
轨道上,在环外未参与环内共轭。成环原子
共平面体系
C _ sp 2
N _ sp 2
Π
6
6N P sp 2
N
§17.3 五元杂环化合物
含一个杂原子的典型五元杂环化合物是呋喃、噻吩和吡咯。含两个杂原子的有噻唑、咪
唑和吡唑。本节重点讨论呋喃、噻吩和吡咯,简单介绍一下噻唑、咪唑和吡唑。
呋喃、噻吩、吡咯的性质
(1)存在与物理性质 P 554
(2)光谱性质 呋喃,噻分,吡咯的电子结构和光谱性质。
电子结构:这三个杂环化合物中,碳原子和杂原子均以sp 2
杂化轨道互相连接成σ健,并且在一个平面上,每个碳原子及杂原子上均有一个p 轨道互相平行,在碳原子的p 轨道中有一个p 电子,在杂原子的p 轨道中有两个p 电子,形成一个环形的封闭的π电子的共轭体系。这与休克尔的4n+2规则相符,因此这些杂环或多或少的具有与苯类似的性质,故称之为芳香杂环化合物。
芳香性大小,试验结果表明
:
光谱性质:IR: νc-H = 3077~3003cm -1
,νN-H = 3500~3200 cm -1
(在非极性溶剂的稀溶
液中,在3495 cm -1,有一尖峰。在浓溶液中则于3400 cm -1
,有一尖峰。在浓和淡的中间浓度
时,两种谱带都有),杂环C =C 伸缩振动:1600~1300 cm -1
(有二至四个谱带)。 NMR :这些杂环化合物形成封闭的芳香封闭体系,与苯环类似,在核磁共振谱上,由于外磁场的作用而诱导出一个绕环转的环电流,此环电流可产生一个和外界磁场方向相反的感应磁场,在环外的质子,处在感应磁场回来的磁力线上,和外界磁场方向一致,在去屏蔽区域,故环上氢吸收峰移向低场。化学位移一般在7ppm 左右。
呋喃:α-H δ=7.42ppm β-H δ=6.37ppm 噻吩:α-H δ=7.30ppm β-H δ=7.10ppm 吡咯:α-H δ=6.68ppm β-H δ=6.22ppm
(3)化学性质 1.亲电取代反应
从结构上分析,五元杂环为Π56
共轭体系,电荷密度比苯大,如以苯环上碳原子的电荷密度为标准(作为0),则五元杂环化合物的有效电荷分布为:
γN
α
β1.43
0.84
1.010.87电荷分布亲电取代
亲核取代N >ββαγγα,>>位
位
五元杂环有芳香性,但其芳香性不如苯环,因环上的π电子云密度比苯环大,且分布不匀,它们在亲电取代反应中的速率也比要苯快得多。
亲电取代反应的活性为: 吡咯 > 呋喃 > 噻吩 > 苯,主要进入α-位。 五元杂环吡咯、呋喃、噻吩的反应实例见P 555~556
说明:吡咯、呋喃、噻吩的亲电取代反应,对试剂及反应条件必须有所选择和控制。 卤代反应 不需要催化剂,要在较低温度和进行。
硝化反应 不能用混酸硝化,一般是用乙酰基硝酸酯(CH 3COONO 2)作硝化试剂,在低温下进行。
磺化反应 呋喃、吡咯不能用浓硫酸磺化,要用特殊的磺化试剂——吡啶三氧化硫的络合物,噻吩可直接用浓硫酸磺化。
2.加氢反应
3.呋喃、吡咯的特性反应 (1) 呋喃易起D-A 反应
吡咯、噻吩要在特定条件下才能发生D-A 反应。
(2)吡咯的弱酸性和弱碱性
吡咯虽然是一个仲胺,但碱性很弱。
吡咯具有弱酸性,(其酸性介与乙醇和苯酚之间。
O
S N H 0
00000+ 0.1- 0.03- 0.02+ 0.20- 0.06
- 0.04+ 0.32- 0.10- 0.06O N
H
S H , Ni or Pd H , Ni or Pd
H , Ni O
N H
S 四氢呋喃四氢吡咯( THF )不能用
催化因噻吩能 使中毒Pd
Pd O O O O +℃
+内式外式(90%)N H N
H NH 2K b ×3.8 10-10 2 10-42.5 10-14××原因:
上的未共用电子对参与了环的共轭体系,
减弱了与
的结合力。N H
故吡咯能与固体氢氧化钾加热成为钾盐,与格式试剂作用放出RH 而生成吡咯卤化镁。
吡咯钾盐和吡咯卤化镁都可用来合成吡咯衍生物。
重要的五元杂环衍生物
(1)糠醛(α- 呋喃甲醛) 1.制备
由农副产品如甘蔗杂渣、花生壳、高粱杆、棉子壳……用稀酸加热蒸煮制取。
N
H OH
K a =×1.3 10-10 1 10-18
1 10-15××CH 3CH 2
OH
N H + KOH N
K
+ H 2O 固体N H
+ RMgX N + H 2O MgX
干乙醚N H N K (固体)热N COR N N
H COR N H
R N
H N MgX 干乙醚N COR N N H COR N H
R (C 5H 8O 4)n 24
HO CH CH OH
CH 2OH CH CHO OH
24稀CHO 多聚戊糖戊糖呋喃甲醛
水蒸气
2.糠醛的性质 同有α-H 的醛的一般性质。 (1)氧化还原反应
(2)歧化反应
(3)羟醛缩合反应 (4)安息香缩合反应
3.糠醛的用途
糠醛是良好的溶剂,常用作精练石油的溶剂,以溶解含硫物质及环烷烃等。可用于精制松香,脱出色素,溶解硝酸纤维素等。糠醛广泛用于油漆及树脂工业。
(2)吡咯的重要衍生物
最重要的吡咯衍生物是含有四个吡咯环和四个次甲基(-CH= )交替相连组成的大环( ) 化合物。其取代物称为卟啉族化合物。
卟啉族化合物广泛分布与自然界。血红素,叶绿素都是含 环的卟啉族化合物。在血红素中 环络合的是Fe ,叶绿素 环络合的是Mg 。
血红素的功能是运载输送氧气(P 564)叶绿素是植物光合作用的能源。
1964年,Woodward 用55步合成了叶绿素。1965年接着合成VB 12,用11年时间完成了全合成。 Woodward 一生人工合成了20多种结构复杂的有机化合物,是当之无愧的有机合成大师。
Woodward 20岁获博士学位,30岁当教授,48岁时(1965年)获诺贝尔化学奖。
O
CHO O CH=CHCHO +CH 3
CHO
O CHO 320℃,2,O CH 2OH O COOH O
O O + CO 2 + H 2O
O CHO O CH 2OH O
COOH
+浓碱O CHO O CH O OH
δ4567
8γ
绿素与蛋白质结合存在于植物的叶和绿色的茎中。植物光合作用时,叶绿素吸收太阳能转变为化学能,是植物进行光合作用时必需的催化剂。自然界的叶绿素不是一个单纯的化合物,而是由两种叶绿素组合而成,即蓝绿色的叶绿素a(熔点:117~120 ℃)和黄绿色的叶绿素b(熔点:120~130 ℃),两者的比例为:3a:4b,叶绿素环中含镁。叶绿素a 已经被合成(1960年)
叶绿素α的结构
维生素B12,是含钴的类似卟啉环化合物。但其卟啉环在δ-位少一个碳原子。它具有强的医治贫血的功能。
4噻唑和咪唑
1.噻唑
噻唑是含一个硫原子和一个氮原子的五元杂环,无色,有吡啶臭味的液体,沸点117℃,与水互溶,有弱碱性。是稳定的化合物。
一些重要的天然产物几合成药物含有噻唑结构,如青霉素、维生素B1等。
青霉素是一类抗菌素的总称,已知的青霉素大一百多种,它们的结构很相似,均具有稠合在一起的四氢噻唑环和β- 内酰胺环。
S N
CH
C O
NH C R
O
HOOC
CH3
CH3
青霉素具有强酸性(pKa ≈2.7),在游离状态下不稳定(青霉素O 例外),故常将它们变成钠盐、钾盐或有机碱盐用于临床。
维生素B 1(VB 1)
呋喃,噻吩,吡咯的制备。
1.玉米心,稻糠,花生壳,大麦壳,高粱秆等用稀硫酸处理得戊糖,戊糖失水得糠醛,再在400℃下加热,同时在催化剂ZnO,Cr 2O 3存在下,失去一氧化碳而得呋喃。
2.工业上制备噻吩是用丁烷,丁烯或丁二烯与硫磺混合,在600℃反应得到:
3.噻吩也可用琥珀酸钠盐与五硫化二磷一起加热反应制得:
R =CH 2CH 2O CH CH CH 2S CH 3R =R =G V O 常用青霉素
为青霉素为青霉素为青霉素N N CH 2N S
CH 3CH 2CH 2OH NH 3Cl
CH 3Cl 噻唑环对糖类的新陈代谢有显著的影响,人体缺乏时可以引起脚气病
4.帕尔——克诺尔(C.Paal—L.Knorr)合成法:
1,4—二羰基化合物常在无水的酸性条件下,得到呋喃及其衍生物。1,4—二羰基化合物与氨或硫化合物反应,可制备噻吩,吡咯及他们的衍生物,这个方法称为帕尔—克诺尔合成法:
5.取代吡咯的另一个一般的合成法,称为克诺尔合成法,即用氨基酮与有α-亚甲基的酮进行缩合。例如用氨基酮酸酯与酮酸酯或1,3—二酮缩合,氨基酮酸脂由相应的β-羰基酯制得。
α—氨基酮 α—亚甲基酮
§17.4 六元杂环化合物
六元杂环化合物中最重要的有吡啶、嘧啶和吡喃等。
吡啶是重要的有机碱试剂,嘧啶是组成核糖核酸的重要生物碱母体。
17.4.1吡啶
(1) 来源、制法和应用
吡啶存在于煤焦油页岩油和骨焦油中,吡啶衍生物广泛存在于自然界,例如,植物所含的生物碱不少都具有吡啶环结构,维生素PP 、维生素B 6、辅酶Ⅰ及辅酶Ⅱ也含有吡啶环。吡啶是重要的有机合成原料(如合成药物)、良好的有机溶剂和有机合成催化剂。 吡啶的工业制法可由糠醇与氨共热(500℃)制得,也可从乙炔制备(P 565)。
吡啶为有特殊臭味的无色液体,沸点115.5℃,相对密度0.982,可与水、乙醇、乙醚等任意混和。
(2)吡啶的结构
N N N O 吡啶嘧啶
吡喃N N H 上的孤电子对在 轨道上,参与环内共轭,为富
上的孤电子对在
轨道上,在环外成环原子
共平面体系
C _ sp 2
N _ sp 2 Π66
N P sp 2
N
由于吡啶环的N 上在环外有一孤对电子,故吡啶环上的电荷分布不均。
(3)吡啶的性质
1.碱性与成盐
吡啶的环外有一对未作用的孤对电子,具有碱性,易接受亲电试剂而成盐。 吡啶的碱性小于氨大于苯胺。
吡啶易与酸和活泼的卤代物成盐。
2.亲电取代反应
吡啶环上氮原子为吸电子基,故吡啶环属于缺电子的芳杂环,和硝基苯相似。其亲电取代反应很不活泼,反应条件要求很高,不起傅-克烷基化和酰基化反应。亲电取代 反应主要在β-位上。
CH 3NH 2NH 3
N
NH 2
pK b 3.38 4.768.80
9.42N + HCl N HCl N
NH 3
N + SO 3CH 2Cl 2
N SO 3(90%)
此反应常用于在反应中吸收生成的气态酸室温吡啶三氧化硫络合物
是常用的缓和磺化剂N N N RI
R I 300℃I N I +R R
N N
R
R 制取烷基吡啶的一种方法
γN
αβ1.430.841.010.87电荷分布亲电取代亲核取代N >ββαγ
γα,>>位
位
N
N Cl
N Br
N
NO 2
SO 3H
氯吡啶
溴吡啶硝基吡啶
吡啶
磺酸3333
3.氧化还原反应 (1)氧化反应
吡啶环对氧化剂稳定,一般不被酸性高锰酸钾、酸性重铬酸钾氧化,通常是侧链烃基被氧化成羧酸。
吡啶易被过氧化物(过氧乙酸、过氧化氢等)氧化生成氧化吡啶。
氧化吡啶在有机合成中用于合成4-取代吡啶化合物。
(2)还原反应
吡啶比苯易还原,用钠加乙醇、催化加氢均使吡啶还原为六氢吡啶(即胡椒啶)。 4.亲核取代
由于吡啶环上的电荷密度降低,且分布不均,故可发生亲核取代反应。例如:
17.4.2 稠杂环化合物
稠杂环化合物是指苯环与杂环稠合或杂环与杂环稠合在一起的化合物。常见的有喹啉、吲哚和嘌呤。
N
N N
N 吡啶甲酸(烟酸)
CH 3 / H HNO 3COOH COOH αβ吡啶甲酸N
N 3O
O N HNO O N O
NO 22490℃PCl N NO 2
+ POCl 3N NaNH N 2NHNa
N NH 2二甲苯胺中回流N N H N N N H
N 2
3456789111223
3445566778喹啉吲哚嘌呤( Quioline )( indole )
( Purine )
1吲哚
吲哚是白色结晶,熔点52.5℃。极稀溶液有香味,可用作香料,浓的吲哚溶液有粪臭味。素馨花、柑桔花中含有吲哚。吲哚环的衍生物广泛存在于动植物体内,与人类的生命、生活有密切的关系。
吲哚的性质与吡咯相似,也可发生亲电取代反应,取代基进入β-位。见P 563。
N H
CH 2CH COOH NH 2
N H
CH 3β色氨酸构成蛋白质的重要成分甲基吲哚(粪臭素)
很稀时有茉莉香味
N H CH 2CH 2NH 2
HO 5羟基色氨动物激素,参与神经思维的物质。
N
H CH 2COOH β吲哚乙酸植物激素,少量能调节植物生长,量大则杀伤植物。如在侧链多一个 就失去生理效能。CH
2N H β吲哚磺酸
Br 2,O O 溴吲哚硝基吲哚
33N H
N H
N
H
Br
NO 2SO 3H 70%
35%N
H CH 2CH 2NHAc CH 3O 脑白金Melatonine
2.喹啉
喹啉存在于煤焦油中,为无色油状液体,放置时逐渐变成黄色,沸点238.05℃,有恶臭味,难溶于水。能与大多数有机溶剂混溶,是一种高沸点溶剂。
1.喹啉的性质 (1)取代反应
喹啉是有吡啶稠合而成的,由于吡啶环的电子云密度低于与之并联的苯环,所以喹啉的亲电取代反应发生在电子云
密度较大的苯环上,取代基主要进入5或8位。而亲核取代则主要发生在吡啶环的2或4位。
(2)氧化还原反应
喹啉用高锰酸钾氧化时,苯环发生破裂,用钠和乙醇还原是其吡啶环被还原,这说明在喹啉分子中吡啶环比苯环难氧化,易还原。
2.喹啉环的合成法——斯克劳普(Skraup )法:
喹啉的合成方法有多种,常用的是斯克劳普法。是用苯胺与甘油、浓硫酸及一种氧化剂如硝基苯共热而生成。
其反应过程见P 571。
N
1.63
0.790.930.771.000.950.96
0.98N
N N
NO 2Br
N
NH 2++
H O
N
N N H
KMnO COOH COOH N
NH 2 CH 2-CH-CH 2
OH +
H SO 硝基苯84~91%
3.喹啉的衍生物
喹啉的衍生物在自然界存在很多,如奎宁、氯喹、罂粟碱、吗啡等。
17.4.2嘌呤嘧啶、嘌呤及其衍生物
嘧啶本身不存在于自然界,其衍生物在自然界分布很广,脲嘧啶、胞嘧啶、胸腺嘧啶是遗传物质核酸的重要组成部分,微生素B 1也含有嘧啶环。合成药物的磺胺嘧啶也含这种结构。
uracil thymine cytosine
CH 3CH CH 2
奎宁(金鸡钠碱)存在于金鸡钠树皮中,有抗疟疾疗效N
N Cl
NH CH HO (CH 2)3-N C 2H 5C 2H 5
CH 2
OCH 3OCH 3
CH 3O
CH 3O 氯喹(合成抗疟疾药)
罂粟碱
CH 37
吗啡
含一个被还原了的异喹啉环,是从鸦片中提取出来的。
吗啡的盐酸盐是很强的镇痛药,能
持续6小时,也能镇咳,但易上瘾。
将羟基上的氢换成乙酰基,即为海洛因,不存在于自然界。海洛因比吗啡更易上瘾,可用来解除晚期癌症患者的痛苦。
N N N N N
N
N N OH HO OH HO HO CH 3NH 2尿嘧啶胸腺嘧啶胞嘧啶( U )( T )( C )
嘌呤为无色晶体,m .p216~217℃,易溶于水,其水溶液呈中性,但能与酸或碱成盐。 纯嘌呤环在自然界不存在,嘌呤的衍生物广泛存在于动植物体内。
1.尿酸 存在于鸟类及爬虫类的排泄物中,含量很多,人尿中也含少量。
2.黄嘌呤 存在于茶叶及动植物组织和人尿中。
3生物碱
生物碱是一类存在于生物体内,对任何动物有强烈生理作用的含氮碱性有机化合物,如烟叶中的主要生物碱组分是
尼古丁(
)。生物碱在植物体内常于有机酸(果酸,
柠檬酸,草
酸,琥珀酸,醋酸,丙酸等)结合成盐而存在,也有和无机酸(磷酸,硫酸,盐酸)结合的。
中草药治病有效成分有生物碱,苷等。生物碱的研究促进有机合成药物的发展,为合成新药提供线索,如古柯碱化学的研究导致局部麻醉剂普鲁卡因的合成。
古柯碱
N N N H
N N N N NH ⅡⅠ( )( )9H 7H 嘌呤嘌呤HN N H N H NH N N N H
N
O O O OH HO OH HN N H
N H
N N N
N H
N O O OH HO
古柯碱具有局部麻醉的效能,上面结构式中虚线部分代表有效部分。但古柯碱毒性大,具有易产生毒瘾等缺点,于是进行代用品的研究,药学家合成出许多比古柯碱分子简单而更有效的麻醉药,普鲁卡因等,它是良好的局部麻醉药。
同时归纳出局部麻醉药具有下式的基本结构:
生物碱的一般性质
1.游离生物碱物理性质:
一般是无色固体结晶,有色的很少(黄连素黄色),液体也很少(烟碱为液体),有苦味。分子中含有手征碳原子,具有旋光作用,如天然烟碱(尼古丁)是左旋的。能溶于氯仿,乙醇,醚等有机溶剂,多半不溶或难溶于水。能与无机酸或有机酸结合成盐。这种盐一般易溶于水。
2.化学性质:
(1)生物碱的沉淀反应:生物碱的中性或酸性水溶液与一些试剂(如10%苦味酸)能发生沉淀。
(2)生物碱的颜色反应:生物碱与一些浓酸能呈现出各种颜色,其颜色随各种生物碱而各有特征。
二.生物碱的提取方法:
1.有机溶剂提取法(略)
2.稀酸提取法(略)
三.. 生物碱结构的化学测定。
化学方法通常是先测定其分子式和所含官能团,然后通过降解反应使之成为一些结构的碎片,推测出可能的结构式。最后用可靠的合成方法加以验证。
3.咖啡碱、茶碱和可可碱
三者都是黄嘌呤的甲基衍生物,存在于茶叶、咖啡和可可中,它们有兴奋中枢作用,其中以咖啡碱的作用最强。
咖啡碱 茶碱 可可碱 4.腺嘌呤和鸟嘌呤 是核蛋白中的两种重要碱基。
腺嘌呤(A ) 鸟嘌呤(G )
§18~5 生 物 碱
(自学)
作业1: P 429 1,2,3,5,7,8,10,11
N N N N O O N N N N NH O O N HN N N N O O CH 3CH 3
CH 3CH 3CH 3CH 3CH 3N N N
H
N HN N N H N H 2N O NH 2
第十七章 杂环化合物 (heterocyclic Ring compounds ) 一、教学目的和要求 1.掌握杂环化合物的分类和命名。 2.掌握五元单杂环、六元单杂环化合物的化学性质。 3.理解杂环化合物的结构与芳香性。 4.理解吡咯、吡啶的结构与性质的关系。 二、教学重点与重点 重点:杂环化合物、甾体化合物结构特征与命名(俗名)。 难点:杂环化合物的结构。 三、教学方法和教学学时 (1)教学方法:以课堂讲授为主,结合必要的课堂讨论。教学手段以板书和多媒体相结合。 (2)教学学时:4学时 四、教学内容 1、杂环化合物 (1)杂环化合物概述 (2)吡咯及其衍生物 (3)吡啶及其衍生物 (4)吲哚及其衍生物 (5)苯并吡喃及其衍生物 (6)嘧啶和嘌呤及其衍生物 2、生物碱 (1)生物碱概述 (2)生物碱举例 五、总结、布置作业 17.1 几种基本杂环 (分类和命名) 杂环化合物定义 :杂环化合物是指环比较稳定、含杂原子的环状化合物,包括芳香性杂环和非芳香杂环。 杂环化合物的种类很多,有单环,也有与芳香环或其他杂环并联成的稠杂环。环上的杂原子可以是一个、两个或更多个,而且可以是相同的或是不同的。一般最常见的杂环是五元或六元环。 根据1980年中国化学会颁布的有机化学命名原则,杂环化合物的命名按外文名称音译,并以一口字旁表示是环状化合物。以下是几种常见的杂环化合物的结构与名称。 O S N S N N N H H 呋喃 噻吩 吡咯 噻唑 咪唑 Furan Thiophene Pyrrole Thiazole Imidazole N O N N N N N N
吡啶 吡喃 哒嗪 嘧啶 吡嗪 Pyridine Pyran Pyridazine Pyrimidine Pyrazine H N O N N N N 吲哚 苯并呋喃 嘌呤 N N N 喹啉 异喹啉 吖啶 17.2 几种重要杂环化合物的结构 吡咯、吡啶 、呋喃、噻吩 ----C 、N 、O 、S 皆为 SP2 杂化 ,符合休克尔规则,有芳香性。但根据具体情况的不同,有的是富电子芳杂环,有的是缺电子芳杂环。 1. 1. 五元杂环 吡咯的共轭体系及比例模型如下: 吡咯是富电子芳杂环。 2. 2. 六元杂环 吡啶的共轭体系及比例模型如下: 吡啶是缺电子芳杂环。 富电子芳杂环与缺电子芳杂环因为结构特点的不同而表现出不同的化学 性质,其中亲电取代反应的差异尤为明显。
第十七章 杂环化合物 一、写出下列化合物的构造式: 1,3-甲基吡咯 2,碘化N,N -二甲基四氢吡咯 3,四氢呋喃 4,β-氯代呋喃 5,α-噻吩磺酸 6,糠醛,糠醇,糠酸 7,γ-吡啶甲酸 8,六氢吡啶 9,β-吲哚乙酸 10,8-羟基喹啉 H 1. CH 3 N 2. N CH 3 CH 3 + I -O 3. 4. Cl O 5. S SO 3H 6. O O O CHO CH 2OH COOH 7. COOH N 8. N H 9. N H CH 2COOH 10. N 二、用化学方法区别下列各组化合物: 1,苯,噻吩和苯酚 解:加入三氯化铁水溶液,有显色反应的是苯酚。在浓硫酸存在下,与靛红一同加热显示蓝色的位噻吩。 2,吡咯和四氢吡咯 解:吡咯的醇溶液使浸过浓盐酸的松木片变成红色,而四氢吡咯不能。 3,苯甲醛和糠醛 解:糠醛在醋酸存在下与苯胺作用显红色。
三、用化学方法,将下列混合物中的少量杂质除去。 1,苯中混有少量噻吩 解:在室温下用浓硫酸处理,噻吩在室温与浓硫酸反应生成α-噻吩磺酸而溶于浓硫酸,苯不反应。 2,甲苯中混有少量吡啶 解:用浓盐酸处理,吡啶具有碱性而与盐酸生成盐溶于水相,分离出吡啶。 3,吡啶中有少量六氢吡啶。 解:六氢吡啶是仲胺,在氢氧化钠水溶液中与对甲基苯磺酰氯反应生成固体,过滤除去六氢吡啶。 四、试解释为什么噻吩,吡咯,呋喃比苯容易发生亲电取代反应而吡啶比苯难发生? 解:噻吩,吡咯,呋喃是五元杂环化合物,属于多л-电子杂环化合物,芳环上电子云密度比苯大,所以易于发生亲电取代。而吡啶是六元杂环化合物,是缺л-电子杂环化合物,芳环上电子云密度小于苯环,所以难于发生亲电取代反应。 五、完成下列反应式:
第十六章 杂环化合物、生物碱 杂环化合物的定义:在环状有机化合物中,构成环的原子除了碳原子外还含有其他原子,这环状种化合物就叫做杂环化合物(heterocyclic compound )。除碳以外的其他原子叫做杂原子。常见的杂原子有:氮、氧、硫。 第一节 杂环化合物的分类和命名 一、 分类 按照环的大小和环的数目可分为: 杂环 单杂环 五元环 六元环 苯环与单杂环的稠合杂环(苯并杂环) 两个或两个以上单杂环的稠合杂环O S N H 稠杂环 N N N N N H N 二、 命名 1、音译法:根据外文译音,选用同音汉字,加“口”字旁表示杂环。 O S N H 吡咯呋喃噻吩吡啶N pyrrole furan thiophene pyridine N H 吲哚indole N N 咪啶pyrimidine 取代杂环的命名: ① 杂环的编号从杂原子起依次1,2,3 ……(或:α,β,γ……)。 ② 如环上不止一个杂原子时,则从O 、S 、N 的顺序依次编号。 ③ 有两个相同杂原子的,应从连有H 原子或取代基的开始编号。 ④ 编号时注意杂原子或取代基的位次之和最小。 ⑤ 稠杂环是特定的母体和固定的编号。 N S 5 1 2 4 3 5-乙基噻唑N N H 1 23454-甲基咪唑 CH 3 C 2H 5 N CH 31 23 4563-甲基吡啶 2、根据结构命名:
即根据相应于杂环的碳环来命名,把杂环看作是相应的碳环中的碳原子被杂原子置换而形成的。例如,吡啶可看作是苯环上一个碳原子被氮原子置换而成的,所以叫做氮杂苯。 O S N H N 茂 (环戊二烯)氮茂 氧茂 硫茂 N N 苯氮苯 1,3-二氮苯 第二节 一杂五元杂环化合物 含有一个杂原子的典型五元杂环是呋喃、噻吩、吡咯。 O S N H 一、 呋喃、噻吩、吡咯的结构 1、据现代物理方法证明: ① 呋喃、噻吩、吡咯都是一个平面的五元环结构,即成环的四个C 原子和一个杂原子都是以SP 2杂化轨道成键的。 ②环上每个碳原子的P 轨道有一个电子,杂原子P 轨道上有两个电子。 ③ P 轨道垂直于五元环的平面,互相侧面重叠而形成一个与苯环相似的闭合共轭体系。 ④ 五元环的六个π电子分布在包括环上五个原子在内的分子轨道。 2、分子结构符合休克尔(Huckel)规则(4n+2=6,n=1),π电子数为6。具有芳香性。但芳性比苯弱,环的稳定性差。 3、芳香性秩序: 苯 > 噻吩 > 吡咯 > 呋喃 呋喃的芳香性最弱,实际上它可以进行双烯加成反应,表现出共轭二烯烃的性质。 4、它们的键长数据如下[单位(ppm )]: O S N 140 145 135 172 143 137 138144 135 137 5、吡咯、呋喃、噻吩环上杂原子氮、氧、硫的未共用电子对参与环的共轭体系,使环上的电子云密 度增大。因此,它们都比苯活泼,比苯容易进行亲电取代反应,而且它们进行亲电取代反应的活泼性顺序是: 吡咯 > 呋喃 > 噻吩 > 苯 X +(CF 3CO)2O X COCF 3 +CF 3COOH 三氟乙酐酰化 二、 呋喃、噻吩、吡咯的性质 1、亲电取代反应——主要在杂原子的α位: 它是呋喃、吡咯、噻吩的典型反应。由于它们环上的电子云密度比苯大,比苯容易发生亲电取代反应。同时环稳定性比苯差,因此反应条件与苯不同,需要在较温和的条件下反应,以避免氧化、开环或聚合等副反应。
第十一章 杂环化合物和生物碱 一、学习要求 1.掌握杂环化合物的分类和命名 2.掌握五元杂环、六元杂环和稠杂环的结构和性质 3.掌握生物碱的基本概念及分类 4.了解生物碱的一般性质、提取方法及重要的生物碱 二、本章要点 (一)杂环化合物的分类和命名 1.杂环化合物的概念 由碳原子和非碳原子所构成的环状有机化合物称为杂环化合物,环中的非碳原子称为杂原子,最常见的杂原子有氧、硫、氮等。 2.杂环化合物的分类 按环的数目不同,可分为单杂环和稠杂环两大类。单杂环按环的大小不同又可分为五元杂环和六元杂环。稠杂环通常由苯与单杂环或单杂环与单杂环稠合杂环化合物而成。 3.杂环化合物的命名 杂环化合物的命名比较复杂,目前我国常使用“音译法”,即按英文的读音,用同音汉字加上“口”字旁命名: O 1 2 3 45 5 43 2 1 S 5 432 1N 543 2 1 N S 543 2 1N N H 5432 1N N H 呋喃 噻吩 吡咯 噻唑 吡唑 咪唑 (furan ) (thiophene ) (pyrrole ) (thiazole ) (pyrazole ) (imidazole ) 6 54 32 1 O N N 1 2 3456 N N 1 2 3456 N N 1 2 3456 6 54 3 2 1 N 吡啶 哒嗪 嘧啶 吡嗪 吡喃(pyridine ) (pyridazine) (pyrimidine) (pyrazine) (pyran)
环上有取代基的杂环化合物的名称是以杂环为母体,并注明取代基的位置、数目和名称。杂原子的编号,除个别稠杂环外,一般从杂原子开始编号,环上有不同不同杂原子时,按O 、S 、NH 和N 的顺序编号;某些杂环可能有互变异构体,为区别各异构体,需用大写斜体“H ”及其位置编号标明一个或多个氢原子所在的位置。例如: 2,4-二羟基嘧啶 2-氨基-6-氧嘌呤 4H -吡喃 2H -吡喃 此外,还可以将杂环作为取代基,以官能团侧链为母体进行命名。例如: N ,N-二乙基-3- 4-嘧啶甲酸 3-吲哚乙酸 2-呋喃甲醛 吡啶甲酰胺 (二)含氮六元杂环 1.吡啶的结构 1 2345 6 7 8 9 N N N N H 2N O H N N OH OH 1 23 4 56 O 1 2 34 56 1 2 3 45O 6 1 2 1 CHO O CON(C 2H 5)2 N 2 34 56 COOH 6 5432 1 N N CH 2COOH N H 12 3 456 7 N .. 6 8 75 43 2 110 98 76 5321 6 58 7 654321 H N N N N N N 8 7 65 432 N 7 4 32 1H N 喹啉 异喹啉 吲哚 吖啶 嘌呤 ( quinoline) (isoquinoline) (indole) (acridine) (purine)
第十七章杂环化合物 一、写出下列化合物的构造式: 1,3-甲基吡咯 2,碘化N,N-二甲基四氢吡咯 3,四氢呋喃 4,β-氯代呋喃 5,α-噻吩磺酸 6,糠醛,糠醇,糠酸 7,γ-吡啶甲酸 8,六氢吡啶 9,β-吲哚乙酸 10,8-羟基喹啉 二、用化学方法区别下列各组化合物: 1,苯,噻吩和苯酚 解:加入三氯化铁水溶液,有显色反应的是苯酚。在浓硫酸存在下,与靛红一同加热显示蓝色的位噻吩。 2,吡咯和四氢吡咯 解:吡咯的醇溶液使浸过浓盐酸的松木片变成红色,而四氢吡咯不能。 3,苯甲醛和糠醛 解:糠醛在醋酸存在下与苯胺作用显红色。 三、用化学方法,将下列混合物中的少量杂质除去。 1,苯中混有少量噻吩 解:在室温下用浓硫酸处理,噻吩在室温与浓硫酸反应生成α-噻吩磺酸而溶于浓硫酸,苯不反应。 2,甲苯中混有少量吡啶 解:用浓盐酸处理,吡啶具有碱性而与盐酸生成盐溶于水相,分离出吡啶。 3,吡啶中有少量六氢吡啶。 解:六氢吡啶是仲胺,在氢氧化钠水溶液中与对甲基苯磺酰氯反应生成固体,过滤除去六氢吡啶。 四、试解释为什么噻吩,吡咯,呋喃比苯容易发生亲电取代反
应而吡啶比苯难发生? 解:噻吩,吡咯,呋喃是五元杂环化合物,属于多л-电子杂环化合物,芳环上电子云密度比苯大,所以易于发生亲电取代。而吡啶是六元杂环化合物,是缺л-电子杂环化合物,芳环上电子云密度小于苯环,所以难于发生亲电取代反应。 五、完成下列反应式: 六、用箭头表示下列化合物起反应时的位置。 过量CH 3I 溴化 浓 稀 己二酸 己二胺
七、将苯胺,苄胺,吡咯,吡啶,氨按其碱性由强至弱的次序排列:解:苯胺,苄胺,吡咯,吡啶,氨的碱性强度顺序: 八、下列化合物那些具有芳香性? 的溴化的碘化的硝化的溴化的硝化的硝化的硝化
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 第十一章杂环化合物和生物碱 第十一章杂环化合物和生物碱第十一章杂环化合物和生物碱参考答案 1.命名下列化合物: (1) -呋喃甲酸(2) -甲基吡咯(3) -噻吩磺酸(4)-吡啶甲酰胺(5) 4-甲基吡啶盐酸盐(或: 氯化-4-甲基吡啶)(6) 4-羟基嘧啶(7) 5-硝基喹啉(8)2, 6, 8-三羟基嘌呤 2.写出下列化合物的构造式: (1) (2) BrOBr(3) SCH2OH 3 2 (5) (6) CH2COOH OCHO(7) N NOH 3.把下列化合物按其碱性由强至弱排列。 六氢吡啶甲胺氨吡啶苯胺吡咯 4.用化学方法区别下列各组化合物。 (1)与 FeCl3 溶液作用呈紫色的为苯酚;与 H2SO4-靛红呈蓝色的为噻吩。 (2)蒸气遇蘸有浓 HCl 的松木片显红色的为吡咯。 (3)与 CH3COOH/苯胺显示亮红色的为糠醛。 5.用适当的化学方法,将下列混合物中少量杂质除去。 (1)加入浓硫酸一起振荡,噻吩发生磺化反应生成噻吩磺酸溶于浓硫酸。 (2)利用吡啶的弱碱性,加入 HCl 使其生成吡啶盐酸除去。 6.完成下列反应式。 1 / 7
(1) OCH2OHOCOOH (2) NI HCH3 COOH (3) CONH2 NN COOCH3(4) NOH(8) NNH2N(4) NSO3H3(5) CH3OCHCHO(6) NCOOHNCONH2NCNCH2NH27.喹啉硝化反应发生在苯环上;吲哚硝化 反应发生在吡咯环上。 8.互变异构体的构造式如下: 9.答: 吡啶和六氢吡啶的分子中,氮原子上都有未共用的电子对,都 可以和质子结合显碱性。 两者不同的是氮原子上未共用电子对所处轨道的类型不同,吡 啶中氮原子上的未共用电子对处于 sp2 杂化轨道上,而六氢吡啶中 氮原子上的未共用电子对处于 sp3 杂化轨道上。 处于 sp2 杂化轨道上的电子受到原子核的束缚力较大,即提 供电子的能力较弱,所以吡啶的碱性比六氢吡啶弱。 10.化合物 C5H4O2 构造式为: OH(1) NH 2N 鸟嘌呤 2 (2) HON 胞嘧啶(3) HON 尿 嘧啶(4)HONCH3 胸腺嘧啶ONNH2NH2O OH OOHOCH3OCHO X1fuIW1ftIW0ftHW0 ftHW0etHV0edsGU+drGU-drF U-drFU-crFT- cqFT) cqET) cqET) bqES) bpES (bpDSQ 8nBP 8mBP%8mAP%7mAP%7mAO%7lAO $7lzO$6lzO$6 lzBn8QBn9QCn9*QCn9*QCo 9*RCoa*RDoa( RDpa(RDpa(SDpb(SEpb) SEqb ) SEqb)TEqc) T Fqte0WHte0WHtf0WItf1WIuf 1XIuf1XIug1X Jug2XJvg2YJvg2YJvh2YKvh3 YKwh3Z Kwi3ZK
16--杂环化合物 §1. 杂环化合物的分类和命名 一、杂环大体可分为:单杂环和稠杂环两类: 1. 分类: 稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。 二、命名: 杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为α ,β, γ, δ …)来编号。 如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小: 五元杂环中含有两个杂原子的体系叫唑(azole) §2. 呋喃,噻吩,吡咯 含有一个杂原子的五元杂环单环体系:呋喃,噻吩,吡咯。 一、呋喃,噻吩,吡咯的电子结构和光谱性质 电子结构:这三个杂环化合物中,碳原子和杂原子均以sp2杂化轨道互相连接成σ健,并且在一个平面上,每个碳原子及杂原子上均有一个p 轨道互相平行,在碳原子的p轨道中有一个p电子,在杂原子的p轨道中有两个p电子,形成一个环形的封闭的π电子的共轭体系。这与休克尔的4n+2规则相符,因此这些杂环或多或少的具有与苯类似的性质,故称之为芳香杂环化合物。
芳香性大小,试验结果表明: 光谱性质:IR: νc -H = 3077~3003cm -1,νN -H = 3500~3200 cm -1 (在非极性溶剂的稀溶液中,在3495 cm -1,有一尖峰。在浓溶液中则于3400 cm -1,有一尖峰。在浓和淡的中间浓度时,两种谱带都有),杂环C =C 伸缩振动:1600~1300 cm -1 (有二至四个谱带)。 NMR :这些杂环化合物形成封闭的芳香封闭体系,与苯环类似,在核磁共振谱上,由于外磁场的作用而诱导出一个绕环转的环电流,此环电流可产生一个和外界磁场方向相反的感应磁场,在环外的质子,处在感应磁场回来的磁力线上,和外界磁场方向一致,在去屏蔽区域,故环上氢吸收峰移向低场。化学位移一般在7ppm 左右。 呋喃:α-H δ=7.42ppm β-H δ=6.37ppm 噻吩:α-H δ=7.30ppm β-H δ=7.10ppm 吡咯:α-H δ=6.68ppm β-H δ=6.22ppm 二、呋喃,噻吩,吡咯的制备 1.玉米心,稻糠,花生壳,大麦壳,高粱秆等用稀硫酸处理得戊糖,戊糖失水得糠醛,再在400℃下加热,同时在催化剂ZnO,Cr 2O 3存在下,失 去一氧化碳而得呋喃。 2.工业上制备噻吩是用丁烷,丁烯或丁二烯与硫磺混合,在600℃反应得到: 3.噻吩也可用琥珀酸钠盐与五硫化二磷一起加热反应制得: 4.帕尔——克诺尔(C.Paal —L.Knorr )合成法: 1,4—二羰基化合物常在无水的酸性条件下,得到呋喃及其衍生物。
第十六章杂环化合物 教学要点: 掌握五元杂环化合物的结构、性质;了解吡啶和生物碱。 教学时数: 6 学时 教学方法:教师讲授、 教学手段:多媒体、自制模型 第一节杂环化合物的分类和命名 杂环大体可分为:单杂环和稠杂环两类。 1. 分类: 稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。 2.命名:杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为α ,β, γ, δ …)来编号。
如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小: 五元杂环中含有两个杂原子的体系叫唑(azole) 第二节五元杂环化合物 一.含有一个杂原子的五元杂环单环体系:呋喃,噻吩,吡咯。 (1)呋喃,噻分,吡咯的电子结构和光谱性质。 电子结构:这三个杂环化合物中,碳原子和杂原子均以sp2杂化轨道互相连接成σ健,并且在一个平面上,每个碳原子及杂原子上均有一个p轨道互相平行,在碳原子的p轨道中
有一个p电子,在杂原子的p轨道中有两个p电子,形成一个环形的封闭的π电子的共轭体系。这与休克尔的4n+2规则相符,因此这些杂环或多或少的具有与苯类似的性质,故称之为芳香杂环化合物。 芳香性大小,试验结果表明: 光谱性质:IR: νc-H = 3077~3003cm-1,νN-H = 3500~3200 cm-1(在非极性溶剂的稀溶液中,在3495 cm-1,有一尖峰。在浓溶液中则于3400 cm-1,有一尖峰。在浓和淡的中间浓度时,两种谱带都有),杂环C=C伸缩振动:1600~1300 cm-1(有二至四个谱带)。 NMR:这些杂环化合物形成封闭的芳香封闭体系,与苯环类似,在核磁共振谱上,由于外磁场的作用而诱导出一个绕环转的环电流,此环电流可产生一个和外界磁场方向相反的感应磁场,在环外的质子,处在感应磁场回来的磁力线上,和外界磁场方向一致,在去屏蔽区域,故环上氢吸收峰移向低场。化学位移一般在7ppm左右。 呋喃:α-H δ=7.42ppm β-H δ=6.37ppm 噻吩:α-H δ=7.30ppm β-H δ=7.10ppm 吡咯:α-H δ=6.68ppm β-H δ=6.22ppm 二.呋喃,噻吩,吡咯的制备。 1.玉米心,稻糠,花生壳,大麦壳,高粱秆等用稀硫酸处理得戊糖,戊糖失水得糠醛,
第十八章杂环化合物 第一节杂环化合物的分类和命名 杂环大体可分为:单杂环和稠杂环两类。 1. 分类: 稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。 2.命名:杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为α ,β, γ, δ …)来编号。
如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小: 五元杂环中含有两个杂原子的体系叫唑(azole) 第二节五元杂环化合物 一.含有一个杂原子的五元杂环单环体系:呋喃,噻吩,吡咯。 (1)呋喃,噻分,吡咯的电子结构和光谱性质。 电子结构:这三个杂环化合物中,碳原子和杂原子均以sp2杂化轨道互相连接成σ健,并且在一个平面上,每个碳原子及杂原子上均有一个p轨道互相平行,在碳原子的p轨道中有一个p电子,在杂原子的p轨道中有两个p电子,形成一个环形的封闭的π电子的共轭体系。这与休克尔的4n+2规则相符,因此这些杂环或多或少的具有与苯类似的性质,故称之为芳香杂环化合物。 芳香性大小,试验结果表明: 光谱性质:IR: νc-H = 3077~3003cm-1,νN-H = 3500~3200 cm-1 (在非极性溶剂的稀溶液中,在3495 cm-1,有一尖峰。在浓溶液中则于3400 cm-1,有一尖峰。
在浓和淡的中间浓度时,两种谱带都有),杂环C=C伸缩振动:1600~1300 cm-1(有二至四个谱带)。 NMR:这些杂环化合物形成封闭的芳香封闭体系,与苯环类似,在核磁共振谱上,由于外磁场的作用而诱导出一个绕环转的环电流,此环电流可产生一个和外界磁场方向相反的感应磁场,在环外的质子,处在感应磁场回来的磁力线上,和外界磁场方向一致,在去屏蔽区域,故环上氢吸收峰移向低场。化学位移一般在7ppm左右。 呋喃:α-H δ=7.42ppm β-H δ=6.37ppm 噻吩:α-H δ=7.30ppm β-H δ=7.10ppm 吡咯:α-H δ=6.68ppm β-H δ=6.22ppm 二.呋喃,噻吩,吡咯的制备。 1.玉米心,稻糠,花生壳,大麦壳,高粱秆等用稀硫酸处理得戊糖,戊糖失 水得糠醛,再在400℃下加热,同时在催化剂ZnO,Cr 2O 3 存在下,失去一氧化碳 而得呋喃。 2.工业上制备噻吩是用丁烷,丁烯或丁二烯与硫磺混合,在600℃反应得到: 3.噻吩也可用琥珀酸钠盐与五硫化二磷一起加热反应制得:
第十七章 杂环化合物 1.写出下列化合物的构造式: (1) 3-甲基吡咯 (2) 碘化N,N -二甲基四氢吡咯 (3) 四氢呋喃 H CH 3 N O N CH 3 CH 3 + I - (4) β-氯代呋喃 (5)α-噻吩磺酸 (6) 糠醛,糠醇,糠酸 Cl O S SO 3H O CHO (7)γ-吡啶甲酸 (8)六氢吡啶 COOH N N H (9)β-吲哚乙酸 (10) 8-羟基喹啉 N H CH 2COOH N OH 2.用化学方法区别下列各组化合物: 解:(1)苯,噻吩和苯酚 加入三氯化铁水溶液,有显色反应的是苯酚。在浓硫酸存在下,与靛红一同加热显示蓝色的位噻吩。 (2) 吡咯和四氢吡咯 吡咯的醇溶液使浸过浓盐酸的松木片变成红色,而四氢吡咯不能。 (3) 苯甲醛和糠醛 糠醛在醋酸存在下与苯胺作用显红色。 3. 用化学方法,将下列混合物中的少量杂质除去。 解:(1) 苯中混有少量噻吩 在室温下用浓硫酸处理,噻吩在室温与浓硫酸反应生成α-噻吩磺酸而
溶于浓硫酸,苯不反应。 (2) 甲苯中混有少量吡啶 用浓盐酸处理,吡啶具有碱性而与盐酸生成盐溶于水相,分离出吡啶。 (3) 吡啶中有少量六氢吡啶。 六氢吡啶是仲胺,在氢氧化钠水溶液中与对甲基苯磺酰氯反应生成固体,过滤除去六氢吡啶。 4. 试解释为什么噻吩,吡咯,呋喃比苯容易发生亲电取代反应而吡啶比苯难发生? 解:噻吩,吡咯,呋喃是五元杂环化合物,属于多л-电子杂环化合物,芳环上电子云密度比苯大,所以易于发生亲电取代。而吡啶是六元杂环化合物,是缺л-电子杂环化合物,芳环上电子云密度小于苯环,所以难于发生亲电取代反应。 5. 完成下列反应式: 解: 1. O O CHO + CH 3CHO O CH=CHCHO 2. O CHO O CH 2OH + 3. N H /Pt N H 4. S C O C + O O AlCl 3 S C O HOOC 5.H 2/Pt O 2HCl Cl(CH 2)4Cl 2 NaCN NC(CH 2)4CN H 2O,H + - CH 3 CH 3 H O O
第十一章杂环化合物和生物碱 杂环化合物和生物碱广泛存在于自然界中,在动植物体内起着重要的生理作用。本章介绍杂环化合物的分类、命名、结构特点、性质及重要的杂环化合物,生物碱的一般性质、提取方法和重要的生物碱。 第一节杂环化合物 环状有机化合物中,构成环的原子除碳原子外还含有其它原子,且这种环具有芳香结构,则这种环状化合物叫做杂环化合物。组成杂环的原子,除碳以外的都叫做杂原子。常见的杂原子有氧、硫、氮等。前面学习过的环醚、内酯、内酐和内酰胺等都含有杂原子,但它们容易开环,性质上又与开链化合物相似,所以不把它们放在杂环化合物中讨论。 杂环化合物种类繁多,在自然界中分布很广。具有生物活性的天然杂环化合物对生物体的生长、发育、遗传和衰亡过程都起着关键性的作用。例如:在动、植物体内起着重要生理作用的血红素、叶绿素、核酸的碱基、中草药的有效成分——生物碱等都是含氮杂环化合物。一部分维生素、抗菌素、植物色素、许多人工合成的药物及合成染料也含有杂环。 杂环化合物的应用范围极其广泛,涉及医药、农药、染料、生物膜材料、超导材料、分子器件、贮能材料等,尤其在生物界,杂环化合物几乎随处可见。
一、杂环化合物的分类和命名 为了研究方便,根据杂环母体中所含环的数目,将杂环化合物分为单杂环和稠杂环两大类。最常见的单杂环有五元环和六元环。稠杂环有芳环并杂环和杂环并杂环两种。另外,可根据单杂环中杂原子的数目不同分为含一个杂原子的单杂环、含两个杂原子的单杂环等。 杂环化合物的命名在我国有两种方法:一种是译音命名法;另一种是系统命名法。 译音法是根据IUPAC 推荐的通用名,按外文名称的译音来命名,并用带“口”旁的同音汉字来表示环状化合物。例如: 呋喃 咪唑 吡啶 嘌呤 furan imidazole pyridine purine 杂环上有取代基时,以杂环为母体,将环编号以注明取代基的位次,编号一般从杂原子开始。含有两个或两个以上相同杂原子的单杂环编号时,把连有氢原子的杂原子编为1,并使其余杂原子的位次尽可能小;如果环上有多个不同杂原子时,按氧、硫、氮的顺序编号。例如: O N N N N N N H N
第十六章 杂环化合物 16.1 命名或写出结构 a. O COOH b. N N N H N OH HO c. N H CH 3 d.N N OH e. N CH 3 f. N COOH g. S SO 3H h. 糠醛 i.噻唑 3-甲基吲哚 8-羟基喹啉2-苯基苯并吡喃j. k. l. 答案: a. 2-呋喃甲酸 b. 2,6-二羟基嘌呤 c. 3-甲基吡咯 d. 5-羟基嘧啶 e.N-甲基吡咯 f.3-吡啶甲酸 2-噻吩磺酸 g. h.O CHO i. S N j. N H CH 3 k. N OH l. O 16.2 下列维生素各属哪一类化合物 a. 维生素A b. 维生素B 1,B 2,B 6,B 12 c. 维生素PP d. 维生素C e. 维生素D f. 维生素K g. 叶酸 答案:a. 维生素A 萜类 b. 维生素B 1,B 2,B 6,B 12 杂环化合物 c. 维生素PP 杂环化合物 d. 维生素C 单糖的衍生物 e. 维生素D 己三烯衍生物 f. 维生素K 醌 g. 叶酸 杂环化合物 16.4 下列化合物哪个可溶于酸,哪个可溶于碱,或既可溶于酸又溶于碱? a. N N CH 3 b. N N N H N NH 2 c. N H d. N CH 3 答案: a. 可溶于酸 b. 既可溶于酸又可溶于碱 c. 既可溶于碱又可溶于酸 e. 可溶于碱 16.5 写出下列化合物的互变平衡体系: a. 腺嘌呤 b. 鸟嘌呤 c. 尿嘧啶 d. 胞嘧啶 e. 胸腺嘧啶 f. 尿酸 答案: 参阅教材P293 . 16.6 核苷与核苷酸的结构有什么区别? (教材P294) 答案: 核苷由核糖或脱氧核糖与嘌呤或嘧啶化合而成,核苷酸则是核苷磷酸酯. 16.8 水粉蕈素是由一种蘑菇中分离出的有毒核苷,其系统命名为9-β-D -呋喃核糖基 嘌呤。写出水粉蕈素的结构式。 答案:
第17章 杂环化合物 班级 姓名 本章需掌握知识: 一.掌握常见杂环化合物的命名(呋喃、吡咯、噻吩、吡啶、四氢呋喃、四氢吡咯、四氢噻吩、哌啶 -六氢吡啶、喹啉); 二.呋喃、噻吩、吡咯都具有芳香性,亲电反应活性比苯更高;注意单取代和双取代时的定位规则; 呋喃可以发生[4+2]反应; 三.吡啶同样具有芳香性,亲电反应活性比苯弱;注意亲电取代反应的位置;要知道吡啶、哌啶是 常用的有机碱; 四.吡啶的特殊反应-齐齐巴宾(Chichibabin)反应;侧链氧化;知道喹啉的斯克洛浦(Skraup)合成法。 1.命名或写出结构式。 呋喃 噻吩 吡咯 吡啶 哌啶 喹啉 四氢呋喃 4-二甲基氨基吡啶 O H 3C CH 3 O CH=O N COOH N HO N H O N CH 3 2.完成反应 (1) O CHO NaOH + (2) O O (3) N (4) N Cl NaOH (5) S OCH 3 CH 3CONO 2 O S OCH 3 CH 3CONO 2 O (6) S NO 2 S NO 2 Br 2 Br 2 (7) N CH 3 CH 3 (8) O I(CH 2)4I 己二酸 己二胺 3.比较下列化合物亲电取代反应活性顺序(按活性由高到低排列)。 S N N H (A) (B) (C) (D) 4.下面化合物N 原子上的孤对电子是在整个分子所在的面上,还是垂直于分子所在面并解释原因。 N H N (1) (2) 5.如何除去苯中少量的噻吩? 6.环己烷中少量的吡啶? 7.二酸乙酯与吡啶作用生成不饱和的反丁烯二酸乙酯。吡啶在这里起什么作用?它比通常使用的氢氧化钾乙醇溶液有什么优点? Br O O EtO O OEt O EtO 8.比较下列化合物碱性的强弱(按照碱性由强到弱排列)。 N H N NH 2 (A) (B) (C) (D) NH 2 O
第十七章 杂环化合物 学习要求: 1. 掌握杂环化合物的分类和命名。 2. 掌握杂环化合物的化学性质。 3. 理解杂环化合物的结构与芳香性。 4.理解吡咯、吡啶的结构与性质的关系。 5.了解嘧啶、喹啉、嘌呤及吲哚。 6.了解几种重要生物碱(麻黄素、烟碱、阿托品、咖啡碱和茶碱)。 计划课时数 4课时 重点:杂环化合物的化学性质,杂环化合物的结构与芳香性。 难点:杂环化合物的结构与芳香性。 教学方法 采用模型、多媒体课件和板书相结合的课堂讲授方法。 引言 杂环化合物是指组成环的原子中含有除碳以外的原子(杂原子——常见的是N 、O 、S 等)的环状化合物。 杂环化合物不包括极易开环的含杂原子的环状化合物,例如: 本章我们只讨论芳香族杂环化合物。 杂环化合物是一大类有机物,占已知有机物的三分之一。杂环化合物在自然界分布很广、功用很多。例如,中草药的有效成分生物碱大多是杂环化合物;动植物体内起重要生理作用的血红素、叶绿素、核酸的碱基都是含氮杂环;部分维生素,抗菌素;一些植物色素、植物染料、合成染料都含有杂环。 § 杂环化合物的分类和命名 17.1.1 杂环大体可分为:单杂环和稠杂环两类。 NH O , ,,O O O O O O 杂环化合物 非芳香杂环芳杂环(符合休克尔规则的杂环)如如 O O NH N N H O ,………… ,,
稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。 17.1.2命名:杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为α ,β, γ, δ …)来编号。 如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小:
第十七章杂环化合物§17—1 杂环化合物的分类和命名 一、分类 杂环单杂环 五元环 六元环 苯环与单杂环的稠合杂环(苯并杂环) 两个或两个以上单杂环的稠合杂环 O S N H 稠杂环 N N N N N H N 二、命名 杂环的命名常用音译法,是按外文名词音译成带“口”字旁的同音汉字。 N H O S N N N (pyrrole)(furan)(thiophene)(pyridine) (pyrimidine) N N N N H N N H (quinoline)(indole)(purine) 吡咯呋喃噻吩吡啶 嘧啶喹啉吲哚嘌呤 取代杂环的命名: ①杂环的编号从杂原子起依次1,2,3 ……(或:α,β,γ……)。 ②如环上不止一个杂原子时,则从O、S、N的顺序依次编号。 ③有两个相同杂原子的,应从连有H原子或取代基的开始编号。
④编号时注意杂原子或取代基的位次之和最小。 N S NH2 H3C 5 12 43 2-氨基-4-甲基噻唑 N H1 2 3 4 5 N N1 2 3 4 5 CH3 吡唑 1-甲基咪唑 §17—2 五元杂环化合物一、结构 1.分子结构 O S N H 5 6 π 为共轭体系 电子= 6符合4n + 2具有芳性 富电子芳环 π 据现代物理方法证明: ①呋喃、吡咯、噻吩是一个平面结构。 ②环上的C原子和杂原子都是以SP2杂化轨道成键的。 ③五个没有杂化的P轨道垂直于环平面,形成闭合共轭体系。 ④环形π电子分布于杂环平面的上、下两方。
⑤共轭能 噻吩、吡咯、呋喃共轭能分别为125.5、90.4、71.1kJ/mol。2.芳香性 ①符合休克尔规则,π电子数为6。 ②芳香性比较(易取代、难加成、难氧化): 苯>噻吩>吡咯>呋喃 ③解释 环的稳定性:苯>噻吩>吡咯>呋喃 二、化学性质 1.亲电取代反应 ①卤代 O O O O Cl Br Cl + Cl 80% N H H 80%
第十七章-杂环化合物-练习及答案
第十七章 杂环化合物 1.写出下列化合物的构造式: (1) 3-甲基吡咯 (2) 碘化N,N -二甲基四氢吡咯 (3) 四氢呋喃 H CH 3 N O N CH 3 CH 3 + I - (4) β-氯代呋喃 (5)α-噻吩磺酸 (6) 糠醛,糠醇,糠酸 Cl O S SO 3H O CHO (7)γ-吡啶甲酸 (8)六氢吡啶 COOH N N H (9)β-吲哚乙酸 (10) 8-羟基喹啉 N H CH 2COOH N OH 2.用化学方法区别下列各组化合物: 解:(1)苯,噻吩和苯酚 加入三氯化铁水溶液,有显色反应的是苯酚。在浓硫酸存在下,与靛红一同加热显示蓝色的位噻吩。 (2) 吡咯和四氢吡咯 吡咯的醇溶液使浸过浓盐酸的松木片变成红色,而四氢吡咯不能。 (3) 苯甲醛和糠醛
糠醛在醋酸存在下与苯胺作用显红色。 3. 用化学方法,将下列混合物中的少量杂质除去。 解:(1) 苯中混有少量噻吩 在室温下用浓硫酸处理,噻吩在室温与浓硫酸反应生成α-噻吩磺酸而溶于浓硫酸,苯不反应。 (2) 甲苯中混有少量吡啶 用浓盐酸处理,吡啶具有碱性而与盐酸生成盐溶于水相,分离出吡啶。 (3) 吡啶中有少量六氢吡啶。 六氢吡啶是仲胺,在氢氧化钠水溶液中与对甲基苯磺酰氯反应生成固体,过滤除去六氢吡啶。 4. 试解释为什么噻吩,吡咯,呋喃比苯容易发生亲电取代反应而吡啶比苯难发生? 解:噻吩,吡咯,呋喃是五元杂环化合物,属于多л-电子杂环化合物,芳环上电子云密度比苯大,所以易于发生亲电取代。而吡啶是六元杂环化合物,是缺л-电子杂环化合物,芳环上电子云密度小于苯环,所以难于发生亲电取代反应。 5. 完成下列反应式: 解:
173 第12章 杂环化合物及生物碱 Heterocyclic Compounds and Natural Bases 重点提示:本章介绍了杂环化合物的分类和命名,分析了五员单杂环和六员单杂环化合物的结构——芳香杂环,重点阐述了五员单杂环化合物呋喃、噻吩和吡咯以及六员单杂环的典型代表吡啶的化学性质——芳香性,介绍了一些重要的、常见的杂环衍生物和生物碱。 12.1 杂环化合物(Heterocyclic Compounds) 分子中由碳原子和氧、硫、氮等其它原子形成的比较稳定的环状结构的化合物称为杂环化合物。杂环中除碳原子以外的其它原子称为杂原子。最常见的杂原子有氧、硫、氮等。例如: S N H N N N O 呋喃 噻吩 吡咯 吡啶 嘧啶 furan thiophene pyrrole pyridine pyrimidine 12.1.1杂环化合物的分类和命名(Classification and Nomenclature) 1.分类 按照杂环的结构,杂环化合物的分类和名称见表12-1。 2.命名 杂环化合物的命名在我国有两种方法:译音命名法和糸统命名法。目前普遍采用译音命名法。 (1)译音命名法 杂环母体的命名:杂环母体的名称是按英文名称音译,选用简单的同音汉字,加上 “口”字旁以表示环状化合物。详情见表12-1。 环上取代基的编号:含一个杂原子的单杂环上有取代基时,环上原子的编号从杂原子开始,并遵循最低糸列规则,使各取代基的位次尽可能小,也可用希腊字母来表示取代基的位次;单杂环上有不同杂原子时,则按氧、硫、氮的顺序编号;如果单杂环上的两个杂原子都是氮,则由连有氢或取代基的氮原子开始编号,并使杂原子的位次尽可能小;稠杂环的编号有特定的编号顺序(见表12-1)。例如: O C HO N C O O H C 2H 5 O N S C H 3 C H 3 1 2 345 4 1 6 2 3 51 2 345 1 2 345 2-呋喃甲醛 3-吡啶甲酸 2-甲基-5-乙基呋喃 5-甲基噻
第十七章 杂环化合物 一. 学习目的和要求: 1. 掌握杂环化合物的分类和命名。 2. 掌握五元单杂环、六元单杂环化合物的化学性质。 3. 理解杂环化合物的结构与芳香性。 4. 理解吡咯、吡啶的结构与性质的关系。 5. 了解嘧啶、喹啉、嘌呤及吲哚。 6. 了解几种重要生物碱(麻黄素、烟碱、阿托品、咖啡碱和茶碱)。 二. 本章节重点、难点: 杂环化合物的化学性质,杂环化合物的结构与芳香性。杂环化合物的结构与芳香性。 引言 杂环化合物是指组成环的原子中含有除碳以外的原子(杂原子——常见的是N 、O 、S 等)的环状化合物。 杂环化合物 非芳香杂环芳杂环(符合休克尔规则的杂环)如 如 O O NH N N H O , ………… ,, 杂环化合物不包括极易开环的含杂原子的环状化合物,例如: NH O , , , O O O O O O 本章我们只讨论芳香族杂环化合物。 在具有生物活性的天然化合物中,大多数是杂环化合物。例如,中草药的有效成分生物碱大多是杂环化合物;动植物体内起重要生理作用的血红素、叶绿素、核酸的碱基都是含氮杂环;一些维生素、抗菌素、植物色素、植物染料、合成染料都含有杂环。 17.1 杂环化合物的分类和命名 17.1.1 杂环从结构上大体分为:单杂环和稠杂环两类。
17.1.2命名 杂环化合物的命名比较复杂,现在一般通用的有两种类型的命名方法。一种是按照化合物的西文名称音译,另一种是根据相应的碳环化合物名称类比命名。杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。 1.单杂环的命名方法 第一步,写出杂环化合物的基本名称 fura thiophene imidazole oxazole 呋喃 吡咯 噻吩 咪唑 噁唑 噻唑 吡喃 吡啶 嘧啶 吡嗪