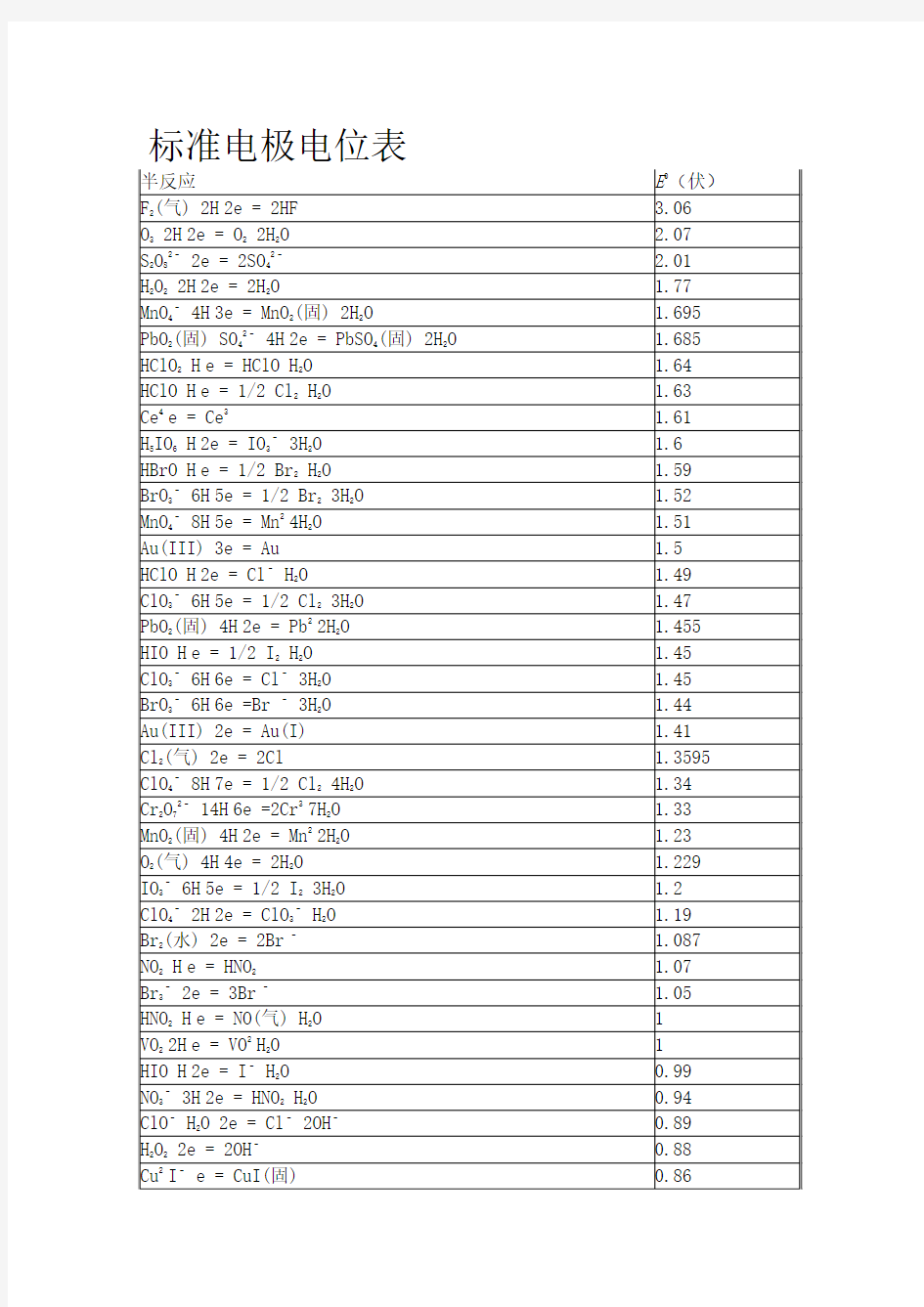
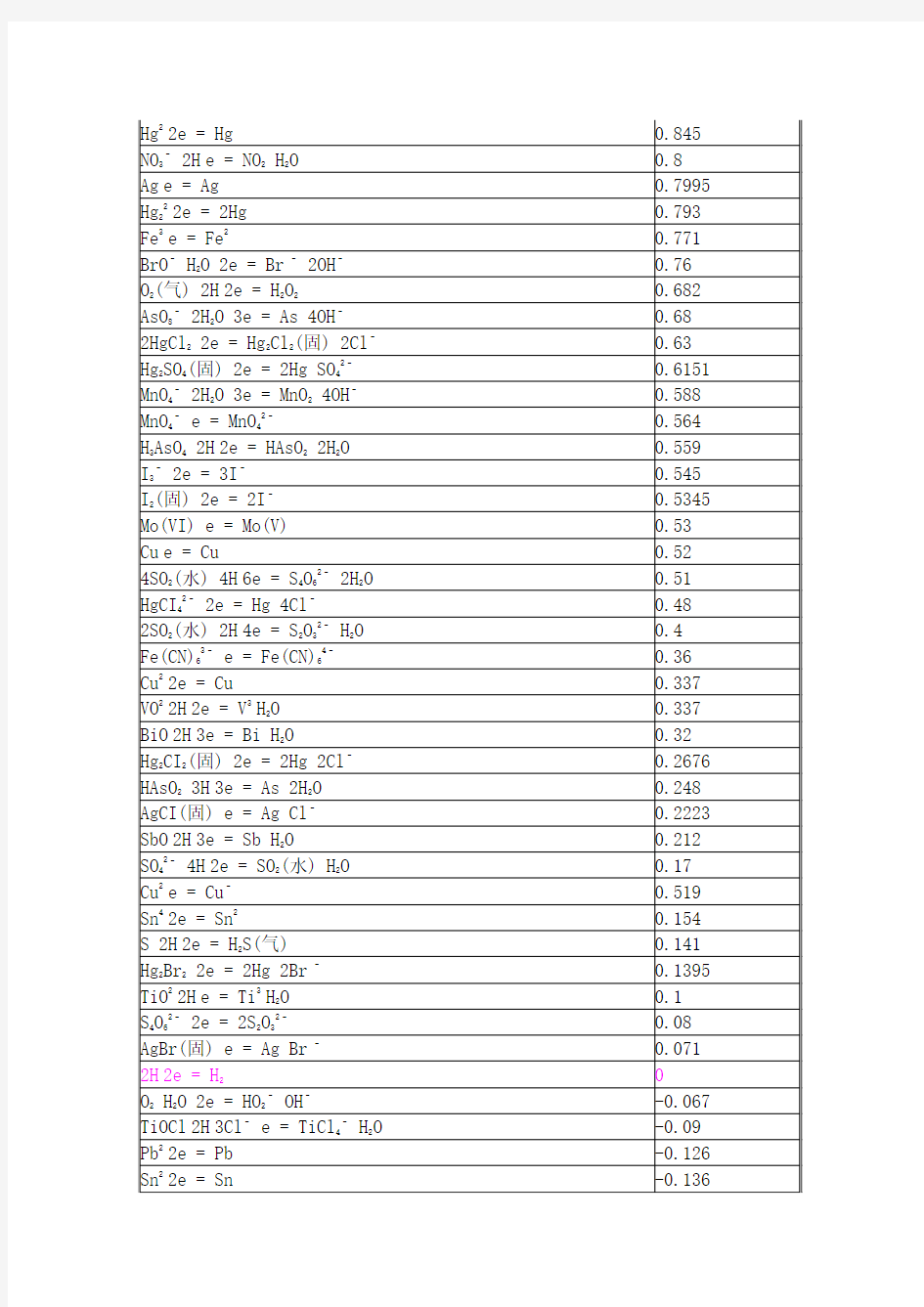
标准电极电位表
https://www.doczj.com/doc/801529923.html,/view/439955.htm 标准电极电位 科技名词定义 中文名称:标准电极电位 英文名称:standard electrode potential 定义:半电池的所有反应物质活度为1mol时,电极相对于标准氢电极电位的电位值,即该电极与标准氢电极组成的电池的电动势。对给定的电极说,其标准电极电位是一个常数。 应用学科:机械工程(一级学科);分析仪器(二级学科);电化学式分析仪器-电化学式分析仪器一般名词(三级学科) 本内容由全国科学技术名词审定委员会审定公布 目录 概况 概念 相关问题 概况 标准电极电位是以标准氢原子作为参比电极,即氢的标准电极电位值定为0,与氢标准电极比较,电位较高的为正,电位较低者为负。如氢的标准电极电位H2←→H+ 为0.000V,锌标准电极电位Zn ←→Zn2+ 为-0.762V,铜的标准电极电位Cu ←→Cu2+为+0.337V。 金属浸在只含有该金属盐的电解溶液中,达到平衡时所具有的电极电位,叫做该金属的平衡电极电位。当温度为25℃,金属离子的有效浓度为1mol/L(即活度为1)时测得的平衡电位,叫做标准电极电位。 概念 什么叫标准电极电位
电极电位是表示某种离子或原子获得电子而放还原的趋势。如将某一金属放入它的溶液中(规定溶液中金属离子的浓度为lm),在25℃时,金属电极与标准氢电极(电极电位指定为零)之间的电位差,叫做该金属的标准电极电位。表7-2列出一些金属、非金属以及同一种金属具有不同价态的离子的标准电极电位,这些数值都是与标准氢电极比较而得出的。 相关问题 为了能正确使用标准电极电位表(课本或化学手册上均有较详细的表),现将有关的一些问题叙述如下: (1)在M+ + ne-→ M电极反应中,M叫做物质的还原态。M+ 叫做物质的氧化态,物质的还原态和氧化态构成氧化还原电对。电对也常用符号来表示,例如Zn/Zn是一个电对,Cu/Cu也是一个电对等。 (2)在表中所列的标准电极电位的正、负数值,不因电极反应进行的方向而改变。例如,不管电极反应是按Zn+2e=Zn,还是按Zn=Zn+2e的方式进行,电对(Zn/Zn 或Zn/Zn)的标准电极电位总是负号, (3)在表中,物质的还原态的还原能力自下而上依次增强;物质的氧化态的氧化能力自上而下依次增强。具体地说,电对的电极电位数值越小,在表中的位置越高,物质的还原态的还原能力越强,电对的电极电位数值越大,在表中的位置越低,物质的氧化态的氧化能力越强。例如电对Zn/Zn的标准电极电位的数值为-0.76伏较Cu数值+0.34伏为小,所以Zn原子较Cu原子容易失去电子,即Zn是较强的还原剂。 (4)物质的还原态的还原能力越强,其对应的氧化态的氧化能力就越弱;物质氧化态的氧化能力越强,其对应的还原态的还原能力就越弱。例如表7—2中K是最强的还原剂,其对应的K则是最弱的氧化剂,F2是最强的氧化剂,其对应的F则是最弱的还原剂。 (5)只有电极电位数值较小的物质的还原态与电极电位数值较大的物质的氧化态之 间才能发生氧化还原反应,两者电极电位的差别越大,反应就进行得越完全。
实验八 电位差计的原理和使用 【实验目的】 1.掌握电位差计的工作原理和正确使用方法,加深对补偿法测量原理的理解和运用。 2.训练简单测量电路的设计和测量条件的选择。 【实验仪器】 UJ31型直流电位差计、SS1791双路输出直流稳压电源、标准电池、标准电阻、AC15/5灵敏电流计、FJ31型直流分压箱、滑线变阻器、直流电阻箱、待校验电表、待测干电池、待测电阻、开关和导线等。 【实验原理】 如图5.8.1所示,电位差计的工作原理是根据电 压补偿法,先使标准电池E n 与测量电路中的精密电阻R n 的两端电势差U st 相比较,再使被测电势差(或电压)E x 与准确可变的电势差U x 相比较,通过检流计G 两次指零来获得测量结果。电压补偿原理也可从电势差计的“校准”和“测量”两个步骤中理解。 校准:将K 2打向“标准”位置,检流计和校准电路联接,R n 取一预定值,其大小由标准电池E S 的电动势确定;把K 1合上,调节R P ,使检流计G 指零,即E n = IR n ,此时测量电路的工作电流已调好为 I = E n /R n 。校准工作电流的目的:使测量电路中的R x 流过一个已知的标准电流I o ,以保证R x 电阻盘上的电压示值(刻度值)与其(精密电阻R x 上的)实际电压值相一致。 测量:将K 2打向“未知”位置,检流计和被测电路联接,保持I o 不变(即R P 不变),K 1合上,调节R x ,使检流计G 指零,即有E x = U x = I o R x 。 由此可得x n n x R R E E = 。由于箱式电位差计面板上的测量盘是根据R x 电阻值标出其对应的电压刻度值,因此只要读出R x 电阻盘刻度的电压读数,即为被测电动势E x 的测量值。 所以,电位差计使用时,一定要先“校准”,后“测量”,两者不能倒置。 【实验装置】 1. UJ31型电位差计 UJ31型箱式电位差计是一种测量低电势的电位差计,其测量范围为 mV .V 1171-μ(1K 置1?档)或mV V 17110-μ(1K 置10?档)。使用 图5.8.1 电位差计的工作原理 图5.8.2 UJ31型电位差计面板图 + - -++- + -标准 检流计 5.7-6.4V 未知1 未知2 K 1 R P2 R P3 R P1 R n K 2 I II III 1.01×10 ×1 未知1 未知2 标准断断粗 中 细 ×1 ×0.1 ×0.001 粗细短路
标准电极电势表 标准电极电势可以用来计算化学电池或原电池的电化学势或电极电势。本表中所给出的电极电势以标准氢电极为参比电极,溶液中离子有效浓度为1mol/L ,气体分压为100kPa ,温度为298K ,所有离子的数据都在水溶液中测得。[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。 注:(s ) – 固体;(l ) – 液体;(g ) – 气体;(aq ) – 水溶液;(Hg ) – 汞齐。 半反应 E° (V)[注 1] 来源 Ba + + e ? Ba(s ) ?4.38 [10][1][3] Sr + + e ? Sr(s ) ?4.10 [11][1][3] Ca + + e ? Ca(s ) ?3.8 [11][1][3] Pr 3+ + e ? Pr 2+ ?3.1 [11] ?N 2(g ) + H + + e ? HN 3(aq ) ?3.09 [6] Li + + e ? Li(s ) ?3.0401 [5] N 2(g ) + 4?H 2O + 2?e ? 2?NH 2OH (aq ) + 2?OH ? ?3.04 [6] Cs + + e ? Cs(s ) ?3.026 [5] Ca(OH) 2(s ) + 2?e ? Ca(s ) + 2 OH ? ?3.02 [11] Rb + + e ? Rb(s ) ?2.98 [4] K + + e ? K(s ) ?2.931 [5]
半反应E° (V)[注 1]来源Mg+ + e? Mg(s) ?2.93 [10] Ba2+ + 2?e? Ba(s) ?2.912 [5] ? La(s) + 3OH??2.90 [5] La(OH) Fr+ + e? Fr(s) ?2.9 [11] Sr2+ + 2?e? Sr(s) ?2.899 [5] ? Sr(s) + 2?OH??2.88 [11] Sr(OH) Ca2+ + 2?e? Ca(s) ?2.868 [5] Eu2+ + 2?e? Eu(s) ?2.812 [5] Ra2+ + 2?e? Ra(s) ?2.8 [5] Yb2+ + 2?e? Yb(s) ?2.76 [11][1] Na+ + e? Na(s) ?2.71 [5][9] Sm2+ + 2?e? Sm(s) ?2.68 [11][1] No2+ + 2?e? No(s) ?2.50 [11] ?Hf(s) + 4?OH??2.50 [11] HfO(OH)
1 在酸性溶液中 (298K) 电对方程式 Eq/V Li(I)-(0) Li++e-=Li -3.0401 Cs(I)-(0) Cs++e-=Cs -3.026 Rb(I)-(0) Rb++e-=Rb -2.98 K(I)-(0) K++e-=K -2.931 Ba(II)-(0) Ba2++2e-=Ba -2.912 Sr(II)-(0) Sr2++2e-=Sr -2.89 Ca(II)-(0) Ca2++2e-=Ca -2.868 Na(I)-(0) Na++e-=Na -2.71 La(III)-(0) La3++3e-=La -2.379 Mg(II)-(0) Mg2++2e-=Mg -2.372 Ce(III)-(0) Ce3++3e-=Ce -2.336 H(0)-(-I) H2(g)+2e-=2H--2.23 Al(III)-(0) AlF63-+3e-=Al+6F--2.069 Th(IV)-(0) Th4++4e-=Th -1.899 Be(II)-(0) Be2++2e-=Be -1.847 U(III)-(0) U3++3e-=U -1.798 Hf(IV)-(0) HfO2++2H++4e-=Hf+H2O -1.724 Al(III)-(0) Al3++3e-=Al -1.662 Ti(II)-(0) Ti2++2e-=Ti -1.630 Zr(IV)-(0) ZrO2+4H++4e-=Zr+2H2O -1.553 Si(IV)-(0) [SiF6]2-+4e-=Si+6F--1.24 Mn(II)-(0) Mn2++2e-=Mn -1.185 Cr(II)-(0) Cr2++2e-=Cr -0.913 Ti(III)-(II) Ti3++e-=Ti2+-0.9 B(III)-(0) H3BO3+3H++3e-=B+3H2O -0.8698 *Ti(IV)-(0) TiO2+4H++4e-=Ti+2H2O -0.86 Te(0)-(-II) Te+2H++2e-=H2Te -0.793 Zn(II)-(0) Zn2++2e-=Zn -0.7618 Ta(V)-(0) Ta2O5+10H++10e-=2Ta+5H2O -0.750 Cr(III)-(0) Cr3++3e-=Cr -0.744 Nb(V)-(0) Nb2O5+l0H++10e-=2Nb+5H2O -0.644 As(0)-(-III) As+3H++3e-=AsH3 -0.608 U(IV)-(III) U4++e-=U3+-0.607 Ga(III)-(0) Ga3++3e-=Ga -0.549 P(I)-(0) H3PO2+H++e-=P+2H2O -0.508 P(III)-(I) H3PO3+2H++2e-=H3PO2+H2O -0.499 *C(IV)-(III) 2CO2+2H++2e-=H2C2O4 -0.49 Fe(II)-(0) Fe2++2e-=Fe -0.447 Cr(III)-(II) Cr3++e-=Cr2+-0.407
在酸性溶液中(298K) 电对方程式E/V Li(I)-(0)Li++e-=Li-Cs(I)-(0)Cs++e-=Cs-Rb(I)-(0)Rb++e-=Rb- K(I)-(0)K++e-=K-Ba(II)-(0)Ba2++2e-=Ba-Sr(II)-(0)Sr2++2e-=Sr-Ca(II)-(0)Ca2++2e-=Ca-Na(I)-(0)Na++e-=Na-La(III)-(0)La3++3e-=La-Mg(II)-(0)Mg2++2e-=Mg-Ce(III)-(0)Ce3++3e-=Ce- H(0)-(-I)H2(g)+2e-=2H--Al(III)-(0)AlF63-+3e-=Al+6F--Th(IV)-(0)Th4++4e-=Th-Be(II)-(0)Be2++2e-=Be- U(III)-(0)U3++3e-=U-Hf(IV)-(0)HfO2++2H++4e-=Hf+H2O-Al(III)-(0)Al3++3e-=Al-Ti(II)-(0)Ti2++2e-=Ti-Zr(IV)-(0)ZrO2+4H++4e-=Zr+2H2O-Si(IV)-(0)[SiF6]2-+4e-=Si+6F--Mn(II)-(0)Mn2++2e-=Mn-Cr(II)-(0)Cr2++2e-=Cr-Ti(III)-(II)Ti3++e-=Ti2+- B(III)-(0)H3BO3+3H++3e-=B+3H2O-*Ti(IV)-(0)TiO2+4H++4e-=Ti+2H2O-Te(0)-(-II)Te+2H++2e-=H2Te-Zn(II)-(0)Zn2++2e-=Zn-Ta(V)-(0)Ta2O5+10H++10e-=2Ta+5H2O-Cr(III)-(0)Cr3++3e-=Cr-Nb(V)-(0)Nb2O5+l0H++10e-=2Nb+5H2O-As(0)-(-III)As+3H++3e-=AsH3- U(IV)-(III)U4++e-=U3+-Ga(III)-(0)Ga3++3e-=Ga-
标准电极电位表 电极反应E0(V)F2(g) + 2H+ + 2e = 2HF 3.06 O3 + 2H+ + 2e = O2 + 2H2O 2.07 S2O82– + 2e = 2SO42– 2.01 H2O2 + 2H+ + 2e = 2H2O 1.77 MnO4– + 4H+ + 3e = MnO2(s) + 2H2O 1.695 PbO2(s) + SO42– + 4H+ + 2e = PbSO4(s) + 2H2O 1.685 HClO2 + H+ + e = HClO + H2O 1.64 HClO + H+ + e = 1/2 Cl2 + H2O 1.63 Ce4+ + e = Ce3+ 1.61 H5IO6 + H+ + 2e = IO3– + 3H2O 1.60 HBrO + H+ + e = 1/2 Br2 + H2O 1.59 BrO3– + 6H+ + 5e = 1/2 Br2 + 3H2O 1.52 MnO4– + 8H+ + 5e = Mn2+ + 4H2O 1.51 Au(III) + 3e = Au 1.50 HClO + H+ + 2e = Cl– + H2O 1.49 ClO3– + 6H+ + 5e = 1/2 Cl2 + 3H2O 1.47 PbO2(s) + 4H+ + 2e = Pb2+ + 2H2O 1.455 HIO + H+ + e = 1/2 I2 + H2O 1.45 ClO3– + 6H+ + 6e = Cl– + 3H2O 1.45 BrO3– + 6H+ + 6e =Br – + 3H2O 1.44 Au(III) + 2e = Au(I) 1.41 Cl2(g) + 2e = 2Cl- 1.3595
标准电极电势表 目录[隐藏] 电极电势的产生—双电层理论 定义 公式 电极电势内容 标准电极电势表 [编辑本段] 电极电势的产生—双电层理论 德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double lay er theory)解释电极电势的产生的原因。当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。金属性质越活泼,这种趋势就越大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度越大,这种趋势也越大。在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。电极电势以符号E Mn+/ M表示, 单位为V(伏)。如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。 电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。 [编辑本段] 定义 标准电极电势是可逆电极在标准状态及平衡态时的电势,也就是标准态时的电极电势. 标准电极电势有很大的实用价值,可用来判断氧化剂与还原剂的相对强弱,判断氧化还原反应的进行方向,计算原电池的电动势、反应自由能、平衡常数,计算其他半反应的标准电极电势,等等。将半反应按电极电势由低到高排序,可以得到标准电极电势表,可十分简明地判断氧还反应的方向. [编辑本段] 公式
2005年电化学和电分析化学 1、标准电极电位和条件电位 各种标准状态下的被测电极与标准氢电极组成原电池,标准氢电极作为阳极(发生那氧化反应)用实验的方法测得的该电池电动势的数值,就是被测电极的标准电极电位。 对于实际体系,在某一特定条件下,该电对的氧化型的总浓度和还原型的总浓度均为1mol/L时的实际电位,就叫条件电位。 2、双电层 当电极插入溶液中后,在电极和溶液之间便有一个界面。如果导体电荷带正电荷,会对溶液中的负离子产生吸引作用,同时对正离子也有一定的排斥作用。结果在电极附近就会聚集很多负离子,叫做吸附层,在吸附层外一微小区域,由于静电引力的存在,也有电荷过剩现象存在,称为扩散层,这种结构就叫做双电层。3、极限电流和扩散电流 在电化学反应中,电解开始后,随着外加电压的继续增大,电流急剧上升,最后当外加电压增加到一定数值时,电流不再增加,达到一个极限值。此时的电流称为极限电流。极限电流与残余电流之差称为扩散电流。 4、半电池的形式电势 5、交流伏安法 在电路里负载两端并联一电压表,电路里串联电流表,通过电压和电流计算出阻抗,包括电容的容抗和电感的感抗。 二简答题 1、何谓循环伏安法?主要用于研究什么?从可逆性角度简述循环伏安曲线有几 类?具体依据及特点? 循环伏安法是以快速线性扫描的形式施加以三角波电压于工作电极上,得到循环伏安曲线的一种方法。 一般用于研究电极过程的可逆性、吸附性以及测定可逆体系标准电极电位,鉴别电极反应产物和研究化学反应控制的各个电极过程。 从可逆性的角度可有三类循环伏安曲线:(1)可逆过程ΔEp= 2.2RT/nF = 56.5/n mv,一般说来,ΔEp与实验条件有关,其数值在55/n ~65/n mv 时,可判断为
第三章 1.自发形成的双电层和强制形成的双电层在性质和结构上有无不同为什么2.理想极化电极和不极化电极有什么区别它们在电化学中有什么重要用途答:当电极反应速率为0,电流全部用于改变双电层的电极体系的电极称为理想极化电极,可用于界面结构和性质的研究。理想不极化电极是指当电极反应速率和电子反应速率相等时,极化作用和去极化作用平衡,无极化现象,通向界面的电流全部用于电化学反应,可用作参比电极。 3.什么是电毛细现象为什么电毛细曲线是具有极大值的抛物线形状 答:电毛细现象是指界面张力随电极电位变化的现象。溶液界面存在双电层,剩余电荷无论带正电还是负电,同性电荷间相互排斥,使界面扩大,而界面张力力图使界面缩小,两者作用效果相反,因此带电界面的张力比不带电时小,且电荷密度越大,界面张力越小,因此电毛细曲线是具有极大值的抛物线形状。 4.标准氢电极的表面剩余电荷是否为零用什么办法能确定其表面带电状况答:不一定,标准氢电极电位为0指的是氢标电位,是人为规定的,电极表面剩余电荷密度为0时的电位指的是零电荷电位,其数值并不一定为0;因为形成相间电位差的原因除了离子双电层外,还有吸附双电层\ 偶极子双电层\金属表面电位。可通过零电荷电位判断电极表面带电状况,测定氢标电极的零电荷电位,若小于0则电极带正电,反之带负电。 5.你能根据电毛细曲线的基本规律分析气泡在电极上的附着力与电极电位有什么关系吗为什么有这种关系(提示:液体对电极表面的润湿性越高,气体在电极表面的附着力就越小。)6.为什么在微分电容曲线中,当电极电位绝对值较大时,会出现“平台”7.双电层的电容为什么会随电极电位变化试根据双电层结构的物理模型和数学模型型以解释。 8.双电层的积分电容和微分电容有什么区别和联系9.试述交流电桥法测量微分电容曲线的原理。10.影响双电层结构的主要因素是什么为什么 答:静电作用和热运动。静电作用使符号相反的剩余电荷相互靠近,贴于电极表面排列,热运动使荷电粒子外散,在这两种作用下界面层由紧密层和分散层组成。11.什么叫ψ1电位能否说ψ1电位的大小只取决于电解质总浓度而与电解质本性无关ψ1电位的符号是否总是与双电层总电位的符号一致为什么 答:距离电极表面d处的电位叫ψ1电位。不能,因为不同的紧密层d的大小不同,而紧密层的厚度显然与电解质本性有关,所以不能说ψ1电位的大小只取决于电解质总浓度而与电解质本性无关。当发生超载吸附时ψ1电位的符号与双电层总电位的符号不一致。 12.试述双电层方程式的推导思路。推导的结果说明了什么问题 13.如何通过微分电容曲线和电毛细曲线的分析来判断不同电位下的双电层结构答:14.比较用微分电容法和电毛细曲线法求解电极表面剩余电荷密度的优缺点。15.什么是特性吸附哪些类型的物质具有特性吸附的能力答:溶液中的各种粒子还可能因非静电作用力而发生吸附称为特性吸附。大部分无机阴离子,部分无机阳离子以及表面活性有机分子可发生特性吸附。
ELECTROCHEMICAL SERIES Petr Vany′sek There are three tables for this electrochemical series. Each table lists standard reduction potentials, E° values, at 298.15 K (25°C), and at a pressure of 101.325 kPa (1 atm). Table1is an alphabetical listing of the elements, according to the symbol of the elements. Thus, data for silver (Ag) precedes those for aluminum (Al). Table 2 lists only those reduction reactions which have E° values positive in respect to the standard hydrogen electrode. In Table 2, the reactions are listed in the order of increasing positive potential, and they range from 0.0000 V to + 3.4 V. Table 3 lists only those reduction potentials which have E° negative with respect to the standard hydrogen electrode. In Table 3, the reactions are listed in the order of decreasing potential and range from 0.0000 V to –4.10 V. The reliability of the potentials is not the same for all the data. Typically, the values with fewer significant figures have lower reliability. The values of reduction potentials, in particular those of less common reactions, are not definite; they are subject to occasional revisions. Abbreviations: ac = acetate; bipy=2,2′-dipyridine, or bipyridine; en=ethylenediamine; phen=1,10-phenanthroline. REFERENCES 1.G. Milazzo, S. Caroli, and V. K. Sharma, Tables of Standard Electrode Potentials, Wiley, Chichester, 1978. 2. A. J. Bard, R. Parsons, and J. Jordan, Standard Potentials in Aqueous Solutions, Marcel Dekker, New York, 1985. 3.S. G. Bratsch, J. Phys. Chem. Ref. Data, 18, 1—21, 1989. TABLE 1 Alphabetical Listing Reaction E°/V Ac3+ + 3 e 1 Ac–2.20 Ag+ + e 1 Ag0.7996 Ag2+ + e 1 Ag+ 1.980 Ag(ac) + e 1 Ag + (ac)–0.643 AgBr + e 1 Ag + Br–0.07133 AgBrO3 + e 1 Ag + BrO3–0.546 Ag2C2O4 + 2 e 1 2 Ag + C2O42–0.4647 AgCl + e 1 Ag + Cl–0.22233 AgCN + e 1 Ag + CN––0.017 Ag2CO3 + 2 e 1 2 Ag + CO32–0.47 Ag2CrO4 + 2 e 1 2 Ag + CrO42–0.4470 AgF + e 1 Ag + F–0.779 Ag4[Fe(CN)6] + 4 e 1 4 Ag + [Fe(CN)6]4–0.1478 AgI + e 1 Ag + I––0.15224 AgIO3 + e 1 Ag + IO3–0.354 Ag2MoO4 + 2 e 1 2 Ag + MoO42–0.4573 AgNO2 + e 1 Ag + 2 NO2–0.564 Ag2O + H2O + 2 e 1 2 Ag + 2 OH–0.342 Ag2O3 + H2O + 2 e 1 2 AgO + 2 OH–0.739 Ag3+ + 2 e 1 Ag+ 1.9 Ag3+ + e 1 Ag2+ 1.8 Ag2O2 + 4 H+ + e 1 2 Ag + 2 H2O 1.802 2 AgO + H2O + 2 e 1 Ag2O + 2 OH–0.607 AgOCN + e 1 Ag + OCN–0.41 Ag2S + 2 e 1 2 Ag + S2––0.691 Ag2S + 2 H+ + 2 e 1 2 Ag + H2S–0.0366 AgSCN + e 1 Ag + SCN–0.08951 Ag2SeO3 + 2 e 1 2 Ag + SeO42–0.3629 Ag2SO4 + 2 e 1 2 Ag + SO42–0.654 Ag2WO4 + 2 e 1 2 Ag + WO42–0.4660 Al3+ + 3 e 1 Al–1.662 Al(OH)3 + 3 e 1 Al + 3 OH––2.31Al(OH)4– + 3 e 1 Al + 4 OH––2.328 H2AlO3– + H2O + 3 e 1 Al + 4 OH––2.33 AlF63– + 3 e 1 Al + 6 F––2.069 Am4+ + e 1 Am3+ 2.60 Am2+ + 2 e 1 Am–1.9 Am3+ + 3 e 1 Am–2.048 Am3+ + e 1 Am2+–2.3 As + 3 H+ + 3 e 1 AsH3–0.608 As2O3 + 6 H+ + 6 e 1 2 As + 3 H2O0.234 HAsO2 + 3 H+ + 3 e 1 As + 2 H2O0.248 AsO2– + 2 H2O + 3 e 1 As + 4 OH––0.68 H3AsO4 + 2 H+ + 2 e–1 HAsO2 + 2 H2O0.560 AsO43– + 2 H2O + 2 e 1 AsO2– + 4 OH––0.71 At2 + 2 e 1 2 At–0.3 Au+ + e 1 Au 1.692 Au3+ + 2 e 1 Au+ 1.401 Au3+ + 3 e 1 Au 1.498 Au2+ + e –1 Au+ 1.8 AuOH2+ + H+ + 2 e 1 Au+ + H2O 1.32 AuBr2– + e 1 Au + 2 Br–0.959 AuBr4– + 3 e 1 Au + 4 Br–0.854 AuCl4– + 3 e 1 Au + 4 Cl– 1.002 Au(OH)3 + 3 H+ + 3 e 1 Au + 3 H2O 1.45 H2BO3– + 5 H2O + 8 e 1 BH4– + 8 OH––1.24 H2BO3– + H2O + 3 e 1 B + 4 OH––1.79 H3BO3 + 3 H+ + 3 e 1 B + 3 H2O–0.8698 B(OH)3 + 7 H+ + 8 e 1 BH4– + 3 H2O–0.481 Ba2+ + 2 e 1 Ba–2.912 Ba2+ + 2 e 1 Ba(Hg)–1.570 Ba(OH)2 + 2 e 1 Ba + 2 OH––2.99 Be2+ + 2 e 1 Be–1.847 Be2O32– + 3 H2O + 4 e 1 2 Be + 6 OH––2.63 Reaction E°/V
等电位联结:将建筑物内部和建筑物本身的所有的大金属构件全部用母排或导线进行电气连接,使整个建筑物的正常非带电导体处于电气连通状态。等电位联结分为总等电位联结(MEB)、辅助等电位联结(SEB)、局部等电位联结(LEB)。 什么是等电位联结?就是将建筑物内部和建筑物本身的所有的大金属构件全部用母排或导线进行电气连接,使整个建筑物的正常非带电导体处于电气连通状态。 怎样做等电位联结?等电位联结分为:总等电位联结(MEB)和局部等电位联结(LEB) 。国家建筑标准设计图集《等电位联结安装》(02D501-2)对建筑物的等电位联结具体做法作了详细介绍。 总等电位联结做法是通过每一进线配电箱近旁的总等电位联结母排将下列导电部分互相连通:进线配电箱的PE(PEN)母排、公用设施的上、下水、热力、煤气等金属管道、建筑物金属结构和接地引出线。它的作用在于降低建筑物内间接接触电压和不同金属部件间的电位差,并消除自建筑物外经电气线路和各种金属管道引入的危险故障电压的危害。 局部等电位联结做法是在一局部范围内通过局部等电位联结端子板将下列部分用 6mm2黄绿双色塑料铜芯线互相连通:柱内墙面侧钢筋、壁内和楼板中的钢筋网、金属结构件、公用设施的金属管道、用电设备外壳(可不包括地漏、扶手、浴巾架、肥皂盒等孤立小物件)等。一般是在浴室、游泳池、喷水池、医院手术室、农牧场等场所采用。要求等电位联结端子板与等电位联结范围内的金属管道等金属末端之间的电阻不超过3Ω。 等电位联结有什么作用?主要是各种保护作用: 1.雷击保护IEC标准中指出,等电位连接是内部防雷措施的一部分。当雷击建筑物时,雷电传输有梯度,垂直相邻层金属构架节点上的电位差可能达到10kV量级,危险极大。但等电位联结将本层柱内主筋、建筑物的金属构架、金属装置、电气装置、电信装置等连接起来,形成一个等电位连接网络,可防止直击雷、感应雷、或其他形式的雷,避免火灾、爆炸、生命危险和设备损坏。 2.静电防护静电是指分布在电介质表面或体积内,以及在绝缘导体表面处于静止状态的电荷。传送或分离固体绝缘物料、输送或搅拌粉体物料、流动或冲刷绝缘液体、高速喷射蒸汽或气体,都会产生和积累危险的静电。静电电量虽然不大,但电压很高,容易产生火花放电,引起火灾、爆炸或电击。等电位联结可以将静电电荷收集并传送到接地网,从而消除和防止静电危害。 3.电磁干扰防护在供电系统故障或直击雷放电过程中,强大的脉冲电流对周围的导线或金属物形成电磁感应,敏感电子设备处于其中,可以造成数据丢失、系统崩溃等。通常,屏蔽是减少电磁波破坏的基本措施,在机房系统分界面做的等电位连接,由于保证所有屏蔽和设备外壳之间实现良好的电气连接,最大限度减小了电位差,外部电流不能侵入系统,得以有效防护了电磁干扰。 4.触电保护1999年6月开始实行的新的建设部《住宅设计规范》中,有一项不太引人瞩目的条款:城镇新建住宅中的卫生间宜做等电位连接。专家通俗的解释是:浴室等电位连接就是保护你不会在洗澡的时候被电着。电热水器、坐浴盆、电热墙,浴霸以及传统的电灯……都有漏电的危险,电气设备外壳虽然与PE线联结,当仍可能会出现足以引起伤害的
标准电极电位表 半反应E0(伏) F2(气) + 2H+ + 2e = 2HF 3.06 O3 + 2H+ + 2e = O2 + 2H2O 2.07 S2O82– + 2e = 2SO42– 2.01 H2O2 + 2H+ + 2e = 2H2O 1.77 MnO4– + 4H+ + 3e = MnO2(固) + 2H2O 1.695 PbO2(固) + SO42– + 4H+ + 2e = PbSO4(固) + 2H2O 1.685 HClO2 + H+ + e = HClO + H2O 1.64 HClO + H+ + e = 1/2 Cl2 + H2O 1.63 Ce4+ + e = Ce3+ 1.61 H5IO6 + H+ + 2e = IO3– + 3H2O 1.60 HBrO + H+ + e = 1/2 Br2 + H2O 1.59 BrO3– + 6H+ + 5e = 1/2 Br2 + 3H2O 1.52 MnO4– + 8H+ + 5e = Mn2+ + 4H2O 1.51 Au(III) + 3e = Au 1.50 HClO + H+ + 2e = Cl– + H2O 1.49 ClO3– + 6H+ + 5e = 1/2 Cl2 + 3H2O 1.47 PbO2(固) + 4H+ + 2e = Pb2+ + 2H2O 1.455 HIO + H+ + e = 1/2 I2 + H2O 1.45 ClO3– + 6H+ + 6e = Cl– + 3H2O 1.45 BrO3– + 6H+ + 6e =Br – + 3H2O 1.44 Au(III) + 2e = Au(I) 1.41 Cl2(气) + 2e = 2Cl 1.3595 ClO4– + 8H+ + 7e = 1/2 Cl2 + 4H2O 1.34 Cr2O72– + 14H+ + 6e =2Cr3+ + 7H2O 1.33 MnO2(固) + 4H+ + 2e = Mn2+ + 2H2O 1.23 O2(气) + 4H+ + 4e = 2H2O 1.229 IO3– + 6H+ + 5e = 1/2 I2 + 3H2O 1.20 ClO4– + 2H+ + 2e = ClO3– + H2O 1.19 Br2(水) + 2e = 2Br – 1.087 NO2 + H+ + e = HNO2 1.07 Br3– + 2e = 3Br – 1.05 HNO2 + H+ + e = NO(气) + H2O 1.00 VO2+ + 2H+ + e = VO2+ + H2O 1.00 HIO + H+ + 2e = I– + H2O 0.99 NO3– + 3H+ + 2e = HNO2 + H2O 0.94 ClO– + H2O + 2e = Cl– + 2OH– 0.89 H2O2 + 2e = 2OH– 0.88 Cu2+ + I– + e = CuI(固) 0.86 Hg2+ + 2e = Hg 0.845 NO3– + 2H+ + e = NO2 + H2O 0.80 Ag+ + e = Ag 0.7995 Hg22+ + 2e = 2Hg 0.793
--标准电极电势表-- 1 在酸性溶液中 (298K) 电对方程式E/V Li(I)-(0) Li++e-=Li -Cs(I)-(0) Cs++e-=Cs -Rb(I)-(0) Rb++e-=Rb - K(I)-(0) K++e-=K -Ba(II)-(0) Ba2++2e-=Ba -Sr(II)-(0) Sr2++2e-=Sr -Ca(II)-(0) Ca2++2e-=Ca -Na(I)-(0) Na++e-=Na -La(III)-(0) La3++3e-=La -Mg(II)-(0) Mg2++2e-=Mg -Ce(III)-(0) Ce3++3e-=Ce - H(0)-(-I) H2(g)+2e-=2H--Al(III)-(0) AlF63-+3e-=Al+6F--Th(IV)-(0) Th4++4e-=Th -Be(II)-(0) Be2++2e-=Be - U(III)-(0) U3++3e-=U -Hf(IV)-(0) HfO2++2H++4e-=Hf+H2O -Al(III)-(0) Al3++3e-=Al -Ti(II)-(0) Ti2++2e-=Ti -Zr(IV)-(0) ZrO2+4H++4e-=Zr+2H2O -Si(IV)-(0) [SiF6]2-+4e-=Si+6F--Mn(II)-(0) Mn2++2e-=Mn -Cr(II)-(0) Cr2++2e-=Cr -Ti(III)-(II) Ti3++e-=Ti2+- B(III)-(0) H3BO3+3H++3e-=B+3H2O - *Ti(IV)-(0) TiO 2+4H ++4e-=Ti+2H 2O - Te(0)-(-II) Te+2H++2e-=H2Te -Zn(II)-(0) Zn2++2e-=Zn -Ta(V)-(0) Ta2O5+10H++10e-=2Ta+5H2O -Cr(III)-(0) Cr3++3e-=Cr -Nb(V)-(0) Nb2O5+l0H++10e-=2Nb+5H2O -As(0)-(-III) As+3H++3e-=AsH3-U(IV)-(III) U4++e-=U3+-Ga(III)-(0) Ga3++3e-=Ga -P(I)-(0) H3PO2+H++e-=P+2H2O -P(III)-(I) H3PO3+2H++2e-=H3PO2+H2O - *C(IV)-(III) 2CO 2+2H ++2e-=H 2C2O4- Fe(II)-(0) Fe2++2e-=Fe -Cr(III)-(II) Cr3++e-=Cr2+-Cd(II)-(0) Cd2++2e-=Cd -
等电位联结安装标准图的编制说明作者:徐华 摘要作者结合对《等电位联结安装》(97SD567)国标图的修编,谈了对等电位联结的一些新认识,同时对实施过程中出现的问题作简要探讨。 关键词等电位联结接地故障防雷等电位电涌防护器IEC 目前,我国许多新修订的规范、标准逐步同国际电工标准(IEC标准)接轨。等电位联结在电气设计中,是一种行之有效的安全措施,早已为国际上许多国家所采用。我国对等电位联结的作用在认识上也有了长足的进步,1997年编制的《等电位联结安装》提出了一些基本做法,自试用以来收到了施工过程中对许多实际问题的反映,特别是信息技术的迅猛发展,对防雷、接地、等电位有了更高的要求,因此我们参考国际、国内的新标准、新做法对原标准图97SD567作了修编,新的图集号是02D501-2,下面主要对新图册做一些说明 1 等电位联结的分类
笔者在编制97SD567时,曾对"等电位联结"和"等电位连接"分析比较,决定本图册采用"等电位联结"这一名称,但现实工作中,这两个词往往还混淆不清,在此想强调一下,任何标准、规范要想正确的贯彻执行,必须要有规范的名称,具体分析见"浅谈《等电位联结安装》标准图的编制"(《现代建筑电气设计技术文集》第233页。在总说明中,把等电位联结分为三个层次,即总等电位联结,辅助等电位联结,局部等电位联结分别作了详细说明。 总等电位联结作用于全建筑物,由等电位联结端子板放射连接或链接进出建筑物的金属管道、金属结构构件等。辅助等电位联结是在导电部分间,用导线直接连通,使其电位相等或接近,一般是在电气装置的某部分接地故障保护不能满足切断回路的时间要求时,作辅助等电位联结。 局部等电位联结是在一局部场所范围内通过局部等电位联结端子板把各可导电 部分连通,一般是在浴室、游泳池、医院手术室、农牧业等特别危险场所,发生电击事故的危险性较大,要求更低的接触电压,或为满足信息系统抗干扰的要求,一般局部等电位联结也都有一个端子板或者连成环形。简单地说,局部等电位联结可以看成是在这局部范围内的总等电位联结。其区别可借助图集第6页图理解。
标准电极电位的概念 标准电极电位是以标准氢原子作为参比电极,即氢的标准电极电位值定为0,与氢标准电极比较,电位较高的为正,电位较低者为负。如氢的标准电极电位H2←→H+ 为 一般标准电极电位以298K(即25摄氏度) 常见金属的标准电极电位: 石墨的标准电极电位为 + V 一价金Au+ +e = Au原子价标准电极电位为 + 1.692 V 三价金Au3+ + 3e=Au原子价标准电极电位为 + 1.498 V 钯Pd2+2e=Pd的标准电极电位为 + 0.830 V 三价铑 Rh3+ + 3e=Rh 的标准电极电位为 + 0.800 V 银 Ag+ +e=Ag的标准电极电位为 + 0.799 V 钌Rh3+ + 3e = Rh的标准电极电位为 + 0.790 V 汞 Hg2/2+ + 2e 的标准电极电位为 + 0. 789 V 铜 Cu2+ + 2e 的标准电极电位为 + V 氯化银的标准电极电位为 + 0. 222 V 氢2H+ + 2e = H2的标准电极电位为V
铁Fe3++3e=Fe的标准电极电位为- V 铅 Pb2+ + 2e=Pb 的标准电极电位为- V 锡 Sn2+ + 2e=Sn 的标准电极电位为- V 钼 Mo3+ + 3e=Mo 的标准电极电位为- V 镍 Ni2+ + 2e=Ni 的标准电极电位为- V 钴 Co2+ + 2e=Co 的标准电极电位为- V 铟 In3+ + 3e=In 的标准电极电位为- V 镉 Cd2+ + 2e 的标准电极电位为- V 铁 Fe2+ + 2e=Fe的标准电极电位为- V 镍硼Ni-B镀层的自腐蚀电位为,比Ni-B-PTFE的自腐蚀电位要高,而Ni-B-PTFE复合镀层的自腐蚀电位为左右 铬 Cr3+ + 3e = Cr 的标准电极电位为-0. 74 V 锌Zn2+ + 2e 的标准电极电位为-0. 763 V 钨 W 的标准电极电位为- 1. 05 V 锰 Mn2+ + 2e 的标准电极电位为- V 钛 Ti2+ + 2e 的标准电极电位为- V 铝 Al3+ + 3e 的标准电极电位为- V 镁 Mg2+ + 2e 的标准电极电位为- V 钕 Nd 是一种活性极强的金属,标准平衡电位为- V