
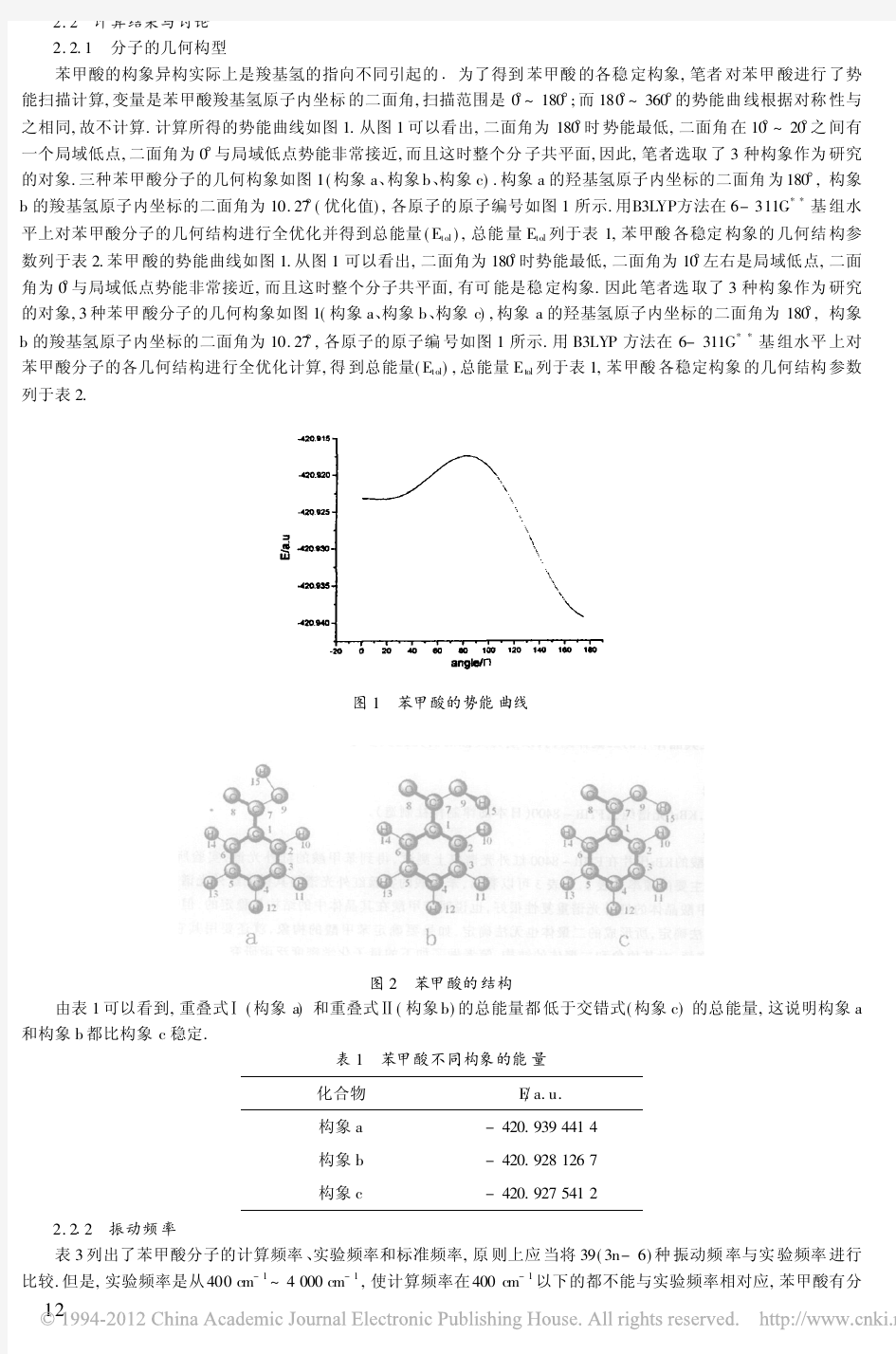
晶体结构与性质 一、晶体的常识 1.晶体与非晶体 得到晶体的途径:熔融态物质凝固;凝华;溶质从溶液中析出 特性:①自范性;②各向异性(强度、导热性、光学性质等) ③固定的熔点;④能使X-射线产生衍射(区分晶体和非晶体最可靠的科学方法) 2.晶胞--描述晶体结构的基本单元.即晶体中无限重复的部分 一个晶胞平均占有的原子数=1 8×晶胞顶角上的原子数+1 4×晶胞棱上的原子+1 2×晶胞面上的粒子数+1×晶胞体心内的原子数 思考:下图依次是金属钠(Na)、金属锌(Zn)、碘(I 2)、金刚石(C)晶胞的示意图.它们分别平均含几个原子? eg :1.晶体具有各向异性。如蓝晶(Al 2O 3·SiO 2)在不同方向上的硬度不同;又如石墨与层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000。晶体的各向异性主要表现在( ) ①硬度 ②导热性 ③导电性 ④光学性质 A.①③ B.②④ C.①②③ D.①②③④ 2.下列关于晶体与非晶体的说法正确的是( ) A.晶体一定比非晶体的熔点高 B.晶体一定是无色透明的固体 C.非晶体无自范性而且排列无序 D.固体SiO 2一定是晶体 3.下图是CO 2分子晶体的晶胞结构示意图.其中有多少个原子?
二、分子晶体与原子晶体 1.分子晶体--分子间以分子间作用力(范德华力、氢键)相结合的晶体 注意:a.构成分子晶体的粒子是分子 b.分子晶体中.分子内的原子间以共价键结合.相邻分子间以分子间作用力结合 ①物理性质 a.较低的熔、沸点 b.较小的硬度 c.一般都是绝缘体.熔融状态也不导电 d.“相似相溶原理”:非极性分子一般能溶于非极性溶剂.极性分子一般能溶于极性溶剂 ②典型的分子晶体 a.非金属氢化物:H 2O、H 2 S、NH 3 、CH 4 、HX等 b.酸:H 2SO 4 、HNO 3 、H 3 PO 4 等 c.部分非金属单质::X 2、O 2 、H 2 、S 8 、P 4 、C 60 d.部分非金属氧化物:CO 2、SO 2 、NO 2 、N 2 O 4 、P 4 O 6 、P 4 O 10 等 f.大多数有机物:乙醇.冰醋酸.蔗糖等 ③结构特征 a.只有范德华力--分子密堆积(每个分子周围有12个紧邻的分子) CO 2 晶体结构图 b.有分子间氢键--分子的非密堆积以冰的结构为例.可说明氢键具有方向性 ④笼状化合物--天然气水合物
第一章 晶体结构和倒格子 1. 画出下列晶体的惯用元胞和布拉菲格子,写出它们的初基元胞基矢表达式,指明各晶体的结构及两种元胞中的原子个数和配位数。 (1) 氯化钾 (2)氯化钛 (3)硅 (4)砷化镓 (5)碳化硅 (6)钽酸锂 (7)铍 (8)钼 (9)铂 2. 对于六角密积结构,初基元胞基矢为 → 1a =→→+j i a 3(2 →→→+-=j i a a 3(22 求其倒格子基矢,并判断倒格子也是六角的。 3.用倒格矢的性质证明,立方晶格的[hkl]晶向与晶面(hkl )垂直。 4. 若轴矢→→→c b a 、、构成简单正交系,证明。晶面族(h 、k 、l )的面间距为 2222) ()()(1c l b k a h hkl d ++= 5.用X 光衍射对Al 作结构分析时,测得从(111)面反射的波长为1.54?反射角为θ=19.20 求面间距d 111。 6.试说明:1〕劳厄方程与布拉格公式是一致的; 2〕劳厄方程亦是布里渊区界面方程; 7.在图1-49(b )中,写出反射球面P 、Q 两点的倒格矢表达式以及所对应的晶面指数和衍射面指数。 8.求金刚石的几何结构因子,并讨论衍射面指数与衍射强度的关系。 9.说明几何结构因子S h 和坐标原点选取有关,但衍射谱线强度和坐标选择无关。 10. 能量为150eV 的电子束射到镍粉末上,镍是面心立方晶格,晶格常数为3.25×10-10m,求最小的布拉格衍射角。 附:1eV=1.602×10-19J, h=6.262×10-34J ·s, c=2.9979×108m/s 第二章 晶体结合 1.已知某晶体两相邻原子间的互作用能可表示成 n m r b r a r U +-=)( (1) 求出晶体平衡时两原子间的距离; (2) 平衡时的二原子间的互作用能; (3) 若取m=2,n=10,两原子间的平衡距离为3?,仅考虑二原子间互作用则离解能为4ev ,计算a 及b 的值; (4) 若把互作用势中排斥项b/r n 改用玻恩-梅叶表达式λexp(-r/p),并认为在平衡时对互作 用势能具有相同的贡献,求n 和p 间的关系。 2. N 对离子组成的Nacl 晶体相互作用势能为 ??????-=R e R B N R U n 024)(πεα
个六元环共有。每个六元环实际拥有的碳原子数为 ______个。C-C键夹角:_______。C原子的杂化方式是______ SiO2晶体中,每个Si原子与个O原子以共价键相结合,每个O原子与个Si 原子以共价键相结合,晶体中Si原子与O原子个数比为。晶体中Si原子与Si—O键数目之比为。最小环由个原子构成,即有个O,个Si,含有个Si-O键,每个Si原子被个十二元环,每个O被个十二元环共有,每个Si-O键被__个十二元环共有;所以每个十二元环实际拥有的Si原子数为_____个,O原子数为____个,Si-O键为____个。硅原子的杂化方式是______,氧原子的杂化方式是_________. 知该晶胞中实际拥有的Na+数为____个 Cl-数为______个,则次晶胞中含有_______个NaCl结构单元。 3. CaF2型晶胞中,含:___个Ca2+和____个F- Ca2+的配位数: F-的配位数: Ca2+周围有______个距离最近且相等的Ca2+ F- 周围有_______个距离最近且相等的F——。 4.如图为干冰晶胞(面心立方堆积),CO2分子在晶胞中的位置为;每个晶胞含二氧化碳分子的个数为;与每个二氧化碳分子等距离且最近的二氧化
碳分子有个。 5.如图为石墨晶体结构示意图, 每层内C原子以键与周围的个C原子结合,层间作用力为;层内最小环有 _____个C原子组成;每个C原子被个最小环所共用;每个最小环含有个C原子,个C—C键;所以C原子数和C-C键数之比是_________。C原子的杂化方式是__________. 6.冰晶体结构示意如图,冰晶体中位于中心的一个水分子 周围有______个位于四面体顶角方向的水分子,每个水分子通过 ______条氢键与四面体顶点上的水分子相连。每个氢键被_____个 水分子共有,所以平均每个水分子有______条氢键。 7.金属的简单立方堆积是_________层通过_________对 _________堆积方式形成的,晶胞如图所示:每个金属阳离子的 配位数是_____,代表物质是________________________。 8.金属的体心立方堆积是__________层通过 ________对________堆积方式形成的,晶胞如图: 每个阳离子的配位数是__________.代表物质是 _____________________。
第一章 P4 问题 对14种布拉菲点阵中的体心立方,说明其中每一个阵点周围环境完全相同 答:①单看一个结晶学单胞可知,各个顶点上的阵点等价,周围环境相同。 ②将单个结晶学单胞做周期性平移后可知,该结晶学单胞中的体心阵点亦可作为其他结晶学原胞的顶点阵点,即体心阵点与顶点阵点也等价,周围环境也相同。 综上所述,体心立方中每一个阵点周围环境完全相同。 问题 在二维布拉菲点阵中,具体说明正方点阵的对称性高于长方点阵。 答:对称轴作为一种对称要素,是评判对称性高低的一种依据。正方点阵有4条对称轴而长方点阵只有两条对称轴,故正方点阵的对称性高于长方点阵。 P9 问题 晶向族与晶面族概念中,都有一个“族”字。请举一个与族有关的其他例子,看看其与晶向族、晶面族有无相似性? 答:“上班族”、“追星族”… 它们与晶向族、晶面族的相似性在于同一族的事物都有某一相同的性质。 问题 几年前一个同学问了这样的问题:() 2πe 晶面该怎么画?你如何看待他的问题?应该指出,这位同学一定是动了脑筋的!结论是注重概念 答:晶面无意义、不存在。晶向是晶面的法向量,相同指数的晶面与晶向是一一对应的。在晶体中原子排布规则中,各阵点是以点阵常数为单位长度构成的离散空间,阵点坐标值均为整数,晶向指数也应为整数,因此晶面指数应为整数时晶面才有意义。(晶体学的面与数学意义下的面有区别,只有指数为整数的低指数面才有意义。) 问题 说明面心立方中(111)面间距最大,而体心立方中(110)面间距最大。隐含了方法 答:①面心立方中有晶面族{100}、{110}、{111},它们的面间距分别为 因此面心立方中{111}面间距最大。 ②体心立方中有晶面族{100}、{110}、{111},其面间距分别为 因此体心立方中{110}面间距最大。 (密排面的晶面间距最大)
选修3第三章《晶体结构与性质》章教学设计 东莞市第一中学刘国强 一、本章教材体现的课标内容 1、主题:第一节晶体的常识 了解晶胞的概念,会计算晶胞中原子占有个数,并由此推导出晶体的化学式。 2、主题:第二节分子晶体与原子晶体 知道分子晶体与原子晶体的结构微粒、微粒间作用力的区别。 了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。 3、主题:第三节金属晶体 知道金属键的涵义,能用金属键理论解释金属的一些物理性质。 能列举金属晶体的基本堆积模型。 知道金属晶体的结构微粒、微粒间作用力与分子晶体、原子晶体的区别。 4、主题:第四节离子晶体 能说明离子键的形成,能根据离子化合物的结构特征解释其物理性质。 知道离子晶体的结构微粒、微粒间作用力与分子晶体。原子晶体、金属晶体的区别。 了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。 二、本章教材整体分析 (一)教材地位 本单元知识是在原子结构和元素周期律以及化学键等知识的基础上介绍的,是原子结构和化学键知识的延伸和提高;本单元知识围绕晶体作了详尽的介绍,晶体与玻璃体的不同,分子晶体、原子晶体、金属晶体、离子晶体,从构成晶体的微粒、晶胞、微粒间的作用力,熔沸点比较等物理性质做了比较,结合许多彩图及详尽的事例,对四大晶体做了阐述;同时,本单元结合数学立体几何知识,充分认识和挖掘典型晶胞的结构,去形象、直观地认识四种晶体,在学习本单元知识时,应多联系生活中的晶体化学,去感受生活中的晶体美,去感受环境生命科学、材料中的晶体知识。 “本章比较全面而系统地介绍了晶体结构和性质,作为本书的结尾章,与前两章一起构成“原子结构与性质、分子结构与性质、晶体结构与性质”三位一体的“物质结构与性质”模块的基本内容。” “通过本章的学习,结合前两章已学过的有关物质结构知识,学生能够比较全面地认识物质的结构及结构对物质性质的影响,提高分析问题和解决问题的能力。” (二)内容体系 本单元知识内容分为两大部分,第一节简单介绍晶体的常识,区别晶体与非晶体,认识什么是晶胞:第二部分分为三节内容,第二节“分子晶体和原子晶体”分别介绍了分子晶体和原子晶体的结构特征及晶体特性,在陈述分子晶体的结构特征时,以干冰为例,介绍了如果分子晶体中分子问作用力只是范德华力时,分子晶体具有分子密堆积特征;同时,教科书以冰为例,介绍了冰晶体里由于存在氢键而使冰晶体的结构具有其特殊性。在第三节“金属晶体”中,首先从“电子气理论”介绍了金属键及金属晶体的特性,然后以图文并茂的方式描述了金属晶体的四种基本堆积模式。在第四节“离子晶体”中,由于学生已学过离子键的概念,教科书直接给出了NaCl和CsCl两种典型离子晶体的晶胞,然后通过“科学探究”讨论了NaCl和CsCl两种晶体的结构;教科书还通过例子重点讨论了影响离子晶体结构的几何因素和电荷因素,而对键性因素不作要求。晶格能是反映离子晶体中离子键强弱的重要数据,教科书通过表格形式列举了某些离子晶体的晶格能,以及晶格能的大小与离子晶体的性质的关系。
1 1. 金刚石晶体结构(硅单质相同) 1mol 金刚石中含有 mol C —C 键, 最小环是 元环,(是、否) 共平面。 每个C-C 键被___个六元环共有,每个C 被_____ 个六元环共有。每个六元环实际拥有的碳原子数为 ______个。C-C 键夹角:_______。C 原子的杂化方式是______ SiO 2晶体中,每个Si 原子与 个O 原子以共价键相结合, 每个O 原子与 个Si 原子以共价键相结合,晶体中Si 原子与 O 原子个数比为 。 晶体中Si 原子与Si —O 键数目之比 为 。最小环由 个原子构成,即有 个O , 个Si ,含有 个Si-O 键,每个Si 原子被 个十二元环,每 个O 被 个十二元环共有,每个Si-O 键被__个十二元环共 有;所以每个十二元环实际拥有的Si 原子数为_____个,O 原子数为____个,Si-O 键为____个。硅原子的杂化方式是______,氧原子的杂化方式是_________. 2 . 在NaCl 晶体中,与每个Na +等距离且最近的Cl -有 个, 这些Cl -围成的几何构型是 ;与每个Na +等距离且最近的 Na +有 个。由均摊法可知该晶胞中实际拥有的Na +数为____个 Cl -数为______个,则次晶胞中含有_______个NaCl 结构单元。 3. CaF 2型晶胞中,含:___个Ca 2+和____个F - Ca 2+的配位数: F -的配位数: Ca 2+周围有______个距离最近且相等的Ca 2+ F - 周围有_______个距离最近且相等的F ——。
2 4.如图为干冰晶胞(面心立方堆积),CO 2分子在晶胞 中的位置为 ;每个晶胞含二氧化碳分子的 个数为 ;与每个二氧化碳分子等距离且最 近的二氧化碳分子有 个。 5.如图为石墨晶体结构示意图, 每层内C 原子以 键与周围的 个C 原子结合,层间作用力为 ; 层内最小环有 _____个C 原子组成;每个C 原子被 个最小环所共用;每个 最小环含有 个C 原子, 个C —C 键;所以C 原子数和C-C 键数之比是_________。C 原子的杂化方式 是__________. 6. 冰晶体结构示意如图 ,冰晶体中位于中心的一个水分子 周围有______个位于四面体顶角方向的水分子,每个水分子通过 ______条氢键与四面体顶点上的水分子相连。每个氢键被_____个 水分子共有,所以平均每个水分子有______条氢键。 7. 金属的简单立方堆积是_________层通过_________对 _________堆积方式形成的,晶胞如图所示:每个金属阳离子的 配位数是_____,代表物质是________________________。 8. 金属的体心立方堆积是__________层通过 ________对________堆积方式形成的,晶胞如图: 每个阳离子的配位数是__________.代表物质是 _____________________ 。
晶体结构与性质 一、晶体的常识1.晶体与非晶体 晶体与非晶体的本质差异 晶体非晶体 自范性 有(能自发呈现多面体外形)无(不能自发呈现多面体外形) 微观结构 原子在三维空间里呈周期性有序排列 原子排列相对无序 晶体呈现自范性的条件:晶体生长的速率适当 得到晶体的途径:熔融态物质凝固;凝华;溶质从溶液中析出特性:①自范性;②各向异性(强度、导热性、光学性质等)③固定的熔点;④能使X-射线产生衍射(区分晶体和非晶体最可靠的科学方法)2.晶胞--描述晶体结构的基本单元,即晶体中无限重复的部分 一个晶胞平均占有的原子数=8×晶胞顶角上的原子数+4×晶胞棱上的原子+2×晶胞面上的粒子数+1×晶胞体心内的原子数 思考:下图依次是金属钠(Na)、金属锌(Zn)、碘(I2)、金刚石(C)晶胞的示意图,它们分别平均含几个原子? 1 1 1
eg:1.晶体具有各向异性。如蓝晶(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨与层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000。晶体的各向异性主要表现在() ①硬度②导热性③导电性④光学性质 A.①③ B.②④ C.①②③ D.①②③④ 2.下列关于晶体与非晶体的说法正确的是() A.晶体一定比非晶体的熔点高 B.晶体一定是无色透明的固体 C.非晶体无自范性而且排列无序 D.固体SiO2一定是晶体 3.下图是CO2分子晶体的晶胞结构示意图,其中有多少个原子? 二、分子晶体与原子晶体 1.分子晶体--分子间以分子间作用力(范德华力、氢键)相结合的晶体注意:a.构成分子晶体的粒子是分子 b.分子晶体中,分子内的原子间以共价键结合,相邻分子间以分子间作用力结合 ①物理性质 a.较低的熔、沸点 b.较小的硬度 c.一般都是绝缘体,熔融状态也不导电 d.“相似相溶原理”:非极性分子一般能溶于非极性溶剂,极性分子一般能溶于极性溶剂 ②典型的分子晶体 a.非金属氢化物:H2O、H2S、NH3、CH4、HX等 b.酸:H2SO4 、HNO3、
几种常见晶体结构分析文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]
几种常见晶体结构分析 河北省宣化县第一中学 栾春武 邮编 075131 栾春武:中学高级教师,张家口市中级职称评委会委员。河北省化学学会会员。市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。 联系电话: E-mail : 一、氯化钠、氯化铯晶体——离子晶体 由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。离子的配位数分析如下: 离子数目的计算:在每一个结构单元(晶胞)中,处于不同位置的微粒在该单元中所占的份额也有所不同,一般的规律是:顶点上的微粒属于该 单元中所占的份额为18,棱上的微粒属于该单元中所占的份额为1 4,面上 的微粒属于该单元中所占的份额为1 2,中心位置上(嚷里边)的微粒才完 全属于该单元,即所占的份额为1。 1.氯化钠晶体中每个Na +周围有6个Cl -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的Cl -围成的空间构型为正八面体。每个Na +周围与其最近且距离相等的Na +有12个。见图1。 图1 图2 NaCl
晶胞中平均Cl-个数:8×1 8 + 6× 1 2 = 4;晶胞中平均Na+个数:1 + 12×1 4 = 4 因此NaCl的一个晶胞中含有4个NaCl(4个Na+和4个Cl-)。 2.氯化铯晶体中每个Cs+周围有8个Cl-,每个Cl-周围有8个Cs+,与一个Cs+距离最近且相等的Cs+有6个。 晶胞中平均Cs+个数:1;晶胞中平均Cl-个数:8×1 8 = 1。 因此CsCl的一个晶胞中含有1个CsCl(1个Cs+和1个Cl-)。 二、金刚石、二氧化硅——原子晶体 1.金刚石是一种正四面体的空间网状结构。每个C 原子以共价键与4个C原子紧邻,因而整个晶体中无单 个分子存在。由共价键构成的最小环结构中有6个碳原 子,不在同一个平面上,每个C原子被12个六元环共用,每C—C键共6 个环,因此六元环中的平均C原子数为6× 1 12 = 1 2 ,平均C—C键数为 6×1 6 = 1。 C原子数: C—C键键数= 1:2; C原子数: 六元环数= 1:2。 2.二氧化硅晶体结构与金刚石相似,C被Si代替,C与C之间插 氧,即为SiO 2晶体,则SiO 2 晶体中最小环为12环(6个Si,6个O), 图3 CsCl 晶 图4 金刚石晶
专题八分子结构与晶体结构 ★双基知识 1.几个基概念 化学键:相邻的两个或多个原子间强烈的相互作用 共价键:原子间通过共用电子对所形成的相互作用 离子键:阴、阳离子通过静电作用所形成的化学键 极性键:由不同元素的原子所形成的共价键 非极性键:由相同元素的原子所形成的共价键 金属键:金属阳离子与自由电子之间较强烈的作用叫金属键。 氢键: 范德华力(分子间作用力) 极性分子非极性分子 离子晶体分子晶体 原子晶体金属晶体 2.常见几种晶体的结构分析(点、线、面、体) (1)氯化钠晶体(2)氯化铯晶体(3)二氧化碳晶体(4)白磷分子的结构(5)C n的结构(6)金刚石晶体(7)二氧化硅晶体(8)石墨晶体 ★巧思巧解 (1)异类晶体:原子晶体(离子晶体)分别大于分子晶体
一般地,原子晶体>离子晶体>分子晶体 (2)同种类型晶体:构成晶体质点间的作用力大,则熔、沸点高,反之则小。 ①离子晶体:离子所带的电荷数越高,离子半径越小,离子键越强,则熔、沸点越高。 ②分子晶体:对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,则熔、沸点越高。 在同分异构体中,一般地,支链越多,熔、沸点越低。 ③原子晶体:原子半径越小,键长越短、键能越大,则熔、沸点越高 ④金属晶体:金属阳离子半径越小,离子所带的电荷越多,则金属键越强,金属熔、沸点越高 ★例题精析 [例1]:下列性质中,可以证明某化合物内一定存在离子键的是:( ) A .可以溶于水 B.具有较高的熔点 C .水溶液能导电 D.熔融状态能导电 [例2]:下列化合物中阴离子半径和阳离子半径之比最大的是: A .LiI B. NaBr C. KCl D. CsF [例3]:食盐晶体如右下图所示。在晶体中●表示Na +,○表示Cl - ,已知食盐的密度为ρg/cm 3, NaCl 的摩尔质量为M g/mol ,阿佛加得罗常数为N ,则在食盐晶体是Na +离子和Cl - 离子的 间距大约是: A . B. 3 2N M C. D. [例4]:根据石墨晶体结构示意图及提供的数据计算(保留三位有效数值)。有关公式、数据见框图。⑴12 g 石墨中,正六边形的数目有多少? ⑵求石墨密度。 ⑶求12克石墨的体积。
第一章材料的结构 2006-09-16 11:50 第一章材料的结构 重点与难点: 在晶体结构中,最常见的面心立方结构(fcc)、体心立方结构(bcc)、密排六方结构(hcp)、金刚石型结构及氯化钠型结构。内容提要: 在所有固溶体中,原子是由键结合在一起。这些键提供了固体的强度和有关电和热的性质。例如,强键导致高熔点、高弹性系数、较短的原子间距及较低的热膨胀系数。由于原子间的结合键不同,我们经常将材料分为金属、聚合物和陶瓷3类。 在结晶固体中,材料的许多性能都与其内部原子排列有关。因此,必须了解晶体的特征及其描述方法。根据参考轴间夹角和阵点的周期性,可将晶体分为7种晶系,14种晶胞。本章重点介绍了在晶体结构中,最常见的面心立方结构(fcc)、体心立方结构(bcc)、密排六方结构(hcp)、金刚石型结构及氯化钠型结构。务必熟悉晶向、晶面的概念及其表示方法(指数),因为这些指数被用来建立晶体结构和材料性质及行为间的关系。在工程实际中得到广泛应用的是合金。合金是由金属和其它一种或多种元素通过化学键合而成的材料。它与纯金属不同,在一定的外界条件下,具有一定成分的合金其内部不同区域称为相。合金的组织就是由不同的相组成。在其它工程材料
中也有类似情形。尽管各种材料的组织有多种多样,但构成这些组织的相却仅有数种。本章的重点就是介绍这些相的结构类型、形成规律及性能特点,以便认识组织,进而控制和改进材料的性能。学习时应抓住典型例子,以便掌握重要相的结构中原子排列特点、异类原子间结合的基本规律。 按照结构特点,可以把固体中的相大致分为五类。 固溶体及金属化合物这两类相是金属材料中的主要组成相。它们是由金属元素与金属元素、金属元素与非金属元素间相互作用而形成。固溶体的特点是保持了溶剂组元的点阵类型不变。根据溶质原子的分布,固溶体可分为置换固溶体及间隙固溶体。一般来说,固溶体都有一定的成分范围。化合物则既不是溶剂的点阵,也不是溶质的点阵,而是构成了一个新的点阵。虽然化合物通常可以用一个化学式(如AxBy)表示,但有许多化合物,特别是金属与金属间形成的化合物往往或多或少由一定的成分范围。 材料的成分不同其性能也不同。对同一成分的材料也可通过改变内部结构和组织状态的方法,改变其性能,这促进了人们对材料内部结构的研究。组成材料的原子的结构决定了原子的结合方式,按结合方式可将固体材料分为金属、陶瓷和聚合物。根据其原子排列情况,又可将材料分为晶体与非品体两大类。本章首先介绍材料的晶体结构。基本要求: 1.认识材料的3大类别:金属、聚合物和陶瓷及其分类的基础。 2.建立原子结构的特征,了解影响原子大小的各种因素。
第六章分子结构与晶体结构 教学内容: 1.掌握杂化轨道理论、 2.掌握两种类型的化学键(离子键、共价键)。 3.了解现代价键理论和分子轨道理论的初步知识,讨论分子间力和氢键对物质性质的影响。 教学时数:6学时 分子结构包括: 1.分子的化学组成。 2.分子的构型:即分子中原子的空间排布,键长,键角和几何形状等。 3.分子中原子间的化学键。 化学上把分子或晶体中相邻原子(或离子)之间强烈的相互吸引作用称为化学键。化学键可 分为:离子键、共价键、金属键。 第一节共价键理论 1916年,路易斯提出共价键理论。 靠共用电子对,形成化学键,得到稳定电子层结构。 定义:原子间借用共用电子对结合的化学键叫做共价键。 对共价键的形成的认识,发展提出了现代价键理论和分子轨道理论。 1.1共价键的形成 1.1.1 氢分子共价键的形成和本质(应用量子力学) 当两个氢原子(各有一个自旋方向相反的电子)相互靠近,到一定距离时,会发生相互作用。每个H原子核不仅吸引自己本身的1s电子还吸引另一个H原子的1s电子,平衡之前,引力>排斥力,到平衡距离d,能量最低:形成稳定的共价键。 H原子的玻尔半径:53pm,说明H2分子中两个H原子的1S轨道必然发生重叠,核间形成一个 电子出现的几率密度较大的区域。这样,增强了核间电子云对两核的吸引,削弱了两核间斥力,体系能量降低,更稳定。(核间电子在核间同时受两个核的吸引比单独时受核的吸引要小,即位能低,∴能量低)。
1.1.2 价键理论要点 ①要有自旋相反的未配对的电子 H↑+ H↓ -→ H↑↓H 表示:H:H或H-H ②电子配对后不能再配对即一个原子有几个未成对电子,只能和同数目的自旋方向相反的未成对电子成键。如:N:2s22p3,N≡N或NH3 这就是共价键的饱和性。 ③原子轨道的最大程度重叠 (重叠得越多,形成的共价键越牢固) 1.1.3 共价键的类型 ①σ键和π键(根据原子轨道重叠方式不同而分类) s-s :σ键,如:H-H s-p :σ键,如:H-Cl p-p :σ键,如:Cl-Cl π键, 单键:σ键 双键:一个σ键,一个π键 叁键:一个σ键,两个π键 例:N≡N σ键的重叠程度比π键大,∴π键不如σ键牢固。 σ键π键 原子轨道重叠方式头碰头肩并肩 能单独存在不能单独存在 沿轴转180O符号不变符号变 牢固程度牢固差 含共价双键和叁键的化合物的重键容易打开,参与反应。
分子结构与晶体结构 ★双基知识 几个基概念 化学键:相邻的两个或多个原子间强烈的相互作用 共价键:原子间通过共用电子对所形成的相互作用 离子键:阴、阳离子通过静电作用所形成的化学键 极性键:由不同元素的原子所形成的共价键 非极性键:由相同元素的原子所形成的共价键 金属键:金属阳离子与自由电子之间较强烈的作用叫金属键。 氢键: 范德华力(分子间作用力) 极性分子非极性分子 离子晶体分子晶体 原子晶体金属晶体 2.常见几种晶体的结构分析(点、线、面、体) (1)氯化钠晶体(2)氯化铯晶体(3)二氧化碳晶体(4)白磷分子的结构 (5)Cn的结构(6)金刚石晶体(7)二氧化硅晶体(8)石墨晶体★巧思巧解 2.四种晶体的比较
晶体类型离子晶体原子晶体分子晶体金属晶体 存在粒子 粒子间作用 熔、沸点 硬度 溶解性 导电性 实例 3.晶体熔、沸点比较 (1)异类晶体:原子晶体(离子晶体)分不大于分子晶体 一样地,原子晶体>离子晶体>分子晶体 (2)同种类型晶体:构成晶体质点间的作用力大,则熔、沸点高,反之则小。 ①离子晶体:离子所带的电荷数越高,离子半径越小,离子键越强,则熔、沸点越高。 ②分子晶体:关于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,则熔、沸点越高。 在同分异构体中,一样地,支链越多,熔、沸点越低。 ③原子晶体:原子半径越小,键长越短、键能越大,则熔、沸点越高 ④金属晶体:金属阳离子半径越小,离子所带的电荷越多,则金属键越强,金属熔、沸点越高 ★例题精析 [例1]:下列性质中,能够证明某化合物内一定存在离子键的是:()A.能够溶于水 B.具有较高的熔点 C.水溶液能导电 D.熔融状态能导电 [例2]:下列化合物中阴离子半径和阳离子半径之比最大的是: A.LiI B. NaBr C. KCl D. CsF [例3]:食盐晶体如右下图所示。在晶体中●表示Na+,○表示Cl-,已知食盐的密度为ρg/cm3,NaCl的摩尔质量为M g/mol,阿佛加得罗常数为N,则在食盐晶体是Na+离子和Cl-离子的间距大约是:
第七章分子结构与晶体结构 第一节离子键 一、离子键的形成和特征 1、离子键的形成 电负性I1或Y1(KJ/mol) 电离能很小的金属原子:Na 0.9 496 K 0.8 419 电子亲合能很大的非金属原子:Cl 3.0 -348.8 O 3.5 -141 电负性相差大的元素相遇,一失电子,一得电子,它们之间以静电引力相结合,形成离子键。 ④:阳阴离子间具有静电引力,两原子的电子云间存在排斥力,两原子核间存在相互排斥力,当两原子接近到一定距离,引力=斥力,(此时整个体系能量最低),形成离子键。 2、离子键的特征 ① 本质:阴、阳离子间的静电引力 ② 无方向性、饱和性 只要空间允许,尽可能多地吸引带相反电荷的离子(任何方向,尽可能多)。但总体来说,有一定比例。 二、离子的特性 1、离子的电荷 离子化合物AmBn:A n+,B m- +n﹥+3,很少见 2、离子的电子层结构 简单阴离子的电子构型,一般与同周期希有气体原子电子层构型相同。 简单的阳离子构型:
3、离子半径 将阴阳离子看成是保持着一定距离的两个球体。 d = r+ + r-单位:pm(10-12m) 规律: ①同一元素: 负离子半径>原子半径>正离子半径 低价负离子半径>高价负离子半径 低价正离子半径>高价正离子半径 例: ②同一周期 从左到右,阳离子:正电荷数↑,半径↓ 阴离子:负电荷数↓,半径↓ ③同一主族 电荷数基本相同,从上到下,半径↑(∵电子层增加) 离子半径↓,离子间引力↑,离子键强度↑,熔、沸点↑,硬度↑ 第二节共价键理论 1916年,路易斯提出共价键理论。 靠共用电子对,形成化学键,得到稳定电子层结构。 定义:原子间借用共用电子对结合的化学键叫作共价键。 对共价键的形成的认识,发展提出了现代价键理论和分子轨道理论。
物质结构要点 1、核外电子排布式 外围核外电子排布式价电子排布式 价电子定义:1、对于主族元素,最外层电子 2、第四周期,包括3d与4S 电子 电子排布图 熟练记忆 Sc Fe Cr Cu 2、S能级只有一个原子轨道向空间伸展方向只有1种球形 P能级有三个原子轨道向空间伸展方向有3种纺锤形 d能级有五个原子轨道向空间伸展方向有5种 一个电子在空间就有一种运动状态 例1:N 电子云在空间的伸展方向有4种 N原子有5个原子轨道 电子在空间的运动状态有7种 未成对电子有3个 ------------------------结合核外电子排布式分析 例2 3、区的划分 按构造原理最后填入电子的能级符号 如Cu最后填入3d与4s 故为ds区 Ti 最后填入能级为3d 故为d区 4、第一电离能:同周期从左到右电离能逐渐增大趋势(反常情况:S2与P3 半满或全 满较稳定,比后面一个元素电离能较大) 例3、比较C、N、O、F第一电离能的大小 --------------- F >N>O>C 例4、某元素的全部电离能(电子伏特)如下:
回答下列各问: (1)I6到I7间,为什么有一个很大的差值?这能说明什么问题? _________________________ (2)I4和I5间,电离能为什么有一个较大的差值_________________________________ (3)此元素原子的电子层有 __________________层。最外层电子构型为 ______________ 5、电负性:同周期从左到右电负性逐渐增大(无反常)------------F> O >N >C 6、对角线规则:某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”如:锂 和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以 及硼和硅的含氧酸酸性的强弱 7、共价键:按原子轨道重叠形式分为:σ键和π键 (具有方向性和饱和性) 单键 -------- 1个σ键 双键------1个σ键和1个π键 三键---------1个σ键和2个π键 8、等电子体:原子总数相等,价电子总数相等----------具有相似的化学键特征 例5、N2 CO CN-- C22-互为等电子体 CO2 CS2 N2O SCN-- CNO-- N3- 互为等电子体 从元素上下左右去找等电子体,左右找时及时加减电荷,保证价电子相等。 9、应用VSEPR理论判断下表中分子或离子的构型。
第2~3章 分子结构与晶体结构 1、已知下列表中数据,求KCl 晶格能 2、写出氯酸根离子 ClO 3- 的路易斯结构式. Cl 原子的电负性小于O 原子,意味着不存在 O -O 之间的键合. 合理的排布应该如下所示: ClO 3-离子中价电子总数等于26(四个原子的价电子数相加再加1), 扣除3个单键的6个电子,余下的20个电子以孤对方式分配给四个原子, 使它们均满足八隅律的要求. 3、判断 OF 2、XeF 4分子的基本形状. 写出路易斯结构式, 并读出中心原子周围价电子对的总数:中心原子价层有4对电子. 4 对价电子的理想排布方式为正四面体, 但考虑到其中包括两个孤对, 所以分子的实际几何形状为角形, 相当于 AB 2E 2 型分子. E D I S H U U E D I S H -+++?-=∴-+-++ +=?21 )()(2 1 θf θf Cl O O O Cl O O O F — O —
XeF4中心原子价层有6 对电子. 理想排布方式为正八面体, 但考虑到其中包括两个孤对, 所以分子的实际几何形状为平面四方形, 相当于AB4E2 型 分子. 苯、二氧化碳、臭氧、碳酸根分子的化学键(1)、苯分子中的p-p大π键苯分子中碳原子采用sp2杂化,3个杂化轨道分别用于形成3个σ键,故苯分子有键角为120 °的平面结构的σ骨架,苯分子的每个碳原子尚有一个未参加杂化的p轨道,垂直于分子平面而相互平行,6 个“肩并肩”的平行p轨道上共有6个电子在一起形成弥散在整个苯环的p-p大π键,符号为π 6 6(2)、二氧化碳分子里的大π键 分子中碳原子采用sp杂化,形成直线型的分子σ骨架O-C- O ,每个碳原子尚有二个未参加杂化的p轨道,其空间取向为相互垂直且与sp杂化轨道的 轴呈正交关系。形成两套3原子4电子符号为π 3 4的p-p大π键(3)、臭氧中的大π键 分子的中心氧原子采用sp2杂化,形成平面三角形,中心氧原子尚有一个未参加杂化的p轨道,垂直于分子平面,端位的2个氧原子也各有一个垂直于 分子平面的p轨道,“肩并肩” 形成符号为π 3 4的p-p大π键(4)、碳酸根中的大π键分子中碳原子采用sp2杂化,形成平面三角形,碳原子尚有一个未参加杂化的p轨道,垂直于分子平面,端位的3个氧原子也各有一个垂直于分子 平面的p轨道,“肩并肩” 形成符号为π 46的p-p大π键(1)CO 2 、CNS-、NO 2 +、N 3-通式AX 2 ,价电子数16,直线型,2个л4 3 (2)CO 3 2-、NO 3 -、SO 3 通式AX 3,总价电子数24,平面三角形,1个л6 4 (3)SO 2 、O 3 、NO 2 -通式 AX 2 ,价电子数18,V字型, (4)SO 42-、PO 4 3-通式AX 4 ,价电子数32,正四面体(5)PO 3 3-、SO 3 2-、 ClO 3-通式AX 3 ,价电子数26,三角锥型
第一章晶体结构 晶体-----内部组成粒子(原子、离子或原子团)在微观上作有规则的周期性重复排列构成的固体。 晶体的通性------所有晶体具有的共通性质,如自限性、最小内能性、锐熔性、均匀性和各向异性、对称性、解理性等。 单晶体和多晶体-----单晶体的内部粒子的周期性排列贯彻始终;多晶体由许多小单晶无规堆砌而成。 基元、格点和空间点阵------基元是晶体结构的基本单元,格点是基元的代表点,空间点阵是晶体结构中等同点(格点)的集合,其类型代表等同点的排列方式。原胞、WS原胞-----在晶体结构中只考虑周期性时所选取的最小重复单元称为原胞;WS原胞即Wigner-Seitz原胞,是一种对称性原胞。 晶胞-----在晶体结构中不仅考虑周期性,同时能反映晶体对称性时所选取的最小重复单元称为晶胞。 原胞基矢和轴矢----原胞基矢是原胞中相交于一点的三个独立方向的最小重复矢量;晶胞基矢是晶胞中相交于一点的三个独立方向的最小重复矢量,通常以晶胞基矢构成晶体坐标系。 布喇菲格子(单式格子)和复式格子------晶体结构中全同原子构成的晶格称为布喇菲格子或单式格子,由两种或两种以上的原子构成的晶格称为复式格子。简单格子和复杂格子(有心化格子)------一个晶胞只含一个格点则称为简单格子,此时格点位于晶胞的八个顶角处;晶胞中含不只一个格点时称为复杂格子,其格点除了位于晶胞的八个顶角处外,还可以位于晶胞的体心(体心格子)、一对面的中心(底心格子)和所有面的中心(面心格子)。 密堆积和配位数-----晶体组成原子视为等径原子时所采取的最紧密堆积方式称为密堆积,晶体中只有六角密积与立方密积两种密堆积方式。晶体中每个原子周围的最近邻原子数称为配位数。由于晶格周期性限制,晶体中的配位数只能取:12,8,6、4、3(二维)和2(一维)。 晶列、晶向(指数)和等效晶列-----晶列是晶体结构中包括无数格点的直线,
第二章晶体的基本概念 z第一节晶体的基本性质 z第二节空间点阵 z第三节整数定律及晶面指数 z第四节晶体投影
晶体研究的早期成就 1690年惠更斯提出:晶体中质点的有序排列导致晶体具有某种多面体外形。 1812年浩羽(R.J.Hauy)提出:晶体是由具有多面体外形的“分子” 成的。 1669年,丹麦人斯登诺(Steno,N.1638-1686),1783年法国矿物学家爱斯尔(DeI Isle,R.1736-1790)分别在观测各种矿物晶体时发现了晶体的第一个定律──晶面夹角守恒定律。
晶体的对称原理 在1805-1809年间,德国学者魏斯(Weiss,C.S.1780-1856开始研究晶体外形的对称性 1830年德国人赫塞尔(Hessel,J.F.Ch.1796-1872),1867年俄国人加多林分别独立地推导出,晶体外形对称元素的一切可能组合方式(也就是晶体宏观对称类型)共有32种(称为32种点群) 19世纪40年代,德国人弗兰根海姆(Frankenheim,M.L.1801-1869)和法国人布拉维(Bravais,A.1811-1863)发展前人的工作,奠定了晶体结构空间点阵理论(即空间格子理论)的基础。弗兰根海姆首次提出晶体内部结构应以点为单位,这些点在三度空间周期性的重复排列。他于1842年推出了15种可能的空间点阵 形式。 布拉维明确地提出了空间格子理论。认为晶体内物质微粒的质心分布在空间格子的平行六面体单位的顶角、面心或体心上,从而它们在三度空间作周期性的重复排列。他于1848年指出,弗兰根海姆的15种空间点阵形式中有两种实质上是相同的,确定了空间点阵的14种形式
第七章分子结构与晶体结构 序言 第一节离子键 第二节共价键理论 第三节杂化轨道理论与分子几何构型第四节晶体的特征 第五节离子晶体 第六节原子晶体 第七节分子间力和氢键 第八节金属晶体 第九节离子极化 第十节混合型晶体
序言: v原子怎样结合成为分子?-化学键?离子键 Link ?共价键 ?金属键 v分子的形状?-分子构型 ?价电子对互斥理论 v分子怎样组成物质材料?-分子间作用力v固体材料的结构? -晶体结构 -无定型结构
价电子(Valence electrons )·····H ·He ::N ··O ·:Cl ·K ·Mg: :Ne :· ·········K ·+ :Cl ·→K +[:Cl:]- ····失或得电子→稳定结构(主族) Loss or gain electrons →octet rule 为什么惰性气体稳定? n s 2n p 6 八电子层结构 ????
化学键—分子中的两个(或多个)原子之间的相互作用 第一节离子键 1916 年德国科学家Kossel( 科塞尔) 提出离子键理论 一离子键的形成(以NaCl为例) 第一步电子转移形成离子: Na -e ——Na+,Cl+ e ——Cl- 相应的电子构型变化: 2s 2 2p 6 3s 1——2s 2 2p 6 ,3s 2 3p 5 ——3s 2 3p 6 形成Ne和Ar的稀有气体原子的结构,形成稳定离子。
第二步靠静电吸引,形成化学键。 体系的势能与核间距之间的关系如图所示: V Vr0 r0r 横坐标核间距r ;纵坐标体系的势能V。 纵坐标的零点当r 无穷大时,即两核之间无限远时的势能。 下面来考察Na+和Cl-彼此接近的过程中,势能V 的变化。 ,当r 减小时,正负离子靠静电相互吸图中可见:r > r 引,势能V 减小,体系趋于稳定。
1 普化无机试卷(分子结构和晶体结构四) 答案 一、问答题 1. (9990) (1) +0.5,变短;(2) -0.5,变长;(C) +0.5,变短 2. (9991) 在一般的分子或离子中,作为端基氧经常与中心成双键,故氧提供2个电子,即一对电子,但在处理双键时,要在电子对数上减去1,其结果与认为氧提供电子数为零,与不按双键处理是一致的。 3. (9992) 中心原子不带孤对电子时,五配位主族元素的化合物分子采用三角双锥结构,如PX 5、X:卤素等;反之,若中心原子有一对孤对电子,化合物分子将采用四方锥结构,如BrF 5和XeOF 4等。 4. (9993) 因BF 3分子中B —F 间除形成σ 键外还生成了∏46大π 键,因而使B —F 键比B —F 平均 键长要短。 5. (9994) 以x 轴为键轴,ns - ns 、np x - np x 重叠形成σ键,其化学键的强弱与原子核间的距离和轨道重叠大小有关。s 轨道是球型对称的,而p x 轨道具有方向性,因此,一般是np x - np x 形成的化学键强。但H 的原子半径特别小,H 2分子的核间距离小,1s - 1s 能有效重叠,而F 的原子半径小有孤对电子对,F 2分子中孤对电子之间排斥作用大,导致2p x - 2p x 形成化学键的键能小。 6. (9995) (1) 八面体,五角双锥体 (2) IF 7 + SbF 5?→? [IF 6][SbF 6] 7. (9996) 乙腈的结构式为CH 3—C ≡N ,甲胩的结构式为CH 3—N ≡C ,CH 3CN 更稳定 ( m f H ?(CH 3CN) = -150 kJ ·mol -1, m f H ?(CH 3NC) = -88 kJ ·mol -1)。两种分子中化学键的键数相同,但C —C 键比C —N 键稳定,故CH 3CN 更稳定。 8. (9997) NF 3 BF 3 ClF 3 N 以sp 3杂化 B 以sp 2杂化 Cl 以sp 3d 杂化 三角锥 平面三角形 近似T 型 取向力,诱导力,色散力 色散力 取向力,诱导力,色散力 9. (9998) (1) (2) (3) (4) (5) BF 3 →BF 4- H 2O → H 3O + PCl 5 →PCl 4 + PCl 5 →PCl 6- AlCl 3 → Al 2Cl 6 Sp 2 → sp 3 sp 3 → sp 3 sp 3d → sp 3 sp 3d → sp 3d 2 sp 2 → sp 3 平面三角形 → 正四面体 V 形 → 三角锥形 三角双锥形 → 正四面体形 三角双锥形 → 正八面体形 平面三角形 → 两个正四面体共棱