
食用醋中醋酸含量的测定
一、实验目的
1、了解实样分析的方法
2、掌握碱标准溶液的标定方法;
3、掌握食醋总酸度的测定原理、方法和操作技术。
二、实验原理:
食醋中的酸性物质主要是醋酸,可以用酸碱中和反应原理,以已知浓度的氢氧化钠溶液进行中和滴定。反应方程式为:CH3COOH+NaOH=CH3COONa+H2O
NaOH在称量过程中不可避免地会吸收空气中的二氧化碳,使得配制的NaOH溶液浓度比真实值偏高,最终使实验测定结果偏高,因此,为得到更准确的数据,必须将NaOH溶液以标准酸溶液邻苯二甲酸氢钾(KHC8H4O4)标定。标定时遵守酸碱中和反应原理,其中参加反应的NaOH与KHC8H4O4的物质的量之比为1∶1。
三、实验器材
试剂:醋精、糯米甜醋、白醋、陈醋、自制家醋、邻苯二甲酸氢钾、氢氧化钠、活性炭、酚酞。
仪器:烧杯、容量瓶、玻璃棒、锥形瓶、25mL酸式滴定管、25mL碱式滴定管、漏斗、滤纸、铁架台、托盘天平、25mL移液管、婆梅氏重表、分析天平、洗耳球。
四、实验步骤
食醋的中和滴定
1用移液管准确量取上述滤液各25mL,转移到250mL容量瓶中加蒸馏水到刻度线,配制成稀醋酸溶液。
2将上述各种稀醋酸溶液注入酸式滴定管中并调整液面在“0”刻度线或以下,读取刻度。
3用托盘天平准确称取2 00g NaOH固体,配制成500mL溶液。
4将上述NaOH溶液注入碱式滴定管中,并调整液面读取刻度。
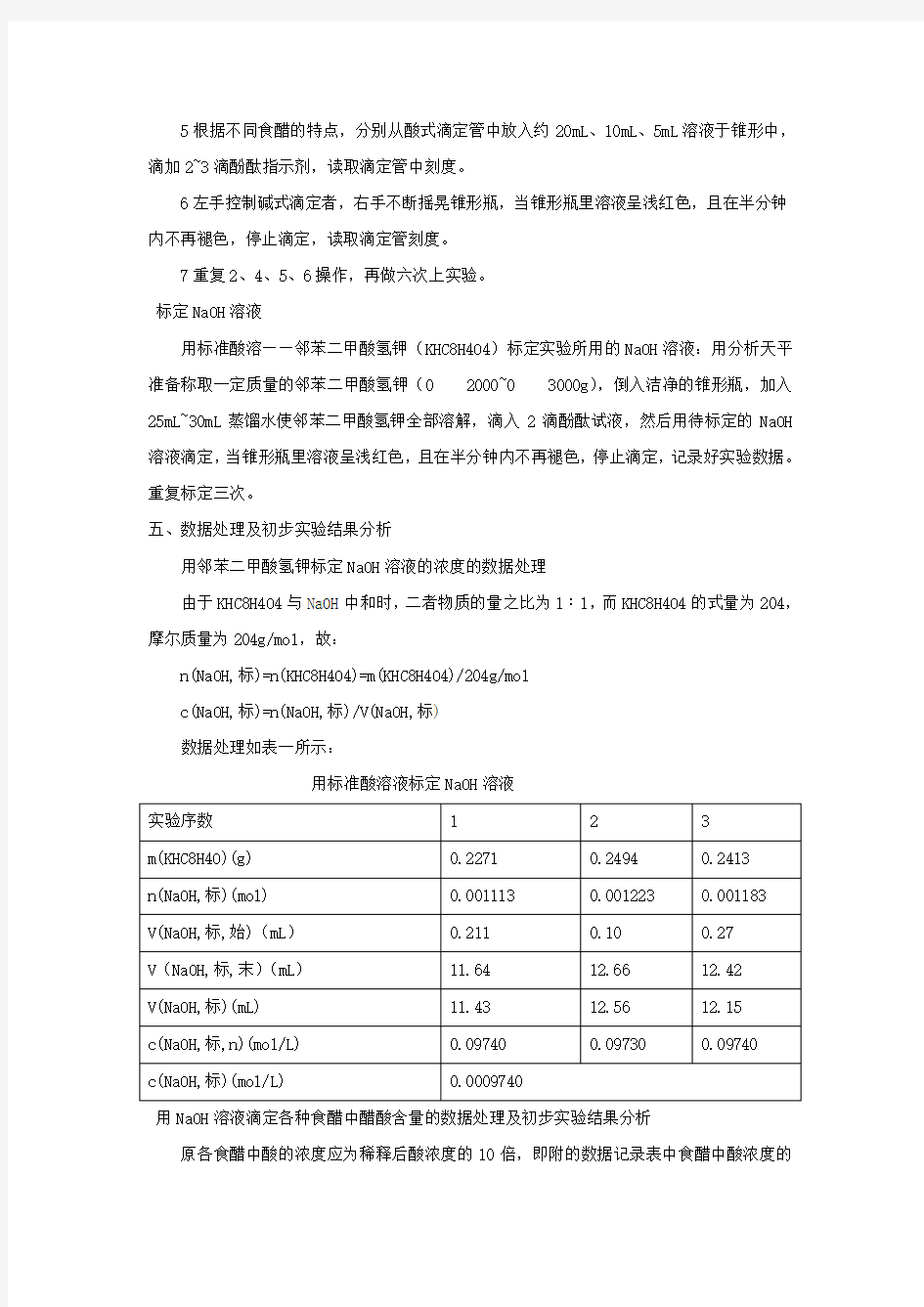
5根据不同食醋的特点,分别从酸式滴定管中放入约20mL、10mL、5mL溶液于锥形中,滴加2~3滴酚酞指示剂,读取滴定管中刻度。
6左手控制碱式滴定者,右手不断摇晃锥形瓶,当锥形瓶里溶液呈浅红色,且在半分钟内不再褪色,停止滴定,读取滴定管刻度。
7重复2、4、5、6操作,再做六次上实验。
标定NaOH溶液
用标准酸溶——邻苯二甲酸氢钾(KHC8H4O4)标定实验所用的NaOH溶液:用分析天平准备称取一定质量的邻苯二甲酸氢钾(0 2000~0 3000g),倒入洁净的锥形瓶,加入25mL~30mL蒸馏水使邻苯二甲酸氢钾全部溶解,滴入2滴酚酞试液,然后用待标定的NaOH 溶液滴定,当锥形瓶里溶液呈浅红色,且在半分钟内不再褪色,停止滴定,记录好实验数据。重复标定三次。
五、数据处理及初步实验结果分析
用邻苯二甲酸氢钾标定NaOH溶液的浓度的数据处理
由于KHC8H4O4与NaOH中和时,二者物质的量之比为1∶1,而KHC8H4O4的式量为204,摩尔质量为204g/mol,故:
n(NaOH,标)=n(KHC8H4O4)=m(KHC8H4O4)/204g/mol
c(NaOH,标)=n(NaOH,标)/V(NaOH,标)
数据处理如表一所示:
用标准酸溶液标定NaOH溶液
用NaOH溶液滴定各种食醋中醋酸含量的数据处理及初步实验结果分析
原各食醋中酸的浓度应为稀释后酸浓度的10倍,即附的数据记录表中食醋中酸浓度的
10倍(其中c酸为用未经标定的NaOH浓度求算的数值,c′酸为用经标定的NaOH浓度求算的数值,下列各表相同)
表二各种食醋中酸的浓度
表三各种食醋中酸的浓度
(1)0.1 mol·L-1 NaOH标准溶液的标定用减量法准确称取0.3 ~0.4 g KHC8H4O4三份,加25 mL蒸馏水溶解。然后加1滴酚酞指示剂,用NaOH溶液滴定至终点。记录每次消耗NaOH 溶液的体积。
(2)食醋试液的制备取10 mL食醋样品,定容于250 mL容量瓶中。
(3)食醋总酸度的测定用移液管移取稀释好的食醋试液25 mL放入锥形瓶中,加1~2滴酚酞指示剂,用NaOH标准溶液滴定至终点。记录NaOH消耗的体积,重复做2~3次。
六、注意事项:
(1)因食醋本身有很浅的颜色,而终点颜色又不够稳定,所以滴定近终点时要注意观察和控制。
(2)注意碱滴定管滴定前要赶走气泡,滴定过程中不要形成气泡。
(3)NaOH标准溶液滴定HAc,属强碱滴定弱酸,CO2的影响严重,注意除去所用碱标准溶液和蒸馏水中的CO2。
实验三 食用白醋中醋酸含量的测定 一、实验目的与要求 1.掌握 NaOH 标准溶液的配制、标定方法及保存要点; 2.了解基准物质邻苯二甲酸氢钾的性质及应用; 3.掌握强碱滴定弱酸的滴定过程、突跃范围及指示剂的选择原理 二、实验原理 1.HAc 浓度的测定 醋酸为有机弱酸(K a =1.8 X 10-5),与NaOH 反应式为: 反应产物为弱酸强碱盐,滴定突跃在碱性范围内,可选用酚酞等碱性范围变色的指示剂。食用白 醋中醋酸含量大约在 30-50 mg/ml 。 2. NaOH 标准溶液的标定 NaOH 在称量过程中不可避免地会吸收空气中的二氧化碳,使得配制的 NaOH 溶液浓度比真实值 偏高,最终使实验测定结果偏高,因此,为得到更准确的数据,必须将 NaOH 溶液以标准酸溶液 邻苯二甲酸氢钾(KHC S H4°4 )标定。 在邻苯二甲酸氢钾的结构中只有一个可电离的 H *离子,其与NaOH 反应的计量比为1:1。标定时 的反应为: 邻苯二甲酸氢甲作为基准物的优点:( 1 )易于获得纯品; ( 2)易于干燥,不吸湿; ( 3)摩尔质 量大,可相对减少称量误差 三、仪器与试剂 酸式滴定管(50mL )、碱式滴定管(50mL )、锥形瓶(250mL )、滴定台、蝴蝶夹、玻璃量筒(10mL )、烧 杯、移液管、滴瓶、试剂瓶(带橡胶塞)。 NaOH (s )(A.R.)酚酞指示剂(0.2%乙醇溶液)、邻苯二甲 酸氢钾(s )(A.R 在100~125 C 下干燥1h 后,置于干燥器中备用) 四、实验步骤 1 1 . 0仆。1丄NaOH 溶液的标定 洗净碱式滴定管,检查不漏水后,用所配制的 NaOH 溶液润洗2?3次,每次用量5?10mL ,然后 将碱液装入滴定管中至“0”刻度线上,排除管尖的气泡,调整液面至0.00刻度或零点稍下处,静置 式中: m 邻苯二甲酸氢钾 — —邻苯二甲酸氢钾质量 /g V NaOH /mL NaOH 体积 /mL
一、选择题 1、用H2 C2 O4 · 2H2O 标定KMnO4溶液时,溶液的温度一般不超过(D ),以防H2 C 2 O 4的分解。 A. 60 ° C B. 75 ° C C. 40 ° C D. 85 ° C 2、用纯水将下列溶液稀释10 倍,其中pH 值变化最大的是(A )。 A. 0.1 mol/L HCl B. 0.1 mol/L HAc C. 1 mol/L NH 3 · H 2 O D. 1 mol/L HAc + 1 mol/L NaAc 3、用同一KMnO 4 标准溶液分别滴定等体积的FeSO 4 和H 2 C 2 O 4 溶液,消耗等体积的标准溶液,则FeSO 4与H 2C 2O 4两种溶液的浓度之间的关系为(A )。 A. B. C. D. 4. 若用0.1000mol/L KOH溶液分别滴定2 5.00mL 某H2SO4和HAc溶液,若消耗的体积相等, 则表示这两种溶液中 ( D ) (A) [H+]相等(B) c(H2SO4) = c(HAc) (C) c(H2SO4) = 2c(HAc) (D) 2c(H2SO4) = c(HAc) 5. 现有一含H3PO4和NaH2PO4的溶液,用NaOH标准溶液滴定至甲基橙变色, 滴定体积为a(mL)。同一试液若改用酚酞作指示剂, 滴定体积为b(mL)。则a 和b 的关系是( C ) (A) a>b(B) b = 2a(C) b>2a(D) a = b 二、简答 1、与其他基准物质比较,邻苯二甲酸氢钾有什么优点? 答案: 邻苯二甲酸氢钾易制得纯品,在空气中不吸水,易保存,摩尔质量大,与NaOH反应的计量比为1:1 2、已标定的NaOH溶液在保存中吸收了二氧化碳,用它来测定HCI的浓度,若以酚酞为指示剂对测定结果有何影响?改用甲基橙,又如何? 答案: 测定C HCI,用酚酞指示剂,偏高(多消耗NaOH)
山东轻工业学院实验报告 成绩 课程名称基础化学实验1 指导教师实验日期 院(系)专业班级实验地点 学生姓名学号同组人无 实验项目名称食用醋酸总酸量的测定 一、实验目的 1.学习碱溶液浓度的标定方法。 2.进一步练习滴定操作及天平减量法称量。 3.学会用标准溶液来测定未知物含量。 4.熟悉移液管、吸量管和容量瓶的使用,巩固滴定操作。 二、实验原理 1.常用于标定碱的基准物质有邻苯二甲酸氢钾、草酸等。本实验选用邻苯二甲酸氢钾作基准物,其反应为KHC8H4O4+NaOH=KNaC8H4O4+H2O 由于产物是弱碱,可选用酚酞作指示剂。 2.醋酸(CH3COOH,简记为HAc)为一元弱酸,解离常数K a=1.8×10-5,可用NaOH标准溶液直接滴定,滴定时用酚酞作指示剂。食用醋酸中酸的主要成分为醋酸,但也可能含有少量其他的酸,所以测定的是总酸量,测定结果用C HAc(g·L-1)表示。 三、主要试剂 NaOH(AR),邻苯二甲酸氢钾(AR),酚酞指示剂,食用醋酸 四、实验步骤(可用简洁的文字、箭头或框图等表示,自己整理,更富有创意) 1.0.2mol·L-1NaOH溶液浓度的标定 减量法准确称取已烘干的邻苯二甲酸氢钾三份,每份重1~1.5g,分别放入三个已编号的250mL的锥形瓶中,各加水50mL,温热使之溶解,冷却后,加入1~2滴酚酞指示剂,用0.2mol·L-1NaOH溶液滴定至呈现微红色(30s不褪色),即为终点。 2.醋酸总酸量的测定 用一清洁的25mL移液管吸取25.00mL试液于250mL锥形瓶中,加入酚酞指示剂1~2滴,用0.2mol·L-1NaOH溶液滴定至溶液恰好出现微红色,于半分钟内不褪色,即为终点。平行测定3次。根据NaOH标准溶液的浓度和滴定时消耗的体积,计算醋酸中的总酸量。
实验四苯甲酸钠的含量测定 一、目的 掌握双相滴定法测定苯甲酸钠含量的原理和操作 二、操作 取本品1.5g,精密称定,置分液漏斗中,加水约25mL,乙醚50mL和甲基橙指示液2滴,用盐酸滴定液(0.5mol/L)滴定,随滴随振摇,至水层显持续橙红色,分取水层,置具塞锥形瓶中,乙醚层用水5mL洗涤,洗涤液并入锥形瓶中,加乙醚20mL,继续用盐酸滴定液(0.5mol/L)滴定,随滴随振摇,至水层显持续橙红色,即得,每1mL的盐酸滴定液(0.5mol/L)相当于72.06mg的C7H5O2Na。 本品按干燥品计算,含C7H5O2Na不得少于99.0% 三、说明 1.苯甲酸钠为有机酸的碱金属盐,显碱性,可用盐酸标准液滴定。 COO Na +H C l COOH +N aC l 在水溶液中滴定时,由于碱性较弱(Pk b=9.80)突跃不明显,故加入和水不相溶混的溶剂乙醚提除反应生成物苯甲酸,使反应定量完成,同时也避免了苯甲酸在瓶中析出影响终点的观察。 2.滴定时应充分振摇,使生成的苯甲酸转入乙醚层。 3.在振摇和分取水层时,应避免样品的损失,滴定前,使用乙醚检查分液漏斗是否严密。 四、思考题 1.乙醚为什么要分两次加入?第一次滴定至水层显持续橙红色时,是否已达终点?为什么? 2.分取水层后乙醚层用5mL水洗涤的目的是什么? 实验五阿司匹林片的分析 一、目的 1.掌握片剂分析的特点及赋形剂的干扰和排除方法。 2.掌握阿司匹林片鉴别、检查、含量测定的原理及方法。 二、操作 [鉴别] 1.取本品的细粉适量(约相当于阿司匹林0.1g),加水10mL煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。 2.取本品的细粉(约相当于阿司匹林0.5g),加碳酸钠试液10mL,振摇后,放置5分钟,滤过,滤液煮沸2分钟,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。 [检查] 游离水杨酸 取本品的细粉适量(约相当于阿司匹林0.1g),加无水氯仿3mL,不断搅拌2分钟,用无水氯仿湿润的滤纸滤过,滤渣用无水氯仿洗涤2次,每次1mL,合并滤液和洗液,在室温下通风挥发至干;残渣用无水乙醇4mL溶解后,移至100mL量瓶中,用少量5%乙醇洗涤容器、洗液并入量瓶中,加5%乙醇稀释至刻度,摇匀,分取50mL,立即加新制的稀硫酸铁铵溶液[取盐酸液(1mol/L)1mL,加硫酸铁铵指示液2mL后,再加水适量使成100mL] 1mL,摇匀;30秒钟内如显色,和对照液(精密称取水杨酸0.1g,置1000mL量瓶中,加冰醋酸1mL,
醋酸钠含量的测定(非水滴定法) 一、实验目的 1.掌握非水溶液酸碱滴定的原理及操作。 2.掌握结晶紫指示剂的滴定终点的判断方法。 二、实验原理 醋酸钠在水溶液中,是一种很弱的碱(pKb=9.24),不能在水中用强酸准确滴定。选择适当的溶剂如冰醋酸则可大大提高醋酸钠的碱性,可以HClO4为标准溶液进行滴定,其滴定反应为: H2Ac++·ClO-4+NaAc =2HAc+NaClO4 邻苯二甲酸氢钾常作为标定HClO4-HAc标准溶液的基准物,其反应如下: C6H4·COOH·COOK+H2Ac+·ClO-4==C6H4·COOH COOH+HAc+KClO4 由于测定和标定的产物为NaClO4和KClO4,它们在非水介质中的溶解度都较小,故滴定过程中随着HClO4-HAc标准溶液的不断加入,慢慢有白色混浊物产生,但并不影响滴定结果。本实验选用醋酐 冰醋酸混合溶剂,以结晶紫为指示剂,用标准高氯酸-冰醋酸溶液滴定。 三、主要仪器和试剂 1. 仪器:50mL酸式滴定管,250mL锥形瓶。 2. 试剂: (1)HClO4-HAc(0.1mol·L-1):在700~800mL的冰醋酸中缓缓加入72%(质量比)的高氯酸8.5mL,摇匀,在室温下缓缓滴加乙酸酐24mL,边加边摇,加完后再振摇均匀,冷却,加适量的无水冰醋酸,稀释至1L,摇匀,放置24h(使乙酸酐与溶液中水充分反应)。 (2)结晶紫指示剂:0.2g结晶紫溶于100mL冰醋酸溶液中。 (3)冰醋酸(A.R) (4)邻苯二甲酸氢钾(A.R) (5)乙酸酐(A.R)
(6)醋酸钠试样 四、实验步骤 1.HClO4-HAc滴定剂的标定 准确称取KHC8H4O4 0.15~0.2g于干燥锥形瓶中,加入冰醋酸20~25mL使其溶解,加结晶紫指示剂1滴,用HClO4-HAc(0.1mol·L-1)缓缓滴定至溶液呈稳定蓝色,即为终点,平行测定三份。取相同量的冰醋酸进行空白试验校正。根据KHC8H4O4的质量和所消耗的HClO4-HAc的体积,计算HClO4溶液的浓度。 2. 醋酸钠含量的测定 准确称取0.1g无水醋酸钠试样,置于洁净且干燥的250mL锥形瓶中,加入20mL醋酐 冰醋酸使之完全溶解,加结晶紫指示剂1滴,用0.1mol·L-1HClO4-HAc标准溶液滴至溶液由紫色转变为蓝色,即为终点。平行测定三份,并将结果用空白试验校正。根据所消耗的HClO4-HAc体积(mL),计算试样中醋酸钠的质量分数。
实验五食用白醋中醋酸浓度的测定 一、实验目的和要求: 1.熟练掌握滴定管、容量瓶、移液管的使用方法和滴定操作技术 2.掌握NaOH标准溶液的配制和标定方法 3.了解强碱滴定弱酸的反应原理及指示剂的选择 4.学会食醋中总酸度的测定方法 二、实验原理 醋酸为有机弱酸(Ka = 1.8×10-5 ),用NaOH标准溶液滴定,在化学计量点时溶液呈弱碱性,滴定突跃在碱性范围内,选用酚酞作指示剂,以醋酸的质量浓度(g·mL-1 )表示。 三、主要仪器和试剂: 5.碱式滴定管50mL 6.移液管25mL 7.容量瓶250mL; 8.白醋(市售) 9.氢氧化钠0.1mol·L-1 10.酚酞 2g·L-1乙醇溶液、 11.邻苯二甲酸氢钾基准物质在100 ~ 125℃干燥1h后,置于干燥器内备用。 四、实验步骤 1.0.1mol·L-1 NaOH标准溶液的配制和标定 台秤上称取4g固体NaOH于烧杯中,加入除去CO2的蒸馏水,溶解完全后加水稀释至1L混匀,转入带橡皮塞的试剂瓶中待标定。 用差减法称取邻苯二甲酸氢钾3份分别置于250mL锥形瓶中,每份0.4 ~0.6 g,加蒸馏水40~50mL,待试剂完全溶解后,加入2~3滴酚酞指示剂,用待标定的NaOH溶液滴定至呈微红色并保持30s不褪即为终点。计算NaOH溶液的浓度。要求测定的相对平均偏差≤0.2%。 2.食用白醋含量的测定
准确移取食用白醋25.00mL置于250mL容量瓶中,用蒸馏水稀释至刻度摇匀。用25mL移液管分别取3份上述溶液置于250mL锥形瓶中,加入2~3滴酚酞指示剂,用NaOH标准溶液滴定至呈微红色并保持30s不褪即为终点。计算每100mL 食用白醋中含醋酸的质量。 五、数据记录及处理 1.0.1mol·L-1 NaOH标准溶液的标定 2.食用白醋含量的测定
实验六食醋(或白醋)中醋酸含量的测定 授课时间:2011.3.12 3.15 (1班)班级:11高应用化工1班 2011.3.14 3.16 (2班)11高应用化工2班 教学目的:同“一.实验目的” 教学重点:预习方案的设计与书写、实验过程练习 教学难点:标准化实验流程与数据处理过程 教学方法:演示、讲授、实验操作 内容分析: 食醋的主要组分是醋酸(Ka=1.8×10-5),此外还含有少量其它有机酸,如乳酸等。可以用酚酞作指示剂,用NaOH标准溶液滴定,测出酸的总含量。食醋中醋酸含量一般为≥3.5%,浓度较大,且有一定的色泽,滴定前应稀释。 本实验是滴定分析中较为简单的实验,可以本实验为媒介,练习滴定分析的基本操作,并且让学生熟悉标准化实验流程。 教学内容: 一.实验目的 1.掌握碱标准溶液的配制与标定方法 2.掌握食用白醋总酸度的测定原理、方法和操作技术。 3.实验方案的自我设计、标准化数据处理过程。 二.实验原理 食醋的主要组分是醋酸(Ka=1.8×10-5),此外还含有少量其它有机酸,如乳酸等。可以用酚酞作指示剂,用NaOH标准溶液滴定,
测出酸的总含量。实际测得的结果是食醋的总酸度。因醋酸含量最多,故常用醋酸含量表示。此滴定属于强酸滴定弱酸,突跃范围偏于碱性区,选酚酞做指示剂。 食醋中醋酸含量一般为≥3.5%,浓度较大,且有一定的色泽,滴定前应稀释。 本实验参照《GB 5009.41-85食醋卫生标准的分析方法》(见附件)设计。 三.所需仪器试剂 滴定管、容量瓶、锥形瓶、移液管、洗耳球、玻璃棒、洗瓶电子天平、量筒、烧杯 0.1mol/LNaOH溶液,酚酞指示剂,食醋样品、基准邻苯二甲酸氢 钾 四.实验步骤 1.提问式演示讲解 0.1mol/LNaOH标准溶液的配制和标定,详见实验五。 根据实验人数及每人的大约需要量来设计算所需NaOH标准溶液的体积,进而计算所需称量氢氧化钠的质量(用什么称?) 强调:氢氧化钠加入水中,若浓度较大时需注意散热问题。小心迸溅。2.醋中总酸量的测定 用10 mL移液管吸取食醋一份,置于100 mL容量瓶中,用蒸馏水稀释至刻度,摇匀。
食用醋中醋酸含量的测定 一、实验目的 1、了解实样分析的方法 2、掌握碱标准溶液的标定方法; 3、掌握食醋总酸度的测定原理、方法和操作技术。 二、实验原理: 食醋中的酸性物质主要是醋酸,可以用酸碱中和反应原理,以已知浓度的氢氧化钠溶液进行中和滴定。反应方程式为:CH3COOH+NaOH=CH3COONa+H2O NaOH在称量过程中不可避免地会吸收空气中的二氧化碳,使得配制的NaOH溶液浓度比真实值偏高,最终使实验测定结果偏高,因此,为得到更准确的数据,必须将NaOH溶液以标准酸溶液邻苯二甲酸氢钾(KHC8H4O4)标定。标定时遵守酸碱中和反应原理,其中参加反应的NaOH与KHC8H4O4的物质的量之比为1∶1。 三、实验器材 试剂:醋精、糯米甜醋、白醋、陈醋、自制家醋、邻苯二甲酸氢钾、氢氧化钠、活性炭、酚酞。 仪器:烧杯、容量瓶、玻璃棒、锥形瓶、25mL酸式滴定管、25mL碱式滴定管、漏斗、滤纸、铁架台、托盘天平、25mL移液管、婆梅氏重表、分析天平、洗耳球。 四、实验步骤 食醋的中和滴定 1用移液管准确量取上述滤液各25mL,转移到250mL容量瓶中加蒸馏水到刻度线,配制成稀醋酸溶液。 2将上述各种稀醋酸溶液注入酸式滴定管中并调整液面在“0”刻度线或以下,读取刻度。 3用托盘天平准确称取200g NaOH固体,配制成500mL溶液。 4将上述NaOH溶液注入碱式滴定管中,并调整液面读取刻度。
5根据不同食醋的特点,分别从酸式滴定管中放入约20mL、10mL、5mL溶液于锥形中,滴加2~3滴酚酞指示剂,读取滴定管中刻度。 6左手控制碱式滴定者,右手不断摇晃锥形瓶,当锥形瓶里溶液呈浅红色,且在半分钟内不再褪色,停止滴定,读取滴定管刻度。 7重复2、4、5、6操作,再做六次上实验。 标定NaOH溶液 用标准酸溶——邻苯二甲酸氢钾(KHC8H4O4)标定实验所用的NaOH溶液:用分析天平准备称取一定质量的邻苯二甲酸氢钾(02000~03000g),倒入洁净的锥形瓶,加入25mL~30mL蒸馏水使邻苯二甲酸氢钾全部溶解,滴入2滴酚酞试液,然后用待标定的NaOH 溶液滴定,当锥形瓶里溶液呈浅红色,且在半分钟内不再褪色,停止滴定,记录好实验数据。重复标定三次。 五、数据处理及初步实验结果分析 用邻苯二甲酸氢钾标定NaOH溶液的浓度的数据处理 由于KHC8H4O4与NaOH中和时,二者物质的量之比为1∶1,而KHC8H4O4的式量为204,摩尔质量为204g/mol,故: n(NaOH,标)=n(KHC8H4O4)=m(KHC8H4O4)/204g/mol c(NaOH,标)=n(NaOH,标)/V(NaOH,标) 数据处理如表一所示: 用标准酸溶液标定NaOH溶液 实验序数 1 2 3 m(KHC8H4O)(g) 0.2271 0.2494 0.2413 n(NaOH,标)(mol) 0.001113 0.001223 0.001183 V(NaOH,标,始)(mL)0.211 0.10 0.27 V(NaOH,标,末)(mL)11.64 12.66 12.42 V(NaOH,标)(mL) 11.43 12.56 12.15 c(NaOH,标,n)(mol/L) 0.09740 0.09730 0.09740 c(NaOH,标)(mol/L) 0.0009740 用NaOH溶液滴定各种食醋中醋酸含量的数据处理及初步实验结果分析 原各食醋中酸的浓度应为稀释后酸浓度的10倍,即附的数据记录表中食醋中酸浓度的
电位滴定法测定食醋中醋酸的含量 一、实验目的 1 通过醋酸的电位滴定,掌握电位滴定的基本操作、PH的变化及指示剂的选择。 2 学习食用醋中醋酸含量的测定方法。 二、实验原理 食用醋的主要酸性物质是醋酸(HAC),此外还含有少量其他的弱酸。醋酸的解离常数Ka=×10-5,用NaOH标准溶液滴定醋酸,化学计量点的PH为,可选用酚酞作指示剂,滴定终点时溶液由无色变为微红色。两者的反应方程式为:HAc + NaOH = NaAc + H2O。然而在本实验滴定过程中,由于食用醋的棕色无法使用合适的指示剂来观察滴定终点,所以它的滴定终点用酸度计来测量。 本实验选用邻苯二甲酸氢钾(KHP)作为基准试剂来标定氢氧化钠溶液的浓度。邻苯二甲酸氢钾纯度高、稳定、不吸水、而且有较大的摩尔质量。标定时可用酚酞作指示剂 三、主要试剂和仪器 1 仪器:pHS-2C型酸度计、天平、电子分析天平、电磁搅拌器、容量瓶(150ml)、锥形瓶(250ml)、吸量管( ,25ml)、碱式滴定管、烧杯(250ml)、量筒(50ml) 2 试剂:NaOH、KHC8H4O4基准物质、食用醋、酚酞、去离子水 四、实验内容和步骤 1 酸度计的安装与校正
(1)开机预热30min,连接复合电极,安排好滴定管和酸度计的位置 (2)用标准缓冲溶液校准仪器(测定前要开动搅拌器):将搅拌棒放入标准缓冲溶液中,把电极插入溶液中使玻璃球完全浸没在溶液中,开动搅拌器,注意观察磁棒不要碰到电极。 (3)标准缓冲溶液定位:先将斜率旋钮顺时针调到最大,调节pHl量程至6,按下读数开关,将定位旋钮调至pH至标准缓冲溶液pH值。 (4)标准缓冲溶液调斜率:调节pH量程至8,按下读数开关,将斜率旋钮调至pH至标准缓冲溶液pH值。 (5)标准缓冲溶液定位:再调节pH量程至6,按下开关读数,将定位旋钮调至pH至标准缓冲溶液pH值。 注意事项:以上校正完成后,定位和斜率旋钮位置不能在变动! ○1在将电极插入待测溶液前,要用蒸馏水冲洗干净,用滤纸吸干水分,再放入溶液中 ○2测定应在搅拌的情况下进行 ○3测定前必须根据测量pH范围选择合适的量程 2 粗配氢氧化钠溶液 用天平称量克氢氧化钠于100ml烧杯中,加蒸馏水溶解,搅拌,可加热加速溶解。等放至室温后转移到带胶塞的试剂瓶中,共加500ml蒸馏水稀释。 3 氢氧化钠的标定(常量法)
食醋成分分析 俞中锋,陈以满,霍东娟,朱吉 氨基酸成分的测定 采用高效阴离子交换色谱及脉冲安培检测法分离并测定了食醋中多种氨基酸。用不同比例的氢氧化钠溶液、乙酸钠溶液及水组成的混合溶液作为淋洗液,以梯度淋洗方式将分离柱上的氨基酸先后洗脱并测定。用提出的方法分析了4种不同品牌的食醋样品,共测得18种氨基酸,此方法毋需柱前或柱后衍生化操作,对18种氨基酸的检出限在1.7"---20.0,ug/L范围内。根据测定每种氨基酸中所得保留时间值算得的相对标准偏差(竹一6)均小于1.2%,作标准加入法测定了各氨基酸的回收率,其值在84%~108%之间。 1试验部分 1.1仪器与试剂 Dionex ICS 2500 BioLC离子色谱装置,包括GSS0四元梯度泵,LC30柱温箱(30℃),AS50自动进样器(25 pL进样),ED50A电化学检测器。Chromeleon 6.5色谱工作站。氨基酸标准(生化级)储备液均为0.01 mg,为防止微生物生长,用20 mg叠氮化钠溶液稀释配制工作溶液。氢氧化钠溶液:用球状的氢氧化钠加水配成浓度为19.3 tool·L_1溶液,静置24 h后,取13.1 mL用水稀释至l L,配成浓度为250 mmol·L-1溶液。乙酸钠溶液:1 mol/L,称取乙酸钠820 g,用水溶解后稀释到l L,用0.20m尼龙滤膜过滤。水为去离子水。为防止淋洗液(氢氧化钠溶液和乙酸钠溶液的混合溶液)吸收空气中二氧化碳,淋洗液瓶上方需要施加大约40~50 kPa的氮气进行保护。 1.2分析条件 色谱柱:AminoPac PAl0分析柱(250 mm×2 mm)和保护柱(40 mm×2 ram)。定量环体积25肛L,柱温箱温度设为30℃。淋洗液由去离子水、250 mmol·L-1氢氧化钠溶液和l mol·L叫乙酸钠溶液按照一定的梯度程序混合得到(表1),流速0.25 mL/min。电化学检测器:金工作电极,Ag-AgCl参比电极。 2结果与讨论 2.1分离和检测条件的优化 以氢氧化钠和乙酸钠为淋洗液,选择合适的淋洗液梯度,18种常见氨基酸可在高效阴离子交换色谱柱上实现分离。其中,氢氧化钠溶液淋洗能力较弱,用来洗脱弱保留的碱性氨基酸和脂肪族氨基酸;乙酸钠溶液洗脱能力强,用来洗脱强保留的酸f生氨基酸和芳香族氨基酸,如组胺酸、苯丙氨酸、谷氨酸、天冬氨酸、胱氨酸和酪氨酸可以从色谱柱上洗脱。为了保证每次进样分析时色谱柱状态一致,每次分离结束后需要用一定浓度的氢氧化钠溶液平衡色谱柱25 min,从而提高测定结果的重现性。电极电位会影响金电极的使用寿命以及测定结果的灵敏度和精密度,试验选择的电位波形见图
醋酸是一种弱酸,如果用强碱氢氧化钠溶液来滴定,在滴定终点突变点前的pH会维持在4~6之间,因此变色范围在4~6之间的指示剂不适合,例如甲基橙就不适合。应该选择酚酞作为指示剂。 2.实验原理 2 1 食醋中的酸性物质主要是醋酸,可以用酸碱中和反应原理,以已知浓度的氢氧化钠溶液进行中和滴定。反应方程式为:CH3COOH+NaOH=CH3COONa+H2O 2 2 NaOH在称量过程中不可避免地会吸收空气中的二氧化碳,使得配制的NaOH溶液浓度比真实值偏高,最终使实验测定结果偏高,因此,为得到更准确的数据,必须将NaOH 溶液以标准酸溶液邻苯二甲酸氢钾(KHC8H4O4)标定。标定时遵守酸碱中和反应原理,其中参加反应的NaOH与KHC8H4O4的物质的量之比为1∶1。 3.实验用品 31试剂 醋精、糯米甜醋、白醋、陈醋、自制家醋、邻苯二甲酸氢钾、氢氧化钠、活性炭、酚酞。 32仪器 烧杯、容量瓶、玻璃棒、锥形瓶、25mL酸式滴定管、25mL碱式滴定管、漏斗、滤纸、铁架台、托盘天平、25mL移液管、婆梅氏重表、分析天平、洗耳球。 4.实验操作 42食醋的中和滴定 421用移液管准确量取上述滤液各25mL,转移到250mL容量瓶中加蒸馏水到刻度线,配制成稀醋酸溶液。 422将上述各种稀醋酸溶液注入酸式滴定管中并调整液面在“0”刻度线或以下,读取刻度。 423用托盘天平准确称取200g NaOH固体,配制成500mL溶液。 424将上述NaOH溶液注入碱式滴定管中,并调整液面读取刻度。 425根据不同食醋的特点,分别从酸式滴定管中放入约20mL、10mL、5mL溶液于锥形中,滴加2~3滴酚酞指示剂,读取滴定管中刻度。 426左手控制碱式滴定者,右手不断摇晃锥形瓶,当锥形瓶里溶液呈浅红色,且在半分钟内不再褪色,停止滴定,读取滴定管刻度。
冰醋酸含量测定报告 Prepared on 22 November 2020
冰醋酸的成分含量测定方法 实验目的:主要是为了测定供应商提供的冰醋酸的浓度含量是否达到标准要求(CH3COOH%>=98%)。 实验器材:烧杯三个(50ml)锥形瓶两个(带活塞1个)(250ml)酸式滴定管1个100g的精密电子秤一个 .滴管2个 实验原料:100ml的冰醋酸(无色透明液体,具有很强的挥发性,刺激性气味)的氢氧化钠(L的NaoH是无色透明液体,有腐蚀性)酚酞指示剂(主要是为了测 定溶液的碱性)蒸馏水(500ml以上)(注意不能用自来水) 实验原理:主要是通过冰醋酸与氢氧化钠的中和反应,酚酞试剂遇碱变色的原理.往稀释的冰醋酸溶液中滴入的NaOH溶液,直至溶液变成微红色。(通过化学反应, 可知1摩尔的醋酸消耗1摩尔的氢氧化钠。测出消耗多少体积的氢氧化钠, 就可以算出消耗多少摩尔的氢氧化钠,进而计算出消耗多少质量的醋酸,通 过反应消耗醋酸的质量与样品的质量百分比,就求出样品中醋酸的含量百分 比。) 化学反应式: NaOH + CH3COOH = CH3COONa + H2O 计算公式:CH3COOH%={N(NaOH)*V(NaOH)*样品重(g)*1000}*100% 实验步骤:1.先在实验室充分准备好此次实验的器材和实验的原料。(拿一个250ml的锥形瓶(带活塞)到车间的助剂室提取100ml的冰醋酸,并立即盖好塞子。 贴上标签)其他的材料均可在实验室提取。 2. 分别给烧杯编上(1、2、3)号,锥形瓶((装有样品醋酸的为1)、装稀 释的醋酸为2),滴定管(1、2) 3.开电子秤(待电子秤显示数据),接着把烧杯1放到电子称上面称量,调 零。并关闭好各个电子称的各个门。 4.把装有醋酸的锥型瓶半倾,将滴管1伸进醋酸溶液的中间吸取溶液,接着将 滴管1取出,并盖好锥形瓶1瓶子。 5.先打开电子称的顶门,将滴管1伸入电子秤上空中,滴2-3滴()左右的醋 酸溶液,关好电子秤的顶门,待秤上读数稳定,读取读数,并记录读数g。 6.把滴定管放到烧杯2中,迅速打开电子秤的侧门,将烧杯1取出,并用蒸馏 水进行稀释(将蒸馏瓶嘴贴着烧杯1口环绕注入蒸馏水),导入锥形瓶2 中,25ml左右一次,进行四次,共100ml, 7.关闭电子秤,将其他器材与移到滴定管旁边。并在滴定管下方放一张白纸, 防止滴定管漏出的NaOH溶液腐蚀试验台。 8.用滴管2吸取酚酞试剂,往锥形瓶2滴入1—2滴酚酞试剂。 9.倒入适量的氢氧化钠溶液到烧杯3.在将烧杯3的氢氧化钠溶液缓慢的倒入滴 定管中,使得滴定管的液面升到刻度10ml左右。 10.将烧杯3沾取滴定管口溢出的NaOH溶液,读取滴定管的数据,并记录V2. 11.将锥形瓶2放到滴定管的正下方,左手控制滴定管的旋转开关(主要是为 了控制滴定管的滴定速度。)一滴,一滴的放,右手拿着锥形瓶2.晃动锥形
食醋中总酸量的测定 孟娟 2012级化学3班14小组41207149 一、实验目标 1.初步学会用传感器技术测定食醋中的总酸量; 2.会组织中学生用传感器技术测定食醋中的总酸量教学过程。 二、实验原理 1.食醋中的主要成分是醋酸,此外还含有少量的乳酸等有机酸,醋酸是弱酸,用传统的pH试纸或酸度计测定食醋中的总酸量,总是要比实际浓度低,误差很大。本实验将使用传感器技术来测定食醋中的总酸量,该方法不怕待测物中的颜色干扰,测定既快又不用加指示剂。 传感器简介:传感器是一系列根据一定的物理化学原理制成的物理化学量的感应器具,它能把外界环境中的某个物理化学量的变化以电信号的方式输出,再经数据模拟装置转化成数据或图表的形式在数据采集器上显示并储存起来。中学化学教学中进行科学探究常用到的传感器有温度传感器、pH传感器、溶解氧传感器、电导率传感器、光传感器、压力传感器、色度传感器等。传感器技术的特点:便携,实时,准确,综合,直观。 pH传感器是用来检测被测物中氢离子浓度并转换成相应的可用输出信号的传感器,通常由化学部分和信号传输部分构成。pH传感器利用能斯特(NERNST)原理。 待测的食醋中醋酸及其他有机酸可换算为醋酸总量,都可以被标准的强碱NaOH溶液标定: NaOH+CH3COOH=CH3COONa+H2O C待测V待测=C标准V标准 2.当溶液中的电解质含量恒定时,电导率亦恒定,当生成难电离物质时,电导率下降,pH传感器就是把电信号转化为化学信息来测定其中的总酸度的。三、仪器与药品 pH传感器、数据采集器、自动计数器、50mL酸式滴定管、电磁搅拌器、铁架台、250mL烧杯、量筒 有色食醋原液、0.1mol/L NaOH溶液、蒸馏水 四、实验操作过程 1.准备阶段:pH传感器的标定 (1)在采集器3号传感器接口上连接好pH传感器,然后按下采集器电源开
醋酸电离常数的测定实验报告 篇一:实验四醋酸解离常数的测定 实验四醋酸解离常数的测定 (一) pH法 一. 实验目的 1. 学习溶液的配制方法及有关仪器的使用 2. 学习醋酸解离常数的测定方法 3. 学习酸度计的使用方法二. 实验原理 醋酸(CH3COOH,简写为HAc)是一元弱酸,在水溶液中存在如下解离平衡: HAc(aq) + H2O(l) ? H3O+(aq) + Ac- (aq) 其解离常数的表达式为 [c (H3O+)/cθ][c(Ac-)/ cθ] Kθa HAc(aq) = —————————————c(HAc)/ cθ 若弱酸HAc的初始浓度为C0 mol?L-1,并且忽略水的解离,则平衡时: c(HAc) = (C0 – x)mol?L-1 c (H3O+) = c(Ac-)= x mol?L-1 x Kθa HAc = ———— C0– x 在一定温度下,用pH计测定一系列已知浓度的弱酸溶液的pH。根据PH = -㏒[c (H3O+)/cθ],求出c (H3O+),
即x,代入上式,可求出一系列的Kθa HAc,取其平均值,即为该温度下醋酸的解离常数。 实验所测的4个p Kθa(HAc),由于实验误差可能不完全相同,可用下列方式处理,求p Kθa(HAc)平均和标准偏差s: n ∑ Kθai HAc i=1 θ Ka HAc = ———————— n S = 三.实验内溶(步骤) 1.不同浓度醋酸溶液的配制 2.不同浓度醋酸溶液pH的测定四.数据记录与处理 温度_18_℃ pH计编号____标准醋酸溶液浓度_0.1005_mol?L-1 实验所测的4个p Kθa(HAc),由于实验误差可能不完全相同,可用下列方式处理,求p Kθa(HAc)平均和标准偏差s: n ∑ Kθai HAc i=1 Kθa HAc = ————————
醋酸含量的测定 The Standardization Office was revised on the afternoon of December 13, 2020
食醋中醋酸含量的测定 【实验目的】 1. 了解基准物质邻苯二甲酸氢钾()的性质及其应用。 2. 掌握NaOH标准溶液的配制、标定及保存要点。 3. 掌握强碱滴定弱酸的滴定过程、突跃范围及指示剂的选择原理。 【实验用品】 仪器:50mL碱式滴定管,移液管,250mL容量平,250mL锥形瓶,分析天平,托盘天平。 试剂:邻苯二甲酸氢钾(),L ,NaOH溶液,%酚酞指示剂。【实验步骤】 溶液的标定 (1)在电子天平上,用差减法称取三份邻苯二甲酸氢钾基准物分别放入三个250mL锥形瓶中,各加入30-40mL去离子水溶解后,滴加1-2滴%酚酞指示剂。 (2)用待标定的NaOH溶液分别滴定至无色变为微红色,并保持半分钟内不褪色即为终点。 (3)记录滴定前后滴定管中NaOH溶液的体积。计算NaOH溶液的浓度和各次标定结果的相对偏差。 2. 食醋中醋酸含量的测定 (1)用移液管吸取食用醋试液一份,置于250mL容量瓶中,用水稀释至刻度,摇匀。
(2)用移液管吸取稀释后的试液,置于250mL锥形瓶中,加入%酚酞指示剂1-2滴,用NaOH标准溶液滴定,直到加入半滴NaOH标准溶液使试液呈现微红色,并保持半分钟内不褪色即为终点。 (3)重复操作,测定另两份试样,记录滴定前后滴定管中NaOH溶液的体积。测定结果的相对平均偏差应小于。 (4)根据测定结果计算试样中醋酸的含量,以g/L表示。 【实验研讨】 1. 醋酸是一种有机弱酸,其离解常数Ka = ×,可用标准碱溶液直接滴定,反应如下: 化学计量点时反应产物是NaAc,是一种强碱弱酸盐,其溶液pH在左右,酚酞的颜色变化范围是8-10,滴定终点时溶液的pH正处于其内,因此采用酚酞做指示剂,而不用甲基橙和甲基红。 2. 食用醋中的主要成分是醋酸(乙酸),同时也含有少量其他弱酸,如乳酸等。凡是CKa >的一元弱酸,均可被强碱准确滴定。因此在本实验中用NaOH滴定食用醋,测出的是总酸量,测定结果常用: 3. 食用醋中约含3%-5%的醋酸,可适当稀释后再进行滴定。白醋可以直接滴定,一般的食醋由于颜色较深,可用中性活性炭脱色后再行滴定。 4. 是标定NaOH的基准物质,因此称取时要用电子天平,并要用差减法,使其称量结果尽量精确。而称量NaOH就不需要十分准确,用托盘天平即可。
工业盐酸中铁含量的 测定
工业盐酸中铁含量的测定 1、实验目的 (1)了解并掌握1,10-菲啰啉分光光度法测盐酸中铁含量的方法及操作(2)进一步掌握分光光度计的使用方法 (3)熟练比色皿的清洗,装样等操作 (4)加强对一般溶液的配制操作练习 2、实验原理 (1)分光光度计的工作原理是基于物质对光的吸收具有选择性,不同的物质都有各自的吸收光谱,即有不同的吸光度。 (2)盐酸羟胺能将三价铁还原为二价铁。 (3)在pH为4.5的缓冲溶液体系下,二价铁能与1,10-菲啰啉发生反应,生成橙红色的配合物。 3、实验仪器 分析天平、紫外-可见分光光度计、洗瓶、胶头滴管、烧杯、比色皿、玻璃棒、移液管、洗耳球、pH试纸、滤纸、容量瓶、量筒。 4、实验药品 工业盐酸、浓氨水、浓盐酸、氢氧化钠、盐酸羟胺、乙酸——乙酸钠缓冲溶液、铁标夜(硫酸亚铁按)、1,10-菲啰啉试剂。 5、药品配置表
6、实验步骤 (1)所需溶液的配置 ①配制50mL的0.01g/L的铁标准溶液:量取5.0mL的0.1g/L的铁标液于烧杯中,用去离子水将其稀释,用50mL的容量瓶定容,备用(邱文静) ②配制250mL的(1+10)盐酸溶液:用量筒量取浓度为12mol/L的浓盐酸 22.7mL于烧杯中,再用量筒量取227.3mL的去离子水将其稀释,用250mL的容量瓶将其定容,搅拌均匀,贴上标签,以待备用(严翠平) ③配制100mL的(1+1)氨水溶液(第二次用的是氢氧化钠):用量筒量取浓氨水50mL于烧杯中再用量筒量取50mL去离子水将其稀释,搅拌均匀,贴上标签,备用(任云杰) ④配制100mL的盐酸羟胺溶液:准确称取10.0g的盐酸羟胺试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,备用(蒋滟耀)
课题6-1 食醋总酸含量的测定 长河高中包群刚 本课题内容是学生首次运用化学定量分析来解决实际问题。它由两部分内容组成:(1)总酸含量概念、测定的原理与测定过程中溶液的pH变化;(2)课题方案的设计,主要介绍了总酸含量测定的方法与步骤,常见仪器的使用与数据的处理等。通过本课题的学习,将使学生认识到定量分析在化学研究中的重要性,体会定量分析在工农业生产与生活中的实际应用价值。 一、实验目标 1.认识用NaOH溶液滴定醋酸的反应原理。 2.练习移液管、滴定管、容量瓶的使用方法,初步掌握中和滴定的基本技能。 3.能通过实验收集有关数据,并正确地加以处理。 4.应用中和滴定法测定食醋的含酸量,体验用化学定量分析方法解决实际问题的过程。5.培养学生实事求是的科学态度和创新精神。 二、实验原理 1.化学反应原理:食醋中含醋酸(CH3COOH)3~5%(质量/体积),此外还有少量乳酸等有机酸弱酸。用NaOH溶液滴定时,实际测出的是总酸量,即食品中所有酸性成分的总量。 它包括未离解的酸和已离解的酸,而分析结果通常用含量最多的醋酸来表示。它们与NaOH 溶液的反应为: CH3COOH+NaOH = CH3COONa + H2O H n A(有机酸)+nNaOH = Na n A + nH2O 由于是强碱滴定弱酸,滴定的pH突变在碱性范围内,理论上滴定终点的pH在8.7左右。通常用酚酞作指示剂,滴至溶液呈粉红色且30s内不褪色,表明达到滴定终点。 三、实验样品与仪器 待测样品:杭州香醋(白米醋) 仪器:移液管、容量瓶、碱式滴定管、酸式滴定管、锥形瓶、铁架台、滴定管夹、洗耳球、玻璃棒。 试剂:浓度约为0.100moL·L-1NaOH标准溶液、0.1%酚酞溶液,蒸馏水。 三、实验步骤 1.配制待测食醋溶液 用25mL移液管吸取市售食醋25mL,置于250mL容量瓶中,加水稀释至刻度,摇匀即得待测食醋溶液。
实验三 食用白醋中醋酸含量的测定 一、实验目的与要求 1.掌握NaOH 标准溶液的配制、标定方法及保存要点; 2.了解基准物质邻苯二甲酸氢钾的性质及应用; 3.掌握强碱滴定弱酸的滴定过程、突跃范围及指示剂的选择原理。 二、实验原理 1.HAc 浓度的测定 醋酸为有机弱酸(K a =×10-5 ),与NaOH 反应式为: 反应产物为弱酸强碱盐,滴定突跃在碱性范围内,可选用酚酞等碱性范围变色的指示剂。食用白醋中醋酸含量大约在30-50 mg/ml 。 2.NaOH 标准溶液的标定 NaOH 在称量过程中不可避免地会吸收空气中的二氧化碳,使得配制的NaOH 溶液浓度比真实值偏高,最终使实验测定结果偏高,因此,为得到更准确的数据,必须将NaOH 溶液以标准酸溶液邻苯二甲酸氢钾(448O H KHC )标定。 在邻苯二甲酸氢钾的结构中只有一个可电离的H + 离子,其与NaOH 反应的计量比为1:1。标定时的反应为: 邻苯二甲酸氢甲作为基准物的优点:(1)易于获得纯品;(2)易于干燥,不吸湿;(3)摩尔质量大,可相对减少称量误差。 式中:m 邻苯二甲酸氢钾——邻苯二甲酸氢钾质量/g mL V NaOH /——NaOH 体积/mL 三、仪器与试剂 酸式滴定管(50mL)、碱式滴定管(50mL)、锥形瓶(250mL)、滴定台、蝴蝶夹、玻璃量筒(10mL)、烧杯、 移液管、滴瓶、试剂瓶(带橡胶塞)。NaOH (s).)、酚酞指示剂%乙醇溶液)、邻苯二甲酸氢钾(s).在100~125℃
下干燥1h 后,置于干燥器中备用)。 四、实验步骤 1.NaOH L mol 1.1.0-溶液的标定 洗净碱式滴定管,检查不漏水后,用所配制的NaOH 溶液润洗2~3次,每次用量5~10mL ,然后将碱液装入滴定管中至“0”刻度线上,排除管尖的气泡,调整液面至刻度或零点稍下处,静置1min 后,精确读取滴定管内液面位置,并记录在报告本上。 用差减法准确称取约 g 已烘干的邻苯二甲酸氢钾三份,分别放入三个已编号的250 mL 锥形瓶中,加50 mL 水溶解(若不溶可稍加热,冷却后),加入1~2 滴酚酞指示剂,用 mol ·L -1 NaOH 溶液滴定至呈微红色,半分钟不褪色,即为终点。计算NaOH 标准溶液的浓度。 2.食用白醋中醋酸含量的测定 用移液管吸取食用白醋试液,置于250mL 容量瓶中,用水稀释至刻度,摇匀。用移液管吸取稀释后的试液,置于250mL 锥形瓶中,加入%酚酞指示剂1-2滴,用NaOH 标准溶液滴定,直到加入半滴NaOH 标准溶液使试液呈现微红色,并保持半分钟内不褪色即为终点。平行测定三次,测定结果的相对平均偏差应小于%。 五、实验数据记录与处理 1.NaOH L mol 1.1.0-溶液的标定 项目 1 2 3 m 邻苯二甲酸氢钾/g NaOH C /)./(1-L mol 偏差 相对平均偏差 2.食用白醋中醋酸含量的测定
实验三食用白醋中醋酸含量的测定
实验三 食用白醋中醋酸含量的测定 一、实验目的与要求 1.掌握NaOH 标准溶液的配制、标定方法及保存要点; 2.了解基准物质邻苯二甲酸氢钾的性质及应用; 3.掌握强碱滴定弱酸的滴定过程、突跃范围及指示剂的选择原理。 二、实验原理 1.HAc 浓度的测定 醋酸为有机弱酸(K a =1.8×10-5),与NaOH 反应式为: O H NaAc NaOH HAc 2+=+ 反应产物为弱酸强碱盐,滴定突跃在碱性范围内,可选用酚酞等碱性范围变色的指示剂。食用白醋中醋酸含量大约在30-50 mg/ml 。 2.NaOH 标准溶液的标定 NaOH 在称量过程中不可避免地会吸收空气中的二氧化碳,使得配制的NaOH 溶液浓度比真实值偏高,最终使实验测定结果偏高,因此,为得到更准确的数据,必须将NaOH 溶液以标准酸溶液邻苯二甲酸氢钾(448O H KHC )标定。 在邻苯二甲酸氢钾的结构中只有一个可电离的H +离子,其与NaOH 反应的计量比为1:1。标定时的反应为: O H O H KNaC NaOH O H KHC 2448448+=+ 邻苯二甲酸氢甲作为基准物的优点:(1)易于获得纯品;(2)易于干燥,不吸湿;(3)摩尔质量大,可相对减少称量误差。
1 .1000)( -?=L mol V M m C NaOH NaOH 邻苯二甲酸氢钾 式中:m 邻苯二甲酸氢钾——邻苯二甲酸氢钾质量/g mL V NaOH /——NaOH 体积/mL 三、仪器与试剂 酸式滴定管(50mL)、碱式滴定管(50mL)、锥形瓶(250mL)、滴定台、蝴蝶夹、玻璃量筒(10mL)、烧杯、移液管、滴瓶、试剂瓶(带橡胶塞)。 NaOH (s)(A.R.)、酚酞指示剂(0.2%乙醇溶液)、邻苯二甲酸氢钾(s)(A.R.在100~125℃下干燥1h 后,置于干燥器中备用)。 四、实验步骤 1.NaOH L mol 1.1.0-溶液的标定 洗净碱式滴定管,检查不漏水后,用所配制的NaOH 溶液润洗2~3次,每次用量5~10mL ,然后将碱液装入滴定管中至“0”刻度线上,排除管尖的气泡,调整液面至0.00刻度或零点稍下处,静置1min 后,精确读取滴定管内液面位置,并记录在报告本上。 用差减法准确称取约0.6 g 已烘干的邻苯二甲酸氢钾三份,分别放入三个已编号的250 mL 锥形瓶中,加50 mL 水溶解(若不溶可稍加热,冷却后),加入1~2 滴酚酞指示剂,用0.1 mol ·L -1 NaOH 溶液滴定至呈微红色,半分钟不褪色,即为终点。计算NaOH 标准溶液的浓度。 2.食用白醋中醋酸含量的测定 用移液管吸取食用白醋试液25.00mL ,置于250mL 容量瓶中,用水稀释至刻度,摇匀。用移液管吸取25.00mL 稀释后的试液,置于250mL 锥形瓶中,加入