
高一 班学号 姓名 上学期期中化学复习题1
1. 下列物质属于纯净物的是 ( )
A .盐酸
B .漂白粉
C .液氯
D .氯水
2. 下列各组仪器:①漏斗;②容量瓶;③试剂瓶;④分液漏斗;⑤天平;⑥量
筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是 ( )
A .①③⑦
B .②⑥⑦
C .①④⑧
D .④⑥⑧
3. 下列叙述正确的是 ( )
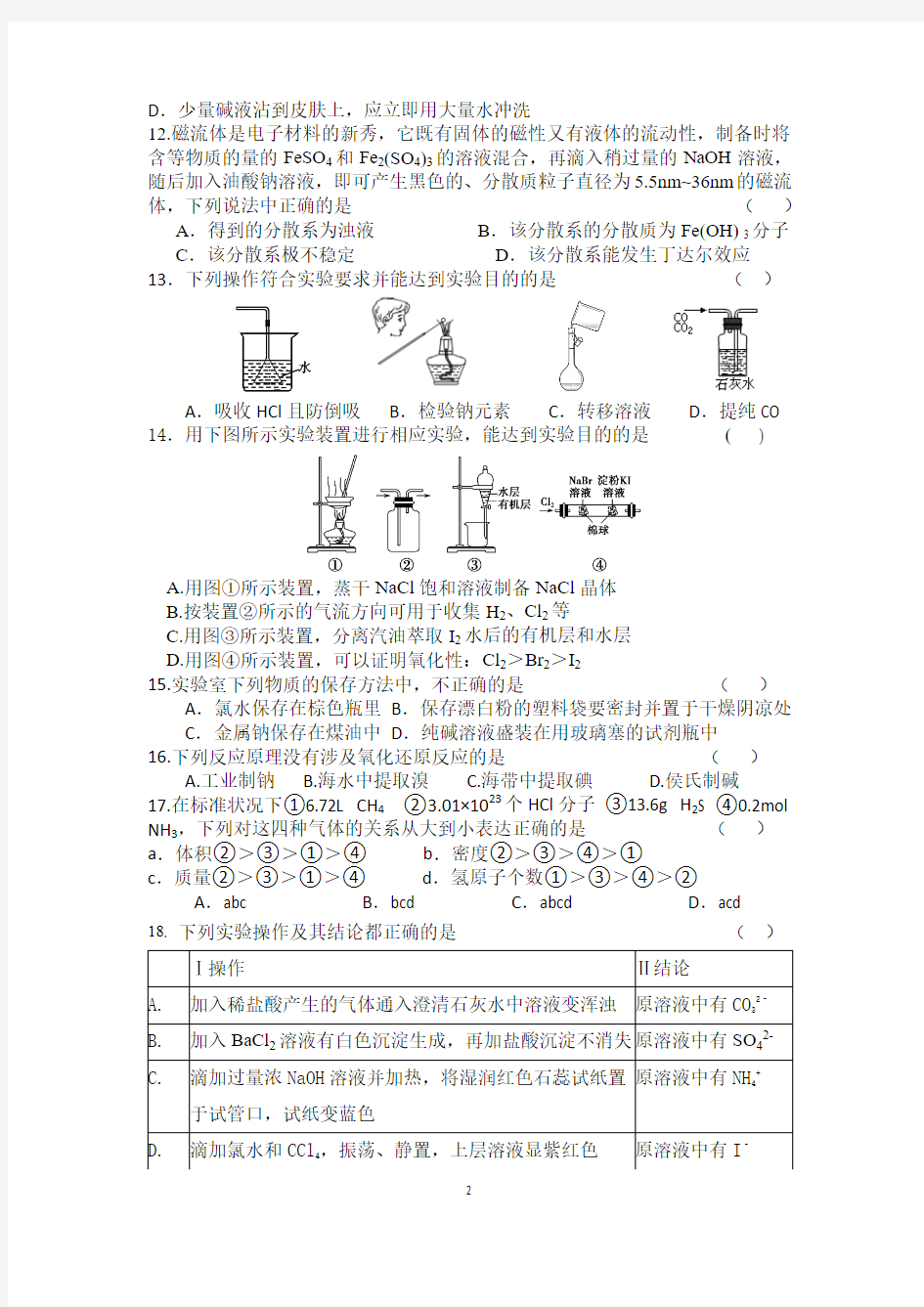
A .由同种元素组成的物质肯定是纯净物
B .含金属元素的离子一定是阳离子
C .一种元素可能形成多种核素
D .具有相同质子数的粒子都属于同种元素
4. 下列属于既能导电又是电解质的是 ( )
A .液态氯化氢 B. 新制氯水 C. 小苏打固体 D .熔融苏打
5.等物质的量的N 2和14CO 相比较,下列叙述中正确的是 ( )
A .体积一定相等
B .在同温同压下密度一定相等
C .在标准状况下质量一定相等
D .分子数一定相等
6. 判断下列有关化学基本概念的依据正确的是 ( )
A.溶液与胶体:本质区别是能否发生丁达尔效应
B.纯净物与混合物:是否仅含有一种元素
C.氧化还原反应与非氧化还原反应:是否有化合价改变
D.电解质与非电解质:物质本身的导电性
7.不属于四种基本反应类型,但属于氧化还原反应的是 ( )
A .2KMnO 4=====△K 2MnO 4+MnO 2+O 2↑
B .2Na +Cl 2=====△2NaCl
C .Fe +CuSO 4===Cu +FeSO 4
D .Fe 2O 3+3CO=====高温2Fe +3CO 2
8.下列有关“物质的量”的说法正确的是 ( )
A .物质的量就是1mol 物质所具有的质量
B .物质的量就是1mol 物质所具有微粒的数量
C .物质的量是国际单位制中的七个基本单位之一
D .物质的量用于表示含有一定数目微粒的集体
9.下列有关“摩尔质量”的说法正确的是 ( )
A .H 2SO 4的摩尔质量在数值上一定等于其相对分子质量
B .O 2的摩尔质量为32
C .任何条件下,H 2O 的摩尔质量都是18g/mol
D .若H 2的物质的量为2mol ,则其摩尔质量为4g/mol ,
10.下列有关“摩尔体积”的说法正确的是 ( )
A .气体摩尔体积就是22.4L/mol
B .常温常压下,1mol 任何气体所占的体积约为22.4L
C .若1mol 某气体所占体积为22.4L ,则该气体不一定处于标准状况下
D .相同物质的量的两种气体的体积大小由气体分子的大小决定
11.化学与生活是紧密相联的,下列说法不正确的是 ( )
A .针对流感、水痘等传染病的扩散情况,要加强环境、人员等的消毒预防,其
中消毒剂常选用含氯消毒剂、双氧水等适宜的物质
B .氯气泄漏时,应用蘸有肥皂水等碱性溶液的湿毛巾捂住口鼻疏散到安全地带
C .为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
D.少量碱液沾到皮肤上,应立即用大量水冲洗
12.磁流体是电子材料的新秀,它既有固体的磁性又有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可产生黑色的、分散质粒子直径为5.5nm~36nm的磁流体,下列说法中正确的是()A.得到的分散系为浊液B.该分散系的分散质为Fe(OH) 3分子C.该分散系极不稳定D.该分散系能发生丁达尔效应13.下列操作符合实验要求并能达到实验目的的是()
A.吸收HCl且防倒吸B.检验钠元素C.转移溶液D.提纯CO 14.用下图所示实验装置进行相应实验,能达到实验目的的是(
)
A.用图①所示装置,蒸干NaCl饱和溶液制备NaCl晶体
B.按装置②所示的气流方向可用于收集H2、Cl2等
C.用图③所示装置,分离汽油萃取I2水后的有机层和水层
D.用图④所示装置,可以证明氧化性:Cl2>Br2>I2
15.实验室下列物质的保存方法中,不正确的是()
A.氯水保存在棕色瓶里B.保存漂白粉的塑料袋要密封并置于干燥阴凉处C.金属钠保存在煤油中D.纯碱溶液盛装在用玻璃塞的试剂瓶中
16.下列反应原理没有涉及氧化还原反应的是()
A.工业制钠
B.海水中提取溴
C.海带中提取碘
D.侯氏制碱
17.在标准状况下①6.72L CH4②3.01×1023个HCl分子③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是()a.体积②>③>①>④b.密度②>③>④>①
c.质量②>③>①>④d.氢原子个数①>③>④>②A.abc B.bcd C.abcd D.acd
18. 下列实验操作及其结论都正确的是()
19.有一在空气中暴露过的NaOH固体,经分析知其含H
2O7.65%,含Na
2
CO
3
4.32%,其余是NaOH。若将10.0g样品放入300mL 1mol/L的盐酸,使其充分
作用后,残留酸用0.100mol/L的NaOH溶液恰好中和完全。则蒸发所得溶
液,得到固体质量 ( )
A. 17.55g
B. 11.7g
C.23.4g
D. 无法计算
20.用N A表示阿伏德罗常数,下列叙述正确的是()
A.标准状况下,22.4LH2O含有的分子数为1N A
B.常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 N A
C.通常状况下,N A个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,1L溶液中含有Cl-个数为 N A
21.科学家及其提出学说与贡献的叙述不对应的是()
A.道尔顿提出原子学说
B.汤姆生发现电子,并提出原子结构轨道模型
C.舍勒发现了氯气
D.卢瑟福根据α粒子散射现象,提出了带核的原子结构模型
22.鉴别NaCl、NaBr、NaI三种溶液不可以选用的试剂是 ( )
A.硝酸银、硝酸溶液 B.氯水、淀粉溶液
C.淀粉碘化钾试纸 D.氯水、CCl
4
23. NaCl是一种化工原料,可以制备一系列物质(如下图)。下列说法正确的是
()
A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.图中所示转化反应都是氧化还原反应
24.钠与氯气反应的装置作如下图改进,将一根玻璃管与氯气发生器相连,玻璃
管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH
溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见
钠着火燃烧,生成大量白烟。以下叙述错误的是 ( ) A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉
球是用于吸收过量的氯气,以免其污染空气
C.钠着火燃烧产生苍白色火焰
D.若在棉球外沿滴一滴淀粉碘化钾溶液,据其颜色变化判断氯气是否被碱
液完全吸收
25.少量的金属钠长期暴露在空气中,它的最终产物是()
A.NaOH
B. Na
2CO
3
?10H
2
O C.Na
2
CO
3
D.NaHCO
3
26.将少量金属钠分别投入下列物溶液中,有气体放出且溶液质量减轻的是( )
A.HCl B.NaOH C.K
2SO
4
D.CuSO
4
27.下列溶液,不用其他试剂,也不用焰色反应就能将它们区别开来的是( )
A.AgNO
3NaCl BaCl
2
NaOH B.K
2
CO
3
KHCO
3
HCl H
2
SO
4
C. Na
2CO
3
NaHSO
4
Ba(NO
3
)
2
KCl D.KNO
3
NaCl BaCl
2
(NH
4
)
2
SO
4
28.为了除去KCl固体中少量K2SO4和CaCl2杂质,需进行下列六项操作,正确的
次序是:①加水溶解②蒸发结晶③加过量BaCl2溶液④加过量盐酸
⑤加过量K2CO3 ⑥过滤()
A.①⑤③⑥④②B.①⑤③④⑥②
C.①③④⑥⑤②D.①③⑤⑥④②
29.下列溶液中的Cl-浓度与150 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是( ) A.150 mL 1 mol·L-1 NaCl溶液B.75 mL 1 mol·L-1 MgCl2溶液
C.50 mL 3 mol·L-1 NaClO溶液D.150 mL 3 mol·L-1 KCl溶液
30.关于钠的描述正确的是( )
①钠在自然界既有游离态又有化合态存在;②金属钠着火可以用泡沫灭火器救火;③工业电解熔融氯化钠来制取钠;④Na-K合金做快中子反应堆的导热剂;
⑤钠比铜活泼,因而钠可以从CuCl2溶液中置换出铜;⑥钠在空气中燃烧,主要产物Na2O2
A.①③④⑤⑥B.③④⑥C.③④D.全部
31. 下图是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳
定性的套管实验,下列说法错误
..的是()
A.甲为小苏打,乙为纯碱
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.整个实验过程中可以看到丙烧杯的澄清石灰水没变浑浊
D.同质量的甲和乙完全反应消耗的同浓度的盐酸体积:甲>乙
32.现有下列反应式,据两式判断,下列各组粒子中,氧化性由强到弱的排列顺序正确的是()
(1)2Fe3++2I 2Fe2++I
2(2)Br
2
+2Fe 2Fe3++2Br—
A.Br
2>Fe2+> I
2
B.Br
2
>Fe3+> I
2
C.I
2
> Br
2
>Fe3+ D.Fe3+> Br
2
> I
2
33.已知工业上制备二氧化氯的方法之一是:CH
3OH+6NaClO
3
+3H
2
SO
4
=6ClO
2
+CO
2
+3Na
2SO
4
+5H
2
O,则下列说法正确的是()
A.氧化剂是甲醇B.氧化剂与还原剂的物质的量之比为2∶1
C.氧化产物是二氧化氯D.还原产物与氧化产物的物质的量之比为6∶1
34.现有25mL 2mol·L–1的Na2CO3溶液和75mL 1mol·L–1的稀盐酸。(1)将Na2CO3溶液逐滴滴入稀盐酸中;(2)将稀盐酸逐滴滴入Na2CO3溶液中。两操作的现象
及结果(标准状况下)为()A.现象相同,所得气体的体积相等B.现象相同,所得气体的体积不等
C.恰好完全沉淀时需消耗Na2SO4溶液的体积为125 mL
D.混合前,Na2SO4溶液的物质的量浓度为5 mol·L-1
36.有以下几种物质:①食盐晶体②乙醇③水银④蔗糖⑤醋酸⑥KNO3
溶液⑦熔融的氢氧化钠⑧液态氯化氢。请按要求填空回答(填序号
...):(1)以上物质可以导电的是;
(2)以上物质中属于电解质的是;属于非电解质的是。
(3)液态氯化氢在中的电离方程式为。
37.(1)微粒A R n+的中子数为A-x+n,则该原子的组成可表示为,mg R n+核外电子的物质的量为。
(2)与氖原子电子层结构相同且得两个电子后呈中性的微粒结构示意图为。(3)已知碳有12C、13C、14C,氧有16O、17O、18O,它们能形成种CO2分子。(4)提纯混有少量NaCl的KNO3粉末的方法(填步骤):。(5)V L Fe2 (SO4)3溶液中含a g SO42-,则C(SO42-)为;取此溶液0.5 V L加水将其稀释至2 V L,则稀释后溶液中C(Fe3+)为。
38.现用质量分数为98%的浓硫酸(密度为1.84g/cm3)来配制450mL 0.2mol?L﹣1
的稀硫酸,可供选择的仪器有:①玻璃棒②烧杯③胶头滴管④量筒(1)除上述仪器外,尚缺最重要的仪器是。
(2)需用量筒量取浓硫酸的体积为mL。
(3)在配制过程中,下列操作可引起所配溶液浓度偏低的有(填序号)A. 定容时,仰视刻度线; B. 未冷却至室温就转移到容量瓶中;
C. 容量瓶中含有少量蒸馏水;
D. 未洗涤稀释浓硫酸时用过的烧杯和玻璃棒;
E. 定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
39.工业制氯气的化学方程式为。与电源正极相连的一极收
集到的气体是,检验该气体的化学方程式。若电解一段时间后,与电源正极相连的一极收集到的4.48 L气体(标准状况下),若
与完全反应最多能产生g漂白粉,共转移了个电子(设N
为阿伏加德罗常数的值)。
A
40. 下图是实验室制备氯气并进行一系列
相关实验的装置(夹持及加热仪器已略)。
(1)制备氯气选用的药品为固体二氧化锰
和浓盐酸,则相关的化学反应方程式
为:,若产生
了标况下4.48L氯气,被氧化的
HCl g,共转移了个电子(设N
为阿伏加德罗常数的值)。装置B中饱和食
A
盐水的作用是;
(2)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入(大量、少量)氯气时,可以看到无色溶液逐渐变为色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是。(3)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式:。(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次
量减少了 0.31g,则原混合物中碳酸钠的质量为 g
42.一块表面已被氧化为氧化钠的钠块5.4g,投入362.7g水中产生了0.1g气体,则原来被氧化的钠是 g,生成的溶液中Na+与H
O的个数比为。
2
43. 取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入1.00mol/L的HCl溶液,
产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间
关系如图所示,通过计算回答:
(1)A溶液中的溶质为_________(化学式),其物质的量之
比是_______。
(2)通入CO2气体体积__________________(标准状况)。
(3)NaOH溶液的物质的量浓度______________________。
44.在硫酸钠和硫酸铝的混和溶液中,C(Al3+)为0.2mol/L,C(SO42-)为0.4mol/L,
则C(Na+)为 mol/L。
45.为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准准
(233)= 。
(2)盐酸的物质的量浓度c(HCl)= 。
高一化学必修一期中试题2 本试卷分选择题和非选择题两部分,满分100分。 常用相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 S:32 K:39 Fe:56 第Ⅰ卷(选择题,共50分) 一、选择题(每题只有一个选项符合题意,每题2分,共20分。) 1.将30 mL 0.5mol/L 的NaOH 溶液加水稀释到500 mL ,稀释后NaOH 的物质的量浓度为( ) A .0.3 mol/L B .0.03 mol/L C .0.05 mol/L D .0.04 mol/L 2.下列物质属于电解质的是( ) A .铜 B .食盐水 C .烧碱 D .蔗糖 3.下列对“摩尔”的叙述不正确... 的是( ) A .摩尔是一个单位,可用于计量物质所含微观粒子的多少。 B .摩尔既能用来计量纯净物,又能用来计量混合物。 C .1mol 任何气体所含的气体分子数目都相等。 D .用“摩尔”(而不用“个”)计量微观粒子与用“纳米”(而不用“米”)计量原子直径,计量思路都是扩大单位。 4.下列化学方程式中,不.能用.. 离子方程式Ba 2+ + SO 4 2— = BaSO 4↓表示的是( ) A .Ba(NO 3)2 +H 2SO 4= BaSO 4↓+2HNO 3 B .BaCl 2+ Na 2SO 4= BaSO 4↓+2 NaCl C .BaCO 3 + H 2SO 4= BaSO 4↓+ H 2O+CO 2↑ D .BaCl 2+ H 2SO 4= BaSO 4↓+2HCl 5.下列说法正确的是( ) A .能电离出H + 的化合物叫做酸 B .实验测得1mol 某气体体积为22.4L ,测定条件一定是标准状况 C .摩尔是七个基本物理量之一 D .化合物分为酸、碱、盐和氧化物是用树状分类法分类的 6.同温同压下,同体积的甲乙两种气体的质量比是17:14。若乙气体是CO ,则甲气体是( ) A .H 2S B .HCl C .NH 3 D .Cl 2 7.下列各组物质,按化合物、单质、混合物的顺序排列的是( ) A .烧碱、液态氧、碘酒 B .生石灰、白磷、熟石灰 C .干冰、铁、氯化氢 D .空气、氮气、胆矾 8.下列四种物质的溶液,其中一种与其它三种能发生离子反应,这种物质是( ) A .H 2SO 4 B .KOH C .BaCl 2 D .Na 2CO 3 9.下列溶液与20mL 1 mol·L —1 NaNO 3溶液中NO 3—物质的量浓度相等的是( ) A .10 mL 1 mol·L —1 Mg(NO 3)2溶液 B .5 mL 0.8 mol·L —1 Al(NO 3)3溶液 C .10 mL 2 mol·L —1 AgNO 3溶液 D .10 mL 0.5 mol·L —1 Cu(NO 3)2溶液 10.1g N 2中含有x 个原子,则阿伏伽德罗常数是( ) A . 28x mol —1 B .14 x mol —1 C .14x mol —1 D .28x mol —1 二、选择题(每题有1~2个选项符合题意,每题3分,部分得分1分,共30分。) 11.实验室用固态不纯氯化钠(含少量NH 4HCO 3和Na 2SO 4杂质)制取纯净氯化钠溶液。下列操作 可供选用:①逐滴加入稀盐酸,调节pH 值为5;②煮沸;③加蒸馏水溶解;④加热至不再产生气体为止;⑤加入稍过量的Na 2CO 3溶液;⑥加入稍过量的BaCl 2溶液;⑦过滤。上述实验操作的正确顺序应是( ) A .①②⑤⑥⑦③④ B .③④⑥⑤⑦①② C .④③⑥⑤⑦①② D .④③⑤⑥⑦②① 12.下列各组中的离子,能在水溶液中大量共存的是( ) A .K +、H +、SO 42—、OH — B .Na +、Ca 2+、CO 32—、NO 3— C .Na +、H +、Cl —、CO 32— D .Na +、Cu 2+、SO 42—、Cl — 13.设N A 为阿佛加德罗常数,下列对于0.3mol/L 的硫酸钾溶液的说法中不正确...的是( ) A .1L 溶液中含有0.6N A 个钾离子 B .1L 溶液中含有钾离子和硫酸根离子总数为0.9N A C .2L 溶液中钾离子浓度为1.2mol/L D .2L 溶液中含有硫酸根离子0.6N A 个 14.下列操作中不正确... 的是( ) A .过滤时,玻璃棒与三层滤纸的一边接触。 B .过滤时,漏斗下方紧贴烧杯内壁。 C .加热试管内物质时,试管底部与酒精灯灯芯接触。 D .向试管中滴加液体时,胶头滴管紧贴试管内壁。 15.下列离子方程式中,正确的是( ) A .稀硫酸滴在铜片上:Cu + 2H + = Cu 2+ + H 2↑ B .氧化镁与稀盐酸混合:MgO + 2H + = Mg 2++ H 2O C .铜片插入硝酸银溶液中:Cu + Ag + = Cu 2+ + Ag D .铁与稀硫酸反应 2 Fe + 6H + = 2Fe 3+ + 3H 2↑ 16.200 ml Fe 2(SO 4)3溶液中含Fe 3+ 56g ,溶液中SO 42—的物质的量浓度是( )
2019-2010学年上学期期中考试 高一化学试题 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至4页,第Ⅱ卷5至8页。满分100分,考试时间90分钟。 相对原子质量:H 1 C 12N 14O 16Na 23Al 27S 32Cu 64 Cl 35.5 第Ⅰ卷(选择题共50分) 注意事项: 1. 答第Ⅰ卷前,考生务必将自己的姓名、考号、试卷类型、考试科目用铅笔涂写在答题卡上。 2. 每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试卷上。 一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个 ....选项符合题意。) 1.对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是 A.B.C.D. 2.下列关于物质的元素组成或分类的说法正确的是 A.碱都含氢元素B.酸都含氧元素 C.盐都含金属元素D.漂粉精、液氯、干冰均为混合物 3.下列是关于氯水的叙述,正确的是( ) 和HClO分子 B.新制氯水可使蓝色石蕊试纸先变红后褪色A.新制氯水中只含Cl 2 C.光照氯水有气泡冒出,该气体为Cl D.氯水放置数天后,pH值将增大 2
4.某国外化学教材中有一张关于氧化还原反应的插图:由图可知,在该反应中是 A.还原剂 B.氧化剂 C.氧化产物 D.还原产物 5.下列说法正确的是 A.在标准状况下,1mol水的体积是22.4 L B.1mol H 2 所占的体积一定是22.4L C.1 L0.5 mol·L-1的 MgCl 2 溶液中,含有Cl-的个数为0.5N A(N A为阿伏加德罗常数) D.在标准状况下,总质量为28 g的N 2 和CO的混合气体,其体积约为22.4 L 6.0.8 g某物质含有3.01×1022个分子,该物质的相对分子质量约为 A.8 B.16 C.64 D.160 7.下列说法中,不正确 ...的是 A.可以利用丁达尔效应区分胶体和溶液 B.胶体中分散质微粒直径通常大于100 nm C.根据分散质微粒直径大小,可将分散系分为溶液、胶体和浊液 D.向沸水中逐滴加入1mol·L—1FeCl 3溶液,煮沸至液体呈红褐色,制得Fe(OH) 3 胶体 8.现有NaOH、 Na 2CO 3 、 Ba(OH) 2 三种溶液,选用一种试剂把它们一次鉴别出来,可选用() A.稀盐酸 B.稀硫酸 C.BaCl 2溶液 D.Na 2 SO 4 溶液 9.下列离子检验的方法不正确的是() A.某溶液中加入硝酸银溶液生成白色沉淀,说明原溶液中一定有Cl-离子 B.某溶液中加入盐酸酸化的氯化钡溶液生成白色沉淀,说明原溶液中可能有SO 4 2-离子C.某溶液中加入氢氧化钠溶液生成蓝色沉淀,说明原溶液中一定有Cu2+离子 D.某溶液中加入稀硫酸溶液产生无色气体,说明原溶液中可能有CO 3 2-离子 10.下列反应的离子方程式书写正确的是 A.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu B.稀 H 2SO 4 与铁粉反应:2Fe+6H+=2Fe3++3H 2 ↑ C.氢氧化钡溶液与稀 H 2SO 4 反应:Ba2++SO 4 2-=BaSO 4 ↓ D.碳酸钙与盐酸反应:CO 32-+2H+=H 2 O+CO 2 ↑ 二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个 ....选项符合题意。)
高一上学期化学期中考试试卷(A) 姓名:________ 班级:________ 成绩:________ 一、单选题 (共14题;共28分) 1. (2分)(2016·宜丰模拟) 下列措施不符合“绿色化学”思想的是() A . 循环使用物料 B . 用水代替有机溶剂 C . 直接排放电镀废水 D . 发展原子利用率达到100%的化学反应 2. (2分)(2016·四川模拟) 下列做法中,利用了氧化还原反应原理的是() A . 用活性炭吸附新装修居室里的有害气体 B . 用K2Cr2O7检查司机是否酒后驾车 C . 用盐酸清洗陶瓷面盆上的铁锈迹 D . 用石灰水吸收燃煤烟气中的SO2 3. (2分) (2018高一上·双峰月考) 下列实验操作中正确的是() A . 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处 B . 蒸发操作时,应使混合物中的水分完全蒸干后才能停止加热 C . 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 D . 分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从下口放出到另一个烧杯中 4. (2分)化学与生活密切相关.下列有关说法正确的是() A . 利用稀硝酸清除铜镜表面的铜锈是因为稀硝酸具有强氧化性 B . 燃料的脱硫脱氮、NO的催化转化都是减少酸雨产生的措施 C . BaCO3难溶于水,在医学上常用作钡餐
D . 工业上通过电解NaCl溶液制取Na 5. (2分) (2016高一上·抚州期中) 下列反应中,铁元素被氧化的是() A . FeS+2HCl=FeCl2+H2S↑ B . Fe+H2SO4=FeSO4+H2↑ C . FeO+2HCl=FeCl2+H2O D . Fe2O3+3CO=2Fe+3CO2 6. (2分)鉴别FeCl3溶液和Fe(OH)3胶体,下列方法中最简单有效的是() A . 加入足量的NaOH溶液 B . 加热煮沸 C . 加入足量的盐酸 D . 观察是否产生丁达尔现象(效应) 7. (2分)制印刷电路时常用FeCl3溶液作为“腐蚀液”,发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2向盛有FeCl3溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是() A . 有 Cu无Fe B . 有Fe无Cu C . Fe、Cu都有 D . Fe、Cu都无 8. (2分) (2016高二上·社旗开学考) 在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g?cm ﹣3 ,这种氨水的物质的量浓度和溶质的质量分数分别为() A . 18.4mol?L﹣134.7% B . 20.4mo l?L﹣138.5%q2 C . 18.4mol?L﹣138.5% D . 20.4mol?L﹣134.7%
江西省2021版高一下学期期中化学试卷(I)卷 姓名:________ 班级:________ 成绩:________ 一、选择题 (共16题;共33分) 1. (2分) (2019高一上·上海期末) 下列书写错误的是() A . 硫酸的分子式H2SO4 B . 甲烷的结构式 C . Mg原子结构示意图 D . 溴化氢的电子式 2. (2分)从化学角度看,下列叙述正确的是() A . 海水晒盐属于化学变化 B . 电动车充电是化学能转变为电能 C . 不锈钢属于复合材料 D . 燃油以雾状喷出有利于完全燃烧 3. (2分) (2016高一下·长沙期中) 1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298.以下叙述不正确的是() A . 该元素属于第七周期 B . 该元素位于ⅢA 族 C . 该元素为金属元素,性质与Pb相似 D . 该同位家原子含有114个电子,184个中子 4. (2分)下列化学用语或模型正确的是()
A . 氯化氢的电子式: B . 硫离子结构示意图: C . 8个中子的碳原子:12C D . CH4分子的比例模型: 5. (2分) (2016高一下·三门峡期中) 能说明Cl的非金属性比S强的事实有() ①常温下S为固体,而Cl2为气体 ②Cl2与H2混合,强光照射剧烈反应,而S与H2反应需较高温度 ③与Fe反应,Cl2生成FeCl3 ,而S生成FeS ④盐酸是强酸,而氢硫酸是弱酸 ⑤将Cl2通入氢硫酸中可置换出S. A . ①③⑤ B . ②③⑤ C . ②③④ D . ②③④⑤ 6. (2分) (2018高三下·河北开学考) 将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 mol·L-1·min-1;乙:v(N2)=2 mol·L -1·min-1;丙:v(NH3)= 1 mol·L-1·min-1。则三个容器中合成氨的反应速率() A . v(甲)>v(乙)>v(丙) B . v(乙)>v(丙)>v(甲) C . v(丙)>v(甲)>v(乙)
高一英语期中模拟试题 【模拟试题】 第一部分:听力(略) 非听力题 第二部分:英语知识运用(共两节,满分35分) 第一节:单项填空(共15小题;每小题1分,满分15分) 16. The rude man just went on _________ up the boy although I told him to stop . A. beating B. to beat C. beat D. beaten 17. Our cat can see well in ___________ dark , so she always lives an active life after _____ dark . A. the ; the B. the ; 不填 C. 不填; the D. 不填;不填 18. After I went there ________ the first time last May , I have been there ______ another 5 times . A. at ; for B. in ; 不填 C. for ; 不填 D. 不填; for 19. Though these apples _________ good , they ________ very sweet . A. don’t look , taste B. aren’t looked ; are tasted C. don’t seem ; are tasted D. aren’t seem ; taste 20. You won’t be able to finish the work ___________ you start right now . A. if B. so that C. if not D. unless 21. As we were all asleep , ________ of us heard the sound . A. both B. none C. neither D. few 22. I have been working in the company for ___________ years . A. a many good B. good many C. many good D. a good many 23. —What colour is your jacket ? —My jacket is the same colour ________ . A. like you B. like yours C. as you D. as yours 24. —What do you think of my new car ? —It looks very nice , but would you please _________ park it here ? A. not B. not to C. to not D. don’t 25. —When will the Browns leave for shanghai ? —They _______ tomorrow morning . A. do leave B. are leaving C. have left D. leave 26. He _______ football quite well , but he hasn’t had time to play since the new term began . A. will play B. played C. plays D. has played 27. A computer can only do _______ you have instructed it to do . A. how B. after C. what D. when 28. —Why was the official meeting called ?
高一上学期化学期中考试试卷(理科) 姓名:________ 班级:________ 成绩:________ 一、选择题 (共18题;共36分) 1. (2分) (2018高一上·湖北月考) 在萃取—分液实验中,振荡分液漏斗的操作正确的是() A . B . C . D . 2. (2分) (2018高一上·湖北期中) 为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,在下列操作中选取必要的步骤和正确的操作顺序() ①过滤②加过量的NaOH溶液③加过量的盐酸④加过量的Na2CO3溶液⑤加过量的BaCl2溶液⑥加热蒸发 A . ②④⑤①③⑥ B . ④⑤②①③⑥
C . ①②⑤④③⑥ D . ②⑤④①③⑥ 3. (2分) (2017高二上·大连期末) 下列实验可达到实验目的是() A . 将与NaOH的水溶液共热制备CH3﹣CH═CH2 B . 用甲苯与稀硝酸、稀硫酸的混合酸相混制取TNT C . 甲苯在溴化铁催化作用下与液溴反应生成2,4,6﹣三溴甲苯 D . 向CH3CH2Br中滴入AgNO3溶液就可以检验溴元素 4. (2分) (2016高一上·唐山期中) 下列物质在水溶液中的电离方程式书写正确的是() A . KClO3═K++3O2﹣+Cl5+ B . NaHCO3═Na++H++CO32﹣ C . H2SO4═H++SO42﹣ D . Al2(SO4)3═2Al3++3SO42﹣ 5. (2分) (2018高二下·广州期中) 下列反应属于化合反应的是() A . 2Mg+O2 2MgO B . 2Al+Fe2O3 Al2O3+2Fe C . 2HClO 2HCl+O2 ↑ D . NaOH+Al(OH)3===NaAlO2+2H2O 6. (2分)用CuSO4?5H2O晶体配制500mL 浓度为1mol?L﹣1的硫酸铜溶液时,正确的是() A . 用托盘天平称取80.0g晶体用于配制溶液 B . 将正确称取的晶体置于预先量取的500mL水中
【典型题】高一数学下期中模拟试卷(含答案)(1) 一、选择题 1.设l 为直线,,αβ是两个不同的平面,下列命题中正确的是( ) A .若//l α,//l β,则//αβ B .若l α⊥,l β⊥,则//αβ C .若l α⊥,//l β,则//αβ D .若αβ⊥,//l α,则l β⊥ 2.陀螺是汉族民间最早的娱乐工具之一,也称陀罗,北方叫做“打老牛”.陀螺的主体形状一般是由上面部分的圆柱和下面部分的圆锥组成.如图画出的是某陀螺模型的三视图,已知网格纸中小正方形的边长为1,则该陀螺模型的体积为( ) A .1073 π B . 32 453 π+ C . 16323π+ D .32333 π+ 3.已知,,,A B C D 是同一球面上的四个点,其中ABC ?是正三角形,AD ⊥平面ABC ,26AD AB ==,则该球的体积为( ) A .48π B .24π C .16π D .323π 4.对于平面 、β、γ和直线a 、b 、m 、n ,下列命题中真命题是( ) A .若,,,,a m a n m n αα⊥⊥??,则a α⊥ B .若//,a b b α?,则//a α C .若//,,,a b αβα γβγ==则//a b D .若,,//,//a b a b ββαα??,则//βα 5.<九章算术>中,将四个面都为直角三角形的三棱锥称之为鳖臑.若三棱锥P ABC -为鳖臑,PA ⊥平面,2,4ABC PA AB AC ===,三棱锥P ABC -的四个顶点都在球O 的球面上,则球O 的表面积为( ) A .8π B .12π C .20π D .24π 6.从点(,3)P m 向圆2 2 (2)(2)1x y +++=引切线,则切线长的最小值( ) A .26B .5 C 26 D .427.在长方体1111ABCD A B C D -中,11111,2AA A D a A B a ===,点P 在线段1AD 上运
太原市2017-2018 学年第一学期高一年级阶段性测评 化学试卷 (考试时间:下午4:15-5:15 ) 说明:本试卷为闭卷答卷,做题时间90 分钟,满分100 分 题号一二三总分 可能用到的相对原子质量:H 1 C 12 N 14 O16 Na 23 Mg 24 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Cu 64 一、选择题(本大题共20 个小题,每小题2 分,共40 分,每小题只有一个选项符合题意,请将正确的选项填入答案栏中) 1.在天然气运输车上应张贴的标志是 2.下列物质中,属于电解质的是 A.Fe B.BaSO 4 C.C 2 H 5 OH D.NaOH 溶液 3.自然界和生活中的下列事例,与氧化还原反应无关的是 A.醋的酿造 B.金属生锈 C.动植物呼吸 D.石膏点豆腐 4.夜晚常能观察到车灯形成的“光柱”,此现象属于胶体的 A.电泳现象 B.丁达尔效应 C.布朗运动 D.聚沉现象 5.《本草衍义》中对精制砒霜过程有如下描述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆 器,遂凝结累然下垂如乳,尖长者次之。”文中所涉及的操作方法是 A.蒸发 B.萃取 C.升华 D.分液 6.生活中有关金属的下列用途,叙述错误的是 A.铝箔包装食品 B.铜丝作导线 C.银的粉末刷暖气片 D.铁粉作食品脱氧剂 7.能在无色溶液中大量共存的一组离子是 A.H + 、Na + 、Cl -、SO 4 2- B.H + 、Fe 3+ 、NO 3 -、Cl - C.H + 、K + 、CO 3 2-、Cl - D.K + 、Ca 2+ 、OH -、CO 3 2- 8.右图是蒸馏实验的装置图,下列有关说法正确的是 A.仪器a 是圆底烧瓶 B.冷却水从b 口通入 C.操作时先加热,后通入冷却水
高一数学期中模拟试题 及答案 SANY GROUP system office room 【SANYUA16H-
高一数学(必修1)期中模拟试卷9 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,考试时间120分钟,满分120分。 第Ⅰ卷(选择题,48分) 一、选择题:在每小题给出的四个选项中,只有一项符合题目要求,请将答案填在题 后的答题框内(本大题共12小题,每小题4分)。 1、已知全集{1,3,5,7}B {2,4,6},A ,6,7},{1,2,3,4,5U ===则)(B C A U = ( ) A 、 }6,4,2{ B 、 {1,3,5} C 、 {2,4,5} D 、 {2,5} 2、设集合A={x ∈Q|1->x },则 ( ) A 、A ∈? B 、2A ? C 、2A ∈ D 、{} 2A 3、下列各组函数是同一函数的是 ( ) ① 3()2f x x =-()2g x x =-②()f x x =与2()g x x ;③0()f x x =与 01 ()g x x = ;④2()21f x x x =--与2()21g t t t =--。 A 、①② B 、①③ C 、③④ D 、①④ 4、若:f A B →能构成映射,下列说法正确的有 ( ) (1)A 中的任一元素在B 中必须有像且唯一;(2)B 中的多个元素可以在A 中有相同的原像;(3)B 中的元素可以在A 中无原像;(4)像的集合就是集合B 。 A 、1个 B 、2个 C 、3个 D 、4个 5、下列函数中是幂函数的是 ( ) (1))1,(≠=a m a ax y m 为非零常数且;(2)3 1x y =(3)πx y =(4)3)1(-=x y A 、(1)(3)(4) B 、(2)(3) C 、(3)(4) D 、全不是
高一年级化学上学期期中阶段测试试题卷 时量:60分钟(必考部分)30 分钟(选考部分) 满分:100 分(必考部分)50分(选考部分) 必考部分 可能用到的元素的相对原子质量:H 1 C 12 N 14 O 16 Ca 40 一、选择题(每小题3分,每小题只有一个选项符合题意) 1.如果你家里的食用花生油混有水,你将采用下列何种方法分离 A.过滤 B.蒸馏 C.分 液 D.萃取 【答案】C 2.下列说法中正确的是 A.1molNaOH的质量是40g B.1molCH4体积约为22.4L C.CO2的摩尔质量为44g D.1molH2O中约含6.02×1023个H 【答案】A 3.下列关于胶体的说法中正确的是 A.胶体外观不均匀B.胶体能通过半透膜 C.胶体能产生丁达尔效应D.胶体不稳定,静置后容易产生沉淀 【答案】C 4.关于氧化剂的叙述正确的是 A.分子中不一定含有氧元素B.分子中一定含有氧元素 C.在反应中失去电子的物质D.在反应中化合价升高的物质 【答案】A 5.在自来水蒸馏实验中,下列操作叙述不正确 ...的是
A.在蒸馏烧瓶中盛约1/2体积的自来水,并放入几粒碎瓷片 B.将温度计水银球插到蒸馏烧瓶中的自来水中 C.冷水应从冷凝管下口进,上口出 D.收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 【答案】B 6.用四氯化碳萃取碘水中的碘,下列说法中不正确 ...的是 A.实验中使用的主要仪器是分液漏斗、烧杯、铁架台(带铁圈) B.碘在四氯化碳中的溶解度比在水中的溶解度大 C.碘的四氯化碳溶液呈紫红色 D.分液时,水层从分液漏斗下口放出,碘的四氯化碳溶液从分液漏斗上口倒出 【答案】D 7.下列溶液中,能大量共存的离子组是 A.K+、Na+、CO32-、NO3- B.Ag+、Na+、SO42-、Cl- C.OH-、HCO3-、Ca2+、Na+ D.Ba2+、Na+、OH-、SO42— 【答案】A 8.配制一定体积、一定物质的量浓度的溶液时,下列操作会使配得的溶液浓度偏小的是A.容量瓶中原有少量蒸馏水 B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 C.定容时观察液面俯视 D.滴管加水时,有少量水滴到容量瓶外 【答案】B 9.已知3.01×1023个X气体分子的质量为16 g,则X气体的摩尔质量是 A.16 g B.32 g C.64 g /mol D.32 g /mol 【答案】D 10.影响一定数量气体体积大小的主要因素是 A、气体分子的摩尔质量 B、微粒本身的大小 C、微粒的质量 D、微粒间的平均距离 【答案】D
江西省2021年高一上学期化学期中考试试卷(II)卷 姓名:________ 班级:________ 成绩:________ 一、单选题 (共15题;共30分) 1. (2分) (2015高一上·大新月考) 能用酒精灯直接加热的仪器是() A . 量筒 B . 试管 C . 容量瓶 D . 烧杯 2. (2分) (2018高一上·双峰月考) 下列关于摩尔质量叙述中正确的是() A . 1 mol CO 的质量是28 g·mol-1 B . 硫酸根离子的摩尔质量是 98 g C . Cl2 的摩尔质量是71 g·mol D . NaCl 的相对分子质量是58.5 g·m 3. (2分) (2017高一上·宝坻期中) 下列各组混合物中,能用分液漏斗进行分离的是() A . 酒精和水 B . 四氯化碳和水 C . 汽油和植物油 D . 碘和四氯化碳 4. (2分) (2018高一上·南宁月考) 化学教材中,常借助示意图表达实验装置的要点、阐述化学过程的原理等。下列有关示意图表现的内容一定错误的是()
A . 橡皮管能使液体顺利留下 B . 分离乙醇和乙酸 C . 检查装置气密性 D . 收集氨气 5. (2分) (2018高二上·北京期末) 下列除杂试剂和方法错误的是()编号被提纯物质(杂质)除杂试剂分离方法A甲烷(乙烯)酸性高锰酸钾溶液洗气 B乙烯(二氧化硫)氢氧化钠溶液洗气 C溴苯(溴)氢氧化钠溶液分液 D苯(苯酚)氢氧化钠溶液分液 A . A
B . B C . C D . D 6. (2分) (2016高一上·河北期中) 同温同压下,等质量的CO和CH4分别在足量的O2中完全燃烧,消耗O2的体积分别为xL和yL,则x与y的比值为() A . 1:4 B . 4:7 C . 1:7 D . 7:1 7. (2分) (2017高三上·重庆开学考) NA为阿伏伽德罗常数,下列叙述正确的是() A . 7.8 g Na2O2中含有的阴离子数等于0.2NA B . 0.1 mol16OD- 离子含有的电子、中子数均为1.0NA C . 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA D . 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA 8. (2分) (2017高二下·怀仁期末) 标准状况下VL氨气溶解在1L水里(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为,物质的量浓度c mol/L,则下列关系中错误的是() A . ρ= B . = C . = D . c= 9. (2分) (2015高一上·襄城期末) 用NaCl固体配制0.1mol?L﹣1的NaCl溶液,下列操作或说法正确的
高一下化学期中模拟试题一 1.根据元素周期表和元素周期律,下列推断正确的是 A.HF、HCl、HBr、HI的酸性逐渐增强,说明F、Cl、Br、I的非金属性逐渐增强B.元素R最高正价为+7价,表明R元素属于ⅦA族元素 C.若M+ 和R2-具有相同的电子层结构,则原子半径:M<R D.从元素在周期表中的位置可以推断,硅和锗都可用作半导体材料 2.依据元素周期律,下列推断正确的是 A.酸性:H2SiO3>H2CO3B.热稳定性:H2Se>H2S>H2O C.碱性:CsOH>Ca(OH)2D.若离子半径:R2->M+,则原子序数:R >M 3.2011年3月11日,日本大地震引起全世界关注,中国核事故应急协调委员会4月1曰发布,内地除西藏外都检测到,还检测到了极微量的人工放射性核素、。已知铯(Cs)是钠的同族元素,据此,下列关说法正确的是 A.、互为同位素 B.放出射线是一个自发的化学变化过程,射线对人危害很大 C.与的中子数相同 D.单质铯的金属性比单质钠弱 4.下列顺序不正确的是 A.热稳定性:HF > HCl > HBr > HI B.微粒的半径:Cl-> Na+ > Mg2+ > Al3+ C.电离程度(同温度同浓度溶液中):HCl > CH3COOH > NaHCO3 D.分散质粒子的直径:Fe(OH)3悬浊液> Fe(OH)3胶体> FeCl3溶液 5.碘与氢气反应的热化学方程式是(注△H小于0是放热反应,△H大于0是吸热反应) ①I2(g) + H2(g) 2HI(g)△H =-9.48 kJ?mol-1 ②I2(s) + H2(g) 2HI(g)△H = +26.48 kJ?mol-1 下列说法正确的是 A.①的产物比②的产物稳定 B.I2(s) = I2(g)△H= +17.00 kJ?mol-1 C.②的反应物总能量比①的反应物总能量低 D.1mol I2(g)中通入1 mol H2(g),发生反应时放热9.48 kJ 6.下列反应中生成物总能量高于反应物总能量的是 A.氧化钙溶于水B.铁粉溶于稀硫酸C.盐酸与氢氧化钠反应D.碳酸钙分解 7.下列有关物质的性质或结构的说法正确的是 A.第二周期元素最高价与其原子最外层电子数相等 B.Na的原子半径比Cl的大,但Na+的半径比Cl一的小 C.Li、Na、K、Rb、Cs都属于碱金属元素,它们单质的还原性随原子序数的增大而减弱D.Cl与I同属于ⅦA族元素,则两者最高价氧化物对应水化物的酸性:HClO4<HIO4 8.(2012浙江高考)X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是 A.原子半径:Z>Y>X B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂 D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2
高一年级期中(学段)考试英语试卷 考试时间:120分钟满分:150分 说明:本试卷分第I卷(选择题)和第II卷(非选择题)两部分。 第一部分:听力(共两节,满分30分)(略) 第二部分:阅读理解(共两节,满分40分) 第一节(共15小题;每小题2分,满分30分) 阅读下列短文,从每题所给的四个选项(A、B、C、D)中,选出最佳选项。 A An interesting study posted on Facebook recently shows how men and women develop new interests as they mature(成熟). While women tend to take exercise seriously from the age of 34, men will wait until their 45th birthdays before working hard to get in shape. The average woman spends more time talking about sports, politics, career and money as she gets older. Women’s interest in books reaches its peak(顶峰) at the age of 22, while that of men does so when they are in their 50s.
Men start to change their focus from the workplace to other things after age 30, while women do not do so until eight years later. Both, however, care most about fashion at age 16. The research used anonymous(匿名的) data donated by thousands of Facebook users, recording the statuses, ‘likes’and ‘interests’they had posted on their profiles. It found the average woman talks about television most at 44, while men peak much younger, at age 31. Men are also most likely to see a film in a cinema at age 31, while women go out to see films most when they are only 19. Men are most interested in travel at 29, women at 27, while women talk most about food and drink at 35, and men at 38. And if you are middle aged, a safe topic for any audience is the weather, which is a key interest for many as they approach 60. Stephen Wolfram, the British scientist who carried out the research, says, “It’s almost shocking how much this tells us about the changes of people’s typical interests. “People talk less about video games as they get older, and more about politics.” 21. When do women love books best? A. At the age of 22. B. At the age of 50. C. At the age of 30. D. At the age of 15. 22. Men tend to ______ once they are 30.
2019-2020学年高一第一学期期中考试 化学试卷 说明: 试卷满分100分,考试时间90分钟。答案请写到答题卷的相应位置,写在试卷上不得分。 可能用到的原子量:H-1 C-12 O-16 S-32 Ba-137 第Ⅰ卷 选择题(共48分) 一、选择题:(每小题只有一个选项符合题意,共16小题,每小题3分) 1.图中所示的实验方法、装置或操作完全正确的是( ) A .振荡分液漏斗 B .制蒸馏水 C .称取氢氧化钠 D .稀释浓硫酸 2.下列实验过程中出现的异常情况,其可能原因分析错误的是( ) 3.用N A 表示阿伏加德罗常数的值,下列说法正确的是( ) A .25℃、l01 kPa 时,16g O 2和O 3混合气体中含有的原子数为N A B .在标准状况下,含N A 个氦原子(He)的氦气所含的分子数是0.5 N A C .1 mol FeCl 3跟沸水完全反应转化为氢氧化铁胶体,其中胶粒的数目等于N A D .标准状况下,4.48 L 的水中含有H 2O 分子的数目为0.2 N A 4.下列说法正确的是( ) A .NaCl 晶体中含有Na +、Cl -,所以NaCl 晶体能导电 B .CO 2溶于水能导电,所以CO 2是电解质 C .BaSO 4难溶于水, BaSO 4是非电解质 D .Cl 2的水溶液能够导电,但Cl 2既不是电解质也不是非电解质 异常情况 可能原因分析 A 蒸发结晶:蒸发皿破裂 将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 B 蒸馏:冷凝管破裂 冷凝管没有通水或先加热后通水 C 萃取:液体静置不分层 加入萃取剂的量较多 D 分液:分液漏斗中的液体难以滴下 没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗 口侧面的小孔没有对齐
第二学期高一数学期中考试模拟试题 第一部分 选择题 (共60分) 一、选择题:本大题共12小题,每小题5分,共60分. 在每小题给出的四个选项中,只 有一项是符合题目要求的. (1) 已知某厂的产品合格率为%90,现抽出10件产品检查,则下列说法正确的是 (A )合格产品少于9件 (B )合格产品多于9件 (C )合格产品正好是9件 (D )合格产品可能是9件 (2) 某公司在甲、乙、丙、丁四个地区分别有150个、120个、180个、150个销售点。公司 为了调查产品销售的情况,需从这600个销售点中抽取一个容量为100的样本,记这项 调查为○ 1;在丙地区中有20个特大型销售点,要从中抽取7个调查其销售收入和售后服务等情况,记这项调查为○ 2。则完成○1、○2这两项调查宜采用的抽样方法依次是 (A )分层抽样法,系统抽样法 (B )分层抽样法,简单随机抽样法 (C )系统抽样法,分层抽样法 (D )简单随机抽样法,分层抽样法 (3) 用直接排序法将无序列{}27,13,76,97,65,38,49按照从大到小的顺序排为有序列时,第五 趟有序列插入排序后,得到的数列是 (A ){}27,13,76,97,38,49,65 (B ){}27,13,76,38,65,49,97 (C ){}13,27,97,65,38,49,76 (D ){}27,13,38,49,65,76,97 (4) 从4名男生和2名女生中任选3人参加演讲比赛,则所选3人中至少有1名女生的概率是 (A ) 51 (B )53 (C )54 (D )3 1 (5) 在抽查产品的尺寸过程中,将其尺寸分成若干组。[),a b 是其中的一组, 抽查出的个体在该组上的频率为m,该组上的直方图的高为h,则a b -= (A )hm (B ) m h (C )h m (D )h+m (6) 右图给出的是计算20 1 614121++++ 的值的一个流程图,其中判断 框内应填入的条件是 (A ) 10>i (B ) 10i (D ) 20高一化学上学期期中考试试卷含答案
2018-2019学年度第一学期高一期中考试 试题卷(化学科) 说明: 1、本试卷满分100分,考试时间90分钟。 2、可能用到的相对原子质量: H-1 C-12 N-14 O-16 Cl-35.5 Zn-65 Na-23 Ca-40 S-32 Cu-64 Fe-56 Al-27 第一部分选择题(共54分) 一、单项选择(每题只有一个选项符合题意,每题3分,共54分) 1、下列说法中,正确的是() A. 早在远古时代,化学就已经成为了一门独立的自然科学 B. 食品添加剂、化妆品、合成材料的广泛使用证明化学具有创造性和实用性 C. 一次性筷子方便又卫生,且耗用木材不多,应提倡大量推广应用 D. 大量开采地下水,可解决人类生产和生活对水的需求 2、研究物质性质的基本程序是一个系统化的过程,其主干可分为四个步骤: ①观察物质的外观;②实验和观察;③解释和结论;④预测物质的性质。 排列顺序正确的是() A. ②①④③ B. ①②③④ C. ①④②③ D. ④①②③ 3、下列关于过氧化钠的说法中,不正确的是( ) A.能与水反应生成碱和氧气 B.属碱性氧化物 C.淡黄色固体 D.可由钠在空气中燃烧制备 4、下列物质不能使干燥的有色布条褪色的是 A. 漂白粉溶液 B. 双氧水 C. 次氯酸钠溶液 D. 干燥的氯气 5、2013年1月初华北地区连续5~6天出现大雾,致使高速公路封闭、飞机停飞。雾属于下列分散系中的( ) A.溶液 B.悬浊液 C.胶体 D.乳浊液
6、下列事实与胶体性质无关的是() A. 向豆浆中加入硫酸钙做豆腐 B. 将植物油倒入水中用力搅拌形成油水混合物 C. 利用丁达尔效应可以区别溶液与胶体 D. 观看电影时,从放映机到银幕有明显的光路 7、下列各组物质,按酸、混合物、碱顺序排列的是 A. 空气、硫酸铜、硫酸 B. 乙酸、空气、纯碱 C. 氧化铁、胆矾、熟石灰 D. 硝酸、蔗糖水、氢氧化铁 8、下列各组中的离子,能在水溶液中大量共存的是() A.K+、H+、SO 4 2—、OH— B.Na+、Ca2+、CO 32—、NO 3 — C.Na+、H+、Cl—、CO 3 2— D.Na+、Cu2+、SO 4 2—、Cl— 9、下列图示与内容不相吻合的是() A.闻氯气的气味 B.用排饱和食盐水法收集氯气 C.盛装浓硫酸的容器 D.证明氯气可以与NaOH溶液反应 10、用摩尔(mo1)作为单位的物理量是() A. 长度 B. 质量 C. 物质的量 D. 电流 11、1mol H 2O中含有的H 2 O分子数约为() A. 3.01×1023 B. 6.02×1023 C. 3 D. 1 12、当光束通过下列分散系时,可观察到丁达尔效应的是() A. 硫酸铜溶液 B. 氢氧化铁胶体 C. 蔗糖溶液 D. 氯化钠溶液 13、某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。以下结论中正确的是( )