
收稿日期:2000-11-22. 第一作者:王明辉,男,1965年生,硕士,副教授.
联系人:李和兴.Tel :(021)64322511;Fax :(021)64322150;E -mail :HeXing -Li @shtu .edu .cn .
基金项目:国家自然科学基金(29973025)和上海市教委发展基金(99D12)资助项目.
文章编号:0253-9837(2001)03-0287-04
Ni -B /SiO 2非晶态催化剂应用于硝基苯液相加氢制苯胺
王明辉, 李和兴
(上海师范大学化学系,上海200234)
摘要:考察了Ni -B /SiO 2非晶态催化剂在高压液相硝基苯加氢制苯胺反应中的催化活性和选择性.研究表明,该催
化剂不仅具有很高的催化活性,而且对苯胺的选择性较高,优于Raney Ni 以及其它Ni 基催化剂.晶化导致催化剂失活.载体的存在不仅能提高催化剂的分散度,而且能对非晶态结构起稳定化作用;将催化剂保存在乙醇中可保持其活性不变.结合催化剂的表征,讨论了Ni -B /SiO 2非晶态催化剂的催化性能与其结构的关系.关键词:镍,硼,二氧化硅,负载型非晶态催化剂,硝基苯,催化加氢,苯胺中图分类号:O643 文献标识码:A
苯胺是染料工业最重要的中间体之一,也是医药、橡胶促进剂和防老剂的重要原料,还应用于香料、氨基塑料、油漆和炸药等的生产,市场需求量很大.工业上生产苯胺的传统方法是硝基苯Fe 粉还原法,其主要缺点是环境污染极其严重,每生产1吨苯胺将产生2.2吨Fe 3O 4[1]
.目前较有发展前途的是采用硝基苯加氢还原法制备苯胺,常用的催化剂是Raney 金属(如Raney Ni ,Raney Cu 等)和负载型贵金属(如Pd /C ,Pt /Al 2O 3等)[2~7]
,前者对苯胺的选择性较差,且仍存在环境污染问题,而后者价格极其昂贵.因此,迫切需要开发一种价廉、高效并能满足绿色化工要求的新型催化剂.众所周知,非晶态合金由于其独特的结构而具有优良的催化性能,有关这方面的研究已成为当前催化领域中的一个热点.到目前为止,已报道的工作主要集中在烯烃、炔烃和芳香环的催化加氢[8~15],有关其他官能团加氢的报道甚少[16~19],而非晶态催化剂应用于硝基化合物的加氢至今未见报道.本文首次报道了Ni -B /SiO 2非晶态催化剂在高压液相硝基苯加氢中的催化性能,发现其催化活性和催化选择性显著优于其他Ni 基催化剂,表明该催化剂具有潜在的工业化应用前景.
1 实验部分1.1 催化剂制备 向烧杯中加入1.0g 的SiO 2(BET 比表面积=198m 2/g )和所需量的NiCl 2水溶液,浸渍过夜,在473K 下烘干后将烧杯置于冷水浴中,在搅拌下逐滴加入KBH 4水溶液(1.0mol /L ),
使负载于SiO 2上的Ni 2+还原,得到的Ni -B /SiO 2样品依次用蒸馏水和无水乙醇(EtOH )反复洗涤,最后
保存在EtOH 中备用.采用类似的方法,在不加载体的情况下,可制得超细Ni -B 非晶态合金催化剂.催化剂的热处理在高纯N 2气保护下进行,热处理温度为室温至873K ,各温度下的热处理时间均为2h .
Ni /SiO 2催化剂是由H 2在673K 下还原催化剂的前躯体(制备方法同上)2h 制备的.Raney Ni 催化剂由上海日用化工原料厂提供.
1.2 催化剂表征 催化剂的组成和负载量采用电感耦合等离子体光谱(ICP )测定.其活性比表面积(S active )由氢吸附法确定[18].采用原位X 射线衍射(XRD )和扫描电子显微镜(SEM )分析催化剂的结构和表面形貌.表面电子态则由X 射线光电子能谱(XPS )测定,所有的结合能均以污染碳的标准结合能(C 1s ,284.6eV )进行校正.1.3 催化剂活性评价 在200m l 的高压釜中依次加入1.0g 催化剂,10ml 硝基苯(NB )和30ml EtOH ,反复通H 2以除去空气,最后通H 2至1.0M Pa .将高压釜置于油浴中,以60K /h 的速率缓慢加热到所需温度.当压力达到平衡后开启搅拌器,此时加氢反应开始.选择搅拌速度>1000r /mim ,因为此时催化剂的活性与催化剂的用量接近正比关系,可以认为基本上消除了扩散因素的影响.每次反应时间均为4h .通过观察和记录高压釜内压强随时间的变化监测加氢反应过程.通过理想气体状态方程可算得单位质量Ni 上的吸氢速率(R m H 2
).为第22卷第3期 Vol .22N o .3
催 化 学 报
Chinese Journal of Catalysis
2001年5月
M ay 2001
了比较活性位的本质对催化性能的影响,以及分散度对催化剂活性的影响,采用催化剂的活性比表面
积,通过转换R m
H 2,获得单位面积Ni 上的吸氢速率(R s H 2
).由气相色谱仪分析反应产物以确定反应的转化率和产物的选择性,色谱条件为:氢火焰检测,OV -101毛细管色谱柱,采用程序升温,升温速率
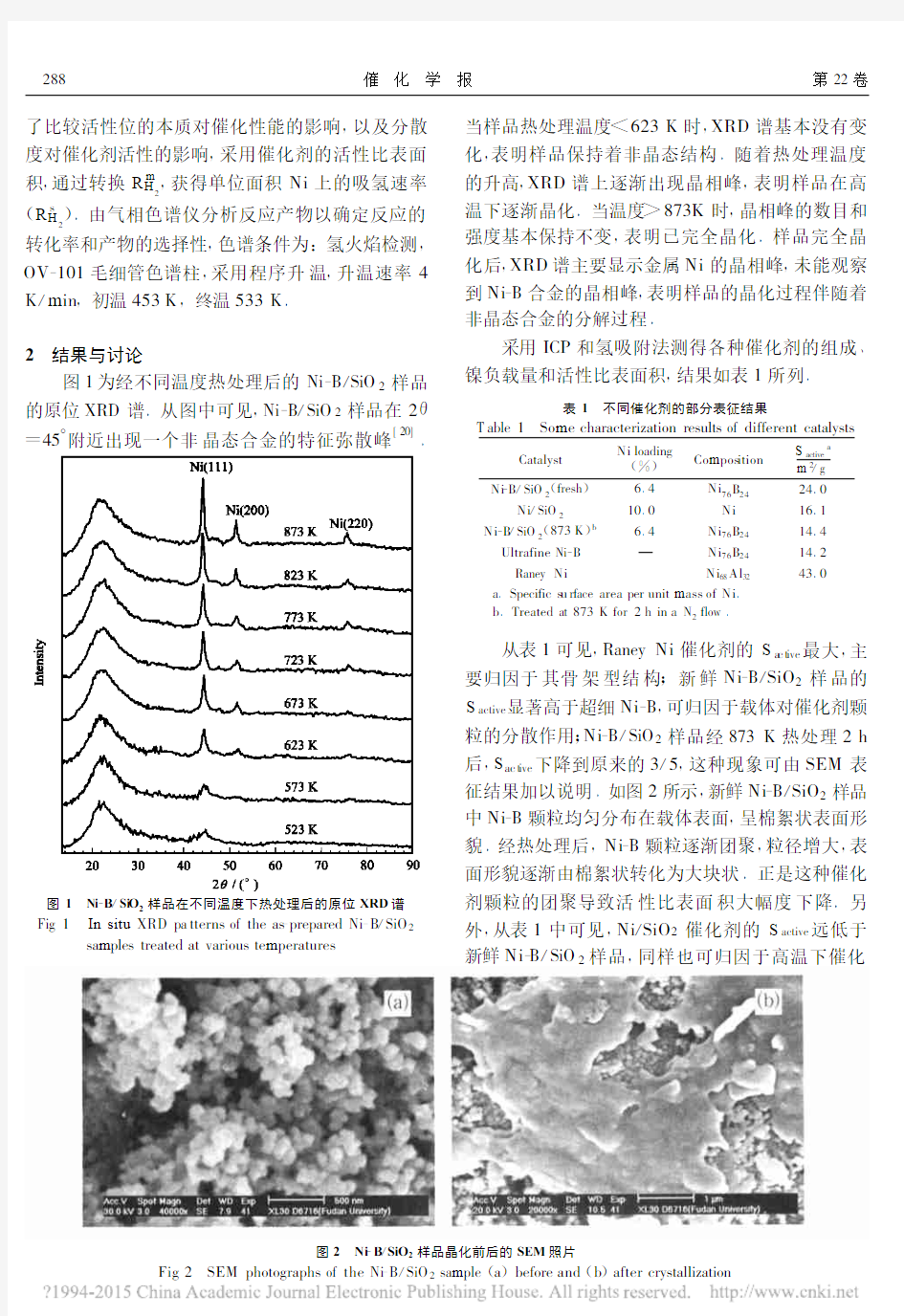
4图1 Ni -B /Si O 2样品在不同温度下热处理后的原位XRD 谱
Fig 1 In situ XRD pa tterns of the as -prepared Ni -B /SiO 2
samples treated at various temperatures
图2 Ni -B /SiO 2样品晶化前后的SEM 照片
Fig 2 SEM photographs of the Ni -B /SiO 2sample (a )before and (b )after crystallization
K /min ,初温453K ,终温533K .2 结果与讨论
图1为经不同温度热处理后的Ni -B /SiO 2样品的原位XRD 谱.从图中可见,Ni -B /SiO 2样品在2θ=45°附近出现一个非晶态合金的特征弥散峰
[20]
.
当样品热处理温度<623K 时,XRD 谱基本没有变化,表明样品保持着非晶态结构.随着热处理温度的升高,XRD 谱上逐渐出现晶相峰,表明样品在高温下逐渐晶化.当温度>873K 时,晶相峰的数目和
强度基本保持不变,表明已完全晶化.样品完全晶化后,XRD 谱主要显示金属Ni 的晶相峰,未能观察到Ni -B 合金的晶相峰,表明样品的晶化过程伴随着非晶态合金的分解过程.
采用ICP 和氢吸附法测得各种催化剂的组成、镍负载量和活性比表面积,结果如表1所列.
表1 不同催化剂的部分表征结果
T able 1 Some characterization results of different catalysts
Catalyst Ni loading
(%)Compos ition S active a
m 2/g Ni -B /SiO 2(fresh )
6.4Ni 76B 24
24.0Ni /SiO 2
10.0Ni 16.1Ni -B /SiO 2(873K )b
6.4
Ni 76B 2414.4Ultrafine Ni -B Ni 76B 2414.2Raney Ni
Ni 68Al 32
43.0
a .Specific s u rface area per unit mass of Ni .
b .Treated at 873K for 2h in a N 2flow .
从表1可见,Raney Ni 催化剂的S a c t ive 最大,主要归因于其骨架型结构;新鲜Ni -B /SiO 2样品的S active 显著高于超细Ni -B ,可归因于载体对催化剂颗粒的分散作用;Ni -B /SiO 2样品经873K 热处理2h 后,S ac t ive 下降到原来的3/5,这种现象可由SEM 表征结果加以说明.如图2所示,新鲜Ni -B /SiO 2样品中Ni -B 颗粒均匀分布在载体表面,呈棉絮状表面形貌.经热处理后,Ni -B 颗粒逐渐团聚,粒径增大,表面形貌逐渐由棉絮状转化为大块状.正是这种催化
剂颗粒的团聚导致活性比表面积大幅度下降.另外,从表1中可见,Ni /SiO 2催化剂的S active 远低于新鲜Ni -B /SiO 2样品,同样也可归因于高温下催化
288催 化 学 报第22卷
剂颗粒的团聚,因为Ni/SiO2催化剂是在高温(773 K)下用H2还原而获得的.
各种催化剂在硝基苯液相加氢制苯胺反应中的催化性能如表2所列.
表2 硝基苯液相加氢反应中各催化剂催化性能的比较
T able2 Comparison of the cataly tic performance of different cataly sts during liquid-phase nitrobenzene hydrogenation
Catalyst Catalyst amount(g)R m H
2/(mmol·h-1·g-1)R s H
2
/(mmol·h-1·m-2)Convers ion(%)Selectivity(%)
Ni-B/SiO2(fresh)1.0167.28.580.394.6 Ni/SiO21.061.03.834.676.7 Ni-B/S iO2(873K)1.082.97.039.690.4 Ultrafine Ni-B0.5118.38.488.190.8 Raney Ni0.3168.33.982.785.3 Reaction conditions:p(H2)=1.0M Pa,T=383K,nitrobenzene10.0m l,EtOH30.0ml.
R m H
2
hydrogen uptake rate per unit mass of Ni.
R s H
2
hydrogen uptake rate per unit area of the active surface of Ni.
比较表2中列出的各种催化剂的催化性能,可以得出如下结论:
(1)所有非晶态催化剂对苯胺均具有非常高的选择性,这主要归因于非晶态合金中存在分布均匀的活性中心[10].
(2)由于Ni-B/SiO2非晶态催化剂的面积比活性(R s H
2
)与非负载的超细Ni-B非晶态催化剂基本
相同,因此,前者的质量比活性(R m H
2
)显著高于后者.这主要归因于载体对催化剂颗粒的分散作用,导致Ni-B/SiO2非晶态催化剂表面含有更多的活性Ni原子.另外,载体的存在还有利于提高非晶态合金催化剂的热稳定性[18].研究表明,负载型Ni-B 非晶态催化剂可反复使用5次以上,其使用寿命显著高于超细Ni-B非晶态合金催化剂(只能使用1次),甚至优于Raney Ni催化剂(使用3次其活性就显著下降).另外,将催化剂保存在EtOH中两周,也未见明显的活性变化.
(3)Ni-B/SiO2非晶态催化剂经873K晶化后,
其R m H
2
显著下降.这归因于活性比表面积的下降,同时,由于R s H
2
也明显减小,从而也导致单个活性Ni原子的催化活性显著下降.
(4)Ni-B/SiO2非晶态催化剂的催化活性远高于Ni/SiO2,其主要原因是这两种催化剂的分散度及活性Ni原子的催化能力不同.这一现象也可解释Ni-B/SiO2与Raney Ni催化剂的差别.虽然Raney Ni由于活性比表面积非常大,其R m H
2
大致接
近于Ni-B/SiO2非晶态催化剂,但比较二者的R s H
2
,不难发现,Raney Ni催化剂中单个Ni原子的催化活性远低于Ni-B/SiO2非晶态催化剂.
上述结果显示,Ni-B/SiO2非晶态催化剂具有优良的催化性能,这与其活性组分的高分散度有关.扣除分散度影响后,其催化活性仍显著高于其他Ni 基催化剂,这可通过几何效应和电子效应加以说明.
从几何效应分析,根据XRD的表征结果,非晶态合金具有短程有序而长程无序的结构特征.这种结构有利于反应物的吸附,同时具有分布均匀的活性位,这些活性位是高度配位不饱和的,而且相互间有较强的协同作用,这些均有利于提高表面Ni原子的催化活性[8].当Ni-B/SiO2非晶态催化剂经高温处理后,样品结构从非晶态转化为晶态,同时大部分Ni-B合金分解,这是导致催化剂失活的重要原因.
从电子效应分析,根据XPS表征结果[21],在Ni-B非晶态合金中,Ni原子和B原子存在明显的相互作用,部分电子由B原子转移到Ni原子,所以合金中Ni呈富电子状态,而B呈缺电子状态.由于硝基(—NO2)中N原子的部分电子转移给O原子,因此富电子的活性Ni原子可通过吸附缺电子的N原子而增强对硝基的吸附,而缺电子的B原子又与硝基中的O原子作用,进一步加强对硝基苯的吸附.一旦加氢完成后,氨基(—NH2)中的N原子因富电子而迅速离开活性Ni原子,因此Ni-B合金中的这种电子效应有利于促进硝基苯的催化加氢反应.从表2可见,晶化后的Ni-B/SiO2催化剂与Ni/SiO2催化剂之间存在明显的活性差异,这就充分证明了上述结论.
值得注意的是,Ni-B合金中的电子效应还有利于提高Ni-B/SiO2非晶态催化剂的抗中毒能力[11],使该催化剂具有良好的工业化应用前景.当然,在考虑工业化应用时,还需要考察反应条件(如反应温度、反应时间、氢压、催化剂颗粒大小及反应溶剂等因素)的影响,并进一步提高催化剂的使用寿命.有
289
第3期王明辉等:N i-B/SiO2非晶态催化剂应用于硝基苯液相加氢制苯胺
关这方面的研究工作正在进行之中.
致谢:本文工作得到中国科学院院士、复旦大学邓景
发教授的指导,复旦大学的戴维林和谢松海老师及李
辉博士为催化剂表征实验提供了大量帮助,在此表示
感谢.
参考文献
1 化学工业部科学技术情报研究所.化工产品手册.北京:化学工业出版社(Institute of Science and T echnology of the M inistry of Chemical Industry.Handbook of Chemical P ro ducts.Beijing:Chem I nd Press),1985
2 Aramendia M A,Borau V,G omez J et al.Appl Catal, 1984,10(3):347
3 Li C,Chen Y-W,Wang W-J.Appl Catal A,1994,119
(2):185
4 M etcalfe A,Row den M W.J Catal,1971,22(1):30
5 Pinna F,Selv a M,Signo retto M et al.J Catal,1994, 150(3):356
6 Brown H C,Bro wn C A.J Am Chem Soc,1962,84(14): 2827
7 Stratz A M.Chem Ind,1984,189(3):335
8 Deng J-F,Li H,Wang W.Catal Today,1999,51(1): 1139 Chen Y.Catal Today,1998,44(1-4):3
10 Baiker A.Faraday Discuss Chem Soc,1989,87(2):239 11 M olnar A,Smith G V,Bartok M.Adv Catal,1989, 36:329
12 宋真,郝志显,潭大力等.催化学报(Song Zh,Hao Zh X,T an D L et al.Chin J Catal),1999,20(3):193
13 马爱增.催化学报(M a A Z.Chin J Catal),1999,20
(6):603
14 张国胜,沈宁福.催化学报(Zhang G Sh,Shen N F.
Chin J Catal),2000,21(1):67
15 王明辉,李和兴,邓景发.催化学报(Wang M H,Li H X,Deng J F.Chin J Catal),1999,20(5):548
16 Li H,Wang W,Deng J F.J Catal,2000,191(1):257 17 Li H,Xu Y,Deng J F.N ew J Chem,1999,23(11): 1059
18 Li H,W ang W,Li H,Deng J-F.J Catal,2000,194
(2):211
19 Xie S,Li H,Li H,Deng J-F.Appl Catal A,1999,189
(1):45
20 Yamashita H,Yo shikawa M,F unabiki T et al.J Chem Soc,Faraday TransⅠ,1986,82(6):1771
21 Li H,Li H,Dai W-L et al.Appl S ur f Sci,1999,152 (1-2):25
Liquid-Phase Hydrogenation of Nitrobenzene to Aniline
over Ni-B/SiO2Amorphous Catalyst
WANG Minghui,LI Hexing*
(Department of Chemistry,Shanghai Normal University,Shanghai200234,China)
Abstract:A Ni-B/SiO2amorphous catalyst,prepared by impregnation of silica support with Ni ions which were reduced by K BH4aqueous solution,was employed in liquid-phase hydrogenation of nitrobenzene to ani-line.In comparison with other Ni-based catalysts,such as ultrafine Ni-B amorphous alloy,Raney Ni,Ni/ SiO2,and the crystalline Ni-B/SiO2,the as-prepared Ni-B/SiO2amorphous catalyst exhibited higher activity and better selectivity for aniline.The catalyst could be kept in ethanol without significant decrease in the ac-tivity for a long period.However,deactivation of the catalyst was observed when it was crystallized at high temperature.The relationship between the catalytic activity and the nature of the active sites was discussed based on various characterizations including BET,SEM,XRD,XPS,hydrogen chemisorption,etc.The higher activity of the Ni-B/SiO2amorphous catalyst could be attributed to the higher dispersion of the Ni ac-tive sites and was closely related to both the structural and electronic effects on the catalytic property of the Ni active sites.The promoting effect of the silica support was interpreted in terms of its dispersing effect which increased the surface active area of the catalyst on one hand and inhibited the crystallization of Ni-B amorphous alloy on the other.
Key words:nickel,boron,silica,supported amorphous catalyst,nitrobenzene,catalytic hydrogenation, aniline
(Ed LYX) 290催 化 学 报第22卷
硝基苯催化加氢制苯胺的安全技术分析 苯胺是重要的有机化工中间体,广泛地应用于橡胶助剂、染料、感光化学品、医药、农药、炸药及聚氨酯等行业。由于市场需求较大,近几年改建、扩建及新建一批苯胺生产装置。但在苯胺及配套装置生产过程中使用大量易燃易爆、有毒有害的危险化学品,加之生产工艺条件苛刻,装置及控制技术要求严格,使其生产过程事故具有突发性、灾害性的特点。因此,有必要对苯胺的安全生产问题进行认真剖析并提出具体的对策。 1 苯胺生产工艺流程简介 以目前国内先进的35000t/a硝基苯催化加氢制苯胺生产装置为例。苯胺生产中的原料氢与系统中的循环氢混合经氢压机增压至0.2MPa后,与来自流化床顶的高温混合气在热交换器中进行热交换,被预热到约180oC进入硝基苯汽化器,硝基苯经预热后在汽化器中汽化,与过量的氢气合并过热至180oC~200oC,进入流化床反应器,与催化剂接触。硝基苯被还原,生成苯胺和水并放出大量热,利用流化床反应器中的余热锅炉中的软水汽化产生蒸气带走反应热来控制反应温度在250oC~270℃。反应后的混合气与催化剂分离,进热交换器与混合氢进行热交换,用水冷却,粗苯胺及水被冷凝,与过量的氢分离,过量氢循环使用,粗苯胺与饱和苯胺水进入连续分离器,粗苯胺进入脱水塔脱水,然后进精馏塔精馏得到成品苯胺。苯胺水进共沸塔回收苯胺,废水中含苯胺≤500 mg/L,去污水车间进行二级生化处理。 2 苯胺生产中的主要危险介质分析 苯胺生产中的危险介质主要是硝基苯、氢气和苯胺。 2.1 硝基苯 硝基苯的分子式为C6H5NO2,相对分子质量为123.11,淡黄色透明油状液体,有苦杏仁味,能溶于苯、乙醇及乙醚,难溶于水。有毒,多量吸人蒸气或经皮肤吸收都会引起中毒,在车间空气中的最高容许浓度为5mg/m3。 常用的理化数据:相对密度1.205(25℃),熔点5.7℃,沸点210.9℃,闪点87.8℃(闭杯),爆炸下限1.8%(93.3℃),自燃点482℃,蒸气密度4.25 g/L。 危险特性:有毒,遇火种、高热能引起燃烧爆炸,与硝酸反应强烈。 储运注意事项:储存于通风阴凉的仓间内,远离火种、热源,避免日光曝晒并且与氧化剂、硝酸分开存放;搬运时轻装轻卸,防止破漏,引起中毒;误触皮肤立即用肥皂水洗涤。 2.2 氢气 氢气为无色无臭气体,极微溶于水、乙醇、乙醚,无毒、无腐蚀性,极易燃烧,燃烧时发出青色火焰,并发生爆鸣,燃烧温度可达2 000℃,氢氧混合燃烧火焰温度为2 100℃~2 500℃,与氟、氯等能起猛烈的化学反应。 理化常数:密度0.089 9g/L,熔点-259.18℃,沸点-252.8℃,自燃点400℃,爆炸极限4.1%~74.2%,最易引爆体积分数24%,产生大量爆炸压力的体积分数32.3%,最大爆炸压力0.73 MPa,最小引燃能量0.019 mJ,临界温度-239℃,临界压力1.307MPa。 危险特性:与空气混合能成为爆炸性混合物,遇火星、高热能引起燃烧爆炸。在室内使用或储存氢气,当有漏气时,氢气上升滞留屋顶,不易自然排出,遇到火星时会引起爆炸。 储运注意事项:氢气应用耐高压的钢瓶盛装;储存于阴凉通风的仓间内,仓温不宜超过30℃,远离火种、热源,切忌阳光直射;应与氧气、压缩空气、氧化剂、氟、氯等分仓间存放,严禁混储、混运。 2.3 苯胺
简单的说就是将硝基苯和氢气加热到200度左右,通入流化床反应器,在金属负载型催化剂(很多种,你这里是活性铜)的作用下,在200-320度时生成苯胺。 反应化学式为C6H5NO2+3H2—-—- C6H5NH2+2H20 硝基苯催化加氢法是目前工业上生产苯胺的主要方法,包括固定床气相催化加氢、流化床气相催化加氢以及硝基苯液相催化加氢三种工艺。 催化剂 C6H5NO2+3H2—-—- C6H5NH2+2H20+Q 生产工艺:1,硝基苯加氢还原:硝基苯经预热和氢气以1:9(摩尔比)进入气化器,气化并加热至185~200℃,通人流化床。以铜作催化剂,气态硝基苯在流化床内发生加氢还原反应。控制流化床内中心温度220~270℃。H:≥90%。加氢反应产生的热量由废热锅炉产生1.3~1.7MPa的饱和蒸汽,供气化器和后续精馏工序使用。流化床顶部出来的气态反应生成物经冷凝、冷却。液相为反应生成的苯胺和水,分层得到粗品苯胺。不凝气(H:≥90%)少量排放,其余压缩后。和新鲜氢混合循环使用。床内铜催化剂定期进行再生处理。2,苯胺精制:粗品苯胺从脱水塔顶泵人。控制脱水塔釜温度140-160℃,塔顶温度120~140℃。塔内真空度一0.06至-0.07MPa。当脱水塔釜液水分≤0.1%后,进入精馏塔精馏脱除重组份(硝基苯、联苯胺类等)。控制塔釜温度l10~120℃。塔顶温度100~llO~C。塔内真空度一0.09MPa以上。气态苯胺从塔顶蒸出冷凝得到成品;塔釜内的重组份定期排放,蒸馏回收苯胺后作为焦油。 固定床气相催化加氢工艺是在l~3 MPa和200—300 摄氏度等条件下,硝基苯和氢发生反应,苯胺的选择性>99%。具有运转费用低、投资少、技术成熟和产品质量好等优点,不足之处是易发生局部过热而引起副反应和催化剂失活。国外大多数苯胺生产厂采用此工艺进行生产。 流化床气相催化加氢法是汽化后的硝基苯与过量H:混合,进人流化床反应器,在260—280℃进行加氢还原反应生成苯胺和水蒸汽。该法较好地改善了传热状况,避免局部过热,减少副反应的生成,延长了催化剂的使用寿命;不足之处是操作较复杂,催化剂磨损大,装置建设、操作和维修费用较高。我国绝大多数苯胺生产厂家均采用流化床气相催化加氢工艺进行生产。 硝基苯液相催化加氢工艺是在无水条件下硝基苯进行加氢反应生成苯胺,苯胺的收率为99%。优点是反应温度较低,副反应少,催化剂负荷高,寿命长,设备生产能力大,不足之处是反应物与催化剂以及溶剂必须进行分离,设备操作以及维修费用高。 目前,成功应用于硝基苯加氢工艺的催化剂主要是还原态的铜基催化剂和贵金属铂系催化剂。
2011级化学教育有机化学 综合性与设计性实验 题目:以硝基苯为原料合成对溴苯胺以硝基苯为原料合成对溴苯胺 (华南师范大学化学与环境学院) 摘要对溴苯胺是非常重要的有机化工原料,常被用作染料原料,如偶氮染料、喹啉染料等,医药及有机合成的中间体等。本实验合成过程以硝基苯为原料,经历制备苯胺、乙酰苯胺、对溴乙酰苯胺等中间体的过程,最终制得目标产物对溴苯胺。其合成过程经历硝化、还原、保护、溴代、去保护等多个步骤,可以制得纯度较高的对溴苯胺。同时,掌握了芳烃硝化、硝基的还原、氨基的保护与去保护、芳烃卤代等方法。通过实验可得,用此实验方法制备对溴苯胺,操作方法简单,可控性强。 关键词合成;对溴苯胺;硝基苯;苯胺;乙酰苯胺;对溴乙酰苯胺Abstract P-bromo-aniline is very important to the organic chemical raw materials, dyes were often used as raw materials, such as the azo dyes, kuilin dyes, medicine and synthetic organic intermediates, etc. The synthesis process of nitrobenzene in as raw material, through preparation aniline, acetyl aniline, bromine acetyl aniline intermediates such as to the process, finally made of bromine aniline target product.
苯胺的制备 一、实验目的 1、1、掌握硝基苯还原为苯胺的原理和实验室法。 2、2、巩固水蒸汽蒸馏和简单蒸馏的基本操作,熟悉萃取分离技能。 二、实验原理 苯胺的制取不可能用任何直接的方法将氨基(-NH2)导入苯环上。而是经过间接的方法来制取,芳香硝基化合物还原是制备芳胺的主要方法。实验室常用的方法,是在酸性溶液中用金属进行化学还原。常用锡-盐酸来还原简单的硝基化合物,也可以用铁-盐酸锡-盐酸法。 NO2 NH2 Sn/HCl 还原 三、实验仪器与药品 三颈烧瓶,回流冷凝管、恒压滴液漏斗、机械搅拌器,Y型管,温度计,分液装漏斗,水蒸气蒸馏装置,油浴加热;硝基苯、还原铁粉、冰醋酸、乙醚、氢氧化钠、精盐等。 四、实验步骤 a、a、安装反应装置,检查装置的气密性;【注意安装装置的先后顺序】 b、b、按实验前预习时自己拟定的方案进行加料,反应,跟踪反应; c、c、结束反应,进行反应后处理(水蒸汽蒸馏); d、d、萃取分液溜出液,用蒸馏方法纯化目标产物。 五、操作重点及注意事项 1、本实验是一个放热反应,当每次滴加硝基苯时均有一阵猛烈的反应发生,故要慢慢加入与充分搅拌。 2、硝基苯为黄色油状物,如果回流液中,黄色油状物消失,而转变成乳白色油珠,表示反应已完全。
3、反应完后,圆底烧瓶上粘附的黑褐色物质,用1:1盐酸水溶液温热除去。 4、在20℃时每100gH2O中可溶解3.4g苯胺加粗盐为盐析。 5、本实验用粒状NaOH,干燥,原因是CaCl2与苯胺形成的分子化合物。 6、反应物内的硝基苯与盐酸互不相溶,而这两种液体与固体铁粉接触机会很少,因此充分振摇反应物,是使还原作用顺利进行的操作关键。 六、思考题 1、1、根据什么原理,选择水蒸汽蒸馏把苯胺的反应混合物中分离出来。 2、2、如果最后制得的苯胺中混有硝基苯该怎样提纯? 3、3、反应物变黑时,即表明反应基本完成,欲检验,可吸入反应液滴入盐酸中摇振, 若完全溶解表示反应已完成,为什么?
实验名称由苯胺设计合成对硝基苯胺院系化学化工学院 班级化基1101 学号20110903215 姓名刘永超
一、实验目的 1、掌握由苯胺设计合成对硝基苯胺的原理 2、掌握邻硝基苯胺和对硝基苯胺的分离方法 3、学会对有毒药品的操作和处理 二、预备知识 1、反应中各步化合物的物理性质 化合物 名称 分子量性状熔点℃沸点℃溶解度 水乙醇乙醚苯胺93.12 无色油 状液体 -6.3 184 微溶溶溶 乙酸酐102.09 无色透 明液体 -73.1 138.6 微溶溶溶 乙酰苯胺135.16 斜方晶 体 133.4 305 微溶于 冷水, 溶于热 水 溶溶 对硝基乙酰苯胺180.16 无色晶 体 100 215.6 微溶于 冷水, 易溶于 沸水 溶溶 邻硝基乙酰苯胺180.16 淡黄色 片状 94 100 微溶于 冷水, 易溶于 沸水 溶溶 对硝基苯胺138.12 淡黄色 针状 148.5 331.7 微溶于 冷水, 易溶于 沸水 溶溶 邻硝基苯胺138.12 橙黄色 针状 69.7 284.5 微溶于 冷水, 易溶于 沸水 溶溶 2、酰化反应的反应活性:酰氯>酸酐>酯>酰胺,故乙酰苯胺可由苯胺与酰氯、酸酐或冰醋酸来制备。在芳胺的反应中,常将氨基通过乙酰化反应保护起来,降低了氨基在亲电取代反应中的活化能力,以
防止氨基被氧化。由于乙酰基的空间位阻效应,酰胺基属于邻对位定位基,在苯环上往往选择性地生成邻对位取代产物。 三、实验原理 先以苯胺为原料,经乙酰化合成乙酰苯胺,再经过硝化,水解得到邻硝基苯胺和对硝基苯胺的混合物,再通过蒸馏,柱层析,或水蒸气蒸馏分离即可得到对硝基苯胺。 1、乙酰苯胺的制备 乙酸和苯胺的反应是可逆的,且反应速率较慢,可采用乙酸过量的方法和利用分馏柱将反应中生成的水蒸除,使平衡向水生成的方向移动而提高乙酰苯胺的产率。 2、硝化反应 乙酰苯胺与混酸反应,硝化的位置与温度有关。在低温(低于5℃)下产物以对硝基乙酰苯胺为主。硝化温度升高,邻硝基乙酰苯胺产物将增多。 3、水解反应:
苏北四市2019届高三年级期末调研测试 化学 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 As 75 I 127 选择题 单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个 ....选项符合题意。 1.雾霾对人类健康造成危害。下列做法会导致雾霾加剧的是 A.给道路洒水,抑制扬尘 B.提倡市民开私家车出行 C.对裸露土地开展植树绿化 D.对建筑工地、烧烤等加强管理 2.下列有关化学用语表示正确的是 A.中子数为8的碳原子: B.氯化钙的电子式: C.S2-的结构示意图: D.2溴丙烷的结构简式:(CH 3)2CHBr 3.下列物质性质与应用对应关系正确的是 A.氢氟酸显弱酸性,可用于雕刻玻璃 B.NaClO溶液显碱性,可用于杀菌消毒 C.NH4Cl分解时吸收大量的热,可用作阻燃剂 D.CO2密度比空气大,可用作镁着火时的灭火剂 4.短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子最外层电子数是内层的2倍,元素Y的核电荷数等于W原子的最外层电子数,金属元素Z的最高正化合价为+2价。下列说法正确的是 A.最高价氧化物对应水化物的酸性:W>X B.X、Y的单质均具有较高的熔沸点 C.原子半径:r(X)﹤r(Y)﹤r(Z)﹤r(W) D.Z、W形成的化合物中既含有离子键,又含有共价键 5.下列指定反应的离子方程式正确的是 A.将Na2O2投入足量H2O中:2O22-+2H2O=4OH-+O2↑ B.NH4Fe(SO4)2溶液中加入少量NaOH:NH4++OH-=NH3·H2O C.向受酸雨影响的湖泊中撒CaCO3粉末:CO32-+2H+=CO2↑+H2O D.向淀粉—KI溶液中滴加稀硫酸,在空气中一段时间后变蓝: 4I-+O2+4H+=2I2+2H2O 6.实验室用稀硝酸与铜反应制备硝酸铜晶体[Cu(NO3)2·3H2O]及NO气体,需经过铜与稀硝酸反应、收集NO、尾气处理、制取硝酸铜晶体四个步骤,下列图示装置和原理能 达到实验目的的是
硝基苯液相催化加氢制苯胺技术进展 苯胺是一种用途十分广泛的有机化工中间体,广泛应用于聚氨酯原料二苯基甲烷二异氰酸酯(MDI)、燃料、医药、橡胶助剂、农药及精细化工中间体的生产。尤其是作为MDI的生产原料,具有很大的市场潜力。近年来,随着MDI生产的不断发展,苯胺生产能力不断扩大,生产装置趋向大型化。目前苯胺生产工艺路线主要有硝基苯铁粉还原法、苯酚氨化法和硝基苯催化加氢法,分别占苯胺总生产能力的5%、10%和85%,其中硝基苯催化加氢法又分为固定床气相催化加氢、流化床气相催化加氢和液相催化加氢法。目前我国除山东烟台万华聚氨酯集团公司采用固定床工艺、山西天脊集团公司采用液相加氢工艺外,全部采用流化床气相催化加氢法。虽然气相加氢取得了流化床和固定床的混合床技术、催化剂体外再生等一些科技成果,使加氢装置有了很大的改进;但是当年产量达到10万t 以上时,就遇到了设备体积以及产品质量的巨大挑战。而国外应运而生的液相法加氢制苯胺技术则成功地解决了这一问题,使苯胺的生产技术有了质的飞跃。由于液相加氢具有反应温度低、副反应少、催化负荷高、设备生产能力大、总投资低等优点,近年来已引起人们的关注。本文介绍了硝基苯液相催化加氢技术研究进展,为我国硝基苯催化加氢制苯胺技术提供参考建议。 1 传统硝基苯液相加氢制苯胺工艺 为了解决硝基苯气相加氢制苯胺反应温度高等问题,英国ICI、日本三井东亚(Mitsui Toatsu)、美国杜邦(DuPont)公司等相继开发出硝基苯液相催化加氢工艺。 1.1 ICI公司硝基苯液相加氢制苯胺工艺 ICI公司在1939年成功开发硝基苯液相加氢制苯胺工艺,采用苯胺作为溶剂,以硅藻土为载体的活性镍为催化剂,载体的粒径为200目,在反应时要及时移走反应中产生的水,防止水浸湿催化剂。当硝基苯浓度较低时,如当苯胺的摩尔分数大于还原的摩尔分数时,该催化剂具有很好的活性。一般在100℃、3MPa压力下反应。采用浆态床反应器或流化床反应器,通过反应压力将反应物混合进行浓缩,从而去除反应热。 该技术的先进性在于氢气不必为高纯气,可以是摩尔比为3:1的H2与N2的混合气体,而且混合气体可以循环使用。从加氢反应器出来的气体冷却分离水汽后,再补充一部分氢气重新进入反应段反应,该工艺中必须具有大量的循环气,确保快速移走反应中产生的水蒸气,并且确保催化剂悬浮在反应段中。图1(略)为ICI 公司硝基苯液相加氢制苯胺工艺流程图。 在ICI工艺中,溶剂苯胺在液相中的质量分数维持在84%左右,而且反应温度在100℃,此时制备的苯胺中含有质量分数丸0.6%的硝基苯,并含有其他具有氢化核的杂质,需经过精馏装置对其精馏,才能得到高纯度苯胺。 1.2 日本三井东亚化学株式会社硝基苯液相加氢制苯胺工艺 为了克服ICI公司硝基苯反应体系中杂质较多的缺点,日本三井东亚化学株式会社提出改进型硝基苯液相加氢技术,通过降低硝基苯在反应物中的浓度来提高苯胺的纯度,采用贵金属催化剂,包括将沉积在吸油性至少为100的亲油性炭上的钯或钯-铂催化剂悬浮于苯胺溶剂中,向反应体系加入锌化合物和碱金属碳酸盐(碳酸钠)或碱金属碳酸氢盐(碳酸氢钠)作为助催化剂,以及在基本无水情况下在温度150-250℃、压力0.3-0.7 MPa下进行反应,并将硝基苯在反应物中的质量分数维持在0.01%或更低,同时以蒸汽形式连续蒸出产物苯胺和水。 在该技术中所用的催化剂是粒径为20-60μm、比表面积为50-100m2/g、负载Pd
深圳市南油诺安电子有限公司 苯胺及硝基苯挥发性说明 世界卫生组织(WHO)对于挥发性有机物的定义为熔点低于室温而沸点在50~260℃之间的有机化合物的总称。而欧盟(EU)的定义为在20℃条件下,饱和蒸气压大于0.01KPa的所有有机物。 苯胺及硝基苯都是典型的挥发性有机物。即常温下都为液体,但能够挥发出一定浓度的雾状气液混合物蒸气。光离子(PID)气体探测器对于挥发性有机物的检测本质上是测量其挥发出的雾状蒸气的浓度。在同一温度下,液体的饱和蒸气压越高,则其挥发性越强,其产生的雾状蒸气浓度也越高。而同一种液体,其饱和蒸气压随着环境温度的升高而升高(参见附图),同时挥发性也变得更强。 下表列出了部分常见化工产品在37.8℃(100F)的饱和蒸气压: 液体名称饱和蒸气压(KPa)@37.8℃(100F) 汽油(国4)40-85 苯24.37 丙酮53.32(39.5℃) 柴油0.689 煤油0.683 苯胺0.21 硝基苯0.13 (44.4℃) 可以看到苯胺和硝基苯在同样温度条件下,其饱和蒸气压还不到苯的百分之一,即在同样环境条件下,其挥发出的有机挥发物蒸气浓度也远远低于苯(约为百分之一的水平)。而苯和苯胺及硝基苯对于PID探测器的响应系数基本在同一级别(苯RF=0.5,苯胺RF=0.5,硝基苯RF=1.7)。 因而在实际应用中(特别是气温较低时),对于苯有良好反应的PID气体探测器对苯胺及硝基苯的响应值可能较低。但这并非是由于PID检测原理所导致,而是因为此时空气中的有机挥发物蒸气浓度确实很低,使用任何其他原理的气体探测器都不能得到比PID气体探测器更为理想的检测结果。 相应的解决办法是选用具有更高检测精度、更低量程的PID气体探测器,同时根据现场环境适当调低报警设定值。 附图: 苯胺的饱和蒸气压力(mmHg)与环境温度(℃)的对应关系
硝基苯催化加氢制苯胺化工生产安全 一安全生产的重要性和必要性 安全生产是指在生产经营活动中,为了避免造成人员伤害和财产损失的事故而采取相应的事故预防和控制措施,使生产过程在符合规定的条件下进行,以保证从业人员的人身安全与健康,设备和设施免受损坏,环境免遭破坏,保证生产经营活动得以顺利进行的相关活动。 安全生产是安全与生产的统一,安全促进生产,生产必须安全。安全生产关系人民群众的生命财产安全,关系改革发展和社会稳定大局。搞好安全生产工作,切实保障人民群众的生命财产安全,体现了最广大人民群众的根本利益,反映了先进生产力的发展要求和先进文化的前进方向。做好安全生产工作是全面建设小康社会、统筹经济社会全面发展的重要内容,是实施可持续发展战略的组成部分。 二硝基苯催化加氢制苯胺工艺 硝基苯催化加氢制苯胺生产方法主要是相应硝基化合物的还原,包括铁粉还原法、硫化碱还原法和催化加氢法等。其中,催化加氢制备芳胺具有污染少和产品质量高等特点,是环境友好的生产工艺。硝基苯催化加氢法是目前工业上生产苯胺的主要方
法。它又包括固定床气相催化加氢、流化床气相催化加氢以及硝基苯液相催化加氢三种工艺。 (1)硝基苯催化加氢为放热反应 C6H5NO2+3H2=======C6H5NH2+2H2O+544kj /mol 固定床气相催化加氢固定床气相催化加氢工艺是在200~300℃、1~3MPa条件下,经预热的氢和硝基苯发生加氢反应生成粗苯胺,粗苯胺经脱水、精馏后得成品,苯胺的选择性大于99%。固定床气相催化加氢工艺具有技术成熟,优点:反应温度较低,设备及操作简单,维修费用低,建设投资少,不需分离催化剂,产品质量好等;缺点:是反应压力较高,易发生局部过热而引起副反应和催化剂失活,必须定期更换催化剂。目前,国外大多数苯胺生产厂家采用固定床气相加氢工艺,我国山东烟台万华聚氨酯集团有限公司采用该法进行生产。 (2)流化床气相催化加氢 流化床气相催化加氢法是原料硝基苯加热汽化后,与理论量约三倍的氢气混合,进入装有铜—硅胶催化剂的流化床反应器中,在260~280℃条件下进行加氢还原反应生成苯胺和水蒸气,再经冷凝、分离、脱水、精馏得到苯胺产品。优点:较好地改善了传热状况,控制了反应温度,避免了局部过热,减少了副反应的生成,延长了催化剂的使用寿命;缺点:操作较复杂,催化剂磨损大,装置建设费用大,操作和维修费用较高。我国除山东烟台万华聚氨
2,4-硝基加氢还原操作规程 1、投料前先检查甲醇计量槽、硝基计量槽的液位是否灵活、准确,有关设备、仪表是否完好,搅拌冷却水是否打开、畅通。 2、检查计量槽底阀是否打开、计量槽进料阀门是否打开、硝基的旁通回流阀门是否关闭、2,4-硝基放料阀门是否关闭、甲醇放料阀门是否关闭。 3、分别启动2,4-硝基输送泵和2,4-甲醇输送泵,直到液位显示规定的位置,停泵。待投料。 4、打开釜上排空阀门(开1/3~1/2就可以)、釜上的投料阀门,打开2,4-硝基放料阀门,往釜内投2,4-硝基,直到液位显示刻度10,关闭放料阀门。再打开旁通的回流阀门,让余下2,4-硝基流回2,4-硝基储罐。 5、打开漏斗旁通两个针形阀门,打开釜上的催化剂放料阀门,放空几秒钟后,关闭催化剂放料阀门。 6、打开漏斗下方阀门,往漏斗及缓冲节内加入甲醇,直到漏斗液位约2/3为止。 7、保持装催化剂的桶内催化剂水封,慢慢地往漏斗内投入催化剂,直到投完。装催化剂的塑料桶用甲醇洗干净。 8、打开釜上催化剂放料阀门,下到漏斗内甲醇放完,马上关闭催化剂放料阀门。再加入同量的甲醇,再打开催化剂放料阀门,如此重复两次,让留在漏斗及缓冲节内的催化剂全部投入釜内。 9、催化剂投完,关闭催化剂放料阀门、关闭漏斗下方阀门、关闭漏斗旁通两个钍形阀门,盖好漏斗盖板。 10、打开甲醇放料阀门、打开过滤器下方的回流阀门,往釜内投甲醇,直到液位显示刻度10,关闭甲醇放料阀门。再打开氮气阀门,往过滤器充入一定量的氮气(约30S)后,关闭氮气阀门、关闭过滤器下方的回流阀门、关闭釜上的投料阀门。三种原料投料完毕。 11、关闭釜上的排空阀门,打开氢气阀门,往釜内充入氢气直到压力0.5Mpa左右,慢慢打开放空阀门,直到釜内压力为0.1Mpa左右,如此重复三次后关闭放空阀门。把氢气阀门全打开,使釜内压力达到0.9Mpa以上,用皂水检查釜上各阀门的阀蕊、法兰等部位是否泄漏。若无泄漏,继续下一步;若有泄漏马上处理。 12、开启搅拌,打开夹套蒸阀门,打开蒸汽输水阀,开始升温反应。 13、当温度升到65℃时,关闭蒸汽阀门。让体系温度自动上升,当温度达到80℃时,慢慢先打开一套盘管冷却水阀门,通过调节两套盘管冷却水阀门,控制釜内温度在80~90℃(尽可能在86~90℃)之间反应。 14、通过观察釜内温度、压力的变化情况,取样分析反应是否完全,当2,4-硝基含量小于0.3%时,反应结束。 15、反应完毕后,打开冷却水进行降温。当温度降到45℃时,关闭冷却水阀门,停止搅拌,静置30min后,压料。 16、压料时,先打开氢化液缓冲釜的排空阀门,打开进料阀门(缓冲釜上其它阀门均关闭)后,打开过滤器上的出料阀门后,慢慢的打开上出料口阀门,直到过滤器内填满物料才全打开上出料口阀门。开始正常压料。 17、当压料管内出气体,管子振动较大,观察压力变化较快时,关闭上出料口阀门,压料结束。慢慢打开釜上排空阀门,直到压力为零,开始下一批投料。 18、物料出完后,打开缓冲釜底阀,打开物料输送泵,把氢化液送入2,4-苯胺储罐中,备用,待进行后序工序脱甲醇。
硝基苯的催化氢化法制苯胺 组员:刘超谌庄琳 一、苯胺的性质 1.物理性质: 苯胺 Aniline;其他名称,胺基苯,阿尼林油。是最简单的一级芳香胺。无色或微黄色油状液体,有令人不愉快的气味。熔点-6.3℃,沸点184℃,相对密度1.02 (20/4℃),相对分子量93.128,加热至370℃分解。稍溶于水,易溶于乙醇、乙醚、苯等有机溶剂。暴露于空气中或日光下变为棕色。可用水蒸气蒸馏,蒸馏时加入少量锌粉以防氧化。提纯后的苯胺可加入10~15ppm的NaBH4,以防氧化变质。 2.化学性质: 有碱性,能与盐酸化合生成盐酸盐,与硫酸化合成硫酸盐。能起卤化、乙酰化、重氮化等作用。遇明火、高热可燃。与酸类、卤素、醇类、胺类发生强烈反应,会引起燃烧。其氨基上的氢原子可被烃基或酰基取代,生成二级或三级苯胺及酰基苯胺。当苯胺进行取代反应时,主要生成邻、对位取代产物。苯胺与亚硝酸反应生成重氮盐,由此盐可制成一系列苯的衍生物和偶氮化合物。 二、苯胺的用途: (1)苯胺是染料工业中最重要的中间体之一,在染料工业中可用于制造酸性墨水蓝G、酸性媒介BS、酸性嫩黄、直接橙S、直接桃红、靛蓝、分散黄棕、阳离子桃红FG和活性艳红X-SB等。 (2)在有机颜料方面有用于制造金光红、金光红g、大红粉、酚菁红、油溶黑等。在印染工业中用于染料苯胺黑;在农药工业中用于生产许多杀虫剂、杀菌剂如DDV、除草醚、毒草胺等。 (3)苯胺是橡胶助剂的重要原料,用于制造防老剂甲、防老剂丁、防老剂RD及防老剂4010、促进剂M、808、D及CA等 (4)也可作为医药磺胺药的原料,同时也是生产香料、塑料、清漆、胶片等的中间体;并可作为炸药中的稳定剂、汽油中的防爆剂以及用作溶济;其它还可以用作制造对苯二酚、2-苯基吲哚等。 (5)苯胺是生产农药的重要原料,由苯胺可衍生N-烷基苯胺、烷基苯胺、
硝基苯生产工艺的选择 目前硝基苯生产主要采用混酸硝化法,一般有二种工艺,一是等温硝化,二是绝热硝化。绝热硝化与等温硝化相比有以下优点:硝化温度高于等温硝化,有利于提高反应速度,缩短反应时间,混酸组成上绝热法含水高,硝酸浓度低,反应较温和,其最大优点是硝化反应放出的热量不需要冷却,可用于废酸浓缩。 虽然绝热硝化具有许多优点,但该技术在国内没有得到成熟应用,如引进国外技术,技术转让费昂贵。经综合测算,采用绝热硝[wiki]化工[/wiki]艺,单位生产成本比等温硝化高200 元左右。因此,硝化部分选择等温硝化工艺。 1.苯胺生产工艺的选择 a)硝基苯铁粉还原法 硝基苯铁粉还原法采用间歇式生产,将反应物料投入还原锅中,在盐酸介质和约100℃温度下,硝基苯用铁粉还原生成苯胺和氧化铁,产品经蒸馏得粗苯胺,再经精馏得成品,所得苯胺收率为95%~98%,铁粉质量的好坏直接影响苯胺的产率。硝基苯铁粉还原法是生产苯胺的经典方法,但因存在设备庞大、反应热难以回收、铁粉耗用量大、环境污染严重、设备腐蚀严重、操作维修费用高、难以连续化生产、反应速度慢、产品分离困难等缺点,目前正逐渐被其他方法所取代。但由于该法可以同时联产氧化铁颜料,我国有一小部分中小型企业仍采用该法进行生产。 b)硝基苯催化加氢法 硝基苯催化加氢法是目前工业上生产苯胺的主要方法。它又包括固定床气相催化加氢、流化床气相催化加氢以及硝基苯液相催化加氢三种工艺。 固定床气相催化加氢工艺是在200~300℃、1~3MPa条件下,经预热的氢和硝基苯发生加氢反应生成粗苯胺,粗苯胺经脱水、精馏后得成品,苯胺的选择性大于99%。固定床气相催化加氢工艺具有技术成熟,反应温度较低,设备及操作简单,维修费用低,建设投资少,不需分离[wiki]催化剂[/wiki],产品质量好等优点,不足之处是反应压力较高,易发生局部过热而引起副反应和催化剂失活,必须定期更换催化剂。目前国外大多数苯胺生产厂家采用固定床气相加氢工艺进行生产,山东烟台万华聚氨酯集团有限公司采用该法进行生产。 流化床气相催化加氢法是原料硝基苯加热汽化后,与理论量约3倍的氢气混合,进入装有铜-硅胶催化剂的流化床反应器中,在260~280℃条件下进行加氢还原反应生成苯胺和水蒸气,再经冷凝、分离、脱水、精馏得到苯胺产品。该法较好地改善了传热状况,控制了反应温度,避免了局部过热,减少了副反应的生成,延长了催化剂的使用寿命,不足之处是操作较复杂,催化剂磨损大,装置建设费用大,操作和维修费用较高。我国除烟台万华聚氨酯集团有限公司外,其它生产厂家均采用流化床气相催化加氢工艺进行生产。 2.硝基苯液相催化加氢工艺是在150~250℃、0.15~1.0MPa压力下,采用贵金属催化剂,在无水条件下硝基苯进行加氢反应生成苯胺,再经精馏后得成品,苯胺的收率为99%。液相催化加氢工艺的优点是反应温度较低,副反应少,催化剂负荷高,寿命长,设备生产能力大,不足之处是反应物与催化剂以及溶剂必须进行分离,设备操作以及维修费用高。 硝基苯生产工艺 一、硝化
苯胺是其重要的胺类物质之一,苯胺类化合物更是芳香胺的代表,应用于制造染料、药物、树脂,还可以用作橡胶硫化促进剂亦是作为黑色染料使用等。因其氧化而带色,具有特殊的气味,毒性很大,对人体具有致癌作用,因此苯胺、硝基苯行业废水的治理也愈加严格,需要治理达标。那么,苯胺、硝基苯废水要如何处理,下面海普就为大家详细的介绍下,希望对你有所帮助。 硝基苯是易制爆品,也是重要的其本有机中间体。可作为染料、医药等中间体,硝基苯经氯化得间硝基氯苯,广泛用于农药等的生产。 环境中的硝基苯主要来自化工厂、染料厂的废水废气,尤其是苯胺染料厂排出的污水中含有大量硝基苯。贮运过程中的意外事故,也会造成硝基苯的严重污染。硝基苯类化合物废水成分复杂,毒性大,色度高,COD高,生物降解难度大,对生态环境具有较大的危害。因此行业的废水的治理也愈加严格,要治理达标。 目前我国大部分企业对含苯胺及硝基苯废水通常采用单一的氧化法处理废水,难以取得理想的效果。需要容阔含苯胺及硝基苯废水的处理方式,将毒性高、难生物降解的污染物尽可能的降解或转化为易降解的物质,经过简单的处理以达到较好的效果。 苯胺及硝基苯废水现状和困局: 苯胺及硝基苯, 是一种重要的化工原料, 广泛应用于化工、医药工业、印染及农药生产等行业, 也是一种致癌、致畸、致突变的环境污染物。其废水水质复杂,含大量不可生化降解物质,具有COD浓度高、毒性高等特点,常规水处理技术难以治理,已成为工业废水处理难点。 近年来,国家对生态环境保护日益重视,对废水排放标准及区域废水排放总量控制日趋严格,为了保证应用苯胺及硝基苯相关行业的可持续发展,含不难及硝基苯废水治理技术也不断呈现出新的思路,近年来处理这类废水的方法主要有光催化氧化、Fenton氧化法、吸
化学与环境学院 有机化学实验报告实验名称苯胺的制备 【实验目的】 1、掌握硝基苯还原为苯胺的实验方法和原理;
2、巩固水蒸气蒸馏和简单蒸馏的基本操作。 【实验原理】(包括反应机理) (一)芳胺的制取不可能用任何直接的方法将氨基(—NH2)导入芳环上,而是经过间接的方法来制备。将硝基苯还原就是制取苯的一种重要方法。实验室常用的还原剂有铁—盐酸、铁—醋酸、锡—盐酸、锌—盐酸等。用锡—盐酸作还原剂时,作用较快,产率较高,不需用电动搅拌,但锡价格较贵,同时盐酸、碱用量较多。 锡—盐酸法:反应可能经过下列过程: 2C6H5NO2+3Sn+14HCl→(C6H5NH3)+ 2SnCl-2 6 +4H2O (C6H5NH3)+ 2SnCl-2 6 +8NaOH→2C6H5NH2+Na2SnO3+5H2O+6NaCl 铁—醋酸法: 4C6H5NO2+9Fe+4H2O?→ ?+H4C6H5NH2+3Fe3O4 苯胺有毒,操作应避免与皮肤接触或吸入其毒气!若不慎触及皮肤时,应先用水冲洗,再用肥皂及温水洗涤。 (二)水蒸气蒸馏(Steam Distillation)也是分离和提纯有机化合物的常用方法,但被提纯物质必须具备以下条件: (1)不溶或难溶于水; (2)与水一起沸腾时不发生化学变化; (3)在100℃左右该物质蒸气压至少在10mmHg(1.33kPa)以上。水蒸气蒸馏常用于以下几种情况:
(1)在常压下蒸馏易发生分解的高沸点有机物。 (2)含有较多固体的混合物,而用一般蒸馏、萃取或过滤等方法又难以分离。 (3)混合物中含有大量树脂状的物质或不挥发性杂质,采用蒸馏、萃取等方法也难以分离。 在难溶或不溶于水的有机物中通入水蒸气或与水一起共热,使有机物随水蒸气一起蒸馏出来,这种操作称为水蒸气蒸馏。 【主要试剂及物理性质】 【仪器装置】 1、主要仪器:
硝基苯的性质:难溶于水,密度比水大,相对密度 1.2037(20/4℃);易溶于乙醇、乙醚、苯和油。硝基苯由苯经硝酸和硫酸混合硝化而得。作有机合成中间体及用作生产苯胺的原料。硝基苯毒性较强,吸入大量蒸气或皮肤大量沾染,可引起急性中毒. 蒸气压:0.13kPa(1mmHg44.4℃). 硝基苯在水中具有极高的稳定性。由于其密度大于水,进入水体的硝基苯会沉入水底,长时间保持不变。又由于其在水中有一定的溶解度,所以造成的水体污染会持续相当长的时间。硝基苯的沸点较高,自然条件下的蒸发速度较慢,与强氧化剂反应生成对机械震动很敏感的化合物,能与空气形成爆炸性混合物。倾翻在环境中的硝基苯,会散发出刺鼻的苦杏仁味。80℃以上其蒸气与空气的混合物具爆炸性,倾倒在水中的硝基苯,以黄绿色油状物沉在水底。当浓度为5mg/L 时,被污染水体呈黄色,有苦杏仁味。当浓度达100mg/L时,水几乎是黑色,并分离出黑色沉淀。当浓度超过33mg/L时可造成鱼类及水生生物死亡。吸入、摄入或皮肤吸收均可引起人员中毒。中毒的典型症状是气短、眩晕、恶心、昏厥、神志不清、皮肤发蓝,最后会因呼吸衰竭而死亡。 硝化反应是指苯分子中的氢原子被一NO2所取代的反应,也属于取代反应的范畴。 硝基苯经过零价铁还原,会生成苯胺,即C6H5NO2+3Fe+6HCl=C6H7N+3FeCl2+2H2O 苯胺,分子式:C6H7N。无色油状液体。熔点-6.3℃,沸点184℃,相对密度 1.02 (20/4℃),相对分子量93.128,加热至370℃分解。稍溶于水,易溶于乙醇、乙醚等有机溶剂。饱和蒸汽压2kPa 苯胺更易降解 苯胺的工业生产方法主要有硝基苯铁粉还原法、氯化苯胺化法、硝基苯催化加氢还原法和苯酚氨解法。目前硝基苯加氢还原法为主要生产的方法。 苯胺作为一种化工原料广泛应用于国防、塑料、油漆、印染、农药和医药等行业。苯胺也是一种“三致(致癌、致畸、致突变)”物质,严重威胁生态环境和人体健康。基于硫酸自由基的高级氧化技术由于降解彻底,处理设备简单等特点在国内外被广泛关注,已成为当前研究的热点。本研究用基于硫酸自由基的高级氧化技术来降解模拟苯胺废水。探究了实验过程中溶液的环境温度,pH值,氧化剂(过硫酸盐)的初始浓度和废水中常见阴离子等因素对苯胺降解的影响;在高温活化过硫酸盐条件下阐明了过硫酸盐氧化降解苯胺的机理。本研究的主要结论如下:在过硫酸盐体系中,苯胺的降解过程遵循准一级动力学方程。在10-50℃的实验温度范围内,随着温度的增高,苯胺的降解速率也增大。过硫酸盐浓度越大,苯胺降解速率越高。pH值对苯胺降解的影响较为复杂,在强酸性条件下(pH3),苯胺基本没有得到降解;中性条件下苯胺的降解速率要大于弱酸性(pH5)和弱碱性(pH9)下苯胺的降解速率。强碱性条件(pH11)可以促进苯胺
解决方案编号:LX-FS-A62215 硝基苯催化加氢制苯胺的安全技术 分析标准范本 In the daily work environment, plan the important work to be done in the future, and require the personnel to jointly abide by the corresponding procedures and code of conduct, so that the overall behavior or activity reaches the specified standard 编写:_________________________ 审批:_________________________ 时间:________年_____月_____日 A4打印/ 新修订/ 完整/ 内容可编辑
硝基苯催化加氢制苯胺的安全技术 分析标准范本 使用说明:本解决方案资料适用于日常工作环境中对未来要做的重要工作进行具有统筹性,导向性的规划,并要求相关人员共同遵守对应的办事规程与行动准则,使整体行为或活动达到或超越规定的标准。资料内容可按真实状况进行条款调整,套用时请仔细阅读。 苯胺是重要的有机化工中间体,广泛地应用于橡胶助剂、染料、感光化学品、医药、农药、炸药及聚氨酯等行业。由于市场需求较大,近几年改建、扩建及新建一批苯胺生产装置。但在苯胺及配套装置生产过程中使用大量易燃易爆、有毒有害的危险化学品,加之生产工艺条件苛刻,装置及控制技术要求严格,使其生产过程事故具有突发性、灾害性的特点。因此,有必要对苯胺的安全生产问题进行认真剖析并提出具体的对策。
含硝基苯、苯胺污染物废水的处理方法 适用范围 主要适用于含硝基苯、苯胺类污染物废水的处理、也可应用于TDI、硝基苯、苯胺等化工装置的工业化生产中。 基本原理 还原反应的催化剂采用含金属铁的CHA-2X型催化剂,并控制废水的酸碱度为3~4,通入空气进行搅拌,发生如下电化学反应:Fe-2e →Fe2+,2H+2e-→H,新生态的H可与废水中的硝基苯类物质发生加氢反应生成苯胺类物质,以易于进行催化氧化反应。 催化氧化反应加入的H2O2在一定条件下可产生很强的·OH自由基,·OH自由基能将有机污染物直接氧化成无机物,或将其转化为易生物降解的中间产物。H2O2再与催化剂构成氧化体系,会产生更高浓度的·OH自由基,对有机物的降解更加彻底。使硝基苯、苯胺最终降解为CO2,H2O,N2等物质。 在中和絮凝沉淀工序中,中和剂采用氢氧化钠,废水的酸碱度为pH7~9,并加入絮凝剂聚丙烯酰胺等阴离子絮凝剂,使还原反应产生的Fe2+已被氧化成Fe3+,Fe3+又是良好的絮凝剂,能形成具有较高表面能的以Fe3+水解产物为凝胶中心的胶粒或微絮体,进一步吸附废水中的污染物以降低其表面能,最终聚结成较大的絮体沉淀,实现固液分离。 工艺流程
1、调节酸碱度:将生产装置产生的含硝基苯、苯胺类污染物的废水先用硫酸调节酸碱度到pH=3~4; 2、还原反应:将调节酸碱度后的废水由污水泵送入填充有含铁、铜、锌组分的催化剂和焦炭的还原处理器进行还原处理,同时吹入适量空气进行搅拌; 3、催化氧化:还原处理后的废水再用硫酸调节酸碱度至pH=3~4后,再将废水送入填充有含铁、铜、锌组分CHA-1型催化剂和焦炭的催化氧化处理器进行催化氧化处理,同时加入一定浓度和定量的 H2O2,吹入空气进行搅拌; 4、中和絮凝沉淀:经催化氧化处理后的废水用氢氧化钙中和剂和絮凝剂进行中和絮凝沉淀后固液分离; 5、固液分离:分离的清液检测后直接排放或二次利用、污泥经脱水后外运处置。
综 述 文章编号:1002-1124(2004)02-0024-02 硝基苯加氢制备苯胺的催化体系研究进展 郭延红1,郭力民1,孙小燕2 (11延安大学化工研究所,陕西省化学反应工程省级重点实验室,陕西延安716000;21延长油矿管理局,陕西延安716000) 摘 要:介绍了硝基苯加氢反应的铜系、钯系及其他催化体系及近年来的研究进展。 关键词:硝基苯;加氢;催化体系;苯胺中图分类号:T Q03114 文献标识码:A Development on catalyst systems for hydrogenation of nitrobenzene to aniline G UO Y an -hong 1,G UO Li -min 1,S UN X iao -yan 2 (1.Institute of Chemical Engineering Provincial K ey Laboratory Y an ’an University ,Y an ’an 716000,China ; 2.M anagement Bureau of Y anchang Oil Deposit ,Y an ’an 716000,China ) Abstract :Catalyst system such as Cu ,Pd and other catalysts for hydrogenation of nitrobenzene toaniline are intro 2 duced.The recent development on this system is summarized as well. K ey w ords :nitrobenzene ;hydrogenation ;catalyst system ;aniline 收稿日期:2003-12-11 作者简介:郭延红(1965-),女,硕士研究生,副教授,主要从事催化 剂研究。 苯胺是合成许多精细化学品的重要中间体,用 途广泛,由其制得的化工产品和中间体有300多种。近年来作为异氰酸酯的原料,伴随着聚氨酯生产能力的提高,需求量日益增长,开发利用前景广阔。 工业上生产苯胺的方法有硝基苯铁粉还原法、硝基苯催化加氢法及苯酚胺化法。目前,世界上苯胺的生产以硝基苯催化加氢法为主,其生产能力约占苯胺总生产能力的85%,苯胺氨化法约占10%,硝基苯铁粉还原法约占5%[1]。本文拟从近年来有关硝基苯催化加氢法催化剂的研究进展做一些综述。 从报道的文献看,国内外研究人员所报道的硝基苯催化加氢生产苯胺的催化体系主要有铜负载在二氧化硅载体上的Cu/SiO 2体系,将Pt 、Pd 、Rh 等金属负载在氧化铝、活性炭等载体上的贵金属催化剂及其他催化体系。 1 Cu/SiO 2催化体系 Cu/SiO 2催化剂具有原料便宜易得、制备方法简 单可行、造价低、选择性好的优点。缺点是抗毒性差、微量有机硫化物及易使催化剂中毒。从文献报道的情况看,采用Cu/SiO 2催化剂属于气相催化加氢。用于硝基苯加氢制苯胺反应的Cu/SiO 2系列催 化剂主要包括Cu -Cr/SiO 2催化剂、Cu -Cr -M o/SiO 2催化剂。 Cu -Cr/SiO 2催化剂中,铬作为助催化剂,使催 化剂性能有所提高,但催化剂的稳定性仍较差[2~3]。南昌大学现代应用化学研究所研究的硝苯加氢Cu -Cr -M o/SiO 2催化剂,性能较工业上使用的改性铜催化剂有很大提高,其方法大致如下[4]:将一定量的铬酸铵(AR )和钼酸铵(AR )配成溶液,投入干燥后的硅胶,浸渍、干燥、冷却后放入定量饱和铜氨溶液,控制所得催化剂含铜量在12%~18%,过滤、干燥、焙烧即得催化剂母体。研究表明Cu -Cr -M o/SiO 2加氢催化剂较改性单铜催化剂性能有很大提高,改性使得催化剂负荷量有较大提高,在工业上可提高设备的生产能力,并可降低生产成本,而且,通过进一步催化机理研究表明,Cu -Cr -M o/SiO 2催化剂的活性与CuO 有关。通过对该催化剂的TPR 研究表 明,催化剂对于H 2的吸附具有两个活性位(Ⅰ )、(Ⅱ),两活性位具有各自的能量特征。(Ⅰ)具有较强的H 2吸附能力。在改性后的催化剂上存在有两种形态钼,即M oO 3和M oO 2。伏路仪等[5]认为在SiO 2载体上钼的存在形态与M oO 3含量有关,体相M oO 3易与含硫毒物形成较稳定的M oS 2微晶[6],因 而延长了催化剂的寿命,催化剂的活性评价结果说明了低钼含量的催化剂的性能较佳。XRD 实验表明,加入助剂后在催化剂还原时提高了微晶的分散度,即助剂在催化剂上的存在阻止了新生铜微晶的 Sum 101N o 12 化学工程师 Chemical Engineer 2004年2月