
环境监测实验
孙卫国编
内蒙古大学生态与环境科学系
2005年3月1日
实验一容量仪器的校准
一、原理
容量瓶、滴定管等分析实验室常用的玻璃量器,都具有刻度和标称容量(量器上所标示的量值),其容量都可能有一定的误差,即实际容量与其标称容量之差。量器产品都允许有一定的容量允差,规定的允差见表。合格的产品其容量误差往往小于允差,但也有质量不合格的产品流入市场,如果不预先进行校准,就可能给实验结果带来误差。在进行实验之前,应该对所用仪器的计量性能心中有数,保证其测量的精度能满足实验结果准确度的要求。进行高精确度的定量分析工作时,应使用经过校准的仪器,尤其是对所用仪器的质量有怀疑时,或需要使用A级产品而只能买到B级产品时,或不知道现有仪器的精度级别时,都有必要对仪器进行容量校准。因此,容量的校准是一项不可忽视的工作。
校准的方法是,称量被校量器中量入或量出的纯水的质量,再根据该温下纯水的密度计算出被校量器的实际容量。这里应当使用纯水在空气中的密度值。由于空气对砝码的浮力作用和空气成分在水中的溶解等因素,纯水在真空中和在空气中的密度值有差别。
二、仪器
乙醇(95%):供干燥仪器用
具塞锥形瓶(50ml):洗净晾干
温度计:最小分度值0.1oC
分析天平:200g或100g/0.0001g,电子天平:200g/0.001g
三、实验过程:
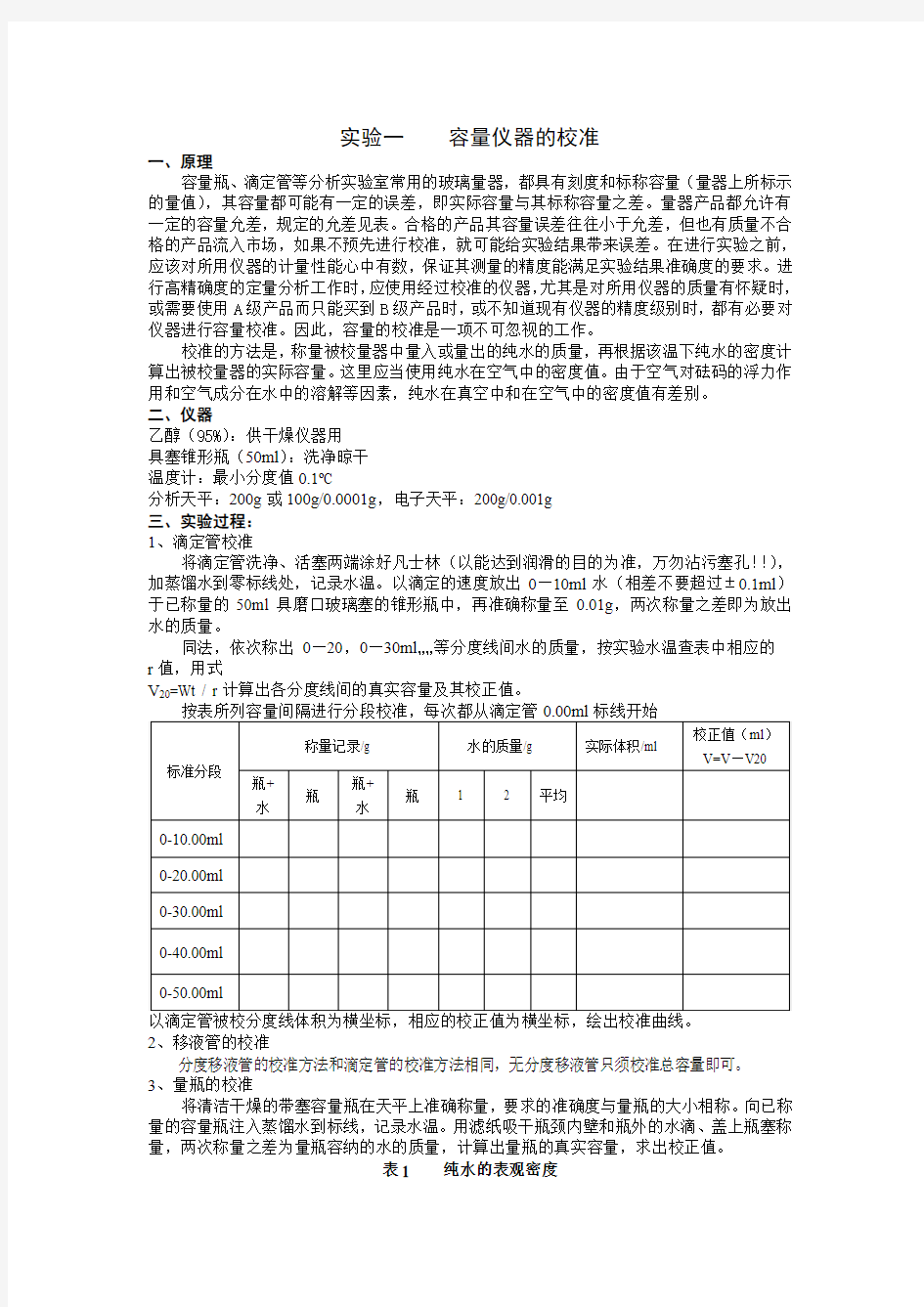
1、滴定管校准
将滴定管洗净、活塞两端涂好凡士林(以能达到润滑的目的为准,万勿沾污塞孔!!),加蒸馏水到零标线处,记录水温。以滴定的速度放出0—10ml水(相差不要超过±0.1ml)于已称量的50ml具磨口玻璃塞的锥形瓶中,再准确称量至0.01g,两次称量之差即为放出水的质量。
同法,依次称出0—20,0—30ml……等分度线间水的质量,按实验水温查表中相应的r值,用式
V20=Wt / r计算出各分度线间的真实容量及其校正值。
2、移液管的校准
分度移液管的校准方法和滴定管的校准方法相同,无分度移液管只须校准总容量即可。3、量瓶的校准
将清洁干燥的带塞容量瓶在天平上准确称量,要求的准确度与量瓶的大小相称。向已称量的容量瓶注入蒸馏水到标线,记录水温。用滤纸吸干瓶颈内壁和瓶外的水滴、盖上瓶塞称量,两次称量之差为量瓶容纳的水的质量,计算出量瓶的真实容量,求出校正值。
表1 纯水的表观密度
四、思考题
1.容量仪器为什么要校准?
2.称量纯水所用的具塞锥形瓶,为什么要避免将磨口部分和瓶塞沾湿?
3.本实验称量时只要求称准到mg位?
4.分段较准滴定管时为何每次都要从0.00ml开始?
实验二水的总硬度的测定
一、实验目的
了解测定水总硬度的意义及测定方法的原理,掌握测定水总硬度的方法
二、概述
总硬度是指水中钙镁离子的总浓度,硬度对工业用水关系很大,尤其是锅炉用水。各种
工业对水的硬度都有一定的要求。饮用水中硬度过高会影响肠胃的消化功能,我国生活饮用
水卫生标准中规定总硬度(以CaCO3计)不得超过450mg/l。
三、原理
在PH10的条件下,用EDTA溶液络合滴定钙和镁离子。铬黑T作指示剂,与钙和镁生成紫红或紫色溶液。滴定中,游离的钙和镁首先与EDTA反应,跟指示剂络合的钙和镁离子随后与EDTA 反应,到达终点时溶液的颜色由紫变为天蓝色。
四、仪器与试剂
50ml滴定管
试剂:
乙二胺四乙酸二钠(简写为Na2H2Y?2H2O或EDTA)。
CaCO3:基准试剂或优级纯试剂,在110℃干燥2h。
HCl溶液(1+1)
铬黑T指示剂:1g铬黑T与100g NaCl混合,研细,存放于干燥器中。
氨性缓冲溶液(PH10):将67gNH4Cl溶于300ml二次水中,加入570ml氨水,稀释至1L,混匀。
EDTA-Mg:将2.44gMgCl2?6H2O及4.44gNa2H2Y?2H2O溶于200ml水中,加入20ml氨性缓冲溶液及适量铬黑T,应
显紫红色。如呈蓝色,应加少量MgCl2?6H2O至紫红色,再滴加0.02mol/LEDTA溶液至刚刚变为蓝色,然后用
二次水稀释至1L。
三乙醇胺(HOCH2CH2)3N(1+4)
五、实验过程
(1)0.02mol/L EDTA溶液:称取7.5gNa2H2Y?2H2O置于烧杯中,加500ml水,微热并搅
拌使其完全溶解,冷却后转入细口瓶中,稀释至1L,摇匀。
(2)0.02mol/L钙标准溶液:准确称取约0.5g CaCO3,置于100ml烧杯中,加几滴水湿润,盖上表皿,缓慢滴加HCl至CaCO3完全溶解,加20ml水,小火煮沸2min,冷却后定量
转移到250ml容量瓶中,加水稀释至刻线,摇匀。
(3)标定EDTA溶液:移取25.00ml钙标准溶液于锥形瓶中,加50ml水及3ml Mg-EDTA
溶液,预加15.00mlEDTA标准溶液,再加5ml氨性缓冲溶液及适量铬黑T指示剂,立即用EDTA标准溶液滴定至由紫红色变为纯蓝色为终点。平行滴定三次,其体积极差应小于
0.05ml,以其平均体积计算EDTA标准溶液的浓度。
(4)自来水总硬度的测定:用100ml移液管量取自来水于锥形瓶中,加5ml氨性缓冲
溶液及少量铬黑T,立即用EDTA标准溶液滴定。要用力摇动,近终点时要慢滴多摇,颜色
由紫红色变为纯蓝色时为终点。平行滴定三份。所耗EDTA标准溶液体积全距应不大于0.1ml。
六、数据处理
测定数据记录(设计表格)
计算水的总硬度,以CaCO3mg/L表示。
七、思考题
1.哪些水样(如地表水,地下水,工业废水,海水等)的硬度大?
2.在pH10以铬黑T为指示剂,为什么滴定的是钙镁合量?
3.用钙标准溶液标定EDTA及测定水样硬度时为何要加入缓冲溶液后立即滴定?量取3份水样时若在滴定前同时加入氨性缓冲溶液好不好?为什么用钙标定EDTA时为什么在加入氨性缓冲溶液前先加入一部分EDTA标准溶液?
实验三水中化学需氧量的测定
(高锰酸盐指数)
一、概述
高锰酸盐指数,是指在一定条件下,以高锰酸钾为氧化剂,处理水样时所消耗的量,以氧的mg/L来表示。水中的还原性物质,如亚硝酸盐,亚铁盐、硫化物等无机物同有机物一起均消耗高锰酸钾。所以高锰酸盐指数是被作为水体受还原性(有机和无机)物质污染程度的综合指标。
二、原理:
样品中加入已知量的高锰酸钾和硫酸,在沸水浴中加热30min,高锰酸钾将样品中的某此有机物和无机还原物质氧化,反应后加入过量的草酸钠还原剩余的高锰酸钾,再用高锰酸钾标准溶液回滴过量的草酸钠。通过计算得到样品中高锰酸盐指数。
三、仪器与试剂
(1)沸水浴装置
(2)250ml锥形瓶
(3)25ml酸式滴定管
(4)10ml,100.0ml移液管
试剂:
(1)高锰酸钾标准贮备溶液(1/5KMnO4=0.1mol/l):称取3.2g高锰酸钾溶于1.2L水中,加热煮沸,使体积减少到约1L,放置过夜,用G-3玻璃砂芯漏斗过滤后,滤液贮于棕色瓶中保存。
(2)高锰酸钾标准溶液(1/5KMnO4=0.01mol/l):吸取100ml上述0.1mol/L高锰酸钾溶液,于1000ml溶量瓶,用水稀释混匀,贮于棕色瓶中。使用当天应进行标定,并调节至0.01mol/l准确浓度。
(3)1+3硫酸溶液。
(4)草酸钠标准贮备液(l/2Na2C2O4=0.1000mol/l):称取0.6705g在105℃—110℃烘干1h 并冷却的草酸钠溶于水,移入100ml容量瓶中,用水稀释至标线。
(5)草酸钠标准溶液(l/2Na2C2O4=0.0100mol/l):吸取10.00ml上述草酸钠标准溶液,移入100ml容量瓶中,用水稀释至标线。
四、实验步骤:
(l)分取100.0ml水样250ml锥形瓶中。
(2)加入5ml(l+3)硫酸、混匀。
(3)加入10.00ml,0.01mol/l高锰酸钾溶液,摇匀,立即放入沸水浴中加热30min(从水浴重新沸腾起计时)。沸水浴液面要高于反应溶液的液面。
(4)取下锥形瓶,趁热加入10.00ml,0.0100mol/L草酸钠标准溶液,摇匀。立即用0.01mol/L 高锰酸钾溶液滴定至显微红色,记录高锰酸钾溶液消耗量。
(5)高锰酸钾溶液浓度的标定:将上述已滴定完毕的溶液加热至70℃,准确加入10.00ml 草酸钠标准溶液(0.0100mol/L),再用0.01mol/L高锰酸钾溶液滴定到显微红色。记录高锰酸钾溶液的消耗量。按下式求得高锰酸钾的校正系数(K)。
五、数据处理:
计算:
1、
V k 00.10=
式中:V —高锰酸钾溶液消耗量(ml )
2、高锰酸盐指数(O 2,mg/L )= 式中:V 1—滴定水样时,消耗高锰酸钾的量(ml );
K —校正系数(每毫升高锰酸钾标液相当于草酸钠标液的毫升数) M —高锰酸钾溶液浓度(mol/L )
8—氧(1/2氧)的摩尔质量(g/mol )
实验四 水中六价铬的测定
一、实验目的
掌握比色分析方法,标准曲线的制作,显色及分光光度计的使用。 二、概述
铬是变价金属,通常认为六价铬的毒性比三价铬大100倍,长期经消化道摄入大量铬,可在体内蓄积,铬是以六价铬的形式进入细胞,然后在细胞内还原为三价铬,构成“终致癌物”,通过胎盘对胎儿生长起抑制作用和致畸作用。对皮肤及结膜有局部作用,可引起皮炎、鼻中膈穿孔、呼吸系统溃疡、脑膜炎和肺癌等。 三、原理
在酸性溶液中,六价铬离子与二苯碳酰二肼(DPC )反应,生成紫红色化合物,于波长
540nm 进行比色测定,其反应式为:
如果测定总铬,需先用高锰酸钾将水样中的三价铬氧化为六价,再用本法测定。
四、仪器与试剂: 仪器:
1、分光光度计,10mm 、30mm 比色皿。
2、50ml 具塞比色管,移液管,容量瓶等。 试剂:
1、铬标准贮备液:
称取于120℃干燥2h 的重铬酸钾(K 2Cr 2O 7优级纯)0.2829g ,用水溶解后,移入1000ml 容量瓶中,用水稀释至标线,摇匀。每毫升溶液含0.100mg 六价铬。 2、铬标准使用液:
吸取5.00ml 铬标准贮备液于500ml 容量瓶中,用水稀释至标线,摇匀。每毫升标准含1.00μg 六价铬。使用时当天配制。 3、二苯碳酰二肼溶液:
称取二苯碳酰二肼(简称DPC ,C 13H 14N 4O )0.2g ,溶于50ml 丙酮中,加水稀释到100ml ,摇匀,贮于棕色瓶内置于冰箱中保存。颜色变深后,不能再用。 4、(1+1)硫酸。 5、(1+1)磷酸。 6、丙酮。
7、0.2%(m/v )氢氧化钠溶液。 8、氢氧化锌共沉淀剂:称取硫酸锌(ZnSO 4.7H 2O )8g ,溶于100mL 水中,称取氢氧化钠2.4g ,溶于120ml 水中。将以上两溶液混合。 9、4%(m/v )高锰酸钾溶液。 10、20%(m/v )尿素溶液。
()[]1001000810101???-+M K V C O =565
6H C NH NH H C NH NH ----C O C r =→++65
65
6H C N N H C NH NH -=--紫红色络合物
→++3r C
11、2%(m/v )亚硝酸钠溶液。 五、实验步骤: 1、水样的预处理
(1)对不含悬浮物低色度的清洁地面水,可直接进行测定。
(2)如果水样有色但不深,可进行色度校正。即另取一份试样,加入除显色剂以外的各种试剂,以
2ml 丙酮代替显色剂,用此溶液为测定试样溶液吸光度的参比溶液。
(3)对浑浊、色度较深的水样,应加入氢氧化锌共沉淀剂并进行过滤处理。
(4)水样中存在次氯酸盐等氧化性物质时,干扰测定,可加入尿素和亚硝酸钠消除。
(5)水样中存在低价铁、亚硫酸盐、硫化物等还原性物质时,可将Cr 6+还原为Cr 3+
,此时,调节水样PH 值至8,加入显色剂溶液,放置5min 后再酸化显色,并以同法作标准曲线。 2、标准曲线的绘制:
取8支50ml 比色管,依次加入0,0.20,0.50,2.00,4.00,6.00,8.00和10.00ml 铬标准使用液,用水稀释至标线,加入1+1硫酸0.5ml 和1+1磷酸0.5ml ,摇匀。加入2ml 显色剂溶液,摇匀。5—10min 后,于540nm 波长处,用1cm 或3cm 比色皿,以水为参比,测定吸光度并作空白校正。以吸光度为纵坐标,相应六价铬含量为横坐标,绘出标准曲线。 3、水样的测定:取无色透明水样或经预处理的水样于50ml 比色管中,其它操作步骤同上。 六、数据处理:
计算标准曲线回归方程:a bx y +=,要求r=0.999
计算六价铬的含量
式中:m —由标准曲线查得的六价铬量(μg ) v —水样的体积(ml ) 七、问答题
1.分光光度法测定水中六价铬和中和总铬的原理是什么? 2.用分光光度法测定六价铬时,加入磷酸的主要作用是什么?
3.测定六价铬或总铬的器皿能否用重铬酸钾溶液洗涤?为什么?应使用什么洗涤剂洗涤为易?
4.测定总铬时,加入高锰酸钾的作用是什么?加入亚硝酸钠和尿素是为什么?
实验五 大气中总悬浮颗粒物的测定
一、实验目的
学习和掌握质量法测定大气中总悬浮颗粒物的方法。掌握大流量中流量采样器基本技术及采样方法。 二、原理:
通过具有一定切割特性的采样器以恒速抽取定量体积的空气,使之通过已恒重的滤膜,则大气中粒径小于100μm 的悬浮微粒被阻后留在滤膜上,根据采样前后滤膜重量之差及采样体积,即可计算总悬浮颗粒物的浓度。
用质量法测定大气中总悬浮颗粒物的方法,一般分为大流量(1.1~1.7m 3
/min )、中流
量(0.05~0.15m 3/min )及小流量(0.01~0.05m 3
/min )采样法。大流量采样法多用于户外,中、小流量采样法多用于室内。 三、仪器:
(1)大流量或中流量采样器:流量1.1~1.7m3/min ,50—150L/min 。 (2)滤膜:超细玻璃纤维滤膜、直径20cm ×25cm 或8—10cm 。 (3)气压计。 (4)温度计。
(5)大盘分析天平:(感量0.1mg )。
(6)流量校准装置:量程0.7~1.4m 3
/min ,量程70~160L/min 经过罗茨流量计校准的孔口校准器。或1342型便携式电子流量计
()V
m L mg C r =
+/6
(7)恒温恒湿箱 四、实验步骤:
1、采样器的流量校准:采样器每月用孔口校准器进行流量校准。
2、采样
(1)每张滤膜使用前均需用光照检查,不得使用有针孔或有任何缺陷的滤膜采样; (2)迅速称重在平衡室内已平衡24h 的滤膜,读数准确至0.1mg ,记下滤膜的编号和重量,将其平展地放在光滑洁净的纸袋内,然后贮存于盒内备用。天平放置在平衡室内,平衡室温度在20—25℃之间,温度变化小于±3℃,相对湿度小于50%,湿度变化小于5%。
(3)将已恒重的滤膜用小镊子取出,“毛”面向上,平放在采样夹的网托上,拧紧采样夹,按照规定的流量采样。
(4)采样5min 后和采样结束前5min 各记录一次U 形压力计压差值,读数准至1mm 。若有流量记录器,则直接记录流量。测定日平均浓度时,一般从8:00开始采样至第二天8:00结束。
(5)采样后,用镊子小心取下滤膜,使采样“毛”面朝内,以采样有效面积的长边为中线对叠好,放回表面光滑的纸袋并贮于盒内。将有关参数及现场温度、大气压力等记录填写在表1中。
表1 总悬浮颗粒物采样记录
中。
表2 总悬浮颗粒物浓度测定记录
总悬浮颗粒物 式中:W1—采样后滤膜质量g ;
W0—采样前滤膜质量g ; t —累积采样时间(min );
K —常数(大流量1×106,中流量1×109
)
QN —标准状态下的采样流量(m 3
/min ), 按下式计算:
式中:Q 2—现场采样流量(m 3
/min );
P 2—采样器现场校准时大气压力(KPa ); P 3—采样时大气压力(KPa );
T 2—采样器现场校准时空气温度(K ); T 3—采样时的空气温度(K )。
若T 3、P 3与采样器校准时的T 2、P 2相近,可用T 2、P 2代之。
()
t
Q W W K m g TSP N ?-=01)/,(3μ3
232232322333223269.23..1012733.101273T T P P Q T T P P Q T P P T P T Q Q n ???=???=?????=
实验六大气中可吸入颗粒物浓度的测定
(大流量采样法)
1.原理、
使一定体积的空气,通过带有10μm切割器的大流量采样器,小于10μm的可吸入颗粒物随气流经分离器的出口被截留在已恒重的滤膜上,根据采样前后滤膜的质量差及采样体积,即可计算出可吸入颗粒物浓度,用mg/Nm3表示。
2.仪器
PM10采样器:具有10μm切割器的大流量采样器。
收集效率为50%时的粒子空气动力学直径D50=(10±1)μm。切割曲线的几何标准差δg≤(1.5±0.1),在有风的条件下(风速小于8m/s)切割入口应具有各向同性效应。
所用切割器必须经国家环境保护总局主管部门校验标定。
以下各项均与TSP相同。
3.注意事项
采样器在采样过程中必须准确保持恒定的流量,因采样器的D50=10μm,δg=1.5±0.1是在一定的流量下获得的。
定期清扫切割器内大于10μm的颗粒物,保持切割器入口距离,以防止大颗粒的干扰。
实验七大气中氮氧化物的测定
实验目的
掌握盐酸萘乙二胺分光光度法测定大气中氮氧化物浓度的分析原理和操作技术。
一、概述
大气中氮氧化物主要包括一氧化氮和二氧化氮,其中绝大部分来自于化石燃料的燃烧过程,包括汽车
及一切内燃机所排放的尾气,也有一部分来自与生产和使用硝酸的化工厂、钢铁厂、金属冶炼厂等排放的废气中。动物实验证明,氮氧化物对呼吸道和呼吸器官有刺激作用,是导致目前支气管哮喘等呼吸道疾病不断增加的原因之一,二氧化氮与二氧化硫和浮游颗粒物共存时,其对人体的影响不仅比单独二氧化氮对人体的影响严重的多,而且也大于各自污染物之和。对人体的实际影响是各污染物之间的协同作用。因此大气氮氧化物的监测分析是环境保护部门日常工作的重要项目之一。
二、原理
大气中的氮氧化物主要是一氧化氮和二氧化氮。先用三氧化铬氧化管将一氧化氮氧化成二氧化氮,二氧化氮被吸收液吸收后,生成亚硝酸和硝酸,其中亚硝酸与对氨基苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,据其颜色的深浅,在540nm 处进行分光光度法测定。
三、仪器与试剂
1.多孔玻板吸收管(棕色)。
2.双球玻璃管(内装三氧化铬—石英砂)。
3.空气采样器。
4.分光光度计。
5.比色管10ml。
试剂:
所有试剂均在配制时均需用不含亚硝酸盐的重蒸水或电导水配制。检验方法吸收液的吸光度不超过0.005
1.吸收液原液:称取5.0g对氨基苯磺酸于200ml烧杯中,将50ml冰乙酸和900ml水的混合液,分数次加入烧杯中,搅拌,溶解,并迅速转入1000ml容量瓶中,待对氨基苯磺酸完全溶解后,加入0.050g盐酸萘乙二胺,溶解后,用水稀释到刻度。此为吸收原液,贮于棕色瓶中,低温避光保存。
采样液由4份吸收原液和1份水混合配制。
2.三氧化铬—石英砂氧化管:筛取20—40目约20g石英砂,用(1+2)盐酸浸泡一夜,
用水洗至中性,烘干。把三氧化铬及石英砂按重量比(1+40)混合,加少量调匀,放在红外线灯下或烘箱里于105℃烘干,烘干过程中应搅拌几次。制好的三氧化铬—石英砂应是松散的,若粘在一起,可适当增加一些石英砂重新制备。
将此砂装入双球氧化管中(约8克),两端用少量脱脂棉塞好,放在干燥器中保存,使用时氧化管与吸收管之间用一小段乳胶管联结。采集的气体尽量少与乳胶管接触,以防氮氧化物被吸附。
3.亚硝酸钠标准贮备液,准确称量0.1500g粒状亚硝酸钠(预先在干燥器内放置24小时),溶于水,移入1000ml容量瓶中,用水稀释至刻度,此溶液每毫升含100.0μgNO2—,贮于棕色瓶中存于冰箱,可稳定三个月。
4.亚硝酸钠标准使用液:吸取上述贮备液5.00ml于100ml容量瓶中,用水稀释至标线,此溶液每毫升含5.0μg NO2—。
四、实验过程
测定吸光度。
用最小二乘法计算标准曲线的回归方程
a
bx
y+
=
式中:Y—标准溶液吸光度(A)与试剂空白吸光度(A0)之差(A-A0)。
X—NO2—含量,(μg)
b、a—回归方程式的斜率和截距。斜率的倒数为样品测定的校正因子Bs,应为5.25±0.25ugNO2/吸光度·5ml。
要求:r=0.999标准曲线的斜率在0.190±0.009A/ugNO2/5ml范围内,截距a应小于0.008,其变动范围应小于0.005。
2.采样:用一支内装5.00ml采样液的多孔玻板吸收管,进气口接氧化管,并使管口略微向下倾斜,以免当潮湿空气将氧化剂弄湿,而污染吸收液.将吸收管的出气口与大气采样器相连接。以0.3L/min的流量抽取空气30-40分钟,若氮氧化物含量很低,可增加采样量,避光采样至吸收液呈微红色为止,记录采样时间和地点,密封好采样管,带回实验室当日测定。若吸收液不变色,应延长采样时间采量应不少于6L。应测定采样现场的温度和大气压力并作好记录。
3.样品测定:采样后,放置15min,将样品溶液直接移入1cm比色皿中,按绘制标准曲线的方法和条件测定试剂空白溶液和样品溶液的收光度。
五、计算与数据处理
1.氮氧化物的含量以NO2计(mg/m3)
()
76
.0
2
?
-
-
=
bVn
a
A
A
C NO
式中:A—样品溶液吸光度;
A0—试剂空白溶液吸光度
b—回归方程式的斜率
a—回归方程式的截距
V n—换算为标准状态下的采样体积(L)
0.76—NO2(气)转换为NO2—(液)的转换系数
六、注意事项:
1、吸收液应避光,且不能常时间暴露在空气中,以防止光照使吸收液显色或吸收空气中的氮氧化物而使试剂空白值增加。
2、氧化管适于在相对湿度为30—70%时使用,当空气相对湿度大于70%时应勤换氧化管,小于30%时,则在使用前,用经过水面的潮湿空气通过氧化管,平衡1h。在使用过程中,应经常注意氧化管是否吸湿引起板结,或者变成绿色。若板结会使采样流阻力增大,影响流量,若变成绿色,表示氧化管已失效。
3、亚硝酸钠(固体)应密封保存,防止空气及湿气侵入。部分氧化成硝酸钠或呈粉末状的试剂都不能用直接法配置标准溶液,若无颗粒状亚硝酸钠试剂,可用高锰酸钾容量法标定出亚硝酸钠贮备溶液的准确浓度后,再稀释为含5.0ugml亚硝酸根的标准溶液。
4、溶液呈黄棕色,表明吸收液已受三氧化铬污染,该样品应报废。
5、绘制标准曲线:向各管中加亚硝酸钠标准使用溶液时,都应用均匀,缓慢的速度加入,曲线的线性较好。
七、问题讨论:
1、氮氧化物对人体有哪些危害作用?
2、氮氧化物与光化学烟雾有什关系?
3、产生光化学烟雾需要哪些条件?
4、通过实验测定结果,你认为大气中氮氧化物的污染状况如何?
实验八环境空气二氧化硫的测定
(甲醛吸收—副玫瑰苯胺分光光度法)
实验目的
掌握甲醛缓冲溶液吸收,盐酸副玫瑰苯胺分光光度法测定大气中二氧化硫浓度的分析原理和操作技术。
一、概述
SO2是主要大气污染物之一,为大气环境污染例行监测的必测项目。它来源于煤和石油等燃料的燃烧,含硫矿石的冶炼硫酸等化工产口生产排放的废气。SO2是一种无色、易溶于水、有刺激性气味的气体,能通过呼吸进入气管,对局部组织产生刺激和腐蚀作用,是诱发支气管炎等疾病的原因之一,特别是当其它烟尘等气溶胶共存时,可加重对呼吸道粘膜的损害。
二、原理:
SO2被甲醛缓冲溶液吸收后,生成稳定的羟甲基磺酸加成化合物,在样品溶液中加入氢氧化钠,使加成化合物分解,释放出SO2与副玫瑰苯胺、甲醛作用,生成紫红色化合物,用分光光度计在577nm处进行测定。
三、仪器与试剂
多孔玻板吸收管:10ml(用于短时间采样)。多孔玻板吸收瓶:50ml(用于24h时间采样)。
空气采样器:短时间采样的采样器,流量范围0—1L/min,或24h连续采样的采样器应具有恒温、恒流、计时、自动控制仪器开关的功能,流量范围0.2~0.3L/min。
分光光度计(可见光波长380—780nm)
具塞比色管:10ml。
恒温水浴器:广口冷藏瓶内放置圆形比色管架,插一支长约150mm,0~40℃温度计,其误差范围不大于0.5℃。
试剂:
蒸馏水25℃电导率小于1.0μΩ.cm,PH值6.0~7.2
1、氢氧化钠溶液,C(NaOH)=1.5mol/L
称取氢氧化钠6g溶于水中,稀释至100ml。
2、0.05mol/L环己二胺四乙酸二钠CDTA-2Na:
称取1.82g反式1,2-环己二胺四乙酸CDTA溶解于6.5ml,氢氧化钠溶液(1.5mol/l),用水稀释至100ml。
3、甲醛缓冲吸收液贮备液:
吸取36%—38%的甲醛溶液5.5ml,CDTA-2Na溶液20.00ml,称取2.04g邻苯二甲酸氢钾,溶于少量水中,将上述三种溶液合并,用水稀释至100ml,贮于冰箱,可保存一年。
4、甲醛缓冲吸收液:
用水将甲醛缓冲吸收液贮备液稀释100倍。此溶液每毫升含0.2mg 甲醛。 5、0.06%氨磺酸钠溶液:
称取0.60g 氨磺酸(H 2NSO 3H )置于100ml 容量瓶中,加入氢氧化钠溶液4.0ml ,用水稀释至标线,摇匀。此溶液密封保存可用10天。 6、碘贮备液,C=(1/2I 2)=0.1mol/l
称取12.7g 碘(I 2)于烧杯中,加入40g 碘化钾和25ml 水,搅拌至完全溶解,用水稀释至1000ml ,贮存于棕色细口瓶中。 7、碘溶液,C (1/2I 2)=0.05mol/l
量取碘贮备液250ml ,用水稀释500ml ,贮于棕色细口瓶中。 8、0.5%淀粉溶液:
称取0.5g 可溶性淀粉,用少量水调成糊状(可加0.2g 二氯化锌防腐),慢慢倒入100ml 沸水中,继续煮沸至溶液澄清,冷却后贮于试剂瓶中。临用现配。 9、碘酸钾标准溶液,C (1/6KIO 3)=0.1000mol/l : 称取3.5667g 碘酸钾(KIO 3优级纯,经110 ℃干燥2h )溶于水,移入1000ml 容量瓶中,用水稀释至标线,摇匀。 10、(1+9)盐酸溶液:
量取10ml 浓盐酸溶于90ml 水中。
11、硫代硫酸钠贮备液C (Na 2S 2O 3)=0.10mol/l 。 称取25.0g 硫代硫酸钠,溶于1000ml 新煮沸但已冷却的水中,加入0.20g 无水碳酸钠,贮于棕色细口瓶中,放置一周后备用。如Na 2S 2O 3.5H 2溶液呈现浑浊,必须过滤。 12、硫代硫酸钠标准溶液,C (Na 2S 2O 3)=0.05mol/l 。 取250.0ml 硫代硫酸钠贮备液置于500ml 容量瓶中,用新煮沸但已冷却的水稀释至标线,摇匀,贮于棕色细口瓶中。 标定方法:
吸取三份10.00ml 碘酸钾标准溶液,分别置于250ml 碘量瓶中,加70ml 新煮沸但已冷却的水,加1.0g 碘化钾,振摇至完全溶解后,加10ml (1+9)盐酸溶液,立即盖好瓶塞,摇匀,于暗处放置5min 后,用硫代硫酸钠标准溶液滴定溶液至浅黄色,加2ml 淀粉溶液,继续滴定溶液至蓝色刚好褪去为终点。硫代硫酸钠标准溶液的浓度按下式计算: 式中 O S Na C 22—硫代硫酸钠标准溶液的浓度,mol/L ;
V —滴定所耗硫代硫酸钠标准溶液的体积,mL 。 13、0.05%乙二胺四乙酸二钠盐(EDTA )溶液:
称取0.25gEDTA-2Na 溶于500ml 新煮沸但已冷却的水中,临用现配。 14、二氧化硫标准溶液
称取0.200g 亚硫酸钠(Na 2SO 4),溶于200ml 浓度为0.05%EDTA —2Na 溶液(用新煮沸并冷却的水配制),放置2—3h 后标定。此溶液每毫升相当于320—400ug 二氧化硫。
标定方法:吸取三份20.00ml 二氧化硫标准溶液,分别置于250ml 碘量瓶中,加入50ml 新煮沸但已冷却的水,0.05mol/L 碘溶液20.00ml 及1.0ml 冰乙酸,盖塞,摇匀。于暗处放置5min 后,用0.05mol/L 硫代硫酸钠标准溶液滴定溶液至浅黄色,加入2ml 淀粉溶液,继续滴定至溶液兰色刚好褪去为终点。记录体积消耗量V 。
另吸取配制亚硫酸钠溶液所用的0.05%EDTA —2Na 溶液20ml 三份,用同法进行空白实验。记录滴定硫代硫酸钠标准溶液的体积V ,ml 。
平行样滴定所耗硫代硫酸钠标准溶液体积之差应不大于0.04ml 。取其平均值。 二氧化硫标准溶液浓度按下式计算:
式中: C —二氧化硫标准溶液的浓度,μg/ml ;
V C O S Na 00
.101000.0322?=()()1000
00
.2002.3232202???-=O S Na SO C V V C
V0 —空白滴定所耗硫代硫酸钠标准溶液的体积,ml;
V—二氧化硫标准溶液滴定所耗硫代硫酸钠标准溶液的体积,ml;
C(Na2S2O3)—硫代硫酸钠标准溶液(3.12)的浓度,mol/l;
32.02—与1mol/L硫代硫酸钠标准溶液(Na2S2O3)相当的二氧化硫的质量,g。
15、二氧化硫标准储备液:
待标定出亚硫酸钠溶液中二氧化硫准确浓度后,立即用吸收液将亚硫酸钠溶液稀释成每毫升含10.00ug二氧化硫的标准溶液贮备液(贮存于冰箱,可保存三个月)。
16、二氧化硫标准使用溶液:
临用时,再用吸收液稀释为每毫升含1.00ug二氧化硫的标准溶液。在冰箱中5℃保存。
17、0.20g/100ml盐酸副玫瑰苯胺(prarosaniline,简称PRA,)贮备液。
取正丁醇和1.0mol/L盐酸溶液各500ml,放入1000ml分液漏斗中,盖塞,振荡3 min,使其互溶达到平衡,静置15min待完全分层后,将下层水相和上层有机相分别移入细口瓶中备用。称取0.100g盐酸副玫瑰苯胺(C19H18N3Cl·3HCl)放入小烧杯中,加平衡过的1.0mol/L 盐酸40ml,用玻棒搅拌至完全溶解后,移入250ml分液漏斗中,再用80ml平衡过的正丁醇洗涤小烧杯数次,洗涤液并入同一分液漏斗中,盖塞,振荡3min,静置15min,待完全分层后,将下层水相移入另一250ml分液漏斗中,再加80ml平衡过的正丁醇,依上法反复提取8~10次后,将水相滤入50ml容量瓶中,用1.0mol/L盐酸溶液稀释至标线,摇匀此贮备液为橙黄色。
18 、0.05g/100ml 盐酸副玫瑰苯胺使用液:
吸取经提纯的PRA贮备液25.00ml移入100ml容量瓶中,加30ml 85%的浓磷酸,12ml 浓盐酸,用水稀释至标线,摇匀,放置过夜后使用。避光密封保存,可使用9个月。
四、实验步骤
1、标准曲线的绘制:取14支10ml具塞比色管,分A、B两组,每组7支,分别对应编号。A组按表1配制标准溶液系列:
0.5ml1.5mol/L氢氧化钠溶液,混匀,再逐管迅速将溶液全部倒入对应编号并盛有PRA溶液的B管中,立即具塞混匀后放入恒温水浴中显色,显色温度与室温之差应不超过3℃,根据不同季节和环境条件按表2选择显色温度与显色时间。
用最小二乘法计算标准曲线的回归方程式:
y+
=
a
bx
式中:Y—(A-A0)校准溶液吸光度A与试剂空白吸光度A0之差,
X—二氧化硫含量,(μg)
b—回归方程的斜率(由斜率倒数求得校正因子:Bs=1/b);
a—回归方程的截距(一般要求小于0.005)
要求校准曲线斜率为0.044±0.002,试剂空白吸光度A 。在显色规定条件下波动范围不超过±15%。 2、采样
短时间采样:根据空气中二氧化硫浓度的高低,采用内装10.00ml 吸收液的多孔玻板吸收管,以0.5L/min 流量避光采样60分钟。采样时吸收液温度的最佳范围在23—29℃范围。
24h 采样:用内装50ml 吸收液的多孔玻板吸收瓶以0.2~0.3L/min 的流量采样。吸收液温度须保持在23℃~29℃。
3、样品测定:样品溶液中如有浑浊物,则应离心分离除去。采样后样品放置20min ,以使臭氧分解。
短时间样品:将吸收管中样品溶液全部移入10ml 比色管中,用甲醛吸收液稀释至标线,加0.5ml 氨磺酸钠溶液,混匀,放置10min 以除去氮氧化物的干扰,以下步骤同标准曲线的绘制。
24h 样品:将吸收瓶中样品全部移入50ml 容量瓶(或具塞比色管)中,用甲醛吸收液稀释至标线。吸取适量样品溶液(2~10ml 于10ml 比色管中,用吸收液稀释至标线,加0.5ml 氨基磺酸钠溶液,混匀,放置10min 以除去氮氧化物的干扰,以下步骤同标准曲线的绘制。如样品吸光度超过校准曲线上限,则可用试剂空白溶液稀释,在数分钟内再测量其吸光度,但稀释倍数不要大于6。 五、数据处理
计算:
式中:A —样品溶液的吸光度
A 0—试剂空白溶液的吸光度
Bs —校正因子1/b ,μgSO 2/ A. 12ml V t —样品溶液总体积,ml
V a —测定时所取样品溶液体积,ml
V s —标准状况下的采样体积L (0℃,101.325Kpa )。 六、注意事项:
(1) 因此在实验中要注意温度控制,一般需用恒温水浴法进行控制,因为温度对显色影
响较大,温度
越高时,空白值越大,温度高时显色快,退色亦快,另外,注意使水浴水面高度超过比色管中溶液的液面高度,否则会影响测定准确度。
(2)对品红的提纯很重要,因提纯后可降低试剂空白值和提高方法的灵敏度。提高酸度虽可降低空白值,但灵敏度也有下降。
(3)六价铬能使紫红色络合物退色,产生负干扰,所以应尽量避免用硫酸或铬酸洗液洗涤玻璃器皿,若已洗,则要用(1+1)盐酸浸泡1h ,用水充分洗涤,除去六价铬。
(4)此操作关键的一步是将含有标准溶液或样品溶液、吸收液、氨基磺酸钠及氢氧化钠溶液倒入对品红溶液时,一定要倒干净,为此在绘制标准曲线及进行测定时,应尽量选择台肩小的比色管,同时每倒3个溶液后,等3min ,再倒3个,依次进行,以确保每支比色管的显色时间皆为15min 。
(5)用过的比色管及比色皿及时用酸洗涤,否则红色难于洗净,比色管用(1+4)的盐酸及1/3体积的95%乙醇混合液洗涤。 七、问答题
1.实验过程中存在哪些干扰?应如何消除? 2.多孔玻板吸收管的作用是什么?
实验九 水中氟化物的测定 (氟离子选择电极法)
一、原理
将氟离子选择电极和外参比电极(如甘汞电极)浸入欲测含氟溶液,构成原电池。该原电池的电动势与氟离子活度的对数呈线性关系,故通过测量电极与已知F-浓度溶液组成的
()
()a t
n S V V V B A A m mg SO ?
?-=032/,
原电池电动势和电极与待测F-浓度溶液组成原电池的电动势,即可计算出待测水样中F-浓度。常用定量方法是标准曲线法和标准加入法。
对于污染严重的生活污水和工业废水,以及含氟硼酸盐的水样均要进行预蒸馏。
二、仪器
1.氟离子选择性电极。
2.饱和甘汞电极或银-氯化银电极。
3.离子活度计或PH计,精确到0.1mV。
4.磁力搅拌器、聚乙烯或四氟乙烯包裹的搅拌子。
5.聚乙烯杯:100mL,150mL。
6.其他常用的实验设备。
三、试剂
所用水为去离子水或无氟蒸馏水。
1.氟化物标准贮备液:
称取0.2210g基准氟化钠(NaF)(预先于105-110℃烘干2h,或者于500-650℃烘干约40min,冷却),用水溶解后转入1000mL容量瓶中,稀释至标线,摇匀。贮存在聚乙烯瓶中。此溶液每毫升含氟离子100μg。
2.氟化物标准溶液:用无分度吸管吸取氟化钠标准储备液10.00mL,注入100mL容量瓶中,稀释至标线,摇匀。此溶液每毫升含氟离子10μg。
3.乙酸钠溶液:称取15g乙酸钠(CH3COONa)溶于水,并稀释至100mL。
4.总离子强度调节缓冲溶液(TISAB):
0.2mol/L柠檬酸钠-1mol/L硝酸钠(TISABⅠ):称取58.8g二水合柠檬酸钠和85g硝酸钠,加水溶解,用盐酸调节PH至5-6,转入1000ml容量瓶中,稀释至标线,摇匀。
5.2mol/L盐酸溶液.
四、测定步骤
仪器准备和操作
按照所用测量仪器和电极使用说明,首先接好线路,将各开关置于“关”的位置,开启电源开关,预热15min,以后操作按说明书要求进行。测定前,试液应达到室温,并与标准溶液温度一致(温差不得超过±1℃)。
2、标准曲线绘制:
用无分度吸管取1.00、3.00、5.00、10.00、20.00mL氟化物标准使用液,分别置于5只50mL容量瓶中,加入10mL总离子强度调节缓冲溶液,用水稀释至标线,摇匀。分别移入100mL聚乙烯杯中,各放入一只塑料搅拌子,按浓度由低到高的顺序,依次插入电极,连续搅拌溶液,读取搅拌状态下的稳态电位值(E)。在每次测量之前,都要用水将电极冲洗净,并用滤纸吸去水分。在半对数坐标纸上绘制E-logC F-标准曲线,浓度标于对数分格上,最低浓度标于横坐标的起点线上。
3、水样测定:
用无分度吸液管吸取适量水样,置于50mL容量瓶中,用乙酸钠或盐酸溶液调节至近中性,加入10mL总离子强度调节缓冲溶液,用水稀释至标线,摇匀。将其移入100mL聚乙烯杯中,放入一只塑料搅拌子,插入电极,连续搅拌溶液,待电位稳定后,在继续搅拌下读取电位值(E X)。在每次测量之前,都要用水充分洗涤电极,并用滤纸吸取水分。根据测量得的毫伏数,由标准曲线上查得氟化物的含量。
4、空白试验:
用蒸馏水代替水样,按测定样品的条件和步骤进行测定。
当水样组成复杂或成分不明时,宜采用一次标准加入法,以便减小基本的影响。其操作是:先按步骤2测定出试液的电位值(E1),然后向试液中加入一定量(与试液中氟的含量相近)的氟化物标准液,在不断搅拌下读取稳态电位值(E2)。
五、计算
1.测定数据记录(设计表格)
2、标准曲线法:根据从标准曲线上查知稀释水样的浓度和稀释倍数即可计算水样中氟化物含量(mg/L)。
3、标准加入法:
式中:Cx ——水样中氟化物(F -
)浓度(mg/L );
Vx ——水样体积(m L);
Cs ——加入F-
标准溶液的浓度(mg/L ); Vs —为加入F-标准溶液的体积(ml ) △E ——等于E 1—E 2(对阴离子选择性电极),其中,E 1为测得水样试液的电位值(m V)E 2为试液中加入标准溶液后测得的电位值(m V)
S ——氟离子选择性电极实测斜率。如果V S 《V X ,则上式可简化为:
六、注意事项
1、电极用后应用水冲洗干净,并用滤纸吸去水分,放在空气中,或者放在稀的氟化物标准溶液中。如果短时间不再使用,应洗净,吸去水分,套上保护电极敏感部位的保护帽。电极使用前仍应洗净,并吸去水分。
2、如果试液中氟化物含量低,则应从测定值中扣除空白试验值。
3、不得用手指触摸电极的敏感膜,如果电极膜表面被有机物等玷污,必须先清洗干净后才能使用。
4、一次标准加入法所加入标准溶液的浓度(C S ),应比试液浓度(C X )高10—100倍,加入的体积为试液的1/10—1/100,以使体系的TISAB 浓度变化不大。 七、问答题
1.如入离子强度缓冲液起什么作用?
2.氟电极使用前后应如何处理? 参考记录表格如下
实验十 湖水中溶解氧含量的日变化 及不同水质中溶解氧含量的测定
一、概述
溶解于水的氧称为溶解氧。水中溶解氧的含量以每升水中含氧的毫克数表示,它与大气压、空气中氧的分压及水的温度都有密切关系。 地面水敞露于空气中,因而清洁的地面水中所含的溶解氧常接近饱和状态。当水中有大量藻类植物繁殖时,由于植物的光合作用放出氧,有时甚至可以含有过饱的溶解氧。如果水体被可氧化的有机物污染,消耗水中溶解氧。而水体又不能从空气中吸收充足的氧来补充氧的消耗时,溶解氧就不断减少,有时甚至接近零。在这种情况下,厌气细菌大量繁殖,致使有机物腐败,水体发臭。当水中溶解氧低于4ml/l 时,一般鱼类因窒息而死亡,所以水中溶解氧与水生动物也有着密切的关系。因此,溶解氧的测定对于了解水体的有机物污染状况和自净作用有极其重要的意义。 二、实验目的
110-????? ??+-+?=S X X
S E
X S S X V V V Vs V V C C 1
110-??
?
??-??=S E V V C C X S
X X
通过测定湖水中溶解氧在一天中不同时间的含量和湖水、污水及自来水中溶解氧的含量,了解影响水中溶解氧的含量的因素,掌握一种水质监测方法及使用溶氧仪的一般操作技术。
三、仪器与试剂
JPB—607型溶解氧分析仪
塑料桶2500ml、烧杯1000ml、400ml
温度计、乳胶管
四、实验过程
1、样品采集:
(1)、用塑料桶做成的简易采样器采集湖中表层水一桶。采集前先将水样充满桶,冲洗两次,采集时尽量减少空气进入,采好后立即盖好盖子,带回实验室测定。
(2)、分别在上午9、11点,下午1点、3点钟,以同样方式,在同一地点和同一深度采集测定湖水四次。
(3)、在下午3点采集湖水的同时,采集污水和自来水,并同时测定这三种不同质量的水中的溶解氧。
(4)、将采回水样倒入烧杯时,必须使用乳胶管,管的一端插入采样桶的水,另一端插入烧杯底部,利用虹吸法将水样导入烧杯。采集自来水时,先将乳胶管接到水龙头上,放水数分钟,再将乳胶管的另一端插至烧杯底部,收集水样。
2、仪器的调整和测量
(1)、将电极插头插入仪器的电极插口内,同时将仪器的电源开关拨至“测量”档,测量选择开关拨至溶氧档,盐度调节旋钮向左旋至底(0g/l)。
(2)、仪器预热5分钟,然后将电极放入5%新鲜配制的Na2SO3溶液(即无氧水)中5分钟,待读数稳定后,调节调零旋钮,使仪器显示为零。由于电极的残余电流极小,如果没有亚硫酸钠溶液,只要将仪器电源开关置于调零档,调节调零电位器,使仪器显示为零即可。(3)、把电极从溶液中取出,用水冲洗干净,用滤纸小心吸干薄膜表面水分,放入空气中待读数稳定后,调节跨度调节器,使读数指示值为纯水在此温度下饱和溶解氧值。各种温度下饱和溶解氧值见附录。
(4)、反复2---3操作。
(5)、将电极浸入被测溶液中,此时仪器的读数即为被测水样的溶解氧值。
(6)、含盐水溶液溶解氧的测量
如果被测水样含有一定盐度(如海水养殖场),测量时应进行盐度校准。
(7)、如需测量溶液的温度,只要将测量选择功能开关拨至测温档,仪器显示值即为该温度值。
五、数据处理
将上述测得的数据分别记录于下列表中:
附录氧在不同温度和氯化物浓度的水中饱和含量表(气压101.3Kpa)
简述测定溶解氧的水样采样过程? 简述膜电极法测定水中溶解氧的原理?
实验十一 水中氨氮的测定(纳氏试剂比色法)
实验目的:熟练掌握纳氏试剂比色法测定氨氮的原理和方法 一、原理
碘化汞和碘化钾的碱性溶液与氨反应生成淡红棕色胶态化合物,其色度与氨氮含量成正比,通常可在波长410—425nm 范围内测其吸光度,计算其含量。本法最低检出浓度为0.025mg/L (光度法),测定上限为2mg/L 。 [][]KI O H I NH O Hg NH KOH HgI K 7232222342++?=++
二、仪器
1.500mL ~1000ml 全玻璃磨蒸馏器 。 2.50mL 具塞比色管。 3.分光光度计。 4.pH 计。 三、试剂
配制试剂用水均应为无氨水。 1. 无氨水:可用一般纯水通过弱酸性阳离子树脂柱或每升水加入0.1ml 浓硫酸进行蒸
馏,馏出水接收于玻璃容器中。 2. 纳氏试剂:
可选择下列一种方法制备:(1)称取20g 碘化钾溶于约25ml 水中,边搅拌边分次少量加入二氯化汞(HgCl 2)结晶粉末(约10g ),至出现朱红色沉淀不易溶解时,改为滴加饱和二氯化汞溶液,并充分搅拌,当出现微量朱红色沉淀不再溶解时,停止滴加氯化汞溶液。 另称取60g 氢氧化钾溶于水,并稀释至250mL ,冷却至室温后,将上述溶液在边搅拌下,徐徐注入氢氧化钾溶液中,用水稀释至400mL ,混匀。静置过夜,将上清液移入聚乙烯瓶中,密塞保存。
(2)称取16g 氢氧化钠,溶于50mL 水中,充分冷却至室温。 另称取7g 碘化钾和10g 碘化汞(HgI 2)溶于水,然后将此溶液在搅拌下徐徐注入氢氧化钠溶液中。用水稀释至100mL ,贮于聚乙烯瓶中,密塞保存。 3.酒石酸钾钠溶液:
称取50g酒石酸钾钠(KNaC4H4O6·4H2O)溶于100mL水中,加热煮沸以除去氨,放冷,定容至100mL。
4.铵标准贮备溶液:
称取3.819g经100℃干燥过的优级纯氯化铵(NH4Cl)溶于水中,移入1000mL容量瓶中,稀释至标线。此溶液每毫升含1.00mg氨氮。
5.铵标准使用溶液:
移取5.00mL铵标准贮备液于500mL容量瓶中,用水稀释至标线。此溶液每毫升含0.010mg 氨氮。
四、测定步骤
1.水样预处理:无色澄清的水样可直接测定;色度、浑浊度较高和含干扰物质较多的水样,需经过蒸馏或混凝沉淀等预处理步骤。
水样蒸馏先在蒸馏瓶中加200ml无氨水,10ml磷酸盐缓冲液和数粒玻璃珠,加热至流出物中不含氨,冷却,然后将蒸馏液倾出(留下玻璃珠)。取水样200ml置于蒸馏瓶中加入10ml磷酸盐缓冲液,以一只盛有50ml吸收液的250ml锥形瓶收集馏出液,收集时应将冷凝管的导管末端浸入吸收液,其蒸馏速度为6~8ml/min,至少收集150ml馏出液。蒸馏结束前2~3min,应把锥形瓶放低,使吸收液面脱离冷凝管,并再蒸馏片刻以洗净冷凝管和导管,用无氨水稀释至250ml备用。
2.标准曲线的绘制:
吸取0、0.50、1.00、3.00、5.00、7.00和10.0mL铵标准使用液于50mL比色管中,加水至标线,加1.0mL酒石酸钾钠溶液,混匀。加1.5mL纳氏试剂,混匀。放置10min后,在波长420nm处,用光程20mm比色皿,以水为参比,测定吸光度。
由测得的吸光度,减去零浓度空白的吸光度后,得到校正吸光度,绘制以氨氮含量(mg)对校正吸光度的标准曲线。
3.水样的测定:
分取适量的水样(使氨氮含量不超过0.1mg),加入50mL比色管中,稀释至标线,加1.0mL 酒石酸钾钠溶液(经蒸馏预处理过的水样,水样及标准管中均不加此试剂),混匀,加1.5mL 的纳氏试剂,混匀,放置10min后,同标准曲线步骤测量吸光度。
4.空白试验:以无氨水代替水样,作全程序空白测定。
五、计算
由水样测得的吸光度减去空白实验的吸光度后,从标准曲线上查得氨氮含量(mg)。
氨氮(N,mg/L)=
1000
v
m
式中:m—由校准曲线查得氨氮含量(mg);
V—水样体积(mL)。
六、注意事项
1、纳氏试剂中碘化汞与碘化钾的比例,对显色反应的灵敏度有较大影响。静置后生成的沉淀应除去。
2、滤纸中常含痕量铵盐,使用时注意用无氨水洗涤。所用玻璃器皿应避免实验室空气中氨的沾污。
实验十二碘量法测定水中溶解氧
实验目的:
了解测定溶解氧(dissolved oxygen,DO)的意义和方法。掌握碘量法测定操作技术。
一、原理
水样中加入硫酸锰和碱性碘化钾,水中溶解氧将低价锰氧化成高价锰,生成四价锰的氢氧化物棕色沉淀。加酸后,氢氧化物沉淀溶解形成可溶性四价锰Mn(SO4)2,Mn(SO4)2与碘离子反应释放出与溶解氧量相当游离碘。以淀粉为指示剂,用硫代硫酸钠溶液滴定释放出的碘,可计算溶解氧的含量。
6
42322224242422222422422322)()(2)(2)(2O S Na NaI O S Na I O
H SO K MnSO I SO H KI OH MnO OH MnO O OH Mn SO Na OH Mn NaOH MnSO +=++++=++↓
=++↓=+
二、仪器
1.溶解氧瓶:250ml ~300ml
2.滴定管:25ml 、10ml 三、试剂
1.硫酸锰溶液:
称取480g 硫酸锰(MnSO 4·4H 2O )溶于水,用水稀释至1000mL 。此溶液加至酸化过的碘化钾溶液中,遇淀粉不得产生蓝色。 2.碱性碘化钾溶液:
称取500g 氢氧化钠溶解于300—400mL 水中;另称取150g 碘化钾溶于200mL 水中,待氢氧化钠溶液冷却后,将两溶液合并,混匀,用水稀释至1000mL 。如有沉淀,则放置过夜后,倾出上层清液,贮于棕色瓶中,用橡皮塞塞紧,避光保存。此溶液酸化后,遇淀粉应不呈蓝色。
3.1+5硫酸溶液:
将20ml 浓硫酸缓缓加入100ml 水中。 4.1%(m/V )淀粉溶液:
称取1g 可溶性淀粉,用少量水调成糊状,再用刚煮沸的水稀释至100mL 。冷却后,加入0.1g 水杨酸或0.4g 氯化锌防腐。
5.0.02500mol/L(c 1/6K2Cr2O7)重铬酸钾标准溶液:
称取于105—110℃烘干2h ,并冷却的重铬酸钾1.2258g ,溶于水,移入1000mL 容量瓶中,用水稀释至标线,摇匀。 6.硫代硫酸钠溶液:
称取6.2g 硫代硫酸钠(Na 2S 2O 3·5H 2O)溶于煮沸放冷的水中,加入0.2g 碳酸钠,用水稀释至1000mL ,贮于棕色瓶中,在暗处放置7~14d 后标定。
标定:于250ml 碘量瓶中,加入100ml 水和1g 碘化钾,加入10.00ml 浓度为0.02500mol/L 的重铬酸钾标准溶液,5ml 硫酸溶液(1+5),密塞,摇匀,此时反应为:
6
423222234224242722227)(3476O S Na NaI O S Na I O
H SO Cr I SO K SO H KI O Cr K +=++++=++
与暗处静置5min 后,用待标定的硫代硫酸钠溶液滴定至溶液呈淡黄色,加入1ml 淀粉指示剂,继续滴定至蓝色刚好褪去为止。记录用量V ,则硫代硫酸钠的浓度:
(
)V
C
O S Na 0250
.000.103222
1
?
=
7.硫酸(ρ=1.84g/cm 3
) 三、测定步骤 采样
应采用溶解氧瓶进行采样,采样时要十分小心,避免气,注意不使水样与空气相接触。 1.溶解氧的固定:用吸液管插入溶解氧瓶的液面下,加入1mL 硫酸锰溶液,2mL 碱性碘化钾溶液,盖好瓶塞,颠倒混合数次,静置。一般在取样现场固定。
2.析出碘:打开瓶塞,立即用吸管插入液面下加入2.0mL 浓硫酸。小心盖好瓶塞,颠倒混合摇匀,至沉淀物全部溶解为止,放于暗处静置5min 。
3.样品的测定:吸取100.0mL 上述溶液于250mL 锥形瓶中,用硫代硫酸钠标准溶液滴定至溶液呈淡黄色,加入1mL 淀粉溶液,继续滴定至蓝色刚好退去为止,记录硫代硫酸钠溶液用量。 四、计算
1001000
82??=
CV C O
分数 环境监测实验报告 姓名:陈志杰 班级:10级环工一班 院系:水建院 任课教师:杜丹 2012年12 月16 日
内蒙古农业大学西区宿舍楼生活饮用水水质检测分析报告一、西区宿舍楼生活饮用水水质监测目的 1掌握水质现状及其变化趋势。 2为开展水环境质量评价和预测、预报及进行环境科学研究 提供基础数据和技术手段。 3为国家政府部门制定水环境保护标准、法规和规划提供有关 数据和资料。 4对环境污染纠纷进行仲裁监测,为判断纠纷原因提供科学依据。 二、水质监测项目指标 物理指标:水温,臭和味,色度,浊度,透明度,固体物(总固体物,溶解固体物,悬浮物),矿化度,电导率,氧化还原电位。 金属化合物:铝,汞,镉,铅,铜,锌,铬,砷,其他金属化合物如镍、铁、锰、钙、镁、铀。 非金属无机化合物:酸度和碱度,pH,溶解氧(DO),氰化物(简单氰化物,络合氰化物,有机氰化物),氟化物,含氮化合物(氨氮,亚硝酸盐氮,硝酸盐氮,凯氏氮,总氮),硫化物,含磷化合物,其他非金属无机化合物,如氯化物、碘化物、硫酸盐、余氯、硼、二氧化硅。 有机污染物:综合指标和类别指标化学需氧量(COD),高锰酸盐指数,生化需氧量(BOD),总有机碳(TOC),挥发酚,油类。 特定有机污染物:挥发性卤代烃,挥发性有机物(VOCs),多
环芳烃(PAHs)。 底质和活性污泥(污泥沉降比,污泥浓度,污泥容积指数) 二、水质检测方法 实验一pH值的测定 pH值是水中氢离子活度的负对数。pH=-log10αH+。 pH值是环境监测中常用的和最重要的检验项目之一。饮用水标准的pH值的范围是6.5~8.5。由于pH值受水温影响而变化,测定时应在规定的温度下进行,或者校正温度。通常采用玻璃电极法和比色法测定pH值。比色法简便,但受色度、浊度、胶体物质、氧化剂、还原剂及盐度的干扰。玻璃电极法基本不受上述因素的干扰。然而,pH在10以上时,产生“钠差”,读数偏低,需选用特制的“低钠差”,玻璃电极,或使用与水样的pH值相近的标准缓冲溶液对仪器进行校正。 本实验采用玻璃电极法测定pH值。 (一)实验目的 掌握玻璃电极法测定pH的方法及原理 (二)实验原理 以玻璃电极为指示电极,与参比电极组成电池。在25℃理想条件下,氢离子活度变化10倍,使电动势偏移59.16mv,根据电动势的变化测量出pH值。两种电极结合在一起能组成复合电极。pH计测量出玻璃复合电极的电压,电压转换成pH值,其结果被显示出来。(三)实验仪器 pH计(PB-21) (四)实验试剂 1.pH=4.003缓冲液(邻苯二甲酸氢钾) 2.pH=6.864缓冲液(混合磷酸盐) 3.pH=9.182缓冲液(硼砂) (五)实验步骤 1.将电极浸入到缓冲溶液中,搅拌均匀,直至达到稳定。 2.按mode(转换)键,直至显示出所需要的pH值测量方式。
环境监测实验室质量保证试题 姓名:分数 一、填空题 1. 为获知黄河宁夏段水质情况,在宁夏黄河段共设5个断面人工监测,共获得15个监测数据,监测(研究)的总体是 样本是,样本容量为。 2. 监测数据的质量是监测工作的。 3. 环境监测质量保证是环境检测中十分重要的和。 4. 监测分析的误差包括、和。 5. 实施环境监测质量保证的目的在于取得正确可靠的监测结果。监测结果的质量应达到五性的要求,即:、、、 和。 6. 狄克逊(Dixon)检验法适用于容量较小(n≤25)的一组测量值的一致性检验和离群值的剔除。适用于检出或异常值。 7. 格鲁勃斯(Grubbs)检验法适用于检验多组测量值均值的和剔除多组测量值中的,也可用于一组测量值的检验。检出的异常值个数不超过1。 8. 数据修约规则:“四舍六入五考虑,五后非零,五后皆零”。 9. 检出限是指某特定分析方法在给定的内可以从样品中检出待测物质的最小浓度或最小量。 10. 实验室质量控制包括、。 二、选择题 1. 16005化简为4位有效数字为。
A、1.601×104 B、1.600×104 C、1600×10 D、1601×10 ⒉近似数运算,如18.3+1.4546+0.876等于。 A、20.6 B、20.63 C、20.631 D、20.6306 3. 测得溶液的pH=12.55 ,则氢离子浓度为 A、[H+]=5.6×10-13 B、[H+]=5.60×10-13 C、[H+]=5.60×10-12 D、[H+]=5.600×10-13 4. 下列计算式表达相对误差的是 A、测量值—真值 B、测量值—测量均值 C、(测量值—真值)/真值 D、最大值—最小值 5. 近似数运算,0.0123×25.60×1.0686等于 A、0.3364 B、0.336 C、0.33641 D、0.34 6. 灵敏度是指分析信号随测定组分含量的变化而改变的能力,它与检出限密切相关,灵敏度越低, A、检出限越低 B、越高 C、检出限可高可低D检出限不变 7. 进行加标回收率测定时,下列注意事项中错误的是。 A、加标物的形态应该和待测物的形态相同。 B、在任何情况下加标量均不得小于待测物含量的3倍。 C、加标量应尽量与样品中待测物含量相等或相近。 D、加标后的测定值不应超出方法的测定上限的90%。 8. 控制分析结果精密度的质控方法是。 A、行双样测定 B、标准物质测定 C、加标回收率测定 D、仪器和量皿的检定或校准。 9. 水质环境监测分析制作校准曲线时,包括零浓度点在内至少应有浓度点,各浓度点应较均匀地分布在该方法的线性范围内。
1、废水中悬浮固体的测定原理? 悬浮固体系指剩留在滤料上并于103—105℃烘至恒重的固体。测定的方法是将水样通过滤料后,烘干固体残留物及滤料,将所称重量减去滤料重量,即为悬浮固体(总不可滤残渣)。 2、悬浮固体的测定过程中废水粘度高时如何处理? 废水粘度高时,可加2—4倍蒸馏水稀释,振荡均匀,待沉淀物下降后再过滤。 3、碘量法测定水中溶解氧的原理? 在水样中加入硫酸锰和碱性碘化钾,水中的溶解氧将二价锰氧化成四价锰,并生成氢氧化物沉淀。加酸后,沉淀溶解,四价锰又可氧化碘离子而释放出与溶解氧量相当的游离碘。以淀粉为指示剂,用硫代硫酸钠标准溶液滴定释放出的碘,可计算出溶解氧含量.反应式如下: MnSO 4+2NaOH=Na 2 SO 4 +Mn(OH) 2 ↓ 2Mn(OH) 2+O 2 =2MnO(OH) 2 ↓(棕色沉淀) MnO(OH) 2+2H 2 SO 4 =Mn(SO 4 ) 2 +3H 2 O Mn(SO 4) 2 +2KI=MnSO 4 +K 2 SO 4 +I 2 2Na 2S 2 O 3 +I 2 =Na 2 S 4 O 6 +2NaI 4、碘量法测定溶解氧适合哪类水样? 此法适用于含少量还原性物质及硝酸氮<0.1mg/L、铁不大于1mg/L,较为清洁的水样。 5、硫代硫酸钠溶液如何标定? 标定方法如下: 于250mL碘量瓶中,?加入100mL水和1gKI,??加入10.00mL 0.02500mol/L 重铬酸钾(1/6K2Cr2O7)标准溶液、5mL(1+5)硫酸溶液,密塞,摇匀。?于暗处静置5分钟后,用待标定的硫代硫酸钠溶液滴定至溶液呈淡黄色,加入1mL淀粉溶液,继续滴定至蓝色刚好褪去为止,记录用量。 C= V 02500 .0 00 . 10 式中:C—硫代硫酸钠溶液的浓度(mol/L)。 V—滴定时消耗硫代硫酸钠溶液的体积(mL)。 6、重铬酸钾法测定化学需氧量的原理? 在强酸性溶液中,准确加入过量的重铬酸钾标准溶液,加热回流,将水样中还原性物质(主要是有机物)氧化,过量的重铬酸钾以试亚铁灵作指示剂,用硫酸亚铁铵标准溶液回滴,根据所消耗的重铬酸钾标准溶液量计算水样化学需氧量。 7、对于化学需氧量高的废水样如何处理? 对于化学需氧量高的废水样,可先取操作所需体积1/10的废水样和试剂于15×150mm硬质玻璃试管中,摇匀,加热后观察是否成绿色。如溶液显绿色,再适当减少废水取样量,直至溶液不变绿色为止,从而确定废水样分析时应取用的体积。 8、水中六价铬的测定原理? 在酸性溶液中,六价铬遇二苯碳酰二肼反应,生成紫红色化合物,其最大吸收波长为540nm,摩尔吸光系数为4×104。 本方法适用于地面水和工业废水中六价铬的测定。
物联网环境监测实验室建设解决方案 目录 环境监测实验室方案概述 (1) 环境监测实验室主要功能 (1) 环境监测实验室方案概述 物联网环境监测实验室方案设计理念是在实现物联网理论教学的基础上结合实际环境监测应用进行体验式教学,激发学生学习兴趣。 该方案提供该关于物联网环境监测的整体设计以及其设计原理图,而且开放足够多的端口和丰富、完善的接口函数以及二次开发包,为教师、学生提供了一个开放的环境平台 去学习和研究。 该实验室可以满足学校物联网技术/通信工程专业开设的物联网导论、传感器原理及应用、无线传感器网络及应用、物联网工程及应用、物联网标准与中间件技术、物联网应用系统设计等课程的实践实训教学需要,并为学生或教师的物联网技术应用项目开发提供平台。 环境监测实验室主要功能 F图1是物联网环境监测实验室功能总体框图:
图1 物联网工程实验室总体框图 物联网环境监测实验室以光载无线交换机为核心, 构建WiFi 无线局域网,覆盖物联 网实验室及其周边区域,加上实验室的有线网络交换机、网络路由器,从而建立有线网络、 无线局域网的无缝覆盖。 实验室设备包含三种数传模式( WiFi 、Zigbee 、有线)环境监测传 感器,形成一套 同时,其它内置 WiFi 模块的各种手持设备(笔记本电脑、 成为物联网实验设备的一部分;师生教学、科研实践开 WiFi 设备服务器连接, L 記挠无纯空换机(IU2AF ; WiFi 喷备㈱ (■—曲煉集留 ")) Xighcu 第.专..;{- WiFi 说爸肢 …) 覆盖三个层次的物联网教学平台。 手机等)也能无线接入该实验平台, 发的其它感知模块,通过与标准的 学E 做幅P 心 出宣馬感赛 炽帯件减外 融■丄內想卅 光愿传感黯 用电赚帀船测 屎連风向 Jfcpl 輛射 —(单模拦歼,
XX 县作为本项目监测点,鉴于本次监测任务顺利进行,特绘制XX 县环境监测总体方案图,如下图1所示: 图1 XX 县环境监测总体方案图 1监测内容 XX 县地表水水质、县政府所在地空气质量、重点污染源(水、气)、城区及交通干线噪声质量等监测工作。具体内容如下: 1.1地表水水质监测 严格执行《地表水环境质量标准》(GB3838-2002)、《地表水和污水监测技术规范》(HJ/T91—2002)、《环境水质监测质量保证手册(第二版)》及《水和废水监测分析方法》(第四版)等相关标准和规范。 1.1.1 监测断面 哈尔腾河红崖子断面。 1.1.2 监测指标及方法依据(见表1-1) 采用《地表水环境质量标准》(GB3838—2002)表1中除粪大肠 编制监测方案确定监测项目及类别 现场样品采集 检测室样品分析 检测 数据处理及结果分析上报 出具监测报告 接受委托 后期服务
菌群以外的23项指标。
具体监测项目见下表: 表1-1 地表水监测因子及检测方法依据
此外还可根据XX当地污染实际情况,适当增加区域污染物监测。1.1.3 监测网点布置(见表1-2) 表1-2 地表水监测网点布置 1.1.4 样品采集方法及设备(见表1-3) 表1-3 样品采集方法及设备 1.1.4监测时间及频次(见表1-4) 每季度至少监测1次,全面至少监测4次,且需在各监测月份的上旬(1-10日)完成水质监测的采样及实验室分析。具体监测时段按下表执行(特殊情况除外) 表1-4 监测时间及频次
1.2 环境空气质量监测 严格执行《环境空气质量标准》(GB3095—1996)、《环境空气质量手工监测技术规范》(HJ/T193—2005)及《空气和废气监测分析方法》(第四版)等相关标准和规范,应加强监测过程的质量控制。 1.2.1 监测地点 XX县政府广场。 1.2.2 监测指标及方法依据(见表1-5) 表1-5 环境空气监测指标及检测方法依据 1.2.3 监测网点布置(见表1-6) 表1-6 环境空气监测网点布置
实验1 水样色度的测定 纯水是无色透明的,当水中含有某些物质时,如:有机物、某些无机离子和有色悬浮微粒均可使水体着色。水的色度标准测定为铂钴比色法,如果没有氯铂酸钾时,也可改用铬钴标准比色法。但当水源污染时,水体往往产生不正常的颜色,用标准法很难测定,此时可改用稀释倍数法。即天然和轻度污染水的色度可用标准比色法测定,对各类工业有色废水用稀释倍数法测定,并辅以文字描述。 Ⅰ、铂钴比色法* 一、实验目的 1. 明确水体中色度的测定对水质评价的意义; 2. 掌握铂钴比色法测定色度的方法。 二、实验原理 用氯铂酸钾与氯化钴配成标准色列,与水样进行目视比色。规定相当于1L 水中含有1mg铂和0.5mg钴时所具有的颜色,称为1度,作为标准色度单位。 三、仪器与试剂 1.50mL具塞比色管。 2.500度铂钴标准溶液称取1.246g化学纯氯铂酸钾(K2PtCl6)(相当于500mg铂) 及1.000g化学纯氯化钴(CoC12·6H2O)(相当于250mg钴),溶于l00mL水中,加100mL浓盐酸,用水定容至1L。此溶液色度为500度,保存在密塞玻璃瓶中,存放暗处。 四、测定步骤 1.标准色列的配制:向12支50mL比色管中分别加入0、0.50、1.00、1.50、 2.00、 2.50、 3.00、 4.00、 5.00、 6.00、 7.00、9.00及10.00mL色度为500度的铂钴 标准溶液,用水稀释至标线,混匀。各管的色度依次为0、5、10、15、20、 25、30、40、50、60、70、90和100度,密封管口,可长期保存。 2.水样的测定 *本方法与GB11903~89等效。
实验室管理制度 1、监测分析室是分析实验检定的工作场所,为保证环境清洁、安静,不经允许外人不得进入; 2、严禁在监测分析室吸烟、饮食、会客,不得晾晒衣服和放置与实验室无关的物品; 3、监测分析室的地面、操作台应经常打扫、擦拭,保持无灰尘,实验台抽屉试剂架柜、仪器架柜,通风橱要摆放整齐有序,标志清晰、规; 4、各监测分析室应做好安全保卫工作,各种安全设施和消防器材应定期检查,妥善管理,保证随时可以供应,注意实验室用电安全,定期检查电器线路,室电线管道设施,应安全、规,不得随意布线; 5、分析人员进入监测分析室应身着白大褂,必须遵守各项规章制度和安全规则,认真执行本人所承担的技术操作规,工作要集中精神,严禁玩忽职守; 6、使用各种仪器设备时,必须遵守有关操作规程安全使用规则; 7、监测分析室的药品、试剂标签清楚,存放整齐,各种玻璃仪器应分类保管,使用后及时清理干净,放回原处,摆放整齐; 8、凡属剧毒、易燃、易爆物品必须经专人负责保管,不准在监测分析室随意存放; 9、实验完毕,及时整理仪器设备和清洗实验用具,正确处理废弃物,及时切断电源、气源和火源,下班前检查水、电、气及门窗安全方可离去 检测人员行为规 1、爱岗敬业、忠于职守、坚持原则、钻研业务、务实进取; 2、科学检测,严格执行标准、遵守检测程序,保证检测质量 做到数据准确、有效; 3、遵守法规讲廉洁、拒腐蚀、不徇情、守公德、讲文明,做到五不准; a.不准收受被检测单位的礼品礼金或有价礼券; b.不准参加被检测单位的邀请娱乐活动; c.不准收受被检测单位的宴请; d.不准参加被检测单位或个人的营销活动; e.不准利用职权搞不正之风。 4、遵守检测工作程序,做到: a、持证上岗,遵守安全操作规程,确保安全检测; b、检测完毕,要清洗好器皿和仪器,清理剩余样品垃圾; 5、遵守规定,妥善保管检测资料。 为用户和保护技术所有权制度 1、全站工作人员应严格遵守国家机关工作人员制度,做好技术工作。凡系绝密、、文件,必须按规定围传阅,不得随意扩大传阅围; 2、本站重要技术和正在研究中的分析方法,重大事故有关报告及处理记录,各种技术资料,一律不准随意查阅、外借; 3、采样计划、检验报告、原始记录和数据未公开前,未经有关部门许可,一律不准以任何形式向无关人员泄露扩散; 4、凡用户提供的产品技术资料、图纸、工艺文件等,一律不准向外公布或转让,也不得用于个人或单位的经济开发;
地表水水质监测方案 ——广州大学内水质监测一、监测目的 (1)对校园教学区,主要是实验楼区域的校园景观的用水及水样进行监测,了解学校实验楼区域的水质现状。 (2)学习水质监测的步骤,进一步将课堂所学知识运用到实践中,学会制定水质监测方案并按步实施。 (3)进一步熟练常用的水质监测中的实验操作技术,掌握地表各种指标与污染物的测定方法。 (4)熟悉环境质量标准评价的各项标准,并学会运用其来评价水质,提出改善校园水质的意见和建议。 二、基础资料的收集 本次监测选取了校园网主场至生化实验楼区域水域进行监测。根据相关的文档和网上搜寻的资料可知,该河段属于珠江水系广州段,水域的有关资料如下: 1.地形地貌 广州大学城位于中国东南沿海,紧靠珠江两岸地,地处珠江三角洲腹地,是三角洲平原与低山丘陵区的过渡地带。小岛总体地形是东北高、西南低。东北部是由花岗岩与变质岩组成的低山丘陵区,地形高差250m左右,坡度15°~35°。广州大学位于岛的西部,坐落于河流堆积组成的冲积平原,地势平缓,其中分布零星的残丘和苔地,
有着树枝状般的水系。 2.气象 广州大学城地处南亚热带,属海洋性季风气候,有着温暖多雨、光热充足、雨量充沛的特点。其年平均气温约为21.8℃,一年中7月、8月的温度最高,1月最低,绝对最高气温约38.7℃。平均年降雨量为1699.8毫米,集中在梅雨季、台风季两个季节,占全年的82.1%,在七、八、九月份常遭受六级以上的大风袭击或影响,台风最大风力在9级以上,并带来暴雨,破坏力极大,年评卷蒸发量160315,mm。 3.水文 广州大学城位于珠江、冻僵溪流的交汇区上,该区域河段属于不规则半日潮。冲积平原和三角洲平原,地势低平,地表水体类别有:库唐、涌溪、干流河道,全区水域面积16011k㎡,占广州市区面积的10.8%。据黄埔潮汐站资料,珠江平均高潮水位为0.72m,平均低潮水位为-0.88m,涨潮最大潮差2.56m,落潮最大潮差3.00m。潮汐周期为半个月,即15天。每年的1~3月份平均潮位较低,6~9月份较高。各月均值之间差值一般只有0.2米左右,变化较小。 4.监测河段概况 经实地考察,此河段是珠江至校园图书馆中心湖之间的河段,全长约400m,平均宽约4.5m,平均水深1.5m,流经生化实验楼和工程实验楼,水质主要受到这两处污染源的影响。此河段是人工河段,包括河流的河床、两岸的植被、河流的流水量以及河流的污染等,都是有人
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ 名 姓 _ _ _线_ _ _ _ _ _ _ _ _ _ _ 号 学 ) 科 封专 、 本 ( 级 年 密业 专 德州学院期末考试试题 (至学年第 2学期) 课程名称:环境监测实验考试对象:环工本科试卷类型: 8考试时间: 120分钟 一、填空(本题共 25 个空,每空 1 分,共 25 分) 1.测定浊度的方法有法、法和法。 2.用碘量法测定溶解氧时,必须在现场于水样中加入和 固定,如果得到的沉淀为白色,则说明水样没有存在;如果发现沉淀为 棕色,则表示存在。 3.根据污染物质及其形成污染的性质,可将水体污染分为:;;三 种主要类型。 4.离子选择电极法测定水样中的氟离子时,、外参比电极、组成一 个原电池,作标准曲线时,横坐标是,纵坐标是。 5.水样常见的保存方法有、、。 6.对于溶解氧含量,有机物含量的地面水,可不经稀释,而直接以将 20℃的混合水样转移至两个溶解氧瓶内,转移过程中应注意不使其产生。以同样的 操作使两个溶解氧瓶充满水样后溢出少许,加塞水封。立即测定其中一瓶溶解氧,将另一 瓶放入培养箱中,在℃培养后,测其溶解氧。 7.水质监测可分为、两种。 二、判断(本题共 5 道小题,每道小题 2 分,共 10 分) 1.测定噪声时,如遇到五级以上的风力应停止测量。() 2.当干扰物质具有与被测物质相同反应时,会使结果偏高。() 3.高锰酸盐指数是以每毫升样品消耗高锰酸钾的毫克数来表示。() 4.测定空气中总悬浮颗粒时,用分析天平称量采样滤膜时应精确到。() 5.氟离子选择电极在使用之前应在蒸馏水中充分浸泡。()三、 选择题(本题共 5 道小题,每道小题 2 分,共 10 分) 1.每升水中含有()时所具有的颜色,称为 1 度,作为标准色度单位。 A. 0.5mg 铂和钴 B.铂和 1mg钴 C. 1mg 铂和钴 D. 1mg 铂和 1mg钴 2.用不同颜色表示噪声污染强度时,强度最高的是() A. 蓝色 B.红色 C.黄色 D.绿色 3.在测定CODcr中,硫酸亚铁铵滴定溶液保存多日而未重新标定会使结 A. 偏大 B.偏小 C.不变 D.不确定 4.在水质监测中,所测河段的对照断面一般设几个()。 A、一个 B、两个 C、三个 D、四个 5.氨氮的测定,水样预处理时,取250 mL 进行蒸馏,至溜出液达( A.准确到 200mL B.准确到250mL C. 200mL左右 D. 四、简答题(本题共 6 道小题,第一小题 5 分,其余各小题 6 分,共 1.测定水样氨氮时,为什么要先对 200ml 无氨水? 2.简述碘量法测定溶解氧的原理。 3.在氨氮测定时,水样中若含钙、铁、镁等金属离子会干扰测定,用什么 4.COD Cr的测定中,加入硫酸银和硫酸汞的作用分别是什么? 5.什么是化学需氧量和生化需氧量 6.什么是酚酞碱度和甲基橙碱度?总碱度指的是哪个碱度? 五、计算题(每小题10 分,共 20 分) 1.分别取 10ml,5ml 废水于 A、 B 两比色管中,其中向 B 管加入 KMnO4氧 然后再加入 NaNO2,尿素等分解过量试剂,其余操作同制作标准曲线的溶 λ=540nm处测吸光度,结果如下: Cr( ug)0 A 求:( 1)绘制工作曲线;(2)求水样中 Cr(Ⅲ)、Cr(Ⅵ)、总 Cr 的 2.测定污水的 BOD5,水样稀释倍数为 40 倍,稀释水的 DO值当天为 DO值当天为 L, 五天后为 L,求该污水的BOD5(精确到)。
实验一 邻菲罗啉分光光度法测定试样中的微量铁 一、实验目的 1.掌握邻菲罗啉分光光度法测定微量铁的方法原理 2.熟悉绘制吸收曲线的方法,正确选择测定波长 3.学会制作标准曲线的方法 4.通过邻菲罗啉分光光度法测定微量铁,掌握分光光度计的正确使用方法,并了解此仪器的主要构造。 二、实验原理 邻菲罗啉(phen )和Fe 2+在pH3~9的溶液中,生成一种稳定的橙红色络合 物Fe(phen)2+3 ,其lg K =21.3,κ508=1.1×104 L·mol -1·cm -1,铁含量在0.1~6μg·mL -1 范围内遵守比尔定律。显色前需用盐酸羟胺或抗坏血酸将Fe 3+全部还原为Fe 2+,然后再加入邻二氮菲,并调节溶液酸度至适宜的显色酸度范围。有关反应如下: HCl OH NH 2Fe 223?++ ==== 22N Fe 2++↑+ 2H 2O + 4H + + 2Cl - N N Fe 2++ 3 N N Fe 3 2+ 用分光光度法测定物质的含量,一般采用标准曲线法,即配制一系列浓度的标准溶液,在实验条件下依次测量各标准溶液的吸光度A ,以溶液的浓度C 为横坐标,相应的吸光度A 为纵坐标,绘制标准曲线。在同样实验条件下,测定待测溶液的吸光度Ax ,根据测得吸光度值Ax 从标准曲线上查出相应的浓度值Cx ,即可计算试样中被测物质的质量浓度。 三、仪器和试剂 1.仪器 分光光度计,1 cm 比色皿。 2.试剂 (1)100 μg·mL -1铁标准储备溶液,10 μg·mL -1铁标准使用液。 (2)100 g·L -1盐酸羟胺水溶液50mL 。用时现配。
渭河水质采样方案 一、采样目的 为了加强分析人员的的实验操作能力,提高人员综合素质。根据《水质采样技术指导》(HJ 494-2009)的要求,在渭河草滩八路湿地公园段采样进行检测。 二、适用范围 适用于渭河草潭段。 三、检测内容和方法 (1)检测点位确定 根据及《地表水和污水检测技术规范》的要求,在渭河进入草滩段设置一个控制断面,一个点位进行取样详细见表1、表2。 表1采样垂线数的设置 表2采样垂线上的采样点数的设置
(2)采样方法 根据《水质湖泊和水库采样技术指导》(GB/14581-93)的要求进行采样。 (3)测定项目 检测项目为:水温、流量、PH、电导率、溶解氧、透明度、BOD5、COD、细菌总数、粪大肠菌群、总大肠杆菌、高锰酸盐指数、磷酸盐、硫化物、氨氮、悬浮物、碱度、钙、钙和镁、酸度、亚硝酸盐、硝酸盐、动植物和石油类、硫酸盐、水质苯系物、挥发酚、苯胺类化合物、六价铬、总磷、氯化物、总氮、水质甲醛、总残渣、矿化度、全盐量、氟化物、总铬、游离氯和总氯、阴离子表面活性剂、臭氧、氰化物、钴、镍、汞、砷、硒、铋、锑、铁、锰、铜、铅、锌、镉。 四水样采集 (1)采样工具 采样器材主要是采样器和水样容器。关于水样保存及容器洗涤方法见表3。 表3水样保存和容器的洗涤(部分)
注:(1) *表示应尽量作现场测定; **低温(0~4℃)避光保存。 (2)G为硬质玻璃瓶;P为聚乙烯瓶(桶)。 (3)①为单项样品的最少采样量; ②如用溶出伏安法测定,可改用1L水样中加19ml浓HCl04。 (4)I,Ⅱ,Ⅲ,Ⅳ表示四种洗涤方法,如下: I:洗涤剂洗一次,自来水三次,蒸馏水一次; Ⅱ:洗涤剂洗一次,自来水洗二次,1+3 HN03荡洗一次,
实验一 1、pH (1)为什么在测定溶液的酸碱度时,不能将pH试纸直接浸入溶液中? 答:测量水溶液酸碱度的正确方法是,用试棒点取水样在pH试纸上,而不应直接将pH 试纸插入待测水样中。这是因为pH试纸的显色机理本质上是一种化学反应,当将pH试纸直接插入待测水样中时,大量的水样溶液将pH试纸本身所含的显色剂稀释了,冲淡了,从而影响显色的色度造成度数误差。 (2)测定溶液pH值时为什么要先用标准pH缓冲溶液进行定位?玻璃电极使用前为什么要处理? 答:用pH缓冲溶液标定是为了消除不对称电位的影响。因为干玻璃电极不显示pH效应,只有经过水化的玻璃电极才显示pH效应,玻璃电极经浸泡24小时以上,就可形成稳定的水化层,使玻璃电极的膜电位在一定温度下与试液的pH值成线性关系,因此玻璃电极在使用前应在蒸馏水或0.1N盐酸中浸泡24小时以上. (3)为何测pH时要按从稀到浓的次序测定? 答:因为后面一个始终浓度大于前面一个,所以要是用pH电极测试稀溶液后再放到浓的里,影响不大。但要是从浓到稀,电极从浓溶液带出的残液进入稀溶液,电极上的残液将影响稀溶液的测试结果。 2、溶解氧: (1)碘量法测定溶解氧的过程中如何避免空气中氧的干扰? 答:溶解氧采样时,应是水溢流,且碘量瓶上不能附有气泡,采样瓶需要水封。 在固定溶解氧、吸取溶液等的过程中,应将移液管插入水面下。 (2)在配置硫代硫酸钠标准溶液时,所用的蒸馏水为何要先煮沸并冷却后才能使用? 答:赶出水中溶解氧。 空白试验时有时空白值过大,正常的空白值为1-2滴,若超过此数表明蒸馏水制备过久,可能其中溶解了较多的氧,KI会与氧发生反应产生I2,同时蒸馏水中的氧本身也会和硫代硫酸钠标准溶液发生反应,这两方面都会增加硫代硫酸钠标准溶液消耗量使空白值过大:4I- + 4H+ + 4 O2 = 2 I2 + 2H2O 2S2O32- + O2 = 2SO42- +2S↓ 因此每次标定时均应使用新鲜制备的蒸馏水或将蒸馏水重新煮沸10min,冷却后使用,这样可有效避免上述情况的发生。 (3)溶液被滴定至淡黄色,说明了什么?为什么在这时才可以加入淀粉指示剂? 答:溶液为淡黄色时说明I2消耗殆尽,接近终点。 淀粉指示剂的加入要在近终点时加入是因为若加入过早,因碘释放慢,终点会迟后,使滴定结果产生误差。 (4)为什么通过滴定I2可计算出DO的含量? 根据原理解释。 3、浊度 (1)浊度的测定在操作上应注意什么? 答:水中应无碎屑和易沉颗粒,如所用器皿不清洁,或水中有溶解的气泡和有色物质时干扰测定。 (2)有时会加入少许生物抑制剂,起何作用?
《环境监测》实验讲义
实验一废水中浊度的测定 一、实验目的 1.掌握分光光度法测定废水浊度的原理。 2、掌握分光光度法测定浊度的方法。 二、实验原理 在适当的温度下,硫酸肼和六次甲基四胺聚合,生成白色高分子聚合物,以此作为浊度标准液,用分光光度计于680 nm波长处测其吸光度,与在同样条件下测定水样的吸光度比较,得知其浊度。 规定1000mL溶液中含0.1mg硫酸肼和1mg六次甲基四胺为1度 三、实验仪器与试剂 1、仪器 25mL具塞比色管,吸量管(1mL、2mL、5mL),100mL容量瓶,722型分光光度计。 2、试剂 1、无浊度水:将蒸馏水通过0.2微米虑膜过滤,储存于蒸馏水瓶中。 浊度标准液 2、硫酸肼溶液(10 mg/mL):称取1.000g的硫酸肼[(NH2)2·H2SO4]溶于水,定容至100mL。 3、六次甲基四胺溶液(100 mg/mL):称取10.00g的六次甲基四胺溶液溶于水,定容至100mL。 4、浊度标准液:取5.00mL的硫酸肼溶液和5.00mL的六次甲基四胺溶液于100mL容量瓶中,混匀,于(25±3)℃下反应24h,冷却后用无浊度水稀释至刻度,制得浊度为400度的标准液。可保存一个月。 四、实验步骤 1、试样制备 样品应收集到具塞玻璃瓶中,取样后尽快测定。如需保存可保存在冷暗处不超过24h,测试前需激烈振摇并恢复到室温。所有与样品接触的玻璃器皿必须清洁,可用盐酸或表面活性剂清洗。
2、标准系列的配制和测定 吸取浊度为400的标准液0、0.25、0.50、1.25、2.50、5.00及6.25mL分别于7个25mL比色管中,加水稀释至标线,混匀。其浊度依次为0、4、8、20、40、80、100度的标准液。于680 nm波长,用1cm比色皿测定吸光度,绘制标准曲线。 3、水样测定 吸取20mL摇匀水样(无气泡,如浊度超过100度可酌情少取,用无浊度水稀释至25mL)置于25mL比色管中,稀至刻度,测定水样的吸光度,由标准曲线上求得水样的浊度。 注:水样浊度超过100度时,用水稀释后测定。 计算公式: C C B A) (+ = 浊度(度) 式中:A---稀释后水样的浊度,(度) B---稀释水体积,(mL) C---原水样体积,(mL) 五、数据记录及处理 1、记录测得标准系列的吸光度及水样的吸光度。 2、根据测得标准系列的吸光度,绘制吸光度与浊度的标准曲线,由标准曲线上求得水样的浊度。 六、思考题 1、引起天然水呈现浊度的物质有些? 2、浊度测定还有哪些方法?
第三方环境检测机构实验室建设指南 (老兵) 为贯彻落实党的十八大关于全面深化改革的战略部署,培育壮大环境监测服务市场,推进政府购买环境监测服务,引导社会力量参与环境监测,第三方环境监测机构的建设逐渐成为当前实验室建设的热点。现针对第三方环境监测机构必要的场所、技术人员及监测仪器设备提出以下建议。 1.明确拟开展的检测项目 为避免盲目投资造成采购来的仪器闲置浪费,现以最常规和检测仪器不太贵的检测项目为例,建议通过认证开展的检测项目分别是: 1.1水和废水检测项目 水温、pH、电导率、透明度、色度、流量、悬浮物、全盐量(总残渣或溶解性残渣)、游离氯和总氯、硫化物、氰化物、氟化物、氨氮、溶解氧、高锰酸盐指数、化学需氧量、五日生化需氧量、总磷、总氮、铜、铅、锌、镉、总砷、总汞、总硒、总铬(六价铬)、挥发酚、石油类(或动植物油)、阴离子表面活性剂、氯化物、硝酸盐、硫酸盐、铁、锰、嗅和味、浊度、总硬度、粪大肠菌群、亚硝酸盐。上述项目除包含《地表水环境质量标准》(GB3838-2002)表1和表2规定的必测项目,还包括了其它常见的和测试方法较为简单的指标。 1.2空气和废气 总悬浮颗粒物、可吸入颗粒物、二氧化硫、氮氧化物(含二氧化氮和一氧化氮)、烟(粉)尘、烟气参数、烟气黑度、一氧化碳、氟化物、恶臭、氨、铅、砷、硫化氢、铬酸雾、硫酸雾、和甲醛等。 1.3土壤和水系沉积物 水分、pH、镉、汞、砷、铅、铬(含六价铬)、铜、锌、镍、全磷、全氮、钾、阳离子交换量和有机质含量等。 1.4 固体废物 铜、锌、镉、铅、总铬、铬(六价)、汞、铍、钡、镍、总银、砷、氟化物和氰化物等。 1.5噪声和振动 环境噪声、工业企业厂界噪声、建筑施工场界噪声、社会生活噪声、、铁路边界噪声、噪声源(设备噪声)、机动车噪声振动
新田县环境监测标准三级实验室建设方案.txt爱一个人很难,恨一个人更难,又爱又恨的人最难。爱情永远不可能是天平,想在爱情里幸福就要舍得伤心!有些烦恼是我们凭空虚构的,而我们却把它当成真实去承受。新田县三级监测站标准化实施方案 一、建设目标 为提高新田县环境监测质量管理水平,规范环境监测质量管理工作,确保监测数据和信息的准确可靠,为环境管理和政府决策提供科学、准确的依据,根据《环境监测管理办法》(国家环保总局令第 39 号、《xx 省环境保护与生态建设“十一五”》 xx 府办〔200 7〕44号、《xx 省环境监测质量管理规定(试行》xx 环〔2008〕101 号、《全国环境监测站建设标准》(环发〔2007〕56 号及有关法律法规的要求,紧紧围绕减排工作,加大环境综合整治力度,加强对重点污染源的监督性监测工作、为我县减排任务顺利完成提供充分、有效的技术支持,逐步改善我县环境质量。在“十二五”期间将我县环境监测站建设成为能掌握环境质量、污染物排放总量、环境容量和污染物状况,满足以“工业富县、旅游旺县、农业稳县”的发展战略的三级环境监测服务机构。 二、背景及现状 2.1 建设背景 新田县地处湖南省南部,毗邻两广,隶属永州市,面积1022Km2,东接嘉禾县、桂阳县,南临蓝山县,西抵宁远县,北邻祁阳县、芝山区。 县环境监测站始建于 1984年5月,于 2006 年通过计量认证复审,是从事环境监测的服务性全民事业单位,隶属新田县环境保护局,业务上受永州市环境监测中心站的指导,属全国环境监测三级站。承担着新田县境内饮用水水源、地表水常规监测任务及县内所用污染源的监测监督任务。建站已有二十七年,虽然近几年在上级部门和环保局的大力支持下,对实验室的分析操作环境进行完善建设,购买了烟气自动监测仪器、可见光分光光度计、消解通风柜、万分之一分析天平等一批仪器,环境监测能力得到一定提升。但是由于受人员、仪器装备和工作场所的限制,监测监
德州学院期末考试试题 (至学年第 2 学期) 课程名称:环境监测实验考试对象:环工本科试卷类型: 8 考试时间: 120 分钟 一、填空(本题共25个空,每空1分,共25分) 1. 测定浊度的方法有法、法和法。 2. 用碘量法测定溶解氧时,必须在现场于水样中加入和 固定,如果得到的沉淀为白色,则说明水样没有存在;如果发现沉淀为棕色,则表示存在。 3. 根据污染物质及其形成污染的性质,可将水体污染分为:;;三 种主要类型。 4. 离子选择电极法测定水样中的氟离子时,、外参比电极、组成一 个原电池,作标准曲线时,横坐标是,纵坐标是。 5. 水样常见的保存方法有、、。 6. 对于溶解氧含量,有机物含量的地面水,可不经稀释,而直接以将 20℃的混合水样转移至两个溶解氧瓶内,转移过程中应注意不使其产生。以同样的操作使两个溶解氧瓶充满水样后溢出少许,加塞水封。立即测定其中一瓶溶解氧,将另一瓶放入培养箱中,在℃培养后,测其溶解氧。 7. 水质监测可分为、两种。 二、判断(本题共5道小题,每道小题2分,共10分) 1. 测定噪声时,如遇到五级以上的风力应停止测量。() 2. 当干扰物质具有与被测物质相同反应时,会使结果偏高。() 3. 高锰酸盐指数是以每毫升样品消耗高锰酸钾的毫克数来表示。() 4. 测定空气中总悬浮颗粒时,用分析天平称量采样滤膜时应精确到。() 5. 氟离子选择电极在使用之前应在蒸馏水中充分浸泡。() 三、选择题(本题共5道小题,每道小题2分,共10分) 1. 每升水中含有()时所具有的颜色,称为1度,作为标准色度单位。 A. 0.5mg铂和钴 B. 铂和1mg钴 C. 1mg铂和钴 D. 1mg铂和1mg钴 2. 用不同颜色表示噪声污染强度时,强度最高的是() A.蓝色 B. 红色 C.黄色 D.绿色 3. 在测定CODcr中,硫酸亚铁铵滴定溶液保存多日而未重新标定会使结果() A.偏大 B.偏小 C.不变 D.不确定 4. 在水质监测中,所测河段的对照断面一般设几个()。 A、一个 B、两个 C、三个 D、四个 5. 氨氮的测定,水样预处理时,取250 mL进行蒸馏,至溜出液达()时,停止蒸馏。 A. 准确到200mL B. 准确到250mL C. 200mL左右 D. 250mL左右 四、简答题(本题共6道小题,第一小题5分,其余各小题6分,共35分) 1. 测定水样氨氮时,为什么要先对200ml无氨水 2. 简述碘量法测定溶解氧的原理。 3. 在氨氮测定时,水样中若含钙、铁、镁等金属离子会干扰测定,用什么方法来消除干扰 4. COD Cr 的测定中,加入硫酸银和硫酸汞的作用分别是什么 5. 什么是化学需氧量和生化需氧量 6. 什么是酚酞碱度和甲基橙碱度总碱度指的是哪个碱度 五、计算题(每小题10分,共20分) 1.分别取10ml,5ml废水于A、B两比色管中,其中向B管加入KMnO 4 氧化氧化水样中的Cr(Ⅲ), 然后再加入NaNO 2 ,尿素等分解过量试剂,其余操作同制作标准曲线的溶液一并进行,在L=1cm、λ=540nm处测吸光度,结果如下: 求:(1)绘制工作曲线;(2)求水样中Cr(Ⅲ)、Cr(Ⅵ)、总Cr的浓度。 2. 测定污水的BOD5,水样稀释倍数为40倍,稀释水的DO值当天为L, 五天后为L;稀释水样的 DO值当天为L,五天后为L,求该污水的BOD 5 (精确到)。
环境监测站实验室设计 环境监测站实验室设计环境系统实验室要素环境系统实验室要素环境监测是以环境为对象,运用物理的、化学的和生物的技术手段,对其中的污染物及其有关的组成成分进行定性、定量和系统的综合分析,以探索研究环境质量的变化规律。其任务是要对环境样品中的污染物的组成进行鉴定和测试,并研究在一定历史时期和一定空间内的环境质量的性质、组成和结构,主要内容包括:大气环境监测、水环境监测、土壤环境监测、固体废弃物监测、环境生物监测、环境放射性监测和环境噪声监测等。通过对环境的监测能够准确、及时、全面地反映环境质量现状及发展趋势,为环境管理、污染源控制、环境规划等提供科学依据。环境监测的目的具体可归纳为: 1. 根据环境质量标准,评价环境质量。 2. 根据污染分布情况,追踪寻找污染源,为实现监督管理、控制污染提供依据。 3. 收集本底数据,积累长期监测资料,为研究环境容量、实施总量控制、目标管理、预测预报环境质量提供数据。 4. 为保护人类健康、保护环境、合理使用自然资源、制订环境法规、标准、规划等服务。一环境监测技术监测技术包括采样技术、测试技术和数据处理技术。这里以污染物的测试技术为重点作一概述。1) 化学、物理技术目前,对环境样品中污染物的成分分析及其状态与结构的分析多采用化学分析方法和仪器分析方法。如重量法常用作残渣、降尘、油类、硫酸盐等的测定,容量分析被广泛用于水中酸度、碱度、化学需氧量、溶解氧、硫化物、氰化物的测定。仪器分析是以物理和物理化学方法为基础的分析方法。它包括光谱分析法(可见分光光度法、紫外分光光度法、红外光谱法、原子吸收光谱法、原子发射光谱法、X- 荧光射线分析法、荧火分析法、化学发光分析法等);色谱分析法(气相色谱法、高效液相色谱法、薄层色谱法、色谱-质谱联用技术);电化学分析法(极谱法、溶出伏安法、电导分析法、电位分析法、离子选择电极法、库仑分析法);放射分析法(同位素稀释法、中子活化分析法)和流动注射分析法等。当前,仪器分析方法被广泛用于环境物进行定性和定量的测量。如分光光度法常用于大部分金属、无机非金属的测定;气相色谱法常用于有机物的测定;对于污染物状态和结构的分析常用紫外光谱、红外光谱、质谱及核磁共振等技术。2) 生物技术这是利用植物和动物在污染环境中所产生的各种反映信息来判断环境质量的方法,这是一种最直接也是一种综合的方法。生物监测包括生物体内污染物含量的测定;观察生物在环境中受伤害症状;生物的生理生化反应,生物群落结构和种类变化等手段来判断环境质量。例如:利用某些对特定污染物敏感的植物或动物(指示生物)在环境中受伤害的症状,可以对空气或水的污染作出定性和定量的判断。二监测技术的发展目前监测技术的发展较快,许多新技术在监测过程中已得到应用。如GC-AAS(气相色谱-原子吸收光谱)联用仪,使两项技术互促互补,扬长避短,在研究有机汞、有机铅、有机砷方面表现了优异性能。再如,利用遥测技术对整条河流的污染分布情况进行监测,是以往监测方法很难完成的。对于区域甚至全球范围的监测和管理,其监测网络及点位的研究、监测分析方法的标准化、连续自动监测系统、数据传送和处理的计算机化的研究、应用也是发展很快。在发展大型、自动、连续监测系统的同时,研究小型便携式、简易快速的监测技术也十分重要。例如,在污染突发事故的现场、瞬时造成很大的伤害,但由于空气扩散和水体流动,污染物浓度的变化十分迅速,这时大型仪器无法使用,而便携式和快速测定技术就显得十分重要,在野外也同样如此。三环境监测站实验室设计环境监测就其对象、手段、时间和空间的多变性、污染组分的复杂性等,其特点可归纳为:1) 环境监测的综合性环境监测的综合性表现在以下几个方面:¢监测手段包括化学、物理、生物、物理化学、生物化学及生物物理等一切可以表征环境质量的方法。¢监测对象包括空气、气体(江、河、湖、海及地下水)、土壤、固体废物、生物等客体,只有对这些客体进行综合分析,才能确切描述环境质量状况。¢对监测数据进统计处理、综合分析时,需涉及该地区的自然和社会各个方面情况,因此,必须综合考虑才能正确阐明数据的内涵。2) 环境监测的连续性由于环境污染具有时空性等特点,因此,只有坚持长期测定,才能从大量的数据中揭示其变化规律,预测其变化趋势,数据越多,预测的准确度就越高。因此,监测网络、监测点位的选择一定要有科学性,而且一旦监测点位的代表性得到确认,必须长期坚持监测。3) 环境监测的追踪性环境监测包括监测目的的确定、监测计划的制订、采样、样品运送和保存、实验室测定到数据整理等过程,是一个复杂而又有联系的系统,任何一步的差错都将影响最终数据的质量。特别是区域性的大型监测,由于参加人员众多、实验室和仪器
德州学院期末考试试题 (至学年第学期) 课程名称:环境监测实验考试对象:环工试卷类型:10 考试时间:120 分钟, 一、填空(本题共20个空,每空1分,共20分) 1. 水样的色度应以后为准,色度通常采用铂钴比色法,并规定的铂产生颜色为1度。 2. pH对色度影响很大,pH高时往往色度,故测量色度时应测量溶液的pH。 3. 浊度是表现水中悬浮物对光线透过时所产生的阻碍程度。相当于一定粒度的硅藻土在1000mL 水中所产生的浊度,称为1度。 4. 离子选择电极法测定水样中的氟离子时,、外参比电极和被测溶液组成一个原电池,作标准曲线时,横坐标是,纵坐标是。 5. 监测环境噪声要求在的时间,声级计应保持传声器膜片清洁,风力在必须加风罩(以避免风噪声干扰),大风应停止测量。 6. 对于溶解氧含量,有机物含量的地面水,可不经稀释,而直接以将20℃的混合水样转移至两个溶解氧瓶内,转移过程中应注意不使其产生。以同样的操作使两个溶解氧瓶充满水样后溢出少许,加塞水封(瓶内不应有气泡)。立即测定其中一瓶溶解氧,将另一瓶放入培养箱中,在℃培养后,测其溶解氧。 7. 采集溶解氧水样,现场固定应加的试剂为_ 和。 & 8.纳氏试剂分光光度法测定水中氨氮时,为除去水样色度和浊度,可采用絮凝沉淀法和方法。水样中如含余氯,可加入适量_ 。 二、判断题(本题共10道小题,每道小题2分,共20分) 1. 总悬浮颗粒物是指悬浮在空气中,空气动力学当量直径小于100 μm的颗粒物。() 2. 当干扰物质具有与被测物质相同反应时,会使结果偏低。() 3. 高锰酸盐指数是以每升样品消耗高锰酸钾的毫克数来表示。() 4. 用碘量法测定溶解氧时,若水样中含有氧化性物质可使碘化物游离出碘,则使结果产生正干扰。() 5. 水的颜色可分为“表色”和“真色”,前者是指去除浊度后水的颜色,而后者是指没有去除悬浮物的水所具有的颜色,包括了溶解性物质及不溶解悬浮物所产生的颜色。() | 6. 化学需氧量的测定结果应保留三位有效数字。() 7. 氟离子选择电极在使用之前应在被测水样中充分浸泡。() 8. 水样浊度超过100度时,用水稀释后测定。计算公式:浊度(度)= () B A C C + ,其中A—稀释后水 样的浊度,(度);B—稀释水体积,mL;C—原水样体积,mL。() 9. 水样采集后,应加入硫酸锰和碱性氯化钠溶液以固定溶解氧。() 10. 为使监测数据具有可比性,能较好地反映同一水系中不同断面的水质状况,对同一江河、湖库的监测采样应 力求同步,并应避免大雨时采样。() 三、选择题(本题共6道小题,每道小题2分,共12分) $ 1. 悬浮固体的测定中,需将滤膜与称量瓶烘至恒重,恒重的标准是:两次称量相差不超过() A. 0.0001g B. 0.0002g C.0.0005g D. 0.01g 2. 铂钴比色法测定色度时,如水样浑浊,不可采用的方法是() A.放置澄清 B.离心法去除悬浮物 C.用孔径为滤膜过滤 D.滤纸过滤 3. 需要快速测定多个未知含量水样的氨氮最好采用() A.电极法 B.蒸馏—酸滴定法 C.钠氏试剂比色法 D.气相分子吸收法 4. 在测定CODcr中,硫酸亚铁铵滴定溶液保存多日而未重新标定会使结果() A.偏大 B.偏小 C.不变 D.不确定 ' 5. 用不同颜色表示噪声污染强度时,强度最高的是()A.蓝色 B. 红色 C.黄色 D.绿色 6.能综合表示水体中有机污染物的主要指标是() 四、简答题(本题共5道小题,每道小题6分,共30分) 1.简述测定水中SS的过程。 2. 在氨氮测定时,水样中若含钙、铁、镁等金属离子会干扰测定,用什么方法来消除干扰 3.简述重铬酸钾法测定COD Cr的原理,并写出化学反应方程式。 4.测定总铬的标准测定方法条件是什么氧化剂、显色剂是什么尿素的作用是什么 { 5.保存水样的基本要求是什么多采用哪些措施 五、计算题(每小题6分,共18分) 1.环境监测测定水中溶解氧的方法是量取amL水样,迅速加入MnSO4溶液及含NaOH的KI溶液立即塞好塞子, 振荡使它反应均匀,打开塞子,迅速加入适量稀H2SO4,此时有I2生成,用的Na2S2O3溶液以淀粉为指示剂滴定到溶液 由蓝色恰好变为无色为止,共计消耗VmL Na2S2O3溶液,上述的反应为: 2Mn2++O2+4OH-=2MnO(OH)2 MnO(OH)2+2I-+4H+=Mn2++I2+3H2O I2+2S2O32-=2I-+S4O62- 求水溶解的氧气是多少(g/L) 2.监测某水样的BOD5时,采用稀释法测定数据为:水样在培养前溶解氧浓度是;水样在培养后溶解氧浓度是; 取原水样100ml加稀释水至1000ml。稀释水在培养前溶解氧浓度是;稀释水样在培养后溶解氧浓度是,求水样 的BOD5为多少(注:精确至)