
第二单元微粒之间的相互作用
二、化学键
1、化学键:物质中直接相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。
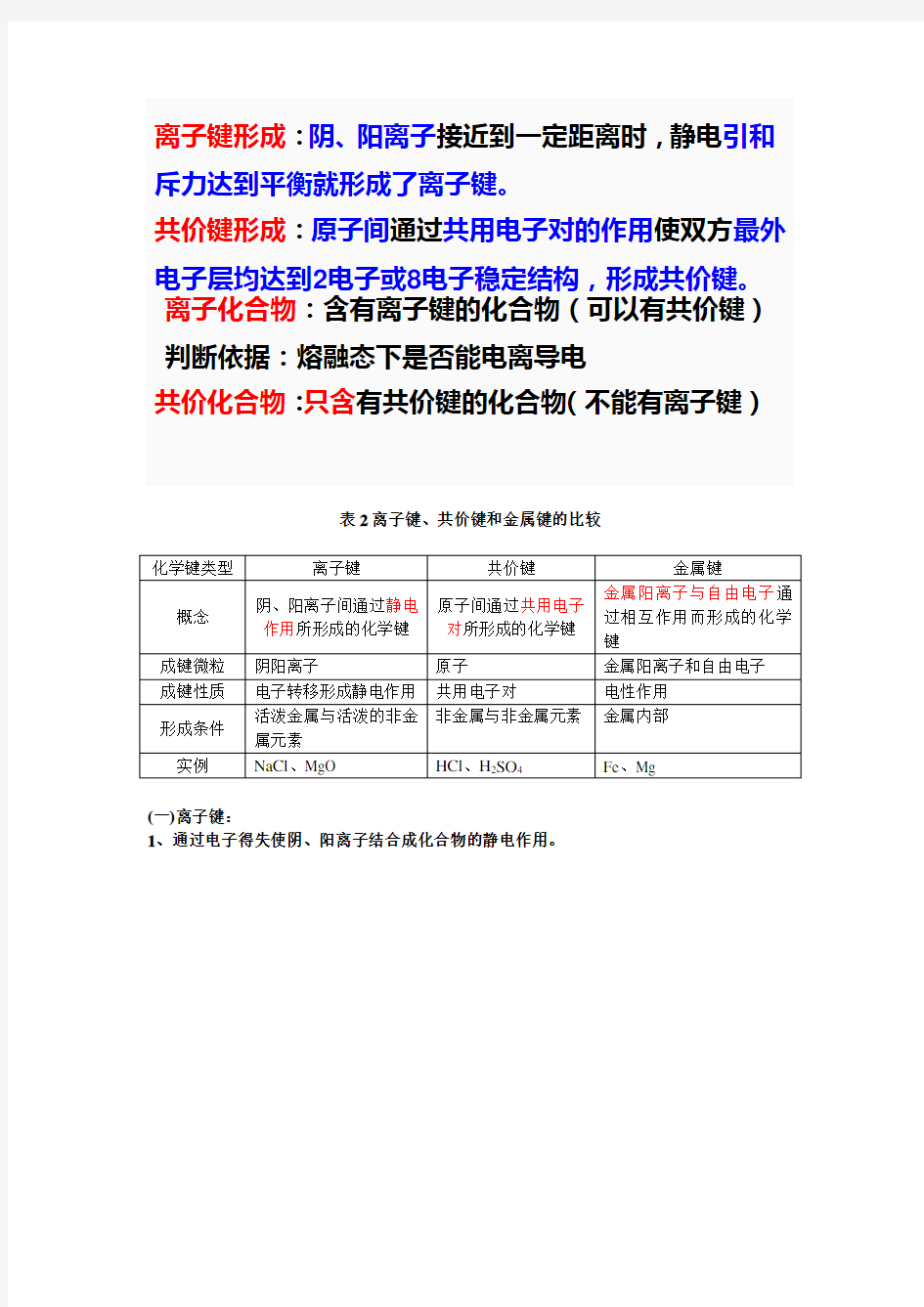
表2离子键、共价键和金属键的比较
(一) 离子键:
1、通过电子得失使阴、阳离子结合成化合物的静电作用。
离子键形成:阴、阳离子接近到一定距离时,静电引和斥力达到平衡就形成了离子键。
共价键形成:原子间通过共用电子对的作用使双方最外电子层均达到2电子或8电子稳定结构,形成共价键。 离子化合物:含有离子键的化合物(可以有共价键) 判断依据:熔融态下是否能电离导电
共价化合物:只含有共价键的化合物(不能有离子键)
2、离子化合物:含有离子键的化合物(可以有共价键)
思考
思考哪些化合物是离子化合物?
1)、活泼的金属元素(IA ,IIA )和活泼的非金属元素(VIA ,VIIA )形成的化合物,如NaCl 、Na 2O 、Na 2O 2等。
2)、活泼的金属元素和酸根离子形成的盐。如Na 2CO 3、MgSO 4
3)、铵盐。如NH 4Cl
4)、碱。如NaOH (弱碱NH 3.H 2O 例外)
3、离子化合物与电解质:离子化合物都是强电解质。在熔融状态下:都可以导电。在水溶液中:有的可以导电,有的不可以导电(此类物质易与水反应或不溶于水)。
Na +
Cl
-
电子转移
氯化钠的形成过程:
不稳定
较稳定
在氯化钠中Na +和Cl - 间存在哪些作用力?
思考:1、所有金属和非金属化合都能形成离子键吗?举例说明。
2、所有非金属化合都不能形成离子键吗?举例说明。
练习:下列物质中属于离子化合物的是( )
1、H2O
2、CaCl2
3、NaOH
4、H2SO4
5、Na2SO4
6、CO2
7、Na2O2
8、NH4Cl
9、NH3 10、CH4 11、NH3.H2O 12、AlCl3 13、HAlO2
离子类型:1、金属离子:
Na+ 、Mg2+、Al3+
2、带负电荷的非金属离子: F-、Cl-、O2-、S2-
3、带电的原子团:
SO 4 (硫酸根离子) CO 3 (碳酸根离子) NO 3 (硝酸根离子) OH (氢氧根)
NH 4(铵根离子)
4、 离子:
1.定义:带电荷的原子(或原子团)叫做离子。 离子所带电荷数由该元素原子的最外层电子数决定。
2、离子的分类:
阳离子: 带正电荷的原子或原子团。 Na + 、Mg 2+、Al 3+、 NH 4+ 阴离子:带负电荷的原子或原子团。
F -、Cl -、O 2-、S 2-、OH -、SO 4
2-
切记:带电的原子团也是离子。
5、电子式:
定义:在元素符号周围用小黑点“.”或小叉 “×”来表示原子的最外层电子的式子。 ⑴、原子的电子式:
如Mg
2
Cl
O
2-
Na
①阴离子的电子式
简单阴离子:复杂的阴离子:O
H
-⑵、离子的电子式:
②阳离子的电子式
简单的阳离子:
复杂的阳离子:即离子符号
如NH 4+:
.N H +
H
H H
一般用
表示
R
n-
使每一个原子达到稳定结
构
要注明最外层电子数
及电荷数并应用括号
“[ ]”括起来
H +
S
2-
H O
C
Mg
Na
⑶、离子化合物的电子式:由阳离子的电子式和阴离子的电子式组
合而成.
注意:相同的离子不能合并写(每个离子都要单独写),一般对称排列. 如:
Mg
2
Cl
×
Cl Na Na O 2-
Na Mg
2
Cl Cl
Na 2 ×
O 2-AB 型AB 2型
A 2
B 型
Mg
2
Br Br
Br
Mg
Br
S 2-K K S
K K 例:⑷、用电子式表示离子化合物的形成过程左侧写原子的电子式,右侧写离子化合物的电子式,中间用连接.
注意:用弧形箭头表示电子转移的方向.
练习:用电子式表示出
K : S : K+: S2- : K2S : Na2O : Na2O2: NaCl : MgO : MgCl2: NH4Cl :
练习:下列微粒的结构示意图中,表示阴离子的是( )
根据上题,用“=.>或<”符号填写:
①原子的核电荷数____质子数_____核外电子数。②阳离子的核电荷数___质子数____核外电子数。③阴离子的核电荷数___质子数_____核外电子数
2+8
6
28+168
13、根据下列几种粒子的结构示意图,用微粒的序号填空8+166
2+162+11
8
2+108
②
①
③
⑥
1.其中属于原子的是____________________
2.具有相似化学性质的粒子是___与__
3.属于金属元素的是__________
4.属于同种元素的是_____与____,______与_______
5.请写出的微粒符号____________
⑤Na +
(二)共价键:通过共用电子对成键
二、共价键
问题:1.活泼的金属元素和活泼非金属元素化合时形成离子键,
非金属元素之间化合时,能形成离子键吗?为什么?
不能,因非金属元素的原子均有获得电子的倾向
2.非金属元素之间化合时,核外电子排布是通过什么方式达到稳定结构的?
H ··H +→·
H H ·H ﹣H (结构式)以H 2、HCl 分子的形成为例
探讨:···Cl ··
:
H ·+→Cl ··
··H
·
··
·H ﹣Cl (结构式)
结论:在H 2、HCl 分子的形成过程中,没有发生电子的得失,
而是通过形成共用电子对达到稳定结构的
用一根短线表示一个共用电子对
共用电子对
2、用电子式表示共价化合物的形成过程
2. HCl
3. H 2O 1. H 25. NH 3
4. CO 2·
·+·
·
H ·H ····:+·H
H ··H +→H H
···Cl ··:
H ·→Cl
····
H ··→···O ····+H ·+O ···
H ::+··O ···+:C :··O ··→C ::O ···O ····:3H ·→
:
·N ·
··N H ::··H
注意:不标电荷和中括号“[ ] ”
H H O H H ﹣H
﹣Cl H O=C=O H H
-N -结构式
练习:.写出下列物质的电子式和结构式
1、氯气: 4、甲烷CH4
2、溴化氢
3、氮气 5、过氧化氢
离子键和共价键的比较非金属单质(除稀有气以体)、共价化合物、部分离子化合物只存在于离子化合物中
存在形成共用电子对
电子得失形成过程以为HCl 例
NaCl 为例
电子式
非金属元素活泼的金属元素与活泼的非金属元素之间
成键元素共用电子对阴阳离子间静电作用成键本质
原子阴、阳离子
成键微粒共价键
离子键
键型[设计P42表]
[ ]
+-·Na Cl ··
:
:·Cl
··
··
H ···
·
共价化合物与离子化合物的区别:
如何判断化合物类型
①存在的键型物质的构成
离子化合物:指离子通过离子键直接构成物质(一定有
离子键、可能有共价键)。
共价化合物:原子间通过共价键构成分子,分子构成
物质(只有共价键)。
②只要有离子键的化合物就是离子化合物、全部是共价键
⑴NaOH、⑵H2S、⑶MgCl2、⑷H2SO4、⑸KNO3、⑹CO2、⑺NH3.H2O、⑻AlCl3 离子化合物:
共价化合物:
含共价键的离子化合物:
极性键与非极性键的区别
[设计P41表]
电子对不偏移H 偏向吸引电子能力强的原子一不偏向任何一原子吸引共用电电子对发生偏移的共价键的共价键定义HCl 、H 2O 、NH 3、CO 2等
2、N 2、O 2、Cl 2等
实例
吸引电子能力强的显负电性吸引电子能力弱的显正电性不显电性成键原子的电性方
个原子共用电子对有无偏移
不相同
相同
子对能力
不同种原子同种原子原子种类极性键(HCl )非极性键(H 2
)
巧记为:同非
判断非极性键和极性键的依据:
同种元素的原子之间形成的共价键一定是非极性键; 不同种元素的原子之间形成的共价键一定是极性键。
非极性分子和极性分子的比较
二、非极性分子与极性分子
非极性分子:分子内电荷分布对称(正负电荷
重心重合)。
极性分子:分子内电荷分布不对称(正负电荷
重心不重合)。
非极性键
化学键的极性与分子极性的关系
非极性分子如:H 2、O 2、
N 2、O 3
极性键
极性分子如:HCl 、H 2O 、
NH 3、HF
SO 2
非极性分子因为分子空间构型对
称,如:CH 4
CO 2
双原子分子极性键→
非极性键→
多原子分子都是非极性键→
有极性键
几何结构对称→
几何结构不对称→
极性分子HCl,CO,NO
非极性分子H
2
,O
2
,N
2
非极性分子如:CO
2
,CH
4
极性分子如:NH
3
,H
2
O
非极性分子P
4
,C
60
判断非极性分子和极性分子的依据:
常见分子的类型与形状比较
小结:
化学键
离子键
共价键
非极性键
极性键
非极性分子
极性分子:结构对称
非极性分子:结构不对称
物质相似相溶原则:
极性分子易溶于极性溶剂中;非极性分子易溶于非极性溶剂中。
例如:
碘(非极性分子)易溶于四氯化碳(非极性分子),但是在水(极性分子)中溶解度很小。练习:下列物质中,
A、KF
B、H2O
C、N2
D、F2
E、CS2
F、CaCl2、
G、CH4
H、CCl4 I、CO2
非极性分子:
极性分子:
下列说法是否正确?并举例说明:
?①含有离子键的化合物一定是离子化合物
?②含有共价键的化合物一定是共价化合物
?③全部由非金属元素组成的化合物一定是共价化合物
?④含金属元素的化合物一定是离子化合物
?⑤水溶液电离出阴阳离子的化合物一定是离子化合物
?⑥离子化合物中可能含有非极性共价键
?⑦在气态单质分子里一定有共价键
?⑧离子化合物一定是电解质;共价化合物中不存在离子键
9、非金属原子间不可能形成离子键。
10、由非极性键构成的物质一定是非极性分子
11、由极性键构成的物质一定是极性分子
答案:1、正确2、错,如:NaOH Na2SO4 3、错,如NH4Cl 等铵盐
4、错,如AlCl3
5、错,如:HCl ,H2SO4 等酸
6、正确,如:Na2O2
7、错,如:He 、Ne等稀有气体
8、正确
9、错,如铵盐:NH4Cl 10、正确,如H2 ,O2,P4
11、错,由极性键构成对称分子是非极性分子。如:CO2,CH4,CCl4
三、分子间作用力:
一、分子间作用力
概念:分子间存在的将分子聚集在一起的作用力称
为分子间作用力,又称为范德华力。
(1)存在:分子间
(2)强弱:比化学键弱
(3)主要影响物质的物理性质(熔沸点)
三、化学键与分子间作用力
卤素单质的熔、沸点与
相对分子质量的关系
四卤化碳的熔沸点与4相对分子质量的关系
分子间的作用力强弱(范德华力)
结论:组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。 练习 1、比较下列物质的沸点高低
HCl HBr HI
2、下列物质变化时,需克服的作用力不属于化学键的是 A 、HCl 溶于水 B 、 I2升华
C 、 H2O 电解
D 、 烧碱熔化
-150-125
-100-75-50-2502550
75100沸点/℃
一些氢化物的沸点
CH 4 SiH 4
GeH 4SnH 4
NH 3 PH 3 AsH 3
SbH 3
H 2O H 2S H 2Se H 2Te HF HCl HBr
HI
沸点如何变化?
二、氢键
1.氢键是一种特殊的分子间作用力,不是化学键
2.强弱:比化学键弱而比范德华力强
3.氢键的表示方法:X —H …Y
X 、Y 可以相同,也可以不同,(主要F 、O 、N)。
氢键对物质性质的影响
⑴氢键的存在使物质的熔沸点相对较高(如HF 、H 2O )。
(3)解释一些反常现象:如水结成冰时,为什么体积会膨胀。
(2)氢键的形成使某些物质在水中的溶解度增大(如NH 3溶于水)
练习:1、化学反应的实质 (1)化学键的形成 化学键的形成与 有关,主要通过两个方面来实现。 ①原子的价电子间的 ——离子键。 ②原子的价电子间的 ——共价键。 (2)化学反应的本质 反应物分子内 和产物分子中______ 。 2、分子间作用力和氢键 (1)分子间作用力 ①定义: 的作用力,又称 。 ②特点 a .分子间作用力比化学键 得多,它主要影响物质的 、 等物理性质,而化学键主要影响物质的化学性质。
b .分子间作用力存在于由共价键形成的多数 和绝大多数气态、液态、固态非金属 分子之间。但像二氧化硅、金刚石等由共价键形成的物质,微粒之间 分子间作用力。
③变化规律 一般说来,对于组成和结构相似的物质,相对分子 质量越大,分子间作用力 ,物质的熔、沸点 也 。例如,熔、沸点:I2 Br2 Cl2 F2。 (2)氢键 ①定义:分子间存在着一种比分子间作用力 的相互作用。 ②形成条件 除H 外,形成氢键的原子通常是 、 、 。 ③存在 氢键存在广泛,如蛋白质分子、H2O 、NH3、HF 等 分子之间。分子间氢键会使物质的熔点和沸点 。
四、晶体。
定义:由结晶物质构成的、其内部的构造质点(如原子、分子)呈平移周
期性规律排列的固体。
特性:(1)晶体拥有整齐规则的几何外形,即晶体的自限性。
(2)晶体拥有固定的熔点,在熔化过程中,温度始终保持不变。
金属晶体
金属阳离子
自由电子
课练17化学键 基础练 1.下列物质中,既含有离子键又含有极性共价键的是() A.NH4H B.Mg3N2 C.NH3D.Na2O2 2.下列表达正确的是() 3.短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是() A.Z2Y B.X2Y2 C.Z2Y2D.ZYX 4.下列变化需克服相同类型作用力的是() A.碘和干冰的升华B.Na2O2和C60的熔化 C.氯化氢和氯化钾的溶解D.溴的汽化和NH4Cl的加热分解 5.下列各图中的大黑点代表原子序数从1~18号元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是() A B C D NH3C2H4CCl4CO2 6.下列说法正确的是() ①在水中氢、氧原子间的作用力均为化学键②金属和非金属化合时一定形成离子键③根据电离方程式HCl===H++Cl-,判断HCl分子内存在离子键④H2分子和Cl2分子的反应过程是H2、Cl2分子内共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程 A.①②④B.都不正确 C.④D.① 7.短周期三种元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子最外层电子数之和为14,且X、Y和Z的电子数之和为26,下列有关推测正确的是
() A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物X2Z D.XYZ3是一种离子化合物,且Y与Z可形成共价化合物YZ3 8.(1)请用下列10种物质的序号填空: ①O2②H2③NH4NO3④K2O2⑤Ba(OH)2⑥CH4⑦CO2⑧NaF ⑨NH3⑩I2 只有离子键的是________;只有共价键的是________。 (2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为离子化合物CaF2,其电子式为________;若XY2为共价化合物CS2,其结构式为________________。 (3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃(2.02×103 Pa),但在180 ℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是______________________。 (4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题: ①元素的原子间反应最容易形成离子键的是________(填序号,下同),最容易形成共价键的是________; A.c和f B.b和g C.d和g D.b和e ②写出a~g 7种元素形成的所有原子都满足最外层8电子结构的任意一种分子的化学式________________。 9.原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W 与氢元素可组成共价化合物XH3、H2Z和HW;Y与氧元素可组成离子化合物Y2O 和Y2O2。 (1)写出Y2O2的化学式________________________,其中含有的化学键是________________。 (2)X、Z、W三种元素的最高价氧化物对应的水化物酸性最强的是____________________(填写化学式)。 (3)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是______________________(填写化学式),生成物属于________(填“离子”或“共价”)化合物。 (4)写出下列物质的电子式: ①XW3:________;②Y2Z:________。 (5)X的气态氢化物的结构式:________。 10.A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、
化学键理论概述(作业) 7-1从电负性数据判断下列化合物中哪些是离子化合物?哪些是共价化合物? NaF ; AgBr ; RbF ; HI ; CuI ; HBr ; CsCl ; 答:题设元素的鲍林电负性为: 根据化学键理论,如果要生成离子键,成键原子的元素电负性差异必须大于1.7(即:离子百分数大于50%),反之只能形成共价键。而离子化合物是由离子键形成的化合物,共价化合物是由共价键形成的化合物,故可以通过判断化合物中化学键的类型判断化合物是离子护额合物还是共价化合物。其判断结果如下: 物质类型判断表 7-2.试证明立方晶系AB 型离子晶体配位数为4和配位数为8的介稳定状态中r + /r -分别为0.225和0.732。 证明:如果晶体处于介稳定状态,则离子间全接触(同号和异号之间皆接触); (1)在配位数为4的立方晶体中, ∠ACB= cos109.5° 5 .109cos ))((2)()()2(5 .109cos )()(2)()() (2;2 2 2 2 2 2 -+-+-+-+-- -+++++++=?++=?= +==r r r r r r r r r BC AC AC BC AB r AB r r AC BC 根据余弦定律: 225 .015 .109cos 11=-+=- + r r 7-4.根据已知的下列数据,由伯恩-哈伯循环计算BaCl 2的Δf H m 0;
氯分子的解离能:242kJ·mol-1;钡的升华热:193kJ·mol-1; 钡的第一电离能:503kJ·mol-1;钡的第二电离能:965kJ·mol-1; 氯的电子亲和能:349kJ·mol-1;氯化钡的晶格能:2027kJ·mol-1; 解:根据化学热力学理论,物质的生成焓是指:在标准态下,由稳定单质生成1mol纯化合 物的热效应。对于BaCl 2的Δ f H m 0对于的反应为: Ba(s)+ Cl 2(g)=BaCl 2 (s) 根据离子键理论,晶格能的定义为:在标准状态下,将1mol离子晶体拆散为气态阳离子和气态阳离子所需要的能量.对于BaCl 2 为: BaCl 2 (s)=Ba2+(g)+ 2Cl-(g) 根据化学热力学由原理设计如下伯恩-哈伯循环。 f H0 = -U + (S + D + I + 2E) = -2027 +[193+242+503+965+2×(-)349] = -822.00 kJ· mol-1; 答:由伯恩-哈伯循环计算BaCl 2的Δ f H m 0为-822.00 kJ·mol-1; 7-8.简述价层电子对互斥理论的主要内容,试用价层电子对互斥理论判断下列分子或离子的空间构型。 BeCl2;BCl3;NH4+;H2O;ClF3;PCl5;I3-;ICl4-; ClO2-;PO43-;CO2;SO2;NOCl;POCl3; 解:价层电子对互斥理论的主要内容有:对于ABm型分子,分子的几何构型与中心原子A 的价层电子对构型有关。其中,中心原子的价层电子对数、电子对的性质(成键电子、孤对电子)、电子对之间的夹角等决定其几何构型。分子的稳定构型是价层电子对构型中斥力最小的构型。 根据价层电子对互斥理论,题设分子或离子的空间构型为: (1)对于BeCl2分子; 中心Be的价层电子对数=(2+2×1)/2=2, 其中成键电子对数=2;故孤对电子对数=2-2=0 所以分子的空间构型为直线型。 (2)对于BCl3分子; 中心B的价层电子对数=(3+3×1)/2=3, 其中成键电子对数=3;故孤对电=0 所以分子的空间构型为平面正三角形; (3)对于NH4+分子;
化学键知识点总结和考点例析本部分知识主要包含:化学键的定义、化学键的比较、原子的电子式、简单阴阳离子的电子式、原子团的电子式、离子化合物的电子式、共价化合物的电子式、离子间的形成、共价键的形成、结构式的书写、极性键与非极性键的比较、分子的极性、键的极性与分子极性的关系等知识。主要的知识点是: 1、使离子或原子相结合的作用力通称为化学键。化学键是强烈的相互作用,所谓“强烈”是指原子间存在电子的转移,即共用电子对的偏移或电子的得失。 2、原子的电子式: 常把其最外层电子数用小黑点“·”或小叉“×”来表示。 4、简单阳离子的电子式:简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子符号表示,如Na+、Li+、Ca2+、Al3+等。 5、原子团的电子式:书写原子团的电子式时,不仅要画出各原子最外层电子数,而且还应用括号“[]”括起来,并在右上角标出“n—”或“n+”电荷字样。 6、离子化合物的电子式:在离子化合物的形成过程中,活泼的金属离子失去电子变成金属阳离子,活泼的非金属离子得到电子变成非金属阴离子,然后阴阳离子通过静电作用结合成离子键,形成离子化合物。所以,离子化合物的电子式是由阳离子和带中括号的阴离子组成,且简单的阳离子不带最外层电子,而阴离子要标明最外层电子多少。
7、共价化合物的电子式:在共价化合物中,原子之间是通过共用电子对形成的共价键的作用结合在一起的,所以本身没有阴阳离子,因此不会出现阴阳离子和中括号。 8、离子键的形成:原子在参加化学反应时,都有通过得失电子或形成共用电子对使自己的结构变成稳定结构的倾向。 9、共价键的形成:从氯原子和氢原子的结构分析,由于氯和氢都是非金属元素,这两种元素的原子获得电子难易的程度相差不大,原子相互作用的结果是双方各以最外层的一个电子组成一个电子对,电子对为两个原子所共用,在两个原子核外的空间运动,从而使双方最外层都达到稳定结构,这种电子对,就是共用电子对。共用电子对受两个核的共同吸引,使两个原子结合在一起。我们把这种原子间通过共用电子对所形成的相互作用称为共价键。 10、非极性键与极性键的比较: 11、极性分子:非极性分子:正负电荷中心重合的分子称为非极性分子。例如:X2型双原子分子(如H2、Cl2、Br2等)、XYn型多原子分子中键的极性互相抵消的分子(如CO2、CCl4等)都属非极性分子。极性分子:正负电荷中心不重合的分子称为极性分子。例如
高三物理第一轮复习《机械振动和机械波》 一、机械振动: (一)夯实基础: 1、简谐运动、振幅、周期和频率: (1)简谐运动:物体在跟偏离平衡位置的位移大小成正比,并且总指向平衡位置的回复力的作用下的振动。 特征是:F=-kx,a=-kx/m (2)简谐运动的规律: ①在平衡位置:速度最大、动能最大、动量最大;位移最小、回复力最小、加速度最小。 ②在离开平衡位置最远时:速度最小、动能最小、动量最小;位移最大、回复力最大、加速度最大。 ③振动中的位移x 都是以平衡位置为起点的,方向从平衡位置指向末位置,大小为这两位置间的直线距离。加速度与回复力、位移的变化一致,在两个“端点”最大,在平衡位置为零,方向总是指向平衡位置。 ④当质点向远离平衡位置的方向运动时,质点的速度减小、动量减小、动能减小,但位移增大、回复力增大、加速度增大、势能增大,质点做加速度增大减速运动;当质点向平衡位置靠近时,质点的速度增大、动量增大、动能增大,但位移减小、回复力减小、加速度减小、势能减小,质点做加速度减小的加速运动。 ④弹簧振子周期:T= 2 (与振子质量有关,与振幅无关) (3)振幅A :振动物体离开平衡位置的最大距离称为振幅。它是描述振动强弱的物理量, 是标量。 (4)周期T 和频率f :振动物体完成一次全振动所需的时间称为周期T,它是标量,单位是秒;单位时间内完成的全振动的次数称为频率,单位是赫兹(Hz )。周期和频率都是描述振动快慢的物理量,它们的关系是:T=1/f. 2、单摆: (1)单摆的概念:在细线的一端拴一个小球,另一端固定在悬点上,线的伸缩和质量可忽略,线长远大于球的直径,这样的装置叫单摆。 (2)单摆的特点: ○ 1单摆是实际摆的理想化,是一个理想模型; ○ 2单摆的等时性,在振幅很小的情况下,单摆的振动周期与振幅、摆球的质量等无关; ○3单摆的回复力由重力沿圆弧方向的分力提供,当最大摆角α<100 时,单摆的振动是简谐运动,其振动周期T= g L π 2。 (3)单摆的应用:○1计时器;○2测定重力加速度g=2 24T L π. 3、受迫振动和共振: (1)受迫振动:物体在周期性驱动力作用下的振动叫受迫振动,其振动频率和固有频率无关,等于驱动力的频率;受迫振动是等幅振动,振动物体因克服摩擦或其它阻力做功而消耗振动能量刚好由周期性的驱动力做功给予补充,维持其做等幅振动。 (2)共振:○1共振现象:在受迫振动中,驱动力的频率和物体的固有频率相等时,振幅最大,这种现象称为共振。 ○ 2产生共振的条件:驱动力频率等于物体固有频率。○3共振的应用:转速计、共振筛。 4、简谐运动图象: (1)特点:用演示实验证明简谐运动的图象是一条正弦(或余弦)曲线。 (2)简谐运动图象的应用: ①可求出任一时刻振动质点的位移。 ②可求振幅A :位移的正负最大值。 ③可求周期T :两相邻的位移和速度完全相同的状态的时间间隔。 ④可确定任一时刻加速度的方向。 ⑤可求任一时刻速度的方向。 ⑥可判断某段时间内位移、回复力、加速度、速度、动能、势能的变化情况。 πm K
1.(全国II卷理综,9,6分)某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63.下列叙述中错误的是 A.它是副族元素 B.它是第六周期元素 C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子 1.答案:D 解析:(排除法)相对原子质量为152.0,近似认为该元素的平均质量数为152,质子数为63,平均中子数为89,该元素只存在两种天然同位素,且在自然界它们的含量相近,两种同位素分子的中子数一个比89多,一个比89少,二者与89的差值的绝对值相等,D错。 要点1:质量数等于质子数和中子数之和。 要点2:两种同位素原子的质量数与平均值比较,越接近平均数的原子其原子个数百分比(丰度)越大。 2.(广东化学,1,3分)我国稀土资源丰富。下列有关稀土元素144 Sm 62 与150 Sm的说法正确的是 62 A. 144 Sm与15062Sm互为同位素 B. 14462Sm与15062Sm的质量数62 相同 C. 144 Sm与15062Sm是同一种核素 D. 14462Sm与15062Sm的核外电62 子数和中子数均为62 2.答案:A 解析:质子数相同,中子数不同的核素称为同位素,具有一定数目质子数和中子数的原子称为核素。144 Sm与15062Sm质量数不同,B错;14462Sm 62 与150 Sm是不同核素,C错;14462Sm与15062Sm的中子数不同,D错。 62 要点1:核素(A X):具有一定数目质子数(Z)和中子数(N=A-Z)的原 Z 子称为核素。
要点2:同位素:质子数(左下角Z )相同,质量数(左上角A )不同的同一元素的不同核素互称同位素。 要点3:核素的量的关系:质量数(左上角A )=质子数(左下角Z )+中子数(N)。 3.(江苏化学,2,3分)下列有关化学用语使用正确的是 A. 硫原子的原子结构示意图: B .NH 4Cl 的电子式: C .原子核内有10个中子的氧原子 O 18 8 D .对氯甲苯的结构 简式: 3.答案:C 【解析】A 项: 所以A 项错误,B 项:4NH Cl 是由4NH +和离子构成,由于Cl -是阴离子,必须写出电子式 ;C 项:18 8O 表示质量数为18,质子数 为8的氧原子,所以该原子核内有10个中子,D 项:该结构简式是邻氯甲苯,因为氯原子和甲基的位置在相邻的碳原子上,对氯甲苯中的氯原子和甲基的位置应该处于相对位置。 要点1:熟记1~20号原子的原子结构结构示意图,阴离子的结构示意图与对应的原子结构示意图比较最外层电子数发生了变化,阴离子带几个单位的负电荷,最外层电子数就加上几;阳离子的结构示意图与对应的原子结构示意图比较最外层电子数发生了变化,;阳离子带
离子键 一离子键与离子化合物 1.氯化钠的形成过程: 2.离子键 (1)概念:带相反电荷离子之间的相互作用称为离子键。 (2)实质: (3)成键微粒:阴、阳离子。 (4)离子键的形成条件:离子键是阴、阳离子间的相互作用,如果是原子成离子键时,一方要容易失去电子,另一方要容易得到电子。 ①活泼金属与活泼的非金属化合时,一般都能形成离子键。如第IA、ⅡA族的金属元素(如Li、Na、K、Mg、Ca等)与第ⅥA、ⅦA族的非金属元素(如O、S、F、Cl、Br、I等)化合时,一般都能形成离子键。 ②金属阳离子与某些带负电荷的原子团之间(如Na+与OH-、SO4-2等)形成离子键。 ③铵根离子与酸根离子(或酸式根离子)之间形成离子键,如NH4NO3、NH4HSO4。 【注意】①形成离子键的主要原因是原子间发生了电子的得失。 ②离子键是阴、阳离子间吸引力和排斥力达到平衡的结果,所以阴、阳离子不会无限的靠近,也不会间距很远。 3.离子化合物 (1)概念:由离子键构成的化合物叫做离子化合物。 (2)离子化合物主要包括强碱[NaOH、KOH、B a(O H)2等]、金属氧化物(K2O、Na2O、
MgO 等)和绝大数盐。 【注意】离子化合物中一定含有离子键,含有离子键的化合物一定是离子化合物。 二 电子式 1.电子式的概念 在元素符号周围,用“· ”或“×”来表示原子的最外层电子的式子叫电子式。 (1)原子的电子式:元素周围标明元素原子的最外层电子,每个方向不能超过2个电子。当最外层电子数小于或等于4时以单电子分步,多于4时多出部分以电子对分布。例如: (2)简单阳离子的电子式:简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示,如: Na +、Li +、Mg +2、Al +3等。 (3)简单阴离子的电子式:不但要画出最外层电子数,而且还应用括号“[ ]”括起来,并在右上角标出“- n ”电荷字样。例如:氧离子 、氟离子 。 (4)多原子离子的电子式:不仅要画出各原子最外层电子数,而且还应用括号“[ ]”括 起来,并在右上角标出“-n ”或“+ n 电荷字样。例如:铵根离子 氢氧根离子 。 (5)离子化合物的电子式:每个离子都要单独写,而且要符合阴阳离子相邻关系,如MgCl 2要写成 ,不能写成,也不能写成 。 2.用电子式表示离子化合物的形成过程 例如:NaCl 的形成过程:; Na 2O 的形成过程: CaBr 2的形成过程: F
第三节化学键第1课时 知识与技能 1.掌握离子键的概念。 2.掌握离子键的形成过程和形成条件,并能熟练地用电子式表示离子化合物的形成过程。 过程与方法 1.通过对离子键形成过程的教学,培养学生抽象思维和综合概括能力; 2.通过电子式的书写,培养学生的归纳比较能力,通过分子构型的教学培养学生的空间想像能力。 情感、态度与价值观 1.培养学生用对立统一规律认识问题。 2.通过对离子键形成过程的分析,培养学生怀疑、求实、创新的精神。 3.培养学生由个别到一般的研究问题的方法。从宏观到微观,从现象到本质的认识事物的科学方法。 教学重点 1.离子键和离子化合物的概念 2.用电子式表示离子化合物的形成过程。 教学难点 用电子式表示离子化合物的形成过程 教具准备 多媒体课件、投影仪、盛有氯气的集气瓶、金属钠、小刀、滤纸、镊子、铁架台、石棉网、酒精灯、火柴。 教学过程 [新课导入] 化学键:(1)定义:使离子相结合或原子相结合的作用力通称化学键。 (2)化学反应的本质:反应物分子内旧化学键的断裂和产物分子中新化学键的形成 离子键 (3)化学键的类型共价键 金属键 一.离子键 【实验1—2】 操作取绿豆大的金属钠(切去氧化层)用滤纸吸净煤油放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方(如图1—10) 现象钠在氯气中燃烧,产生白烟 化学方程式2Na +Cl2点燃 2NaCl 【图1—10】 解释:Na原子与Cl原子化合时,Na失去一个电子Cl原子得到一个电子达到8电子的稳定
定结构,因此,Na原子的最外层的1个电子转移到Cl原子的最外电子层上,形成带正电荷的钠离子和带负电荷的氯离子,阴阳离子通过静电作用结合在一起。 【图1—11】NaCl离子键的形成 1.定义:把带相反电荷离子之间的相互作用称为离子键。 实质:静电作用(包含吸引和排斥) 2.离子键的判断: (1)第IA、ⅡA 族的活泼金属元素 之间所形成的化学键是离子键[Na2O、MgCl2等] 第ⅥA、ⅦA 族的活泼非金属元素 (2)带正、负电荷的原子团之间形成的化学键——离子键。[(NH4)2SO4、NaOH、NH4Cl、Mg(NO3)2等] 3.决定强弱的因素:①离子电荷数:离子电荷越多,离子键越强; ②离子半径:离子半径越小,离子键越强。 4.电子式: (1)电子式:在元素符号周围用小黑点(或×)来表示原子的最外层电子(价电子)的式子叫电子式。 原子:元素符号→标最外层电子数,如: 单核阳离子:阳离子符号即为阳离子的电子式,如:Na+、Mg2+、Al3+写法: 单核阴离子:元素符号→最外层电子数→[ ]→标离子电荷数 如: 原子团的阴阳离子:原子团→最外层电子→[ ]→标离子电荷数 (2)用电子式表示离子键的形成: NaCl 离子键的形成:MgBr2离子键的形成: (3)用电子式表示离子化合物: N 3– Mg N H O F Cl S 2– F
高中化学必修2知识点归纳总结 第一章物质结构元素周期律 第三节化学键 知识点一化学键的定义 一、化学键:使离子相结合或使原子相结合的作用力叫做化学键。相邻的(两个或多个)离子或原子间的强烈 的相互作用。 【对定义的强调】(1)首先必须相邻。不相邻一般就不强烈(2)只相邻但不强烈,也不叫化学键(3)“相互作用”不能说成“相互吸引”(实际既包括吸引又包括排斥) 一定要注意“相邻 ..”和“强烈 ..”。如水分子里氢原子和氧原子之间存在化学键,而两个氢原子之间及水分子与水分子之间是不存在化学键的。 二、形成原因:原子有达到稳定结构的趋势,是原子体系能量降低。 三、类型: 离子键 化学键共价键极性键 非极性键 知识点二离子键和共价键 一、离子键和共价键比较 化学键类型离子键共价键 概念阴、阳离子间通过静电作用所形成的化学键原子间通过共用电子对所形成的化学键 成键微粒阴、阳离子原子 成键性质静电作用共用电子对 形成条件活泼金属与活泼非金属 a.IA、ⅡA族的金属元素与ⅥA、ⅦA族的非 金属元素。 b.金属阳离子与某些带电的原子团之间(如 Na+与0H—、SO42-等)。 非金属元素的原子之间 某些不活泼金属与非金属之间。 形成示例共用电子对 存在离子化合物中非金属单质、共价化合物和部分离子化合物中作用力大小一般阴、阳离子电荷数越多离子半径越小作用 力越强 原子半径越小,作用力越强 与性质的关系离子间越强离子化合物的熔沸点越高。 如:MgO>NaCl 共价键越强(键能越大),所形成的共价分子越 稳定,所形成的原子晶体的熔沸点越高。如稳 定性:H2O>H2S,熔沸点:金刚石>晶体硅实例NaCl、MgO Cl2、HCl、NaOH(O、H之间) 二、非极性键和极性键 非极性共价键极性共价键 概念同种元素原子形成的共价键不同种元素原子形成的共价键, 共用电子对发生偏移 原子吸引电子能力相同不同 共用电子对不偏向任何一方偏向吸引电子能力强的原子 形成条件由同种非金属元素组成由不同种非金属元素组成 通式及示例A—A、A==A、A≡A,如Cl-Cl、C=C、N≡N A—B、A==B、A≡B,如H-Cl、 C=O、C≡N
机械振动和机械波 一、知识结构 二、重点知识回顾 1机械振动 (一)机械振动 物体(质点)在某一中心位置两侧所做的往复运动就叫做机械振动,物体能够围绕着平衡位置做往复运动,必然受到使它能够回到平衡位置的力即回复力。回复力是以效果命名的力,它可以是一个力或一个力的分力,也可以是几个力的合力。 产生振动的必要条件是:a、物体离开平衡位置后要受到回复力作用。b、阻力足够小。 (二)简谐振动 1. 定义:物体在跟位移成正比,并且总是指向平衡位置的回复力作用下的振动叫简谐振动。简谐振动是最简单,最基本的振动。研究简谐振动物体的位置,常常建立以中心位置(平衡位置)为原点的坐标系,把物体的位移定义为物体偏离开坐标原点的位移。因此简谐振动也可说是物体在跟位移大小成正比,方向跟位移相反的回复力作用下的振动,即F=-k x,其中“-”号表示力方向跟位移方向相反。 2. 简谐振动的条件:物体必须受到大小跟离开平衡位置的位移成正比,方向跟位移方向相反的回复力作用。 3. 简谐振动是一种机械运动,有关机械运动的概念和规律都适用,简谐振动的特点在于它是一种周期性运动,它的位移、回复力、速度、加速度以及动能和势能(重力势能和弹性势能)都随时间做周期性变化。 (三)描述振动的物理量,简谐振动是一种周期性运动,描述系统的整体的振动情况常引入下面几个物理量。
1. 振幅:振幅是振动物体离开平衡位置的最大距离,常用字母“A”表示,它是标量,为正值,振幅是表示振动强弱的物理量,振幅的大小表示了振动系统总机械能的大小,简谐振动在振动过程中,动能和势能相互转化而总机械能守恒。 2. 周期和频率,周期是振子完成一次全振动的时间,频率是一秒钟内振子完成全振动的次数。振动的周期T跟频率f之间是倒数关系,即T=1/f。振动的周期和频率都是描述振动快慢的物理量,简谐振动的周期和频率是由振动物体本身性质决定的,与振幅无关,所以又叫固有周期和固有频率。 (四)单摆:摆角小于5°的单摆是典型的简谐振动。 细线的一端固定在悬点,另一端拴一个小球,忽略线的伸缩和质量,球的直径远小于悬线长度的装置叫单摆。单摆做简谐振动的条件是:最大摆角小于5°,单摆的回复力F是重力在 圆弧切线方向的分力。单摆的周期公式是T=。由公式可知单摆做简谐振动的固有周期与振幅,摆球质量无关,只与L和g有关,其中L是摆长,是悬点到摆球球心的距离。g是单摆所在处的重力加速度,在有加速度的系统中(如悬挂在升降机中的单摆)其g应为等效加速度。 (五)振动图象。 简谐振动的图象是振子振动的位移随时间变化的函数图象。所建坐标系中横轴表示时间,纵轴表示位移。图象是正弦或余弦函数图象,它直观地反映出简谐振动的位移随时间作周期性变化的规律。要把质点的振动过程和振动图象联系起来,从图象可以得到振子在不同时刻或不同位置时位移、速度、加速度,回复力等的变化情况。 (六)机械振动的应用——受迫振动和共振现象的分析 (1)物体在周期性的外力(策动力)作用下的振动叫做受迫振动,受迫振动的频率在振动稳定后总是等于外界策动力的频率,与物体的固有频率无关。 (2)在受迫振动中,策动力的频率与物体的固有频率相等时,振幅最大,这种现象叫共振,声音的共振现象叫做共鸣。 2机械波中的应用问题 1. 理解机械波的形成及其概念。 (1)机械波产生的必要条件是:<1>有振动的波源;<2>有传播振动的媒质。 (2)机械波的特点:后一质点重复前一质点的运动,各质点的周期、频率及起振方向都与波源相同。 (3)机械波运动的特点:机械波是一种运动形式的传播,振动的能量被传递,但参与振动的质点仍在原平衡位置附近振动并没有随波迁移。 (4)描述机械波的物理量关系:v T f ==? λ λ 注:各质点的振动与波源相同,波的频率和周期就是振源的频率和周期,与传播波的介质无关,波速取决于质点被带动的“难易”,由媒质的性质决定。 2. 会用图像法分析机械振动和机械波。 振动图像,例:波的图像,例: 振动图像与波的图像的区别横坐标表示质点的振动时间横坐标表示介质中各质点的平衡位置 表征单个质点振动的位移随时间变 化的规律 表征大量质点在同一时刻相对于平衡位 置的位移 相邻的两个振动状态始终相同的质 点间的距离表示振动质点的振动周 期。例:T s =4 相邻的两个振动始终同向的质点间的距 离表示波长。例:λ=8m
考点一:化学键:相邻原子之间强烈的相互作用叫化学键。 化学键的存在:①稀有气体单质中不存在; ②多原子单质分子中存在共价键; ③非金属化合物分子中存在共价键(包括酸); ④离子化合物中一定存在离子键,可能有共价键的存在(Na2O2、NaOH、NH4Cl),共价化合物中不存在离子键; ⑤离子化合物可由非金属构成,如:NH4NO3、NH4Cl 。 1.离子键 1)定义:使阴阳离子结合成化合物的静电作用,叫做离子键。 成键微粒:阴阳离子 相互作用:静电作用(静电引力和斥力) 成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。 2)形成离子键的条件: ①活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间的化合物。 ②活泼的金属元素和酸根离子形成的盐酸根离子:SO42-、NO3-、Cl-等 ③铵盐子和酸根离子(或活泼非金属元素)形成的盐。把NH4+看作是活泼的金属阳离子 ④离子化合物:含有离子键的化合物。 3)离子键的强弱比较 影响因素:离子半径(反比)、电荷数(正比) 比较离子键强弱:KCl与KBr、 Na2O与MgO 决定:稳定性及某些物理性质,如熔点等。 2.共价键 1)定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:原子相互作用:共用电子对 氢分子的形成: 共价键特点:共用电子对不偏移,成键原子不显电性 氯化氢分子的形成: 共价键特点:共用电子对偏向氯原子,氯原子带部分负电荷,氢原子带部分正电荷。 2)形成共价键条件: 同种或不同种非金属元素原子结合; 部分金属元素原子与非金属元素原子,如AlCl3,FeCl3; 3)存在:存在于非金属单质和共价化合物中,也存在于某些离子化合物和原子团中 H2 HCl NaOH NH4Cl Na2O2 SO42- NO3-
高中化学必修2知识点归纳总结 第一章 物质结构 元素周期律 第三节 化学键 知识点一化学键的定义 一、化学键:使离子相结合或使原子相结合的作用力叫做化学键。相邻的(两个或多个)离子或原子间的强烈的相互作用。 【对定义的强调】(1)首先必须相邻。不相邻一般就不强烈 (2)只相邻但不强烈,也不叫化学键 (3)“相互作用”不能说成“相互吸引”(实际既包括吸引又包括排斥) 一定要注意“相邻..”和“强烈..”。如水分子里氢原子和氧原子之间存在化学键,而两个氢原子之间及水分子与水分子之间是不存在化学键的。 二、形成原因:原子有达到稳定结构的趋势,是原子体系能量降低。 三、类型: 离子键 化学键 共价键 极性键 非极性键 知识点二离子键和共价键 一、离子键和共价键比较 二、非极性键和极性键
知识点三离子化合物和共价化合物 通常以晶体形态存在 离子键为主,该化合物也称为离子化合物(3)只有 ..当化合物中只存在共价键时,该化合物才称为共价化合物。(4)在离子化合物中一般既含有金属元素又含有非金属元素;共价化合物一般只含有非金属元素(NH4+例外) 注意:(1)离子化合物中不一定含金属元素,如NH4NO3,是离子化合物,但全部由非金属元素组成。(2)含金属元素的化合物不一定是离子化合物,如A1C13、BeCl2等是共价化合物。 二、化学键与物质类别的关系 、
知识点四电子式和结构式的书写方法 一、电子式: 1.各种粒子的电子式的书写: (1)原子的电子式:常把其最外层电子数用小黑点“·”或小叉“×”来表示。 例如: (2)简单离子的电子式: ①简单阳离子:简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子符号表示,如Na+、Li+、Ca2+、Al3+等。②简单阴离子:书写简单阴离子的电子式时不但要画出最外层电子数,而且还应用括号“[]” 括起来,并在右上角标出“n—”电荷字样。例如:氧离子、氟离子。 ③原子团的电子式:书写原子团的电子式时,不仅要画出各原子最外层电子数,而且还应用括号“[]”括起来,并在右上角标出“n—”或“n+”电荷字样。 例如:铵根离子、氢氧根离子。 (3)部分化合物的电子式: ①离子化合物的电子式表示方法:在离子化合物的形成过程中,活泼的金属离子失去电子变成金属阳离子,活泼的非金属离子得到电子变成非金属阴离子,然后阴阳离子通过静电作用结合成离子键,形成离子化合物。所以,离子化合物的电子式是由阳离子和带中括号的阴离子组成,且简单的阳离子不带最外层电子,而阴离子要标明最外层电子多少。 如:。 ②共价化合物的电子式表示方法:在共价化合物中,原子之间是通过共用电子对形成的共价键的作用结合在一起的,所以本身没有阴阳离子,因此不会出现阴阳离子和中括号。 如: 2.用电子式表示化学反应的实质: (1)用电子式表示离子化合物的形成过程: (2)用电子式表示共价化合物的形成过程: 说明:用电子式表示化合物的形成过程时要注意: (1)反应物要用原子的电子式表示,而不是用分子或分子的电子式表示。用弯箭头表示电子的转移情况,而共价化合物不能标。
达标作业18化学键 [基础题] 1.下列电子式,正确的是() 解析:氯化铵的电子式为,故A错误;溴化铵的电子式为,故B错误;过氧化钠的电 子式为,故C正确;氯化钙的电子式为 ,故D错误。 答案:C 2.下列有关化学用语表示正确的是() A.次氯酸的结构式:H—Cl—O B.氨基的电子式: C.氯离子结构示意图: D.中子数为115、质子数为77的铱(Ir)原子符号为:11577Ir 解析:次氯酸的结构式为H—O—Cl;氯离子结构示意图中原子核内应有17个正电荷;中子数为115,质子数为77的铱原子符号为192 Ir。 77
答案:B 3.如图为元素周期表短周期的一部分,下列有关A、B、C、D 四种元素的叙述中不正确的是() A.A、C两元素形成的化合物都为共价化合物 B.AD2的电子式为 C.B、C形成的化合物BC中所含化学键为非极性共价键 D.B 2的结构式为 解析:根据A、B、C、D四种元素在周期表中的位置可知,A、B、C、D分别为C、N、O、S四种元素。CO、CO2都为共价化合物, A正确;CS2的电子式为,B正确;NO为极性共价键,C错误;N 2的结构式为,D正确。 答案:C 4.下列属于共价化合物的是() A.Cl2B.NaOH C.CH4D.(NH4)2SO4 解析:A项中的Cl2属于单质,不符合题意;B、D两项中的物质属于离子化合物,不符合题意;C项中CH4是由C—H极性共价键构成的共价化合物,符合题意。 答案:C 5.下列物质中既有离子键又有共价键的是() A.MgO B.NH3·H2O C.CaCl2D.(NH4)2SO4 解析:MgO、CaCl2中只含有离子键,NH3·H2O中不含离子键,(NH4)2SO4中既有离子键又有共价键。 答案:D 6.下列有关说法正确的是() ①该组化合物中只含有共价键:H2O、NH4Cl、H2O2;②非金属原子间以共价键结合的物质都是共价化合物;③Na2O、NaOH和Na2SO4为离子化合物,HCl、NH3、H2SO4为共价化合物;④共价化合物是由不同种非金属原子间通过共用电子对形成的;⑤SiO2和CO2中,Si和O、C和O之间都是共价键;⑥离子化合物中一定有金属元素;⑦由阳离子和阴离子结合生成的化合物一定是离子化合物;⑧由两种共价化合物结合生成的化合物一定是共价化合物 A.①②④B.④⑤⑥
化学键知识点<必须掌握的美国AP教材知识点!> 一.化学键: 1.概念:化学键:相邻的原子之间强烈的相互作用. 离子键:存在于离子化合物中 2.分类:共价键:存在于共价化合物中 金属键:存在于金属中 二.离子键: 1.离子化合物:由阴、阳离子相互作用构成的化合物。如NaCl/Na2O/Na2O2/NaOH/Na2SO4等。2.离子键:使阴、阳离子结合成化合物的静电作用。 说明: (1)静电作用既包含同种离子间的相互排斥也包含异种离子间的相互吸引。是阴、阳离子间的静电吸引力与电子之间、原子核之间斥力处于平衡时的总效应。 (2)成键的粒子:阴、阳离子 (3)成键的性质:静电作用 (4)成键条件: ①活泼金属与活泼的非金属化合时,都能形成离子键。如IA、ⅡA族的金属元素(如Li、 Na、K、Mg、Ca等)与ⅥA、ⅦA族的非金属元素(如O、S、F、Cl、Br、I等)之间化合时,一般都能形成离子键。 ②金属阳离子与某些带电荷的原子团之间(如Na+与OH—、SO42—等)、强碱及大多数的盐中 都含有离子键 (5)成键原因: ①原子相互作用,得失电子形成稳定的阴、阳离子; ②离子间吸引与排斥处于平衡状态; ③体系的总能量降低。 (6)存在:离子化合物中一定存在离子键,常见的离子化合物有强碱、绝大多数盐(PbCl2/Pb(CH3COO)2等例外),强的金属的氧化物,如:Na2O/Na2O2/K2O/CaO/MgO等。三.共价键:! 1.概念:原子之间通过共用电子所形成的相互作用。 2.成键粒子:原子(记住必须是原子!) 3.成键性质:共用电子对两原子的电性作用 4.成键条件:同种非金属原子或不同种非金属原子之间,且成键的原子最外层电子未达到饱和状态 5.成键原因:①通过共用电子对,各原子最外层电子数目一般能达饱和,由不稳定变稳定;②两原子核都吸引共用电子对,使之处于平衡状态;③原子通过共用电子对形成共价键后,体系总能量降低。 6.存在范围: ①非金属单质的分子中(除稀有气体外):如O2/F2/H2/C60 ②非金属形成的化合物中,如SO2/CO2/CH4/H2O2/CS2 ③部分离子化合物中,如Na2SO4中的SO42-中存在共价键,NaOH的OH-中存在共价键,NH4Cl中的NH4+存在共价键
化学键 一、化学键 1、概念:化学键是指使离子或原子之间结合的作用。或者说,相邻的原子或原子团强烈的相互作用叫化 学键。 注意:不是所有的物质都是通过化学键结合而成。惰性气体就不存在化学键。 2、分类:金属键、离子键、共价键。 3、意义:①解释绝大部分单质和化合物的形成:绝大部分单质和化合物都是离子或者原子通过化学键的 作用形成的。 ②解释化学变化的本质:化学变化的本质就是反应物化学键的断裂和生成物化学键的形成过程。 原子重新组合就是通过反应物原子间化学键的断裂,然后又重新形成新的化学键的过程。 二、离子键:带相反电荷离子间的相互作用称为离子键。 1、概念:使阴阳离子结合成化合物的静电作用,叫做离子键。 2、成键微粒:阴阳离子 3、本质:静电作用 4、成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。 5、成键条件:活泼金属(IA IIA)与活泼非金属(VIA VIIA)之间的化合物。 6、结果:形成离子化合物。离子化合物就是阴阳离子通过离子键而形成的化合物。离子晶 体就是阴阳离子通过离子键而形成的晶体。 7、范围:典型的金属与典型的非金属之间容易形成离子键。特别是位于元素周期表中左下方的金属与右上方的非金属元素之间。例如:氧化钾、氟化钙、氢氧化钠、硝酸钾、氯化钾 三、共价键: 1、概念:原子通过共用电子对形成的相互作用。 2、本质:静电作用 3、方式:原子间通过共用电子对形成静电作用。 4、条件:非金属元素的原子之间容易形成共价键。 5、结果:形成共价单质或共价化合物。共价单质是指同种元素的原子通过共价键所形成 的单质。共价化合物是由不同种元素的原子通过共价键所形成的化合物。 6、范围:共价单质有H2、B、C、N2、O2、O3、F2、Si、P、S、Cl2、Br2、I2. 共价化合物主要有非金属氢化物、非金属的氧化物、酸、非金属的氯化物。 7、类型:极性键:共用电子对发生偏移的共价键。主要存在于不同元素的原子之间所形成的共价键。如:H-O、C=O、H-C、 非极性键:共用电子对不发生偏移的共价键。主要存在于同种元素的原子之间 所形成的共价键。如:H-H、C-C、C= C、 C C、N N 四、化学键的表示方法——电子式:在元素符号周围用小黑点 · (或×)来表示原子的最外层电子的式子。 1、原子的电子式: 2、离子的电子式:(1)阳离子(直接用离子符号表示) (2)阴离子 练习:写出:溴原子、硅原子;硫离子、鋁离子、钾离子的电子式
【关键字】高三 高三化学一轮练出高分 6.1化学能与热能新人教版1.下列说法中正确的是( ) A.两个原子或多个原子之间的相互作用叫做共价键 B.阴、阳离子间通过静电引力而形成的化学键叫做离子键 C.只有金属元素和非金属元素化合时才能形成离子键 D.大多数的盐、碱和低价金属氧化物中含有离子键 答案 D 解析共价键是原子间通过共用电子对所形成的相互作用,A项不正确;离子键是阴、阳离子间通过静电作用而形成的,是吸引力和排斥力的平衡,B项错误;离子键的形成必须有阴、阳离子,但并不一定是含有金属阳离子,例如铵根阳离子同样可以形成铵盐。 2.下列叙述中,错误的是( ) A.只含非极性键的纯净物一定是单质 B.只含极性键的纯净物一定是化合物 C.只含离子键的纯净物一定存在金属元素 D.纯净物中一定存在化学键 答案 D 解析采用举反例法解答本题。纯净物分单质和化合物,而化合物中一定含有极性键或离子键,不可能只含非极性键,所以,只含非极性键的纯净物一定是单质,如氮气、氧气、氯气等,A选项正确;只含极性键的纯净物如水、甲烷、二氧化硫等都是化合物,B选项正确;离子化合物分两类:一类含金属,如氯化钠、氧化钙等,另一类只含非金属,如铵盐,铵盐含有离子键和共价键,所以只含离子键的纯净物一定不是铵盐,一定含有金属,C选项正确;稀有气体单质属于单原子分子,不含化学键,D选项错误。 3.下列关于化学键的叙述中,正确的是( ) A.共价化合物中可能含离子键,离子化合物中只含离子键 B.离子化合物中可能含共价键,共价化合物中不含离子键 C.构成单质分子的微粒一定含有共价键 D.在氧化钠中,只存在氧离子和钠离子的静电吸引作用 答案 B 解析离子化合物是阴、阳离子通过离子键结合而成的,因此,离子化合物中一定含有离子键。除离子键外,离子化合物中还可能含共价键,如NaOH是由Na+和 OH-结合而成的离子化合物,而OH-中含O-H共价键,在共价化合物中各原子均
偶联剂分子应至少含有两种官能团,第一种官能团在理论上可于增强材料起化学反应,第二种官能团在理论上应能参与树脂的固化反应,与树脂分子链形成化学键结合,于是,偶联剂分子像“桥”一样,将增强材料与基体通过共价键牢固地连接在一起了。 1简介 1949年,Bjorksten和Lyaeger共同提出化学键理论。 关于分子(或晶体)内相邻原子(或离子)间相互结合的理论。按照这种理论,原子(或离子)是以化学键的形式结合成分子(或晶体)的。形成化学键的物理机制是电磁相互作用。 2重要意义 分子中元素原子的电子从一个原子转移到另一个原子而形成正负离子,由电荷相反的正负离子通过其过剩电荷的库伦力彼此吸引形成分子,这种静电库伦力称为离子键;原子间以共享电子对的方式形成分子,这种化学键称为共价键;在通常情况下,共价键共享的电子对分别由两个原子提供,有时共享的电子对则是由一个原子提供的,这样的共价键称为配位共价键;联结金属原子的键称为金属键,金属键的最显著特点是成键电子的流动性,它使金属表现出高度的导电性和导热性;由极性很强的化合物H-X键上的氢原子与另一个键中电负性很大的原子X上的孤立电子相互吸引而形成的分子之间的一种结合力叫氢键。氢键不是化学键,氢键属于分子间作用力。氢键的作用力比范德华力强而比化学键弱。氢键在生理学和蛋白质结构化学上具有重要的意义。 3人类认识 人类对物质结合方式的认识源远流长。在古希腊,恩培多克勒用爱和恨说明物质间的结合和分离,德谟克利特则用原子的漩涡运动说明原子的聚集和分散。中世纪的J.R.格劳伯(1604~1670)提出了物质同类相亲、异类相斥的思想。其后还出现了关于物质结合的亲和力说,认为物质的微粒具有亲和力,由此互相吸引而结合在一起。19世纪初,瑞典化学家J.J.贝采利乌斯(1779~1848)提出了一种建立在正负电相互吸引的观念基础上的电化二元说,从而使亲和力说更加系统化。阐明分子中原子相互作用的经典价键理论是在原子概念基础上形成的。1852年,英国化学家E.弗兰克兰(1825~1899)提出了原子价概念。1857年,德国化学家F.A.凯库勒(1829~1896)提出碳四价和碳链的概念;1865年,他又揭示出苯的环状结构。1874年,荷兰化学家J.H.范霍夫(1852~1911)等提出了碳原子的四个价键向正四面体顶点取向的假说。这是有机化合物的结构理论。 20世纪20年代,在N.H.D.玻尔的原子结构理论的基础上,对价键的实质有了新的认识,形成了原子价的电子理论。该理论包括离子键理论和共价键理论。离子键理论是1916年由美国化学家W.科塞尔(1888~1956)提出的。同年,G.N.刘易斯(1875~1946)提出共价键理论。但这个理论不能解释共价键的方向性、氧分子的顺磁性等,也无法解释两个原子为什么共享一对电子时能相互结合。 1927年,W.H.海特勤和F.伦敦(1900~1954)提出氢分子成键理论。该理论认为两个氢原子结合成一个氢分子由于电子密度的分布集中在两个原子核之间而形成化学键。现代价键理论是将这一成果推广到其他分子体系而形成的。它认为共价键由一对自旋反平行的耦合电子组成,并根据原子轨道最大重叠原理,认为分子中的电子只处于与化学键相连接的两个原子之间的区域内。L.鲍林进而提出共振论对此作了补充。该理论认为分子在若干价键结构间共振。1928年,美国化学家R.S.穆利肯和F.洪德等人提出分子轨道理论,将分子看作一个整体,认为形成化学键的电子在整个分子区域内一定的分子轨道上运动。现代化学键理论是在量子力学的基础上形成的,它使电价理论不能解释的问题获得满意的解释。这种理论目前还在进一步发展中。