
2007,16(4)福建分析测试 Fujian Analysis&Testing
技术交流
离子色谱法测定空气中的氮氧化物和氯化氢含量
杨 泉
(福建省环境监测中心站,福州 350003)
摘 要:阐述了离子色谱法测定空气和废气中氮氧化物、氯化氢的含量的方法与步骤。测定结果显示,氮氧化物和氯化氢的检测限分别为0.08mg/L、0.02mg/L,该方法的回收率分别为96.5%~102.1%,98.5%~103.7%,线性范围分别为0.00-l00mg/L,0.00-100mg/L,是一种简单、快速、可靠测定空气和废气中氮氧化物、氯化氢含量的好方法。
关键词:氮氧化物;氯化氢;离子色谱;空气与废气
中图分类号:O657.75 文献标识码:A 文章编号:1009-8143(2007)04-0037-04
D eterm i n a ti on of N O chem i ca l com pound and hydrochlor i c
i n a i r s am ple by i on chro ma tography
Yang Quan
(Fujian Envir on mentalMonit oring Stati on,Fuzhou350003,China)
Abstract:A method for the deter m inati on of NO chem ical compound and hydr ochl oric in air and exhaust gas by i on chr oma2 t ography is described.The result showed that the detecti on li m its of the method for NO che m ical Compound and hydr ochl o2 ric were0.08mg/L and0.02mg/L;recoveries were96.5%一102.1%and98.5%一103.7%;the linenr ranges were0.00一l00mg/L and0.00一100mg/L.The method is si m p le,rap id and reliable for deter m ining NO che m ical compound and hydr ochl oric in air and exhaust gas.
Keywords:NO che m ical compound;hydr ochl oric;i on chr omat ography;air and exhaust gas
氮氧化物和氯化氢是环境监测中经常遇到的两种化合物,其中氮氧化物的测定方法主要有:盐酸萘乙二胺分光光度法、紫外分光光度法、定电位电解法、非分散红外吸收法等。氯化氢的测定方法主要有:硫氰酸汞分光光度法、硝酸根容量法、离子色谱法等[1~3]。用离子色谱法同时测定空气和废气中的氮氧化物和氯化氢却未见报道,本文探讨了将两种物质同时收集于一个吸收液中,用离子色谱法同时测定氮氧化物和氯化氢,该方法的灵敏度、精密度和准确度可满足日常监测的要求,在环境监测中具有很强的实用性。
1 实验部分1.1 仪器及试剂
离子色谱主机:DX-120型离子色谱仪
去离子水:电导<1μS/c m。凡进入离子色谱仪的水,需经过0.45μm微孔滤膜过滤。
氢氧化钾-碳酸钠混合吸收液:0.089K OH-0.12mol/L Na2CO3,称取5.0g氢氧化钾和12.72g 无水碳酸钠,溶解于水,稀释至1000m l。淋洗液(0. 00178mol/L K OH-0.0024mol/L Na2CO3):由1份吸收液加49份水配制。
硝酸盐标准储备液:1.000mg/ml,称取1.3780g硝酸钠(优级纯,105℃烘干2h),溶解于水,移入1000ml容量瓶中,加入10.00ml淋洗储备液,用水稀释至标线。
收稿日期:2007-1-11
作者简介:杨泉(1971~),男,高级工程师,从事环境监测工作。E-mail:muyibaishui@https://www.doczj.com/doc/626167529.html,.
73
福建分析测试 技术交流 2007,16(4)
亚硝酸盐标准储备液:1.000mg/m l,称取1. 4997g亚硝酸钠(优级纯,干燥器中干燥24h),溶解于水,移入1000m l容量瓶中,加入10.00m l淋洗储备液,用水稀释至标线。
氯化钾标准储备溶液:称取2.103g氯化钾(优级纯,110℃烘干2h),溶解于淋洗液,移入1000m l 容量瓶中,加入10.00m l淋洗储备液,用水稀释至标线。
三种阴离子混合标准使用液:配制含有硝酸根100mg/L、亚硝酸根50mg/L、氯离子100mg/L的混合标准使用液,分别吸取100.0m l硝酸盐标准储备液、50.0m l亚硝酸盐标准储备液及100.0m l氯化钾标准储备溶液于1000m l容量瓶中,加入10.00m l淋洗储备液,用水稀释至标线。酸性高锰酸钾溶液:称取25g高锰酸钾,稍微加热使其全部溶解于500m l水中,然后加入1mol/L硫酸溶液500m l,混匀,贮于棕色试剂瓶中。
1.2 样品采集 取两支各装10.0m l吸收液的多孔玻板吸收瓶和一支内装50.0m l的酸性高锰酸钾溶液的氧化瓶(柱液不低于80mm),用尽量短的聚四氟乙烯软管将氧化瓶串联在两支吸收瓶之间,以0. 4L/m in流量,采样60m in。采样口加盖0.3μm微孔滤膜过滤,样品、吸收液、淋洗液均应通过0. 45μm微孔滤膜过滤。
1.3 色谱条件
淋洗使用液浓度:0.00178mol/L K OH-0.0024mol/L Na2CO3,流速:1.20m l/m in,进样量:10. 0μl。
1.4 样品的分析
将两个吸收管中的样品溶液分别移入50m l具
塞比色管中,用水稀释至标线,摇匀。在与绘制校准曲线相同条件下测定。离子色谱法测定NO-
3
和NO-2是利用离子交换原理进行分离,由抑制柱抑制淋洗液,扣除背景电导,再利用电导检测器进行测
定,根据NO-
3
、NO-
2
和CL-的保留时间定性,峰高或峰面积定量。以去离子水代替上述样品,用完全
相同的步骤进行色谱分析。分别计算NO-
3
、NO-
2的含量(以NO
2
计)和CL-的含量(以HCL计),除以采样标准体积后即得出氮氧化物和氯化氢的含量。
2 结果与讨论
2.1 分离度实验
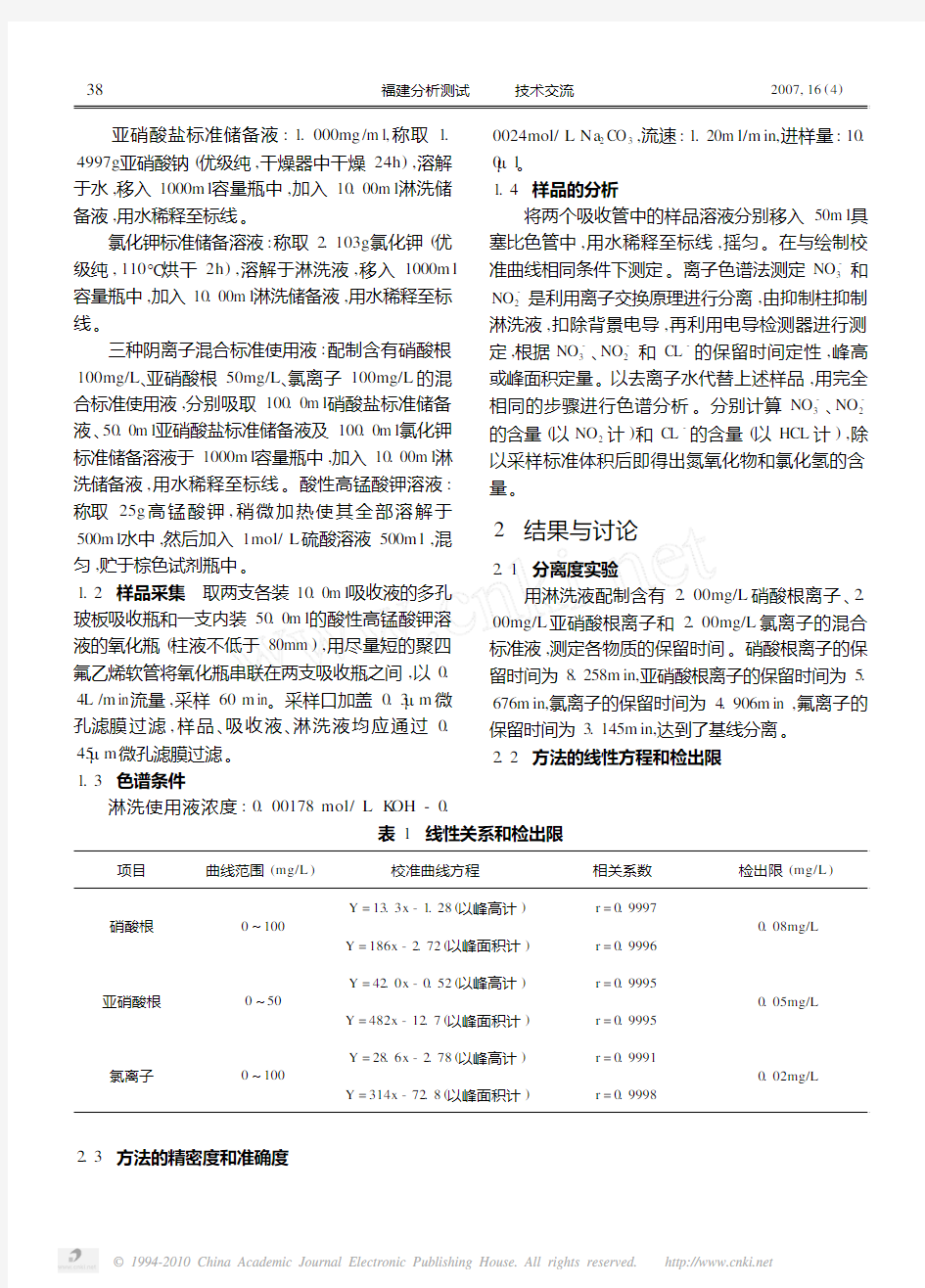
用淋洗液配制含有2.00mg/L硝酸根离子、2. 00mg/L亚硝酸根离子和2.00mg/L氯离子的混合标准液,测定各物质的保留时间。硝酸根离子的保留时间为8.258m in,亚硝酸根离子的保留时间为5. 676m in,氯离子的保留时间为4.906m in,氟离子的保留时间为3.145m in,达到了基线分离。
2.2 方法的线性方程和检出限
表1 线性关系和检出限
项目曲线范围(mg/L)校准曲线方程相关系数检出限(mg/L)硝酸根0~100
Y=13.3x-1.28(以峰高计)r=0.9997
Y=186x-2.72(以峰面积计)r=0.9996
0.08mg/L
亚硝酸根0~50
Y=42.0x-0.52(以峰高计)r=0.9995
Y=482x-12.7(以峰面积计)r=0.9995
0.05mg/L
氯离子0~100
Y=28.6x-2.78(以峰高计)r=0.9991
Y=314x-72.8(以峰面积计)r=0.9998
0.02mg/L 2.3 方法的精密度和准确度
83
2007,16(4)杨 泉:离子色谱法测定空气中的氮氧化物和氯化氢含量
表2 硝酸根离子样品测定结果(n=6)
样品号测定值
(mg/L)
加标量
(mg/L)
回收值
(mg/L)
回收率
(%)
RS D
(%)
1 22.88
42.5
2.00
20.0
4.72
63.8
97.8
102.1
1.9
1.6
表3 亚硝酸根离子样品测定结果(n=6)
样品号测定值
(mg/L)
加标量
(mg/L)
回收值
(mg/L)
回收率
(%)
RS D
(%)
1 21.12
22.5
2.00
20.0
3.01
42.2
96.5
99.2
3.2
2.6
表4 氯离子样品测定结果(n=6)
样品号测定值
(mg/L)
加标量
(mg/L)
回收值
(mg/L)
回收率
(%)
RS D
(%)
1 2
5.42
52.5
2.00
20.0
7.31
75.2
98.5
103.7
2.2
1.7表5 离子色谱法和盐酸萘乙二胺分光光度法测定氮氧化物的结果比较
样品号离子色谱法(mg/m3)盐酸萘乙二胺分光光度法(mg/m3)相对偏差(%)
11.361.273.4
217.216.32.7表6 离子色谱法和硫氰酸汞分光光度法测定氯化氢的结果比较
样品号离子色谱法(mg/m3)硫氰酸汞分光光度法(mg/m3)相对偏差(%)
18.568.212.1
266.665.21.1
由表2一表6可见,方法的精密度和准确度良好,同盐酸萘乙二胺分光光度法测定氮氧化物和硫氰酸汞分光光度法测定氯化氢的结果相近。
3 讨论
3.1 由于硝酸根离子在碱性条件下较稳定,同时碱性条件也利于被测组分的吸收,因此在样品采集和保存过程中溶液要始终保持碱性,经筛选后选择氢氧化钾-碳酸钠作为吸收液。
3.2 吸收液浓度是淋洗液浓度的50倍,故样品溶液在测定前须稀释50倍,使其中氢氧化钾、碳酸钠浓度与淋洗液浓度接近,减少测定误差。当测定低浓度样品时,可直接采用淋洗液作为吸收液。
3.3 氧化瓶和吸收瓶之间不可用乳胶管连接,应用聚四氟乙烯软管连接,连接管应尽量短,以减少采集气体与连接管的接触,防止被测组分被吸附。
3.4 吸收液应避光且不能长时间暴露在空气中,以防止吸收空气中的氮氧化物和氯化氢而使空白值增高;吸收管、连接管及各器皿均应仔细洗涤;操作中注意防止自来水及空气微尘中氯化物的干扰;进样时手勿接触注射器内筒。
3.5 当氧化管中有明显沉淀物析出时,应及时更换。
3.6 任何与硝酸根离子、亚硝酸根离子、氯离子保
93
福建分析测试 技术交流 2007,16(4)留时间接近的物质均干扰测定。采用前处理步骤、淋洗液配制标准试剂、适当稀释待测样品或加入标准物质等方法可以消除干扰。
3.7 氮氧化物包括一氧化氮和二氧化氮。采样
时,二氧化氮首先被第一管吸收液吸收,一氧化氮不会被吸收,经过高锰酸钾氧化管,把一氧化氮氧化为二氧化氮,再通过第二管吸收液被吸收,试验证明二氧化氮和氯化氢绝大多数被第一管吸收液吸收,只有极少量的通过第二管吸收液被吸收;分
别测定两管吸收液中的NO -3和NO -2的含量(以NO 2计),两者之和除以采样体积即为氮氧化物的
含量。
4 结论
本文探讨了用离子色谱法同时监测空气和废气中的氮氧化物和氯化氢的方法,当采样体积为24升时,该方法测定氮氧化物的检出限为0.03mg/
m 3
,方法的回收率为96.5%-102.1%,相对标准偏
差为1.6%一3.2%;氯化氢的检出限为0.01mg/m 3
,方法的回收率为98.5%-103.7%,相对标准偏
差为1.7%一2.2%。方法的灵敏度、精密度和准确度可满足空气和废气中的氮氧化物和氯化氢监测的要求,是实际工作中较为可靠实用的监测方法。
参考文献
[1]国家环境保护总局(水和废水监测分析方法)编委会.水
和废水监测分析方法(第四版)〔M 〕.北京:中国环境科学出版社,2002:156~161,258~271.
[2]国家环境保护总局(空气和废气监测分析方法)编委会.
空气和废气监测分析方法(第四版)〔M 〕.北京:中国环境科学出版社,2003:126~132,190~192,464~481.
[3]汪霄,颜志明.离子色谱法测定空气中的甲酸和氯化氢
含量[J ].中国环境监测,2004,20(2):24,36.
欢迎来稿 欢迎订阅《福建分析测试》
04
_ 一、实验目的与要求 1、掌握氮氧化物测定的基本大气中氮氧化物的原理和方法。 2、绘制实验室空气中氮氧化物的日变化曲线。 3、了解并掌握大气中氮氧化物的有关知识。 二、实验方案 1、实验仪器 (1)大气取样器;(2)分光光度计;(3)棕色多孔玻板吸收管;(4)双球玻璃管;(5)比色管;(6)移液管。 2、实验药品 (1)吸收原液标准液;(2)吸收原液;(3)蒸馏水。 3、实验原理 主要反应方程式为: 4、实验步骤 1)氮氧化物的采集 用一个内装5mL采样液用吸收的多孔玻板吸收管,接上氧化管,并使管口微向下倾斜,朝上风向,避免潮湿空气将氧化管弄湿,而污染吸收液,如图1-1所示。分别以每分钟0.1L、0.3L的流量抽取空气30min。采样高度为1.5m,若
氮氧化物含量很低,可增加采样量,采样至吸收液呈浅玫瑰红色为止。记录采样时间和地点,根据采样时间和流量,算出采样体积。把一天分成几个时间段进行采样(7次),如10:300~11:00、11:30~12:00、12:30~13:00、13:30~14:00、14:30~15:00、15:30~16:00、16:30~17:00。 图1-1 氮氧化物采样装置的连接图示 2)氮氧化物的测定 ①标准曲线的绘制:取7支50mL 比色管,按表1-1配制标准系列。 将各管摇匀,避免阳光直射,放置15 min ,以蒸馏水为参比,用1cm 比色皿,在540nm 波长处测定吸光度。根据吸光度与浓度的对应关系,用最小二乘法计算标准曲线的回归方程式: y = bx + a 式中:y ——(A-A 0),标准溶液吸光度(A )与试剂空白吸光度(A 0)之差; x ——NO 2-浓度,μg/mL ; a 、 b ——回归方程式的截距和斜率。 ρNO x = 76 .0)(0??--V b a A A 式中:ρNO x ——氮氧化物浓度,mg/m 3; A ——样品溶液吸光度; A 0、a 、b 表示的意义同上; V ——标准状态下(25℃,760mmHg )的采样体积,L ;
空气质量氮氧化物的测定 GB/T 13906-92 Air quality—Determination of nitrogen oxides 本标准规定了测定火炸药生产过程中,排出的硝烟尾气中所含的一氧化氮和二氧化氮以及其他氮的氧化物的方法。 本标准分为两篇,第一篇中和滴定法,第二篇二磺酸酚分光光度法。 第一篇中和滴定法 1 主题内容与适用范围 1.1 主题内容 本标准规定了火炸药工业硝烟尾气中氮氧化物测定的中和滴定法。 1.2 适用范围 1.2.1 本标准适用于火炸药工业硝烟尾气中氮氧化物的测定。
1.2.2 本标准测定范围为1000~20000mg/m3。 1.2.3 本标准规定的方法受其他酸碱性气体(如:二氧化硫、氨等)的干扰。 2 原理 氮氧化物被过氧化氢溶液吸收后,生成硝酸,用氢氧化钠标准溶液滴定,根据其消耗量求得氮氧化物浓度。 3 试剂和材料 在测定过程中,除另有说明外均使用符合国家标准的分析纯试剂和蒸馏水或同等纯度的水。 3.1 过氧化氢:30%。 3.2 过氧化氢:3%。取过氧化氢(3.1)100mL,用水稀释至1000mL。 3.3 氢氧化钠标准溶液:c(NaOH)=0.0100mol/L。
3.4 甲基红-次甲基蓝混合指示液:称取0.10g甲基红和0.10g次甲基蓝,溶解在100mL95%乙醇溶液中,装入棕色瓶中,于暗处保存,此溶液有效期为一周。 3.5 氟橡管或厚壁胶管:φ5~8mm。 3.6 采样瓶布套。 4 仪器和设备 实验室常用仪器及下列专用仪器: 4.1 真空采样瓶:容积为2000mL左右,形状如图1。 图1 真空采样瓶 4.2 加热采样管:形状如图2。
环境空气和废气氯化氢的测定离子色谱法 1.适用范围 本方法规定了测定环境空气和废气中氯化氢的离子色谱法。 本方法适用于环境空气和废气中氯化氢的测定。 对于有组织排放废气,本方法检出限为1μg/50ml,当米样体积为10L时,检出限为0.5mg/m3,测定下限为2mg/m3。 对于环境空气,本方法检出限为0.2μg/10ml,当采样体积为60L时,检出限为0.003mg/m3,测定下限为0.012mg/m3。 2 方法原理 用碱性吸收液吸收氯化氢气体生成氯化物。将样品注入离子色谱仪,分离出氯离子,根据保留时间定性,响应值定量。 3 试剂和材料 除非另有说明,分析时均使用符合国家标准的分析纯试剂,去离子水,GB/T6682,二级。 3.1 吸收液:氢氧化钾-碳酸钠溶液,c(KOH)=0.089mol/L,c(Na2CO3)=0.12mol/L。 称取5.0g氢氧化钾和12.72g无水碳酸钠,溶解于水,稀释至1000ml。也可根据仪器型号及色谱柱使用条件进行配置。 3.2 淋洗液:由1份吸收液加49份水配制,临用现配。 3.3 氯化钾标准贮备溶液:ρ(Cl-)=1000μg/ml。 称取2.103g氯化钾(基准试剂,于110℃烘干2h),溶解后移入1000ml容量瓶中,用淋洗液稀释至标线,摇匀。也可使用有证标准溶液进行配置。氯化钾贮备液于0~4℃密封可保存3个月。 3.4 氯化钾标准使用液:ρ(Cl-)=100μg/ml。 吸取10.00ml氯化钾标准贮备溶液,置于100ml容量瓶中,用淋洗液稀释至标线,摇匀,临用现配。 3.5 氯化钾标准使用液:ρ(Cl-)=10μg/ml。 吸取10.00ml氯化钾标准贮备溶液,置于1000ml容量瓶中,用淋洗液稀释至标线,摇匀,临用现配。
?专论与综述? 光电技术在大气氮氧化物检测中的应用 艾锦云,何振江,杨冠玲 (华南师范大学,广东 广州 510631) 摘 要:介绍了大气中氮氧化物的组成,综述了激光诱导荧光法、光纤传感法、激光雷达探测法和化学发光法测定大气中氮氧化物的原理和特点,指出光电技术已在大气氮氧化物检测中得到了广泛的应用,并具有良好的发展前景。 关键词:光电技术;氮氧化物;检测;大气 中图分类号:X831 文献标识码:A 文章编号:10062009(2004)02000703 Application of Photoelectric T echnology in Detection of Nitrogen Oxides in Air AI Jin2yun,HE Zhen2jiang,YAN G Guan2ling (South Chi na N orm al U niversity,Guangz hou,Guangdong510631,Chi na) Abstract:The composition of nitrogen oxides in air was introduced.It discussed the application of photo2 electric technology in detection of nitrogen oxides in air,including laser induction fluorometry,optical fiber sensing,laser radar detection and chemical luminescent analysis.Photoelectric technology had wide applied in detection of nitrogen oxides in air. K ey w ords:Photoelectric technology;Nitrogen oxides;Detection;Air 氮氧化物对大气环境的影响已经越来越受到人们的关注,对大气中氮氧化物检测技术的要求也越来越高,不仅要求检测设备结构简单、易于维护、造价低廉,而且要能实现检测的自动化与在线监测。大气中氮氧化物的检测方法有盐酸萘乙二胺分光光度法、原电池库仑滴定法、压电石英传感器法等,应用光电技术的有激光诱导荧光法、光纤传感法、激光雷达探测法和化学发光法。上述检测方法各有优缺点及适用的领域,就实现检测的自动化与在线监测而言,光电技术有其特有的优势。 1 大气环境中的氮氧化物 氮氧化物常以NO x表示,其中污染大气的主要是NO和NO2,特别是NO2,一般以NO、NO2的总浓度评价环境的污染程度[1]。现在公认NO2与人体健康的关系较NO密切,其毒性为NO的四五倍,且NO进入大气后,在日光照射下,会缓慢生成NO2。2000年6月1日起,我国的环境监测系统已统一以NO2代替NO x作为监测指标。因此,以NO2取代NO x评价大气污染更为合适[2]。 2 应用光电技术检测大气中的NO x 2.1 激光诱导荧光法 激光诱导荧光法是用特定波长的激光束,激发NO2(或NO)分子到较高能级,处于高能级的NO23 (或NO3)跃迁回基态时会以光子发射的形式释放能量,其光子发射时间延迟很短(<1025s),称为荧光,荧光强度与其浓度成正比。光电转换器吸收荧光产生光电流,光电流的大小与NO2(或NO)的浓度成线性,可由光电强度判定其浓度。 收稿日期:20030331;修订日期:20040211 作者简介:艾锦云(1978—),男,江西新余人,在读硕士生,研究方向为光电技术及系统。 1852年Stokes指出,用波长较短的光可以激发出波长较长的光,也就是能量大的光子可以激发能低的光子,此为激光诱导荧光法的理论依据。实际上,该方法也适用于检测大气中的其他污染物, — 7 — 第16卷 第2期环境监测管理与技术2004年4月
空气中氮氧化物(NOx)的测定 (盐酸萘乙二胺分光光度法) 摘要:本文采用盐酸萘乙二胺分光光度法测定室内空气中氮氧化物(NOx),根据配置标准溶液用分光光度计测定其吸光度,绘制标准曲线,分析空气中氮氧化物的含量结果。 关键词:氮氧化物分光光度法含量 综述 大气中氮氧化物主要包括一氧化氮和二氧化氮,其中绝大部分来自于化石燃料的燃烧过程,包括汽车及一切内燃机所排放的尾气,也有一部分来自与生产和使用硝酸的化工厂、钢铁厂、金属冶炼厂等排放的废气中。动物实验证明,氮氧化物对呼吸道和呼吸器官有刺激作用,是导致目前支气管哮喘等呼吸道疾病不断增加的原因之一,二氧化氮与二氧化硫和浮游颗粒物共存时,其对人体的影响不仅比单独二氧化氮对人体的影响严重的多,而且也大于各自污染物之和。对人体的实际影响是各污染物之间的协同作用。因此大气氮氧化物的监测分析是环境保护部门日常工作的重要项目之一。 采用化学发光法测定空气中氮氧化物较以往的盐酸禁乙二胺分光光度法具有灵敏度高、反应速度快、选择性好等特点 ,现已被很多国家和世界卫生组织全球监测系统作为监测氮氧化物的标准方法 ,也已引起我国环保部门的注意和重视 ,相信不久将来 ,此方法也会成为我国环境空气监测氮氧化物的首推方法。 1、实验目的 (1)熟悉、掌握小流量大气采样器的工作原理和使用方法; (2)熟悉、掌握分光光度计的工作原理及使用方法。 (3)掌握大气监测工作中监测布点、采样、分析等环节的工作内容及方法。2、实验原理 ,测定氮大气中的氮氧化物(NOx)主要是一氧化氮(NO)和二氧化氮(NO 2) )氧化管将一氧化氮成二氧化氮。二氧化氧化物浓度时,先用三氧化铬(CrO 3 ),与对氨基苯磺酸起重氧化反应,再与盐氮被吸收在溶液中形成亚硝酸(HNO 2
大气中氯化氢的测定 1原理 氯离子与硫氰酸汞作用,置换出的硫氰酸根与高铁离子反应而显血红色,比色定量,反应式如下: 2Cl-+Hg(SCN)2→HgCl2+2SCN- SCN-+Fe3+→Fe(SCN)2+ 2仪器 1、烟气采样装置。 2、玻璃筛板吸收瓶。 3、25毫升比色管。 4、分光光度计。 3试剂 1、吸收液:取4g(优级纯)氢氧化钠溶于水,稀释至1000ml混匀。 2、硫氰酸汞-乙醇溶液:取0.4克硫氰酸汞(用乙醇重结晶的)溶于100毫升无水乙醇中,保存于棕色瓶中。放置一周后将上清液吸至另一试剂瓶中使用。 3、12%硫酸铁铵溶液:称取12克硫酸铁铵溶于100毫升6N硝酸溶液中,如有沉淀应过滤。 4、氯化氢贮备液:准确称取0.2044克经105℃干燥过的氯化钾,用少量水溶解后,移入1000毫升容量瓶中,稀释至标线,摇匀。此溶液1毫升含0.1毫克氯化氢。 5、氯化氢标准溶液:吸取一定量上述贮备溶液用吸收液稀释成1毫升含10微克氯化氢的标准溶液。 6、硝酸。 7、无水乙醇。 4采样 见第一章“气体采样方法”,按图17串联两只玻璃筛板吸收瓶,内装35-50毫升0.1N氢氧化钠吸收液,以0.5升/分流量,采气5-30分钟。
5分析步骤 1、标准曲线的绘制:在九支比色管中,按下表配制标准色列。 于各管中加入1.00毫升硫酸铁铵溶液,混匀,再加1.00毫升硫氰酸汞溶液、10毫升无水乙醇,混匀。放置15-30分钟,在波长460纳米处,用2厘米比色皿,以试剂空白液作参比,测吸光度。绘制标准英线。 2、样品分析:采样后,将第二吸收瓶中溶液倒入第一吸收瓶,用吸收液洗涤第二吸收瓶2-3次,洗涤淮并入第一吸收瓶,用吸收液稀释至100(或125)毫升标线,摇匀。吸取适量样品溶液于比色管中,加吸收液至5毫升,以下步骤同标准曲线的绘制。 6计算 a ·Vs 氯化氢(毫克/米3)= V nd·V1 式中:a――样品溶液中含氯化氢的量,微克; Vs――样品溶液的总体积,毫升; V1――分析时所取样品溶液的体积,毫升; V nd――采样体积,标、干、升。 7说明 1、烟气中含有其他卤化物、硫化物及氰化物等时对测定有干扰。 2、硫氰酸汞的制备:称取5克硝酸汞〔Hg(NO3)2·H20〕,溶于200毫升0.5N硝酸溶液中,加3毫升硫酸铁铵溶液,充分搅拌下,滴加4%的硫氰化钾溶液,至溶液呈微橙红色为止。生成的硫氰酸汞白色沉淀用玻璃砂漏斗过滤,沉淀用水以倾注法充分洗涤,风干或在60℃真空干燥箱内干燥。保存于棕色瓶中。 3、采用该法的测定范围为0.5-65mg/m3。
氯化氢的测定硫氰酸汞分光光度法 1 原理 空气样品经过0.3gm微孔滤膜阻留含氯化物的颗粒物后,用稀氢氧化钠溶液吸收氯化氢气体。样品溶液中的氯离子和硫氰酸汞反应,生成难电离的二氯化汞分子。置换出的硫氰酸根与三价铁离子反应,生成橙红色硫氰酸铁络离子,用分光光度法测定。反应式如下: 2Cl-+Hg(SCN)2→HgCl2+2SCN- SCN-+Fe3+→Fe3+→Fe(SCN)2+(橙红色) 溴离子、氟离子、硫化物、氰化物等干扰测定,使结果偏高。 本法检出限1.5μg/10mL(按与吸光度0.02相对应的氯化氢浓度计),当采样体积为250L时,最低检出浓度为0.006 mg/m3。 2 仪器 2.1 滤膜采样夹:滤膜直径30~40mm。 2.2 大型气泡吸收管:10mL。 2.3 具塞比色管:10mL。 2.4 空气采样器:流量0~1 L/min。 2.5 分光光度计。 3 试剂 3.1 乙酸纤维微孔滤膜:0.3 μm。 3.2 吸收液:氢氧化钠溶液c(NaOH)=0.05 mol/L。 3.3 硫氰酸汞-乙醇溶液:称取0.40 g硫氰酸汞[Hg(SCN)2,用乙醇重结晶的],用无水乙醇配成100mL溶液。放置一周后将上清液吸至另一棕色细口瓶中备用。 3.4 高氯酸:70%~72%。 3.5 3.0%硫酸铁铵溶液:称取3.0g硫酸铁铵,用(1+1.5)高氯酸溶液溶解并稀释至100mL,如浑浊应过滤。 3.6 氯化钾标准溶液:称取2.045g氯化钾(优级纯,110℃烘干2h),溶解于水,移入1000mL 容量瓶中,用水稀释至标线。此溶液每毫升相当于含1 000/μg氯化氢。再用吸收液稀释至每毫升含10.0μg氯化氢的标准使用溶液。 4 采样 将0.3μm微孔滤膜装在滤膜采样夹内,后面串联两支各装10mL吸收液的吸收管,以1L/min 流量,采气250L。长时间采样,吸收液水分蒸发,需加水补充至原体积。 5 操作步骤 5.1 标准曲线的绘制:取8支10mL具塞比色管,按表1配制标准色列。 表1 氯化钾标准色列
空气中氮氧化物的日变化曲线 XXX(XX大学环境与化学工程学院环境科学专业091班,辽宁大连 116622) 1概述 1.1研究背景 1.1.1氮氧化物的来源 大气中氮氧化物(NO x )包括多种化合物,如一氧化氮、二氧化氮、三氧化二氮、四氧化二氮和五氧化二氮,除二氧化氮以外,其他氮氧化物极不稳定,遇光、湿或热变成二氧化氮或一氧化氮,一氧化氮不稳定又变成二氧化氮。因此大气污染化学中的氮氧化物主要指的是一氧化氮和二氧化氮。其主要来自天 然过程,如生物源、闪电均可产生NO x 。NO x 的人为源绝大部分来自化石燃料的 燃烧过程,包括汽车及一切内燃机所排放的尾气,也有一部分来自生产和使用硝酸的化工厂、钢铁厂、金属冶炼厂等排放的废气,其中以工业窑炉、氮肥生 产和汽车排放的NO x 量最多。城市大气中2/3的NO x 来自汽车尾气等的排放,交 通干线空气中NO x 的浓度与汽车流量密切相关,而汽车流量往往随时间而变 化,因此,交通干线空气中NO x 的浓度也随时间而变化。 1.1.2氮氧化物的危害 NO的生物化学活性和毒性都不如NO 2,同NO 2 一样,NO也能与血红蛋白结 合,并减弱血液的输氧能力。如果NO 2 的体积分数为(50—100)×10-6时,吸 入时间为几分钟到一小时,就会引起6—8周肺炎; 如果NO 2 的体积分数为(150—200)×10-6时,就会造成纤维组织变性性细支气管炎,及时治疗,将于3—5不周后死亡。 在实验室,NO 2 体积分数达到10-6级,植物叶片上就会产生斑点,显示植 物组织遭到破坏。体积分数为10-5级的NO 2 会引起植物光合作用的可逆衰减。 此外,NO x 还是导致大气光化学污染的重要物质。
FHZHJDQ0105 环境空气氯化氢的测定硫氰酸汞分光光度法 F-HZ-HJ-DQ-0105 环境空气—氯化氢的测定—硫氰酸汞分光光度法 1 范围 本方法可用于空气中氯化氢的测定。5mL样品溶液中含2μg氯化氢,可有0.033吸光度。 本法检出限为1μg/5mL,若采样体积为200L时,最低检出浓度为 0.01mg/m3;测定范围为5mL样品溶液中含2~20μg氯化氢,若采样体积为200L时,可测浓度范围为0.02~0.40mg/m3。 2 原理 空气中氯化氢吸收在碱溶液中,在酸性溶液中与硫氰酸汞反应置换出硫氰酸根,再与高铁离子作用生成硫氰酸铁红色化合物,比色定量。 3 试剂 所有试剂均用蒸馏水或去离子水配制。 3.1 吸收液:0.05mol /L氢氧化钠溶液。 3.2 无水乙醇。 3.3 硫氰酸汞-乙醇溶液:称取0.4g硫氰酸汞用无水乙醇溶解成 100mL。 3.4 高氯酸:70%~72%。 3.5 硫酸铁铵溶液:称取6g硫酸铁铵用(1+2)高氯酸溶解成100mL。 3.6 标准溶液:准确称量0.2045g经105℃干燥2h的氯化钾(一级),用水溶解后,移入1000mL 容量瓶中,并稀释至刻度。此溶液1.00mL含0.1mg氯化氢。再用吸收液稀释成1.00mL含10μg 氯化氢的标准溶液。 4 仪器 4.1 气泡吸收管:普通型,有10mL刻度线。 4.2 空气采样器:流量范围0.2~3L/min,流量稳定。使用时,用皂膜流量计校准采样系列在采样前和采样后的流量误差应小于5%。 4.3 具塞比色管,10mL 4.4 分光光度计,用20mm比色皿,在波长460nm下,测定吸光度。 5 采样 串联两个各装10mL吸收液的普通型气泡吸收管,以2.5L/min流量采气200L。长时间采样,需用水补充到原体积。 6 操作步骤 6.1 标准曲线的绘制 按下表制备标准色列管。 0 1 2 3 4 5 6 7 标准溶液V/mL 0 0.20 0.40 0.60 0.80 1.00 1.50 2.00 吸收液V/mL 5.0 4.80 4.60 4.40 4.20 4.00 3.50 3.00 氯化氢含量m/μg 0 2 4 6 8 10 15 20 于标准色列各管中加入2mL硫酸铁铵溶液,混匀。加入1mL硫氰酸汞-乙醇溶液,混匀。 在室温下放置10~30min。用20mm比色皿,以水作参比,在波长460nm下,测定各管溶液 吸光度。以氯化氢含量(μg)为横坐标,吸光度为纵坐标,绘制标准曲线,并计算回归线的斜率。以斜率倒数作为样品测定的计算因子B S(μg)。 6.2 样品测定
) 论文题目:校园空气中NO x 的测定姓名: 院系专业: 班级:09 学号: 指导老师: 完成时间:
目录 目录.................................................................................................................... I 摘要.................................................................................................................. I II Abstract ................................................................................................................ I II 一前言. (1) 1.1 研究背景 (1) 1.1.1 NO x的主要来源 (1) 1.1.2 NO x的主要危害及其防治措施 (1) 1.2 NO x的研究进展 (2) 1.2.1化学发光法 (2) 1.2.2库伦原电池法 (2) 1.2.3盐酸萘乙二胺分光光度法 (2) 1.3实验原理 (3) 1.4选题依据 (3) 二实验部分 (4) 2.1实验仪器 (4) 2.2实验药品和试剂 (4) 2.3实验步骤 (5) 2.3.1标准曲线的绘制 (5) 2.3.2 样品的测定 (6) 2.4数据处理 (6) 三结果与讨论 (7) 3.1标准曲线的绘制 (7) 3.2采样及样品溶液的测定 (8) 3.2.1 NO2一周的含量变化 (8) 3.2.2 NO x一周的含量变化 (8) 3.2.3 NO2含量的日平均浓度 (9) 3.2.4 NO x含量的日平均浓度 (9) 3.2.5实验数据分析 (10)
大气中氮氧化物的测定 一些环评报告中需要的检测方案,几乎所有的大气污染物都需要检测氮氧化物了,由于十二五计划将氮氧化物纳入总量控制指标,这里今天给大家解释一下大气中氮氧化物的测定方法,盐酸萘乙二胺分光光度法。 大气中的氮氧化物注意是二氧化氮和一氧化氮,在测定氮氧化物浓度时,应先用二氧化铬将一氧化氮升成二氧化氮,在进行检测,不然直接检测的话只能检测出二氧化氮的数值,漏掉了一氧化氮。 检测原理:二氧化氮被吸收液吸收后,生成亚硝酸和硝酸,其中,亚硝酸与对氨基苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,据其颜色深浅,用分光光度法定量。因为NO2(气)转变为NO2-(液)的转换系数为0.76,故在计算结果时应除以0.76。 检测仪器: 1.多孔玻板吸收管。 2.双球玻璃管(内装三氧化铬-砂子)。 3.空气采样器:流量范围0—1L/ min。 4. 分光光度计。 检测试剂: 所有试剂均用不含亚硝酸根的重蒸馏水配制。其检验方法是:所配制的吸收液对540nm 光的吸光度不超过0.005。 1.吸收液:称取5.0g 对氨基苯磺酸,置于1000mL 容量瓶中,加入50mL 冰乙酸和900mL 水的混合溶液,盖塞振摇使其完全溶解,继之加入0.050g 盐酸萘乙二胺,溶解后,用水稀释至标线,此为吸收原液,贮于棕色瓶中,在冰箱内可保存两个月。保存时应密封瓶口,防止空气与吸收液接触。采样时,按4 份吸收原液与1 份水的比例混合配成采样用吸收液。 2.三氧化铬-砂子氧化管:筛取20—40 目海砂(或河砂),用(1+2)的盐酸溶液浸泡一夜,用水洗至中性,烘干。将三氧化铬与砂子按重量比(1+20)混合,加少量水调匀,放在红外灯下或烘箱内于105℃烘干,烘干过程中应搅拌几次。制备好的三氧化铬-砂子应是松散的,若粘在一起,说明三氧化铬比例太大,可适当增加一些砂子,重新制备。称取约8g 三氧化铬-砂子装入双球玻璃管内,两端用少量脱脂棉塞好,用乳胶管或塑料管制的小帽将氧化管两端密封,备用。采样时将氧化管与吸收管用一小段乳胶管相接。
固定污染源排气中氯化氢的测定硫氰酸汞分光光度法 1.适用范围 1.1本方法适用于固定污染源有组织排放和无组织排放的氯化氢测定。 1.2在无组织排放样品分析中,当采气体积为60L时,氯化氢的检出限为 0.05mg/m3,定量测定的浓度范围为0.16mg/m3~0.80mg/m3;在有组织排放样品分析中,当采气体积为10L时,氯化氢的检出限为0.9mg/m3,定量测定的浓度范围为3.0mg/m3~24mg/m3。 1.3在本方法规定的显色条件下,当采气体积为100L时,氟化氢(HF)浓度高于0.2mg/m3,硫化氢(H2S)浓度高于0.1mg/m3,以及氰化氢(HCN)浓度高于0.1mg/m3时,将对氯化氢的测定产生干扰。 2. 原理 用稀氢氧化钠溶液吸收氯化氢(HC1)。吸收溶液中的氯离子和硫氰酸汞反应,生成难电离的二氯化汞分子,置换出的硫氰酸根与三价铁离子反应生成橙红色硫氰酸铁络离子,根据颜色深浅,用分光光度法测定。反应式为: 2Cr-+Hg(SCN)2→HgCl2 + 2SCN- SCN- + Fe3+→Fe(SCN)2+(橙红色) 3. 试剂和材料 除非另有说明,分析时均使用符合国家标准的分析纯试剂和去离子水。 3.1 氢氧化钠。 3.2 硫氰酸汞。 3.3 硫酸铁铵:[NH4Fe(SO4)2·12H2O]。 3.4 氯化钾:优级纯,于110℃烘干2h。 3.5 高氯酸:ρ=1.76g/ml。 3.6 无水乙醇。 3.7 硫氰酸汞-乙醇溶液:c=0.04g/100ml。 称取0.04g硫氰酸汞,用无水乙醇配成100ml溶液,放置一周后将上清液吸至另一棕色细口瓶中备用。 3.8 高氯酸溶液:1+1.5。
浅谈空气中的氮氧化物的污染及其治理 摘 要 氮氧化物是只由氮、氧两种元素组成的化合物,包括氧化二氮,一氧化氮,三氧化二氮,二氧化氮,四氧化二氮,五氧化二氮。氮氧化物是大气的主要污染物之一, 是治理大气污染的一大难题。本文介绍了氮氧化物的来源以及治理氮氧 化物的主要方法,分析了这些方法处理氮氧化物的优点或缺点,并预测未来处理氮氧化物方法的发展趋势。 关键词 氮氧化物 产生 危害 治理 天然排放的氮氧化物,主要来自土壤和海洋中有机物的分解,属于自然界的氮循环过程。人为活动排放的氮氧化物,大部分来自化石燃料的燃烧过程,如汽车、飞机、内燃机及工业窑炉的燃烧过程;也来自生产、使用硝酸的过程,如氮肥厂、有机中间体厂、有色及黑色金属冶炼厂等。据80年代初估计,全世界每年由于人类活动向大气排放的氮氧化物,约5300万吨。 氮氧化物对环境的损害作用极大,它既是形成酸雨的主要物质之一,也是形成大气中光化学烟雾的重要物质和消耗臭氧的一个重要因子。其危害主要包括: 1.NOx 对人体及动物的致毒作用。NO 对血红蛋白的亲和力非常强,是氧的数十万倍。一旦NO 进入血液中,就从氧化血红蛋白中将氧驱赶出来,与血红蛋白牢固地结合在一起。长时间暴露在NO 环境中较易引起支气管炎和肺气肿等病变。这些毒害作用还会促使早衰、支气管上皮细胞发生淋巴组织增生,甚至是肺癌等症状的产生。 2.对植物的损害作用,氮氧化物对植物的毒性较其它大气污染物要弱,一般不会产生急性伤害,而慢性伤害能抑制植物的生长。危害症状表现为在叶脉间或叶缘出现形状不规则的水渍斑,逐渐坏死,而后干燥变成白色、黄色或黄褐色斑点,逐步扩展到整个叶片。 3.NOx 是形成酸雨、酸雾的主要原因之一。高温燃烧生成的NO 排人大气后大部分转化成NO ,遇水生成HNO 3、HNO 2,并随雨水到达地面,形成酸雨或者酸雾。
FHZHJDQ0110a环境空气氮氧化物的测定中和滴定法 F-HZ-HJ-DQ-0110a 环境空气—氮氧化物的测定—中和滴定法 1范围 本方法规定了火炸药工业硝烟尾气中氮氧化物测定的中和滴定法。本方法适用于火炸药工业硝烟尾气中氮氧化物的测定。 本方法测定范围为1000~20000mg/m3。本方法受其他酸碱性气体(如:二氧化硫、氨等)的干扰。 2原理 氮氧化物被过氧化氢溶液吸收后,生成硝酸,用氢氧化钠标准溶液滴定,根据其消耗量求得氮氧化物浓度。 3试剂 在测定过程中,除另有说明外均使用符合国家标准的分析纯试剂和蒸馏水或同等纯度的水。 3.1过氧化氢:30%。 3.2过氧化氢:30g/L。取过氧化氢(3.1)100mL。用水稀释至1000mL。 3.3氢氧化钠标准溶液:c(NaOH)=0.0100mol/L。 3.4甲基红-次甲基蓝混合指示液:称取0.10g甲基红和0.10g次甲基蓝,溶解在100mL 95%乙醇溶液中,装入棕色瓶中,于暗处保存,此溶液有效期为一周。 3.5氟橡管或厚壁胶管:?5~8mm。 3.6采样瓶布套。 4仪器 实验室常用仪器及下列专用仪器: 4.1真空采样瓶:容积为2000mL左右,形状如图1。 图1 真空采样瓶 4.2加热采样管:形状如图2。 图2 加热采样管 4.3移液管:100mL。 4.4滴定管:25mL。 4.5锥形瓶:250mL。
5 采样 将长度为100mm 左右的乳胶管(3.5)连接于采样瓶细口处,用真空泵抽取瓶内空气,稍减压后,用移液管准确加入200mL 过氧化氢吸收液(3.2),套上采样瓶布套,减压抽真空,记录瓶内压力(P 1),夹好瓶夹,确保密封不漏,拿至采样现场。采样时,将采样管伸入烟道,使采用咀直对气流方向,先放空5~10s ,使样品气体充满采样管,迅速将采样管与真空采样瓶连接,将气体缓慢采入瓶内,至不冒气泡为止(大约5~10s ),立即夹好瓶夹,注意确保严紧不漏,取下采样瓶。 注:采样注意事项见附录A 6 操作步骤 采样后,将真空采样瓶于往返振荡器上(或用人工)振荡10~15min ,放置10~15min , 测量瓶内余压(P 2) ,并记录室温(t )。然后将试样溶液倒入已经干燥的250mL 锥形瓶中。用移液管吸取50~100mL 样品溶液于另一250mL 锥形瓶中,加4~5滴混合指示液(3.4),用氢氧化钠标准溶液(3.3)滴定至亮绿色为终点。记录消耗量(V )。同时吸取相同体积的过氧化氢吸收液(3.2)做空白试验,记录消耗量(V 0)。 7 结果计算 氮氧化物含量按下式计算: 50 10000.46)(0××××??=n s NOx V V c V V c 式中: NOx c ——氮氧化物浓度(以NO 2计),mg/m 3; V ——滴定所取样品溶液时消耗氢氧化钠标准溶液体积,mL ; V 0 ——滴定空白溶液时消耗氢氧化钠标准溶液体积,mL ; C ——氢氧化钠标准溶液浓度,mol/L 。 46.0 ——与1.00mL 氢氧化钠标准溶液[c (NaOH )=1.000mol/L]相当的以毫克表示的NO 2的质量; V s ——样品溶液总体积,mL ; V n ——换算为标准状况下(0℃,101 325Pa )的采样体积,L 。 V n 按下式计算: 101325 27327312P P t V V t n ?×+×= 式中:V t ——室温下采样体积(采样瓶体积与吸收液体积之差),L ; t ——室温,℃; P 2 ——采样后在t ℃下真空瓶内压力,Pa ; P 1 ——采样前真空瓶内压力,Pa 。 8 精密度和准确度 用标准气测定相对误差小于±5%。 用标准气和样品气测定相对标准偏差小于5%。 用此法和二磺酸酚分光光度法同时测定标准气体和样品气体,相对误差小于±5%。 9 参考文献 GB/T 13906-92
实验一空气中氮氧化物的日变化曲线大气中氮氧化物(NO x)主要包括一氧化氮和二氧化氮,主要来自天然过程,如生物源、闪电均可产生NO x。NO x的人为源绝大部分来自化石燃料的燃烧过程,包括汽车及一切内燃机所排放的尾气,也有一部分来自生产和使用硝酸的化工厂、钢铁厂、金属冶炼厂等排放的废气,其中以工业窑炉、氮肥生产和汽车排放的NO x量最多。城市大气中2/3的NO x来自汽车尾气等的排放,交通干线空气中NO x的浓度与汽车流量密切相关,而汽车流量往往随时间而变化,因此,交通干线空气中NO x的浓度也随时间而变化。 NO x对呼吸道和呼吸器官有刺激作用,是导致支气管哮喘等呼吸道疾病不断增加的原因之一。二氧化氮、二氧化硫、悬浮颗粒物共存时,对人体健康的危害不仅比单独NO x严重得多,而且大于各污染物的影响之和,即产生协同作用。大气中的NO x能与有机物发生光化学反应,产生光化学烟雾。NO x能转化成硝酸和硝酸盐,通过降水对水和土壤环境等造成危害。 一、实验目的 1.掌握氮氧化物测定的基本原理和方法; 2.绘制城市交通干线空气中氮氧化物的日变化曲线。 二、实验原理 在测定NO x时。先用三氧化铬将一氧化氮等低价氮氧化物氧化成二氧化氮;二氧化氮被吸收在溶液中形成亚硝酸,与对氨基苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,用比色法测定。方法的检出限为0.01 /ml(按与吸光度0.01相应得亚硝酸盐含量计)。线性范围为0.03~1.6/ml。当采样体积6L时,NO x (以二氧化氮计)的最低检出浓度为0.01mg/m3。盐酸萘乙二胺盐比色法的有关反应式如下: 主要反应方程式为:
实验十三盐酸萘乙二胺比色法测定大气中氮氧化物 一﹑实验目的 1.学习气体样品的采集和吸收,吸收管及大气采样器的使用。 2.掌握大气中氮氧化物的比色测定方法。 二﹑实验原理 大气中氮氧化物包括一氧化氮和二氧化氮等,在测定氮氧化物浓度时,先用三氧化铬氧化管将一氧化氮氧化为二氧化氮。 二氧化氮被吸收在溶液中形成亚硝酸,与氨基苯磺酸起重氮反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,根据颜色深浅,比色测定。 使用重量法校准的二氧化氮渗透管配置低浓度标准气体,测得NO 2--→NO 2 - 的转换系数为0.76,因此在计算结果中要除以换算系数0.76。 三﹑实验仪器 1.多孔玻板吸收管 2.大气采样器,流量范围0—1L/min。 3.双球玻璃管 4.分光光度计 四﹑试剂 所有试剂均用不含有亚硝酸盐的重蒸水配制。 检验方法:吸收液的吸光度不超过0.005。 1.吸收原液:称取5g对氨基苯磺酸于200mL烧杯中,将50mL冰醋酸与900mL 水的混合液分数次加入烧杯中,搅拌,溶解,并迅速移入1000mL容量瓶中,避光,待对氨基苯磺酸完全溶解后,加入0.050g盐酸萘乙二胺(又名N-甲奈基盐酸二氨基乙烯),溶解后,用水稀释至刻线。此为吸收原液,储于棕色瓶中,存于冰箱,可保存一个月。 2.采样用吸收液:按四份吸收原液与一份水的比例混合。 3.三氧化铬-石英砂氧化管:筛取20—40目部分石英砂,用(1+2)盐酸溶液浸泡一夜,用水洗至中性,烘干,把三氧化铬及石英砂按重量比1:20混合,加少量水调匀,放在红外灯或烘箱里于105℃烘干,烘干过程中搅拌几次,做好的三氧化铬-石英砂应是松散的,若是粘在一起,说明三氧化铬比重太大,可适量增加一些石英砂重新制备。 将三氧化铬-石英砂装入双球玻璃管,两端用少量脱脂棉塞好,用塑料管制
实验十四大气中氮氧化物的测 实验目的:通过本实验,掌握测定大气中氮氧化物的方法及其原理 一、原理 大气中的氮氧化物主要是一氧化氮和二氧化氮。在测定氮氧化物浓度时,应先用三氧化铬将一氧化氮氧化成二氧化氮。二氧化氮被吸收液吸收后,生成亚硝酸和硝酸,其中,亚硝酸与对氨基苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合, (气)转生成玫瑰红色偶氮染料,据其颜色深浅,用分光光度法定量。因为NO 2—(液)的转换系数为0.76,故在计算结果时应除以0.76。 变为NO 2 二、仪器 1.多孔玻板吸收管; 2.双球玻璃管; 3.大气采样器:流量范围0-1L/min; 4.分光光度计; 5.10ml比色管; 6.气压计。 三、试剂 所有试剂均用不含亚硝酸根的重蒸馏水配制。其检验方法是:所配制的吸收液对540nm光的吸光度不超过0.005 。 1.吸收液:称取5.0g对氨基苯磺酸,置于1000mL容量瓶中,加入50mL冰乙酸和900mL水的混合溶液,盖塞振摇使其完全溶解,继之加入0. 50g盐酸萘乙二
胺,溶解后,用水稀释至标线,此为吸收原液,贮于棕色瓶中,在冰箱内可保存两个月。保存时应密封瓶口,防止空气与吸收液接触。 采样时,按4分吸收原液与1份水的比例混合配成采样用的吸收液。 2.三氧化铬-砂子氧化管:筛取20-40目海砂(或河沙),用(1+2)的盐酸溶液浸泡一夜,用水洗至中性,烘干。将三氧化铬与砂子按重量比(1+20)混合,加少量水调匀,放在红外灯下或烘箱内于105℃烘干,烘干过程中应搅拌几次。制备好的三氧化铬-砂子应是松散的,若粘在一起,说明三氧化铬比例太大,可适当增加一些砂子,重新制备。 ,预先在干燥器内3.亚硝酸钠标准贮备液:称取0.1500g粒状亚硝酸钠(NaNO 2 放置24h以上),溶解于水,移入1000mL容量瓶中,用水稀释至标线。此溶液 —,贮存于棕色瓶内,冰箱中保存,可稳定三个月。 每毫升含100.0μgNO 2 4.亚硝酸钠标准溶液:吸取贮备液5mL于100mL容量瓶中,用水稀释至标线。 —。 此溶液每毫升含5.0μgNO 2 四、测定步骤 1.标准曲线的绘制:取7支10mL具塞比色管,按下表所列数据配制标准色列。 以上溶液摇匀,避开阳光直射放置15min,在540nm波长处,用1㎝比色皿,以 —含量(ug)水为参比,测定吸光度。以吸光度为纵坐标,相应的标准溶液中NO 2 为横坐标,绘制标准曲线。
固定污染源废气氯化氢的测定硝酸银容量法 警告:氯化氢对人体有害,采样时,应视采样环境佩戴防护器具,避免吸入或接触皮肤和眼睛。实验中使用的硝酸具有强氧化性和腐蚀性,操作时应佩戴防护用品,溶液配制及样品预处理过程应在通风橱中进行操作。 1.适用范围 本标准规定了测定固定污染源废气中氯化氢的硝酸银容量法。 本标准适用于固定污染源废气中氯化氢的测定。 当采样体积为15 L (标准状态),方法检出限为2mg/m3,测定下限为8.0mg/m3。 2.规范性引用文件 本标准内容引用了下列文件或其中的条款。凡是不注明日期的引用文件,其有效版本适用于本标准。 GB/T 16157固定污染源排气中颗粒物测定与气态污染物采样方法 HJ/T 373 固定污染源监测质量保证与质量控制技术规范(试行) 3.方法原理 氯化氢被氢氧化钠溶液吸收后,在中性条件下,以铬酸钾为指示剂,用硝酸银标准溶液滴定,生成氯化银沉淀,过量的银离子与铬酸钾指示剂反应生成浅砖红色铬酸银沉淀,指示滴定终点,反应式如下: Cl - + AgNO 3 →?? NO 3 — + AgCl ↓ 2Ag + + CrO 42-→Ag 2 CrO 4 ↓(浅砖红色) 4.干扰和消除 当废气中含有硫化物、二氧化硫时,对本方法产生正干扰。硫化氢的浓度≤1000 mg/m3, 二氧化硫的浓度≤10000 mg/m3,均可通过加入1 ml的30%过氧化氢消除干扰。 颗粒态的氯化物对本方法产生正干扰;当废气中硫酸雾浓度>15 g/m3时,本方法在滴定过程中产生白色沉淀,影响滴定过程的终点判定;当待测液中铁含量>10 mg/L时,对本方法滴定过程的终点判定产生影响。上述干扰可在采样时通过滤膜过滤去除。 废气中共存氯气(Cl2)时,可与氢氧化钠反应生成等量的氯离子和次氯酸根离子,干扰氯化氢的测定。用碘量法测定次氯酸根,从总氯化物中减去其含量,即获得氯化氢含量。5试剂和材料 除非另有说明,分析时均使用符合国家标准的分析纯试剂。实验用水为新制备的去离子水或同等纯度的水。 5.1 硝酸:p (HN〇3) =1.42 g/ml。 5.2 无水乙醇::〇 (CH3CH2OH) =0.79 g/ml。 5.3氯化钠(NaCl):优级纯。 使用前应放入瓷坩埚中,于400°C?500°C灼烧40 min?50 min,且不再发出爆裂声。 置于干燥器中冷却备用。 5.4氢氧化钠(NaOH)。 5.5 硝酸银(AgNO3)。 使用前应于105 °C烘30min,置于干燥器中冷却备用。 5.6 铬酸钾(K2&O4)。 5.7 酚酞(C20H14O4)。 5.8 硝酸溶液:c (HNO3) = 0.1 mol/L。
1 重要性和产生的原因 氮氧化物(NOX)是锅炉排放气体中的有害物之一。燃煤锅炉在1996年国家要求控制在650mg/m3,而2004年第3时段排放标准进一步提高要求控制在450 mg/m3;所以对于我们燃煤机组的火电厂热电厂减少NOX的排放迫在眉睫。 在燃烧过程中, NOX生成的途径有3条: 1)热力型NOX:是空气中氮在高温(1 400℃以上)下氧化产生; 2)快速型NOX:是由于燃料挥发物中碳氢化合物高温分解生成的CH自由基和空气中氮气反应生成HCN和N,再进一步与氧气作用以极快的速度生成NOx; 3)燃料型NOX:是燃料中含氮化合物在燃烧中氧化生成的NOx,称为燃料型NOx。 2 降低的方法 对于没有脱硝设备和脱硝燃烧器的燃煤锅炉来说,也就是采用低氮燃烧技术来减少NOX 的生成机会。 1)在燃用挥发分较高的烟煤时,燃料型NOX含量较多,快速型NOX极少。燃料型NOX是空气中的氧与煤中氮元素热解产物发生反应生成NOX,燃料中氮并非全部转变为NOX,它存在一个转换率,降低此转换率,控制NOX排放总量,可采取: (1)减少燃烧的过量空气系数; (2)控制燃料与空气的前期混合; (3)提高入炉的局部燃料浓度。 2)热力型NOx:是燃烧时空气中的N2和O2在高温下生成的NOX,产生的主要条件是高的燃烧温度使氮分子游离增本化学活性;然后是高的氧浓度,要减少热力型NOX的生成,可采取 : (1)减少燃烧最高温度区域范围; (2)降低锅炉燃烧的峰值温度; (3)降低燃烧的过量空气系数和局部氧浓度。 具体来说,就是在保证锅炉燃烧安全的前提下,采取以下措施来减少氮氧化物的生成: (1)低过量空气燃烧
摘要 本文主要介绍了空气中氮氧化物的来源与危害。氮的氧化物有一氧化氮、二氧化氮、三氧化二氮、四氧化三氮和五氧化二氮等多种形式。大气中的氮氧化物主要以一氧化氮(NO)和二氧化氮(NO 2 )形式存在。一氧化氮为无色、无臭、微 溶于水的气体,在大气中易被氧化为NO 2。NO 2 为棕红色气体,具有强刺激性臭味, 是引起支气管炎等呼吸道疾病的有害物质。大气中的NO和NO 2 可以分别测定,也 可以测定二者的总量。它们主要来源于石化燃料高温燃烧和硝酸、化肥等生产排放的废气,以及汽车排气。测定方法化学发光法,盐酸萘乙二胺分光光度法,传感器法,库仑原电池法,阐述了这几种方法的原理,并从优缺点,适用的范围等方面进行了分析对比,为测定以及防治氮氧化物提供了依据。 氮氧化物是评价空气质量的控制标准之一。空气中的氮氧化物主要包括一氧 化氮(NO)和二氧化氮(NO 2 )。据有关部门统计,随着工业化生产的迅猛发展,特别 是煤炭、石油、天然气的大量开采使用,我国多数城市已呈现出NO x 深度增加的趋势。因此,了解氮氧化物的来源及危害机理,建立适合的氮氧化物的分析方法,了解其变化规律,对环保管理及环境整治,保障人类的生存环境具有重大意义。
Abstract This paper mainly introduces the source of nitrogen in the air with hazards. Nitrogen oxide have nitric oxide, no2, trioxide nitrogen, four oxidation three nitrogen and five oxidation 2 nitrogen, and other forms. Atmospheric nitrogen oxide mainly nitric oxide (NO) and nitrogen dioxide (NO2) form existence. Nitric oxide is a colourless, odourless, slightly soluble in water, the gas in the atmosphere for easy oxidation alters. NO2 gas, strongly for palm red irritating smell, is a cause bronchitic etc respiratory diseases hazardous substances. The atmosphere were determined aubject and NO2 can, also can determine the amount of both. They mainly comes from fossil fuels temperature combustion and nitric acid, fertilizer and other production exhaust emissions, and vehicle exhaust. Determination methods chemiluminescence method, hydrochloric acid naphthalene ethylenediamine spectrophotometry, sensor method, coulomb YuanDianChi method, expatiated on the principle of these methods, and the advantages and disadvantages, applicable range from aspects was analyzed and compared, and the prevention for determination of nitrogen oxide to provide the basis. No air quality control standard evaluation of one. The air (nitrogen oxide mainly includes nitric oxide (NO) and nitrogen dioxide alters). According to concerning sectional statistic, along with the rapid development of industrial production, especially coal, oil and gas mass exploitation in most cities use, has presented the NOx depth trend of increase. Therefore, understanding the mechanism of nitrogen oxides origin and harm of nitrogen oxides, establish a suitable analysis methods, understand the change rule, to the environmental protection management and controlling the environment, ensuring human survival environment is of great significance. Key word: source ;substances ;nitric oxide