
植物学报 Chinese Bulletin of Botany 2011, 46 (6): 606–616, https://www.doczj.com/doc/62640246.html,
doi: 10.3724/SP .J.1259.2011.00606 ——————————————————
收稿日期: 2011-05-16; 接受日期: 2011-06-24
基金项目: 国家自然科学基金(No.31030047)和国家重点基础研究发展规划(No.2011CB915402) * 通讯作者。E-mail: qxie@https://www.doczj.com/doc/62640246.html,
泛素连接酶E3介导的植物干旱胁迫反应
宁约瑟1, 2, 王国梁1, 谢旗2*
1
湖南农业大学湖南省作物种质创新与资源利用重点实验室, 长沙 410128
2
中国科学院遗传与发育生物学研究所, 国家植物基因研究中心, 植物基因组学国家重点实验室, 北京 100101
摘要 干旱胁迫严重影响农作物的产量和质量, 制约全球的农业生产。泛素连接酶E3是一个种类繁多的大家族, 涉及对植物生长发育和逆境胁迫响应等过程中关键步骤的控制。该文概述了植物干旱胁迫的调控机制和植物的泛素连接酶E3, 并着重阐述了泛素连接酶E3介导的植物干旱胁迫反应及其作用机制。 关键词 干旱胁迫, 翻译后修饰, 泛素, 泛素连接酶E3
宁约瑟, 王国梁, 谢旗 (2011). 泛素连接酶E3介导的植物干旱胁迫反应. 植物学报 46, 606–616.
干旱胁迫是影响农业生产最重要的非生物胁迫之一, 也是当前植物科学研究中最重要和最活跃的研究领域之一。泛素介导的蛋白酶体途径是植物体内蛋白质翻译后修饰水平最重要的调控机制之一, 其中泛素连接酶E3决定底物蛋白的特异性选择。最近的研究表明, 泛素连接酶E3在植物干旱胁迫中发挥着重要作用。本文综述了目前泛素连接酶E3参与的植物干旱胁迫调控研究进展, 并展望了未来的研究方向, 以期为进一步解析植物的干旱胁迫调控机制提供新线索。
1 植物的干旱胁迫及其调控机制
植物固着生长的特性使其在生长发育过程中不可避免地与外界环境有着密切的关联。当面临逆境胁迫时, 植物必须能够应对这些逆境才能存活(Ahuja et al., 2010; Hirayama and Shinozaki, 2010; Peleg and Blumwald, 2011)。干旱胁迫可发生在植物的不同发育阶段, 并影响植物形态建成的每一个方面, 是导致作物减产的最主要原因(Boyer, 1982; Luo, 2010; Yang et al., 2010), 成为目前人口日益增长情况下实现农业可持续发展的重大挑战(Takeda and Matsu-oka, 2008; Ahuja et al., 2010; Yang et al., 2010)。例如, 2003年欧洲热浪引起的干旱和高温胁迫造成全欧洲范围内粮食减产大约30%(Ciais et al., 2005)。目前, 干旱胁迫已经普遍发生于大多数农作物种植区,
而且根据联合国政府间气候变化专门委员会的报道(www.ipcc.ch), 随着全球气候的变化, 干旱胁迫在未来出现的频率会越来越高。因此, 有关植物应对干旱胁迫反应的研究显得极为迫切和重要。
研究表明, 干旱可导致植物一系列的生理和生化反应, 包括气孔关闭、抑制细胞的分裂和延伸、改变细胞壁的弹性、抑制光合作用和激活呼吸作用等, 从而影响植物的生长和发育(Shinozaki and Yamagu-chi-Shinozaki, 2007; Ahuja et al., 2010)。在分子和细胞水平上, 植物也做出相应调节来应对干旱胁迫, 如干旱胁迫时, 植物能够快速积累渗透调节剂等特异参与胁迫抗性的蛋白(Shinozaki and Yamagu-chi-Shinozaki, 2007)。一系列具有不同功能的基因在干旱处理后表达受到诱导或抑制, 根据这些干旱相关基因的功能, 主要可分为2类: 第1类作为功能蛋白参与干旱胁迫的直接调控, 包括分子伴侣、LEA 蛋白、抗冻蛋白、mRNA 结合蛋白、水通道蛋白、转运蛋白、蔗糖、脯氨酸以及各种蛋白酶等; 第2类是调节蛋白, 主要参与调控干旱胁迫的信号转导和胁迫相关基因的表达, 包括不同家族的转录因子(DREB2、AREB 、MYC 、MYB 、bZIP 和NAC 等)、蛋白激酶、磷酸酶、磷脂代谢酶以及钙调素结合蛋白等信号分子(Shinozaki et al., 2003; Shinozaki and Yamaguchi- Shinozaki, 2007)。
干旱胁迫可引起内源植物激素脱落酸(abscisic
·特邀综述·
宁约瑟等:泛素连接酶E3介导的植物干旱胁迫反应 607
acid, ABA)含量的增加, 进而激活一系列依赖于ABA 的信号转导通路; 对ABA不敏感或合成缺失拟南芥突变体的研究表明, 存在一类不依赖于ABA信号转导通路参与对植物干旱胁迫响应过程的调控通路(Yamaguchi-Shinozaki and Shinozaki, 2006; Na-kashima et al., 2009; Hirayama and Shinozaki, 2010)。Shinozaki和Yamaguchi-Shinozaki(2007)将干旱胁迫引起的信号转导途径总结为5条: 其中, 3条通路(MYB2、MYC2; RD26; AREB/ABF)依赖于ABA 信号途径, 2条通路(HD-ZIP和DREB2)不依赖于ABA 信号途径。但根据其调控模式, 干旱胁迫调控主要可分为4个层面: 转录水平调控、转录后水平调控、表观遗传学水平调控以及翻译后修饰水平调控(Hirayama and Shinozaki, 2010)。其中, 以转录水平调控的研究报道最多, 是研究得最清楚的一个层次, 已有很多评述文章对此进行了综合概括(Xiong et al., 2002; Zhu, 2002; Yamaguchi-Shinozaki and Shi-nozaki, 2006; Nakashima et al., 2009; Hirayama and Shinozaki, 2010)。翻译后修饰水平调控主要包括泛素化修饰、SUMO化修饰和磷酸化修饰等, 是目前植物应对干旱胁迫调控机制研究的一个热点。
2植物泛素连接酶E3
2.1泛素化过程及泛素化酶
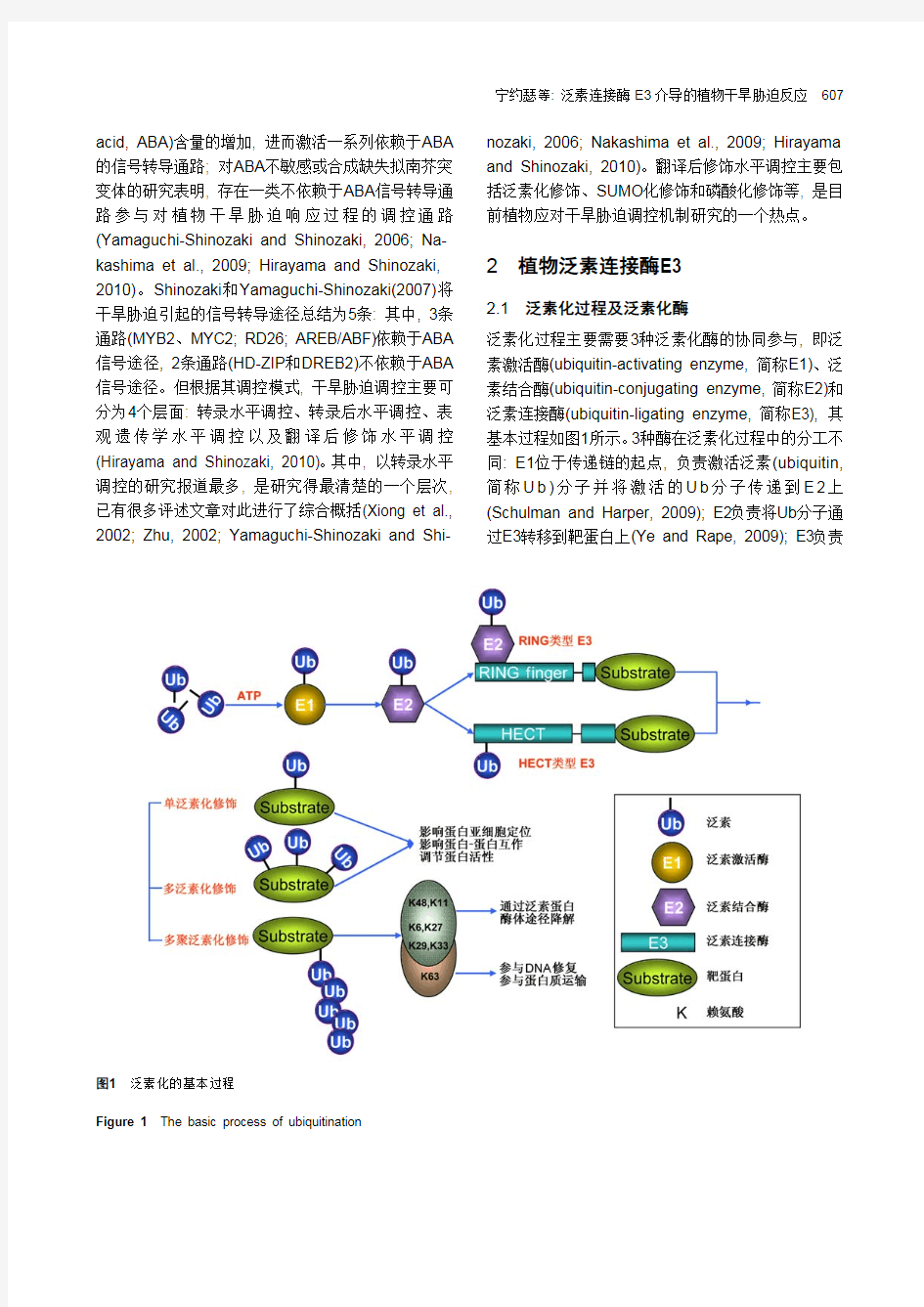
泛素化过程主要需要3种泛素化酶的协同参与, 即泛素激活酶(ubiquitin-activating enzyme, 简称E1)、泛素结合酶(ubiquitin-conjugating enzyme, 简称E2)和泛素连接酶(ubiquitin-ligating enzyme, 简称E3), 其基本过程如图1所示。3种酶在泛素化过程中的分工不同: E1位于传递链的起点, 负责激活泛素(ubiquitin, 简称U b)分子并将激活的U b分子传递到E2上(Schulman and Harper, 2009); E2负责将Ub分子通过E3转移到靶蛋白上(Ye and Rape, 2009); E3负责
图1泛素化的基本过程
Figure 1The basic process of ubiquitination
608 植物学报 46(6) 2011
对靶蛋白的特异识别。根据其亚基成分和作用机制, 泛素连接酶E3可分为单亚基类型(如HECT、RING/U- box)和多亚基类型(如SCF复合物、后期促进复合物(APC)、CUL3-BTB、CUL4-DDB等)(Vierstra, 2009) (图2)。
泛素化过程的一个重要特点是E1s、E2s、E3s 的数量在同一基因组中存在较大差异。如拟南芥(Arabidopsis thaliana)中, 编码E1的基因有2个, 编码E2及E2-like的基因有45个, 而编码E3的基因数量则超过1 300个(Smalle and Vierstra, 2004)。类似的, 在水稻(Oryza sativa)中, 编码E1的基因有6个, 编码E2及E2-like的基因有49个, 而编码E3的基因数量超过1 300个(Du et al., 2009)。因此, 泛素化酶存在一个层级结构: 单个的E1可激活Ub分子并将其传递到一系列E2(E2a、E2b、E2c……)上; 一般认为, 1个E2可以和多种E3协同作用将Ub传递到靶蛋白上, 但也有特异性的E2-E3互作; E3可特异地识别靶蛋白, 1个E3也可识别一系列靶蛋白, 同一靶蛋白也可被不同E3识别(Ciechanover, 1998)。
2.2 泛素化修饰
根据结合到靶蛋白上的Ub分子的数量、结合方式以及对赖氨酸残基的选择, 泛素连接酶E3对靶蛋白的泛素化修饰呈现多元化。只转移1个Ub分子到靶蛋白的单个赖氨酸残基上时称为单泛素化(monoubi- quitylation); 对靶蛋白的多个赖氨酸残基进行单泛素化修饰时称为多泛素化(multiubiquitylation); 靶蛋白的单个赖氨酸残基被一连串相互连接的Ub分子修饰时称为多聚泛素化(polyubiquitylation)(Hochstras- ser, 2006; Mukhopadhyay and Riezman, 2007; Vierstra, 2009; Ye and Rape, 2009)。研究表明, 单泛素化和多泛素化修饰可改变靶蛋白的亚细胞定位、
图2不同类型的泛素连接酶E3
Figure 2Different types of E3 ubiquitin ligase
宁约瑟等:泛素连接酶E3介导的植物干旱胁迫反应 609
蛋白-蛋白相互作用以及调节蛋白的活性等(Mukhop- adhyay and Riezman, 2007; Ye and Rape, 2009)。Ub分子自身包含7个赖氨酸, 因此Ub分子C末端的甘氨酸同样可以和其它Ub分子的赖氨酸残基共价结合形成多聚Ub链。根据相结合Ub分子赖氨酸残基位点的不同, 多聚泛素化分为K6、K11、K27、K29、K33、K48和K63七种形式(图1)。其中, K11和K48两种多聚泛素化修饰主要参与泛素/26S蛋白酶体对靶蛋白的降解过程(Vierstra, 2009; Xu et al., 2009; Ye and Rape, 2009); K63多聚泛素化修饰在动物和酵母中主要参与蛋白质运输、DNA修复以及激活NF-κB等(Jin et al., 2010; Li et al., 2010)。Xu等(2009)对这7类多聚泛素化修饰的作用机制进行了深入研究, 结果表明这7种多聚泛素化形式在体内、体外都可以被检测到, 而且除了K63多聚泛素化修饰, 其它6类多聚泛素化修饰的蛋白都受蛋白酶抑制剂MG132的调控, 说明这6类多聚泛素化修饰的蛋白都可通过泛素/26S蛋白酶体途径降解。但是除了K11和K48, 尚未分离到其它4种多聚泛素化修饰的靶蛋白, 它们究竟参与对蛋白质的泛素化降解还是参与对DNA修复的调控或者其它调控过程, 还需要进一步的研究(Xu et al., 2009; Ye and Rape, 2009)。
2.3 植物泛素连接酶E3参与的生物学过程
泛素化酶的层级结构分布以及泛素化修饰的多样性决定了泛素连接酶E3生物学调控功能的多样性。已有研究表明, 在植物中, 泛素连接酶E3涉及对植物生长发育和逆境胁迫响应等过程中关键步骤的控制, 如激素信号转导(宋素胜和谢道昕, 2006; Dreher and Cal-lis, 2007; Santner and Estelle, 2010)、开花(Vega-Sánchez et al., 2008; Park et al., 2010a)、胚胎发生(Zhang et al., 2008a; Book et al., 2009)、光信号调节(Hoecker, 2005; Henriques et al., 2009)、细胞周期调节(Liu et al., 2008b; Ren et al., 2008; Lai et al., 2009)、植物细胞程序化死亡(Zeng et al., 2004; Lin et al., 2008)、植物与病原菌相互作用(Zeng et al., 2006; Craig et al., 2009; Trujillo and Shirasu, 2010)、冷胁迫(Dong et al., 2006)以及自交不亲和(Qiao et al., 2004; 于晓敏等, 2006; Zhang et al., 2009)等过程。3植物泛素连接酶E3介导的植物干旱胁迫反应
植物泛素连接酶E3在植物干旱胁迫调控过程中同样发挥着重要作用, 目前已鉴定出SCF复合体、U-box 及RING-finger等类型泛素连接酶E3参与植物的干旱胁迫调控过程(表1)。下文将分述不同类型泛素连接酶E3参与的植物干旱胁迫调控过程。
3.1 SCF复合体类型泛素连接酶参与的植物干旱胁迫调控过程
F-box是SCF复合体中负责底物识别的组分, 拟南芥基因组中编码F-box的基因至少有700个(Risseeuw et al., 2003)。Zhang等(2008b)在拟南芥中鉴定到一个ABA信号通路上的负调节子DOR。DOR编码F-box 蛋白, 属于AhSFL家族成员, 与ASK14和CUL1存在特异性的相互作用。dor突变体相比野生型对ABA更敏感。DOR突变促进气孔关闭, 进而增强植物对干旱的耐受性; DOR过表达植物则对干旱胁迫更敏感, 说明DOR负调控植物的干旱胁迫响应过程。进一步的研究表明, DOR作用于ABI1的上游但并不依赖于PLDa1信号通路; 基因芯片分析结果显示, DOR在干旱情况下可能参与了对ABA合成的调控; 说明DOR 通过独立于PLDa1通路的ABA信号通路抑制气孔关闭, 从而负调控植物的干旱胁迫响应过程(Zhang et al., 2008b)。
3.2U-box类型泛素连接酶参与的植物干旱胁迫调控过程
CaPUB1是Cho等(2006)从干旱处理的辣椒(Capsi- cum annuum)中分离出来的一个U-box E3蛋白, 在拟南芥中异源过表达CaPUB1削弱了植物对干旱胁迫的耐受性, 说明CaPUB1负调控植物的干旱胁迫响应过程。酵母双杂交和pull-down分析表明, CaPUB1与RPN6存在相互作用, 且CaPUB1可在体外泛素化RPN6, 结合RPN6在CaPUB1过表达株系中表达量下降的证据, 推测CaPUB1可能通过泛素化修饰RPN6调控植物的干旱胁迫响应过程(Cho et al., 2006)。类似的, Cho等(2008)报道, CaPUB1在拟南芥中的2个同源蛋白PUB22和PUB23也参与植物的干旱胁迫响应过程, pub22 pub23双突变体比pub22和
610 植物学报 46(6) 2011
表1参与植物干旱胁迫反应的泛素连接酶E3
Table 1The ubiquitin ligase E3 involved in drought response in plant
基因 E3类型物种干旱反应互作蛋白与ABA信号的
关系
作用机制参考文献
DOR SCF 拟南芥负调控 ASK14和CUL1 依赖 ABA不敏感, 抑制气孔关闭Zhang et al., 2008b CaPUB1 U-box 拟南芥负调控RPN6 不依赖泛素化修饰RPN6 Cho et al., 2006 PUB22/PUB23 U-box 拟南芥负调控RPN12a 不依赖泛素化修饰RPN12a Cho et al., 2008 AtPUB19 U-box 拟南芥负调控– 依赖 ABA不敏感, 抑制气孔关闭Liu et al., 2011 OsPUB15 U-box 水稻正调控– –
减弱细胞内氧化胁迫Park et al., 2011 XERICO RING finger 拟南芥正调控 AtUBC8和AtTLP9依赖促进ABA合成Ko et al., 2006 SDIR1 RING finger 拟南芥正调控– 依赖 ABA敏感, 促进气孔关闭Zhang et al., 2007 SDIR1 RING finger 水稻、烟草正调控– –
减小气孔开度Zhang et al., 2008c OsSDIR1 RING finger 水稻、拟南芥正调控– –
ABA敏感, 促进气孔关闭Gao et al., 2011 DRIP1/DRIP2 RING finger 拟南芥负调控DREB2A 依赖泛素化修饰DREB2A Qin et al., 2008 Rma1H1 RING finger 拟南芥正调控PIP2;1 – 泛素化修饰PIP2;1 Lee et al., 2009 OsRDCP1 RING finger 水稻正调控– – – Bae et al., 2011 AtAIRP1 RING finger 拟南芥正调控– 依赖 ABA敏感, 促进气孔关闭Ryu et al., 2010 RHA2b RING finger 拟南芥正调控– 依赖 ABA敏感, 促进气孔关闭Li et al., 2011 OsDSG1 RING finger 水稻负调控OsABI3 依赖抑制ABA信号Park et al., 2010b OsBIRF1 RING finger 水稻正调控– – – Liu et al., 2008a CaRFP1 RING finger 拟南芥正调控CABPR1 依赖 ABA敏感Hong et al., 2007 AtSAP5 RING finger 拟南芥正调控– 依赖或不依赖减小气孔开度Kang et al., 2011
pub23单突变体具有更强的耐旱性, 说明PUB22和PUB23可协同负调控植物的干旱胁迫响应过程。PUB22和PUB23都可以与RPN12a相互作用, 且PUB22和PUB23都可在体内、体外泛素化修饰RPN12a, 说明PUB22和PUB23可能通过协同泛素化修饰RPN12a负调控植物的干旱胁迫响应过程(Cho et al., 2008)。
Liu等(2011)鉴定出一个受干旱、高盐、冷以及ABA诱导的U-box E3蛋白AtPUB19。atpub19突变体与野生型相比, 对ABA更敏感。AtPUB19突变促进气孔关闭, 进而增强植物对干旱的耐受性; AtPUB19过表达植物对ABA不敏感, 对干旱更敏感。一系列ABA 和胁迫相关基因在atpub19突变体和AtPUB19过表达植物中表达量明显变化, 说明AtPUB19可能通过负调节ABA信号调控植物的干旱胁迫响应过程(Liu et al., 2011)。
近年来在水稻中也鉴定出参与干旱胁迫响应过程调控的U-box类型泛素连接酶E3。ospub15突变体中由于积累了较高浓度的过氧化氢和氧化蛋白, 导致植株生长缓慢, 幼苗致死; 而OsPUB15过表达植物则增强了对干旱的耐受性, OsPUB15的表达受过氧化氢、干旱和高盐的诱导, 说明OsPUB15可能通过减弱细胞内氧化胁迫, 正调控植物的干旱胁迫响应过程(Park et al., 2011)。
3.3 RING-finger类型泛素连接酶参与的植物干旱胁迫调控过程
最早鉴定的参与干旱胁迫响应过程调控的RING- finger类型泛素连接酶是拟南芥的XERICO基因, 其编码RING-H2锌指类型E3泛素连接酶, 与AtUBC8和AtTLP9存在特异性相互作用。在拟南芥中过表达XERICO时植物对干旱的耐受性显著增强, 说明XERICO正调控植物的干旱胁迫响应过程。在干旱处理情况下, XERICO过表达株系中ABA合成关键基因AtNCED3的表达相比对照更加快速而强烈, 而且XERICO过表达株系中ABA含量升高, 说明XERICO 可能通过增强ABA生物合成, 正调控植物的干旱胁迫响应过程(Ko et al., 2006)。
SDIR1是从干旱处理的拟南芥的芯片数据中分离出来的RING-finger类型E3。相比对照, SDIR1过表达植物对ABA更加敏感。SDIR1的过表达促进气孔关闭, 使叶片气孔开度减小, 水分蒸发减少, 从而使植
宁约瑟等:泛素连接酶E3介导的植物干旱胁迫反应 611
物耐旱能力提高。进一步的研究表明, SDIR1是ABA 信号转导的正调控因子, SDIR1的过表达改变了一系列ABA和干旱胁迫相关基因的表达, 提高了植物体内ABA诱导叶片气孔关闭的敏感性, 说明SDIR1通过介导ABA信号转导正调控植物的干旱胁迫响应过程(Zhang et al., 2007)。SDIR1在烟草(Nicotiana ta-bacum)和水稻中的异源表达显示, 过表达植物与对照相比耐旱性明显增强, 主要原因是SDIR1过表达减少了转基因植物的叶片水分蒸发, 与SDIR1在拟南芥中的作用机制类似(Zhang et al., 2008c)。Gao等(2011)通过同源克隆的方法分离了SDIR1在水稻中的同源蛋白OsSDIR1。OsSDIR1可以互补拟南芥sdir1突变体的表型, 说明OsSDIR1是拟南芥SDIR1蛋白在水稻中的同源蛋白。OsSDIR1过表达也可以明显增强植物对干旱的耐受性, 其主要原因是在干旱条件下转基因水稻中关闭气孔的比例增加, 叶片失水减慢, 从而使植物耐旱能力提高(Gao et al., 2011)。
转录因子DREB2A是干旱胁迫响应途径中重要的正调控因子。Qin等(2008)利用酵母双杂交技术筛选到DREB2A的2个相互作用蛋白DRIP1和DRIP2, 体外泛素化实验表明, DRIP1和DRIP2均可介导对DREB2A的泛素化修饰。在拟南芥中过表达DRIP1时明显延迟了DREB2A调控的干旱响应基因的表达, 而drip1drip2双突变则显著增强了DREB2A调控的干旱响应基因的表达, 提高了植物对干旱的耐受性, 说明DRIP1和DRIP2通过降解干旱响应正调节因子DREB2A而负调控植物的干旱胁迫响应过程(Qin et al., 2008)。
辣椒E3蛋白Rma1H1编码RING-finger类型泛素连接酶, 在拟南芥中异源过表达Rma1H1明显增强了植物对干旱的耐受性, 说明Rma1H1正调控植物的干旱胁迫响应过程; 另一方面, 过表达Rma1H1抑制了水通道蛋白PIP2;1从内质网到细胞膜的运输, 从而导致原生质体和转基因植物中PIP2;1的积累水平下降(Lee et al., 2009)。酵母双杂交分析表明Rma1H1可以和PIP2;1相互作用, 且Rma1H1可以介导PIP2;1的体外泛素化修饰, 说明Rma1H1通过降解水通道蛋白PIP2;1正调控植物的干旱胁迫响应过程(Lee et al., 2009)。Bae等(2011)报道, 辣椒Rma1H1在水稻中的同源蛋白OsRDCP1参与对水稻干旱胁迫响应过程的正调控, 但是其具体作用机制仍不清楚。
AtAIRP1是在筛选ABA不敏感突变体过程中鉴定出来的。与野生型相比, atairp1突变体对ABA不敏感, 对干旱更敏感; 相反, AtAIRP1过表达植物表现出对ABA更敏感和对干旱的明显耐受性; ABA处理后, 一系列干旱胁迫相关基因和ABA相关的bZIP转录因子的表达在AtAIRP1过表达植物中明显被诱导, 说明AtAIRP1是依赖于ABA信号通路的干旱响应正调节因子(Ryu et al., 2010)。
rha2b-1突变体与sdir1和atairp1突变体对ABA和干旱有着类似的响应模式, 即对ABA不敏感, 对干旱更敏感, 说明RHA2b正调控植物的干旱胁迫响应过程。对rha2a rha2b-1双突变体的研究表明, RHA2b和RHA2a可以协同参与对ABA和干旱的响应调控。遗传学分析显示, 与RHA2a类似, RHA2b在ABA信号途径中位于ABI2的下游, 与ABI转录因子ABI3/4/5平行, 说明RHA2b和RHA2a协同调控ABA信号转导, 进而正调控植物的干旱胁迫响应过程(Li et al., 2011)。
OsDSG1是从种子延迟萌发的水稻T-DNA突变体中鉴定出来的。除了延迟种子萌发, osdsg1突变体与野生型相比, 对干旱和高盐的耐受性增强。一系列ABA信号通路基因和ABA响应基因在突变体中被诱导表达。酵母双杂交实验显示OsDSG1与OsABI3存在相互作用, 但二者之间的调节机制仍不清楚, 说明OsDSG1是依赖于ABA信号转导的干旱胁迫响应负调节子(Park et al., 2010b)。
此外, 在烟草中异源过表达OsBIRF1时, 植物对干旱的耐受性明显增强, 但是其作用机制仍不清楚(Liu et al., 2008a)。辣椒CaRFP1也可能通过ABA信号途径正调控植物的干旱胁迫响应过程(Hong et al., 2007)。而AtSAP5则可能通过一种ABA依赖性和ABA 不依赖性交叉的作用机制正调控植物的干旱胁迫响应过程(Kang et al., 2011)。
4植物泛素连接酶E3调控干旱胁迫响应过程的可能机制
泛素连接酶E3蛋白的生化功能是特异性地给靶蛋白加上Ub标签, 从而形成Ub-靶蛋白复合体。因此, 对E3靶蛋白的筛选和研究对于揭示E3的作用机制显得至关重要。表1中列出了18组参与植物干旱胁迫响应过程的泛素连接酶, 其中有4组的靶蛋白目前已得到
612 植物学报 46(6) 2011
图3E3通过泛素化修饰靶蛋白调控干旱胁迫响应过程
Figure 3The E3s regulate drought response by ubiquitination-target proteins
验证, 所以我们按是否通过泛素化修饰靶蛋白对其作用机制进行分类概述。
4.1 通过泛素化修饰已知靶蛋白
对U-box蛋白CaPUB1、PUB22/23以及RING-finger 蛋白DRIP1/DRIP2、Rma1H1的研究均表明, 泛素连接酶E3可以通过泛素化修饰靶蛋白调控植物的干旱胁迫响应过程(图3)(Cho et al., 2006, 2008; Qin et al., 2008; Lee et al., 2009)。除了Rma1H1, 其余3组蛋白都是植物干旱响应的负调节子。根据泛素蛋白酶体途径的生化功能推测, 作为正调节子的泛素连接酶可能通过泛素化修饰降解干旱响应的负调控因子, 而作为负调节子的泛素连接酶可能通过泛素化修饰降解干旱响应的正调控因子。
4.2不通过泛素化修饰已知靶蛋白
对尚未验证靶蛋白的其它14组泛素连接酶E3来说, 应该也存在其相应的靶蛋白, 但目前研究大多集中在与ABA信号途径的相互作用方面, 目前尚未对此予以确认。
DOR和AtPUB19突变促进气孔关闭, dor和atpub19突变体对ABA敏感, 因此DOR和AtPUB19通过ABA依赖的信号途径负调控植物的干旱胁迫响应过程(Zhang et al., 2008b; Liu et al., 2011); 而SDIR1、AtAIRP1和RHA2b在植物中过表达促进气孔关闭, 其过表达转基因植物对ABA敏感, 所以SDIR1、AtAIRP1和RHA2b等ABA信号正调节子正调控植物的干旱胁迫响应过程(Zhang et al., 2007; Ryu et al., 2010; Li et al., 2011)。即参与ABA信号途径的泛素连接酶E3都因其正或负向调控ABA信号而影响气孔开闭, 进而调节植物的干旱胁迫响应过程。
此外, 对XERICO的研究表明, 增强ABA的生物合成可提高植物对干旱的耐受性(Ko et al., 2006)。而对OsPUB15的研究则表明, 减弱细胞内氧化胁迫也可增强植物对干旱的耐受性(Park et al., 2011)。
5问题和展望
泛素连接酶E3在植物干旱胁迫响应过程中起着重要的作用, 但是对其研究还远远不够, 其作用机制仍不清楚。拟南芥和水稻中泛素连接酶E3的数目都超过1300个, 但目前在拟南芥和水稻中鉴定出的参与植物干旱胁迫调控的泛素连接酶E3分别只有11个和5个, 不到其家族总数的1%。干旱胁迫可以影响植物细胞生理生化过程的多个方面, 因此, 还有更多的参与植物干旱胁迫调控的泛素连接酶E3有待鉴定和研究。
宁约瑟等:泛素连接酶E3介导的植物干旱胁迫反应 613
在已发现的18组参与植物干旱胁迫响应过程的泛素连接酶E3中, 通过不同分析方法已找到了其中8组E3的相互作用蛋白, 但只有4个靶蛋白受其相应E3的泛素化修饰调控, 说明泛素连接酶E3相互作用蛋白的鉴定及其对互作蛋白翻译后修饰水平的调控研究更显不足, 建立一种高效可行的泛素连接酶E3互作蛋白的鉴定方法显得尤为迫切。
另一方面, 目前只鉴定到SCF复合体、U-box及RING-finger等类型的泛素连接酶E3参与对植物的干旱胁迫调控, 其它类型的泛素连接酶E3是否也参与了对植物干旱胁迫的调控还不得而知。对更多参与干旱胁迫调控的泛素连接酶的分析及其相互作用蛋白的鉴定将为植物干旱胁迫在翻译后修饰水平上的调控研究提供新线索, 并最终为构建植物干旱胁迫的调控网络和培育抗旱农作物新品种提供理论依据。
参考文献
宋素胜, 谢道昕 (2006). 泛素蛋白酶体途径及其对植物生长发育的调控. 植物学通报23, 564–577.
于晓敏, 蓝兴国, 李玉花(2006). 泛素/26S蛋白酶体途径与显花植物自交不亲和反应. 植物学通报23, 197–206. Ahuja I, de Vos RCH, Bones AM, Hall RD (2010). Plant molecular stress responses face climate change. Trends Plant Sci15, 664–674.
Bae H, Kim SK, Cho SK, Kang BG, Kim WT (2011).
Overexpression of OsRDCP1, a rice RING domain-con- taining E3 ubiquitin ligase, increased tolerance to drought stress in rice (Oryza sativa L.). Plant Sci180, 775–782. Book AJ, Smalle J, Lee KH, Yang PZ, Walker JM, Casper S, Holmes JH, Russo LA, Buzzinotti ZW, Jenik PD, Vierstra RD (2009). The RPN5 subunit of the 26S pro-teasome is essential for gametogenesis, sporophyte de-velopment, and complex assembly in Arabidopsis. Plant Cell 21, 460–478.
Boyer JS (1982). Plant productivity and environment. Sci-ence218,443–448.
Cho SK, Chung HS, Ryu MY, Park MJ, Lee MM, Bahk YY, Kim J, Pai HS, Kim WT (2006). Heterologous expression and molecular and cellular characterization of CaPUB1 encoding a hot pepper U-Box E3 ubiquitin ligase homolog.
Plant Physiol142, 1664–1682.
Cho SK, Ryu MY, Song C, Kwak JM, Kim WT (2008).
Arabidopsis PUB22 and PUB23 are homologous U-Box E3 ubiquitin ligases that play combinatory roles in re-
sponse to drought stress. Plant Cell20, 1899–1914.
Ciais P, Reichstein M, Viovy N, Granier A, Ogée J, Allard V, Aubinet M, Buchmann N, Bernhofer C, Carrara A, Chevallier F, De Noblet N, Friend AD, Friedlingstein P, Grünwald T, Heinesch B, Keronen P, Knohl A, Krinner G, Loustau D, Manca G, Matteucci G, Miglietta F, Ourcival JM, Papale D, Pilegaard K, Rambal S, Seufert G, Soussana JF, Sanz MJ, Schulze ED, Vesala T, Valentini R (2005). Europe-wide reduction in primary productivity caused by the heat and drought in 2003. Na-ture437, 529–533.
Ciechanover A (1998). The ubiquitin-proteasome pathway: on protein death and cell life. EMBO J17, 7151–7160. Craig A, Ewan R, Mesmar J, Gudipati V, Sadanandom A (2009). E3 ubiquitin ligases and plant innate immunity. J Exp Bot60, 1123–1132.
Dong CH, Agarwal M, Zhang YY, Xie Q, Zhu JK (2006).
The negative regulator of plant cold responses, HOS1, is
a RING E3 ligase that mediates the ubiquitination and
degradation of ICE1. Proc Natl Acad Sci USA103, 8281– 8286.
Dreher K, Callis J (2007). Ubiquitin, hormones and biotic stress in plants. Ann Bot99, 787–822.
Du Z, Zhou X, Li L, Su Z (2009). plantsUPS: a database of plants' Ubiquitin Proteasome System. BMC Genomics10, 227.
Gao T, Wu YR, Zhang YY, Liu LJ, Ning YS, Wang DJ, Tong HN, Chen SY, Chu CC, Xie Q (2011). OsSDIR1 overexpression greatly improves drought tolerance in transgenic rice. Plant Mol Biol76, 145–156.
Henriques R, Jang IC, Chua NH (2009). Regulated prote-olysis in light-related signaling pathways. Curr Opin Plant Biol12, 49–56.
Hirayama T, Shinozaki K (2010). Research on plant abiotic stress responses in the post-genome era: past, present and future. Plant J61, 1041–1052.
Hochstrasser M (2006). Lingering mysteries of ubiq-uitin-chain assembly. Cell124, 27–34.
Hoecker U (2005). Regulated proteolysis in light signaling.
Curr Opin Plant Biol8, 469–476.
Hong JK, Choi HW, Hwang IS, Hwang BK (2007). Role of
a novel pathogen-induced pepper C3-H-C4 type RING-
finger protein gene, CaRFPI, in disease susceptibility and osmotic stress tolerance. Plant Mol Biol 63, 571–588.
Jin XJ, Jin HR, Jung HS, Lee SJ, Lee JH, Lee JJ (2010).
An atypical E3 ligase zinc finger protein 91 stabilizes and activates NF-κB-inducing kinase via Lys63-linked ubiquit-
614 植物学报 46(6) 2011
ination. J Biol Chem285, 30539–30547.
Kang MY, Fokar M, Abdelmageed H, Allen RD (2011).
Arabidopsis SAP5 functions as a positive regulator of stress responses and exhibits E3 ubiquitin ligase activity.
Plant Mol Biol75, 451–466.
Ko JH, Yang SH, Han KH (2006). Upregulation of an Arabidopsis RING-H2 gene, XERICO, confers drought tolerance through increased abscisic acid biosynthesis.
Plant J47, 343–355.
Lai JB, Chen H, Teng KL, Zhao QZ, Zhang ZH, Li Y, Liang LM, Xia R, Wu YR, Guo HS, Xie Q (2009). RKP, a RING finger E3 ligase induced by BSCTV C4 protein, affects geminivirus infection by regulation of the plant cell cycle.
Plant J57, 905–917.
Lee HK, Cho SK, Son O, Xu ZY, Hwang I, Kim WT (2009).
Drought stress-induced Rma1H1, a RING membrane- anchor E3 ubiquitin ligase homolog, regulates aquaporin levels via ubiquitination in transgenic Arabidopsis plants.
Plant Cell21, 622–641.
Li HM, Jiang HL, Bu QY, Zhao QZ, Sun JQ, Xie Q, Li CY (2011). The Arabidopsis RING finger E3 ligase RHA2b acts additively with RHA2a in regulating abscisic acid signaling and drought response. Plant Physiol156, 550– 563.
Li J, Wen R, Andersen P, Liang YP, Li Q, Xiao W, Cui ZB (2010). Zebrafish Ubc13 is required for Lys63-linked polyubiquitination and DNA damage tolerance. Mol Cell Biochem343, 173–182.
Lin SS, Martin R, Mongrand S, Vandenabeele S, Chen KC, Jang IC, Chua NH (2008). RING1 E3 ligase localizes to plasma membrane lipid rafts to trigger FB1-induced programmed cell death in Arabidopsis. Plant J56, 550– 561.
Liu HZ, Zhang HJ, Yang YY, Li GJ, Yang YX, Wang XE, Basnayake BM, Li DY, Song FM (2008a). Functional analysis reveals pleiotropic effects of rice RING-H2 finger protein gene OsBIRF1 on regulation of growth and de-fense responses against abiotic and biotic stresses. Plant Mol Biol68, 17–30.
Liu JJ, Zhang YY, Qin GJ, Tsuge T, Sakaguchi N, Luo G, Sun KT, Shi DQ, Aki S, Zheng NY, Aoyama T, Oka A, Yang WC, Umeda M, Xie Q, Gu HY, Qu LJ (2008b).
Targeted degradation of the cyclin-dependent kinase in-hibitor ICK4/KRP6 by RING-type E3 ligases is essential for mitotic cell cycle progression during Arabidopsis ga-metogenesis. Plant Cell20, 1538–1554.
Liu YC, Wu YR, Huang XH, Sun J, Xie Q (2011). AtPUB19,
a U-Box E3 ubiquitin ligase, negatively regulates abscisic
acid and drought responses in Arabidopsis thaliana. Mol Plant, doi:10.1093/mp/ssr030.
Luo LJ (2010). Breeding for water-saving and drought- resistance rice (WDR) in China. J Exp Bot61, 3509–3517. Mukhopadhyay D, Riezman H (2007). Proteasome-inde- pendent functions of ubiquitin in endocytosis and signal-ing. Science315, 201–205.
Nakashima K, Ito Y, Yamaguchi-Shinozaki K (2009).
Transcriptional regulatory networks in response to abiotic stresses in Arabidopsis and grasses. Plant Physiol149, 88–95.
Park BS, Eo HJ, Jang IC, Kang HG, Song JT, Seo HS (2010a). Ubiquitination of LHY by SINAT5 regulates flowering time and is inhibited by DET1. Biochem Biophys Res Commun398, 242–246.
Park GG, Park JJ, Yoon J, Yu SN, An G (2010b). A RING finger E3 ligase gene, Oryza sativa Delayed Seed Ger-mination 1(OsDSG1), controls seed germination and stress responses in rice. Plant Mol Biol74, 467–478.
Park JJ, Yi J, Yoon J, Cho LH, Ping J, Jeong HJ, Cho SK, Kim WT, An G (2011). OsPUB15, an E3 ubiquitin ligase, functions to reduce cellular oxidative stress during seed-ling establishment. Plant J65, 194–205.
Peleg Z, Blumwald E (2011). Hormone balance and abiotic stress tolerance in crop plants. Curr Opin Plant Biol 14, 290–295.
Qiao H, Wang HY, Zhao L, Zhou JL, Huang J, Zhang YS, Xue YB (2004). The F-box protein AhSLF-S2 physically interacts with S-RNases that may be inhibited by the ubiquitin/26S proteasome pathway of protein degradation during compatible pollination in Antirrhinum. Plant Cell16, 582–595.
Qin F, Sakuma Y, Tran LSP, Maruyama K, Kidokoro S, Fujita Y, Fujita M, Umezawa T, Sawano Y, Miyazono K, Tanokura M, Shinozaki K, Yamaguchi-Shinozaki K (2008). Arabidopsis DREB2A-interacting proteins function as RING E3 ligases and negatively regulate plant drought stress-responsive gene expression. Plant Cell20, 1693– 1707.
Ren H, Santner A, del Pozo JC, Murray JAH, Estelle M (2008). Degradation of the cyclin-dependent kinase in-hibitor KRP1 is regulated by two different ubiquitin E3 li-gases. Plant J53, 705–716.
Risseeuw EP, Daskalchuk TE, Banks TW, Liu EW, Cot- elesage J, Hellmann H, Estelle M, Somers DE, Crosby WL (2003). Protein interaction analysis of SCF ubiquitin
宁约瑟等:泛素连接酶E3介导的植物干旱胁迫反应 615
E3 ligase subunits from Arabidopsis. Plant J34, 753–767. Ryu MY, Cho SK, Kim WT (2010). The Arabidopsis C3H2C3-type RING E3 ubiquitin ligase AtAIRP1 is a positive regulator of an abscisic acid-dependent response to drought stress. Plant Physiol154, 1983–1997.
Santner A, Estelle M (2010). The ubiquitin-proteasome system regulates plant hormone signaling. Plant J61, 1029–1040.
Schulman BA, Harper JW (2009). Ubiquitin-like protein activation by E1 enzymes: the apex for downstream sig-nalling pathways. Nat Rev Mol Cell Biol10, 319–331. Shinozaki K, Yamaguchi-Shinozaki K (2007). Gene net-works involved in drought stress response and tolerance.
J Exp Bot58, 221–227.
Shinozaki K, Yamaguchi-Shinozaki K, Seki M (2003).
Regulatory network of gene expression in the drought and cold stress responses. Curr Opin Plant Biol6, 410–417. Smalle J, Vierstra RD (2004). The ubiquitin 26S protea-some proteolytic pathway. Annu Rev Plant Biol55, 555– 590.
Takeda S, Matsuoka M (2008). Genetic approaches to crop improvement: responding to environmental and popula-tion changes. Nat Rev Genet9, 444–457.
Trujillo M, Shirasu K (2010). Ubiquitination in plant immu-nity. Curr Opin Plant Biol13, 402–408.
Vega-Sánchez ME, Zeng LR, Chen SB, Leung H, Wang GL (2008). SPIN1, a K homology domain protein nega-tively regulated and ubiquitinated by the E3 ubiquitin li-gase SPL11, is involved in flowering time control in rice.
Plant Cell20, 1456–1469.
Vierstra RD (2009). The ubiquitin-26S proteasome system at the nexus of plant biology. Nat Rev Mol Cell Biol10, 385–397.
Xiong LM, Schumaker KS, Zhu JK (2002). Cell signaling during cold, drought, and salt stress. Plant Cell 14(Suppl), S165–S183.
Xu P, Duong DM, Seyfried NT, Cheng DM, Xie Y, Robert J, Rush J, Hochstrasser M, Finley D, Peng JM (2009).
Quantitative proteomics reveals the function of unconven-tional ubiquitin chains in proteasomal degradation. Cell 137, 133–145. Yamaguchi-Shinozaki K, Shinozaki K (2006). Transcrip-tional regulatory networks in cellular responses and tol-erance to dehydration and cold stresses. Annu Rev Plant Biol57, 781–803.
Yang SJ, Vanderbeld B, Wan JX, Huang YF (2010). Nar-rowing down the targets: towards successful genetic en-gineering of drought-tolerant crops. Mol Plant3, 469–490. Ye YH, Rape M (2009). Building ubiquitin chains: E2 en-zymes at work. Nat Rev Mol Cell Biol10, 755–764.
Zeng LR, Qu SH, Bordeos A, Yang CW, Baraoidan M, Yan HY, Xie Q, Nahm BH, Leung H, Wang GL (2004).
Spotted leaf11, a negative regulator of plant cell death and defense, encodes a U-box/armadillo repeat protein endowed with E3 ubiquitin ligase activity. Plant Cell16, 2795–2808.
Zeng LR, Vega-Sánchez ME, Zhu T, Wang GL (2006).
Ubiquitination-mediated protein degradation and modifi-cation: an emerging theme in plant-microbe interactions.
Cell Res16, 413–426.
Zhang Y, Feng S, Chen F, Chen H, Wang J, McCall C, Xiong Y, Deng XW (2008a). Arabidopsis DDB1-CUL4 ASSOCIATED FACTOR1 forms a nuclear E3 ubiquitin li-gase with DDB1 and CUL4 that is involved in multiple plant developmental processes. Plant Cell20, 1437–1455.
Zhang Y, Xu WY, Li ZH, Deng XW, Wu WH, Xue YB (2008b). F-box protein DOR functions as a novel inhibi-tory factor for abscisic acid-induced stomatal closure un-der drought stress in Arabidopsis. Plant Physiol148, 2121–2133.
Zhang YJ, Zhao ZH, Xue YB (2009). Roles of proteolysis in plant self-incompatibility. Annu Rev Plant Biol60, 21–42. Zhang YY, Li Y, Gao T, Zhu H, Wang DJ, Zhang HW, Ning YS, Liu LJ, Wu YR, Chu CC, Guo HS, Xie Q (2008c).
Arabidopsis SDIR1 enhances drought tolerance in crop plants. Biosci Biotechnol Biochem72, 2251–2254.
Zhang YY, Yang CW, Li Y, Zheng NY, Chen H, Zhao QZ, Gao T, Guo HS, Xie Q (2007). SDIR1 is a RING finger E3 ligase that positively regulates stress-responsive abscisic acid signaling in Arabidopsis. Plant Cell19, 1912–1929. Zhu JK (2002). Salt and drought stress signal transduction in plants. Annu Rev Plant Biol53, 247–273.
616 植物学报 46(6) 2011
E3 Ubiquitin Ligase-mediated Drought Responses in Plants
Yuese Ning1, 2, Guoliang Wang1, Qi Xie2*
1Hunan Provincial Key Laboratory of Crop Germplasm Innovation and Utilization, Hunan Agricultural University, Changsha 410128, China; 2State Key Laboratory of Plant Genomics, National Center for Plant Gene Research, Institute of Genetics and
Developmental Biology, Chinese Academy of Sciences, Beijing 100101, China
Abstract Drought stress seriously affects crop yield and quality and constrains global agricultural production. E3 ubiq-uitin ligases are a large family with wide variety and are involved in many important biological processes in plants. In this paper, we summarize the drought stress regulation mechanism, plant ubiquitin ligase E3, and describe the ubiquitin ligase E3 response to plant drought stress and its mechanisms.
Key words drought, post-translational modification, ubiquitin, ubiquitin ligase E3
Ning YS, Wang GL, Xie Q (2011). E3 ubiquitin ligase-mediated drought responses in plants. Chin Bull Bot46, 606–616.———————————————
*Author for correspondence. E-mail: qxie@https://www.doczj.com/doc/62640246.html,
(责任编辑: 刘慧君)
前一阵子一直在做双酶切质粒重组,失败了很多次,不过很快改善了实验方法,用2周重组了14个质粒。现就自己的体会,谈一下质粒重组的一些个人经验。 1. 回收PCR产物: 在进行PCR扩增时候,给引物两端设计好酶切位点,一般说来,限制酶的选择非常重要,尽量选择粘端酶切和那些酶切效率高的限制酶。选好酶切位点后,在各个酶的两边加上保护碱基。 双酶切时间及其体系:需要强调的是很多人建议酶切过夜,其实完全没有必要,我一般酶切3个小时,其实1个小时已经足够。应用大体系,如100微升。 2. 纯化问题: 纯化PCR产物割胶还是柱式,我推荐柱式,因为割胶手法不准,很容易割下大块的胶,影响纯化效率。现在的柱式纯化号称可以祛除引物,既然如此,酶切掉的几个碱基肯定也会被纯化掉了。所以,PCR产物和双酶切产物的纯化均可应用柱式纯化。 3. 酶量的问题: 对1单位酶的定义如下:在50μl 反应液中,30℃温度下反应1小时,将1μg 的λDNA完全分解的酶量定义为1个活性单位(U)。而该酶浓度约为15单位/微升,在除外酶降解的因素外,该酶可分解15μg的DNA,而一般从1-4ml 菌液提出的DNA约为3μg,而PCR纯化后的产物(50体系)约为3μg,所以即便全部加进去,只要纯化的质量好,酶切完全切得动。 4. 酶切、回收后的PCR产物与载体的连接: 摩尔比的计算,很多人凭经验也可以。但对于初学者从头认真计算则非常有必要。回收的载体片段:回收的PC R产物片段=1:10,一般取前者0.03pmol,后者取0.3pmol。
pmol为单位的DNA转换为为μg单位的DNA:(X pmoles×长度bp×650)/ 1,000,000(注:长度bp×650是该双链DNA的分子量)所得数值即为μg,也可以直接用这个公式套。1pmol 1000bp DNA=0.66μg,如载体是5380b p,则0.03pmol为0.03×5.38×0.66=0.106524μg。 5. 测DNA浓度: 测DNA浓度可以在专用机子上测,注意OD值,一般约1.8-2.0.另外,如果嫌麻烦,也可用MARKER进行估测,如MARKER2000,5微升的MARKER每个条带约50ng。 6. 连接反应: TAKARA的连接酶上的说明写的过夜,而其对连接酶单位的定义为:在20 μl的连接反应体系中,6 μg的λD NA-Hind III的分解物在16℃下反应30分钟时,有90%以上的DNa段被连接所需要的酶量定义为1个活性单位(U)。而它的浓度为350 U/μl ,所以完全够用。连接酶容易失活,注意低温操作,最好在冰上。时间3个小时足已。 7.转化: ①全量(10 μl)加入至100μl JM109感受态细胞中,冰中放置30分钟。 ②42℃加热45秒钟后,再在冰中放置1分钟。 ③加入890 μl AMP阴性培养基,37℃振荡培养60分钟。 取100μl铺板。也可离心后余100μl 几个非常重要的问题: 1 做转化的时候,进行酶连接反应时,注意保持低温状态,因为LIGASE酶很容易降解。为保险起见,一般连接3小时,16度。
植物对干旱胁迫的响应及其研究进展 学院:班级: 姓名:学号: 摘要:植物在经受干旱胁迫时,通过细胞对干旱信号的感知和传导,调节基因表达,产生新蛋白质,从而引起大量形态、生理和生化上的变化.干旱胁迫对植物在细胞、器官、个体、群体等水平的形态指标有显著影响,也会影响其光合作用、渗透调节、抗氧化系统等生理生化指标.植物对干旱胁迫分子响应较复杂,包括合成一些新的基因如NCED、Dehydrin基因和CBF、DREB等转录因子.另外,干旱胁迫还能造成蛋白质组学的变化. 关键词干旱胁迫;生态响应;生理机制;研究进展干旱作为影响作物生长发育、基因表达、分布以及产量品质的重要因素之一,严重限制了作物的大面积扩展。植物对干旱的适应能力不仅与干旱强度、速度有关,而且更受其自身基因的调控。在一定干旱阀值(drought threshold)胁迫范围内,很多植物能够进行相关抗旱基因的表达,随之产生一系列生理、生化及形态结构等方面的变化,从而显现出抗旱性的综合性状。因此,从植物本身出发,深入研究植物的抗旱机理,揭示其抗旱特性,提高植物品种的抗旱耐旱能力,以降低作物栽培的用水量,同时最大程度提高作物的产量和品质,科学选育适宜广大干旱、半干旱地区种植的优良作物品种,已成为国内外专家学者们所特别关注和研究的热点问题,对于水资源的合理利用和生态环境的改善均有着重要的意义。 目前,生存资源、环境与农业可持续发展之间的矛盾日益突出,这就要求人们更应高度重视农业综合开发过程中作物逆境生物学的基础研究。 一、植物抗旱基因工程研究新进展 (一)与干旱胁迫相关的转录因子研究 通过转化调节基因来提高植物脱水胁迫的耐性是一条十分诱人的途径.由于在逆境条件下,这些逆境相关的转录因子,能与顺式作用重复元件结合,从而调节这些功能基因的表达和信号转导,它们在转基因植物中的过量表达会激活许多抗逆功能基因的同时表达.胁迫诱导基因能增强胁迫反应的耐力,不同的转录因子参与胁迫诱导基因的调控.遗传研究已经鉴
泛素-蛋白酶体通路与癌症关系的研究进展 张海满 (山东农业大学生命科学学院山东泰安201018) 摘要:泛素化过程是真核细胞内重要的蛋白质质控系统,参与细胞的多种生理活动过程,对维持细胞正常的生理功能具有十分重要的意义。泛素-蛋白酶体途径(UPP)的异常改变不仅与癌症的病因学有着直接关素,并且与癌症的发展和预后有着密切的关系。本文综述了泛素的构成、泛素链的形成过程、UPP的生理和病理功能及UPP与癌症的关系的研究进展。 关键词:泛素-蛋白酶体通路;UPP;癌症;研究 细胞内蛋白质的产生和降解必须保持着动态平衡,才能维持细胞的稳态和正常功能。泛素-蛋白酶体途径( ubiquitin-pro-teasome pathway, UPP)是细胞内蛋白质选择性降解的重要途径,泛素分子主要通过泛素活化酶、泛素结合酶和泛素-蛋白连接酶与靶蛋白结合形成一条多泛素链,将底物蛋白泛素化,使靶蛋白被26S蛋白酶体所识别和降解。UPP可高效并高选择性地降解细胞内蛋白质,尤其是一些短寿命的细胞周期调节蛋白、癌基因和抑癌基因产物以及变性变构蛋白等。 1.泛素-蛋白酶体途径(UPP)的构成 UPP成分十分复杂,主要包括泛素( ubiquitin, Ub)、泛素活化酶( ubiquitin-activatingenzyme, E1)、泛素连接酶( ubiquitin-conjugatingenzyme, E2)、泛素蛋白连接酶( ubiquitin-protein ligating enzyme, E3)、26S蛋白酶体及去泛素化酶( deubiquitinating enzyme, DUBs)等。UPP存在于所有真核生物的细胞内,是蛋白质选择性降解的主要方式。 1.1泛素( ubiquitin, Ub) 泛素是一种广泛分布在真核细胞中的高度保守的小分子球状蛋白质。1975年由Goldstein首次提出,此后不断出现有关报道[1]。单个泛素分子由76个氨基酸残基组成,相对分子质量约8.5×103,有一个明显的疏水核心和大量的氢键,表现出特殊的稳定性,能够防止其自身在结合和靶向性降解循环中变性失活,从而保证泛素循环的进行。依赖于ATP的酶促反应,E1通过在Ub的羧基末端和E1自身激活位点半胱氨酸之间形成一个硫酯键而激活Ub,激活的Ub被转到E2结合酶上,然后E2在E3作用下共价结合到需要降解的胞质或胞核的蛋白上,使底物蛋白发生泛素化,形成Ub单体,多个Ub单体通过异肽键连接形成多聚Ub链,每个多聚Ub链至少含有4个Ub单体。 1.2泛素活化酶( ubiquitin-activating enzymes, E1) 泛素活化酶是单基因编码的相对分子质量分别为110×103和117×103的2个亚基,存在于细胞核
双酶切连接反应之全攻略 1、回收PCR产物:在进行PCR扩增时候,给引物两端设计好酶切位点,一般说来,限制酶的选择非常重要,尽量选择粘端酶切和那些酶切效率高的限制酶,如BamHI,HindIII,提前看好各公司的双切酶所用公用的BUFFER,以及各酶在公用BUFFER里的效率。选好酶切位点后,在各个酶的两边加上保护碱基,其原则可参照: 双酶切时间及其体系:需要强调的是很多人建议酶切过夜,其实完全没有必要,我一般酶切3个小时,其实1个小时已经足够。应用大体系,如100微升。 纯化问题:纯化PCR产物割胶还是柱式,我推荐柱式,因为割胶手法不准,很容易割下大块的胶,影响纯化效率。现在的柱式纯化号称可以祛除引物,既然如此,酶切掉的几个碱基肯定也会被纯化掉了。所以,PCR产物和双酶切产物的纯化均可应用柱式纯化。我用的是TAKARA的纯化柱试剂盒 酶量的问题:以TAKARA的为例,其对1单位酶的定义如下:在50 μl 反应液中,30℃温度下反应1小时,将1 μg 的λDNA完全分解的酶量定义为1个活性单位(U)。 而该酶浓度约为15单位/ 微升,在除外酶降解的 因素外,该酶可分解15μg的DNA,而一般从1-4ml菌液提出的 DNA约 为3μg,而PCR纯化后的产物(50体系)约为3μg,所以即便全部加进去,只要纯化的 质量好,酶切完全切得动。 2、酶切、回收后的PCR产物与载体的连接 摩尔比的计算: 很多人凭经验也可以。但对于初学者从头认真计算则 非常有必要。回收的载体片段:回收的PCR产物片段=1:10 ,一般取前者0.03pmol,后者取0.3pmol。 pmol为单位的DNA转换为为μg单位的DNA:(X pmoles×长度bp×650)/ 1,000,000 (注:长度bp×650是该双链DNA的分子量)所得数值即为μg,也可以直接用这个公式套.1pmol 1000bp DNA=0.66μg,如载体是5380bp,则0.03pmol为 0.03×5.38×0.66=0.106524μg。 测DNA浓度: 可以在专用机子上测,注意OD值,一般约1.8-2.0.另外,如果嫌麻烦,也可用MARKER 进行估测,如MARKER2000,5微升的 MARKER每个条带约50ng。 连接反应:TAKARA的 连接酶上的 说明写的过夜,而其对连接酶单位的定义为:在20 μl的连接反应体系中,6 μg的λDNA-Hind III的分解物在16℃下反应30分钟时,有90%以上的DNA片段 被连接所需要的酶量定义为1个活性单位(U)。而它的浓度为350 U/μl ,所以完全够用。连 接酶容易失活,注意低温操作,最好在冰上。时间3个小时足已。 3、转化: a、全量(10 μl)加入至100 μl JM109感受态细胞中,冰中放置30分钟。 b、42℃加热45秒钟后,再在冰中放置1分钟。 c、加入890 μl AMP阴性培养基,37℃振荡培养60分钟。 取100μl铺板。也可离心后余100μl 几个非常重要的问题 1 做转化的时候,进行酶连接反应时,注意保持低温状态,因为LIGASE酶很容易降解.为保险起见,一般 连接3小时,16度.
质粒DNA酶切、连接、转化、筛选、鉴定 (2011-04-29 10:42:22) 转载▼ 质粒DNA酶切、连接、转化、筛选、鉴定 实验目的 1、学习和掌握限制性内切酶的特性 2、掌握对重组质粒进行限制性内切酶酶切的原理和方法 3、掌握利用CaCl2制备感受态细胞的方法 4、学习和掌握热击法转化E.coli的原理和方法 5、掌握α互补筛选法的原理 6、学习用试剂盒提取重组质粒DNA的方法 7、复习琼脂糖凝胶电泳的原理及方法 实验原理 重组质粒的构建需要对DNA分子进行切割,并连接到合适的载体上进行体外重组。限制性核酸内切酶和DNA连接酶的发现与应用,为重组质粒的构建提供了有力的工具。 限制性核酸内切酶酶切分离法适于从简单基因组中分离目的基因。质粒和病毒等DNA 分子小的只有几千碱基,大的也不超过几十万碱基,编码的基因较少,获得目的基因的方法也比较简单。 DNA连接酶催化两双链DNA片段相邻的5’-磷酸和3’-羟基间形成磷酸二酯键。在分子克隆中最有用的DNA连接酶是来自T4噬菌体的DNA 连接酶:T4 DNA连接酶。T4 DNA 连接酶在分子克隆中主要用于:1、连接具有同源互补粘性末端的DNA片段;2、连接双链DNA分子间的平端;3、在双链平端的DNA分子上添加合成的人工接头或适配子。 目的DNA片段与载体DNA片段之间的连接方式(以T4DNA连接酶为例)主要有以下几种: (一)、具互补粘性末端片段之间的连接 大多数的核酸内切限制酶都能够根据识别位点切割DNA分子,形成1~4核苷酸单链的粘性末端。当载体和外源DNA用同一种限制性内切酶切割时,产生相同的粘性末端,连接后仍保留原限制性内切酶的识别序列;如果用两种能够产生相同的粘性末端的限制酶(同尾酶)切割时,虽然可以有效地进行连接,但是获得的重组DNA分子消失了原来用于切割的那两种限制性核酸内切酶的识别序列,这样不利于从重组子上完整地将插入片段重新切割下来。 (二)、平末端的连接 载体分子和外源DNA插入片段并不一定总能产生出互补的粘性末端。实际上有许多情况都是例外的,因为有些限制酶切割DNA分子之后所形成的都是平末端的片段;有的实验要用两种不同的限制酶分别切割载体分子和外源DNA,形成的也多半是非互补的粘性末端或平末端;再如用机械切割法制备的DNA片段,PCR扩增的和化学合成的DNA片段或由RNA为模板反转录合成的cDNA片段,也不会具有互补的粘性末端。 理论上任何一对DNA平末端均能在T4DNA连接酶催化下进行连接,这给不同DNA分子的连接带来了方便。但是,平末端连接更为复杂,且速度也慢得多,因为一个平末端的5’磷酸基团或3’羟基与另一个平末端的3’羟基和5’磷酸基团同时相遇的机会显著减少,通常
泛素-蛋白酶体及其抑制剂 沈子珒许啸声李稻审校 上海交通大学医学院病理生理学教研室 摘要:蛋白酶体与泛素化信号系统一起构成的泛素—蛋白酶体(UPP)是哺乳动物细胞内主要的蛋白水解酶体系,参与和调控细胞的增殖、分化和凋亡。蛋白酶体是一个由20S 催化颗粒、11S调控因子和2个19S调节颗粒组成的ATP依赖性蛋白水解酶复合体。蛋白酶体的活性状态对细胞功能正常维持是非常重要的。26S蛋白酶体对蛋白的降解依赖于靶蛋白的泛素化和泛素化蛋白识别。蛋白酶体抑制剂能通过抑制蛋白酶体活性进而干扰和影响细胞原有的功能,尤其对肿瘤细胞生长有明显的抑制作用。同时,利用蛋白酶体抑制剂改变蛋白酶体的酶切位点活性也成为免疫、炎症等研究的热点。蛋白酶体的抑制剂可分为天然化合物和合成化合物两类,其中Bonezomib(Velcade,PS-341)是近年研究较多的一种蛋白酶体抑制剂。 关键词:肿瘤蛋白酶体泛素蛋白酶体抑制剂PS-341 泛素—蛋白酶体通路(Ubiquitin–proteasome pathway,UPP)的蛋白酶体(proteasome)是一种具有多个亚单位组成的蛋白酶复合体,蛋白酶体沉降系数为26S,故又称26S蛋白酶体。蛋白酶体水解蛋白的前提是靶蛋白的泛素化。在UPP中,各种靶蛋白质泛素化后,先被26S蛋白酶体的19S亚单位识别,随后泛素化靶蛋白脱泛素链和变性,进入20S亚单位的筒状结构内被降解成3~22个多肽。由于蛋白酶体具有精确降解细胞内各种目的靶蛋白,进而参与基因转录和细胞周期调节,以及受体胞吞、抗原呈递等各种细胞生理过程[1]。因此,应用蛋白酶体抑制剂改变其酶切位点活性已成为抗肿瘤治疗的研究热点,蛋白酶体是影响和改变细胞功能重要的目的靶标。 1.蛋白酶体组成 1979年,Goldberg等首先报道在大鼠肝脏和网织红细胞中存在一种分子质量为700 kD的受A TP激活的中性蛋白水解酶。此后,一些在形态、功能及免疫学特征上与之相同的颗粒通过不同途径被分离出来,被统一命名为蛋白酶体[2]。在真核生物进化中,蛋白酶体具有高度的保守性,其简单形式甚至存在于古细菌和真细菌中。真核细胞内的蛋白酶体分布于胞质与胞核内,有的与内质网或细胞骨架相结合,约占细胞蛋白质总量的1%。有功能的26S蛋白酶体是由20S催化颗粒(catalytic particle, CP)、11S调控因子(11S regulator)和2个19S调节颗粒(regulatory particle, RP)组成,其分子量为2.4MD,是ATP依赖性蛋白水解酶复合体。 1.120S催化颗粒(20S CP) 人类蛋白酶体CP的沉降系数为20S,分子量700~750kD。它由α环和β环组成,每个环各有7个相同的亚单位,分别以α1-7β1-7β1-7α1-7顺序排列成圆桶状结构,20S CP中间由两个β亚单位环组成。几乎所有β亚单位都含有一个N 端前导序列,尽管此序列在20S CP装配过程中被切除,但在引导真核生物β亚单位的正确折叠以及β与α亚单位的组装中有重要作用[3]。当β亚单位的N端前导序列被切除后,Thr残基被暴露出来,Thr是酶的活性位点,分别存在于β环的内表面,使β亚单位具有类似的丝氨酸蛋白酶的催化作用[4]。例如,β亚单位N端的折叠方式允许Thr的-OH对底物发动亲核反应形成半缩醛,而Thr的α-NH3可代替丝氨酸蛋白酶中His的咪唑基作为质子受体。此外,活性位点附近的一个Lys残基与特定的丝氨酸蛋白酶中一样,也起着催化剂的作用。目前认为,在20S CP内起催化作用的亚单位主要是β1、β2、β5。不同的β亚单位的催化活性尽管不同,但能互相协调使蛋白酶体具有多种蛋白酶活性,如类糜蛋白酶活性(chymotrypsin-like, ChTL)、类胰蛋白酶活性(trypsin-like,TL)、肽-谷氨酰肽水解酶活性(post-glutamyl-peptide hydrolyzing,PGPH)、支链氨基酸肽酶活性、中性氨基酸切割活性。在20S CP圆桶状的两端由α亚单位环组形成,环口的中央被α亚单位(α
干旱胁迫对植物影响 摘要:胁迫严重影响着植物的生长发育,如干旱胁迫,可造成经济作物产量的逐年大幅下降[1],它们不能逃避不利的环境变化, 它 们需要快速的感应胁迫刺激进而适应各种环境胁迫。大多数植物遭受干旱逆境后各个生理过程都会受到不同程度的影响。我们都知道 ,水分在植物的生命活动中起着重要的作用,不仅是光合作用的原料之一,而且还维持着植物的正常体态。因此,我们要用各种预防途径来减少干旱对植物的影响。 关键词:干旱胁迫植物影响 Drought stress impact on plants Abstract : stress seriously influence the plant growth and development, such as drought stress, which can cause economic crop production has fallen dramatically year by year [1], they cannot escape from adverse environmental change, they need fast induction stress stimulation and adapt to various environmental stresses. Most plants by drought adversity after various physiological processes are subject to the influence of different level. As we all know, water in the plant life activities play an important role, not only is one of the raw material of photosynthesis, but also maintains the normal posture of plants. Therefore, we want to use a variety of preventive ways to minimize the effects of drought on plant.
实验三、酶切与连接 一、实验目的与原理简介 限制性内切酶在基因工程中主要应用地以下两个方面:制作基因酶切图谱和进行基因克隆。 制作基因图谱,就是利用特定的酶切出特定的条带; 而利用基因克隆时选择酶应注意以下几个方面: 1)克隆片段的长度;2)克隆片段中切点的情况3)载体上切点的情况; 4)切割与连接方式;5)接头状态。 酶切方式可分为部分酶切和完全酶切两种: 1)部分酶是指同一DNA 片段上有些被切开而另一些未被切开,此法主要应用于基因 的克隆 。用部分酶切法是基于基因内部可能有此酶的位点。进行部分酶切可通过两个方式:一是不同的时间内在同一酶反应管中取样终止反应,利用时间来控制酶切的程度。另一种是在其余条件相同时控制 酶的稀释度,利用不同酶浓度控制酶切程度,这种方法因易于控制反应而被广泛应用。 2)完全酶切法适用于如载体切割、酶切图谱的制作、基因的鉴定与DNA 片段的分离工作。完全酶切又可分为单酶切、多酶切两种。在多酶切反应中当2种或2种以上的酶有相同 的反应条件时,可同时进行酶切,不然须在前一种酶作用完成后将其失活,而后进行第二种酶切反应,这样可以避免片段混乱现象的出现。 二、材料和试剂 限制性内切酶NotI 、EcoRI ;10×Buffer , PCR 产物、pPIC9K 质粒、10×T4连接Buffer 、T4 Ligase 、DDW 、琼脂糖、电泳缓冲液 、Goldview 染液、胶回收试剂盒;电泳仪、恒温水浴锅、EP 管、移液枪、灭菌枪头、紫外检测仪 三、实验步骤 1)PCR 产物双酶切(NotI ,EcoRI ),pPI9K 质粒双酶切(NotI ,EcoRI );PCR 体系如下: 2)然后电泳检测后在紫外检测仪下观察(UV ,260nm )。 3)切胶回收(尽量不要切到不含目的片段的胶),按照胶回收试剂盒标准操作。 4)回收产物电泳检测后进行连接: 连接体系: 10×T4连接Buffer 1μl 目的基因 6μl 质粒载体 2μl 产物酶切体系 pPI9K 质粒酶切体系 DDW 4.6μl DDW 7μl 10×H Buffer 1μl 10×H Buffer 1μl 目的片段 4μl pPI9K 质粒 1.6μl NotI quickcut 0.2μl NotI quickcut 0.2μl EcoRI quickcut 0.2μl(37℃15min) EcoRI quickcut 0.2μl(37 ℃15min)
双酶切: 载体大小为3000bp左右,在SfiⅠ和BssHⅡ位点之间有370bp左右的片段存在。 我想通过SfiⅠ和BssHⅡ双酶切,将370bp的片段切掉,然后装入不同的片段。 我的酶切体系如下: 质粒(载体+老片段)1ul(约100ng) (NEBlack Eye SfiⅠ1ul (NEBlack Eye BssHⅡ1ul 10×buf 2.2ul 100×BSA 0.2ul 水14.8ul 总体积20ul 50度,2小时。切出了370bp左右的片段,回收载体。 然后取回收载体的1ul自连,铺平板,但是长出了300多个克隆。证明酶切不完全,怀疑有大量载体只是单酶切。50度3小时我试过,但是质粒有降解。酶量应该说是过量的。请问有什么办法可以酶切完全? 粘性连接 (一)外源DNA和质粒载体的连接反应 外源DNA片段和线状质粒载体的连接,也就是在双链DNA5’磷酸和相邻的3'羟基之间形成的新的共价链。如质粒载体的两条链都带5'磷酸,可生成4个新的磷酸二酯链。但如果质粒DNA已去磷酸化,则吸能形成2个新的磷酸二酯链。在这种情况下产生的两个杂交体分子带有2个单链切口,当杂本导入感受态细胞后可被修复。相邻的5'磷酸和3'羟基间磷酸二酯键的形成可在体外由两种不同的DNA连接酶催化,这两种酶就是大肠杆菌DNA连接酶和T4噬菌体DNA连接酶。实际上在有克隆用途中,T4噬菌体DNA连接酶都是首选的用酶。这是因为在下沉反应条件下,它就能有效地将平端DNA片段连接起来。 DNA一端与另一端的连接可认为是双分子反应,在标准条件下,其反应速度完全由互相匹配的DNA末端的浓度决定。不论末端位于同一DNA分子(分子内连接)还是位于不同分子(分子间连接),都是如此。现考虑一种简单的情况,即连接混合物中只含有一种DNA,也就是用可产生粘端的单个限制酶切割制备的磷酸化载体DNA。在瓜作用的底物。如果反应中DNA浓度低,则配对的两个末端同一DNA分子的机会较大(因为DNA分子的一个末端找到同一分子的另一末端的概率要高于找到不同DNA分子的末端的概率)。这
【原创】双酶切连接反应之全攻略(原创) 双酶切连接反应之全攻略 前一阵子一直在做双酶切质粒重组,失败了很多次,不过很快改善了实验方法,用2周重组了14个质粒。现就自己的体会,结合战友的宝贵经验,谈一下质粒重组的一些个人经验。 1、回收PCR产物:在进行PCR扩增时候,给引物两端设计好酶切位点,一般说来,限制酶的选择非常重要,尽量选择粘端酶切和那些酶切效率高的限制酶,如BamHI,HindIII,提前看好各公司的双切酶所用公用的BUFFER,以及各酶在公用BUFFER里的效率。选好酶切位点后,在各个酶的两边加上保护碱基,其原则可参照: 双酶切时间及其体系:需要强调的是很多人建议酶切过夜,其实完全没有必要,我一般酶切3个小时,其实1个小时已经足够。应用大体系,如100微升。 纯化问题:纯化PCR产物割胶还是柱式,我推荐柱式,因为割胶手法不准,很容易割下大块的胶,影响纯化效率。现在的柱式纯化号称可以祛除引物,既然如此,酶切掉的几个碱基肯定也会被纯化掉了。所以,PCR产物和双酶切产物的纯化均可应用柱式纯化。我用的是TAKARA的纯化柱试剂盒 酶量的问题:以TAKARA的为例,其对1单位酶的定义如下:在50 μl 反应液中,30℃温度下反应1小时,将1 μg 的λDNA完全分解的酶量定义为1个活性单位(U)。而该酶浓度约为15单位/微升,在除外酶降解的因素外,该酶可分解15μg的DNA,而一般从1-4ml菌液提出的DNA约为3μg,而PCR纯化后的产物(50体系)约为3μg,所以即便全部加进去,只要纯化的质量好,酶切完全切得动。 2、酶切、回收后的PCR产物与载体的连接 摩尔比的计算,很多人凭经验也可以。但对于初学者从头认真计算则非常有必要。回收的载体片段:回收的PCR产物片段=1:10,一般取前者,后者取。pmol为单位的DNA转换为为μg单位的DNA:(X pmoles×长度bp×650)/ 1,000,000 (注:长度bp×650是该双链DNA的分子量)所得数值即为μg,也可以直接用这个公式套.1pmol 1000bp DNA=μg,如载体是5380bp,则为 ××=μg。 测DNA浓度可以在专用机子上测,注意OD值,一般约另外,如果嫌麻烦,也可用MARKER进行估测,如MARKER2000,5微升的MARKER每个条带约50ng。连接反应:TAKARA的连接酶上的说明写的过夜,而其对连接酶单位的定义为:在20 μl的连接反应体系中,6 μg的λDNA-Hind III的分解物在16℃下反应30分钟时,有90%以上的DNA片段被连接所需要的酶量定义为1个活性单位(U)。而它的浓度为个小时足已。3,所以完全够用。连接酶容易失活,注意低温操作,最好在冰上。时间350 U/μl 3、转化: a、全量(10 μl)加入至100 μl JM109感受态细胞中,冰中放置30分钟。 b、42℃加热45秒钟后,再在冰中放置1分钟。 c、加入890 μl AMP阴性培养基,37℃振荡培养60分钟。 取100μl铺板。也可离心后余100μl 几个非常重要的问题 1 做转化的时候,进行酶连接反应时,注意保持低温状态,因为LIGASE酶很容易降解.为保险起见,一般连接3小时,16度. 2 对含有AMP-RESISTENCE的质粒铺板时,注意加AMP时的温度,温度过高,会使克隆株无法筛选出来.我的方法是培基高温消毒后放在烤箱里,烤箱一般温度为 55-60度,然后做的时候拿出来,这样好掌握温度。铺板前后注意用吹风机吹干 3对照的设立: 为验证双酶切是否成功,可做如下对照: A 酶切反应时加各单酶分别切,两管,用同一种BUFFER,跑胶,看单切的两管是否成线性.如两管均成线性可初步判断双酶切成功. 做转化时,也要进行对照. 设4个: A.即拿双酶切的质粒产物也进行连接反应,这个对照可进一步看双酶切是否成功,如果长出克隆,说明很有可能只进行了单酶切,如没长出克隆,则证明双酶切成功, 当然要保证感受态,培基,连接酶都'正常'的情况下. B.酶切过的未进行连接反应的双酶切产物,进行转化,这一步可以证明是否有残留的未被任何酶切的原始质粒 C.设原始质粒为对照,意为检测整个操作过程中是否有误. 阴性板上用同一批感受态细胞铺板20微升足够,检测感受态状况. 4.所有的试剂切记低温保存.一步一个脚印.不要偷懒,图省事最后却更费事.注意设立对照。
DNA的酶切实验 采用粘末端连接必须对目的DNA分子和载体分子进行酶切以获得相应的粘末端进行连接。酶切可以是单酶切也可以是双酶切。单酶切操作比较简单,但双酶切如果两种酶所用缓冲液成分不同(主要是盐离子浓度不同)或反应温度不同,这时可以采用如下措施解决:1)先用一种酶切,然后乙醇沉淀回收DNA分子后再用另外一种酶切;2)先进行低盐要求的酶酶切,然后添加盐离子浓度到高盐的酶反应要求,加入第二种酶进行酶切;3)使用通用缓冲液进行双酶切。具体要根据酶的反应要求进行,尽量避免星号活力。一材料、试剂和仪器: 1 材料:质粒DNA 2 试剂:限制性内切酶、ddH2O 3 仪器:微量移液枪,离心机,水浴锅,电泳仪,紫外透射观测仪 实验程序: I. .单酶切: II. 双酶切: 注:酶切的选择原则一般是尽量扩大酶切体系,这样抑制因素得以稀释;基因组DNA或质粒DNA酶的用量较一般DNA大,一般为1μg/10U;所加酶的体积不能超过酶切总体积的1/10,否则甘油浓度会超过5%,会产生星号活力;对难切的质粒或基因组DNA应延长反应时间4—5hr, 甚至过夜。灭火限制性内切酶活性可以采用加热灭活,乙醇沉淀,酚/氯仿抽提,添加EDTA或SDS等方法,具体每一种酶可能有些方法不能完全灭活,这一点需要注意。 二. 结果与分析: 假若一种酶在环状质粒DNA中只有一个酶切位点, 且酶切彻底,紫外灯下检测电泳结果, 则单酶切应为一条带, 而双酶切则为两条带。如果条带数目多于理论值,那么有可能是酶切不完全。如果酶切结果与酶切前的质粒条带一样(超螺旋、线性和开环三条带),则说明质粒完全没有被切开。 图4 重组质粒HindIII XbaI双酶切琼脂糖凝胶电泳分析
泛素标记的蛋白质降解 ——探索生命活动中化学过程的又一成果 李静雯陆真 (南京师范大学化学教育研究所南京 210097) 摘要:本文主要介绍了2004年诺贝尔化学奖--泛素调节蛋白质降解的原理、模型及应用实例。该成果将有助于科学家从分子水平对细胞控制蛋白质分裂进行研究,并有利于研发新型药物,从而造福人类。 关键词:2004诺贝尔化学奖泛素标记蛋白质降解 2004年10月16日瑞典皇家科学院将本年度诺贝尔化学奖授予以色列科学家阿龙·切哈诺沃、阿夫拉姆·赫什科和美国科学家欧文·罗斯,以表彰他们在泛素调节的蛋白质降解研究领域中的卓越成就。 图1 2004年诺贝尔化学奖获得者,从左至右依次为阿龙·切哈诺沃、阿弗拉姆·赫尔什科、欧文·罗斯 阿龙·切哈诺沃1947年出生在以色列城市海法,现年57岁,1976-1981年间在赫什科指导下攻读博士学位,1981年获得以色列工学院医学博士学位,曾在麻省理工学院从事研究,后返回以色列工学院任教;阿弗拉姆·赫尔什科1937年出生在匈牙利,犹太后裔,13岁移民以色列,现年67岁,1969年在耶路撒冷希伯来大学获得医学博士学位,曾在旧金山加州大学从事研究,1972年起在以色列工学院任教;来自美国的欧文·罗斯现年78岁,1952年在芝加哥大学获得博士学位,现就职于美国加利福尼亚大学欧文分校。三名获奖者自20世纪70~80年代以来就一直致力于这一领域的研究。1970年代末,赫什科借着带薪休假的机会,带着当时还是博士后的切哈诺沃,到美国费城福克斯·蔡斯癌症研究中心的罗斯实验室进行访问研究,在那里完成了三位获奖者的大部分合作研究,发表了一系列生物化学论文。 1 泛素调节的蛋白质降解的生物学概述 蛋白质是包括人类在内各种生物体的重要组成成分。对于生物体而言,蛋白质的生成与降解至关重要。过去几十年来,生物化学界对于细胞如何制造出各种蛋白质有很多解释,但是对蛋白质降解的研究还很少,上世纪80年代初期这三名学者深入蛋白质降解过程的研究领域,进而发现了细胞最重要的循环过程以及有规律的蛋白质降解活动。
四种观赏植物的活性氧代谢对干旱胁迫的响应以红叶石楠(Photinia serrulata Lindl)、小叶黄杨(Buxus sinica (Rehd. et Wils.)Cheng var. parvifolia M.Cheng)、金叶女贞(Ligustrum×vicaryi Hort.)及大叶黄杨(Euonymus japonicus Thunb.)为试验材料。采用盆栽试验法,在避雨大棚中进行自然干旱-复水试验。 测定干旱胁迫下,4种植物体内超氧阴离子自由基(O2-)产生速率、过氧化氢(H2O2)含量、丙二醛(MDA)、可溶性蛋白含量、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)及谷胱甘肽还原酶(GR)活性的变化及抗坏血酸-谷胱甘肽循环系统中DHA、ASA、GSH及GSSG的含量。以探索这4种观赏植物的活性氧代谢对干旱胁迫的响应。 在干旱处理条件下,结果表明:4种植物的过氧化氢(H2O2)含量总体呈先上升后下降的趋势。超氧阴离子生成速率:红叶石楠呈先下降后上升的趋势,且维持较高水平。 小叶黄杨、金叶女贞、大叶黄杨均呈先上升高后下降。丙二醛(MDA)含量:红叶石楠干旱处理远高于对照水平,变化幅度较小。 小叶黄杨呈上升趋势。金叶女贞呈下降-升高-下降的趋势。 大叶黄杨呈下降-升高-下降-升高的趋势。可溶性蛋白含量:红叶石楠、小叶黄杨呈下降趋势,金叶女贞为先升后降,大叶黄杨呈先降后升。 清除酶类变化趋势:4种植物的SOD活性总体呈先上升后下降的趋势;APX 活性小叶黄杨总体上升趋势,金叶女贞及红叶石楠呈升高-下降-升高的趋势,大叶黄杨呈先升后降的趋势;POD活性变化:红叶石楠呈先升后降,小叶黄杨呈上升趋势,大叶黄杨呈下降升高的趋势;CAT活性变化:红叶石楠、金叶女贞、大
新疆农业大学 专业文献综述 题目: 干旱胁迫及植物抗旱性的研究进展 姓名: 库热·巴吐尔 学院: 林学与园艺学院 专业: 园艺(特色经济林) 班级: 041班 学号: 043231142 指导教师: 海利力·库尔班职称: 教授 2008年12月19日
干旱胁迫及植物抗旱性的研究进展 摘要:干旱(水分亏缺)是我国北方沙漠化地区植物生长季的主要环境胁迫因子。本文从植物干旱的种类,植物对水分胁迫的生理反应,抗旱机理,植物水分胁迫的研究方法等几个方面,探讨植物抗旱研究的进展,存在问题及发展趋势,和干旱和高温在生理水平对植物光合作用影响机制的最新研究进展进行了综述,并对以后的相关研究进行了一些分析。 关键词:干旱胁迫;植物抗旱性,干旱机制 干早(Drought)是限制植物生长发育,基因表达和产量的重要因子[1-4],是气象与环境质量的指标,是指在无灌溉条件下,长期无雨或少雨,气温高,湿度小,土壤水分不能满足农作物的需要,使作物的正常生长受到抑制,甚至枯死,造成减产或无收的一种自然现象,一般分为大气干旱和土壤干早[5-6]。全球干旱半干旱地区约占陆地面积的35%遍及世界60多个国家和地区。我国是一个干旱和半干旱面积很大的国家,干旱半干旱的面积约占国土面积的52.5%,其中干旱地区占30.8%,半干旱地区占21.7%[7]。植物的抗旱性是指植物在大气或土壤干旱条件下生存和形成产量的能力,抗旱性鉴定就是按植物抗旱能力大小进行鉴定,评价的过程[8-10]。前人对于植物抗旱性的研究作了大量的工作,并在许多方面取得了突破性进展,为干旱半干旱地区的农林业生产提供了理论基础。但这些研究都具有一定的局限性,主要表现为现有研究结果多数是针对植物某个或几个方面进行研究,如某些生理或生化指标,而这些研究指标只在某一时间范围内起有限的作用,用这些具有时间限制的少数几个指标来阐明植物抗旱的途径,方式和机理,或进行耐旱性评价都难以反映植物的真实情况,甚至会使某些最关键的问题被忽略。因此,本文对植物干旱胁迫及抗旱性方面的一些研究成果及存在的问题进行了探讨。 1 干旱胁迫 干旱是一个长期存在的世界性难题,中国水的问题始终是个大问题,水的安全供给问题引起了世界各国的关注。中国的干旱缺水问题目前已引起党中央,国务院和全社会的关注,中国的水危机不是危言耸听,而是既成事实。干旱缺水将成为我国农业和经济社会可持续发展的首要制约因素。 1.1 干旱胁迫的类型及特点 干旱形成有两种主要原因,并形成两类干旱。一是土壤干旱。由于连年干旱,雨量过少,每年降雨量约在200~300mm,地下水位又较低,土壤中水分根本不能满足植物生长,如无灌溉,作物将受干旱之害。二是大气干旱。植物的水分亏缺是由于蒸腾失水超过吸水而产生的,即使在土壤水分充足的情况下,晴天的中午也常常产生干旱。气温高,强烈的太阳辐射显著促进蒸腾;由于土壤干燥,地温低,根的机能低下,使吸水受到抑制。都能使植物产生水分亏缺,特别是二者同时产
1、DNA纯度 一般而言,纯度高的DNA(即混入的蛋白质、RNA或多糖类物质较少)容易被限制性内切酶消化,基因重组是严重洪的所有酶促反应都有类似共性,因此应尽量提高DNA纯度。若DNA不能被限制性内切核酸酶切割,应对DNA样品进行酚抽提、乙醇沉淀等操作,以提高DNA纯度。下列因素影响DNA纯度: (1)DNA样品中常常杂有RNA,虽然它的存在不影响酶的反应速度,但RNA可和酶蛋白 发生非特异性结合而减少酶的有效浓度,使酶解不彻底。另外,RNA在凝胶电泳中 呈现的区带会掩盖该区带范围内的DNA片段的呈现,干扰DNA片段的观察。 (2)一般来说,少量蛋白质的污染对DNA酶解的影响不大,但如果杂有核酸酶等蛋白质, 就会干扰酶切反应,并影响酶解产物。有一类蛋白质叫结合蛋白,他能与DNA发生 非特异结合,不仅封闭DNA上的识别序列而影响酶切反应,而且DNA与蛋白质结 合物在凝胶电泳上迁移甚慢,从而改变DNA片段在电泳图谱中的位置,影响DNA 片段的定性分析。 (3)样品中杂有其他DNA,如制备的质粒DNA中含有染色体DNA片段等,它们不影响 酶解作用,但干扰酶解产物电泳图谱并影响以后的重组连接反应。 (4)DNA样品中的其他杂志,如Hg2+、酚、氯仿、乙醇、EDTA、SDS、NaCl等,这些杂 质常常是制备过程中不慎带进的,它们影响酶切速度,甚至改变识别特异性,出现 酶的第二活性。 2、DNA甲基化 限制性内切核酸酶的识别序列若被修饰酶产生了修饰反应(如甲基化酶的甲基化反应),则该DNA不能被限制酶再切割。甲基化酶是大多数大肠杆菌菌株中都存在 的酶系之一,有dam甲基化酶和dcm甲基化酶两大类。Dam甲基化酶在5’GATC3’ 的A上甲基化,dcm甲基化酶在5’CCAGG3’或5’CCTGG3’的C上甲基化。若出现甲基 化影响,则应使用甲基化酶缺陷菌株(dcm或dam),或使用不受甲基化酶影响的限 制性内切核酸酶,如MboI和Sau3A是同裂酶,因MboI受甲基化影响程度大,则宜 使用几乎不受甲基化酶影响的Sau3A。 3、星号活力 又称第二活力,是指该改变了酶切反应条件后特异序列识别特性降低的一种现象。 由于识别特异性降低,可能对原识别序列相似的序列也产生切割反应。如EcoRI的典型识别序列为GAATTC,条件改变后,其识别序列由原来的六核苷酸降为四核苷酸AATT。 高浓度甘油、高PH、低离子强度、β-巯基乙醇、DMSO、Mn2+等的存在可能导致酶产生星号活力。厂家提供的酶一般存放在50%甘油溶液中,若酶量站反应体系的1/10以上,将可能导致星号活力。小的反应体系若长时间在恒温水浴锅中进行酶切反应,因Eppendorf管里的内外温差将导致水分蒸发,蒸气凝结在盖子上而使反应体积缩小非常明显,将改变反应体系的组成,而容易产生星号活力,因此长时间进行酶切反应,宜使用空气恒温箱为保温设备,可避免水分蒸发和凝结。 4、终止限制性内切核酸酶反应的方法 (1)加EDT A以Mg2+,使酶失去辅助因子而终止酶切反应; (2)65℃下保温5-10min而使酶失活。但是有些酶在此温度下仍有活性,这种酶就不能 用高温失活方法来终止酶切反应; (3)加SDS至终浓度0.1%或加尿素至0.5mol/L,使酶蛋白解聚变形; (4)用等体积酚抽提酶解产物,这种方法使酶活性丧志最彻底,灭火后的样品用乙醇沉 淀法回收DNA;
泛素—蛋白酶体途径代谢异常与2型糖尿病发生的关系 随着社会的进步发展,人们生活水平的提高,糖尿病(diabetes mellitus,DM) 的发病率逐年增高。据统计2011年全球糖尿病患者总数约 3.66 亿[1],到2030 年患病人数预计将达到 5.52 亿,这其中 85%~90%为 2 型糖尿病(type 2 diabetes mellitus,T2DM),而中国、印度和美国为世界糖尿病三大国[2]。T2DM以及其相应带来的并发症已成为严重威胁人类机体健康的主要慢性病之一,不仅给患者身心带来巨大困扰,而且增加了患者家庭乃至社会的医疗负担。T2DM主要表现为胰岛素抵抗和胰岛素分泌缺陷而非胰岛B细胞自身免疫破坏。然而其确切发病机制尚未明确。近年来,人们发现在肥胖、糖尿病等众多机体代谢紊乱情况下,胰岛素靶器官中泛素-蛋白酶体系统(Ubiquitin-Proteasome System, UPS)活性明显上调,并且表现出相应的病理表现[3],UPS在T2DM及其并发症的发生、发展过程中起了重要作用。现将其机制作一综述。 1. 泛素—蛋白酶体系统的组成 UPS由泛素(ubiquitin, Ub)、泛素活化酶(ubiquitin—activating enzyme, E1 )、泛素结合酶(ubiquitin—conjugating enzyme, E2)、泛素蛋白连接酶(ubiquitin—protein ligase, E3 )、蛋白酶体及其底物(蛋白质)构成,其对靶蛋白的降解是一种三级酶联反应过程。通过UPS,细胞几乎可以对其内在的任何一种蛋白质进行高度特异性的降解,整个过程由底物蛋白的泛素化和蛋白酶体降解两个部分组成[4]【4】。泛素化是对特异的靶蛋白进行泛素修饰的过程,泛素化修饰涉及泛素激活酶 E1、泛素结合酶 E2 和泛素连接酶 E3 的一系列反应。首先在 ATP 供能的情况下,泛素分子 C 端的 Gly 残基与 E1 激活酶上的 Cys 残基结合,将泛素激活;接着,激活酶将活化的泛素分子通过转酰基作用转移到 E2 结合酶的 Cys 残基上,二者以硫酯键连接;之后,随着泛素连接酶识别靶蛋白,E3 连接酶分别结合着携带着泛素分子的 E2 结合酶和待泛素化修饰的底物蛋白,在连接酶的作用下,泛素分子从结合酶上转移到底物蛋白上,完成泛素化修饰。在此过程中,E3 连接酶尤其重要,它决定着泛素化修饰的时间性和特异性。根据连接在靶蛋白上的泛素分子的连接方式和数目,可以将泛素化修饰分为单泛素化修饰和多聚泛素化【5】。由泛素控制的蛋白质降解具有重要的生理意义,它不仅能够清除错误的蛋白质,还对细胞周期调控、DNA修复、细胞生长、免疫功能等都有重要的调控作用。 1.1泛素(Ub) Ub是1975 年由 Goldstein首先发现的一种在真核生物细胞内高度保守的多肽,单个泛素分子是由76个氨基酸组成,分子量约85kD , 泛素以共价键与底物蛋白连接,它的主要功能是标记待降解的蛋白质,使其被转运至蛋白酶体,进而发生降解【6】。泛素也可以标记跨膜蛋白,比如受体,将其从细胞膜上除去。泛素分子中散布着7个赖氨酸残基,这些残基可以作为其他泛素共价结合的位点。经过几轮结合后,泛素链将会变得很长,这样有助于对“标记”蛋白的识别【7】。泛素化蛋白可被泛素解离酶识别,而将泛素分子从底物蛋白上水解下来,重复利用【8】。 1.2 参与泛素化降解的酶 E1是一种广泛表达的多肽,大约1100 个氨基酸,含有位置固定的保守的半胱氨酸残基。有2个亚型,是由同一个mRNA 在不同的起始位点翻译而成的,存在于细胞浆和细胞核中。目前在脊椎动物中已发现的E1只有一个,有数目不等的E2和大量的E3;E1酶可以激活所有的E2酶,每个E2酶又可以与多个E3酶相互作用【9】。E1首先与ATP结合,然后与泛素相互作用,催化泛素C端腺嘌呤化并释放焦磷酸,使其C端甘氨酸残基与E1的半胱氨酸残基形成高能硫酯键而获得活性,E1—泛素结合的中间体再将泛素转移给E2s,形成E2-泛素中间体。