
一、实验目的
了解病毒感染力测定的几种常用方法,掌握半数细胞培养物感染量TCID50的操作步骤、计算方法及含义。
二、测定病毒感染力的方法
半数致死量LD50( 50% lethal dose):用动物或鸡胚来检测
半数鸡胚感染量EID50(egg 50% infective dose):用鸡胚来检测
半数细胞培养物感染量TCID50(50% tissue culture infective dose):用细胞来检测
蚀斑形成单位(plaque forming unit,PFU):用细胞来检测
三、材料
1、长满单层的细胞1瓶
2、胰酶、吸球、吸管、生长液
3、96孔细胞培养板
4、加样器、枪头
5、病毒液(PRV)
四、TCID50的操作步骤
1、在青霉素瓶或离心管中将病毒液作连续10倍的稀释,从10-1-10-10。
2、将稀释好的病毒接种到96孔微量培养板中,每一稀释度接种一纵排共8 孔,每孔接种100μl。
3、在每孔加入细胞悬液100μl,使细胞量达到2~3×105个/ml。
4、设正常细胞对照,正常细胞对照作两纵排。(100μl生长液+100μl细胞悬液)
5、逐日观察并记录结果,一般需要观察5-7天。
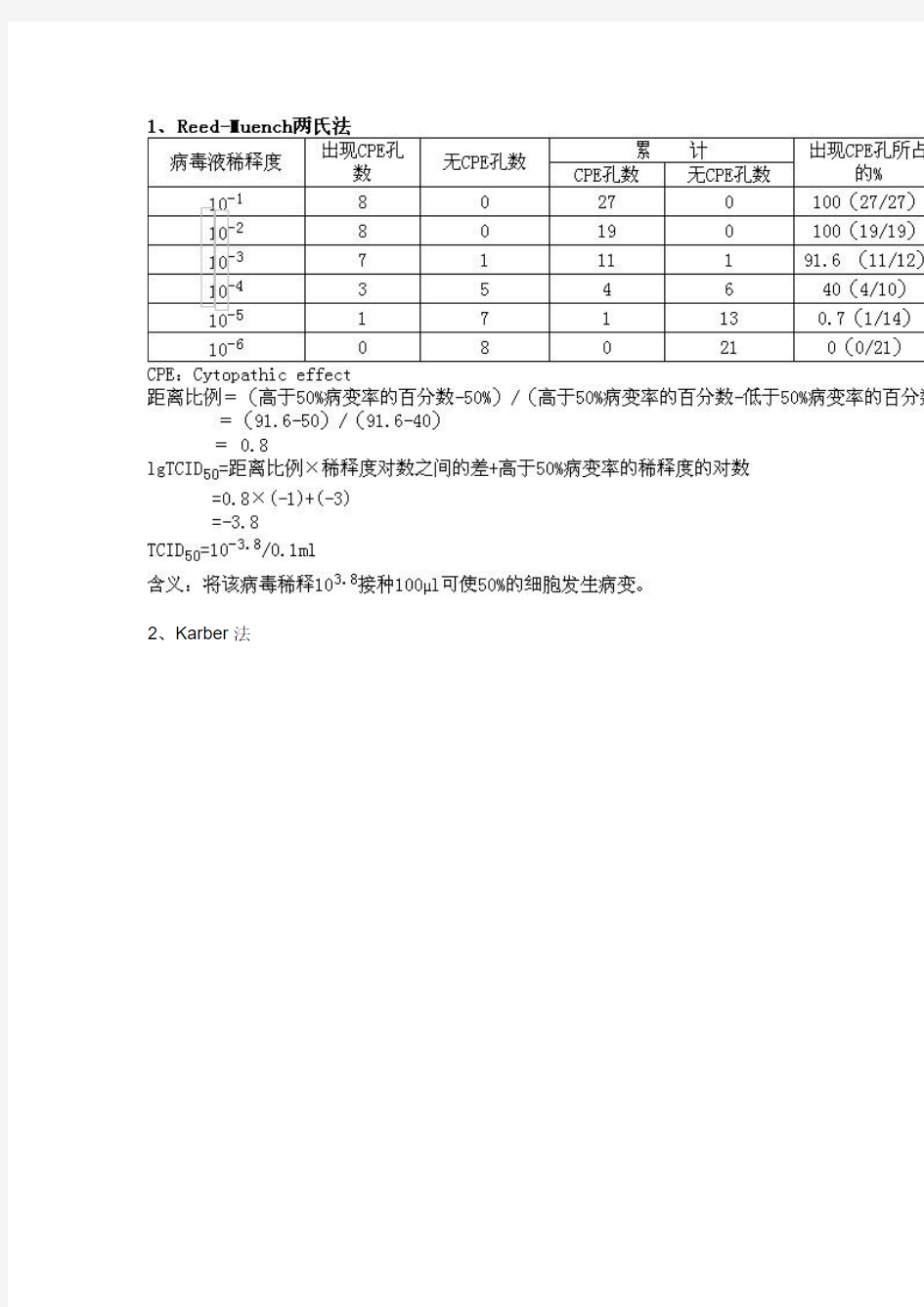
6、结果的计算,按Reed-Muench两氏法或Karber法
五、TCID50的计算方法
1、Reed-Muench两氏法咱们一般情况下用这个计算病毒的TCID???????????
2、Karber法
含义:将该病毒稀释103.875接种100μl可使50%的细胞发生病变。
操作步骤
(1) 准备细胞
取出一块细胞培养板,每个孔大约传8000~10000个细胞(一个T25瓶的细
胞消化后加10ml培养液正好传一块96孔板,要传匀)。每个孔的细胞铺成单层大约60%丰度即可接种病毒(下午传好板第二天早上就能用)。
细胞对照选取16个孔即可。滴定与对照可以在一块培养板上进行,操作中注意不要窜孔。也可以分别在不同的细胞培养板上进行,但要保证实验条件一致。
(2) 稀释待测病毒液。
A法为参考书上标准的操作方法
B法参照书将液体量减少后的结果
病毒稀释液根据是否需要胰酶来选择适合的液体,无论哪种都无血清。
A向每支试管中加入1.8ml病毒稀释液。向1号试管中加入0.2ml病毒,依次10倍系列稀释至适宜浓度,最后一支试管。
B在EP管中用无血清的孵育液10倍倍比稀释病毒原液(10-1,10-2…10-10等),根据病毒大致的滴度确定稀释的倍数。首次滴定可以多稀释几个滴度。
根据接种的孔数稀释病毒,常规每个稀释度接种4孔,则每个稀释度配500μl,即10-1为50μl加入450μl的孵育液中;如每个稀释度接种8个孔,则各配制1ml,即10-1为100μl加入900μl孵育液中。若接种8个孔,则相应增加液体量。上述的配
液并不是固定不变的,可以根据接种的量自行调整。
【!此步操作注意事项:
1)建议每个稀释度接种8个孔,若要统计分析则还要增加至16个孔。
2)病毒稀释过程中一定将病毒液与孵育液充分混匀。
2)此过程中需要使用加样器和tip头。使用前用75%乙醇擦拭加样器,并用紫外线照射20min,确保无菌。使用新高压的tip头,外包装一定在超净台(或安全柜中打开)。】
(3) 接种
取细胞培养板,用多道加样器(又称排枪)吸去96孔板中的培养液,吸取孵育液加在每孔中再轻轻吹打一次,然后吸出孵育液(此步目的是去除血清,因为血清能干扰病毒的吸附)。将稀释好的病毒液加到96孔板上,每孔100μl,根据观察的习惯,一般从右到左,从上到下,从高稀释度到低稀释度(10-1,10-2 )到原液加样。【切记:设置正常的细胞对照。每次实验要重复4次,计算标准差。】
37℃CO2培养箱中孵育1h,取出培养板吸去病毒液(从低浓度向高浓度吸取可避免窜孔),加入维持液200μl继续在37℃ CO2培养箱中培养。
(4) 培养
将培养板放置于CO2培养箱。培养温度,培养天。
(5) 测定结果
取出培养板,显微镜下观察细胞病变。
计算方法
1) Spearman-Karber 法
LgCCID50 /0.2ml= - (X0 - d/2 + d×∑R1/N1)
X0 = 全部病变最低稀释度对数
d = 稀释因数对数
N1 = 每个稀释度所种的孔数
R1 = 病变孔数
∑ = 积和
LgCCID50 /ml = LgCCID50 /0.2ml +0.7
2) Reed-Muench法
观察CPE, 找出能引起半数细胞瓶或管感染的病毒稀释倍数,按计算出该病毒液的TCID50
杆状病毒滴度检测 实验概要 本实验介绍了检测病毒滴度的方法。 实验原理 根据噬菌斑数计算病毒滴度。 工具/原料 ? 1. 4% agarose gel:2g agrose 50ml 水,高压灭菌 ?2×Grace(unsupplemented):9.14g粉末(invitrogen)0.07gNaHCO3 H2O,调PH6.1,定容至100ml,无菌过滤 ?supplemented Grace:1×Grace添加 3.33mg/ml Lactalbumin,3.33mg/ml yeastolate,无菌过滤 ? 4. 高温灭活FBS ?主要设备 1. 6孔板 2. 12ml离心管 3. 100ml无菌玻璃瓶 4. 无菌吸管 5. 70℃水浴锅 ?实验材料 杆状病毒,SF9:5×105cells/ml 方法/步骤 1. 1
无菌条件下,2ml/孔细胞(5×105cells/ml)种入6孔板,室温孵育1h使其贴壁,孵育后镜检其贴壁程度; 2. 2 将4% agarose gel放入70℃水浴锅融解,空100ml无菌瓶与2×Grace放入40℃水浴锅预热; 3. 3 将杆状病毒用无血清supplemented Grace梯度稀释:10-1~10-8。 4. 4 弃6孔板内上清,快速加入稀释好的病毒,1ml/孔,复孔,室温孵育1h。 5. 5 配置上层琼脂:加20ml高温灭活FBS到2×Grace 100ml,25ml 2×Grace(含FBS)12.5ml 无菌水12.5ml 4% agarose gel,至预热的100ml无菌瓶,轻轻混匀,放入37℃水浴锅备用; 6. 6 弃6孔板内上清,快速加2ml上层琼脂,以防菌层干燥,静置10-20min使其凝固; 7.7 将6孔板放入27℃培养箱,培养4-10天;
可以采用倍比稀释来测定病毒的滴度。 第一个Ep管中加入10uL病毒原液,记为1E+1 uL ; 第二个Ep管中进行了第一次十倍稀释,所得病毒原液为第一个Ep中的1/10,记为1E+0 uL; 第三个Ep管中进行了第二次十倍稀释,所得病毒原液为第二个Ep中的1/10,记为1E-1 uL ; 依次类推… 第七个Ep管中进行了第六次十倍稀释,所得病毒原液为第六个Ep中的1/10,记为1E-5 uL ; 第八个Ep管中进行了第七次十倍稀释,所得病毒原液为第七个Ep中的1/10,记为1E-6 uL ; 换句话说:如果在加入1E-5 uL 病毒原液的孔中观察到3个带有荧光的细胞,说明该孔中至少有3个病毒颗粒感染了细胞,则该病毒的滴度等于带有荧光的细胞数除以病毒原液量,本例子中就是3/(1E-5)=3E+5,单位为TU/ uL ,也就等于3E+8 TU/mL。 稀释计数法 滴度单位:TU/mL,指每毫升中含有的具有生物活性的病毒颗粒数。「TU」为「transducing units」的缩写,中文为「转导单位」,表示可以感染并进入到靶细胞中的病毒基因组数。 第一天细胞准备 将生长状态良好的293 T 细胞消化计数后稀释至1×100 000/mL,加入96 孔板,100 μL/孔,为每个病毒准备10 个孔。放入37℃,5% 二氧化碳培养箱中培养。 第二天加病毒 在EP 管中做10 倍梯度稀释,连续10 个稀释度。稀释方法如下:每种病毒准备10 个1.5mL EP 管,每管加入90 μL 培养液,往第一个管中加入10 μL 病毒原液,混匀后,吸取10 μL 加入第二个管混匀。依此类推,做十个稀释度(10—0.00000001)。 吸取96 孔板中原有的培养基,加入含稀释好的病毒液。并做好标记。 第三天追加培养液 在每个孔再加入100 μL 完全培养液,利于细胞的生长。 第四天观察结果并计算滴度 在荧光显微镜下观察结果,并数出最后两个有荧光的荧光细胞克隆数。假设为X 和Y,则滴度(TU/mL)=(X+Y×10)×1000/2/X 孔的病毒液的含量(μL)。 定量PCR 法 病毒感染1 天前,取6 孔板接种HOS 细胞。每孔细胞为5×100 000 个。 接种细胞24 小时后,取两个孔的细胞用血球计数板计数,确定感染时细胞的实际数目,记为N。 弃去其他培养板中的培养基,更换为含有5 μg/mL polybrene 的新鲜培养基。将浓缩病毒用培养基稀释200 倍,也就是取1 μL 病毒加入到199 μL 的培养基中。在3 个培养孔中分别加入0.5 μL,5 μL 和50 μL 的稀释病毒。 感染开始后20 小时,除去培养上清,换为500 μL 含DNaseI 的新鲜培养基。在37℃消化15 分钟,这一步是要除去残余的质粒DNA。然后换为2 mL 正常的培养基,继续培养48 小时。 用0.5 mL 0.25% 胰酶-EDTA 溶液消化细胞,在37℃放置1 分钟。用培养基吹洗下,离心收集细胞。按照DNeasy 试剂盒的说明抽提基因组DNA 。每个样品管中加入200 μL 洗脱液洗下DNA 。用DNA 定量试剂盒定量(Bio-Rad)。基因组DNA 可以稳定保存在-20℃至少两个月。 准备PCR 所需的试剂和样品。为病毒序列检测引物配总管Ⅰ: Forward primer (100 pmol/mL):0.1μL ×n Reverse primer (100 pmol/mL):0.1μL ×n Probe (100 pmol/mL):0.1μL ×n 水:19.7 μL ×n n = number of reactions。例如:总反应数为40,将1 mL 2×TaqMan Universal PCR Master Mix,4 μL forward
慢病毒滴度检测方法 空斑测定法 空斑法测定滴度的主要原理是病毒感染QBI-293A细胞后,通过一个感染周期便可再感染邻近细胞,直至形成一个成熟的空斑。这是所有生物学方法测定病毒滴度中最具挑战性的方法。由于许多因素如单层细胞质量、操作和观察方法等都可影响到最后的结果,因此这一方法得到的结果往往最不稳定。 1.5×105细胞/60mm培养皿用5ml DMEM5%培养,3-4小时后等细胞贴壁即可进行病毒感染。或者在病毒感染前一天加入3×105细胞/60mm培养皿。 2.在12孔板中稀释病毒,储存于-20℃或-80℃备用。第1个稀释孔将病毒保存液稀释至1ml,其它孔稀释至3ml,大体积可提高可重复性。稀释浓度原则视病毒浓度而定(纯化还是未纯化的),调节稀释度至10-100个病毒/孔,一般为10-12,这样稀释比大约为10-7~10-12。 稀释:将100ul病毒保存液加入900ul DMEM5%。用移液器上下吸打5次,此时稀释度为10-1。换用新枪头将300ul 10-1稀释液加入2.7ml DMEM5%吸打5次,稀释度为10-2。然后分别取300ul前一稀释液加入2.7ml DMEM5%,形成一系列稀释度,最后4个稀释度用于感染细胞。 注意:每次稀释时都必须换用新枪头。 3.吸去细胞培养液,每个培养皿中加入1ml病毒稀释液和1ml DMEM5%,十字形轻轻晃动混匀,37℃培养90分钟。 4.吸去培养液,按5.2.2中所述加入1.25%琼脂糖培养基。 5.37℃培养,经常注意是否有空斑形成和是否需要加入新鲜培养基。21天后应该可以看到空斑形成的白色小斑点。 结果:计数有多少个独立的空斑形成,将此数目乘以稀释度即可得到每毫升产生的空斑形成单位(PFU/ml)。 50%组织培养感染剂量法 此方法基于最高稀释度下在QBI-293A细胞中CPE的形成,它是昆腾公司用于测定滴度的标准方法。 细胞准备: 1.收集一瓶QBI-293A细胞,计数。 2.用DMEM 2%准备20ml 105/ml细胞。 3.用12道排枪在2块96孔板中每孔加入100ul细胞悬液。 5.8.3.2 准备稀释病毒液 1.第1管中加入0.9ml DMEM 2%,其余加入1.8ml。第1管中再加入0.1ml病毒保存液。 2.上下吸打5次混匀。 3.换用新枪头。 4.从第1管中吸取0.2ml加入第2管中。
慢病毒包装、纯化、滴度测定及感染 一、包装 1.包装细胞 ?(P11); ? (P16) 2.病毒载体及包装质粒 病毒载体:组构建及中量提取; 包装质粒:商品化产品(?(P12); ? (P17))或中量提取(目前唯一使用来源); 3.细胞转染 方法一: ?(P12); ? (P17); 方法二: 按照? & (.15338)进行,简要中文说明如下: a. 转染前24小时,把4–5 x 106个293T细胞传代至10培养皿中,加入完全培养基至终体积10,培养过夜,转染时,细胞密度为80–90%; b. 293T细胞转染前2小时换上9新鲜的完全培养基; c. 用之前充分混匀,在管中加入15的混合物( :::的摩 尔比为1:1:1:1),15的,用定容到500,标记为 1,温和混匀,室温孵育5分钟; d. 充分混匀,在管中加入45的和455的,标记为 2,
温和混匀; e. 将 1的溶液加到 2中,温和混匀,室温孵育5分钟; 1 ( ) 2 () 15 ( :::1:1:1:1)455 μl 15 μl 45 μl 500μl 500 μl 500 μl f. 将1 转染复合物逐滴加入前一天种好细胞的100皿中,边加边摇匀。 g. 将细胞放入置于37 ℃、5 2 培养箱中培养,12小时后换 上新鲜的培养基继续培养。 h. 转染后48-72h,收取培养上清,500g离心10或利用0.45 μm 低蛋白吸附滤膜去除细胞碎片和团聚的病毒; 方法三: C0508磷酸钙法细胞转染试剂盒(目前唯一使用方法) 4.病毒上清收集 转染后12h, 48h,72h分别收集一次; 二、纯化 方法一: (i) 病毒上清(接一、包装 4.病毒收集). () 51 a 50% 6000 . () 21.7 a 4 M .
狂犬病毒PV-2061株的病毒滴度测定方法的研究 发表时间:2018-11-22T13:05:51.323Z 来源:《医药前沿》2018年27期作者:李爽1 姚宇1 李鹤1 田威2(通讯作者) [导读] 建立狂犬病毒PV-2061株病毒滴度的快速、准确的检测方法。方法:取12批狂犬病毒PV-2061株的病毒样品 李爽1 姚宇1 李鹤1 田威2(通讯作者) (1辽宁成大生物股份有限公司辽宁沈阳 110179) (2沈阳药科大学生命科学与生物制药学院辽宁沈阳 110015) 【摘要】目的:建立狂犬病毒PV-2061株病毒滴度的快速、准确的检测方法。方法:取12批狂犬病毒PV-2061株的病毒样品,分别采用蚀斑法、免疫荧光法检测病毒滴度,与小鼠脑内注射法进行比较,验证其检测结果的相关性。另取一批狂犬病毒PV-2061株的病毒样品,用蚀斑法和免疫荧光法重复检测6次,比较两种实验方法的精密性。结果:蚀斑法和免疫荧光法测得的结果与小鼠脑内注射法之间呈正相关性;重复测定同一病毒样品,免疫荧光法的变异系数更低,表明免疫荧光的重复性更好。结论:以细胞法替代小鼠法检测狂犬病毒的毒力是可行的。免疫荧光法检测病毒滴度,快速、准确、精密度好,为狂犬病毒PV-2061株的疫苗的研究奠定了基础。 【关键词】狂犬病病毒;免疫荧光法;蚀斑法 【中图分类号】R373.9 【文献标识码】A 【文章编号】2095-1752(2018)27-0251-02 Determination of virus titer of rabies virus PV-2061 strain Li Shuang 1,Yao Yu 1,Li He 1,Tian Wei 2 (Corresponding author) 1. Liaoning Cheng Da biological Limited by Share Ltd, Shenyang , Liaoning 110179 2. School of life sciences and Biopharmaceutics, Shenyang Pharmaceutical University, Shenyang, Liaoning 110015 【Abstract】Objective To establish a fast and accurate method to detect the titer of the PV-2061 strain of rabies virus. Methods The virus samples of rabies virus PV-2061 strain of 12 batches were measured by plaque assay and immunofluorescence, and compared with the intracerebral injection in mice to verify the correlation of the test results. A sample of rabies virus PV-2061 strain was also repeated for 6 times by plaque assay and immunofluorescence. The accuracy of the two methods was compared. Results The results of plaque assay and immunofluorescence were positively correlated with the intracerebral injection in mice; Repeated determination of the same virus sample showed that the coefficient of variation of immunofluorescence method was lower, indicating that immunofluorescence was more reproducible. Conclusion It is feasible to detect the virulence of rabies virus by cell method instead of mouse method. The detection of virus titer by immunofluorescence is rapid, accurate and precise, which lays the foundation for the research of vaccine against rabies virus PV-2061 strain. 【Key words】Rabies virus; Immunofluorescent assay;Plaque assay 狂犬病,俗称恐水病,是一种由狂犬病病毒感染引起的人兽共患传染病,一旦感染发病,病死率高达100%。狂犬病至今仍无特效的治疗方法,实施疫苗免疫是预防和控制狂犬病发病最有效的措施[1]。在疫苗生产的各项检测指标中,狂犬病毒毒力的测定是至关重要的,其直接关系到疫苗成品的效价和免疫效果。《中华人民共和国药典》三部(2015版)狂犬病毒滴度检测的方法推荐采用小鼠法。但是由于实验动物之间存在个体差异,实验人员操作的熟练程度等诸多因素均会影响实验结果的准确性。细胞法作为病毒滴度测定的一种替代方法,近年来广受国内外学者的青睐,其中蚀斑法、免疫荧光法等都是比较经典的实验方法。 1.材料和方法 1.1 病毒及细胞病毒株 狂犬病毒PV-2061株第18代,由辽宁成大生物股份有限公司提供,原始毒株来源于ATCC。细胞株:幼仓鼠肾细胞(BHK-21)、非洲绿猴肾细胞(Vero)来源于中科院上海细胞库。 1.2 实验动物 昆明系SPF级小鼠,雄性,体重11~13g,来源于湖南斯莱克景达实验动物有限公司。 1.3 主要试剂 FITC标记的抗狂犬病病毒特异性荧光抗体购自美国Novus Biologicals公司,浓度0.93mg/ml;新生牛血清购自美国Hyclone公司;甲基纤维素购自美国Sigma公司。 1.4 蚀斑法 1.4.1制备单层细胞将BHK-21细胞浓度调整至1×105个/ml,接种6孔细胞培养板,长满单层备用。 1.4.2病毒滴度测定将狂犬病毒样品5倍稀释,然后进行10倍系列稀释,共6个稀释度(1×10-4、5×10-4、1×10-5、5×10-5、1×10-6、5×10-6),接种至已制备好的6孔细胞培养板中,0.4ml/孔,于5%CO2、37℃的培养箱内吸附90min,每隔15min轻摇板一次,然后加入甲基纤维素覆盖液,4ml/孔,于培养箱中培养7d后,弃去覆盖液,加入结晶紫染色液,2ml/孔,室温30min后弃去染色液,用自来水冲洗至流水无色,晾干,细胞培养板孔内蚀斑清晰可见。统计各孔蚀斑数,计算结果,病毒滴度以lgPFU/ml表示。 PFU/ml=(每孔平均蚀斑数×病毒稀释倍数)/每孔接种病毒量 1.5 免疫荧光法 1.5.1制备单层细胞将Vero细胞调整浓度至1×105个/ml,接种96孔细胞培养板中,长满单层后备用。 1.5.2病毒滴度测定用细胞培养液将待测的狂犬病毒样品以10倍系列稀释,共6个稀释度(1×103、1×104、1×105、1×106、1×107、1×108),接种至制备好的96孔细胞培养板中,100μL/孔,每个稀释度6孔,每块板上设正常细胞对照孔和病毒阳性对照孔,置5% CO2、37℃培养箱中培养2d后,用PBS洗板3次,室温干燥后加入80%冷丙酮,100μL/孔,4℃固定30min后弃丙酮,置室温干燥,然后用100×稀释的荧光抗体进行染色,50μL/孔,置湿盒内37℃温育30min,洗板3次,甘油封闭,荧光显微镜下观察,计数病毒感染细胞的荧光灶数,细胞浆内有绿色特异性荧光颗粒者为阳性。正常细胞对照无特异性荧光,病毒对照阳性者为有效,以Reed-Muench法计算感染性滴度[2]。 1.6 小鼠LD50测定法 将病毒样品进行10倍系列稀释,脑内接种11~13g的小鼠,每个稀释度注射6只,0.03ml/只。连续观察14d,3天后死亡或呈典型发病症状的小鼠均计入死亡数内,计算LD50。
病毒滴度测定 有很多名词都用来描述病毒溶液的滴度。 1. VP(病毒颗粒)或OPV(光学颗粒单位) 2. GTU(基因转移单位)或转导颗粒(BFU即蓝点形成单位,与GTU类似) 3. PFU(空斑形成单位) 4. TCID50(50%组织培养感染剂量) 不同的概念缘于不同的滴度测定方法,这些方法包括2类:物理方法(VP)和生物学方法(GTU、PFU、TCID50)。 1.测定VP的方法是测定病毒颗粒在260nm处的吸光度(病毒DNA和蛋白的总吸光度中主要为DNA),1个OD值相当于1.1×1012个病毒颗粒。用这种方法进行测定在各个实验室中都较为稳定,但它不能区分感染性和缺陷性病毒颗粒。因此这种方法只能提供病毒的量,至于质,比如是否含有缺陷性颗粒则没有考虑在内。 2. GTU则测定感染后能表达报告基因的细胞数量。这个过程中,病毒将DNA转入细胞,在一个感染周期结束前立即测定表达报告基因的细胞。如果重组腺病毒含有报告基因如GFP 或LacZ等则可以用这种方法进行测定,病毒保存液通常不用这种方法来进行描述。 3. PFU是测定腺病毒滴度最早的标准方法,主要测定单层细胞培养中病毒裂解空斑的形成。空斑形成需要许多个感染周期,得到最终结果通常需要三个星期。一般来说,这种方法得到的结果很少能在其它实验室重复,即使在同一实验室内,不同技术员操作也很少能得到相同的结果。 4. TCID50已被用于测定许多种病毒的滴度,但以前并不用于腺病毒。病毒稀释液与细胞在96孔板进行培养,然后监测每孔是否CPE。TCID50方法相对PFU方法而言有几个优点,如速度是PFU的2倍,结果更具预料性,在不同操作个体间也更稳定。 所有生物学方法所得到的结果在不同实验室之间往往有所差异,它主要与病毒感染方法有关。许多因素如加入的病毒储存液的量、管子的类型、培养的时间、细胞和培养液的量等都会影响结果。最近,出现了两种测定病毒滴度的改良方法。一种是用更小体积的病毒液进行感染并在感染过程中不断晃动培养板(Mittereoler等,1996);另一种方法则在感染时将培养板进行离心(1000 RCF90分钟)(Nyberg-Hoffman等,1997)。这两个实验室所得到的结果更为稳定,并证实以前的方法低估了病毒保存液中感染性病毒颗粒的数量。迄今为止,尚无一种方法被控制机构认定为测定滴度的标准方法。 对于同一管病毒保存液,不同的方法所得到的结果往往相差100倍以上,典型的数据见表6。所有结果都只是大概的,目前最有效的生物学方法(离心法感染)能检测到1个感染性颗粒/2个颗粒。下一部分,我们将详细描述3种不同的测定病毒滴度的方法。选择滴定方法要考虑的关键因素包括可重复性、稳定性、敏感性、易用性和耗时。无论选择那种方法,稀释和滴定过程必须重复操作以得到精确结果。一般来说,用TCID50方法得到的病毒保存液的滴度应为: 106~107 第一代细胞经冻融后 108~109 100倍数量的细胞经过冻融后 1010~1011 用氯化铯方法纯化后 表6:各滴度测定方法特性 方法类型时间可重复性滴度* 评注 VP 物理学方法 2小时好 5×1012 GTU 生物学方法 2天可变 2×1011
慢病毒滴度检测标准操作细则 1. 目的: 规范慢病毒滴度检测标准操作程序 2. 范围: 适用于慢病毒滴度检测操作工序 3. 操作程序 3.1器材准备 移液枪、各种枪头,1.5mL EP管、试管架,酒精灯、荧光显微镜、CO2培养箱、生物安全柜 3.2溶液准备 1640培养基,FBS(gemini), 3.3操作步骤 3.3.1检测前一天,对293T细胞传代,每个96孔中加8000个细胞,37度培养过夜,感染时细胞长至30~50%的融合密度; 3.3.2次日,准备10个无菌的Ep管,每个EP管中加入90 μL的培养基(1640培养基+10% FBS),取待测定的病毒原液10 μL加入到第一个管中,混匀(用移液枪反复吹吸混匀,注意不要吹起气泡)后,标记(10-1),取10 μL加入到第二个管中,继续相同的操作直到最后一管(10-8)。 3.3.4选取所需的细胞孔,吸去孔板中培养液,加入梯度稀释为10-3至10-8稀释好的病毒溶液90ul到孔板中,轻轻混匀,放入37℃ 5% CO2培养箱中培养; 3.3.5 24小时后,视具体情况更换新鲜完全培养基90ul。小心操作,不要吹起细胞。 3.3.6 第四天,在荧光显微镜下观察各孔中荧光细胞数量,病毒滴度为表达荧光的细胞数乘以相应稀释倍数。 3.3.7例如:某一慢病毒感染细胞后96小时部分孔(某一视野)的荧光照片如下: 一号孔:一号稀释液,含有10*10-3ml慢病毒液 二号孔:二号稀释液,含有10 *10-4ml慢病毒液 三号孔:三号稀释液,含有10*10-5ml慢病毒液 四号孔:四号稀释液,含有10*10-6ml慢病毒液 五号孔:五号稀释液,含有10*10-7ml慢病毒液 六号孔:六号稀释液,含有10*10-8ml慢病毒液
吉凯基因慢病毒滴度检测方法 逐孔稀释滴度测定法: 一:样品准备 1.检测前一天,对293T 细胞传代,每个24 孔中加1×105 个细胞,体积为 500μL; 2.次日,准备7~10 个无菌的Ep 管,在每个管中加入90 μL 的培养基(DMEM+10% FBS); 3.取待测定的病毒原液10μL 加入到第一个管中,混匀后,取10 μL 加入到 第二个管中。继续相同的操作直到最后一管; 4.选取所需的细胞孔,吸去90 μL 培养基。加入稀释好的病毒溶液。放入37℃ 5%CO 培养箱中培养; 2 5.48 小时后,加入新鲜培养基500 μL。小心操作,不要吹起细胞; 6. 4 天后,抽提RNA 准备做RT-qPCR。 二:Real time 定量PCR 法测定滴度 具体操作内容参考“吉凯基因慢病毒包装手册”14页“2) Real time 定量PCR 法测定滴度” 三:滴度计算方法 1.加入不同病毒量的细胞样品,通过提取总RNA后反转录为cDNA,然后进行定 量PCR检测,通过比较control组和试验组的Ct值差异判断滴度值。通常情况下,认为Ct值差异2以上存在显著差异。 2.反转录反应所获得的20 μL cDNA中只取了1 μL用于实时定量检测,所以 该结果仅表示1/20样品的情况,所以在滴度计算时应该乘以系数20。 3.例如:若某次滴度检测中,1.00E-05 μL组样品和control组样品的Ct值 存在2个左右差异,则认为在1.00E-05 μL组样品中存在病毒颗粒。 假定该组样品含有至少有1个病毒颗粒,则病毒的滴度为: 1/(1.00E-05) *20=2.00E+6 TU/μL=2.00E+9 TU/ml。
二、空斑测定法 空斑法测定滴度的主要原理是病毒感染细胞后,通过一个感染周期便可再感染邻近细胞,直至形成一个成熟的空斑。这一方法得到的结果往往最不稳定。 1.5×105细胞/60mm培养皿用5ml DMEM5%培养,3-4小时后等细胞贴壁即可进行病毒感染。或者在病毒感染前一天加入3×105细胞/60mm培养皿。 2.在12孔板中稀释病毒,储存于-20℃或-80℃备用。第1个稀释孔将病毒保存液稀释至1ml,其它孔稀释至3ml,大体积可提高可重复性。稀释浓度原则视病毒浓度而定(纯化还是未纯化的),调节稀释度至10-100个病毒/孔,一般为10-12,这样稀释比大约为 10-7~10-12。 稀释:将100ul病毒保存液加入900ul DMEM5%。用移液器上下吸打5次,此时稀释度为10-1。换用新枪头将300ul 10-1稀释液加入2.7ml DMEM5%吸打5次,稀释度为10-2。然后分别取300ul前一稀释液加入2.7ml DMEM5%,形成一系列稀释度,最后4个稀释度用于感染细胞。 注意:每次稀释时都必须换用新枪头。 3.吸去细胞培养液,每个培养皿中加入1ml病毒稀释液和1ml DMEM5%,十字形轻轻晃动混匀,37℃培养90分钟。 4.吸去培养液,按5.2.2中所述加入1.25%琼脂糖培养基。 5.37℃培养,经常注意是否有空斑形成和是否需要加入新鲜培养基。21天后应该可以看到空斑形成的白色小斑点。 结果:计数有多少个独立的空斑形成,将此数目乘以稀释度即可得到每毫升产生的空斑形成单位(PFU/ml)。 三、50%组织培养感染剂量法 此方法基于最高稀释度下在细胞中CPE的形成,它是昆腾公司用于测定滴度的标准方法(一)细胞准备: 1.收集一瓶细胞,计数。 2.用DMEM 2%准备20ml 105/ml细胞。 3.用12道排枪在2块96孔板中每孔加入100ul细胞悬液。 (二)准备稀释病毒液 1.第1管中加入0.9ml DMEM 2%,其余加入1.8ml。第1管中再加入0.1ml病毒保存液。 2.上下吸打5次混匀。 3.换用新枪头。 4.从第1管中吸取0.2ml加入第2管中。 5.反复稀释至最高稀释度。 6.用同一管病毒保存液进行第2轮稀释。 7.最后8个稀释液加入96孔板,每孔0.1ml,每个稀释度10孔,2孔为阴性对照。阴性对照孔中加入0.1ml DMEM 2%监测细胞存活情况。加样时从最高稀释度开始。 8.37℃培养10天。 9. 10天后倒置显微镜下观察,计算每一排中出现CPE的孔数。只要有一小点或是一些细胞出现CPE即为阳性,如果无法确定,可与阴性对照比较。 10.计算每一排中出现阳性的孔数。 如果阴性对照中无任何CPE且细胞生长良好,最低稀释度100%阳性而最高稀释度100%
病毒TCID50测定 操作步骤 (1) 准备细胞 取出一块细胞培养板,每个孔大约传8000~10000个细胞(一个T25瓶的细 胞消化后加10ml培养液正好传一块96孔板,要传匀)。每个孔的细胞铺成单层大约60%丰度即可接种病毒(下午传好板第二天早上就能用)。 细胞对照选取16个孔即可。滴定与对照可以在一块培养板上进行,操作中注意不要窜孔。也可以分别在不同的细胞培养板上进行,但要保证实验条件一致。 (2) 稀释待测病毒液。 A法为参考书上标准的操作方法 B法参照书将液体量减少后的结果 病毒稀释液根据是否需要胰酶来选择适合的液体,无论哪种都无血清。 A向每支试管中加入1.8ml病毒稀释液。向1号试管中加入0.2ml病毒,依次10倍系列稀释至适宜浓度,最后一支试管。 B在EP管中用无血清的孵育液10倍倍比稀释病毒原液(10-1,10-2…10-10等),根据病毒大致的滴度确定稀释的倍数。首次滴定可以多稀释几个滴度。 根据接种的孔数稀释病毒,常规每个稀释度接种4孔,则每个稀释度配500μl,即10-1为50μl加入450μl的孵育液中;如每个稀释度接种8个孔,则各配制1ml,即10-1为100μl加入900μl孵育液中。若接种8个孔,则相应增加液体量。上述的配液并不是固定不变的,可以根据接种的量自行调整。 【!此步操作注意事项: 1)建议每个稀释度接种8个孔,若要统计分析则还要增加至16个孔。 2)病毒稀释过程中一定将病毒液与孵育液充分混匀。 2)此过程中需要使用加样器和tip头。使用前用75%乙醇擦拭加样器,并用紫外线照射20min,确保无菌。使用新高压的tip头,外包装一定在超净台(或安全柜中打开)。】(3) 接种 取细胞培养板,用多道加样器(又称排枪)吸去96孔板中的培养液,吸取孵育液加在每孔中再轻轻吹打一次,然后吸出孵育液(此步目的是去除血清,因为血清能干扰病毒的吸附)。将稀释好的病毒液加到96孔板上,每孔100μl,根据观察的习惯,一般从右到左,从上到下,从高稀释度到低稀释度(10-1,10-2 )到原液加样。【切记:设置正常的细胞对照。每次实验要重复4次,计算标准差。】 37℃CO2培养箱中孵育1h,取出培养板吸去病毒液(从低浓度向高浓度吸取可避免窜孔),加入维持液200μl继续在37℃ CO2培养箱中培养。 (4) 培养
有很多名词都用来描述病毒溶液的滴度。 1. VP(病毒颗粒)或OPV(光学颗粒单位) 2. GTU(基因转移单位)或转导颗粒(BFU即蓝点形成单位,与GTU类似) 3. PFU(空斑形成单位) 4. TCID50(50%组织培养感染剂量) 不同的概念缘于不同的滴度测定方法,这些方法包括2类:物理方法(VP)和生物学方法(GTU、PFU、TCID50)。 1.测定VP的方法是测定病毒颗粒在260nm处的吸光度(病毒DNA和蛋白的总吸光度中主要为DNA),1个OD值相当于1.1×1012个病毒颗粒。用这种方法进行测定在各个实验室中都较为稳定,但它不能区分感染性和缺陷性病毒颗粒。因此这种方法只能提供病毒的量,至于质,比如是否含有缺陷性颗粒则没有考虑在内。 2. GTU则测定感染后能表达报告基因的细胞数量。这个过程中,病毒将DNA转入细胞,在一个感染周期结束前立即测定表达报告基因的细胞。如果重组腺病毒含有报告基因如GFP或LacZ等则可以用这种方法进行测定,病毒保存液通常不用这种方法来进行描述。3. PFU是测定腺病毒滴度最早的标准方法,主要测定单层细胞培养中病毒裂解空斑的形成。空斑形成需要许多个感染周期,得到最终结果通常需要三个星期。一般来说,这种方法得到的结果很少能在其它实验室重复,即使在同一实验室内,不同技术员操作也很少能得到相同的结果。 4. TCID50已被用于测定许多种病毒的滴度,但以前并不用于腺病毒。病毒稀释液与细胞在96孔板进行培养,然后监测每孔是否CPE。TCID50方法相对PFU方法而言有几个优点,如速度是PFU的2倍,结果更具预料性,在不同操作个体间也更稳定。 所有生物学方法所得到的结果在不同实验室之间往往有所差异,它主要与病毒感染方法有关。许多因素如加入的病毒储存液的量、管子的类型、培养的时间、细胞和培养液的量等都会影响结果。最近,出现了两种测定病毒滴度的改良方法。一种是用更小体积的病毒液进行感染并在感染过程中不断晃动培养板(Mittereoler等,1996);另一种方法则在感染时将培养板进行离心(1000 RCF90分钟)(Nyberg-Hoffman等,1997)。这两个实验室所得到的结果更为稳定,并证实以前的方法低估了病毒保存液中感染性病毒颗粒的数量。迄今为止,尚无一种方法被控制机构认定为测定滴度的标准方法。 对于同一管病毒保存液,不同的方法所得到的结果往往相差100倍以上,典型的数据见表6。所有结果都只是大概的,目前最有效的生物学方法(离心法感染)能检测到1个感染性颗粒/2个颗粒。下一部分,我们将详细描述3种不同的测定病毒滴度的方法。选择滴定方法要考虑的关键因素包括可重复性、稳定性、敏感性、易用性和耗时。无论选择那种方法,稀释和滴定过程必须重复操作以得到精确结果。一般来说,用TCID50方法得到的病毒保存液的滴度应为: 106~107 第一代细胞经冻融后 108~109 100倍数量的细胞经过冻融后 1010~1011 用氯化铯方法纯化后 表6:各滴度测定方法特性 方法类型时间可重复性滴度* 评注 VP 物理学方法 2小时好5×1012
定量测定重组昆虫杆状病毒滴度的方法 摘要 本发明提供一种定量测定重组昆虫杆状病毒滴度的方法,该方法利用重组昆虫杆状病毒感染昆虫细胞后会干扰宿主细胞的生长和复制,通过酸性磷酸酶法检测细胞的数量实现定量测定重组昆虫杆状病毒滴度。该方法灵敏度高,准确性好,所需试剂廉价易得;操作简便,技术容易掌握;耗时较短,效率更高。 说明 定量测定重组昆虫杆状病毒滴度的方法 技术领域 [0001] 本发明涉及病毒滴度测定,具体地,涉及一种定量测定重组昆虫杆状病毒滴度的方法。背景技术 [0002]自从80年代初发现杆状病毒科核型多角体病毒的多角体蛋白基因(polh)的强启动子特性后,Smith and Summer [Smith GE, MD Summers and MJ Fraser.Production ofhuman beta interferon in insect cells infected with a baculovirus expressionvector.Mol Cell Biol.1983; 3 (12): 2156-2165]首次建立了杆状病毒表达系统(Baculovirus Expression Vector System, BEVS)。杆状病毒表达系统已成为当今基因工程领域四大表达系统之一,与大肠杆菌、酵母哺乳动物细胞表达系统相比,BEVS在以下四个方面具有特殊的研究价值:(I)作为超高效的真核基因表达系统,生产有用的目的蛋白; [2]作为基因工程病毒杀虫剂,提高害虫防治效率;(3)研究杆状病毒基因组的结构和功能;(4)研究真核基因的表达调控机制。杆状病毒表达载体系统已成为研究各种原核蛋白和真核蛋白的非常有效和广泛使用的工具[李卫国,王厚伟,牟志美,石连辉.昆虫重组杆状病毒获得技术研究展望.山东农业大学学报(自然科学版).2003,34(1): 134-138]。 [0003] 检测病毒滴度的方法有终点稀释法和空斑法。终点稀释法是常用检测病毒滴度的方法,具有简便、快速的特点。它是将病毒进行梯度系列稀释后感染细胞,通过检测50%组织细胞感染量(TCID5tl)来判定病毒滴度。空斑技术最早是由Dulbecco建立[DulbeccoR.-Production of plaques in monolayer tissues by using single particles ofanimal virus.Proc Nat Acad Scil952; 38 (8): 747-752], Hink 和Vial 后来把这项技术应用于杆状病毒的研究工作。空斑法是将适量病毒感染细胞后,病毒在感染的细胞内复制、增殖并释放出游离病毒粒子,这些游离病毒粒子由于受到琼脂糖固定培养基的限制,只能感染邻近的细胞。经过几个感染周期以后,这些被感染的细胞均死亡而不被中性红染色,周围的活细胞则被染成红色,于是在最初被病毒感染的细胞周围形成一个无色透明区域,即空斑。通过计数空斑的数量即可判定病毒滴度。
季节性流感病毒每年都在人与人之间传播,温带地区易在冬季暴发。接种流感疫苗是预防季节性流感的最有效方法。2006年9月,WHO发起全球流感行动计划(Global Action Plan for Influenza Vaccines,GAP),目的是提高流感疫苗产能,以满足大流行期间全球流感疫苗的供应[1]。2012年2月,WHO授予长春百克生物科技股份公司采用WHO提供的毒株研发、生产和销售三价流感减毒活疫苗(live atte-nuated influenza vaccine,LAIV)的许可。 目前,流感疫苗在世界范围内仍以灭活疫苗为主。灭活疫苗仅能激发机体的体液免疫,且需大剂 CCID50法检测流感病毒滴度方法的建立及验证 孙瑶1,申镇维2,3,姜春来1,孟祥博4,徐菲1 1.吉林大学生命科学学院艾滋病疫苗国家工程实验室,吉林长春130012; 2.长春百克生物科技股份公司, 吉林长春130012;3.吉林大学第一医院转化医学研究院免疫学研究所,吉林长春130061; 4.吉林大学中日联谊医院胃肠内科,吉林长春130033 摘要:目的建立基于MDCK细胞的三价流感减毒活疫苗病毒滴度检测方法,并进行验证。方法以抗流感病毒血清中和三价流感减毒活疫苗中两种型别病毒,采用CCID50法检测未中和型别病毒感染性滴度,并对方法的专属性、线性、准确性、精密度、耐用性进行验证。结果样品中的辅料成分、其他型别病毒和异源抗病毒血清均不会对病毒滴度测定结果产生干扰;该方法检测H1N1、H3N2和B型流感病毒滴度的线性范围分别为3.81~8.48、3.48~ 7.65和2.45~6.98logCCID50/0.2ml,在线性范围内,线性回归系数(R2)分别为1、0.9946和0.9945;该方法检 测3种型别流感病毒滴度重复性和中间精密度的相对标准偏差(relative standard deviation,RSD)均小于15%,平均回收率在85%~115%之间;同一样品不同时间点检出结果差异无统计学意义(P均>0.05)。结论建立的CCID50法专属性、准确度、线性、精密度、耐用性良好,是一种简便、快速、成本低、检测误差小的方法,可用于三价流感减毒活疫苗病毒滴度的检测。 关键词:CCID50;三价流感减毒活疫苗;病毒滴度;MDCK细胞 中图分类号:R373.1+3R392-33文献标识码:A文章编号:1004-5503(2016)09-0978-06 Development and validation of a CCID50method for determination of influenza virus titer SUN Yao*,SHEN Zhen-wei,JIANG Chun-lai,MENG Xiang-bo,XU Fei *National Engineering Laboratory for AIDS Vaccine,College of Life Science,Jilin University, Changchun130012,Jilin Province,China Corresponding author:XU Fei,E-mail:feixu@https://www.doczj.com/doc/518694626.html, Abstract:Objective To develop and validate a Madin-Darby canine kidney(MDCK)cell line based potency assay to test the titer of trivalent live attenuated influenza vaccine.Methods The infectious titer of non-neutralized virus was determined by CCID50method.The test was validated for specificity,linearity,accuracy,precision and robustness.Results The virus preservers,other viral strains and heterologous antisera in samples showed no influence on the determination result of virus titer.The linear ranges of titers of influenza H1N1,H3N2and B viruses were3.81~8.48,3.48~7.65 and2.45~6.98logCCID50/0.2ml,with R2values of1,0.9946and0.9945,respectively.The relative standard deviations(RSD s)of reproducibility and intermediate precision of virus titers of the three types were less than15%,while the mean recovery rate was85%~115%.The determination results of the same sample at various time points showed no significant difference(each P>0.05).Conclusion The developed CCID50method showed high specificity,linearity, accuracy,precision and robustness,which was simple,rapid,low-cost and with small error,and was suitable for determination of virus titer of trivalent live attenuated influenza vaccine. Key words:CCID50;Trivalent live attenuated influenza vaccine;Virus titer;MDCK cells ·技术方法· 基金项目:吉林省科技发展计划项目“创新生物技术药物的开发”课 题(140901GX010013647). 通讯作者:徐菲,E-mail:feixu@https://www.doczj.com/doc/518694626.html, DOI:10.13200/https://www.doczj.com/doc/518694626.html,ki.cjb.001458
慢病毒滴度测定方法简介(表达荧光的慢病毒) Day 0:将生长状态良好的293T 细胞消化计数后稀释至1?105/ml, 加入96孔板,100 μl/孔(1?104个细胞),每种病毒需要6个孔。放入37℃,5% CO2培养 箱中培养过夜。 Day 1: 在EP 管中做10倍梯度稀释,连续6个稀释度。稀释方法如下:每种病毒准备6个1.5 ml EP 管,每管加入90 μl完全培养基,往第一个管中加入10 μl 病毒原液,混匀后,吸取10 μl 加入第二个管混匀。以此类推。然后把稀释好 的病毒和细胞孵育过夜。 Day 2:吸去带有病毒的培养液,在每个孔中再加入100 μl 完全培养液,以利于细胞的生长。 Day 3:显微镜观察荧光。此时荧光会有初步表达。 Day 4:在荧光显微镜下观察结果,对荧光比例合适(10-30%之间)的孔进行细胞计数,并计算滴度。其计算公式如下:
滴度(TU/ml)=细胞数?荧光百分比?103/病毒原液体积(μl)。 举例:③号管对应孔的荧光比例为30%,细胞总数为8?104, 滴度(TU/ml)=8?104?30%?103/0.1=2.4?108 如果要感染2×105个细胞,MOI=30(1个细胞对应30个病毒粒子)(见下注),则需要病毒体积为=2×105?30/2.4?108(ml)=0.025 ml=25 μl. 注:MOI值: MOI 是multiplicity of infection的缩写,中文译为感染复数,实际的含义即为每个细胞被多少个有活力病毒所感染。各种细胞的最适MOI值有差别,请客户正式实验前先进行预实验摸索最适MOI。