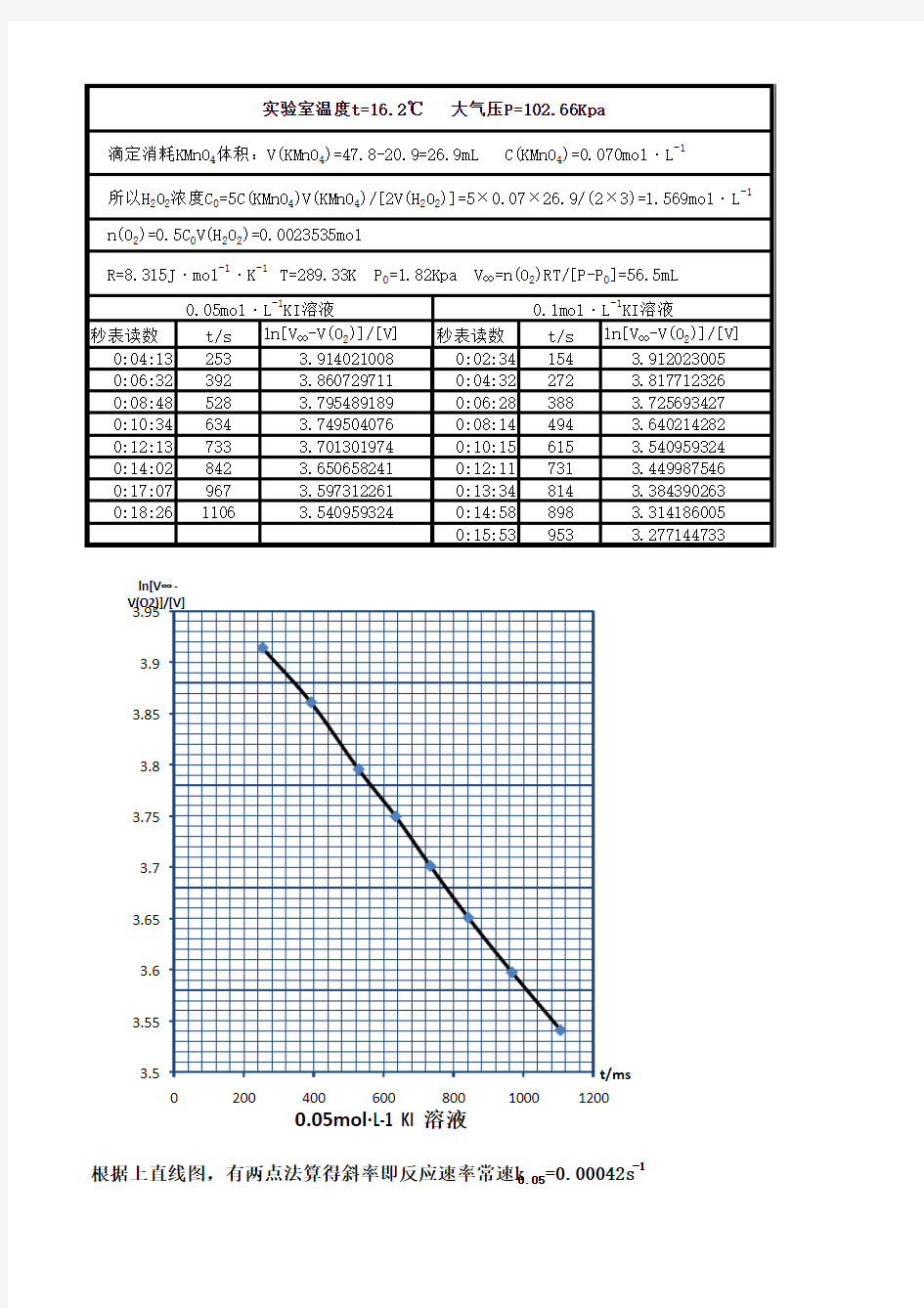

秒表读数t/s
秒表读数
t/s
0:04:13253 3.9140210080:02:34154 3.9120230050:06:32392 3.8607297110:04:32272 3.8177123260:08:48528 3.7954891890:06:28388 3.7256934270:10:34634 3.749504076
0:08:14494 3.6402142820:12:13733 3.7013019740:10:15615 3.5409593240:14:02842 3.6506582410:12:11731 3.4499875460:17:07967 3.5973122610:13:34814 3.3843902630:18:26
1106 3.540959324
0:14:58898 3.3141860050:15:53
953 3.277144733
根据上直线图,有两点法算得斜率即反应速率常速k 0.05=0.00042s
-1
实验室温度t=16.2℃ 大气压P=102.66Kpa
0.05mol·L -1KI溶液
0.1mol·L -1KI溶液
ln[V ∞-V(O 2)]/[V]ln[V ∞-V(O 2)]/[V] 滴定消耗KMnO 4体积:V(KMnO 4)=47.8-20.9=26.9mL C(KMnO 4)=0.070mol·L -1
所以H 2O 2浓度C 0=5C(KMnO 4)V(KMnO 4)/[2V(H 2O 2)]=5×0.07×26.9/(2×3)=1.569mol·L -1
R=8.315J·mol -1·K -1 T=289.33K P 0=1.82Kpa V ∞=n(O 2)RT/[P-P 0]=56.5mL n(O 2)=0.5C 0V(H 2O 2)=0.0023535mol
本次实验过程中U型管内液面齐平过程漫长,且得出的反应速率常数与理论值比起来均
偏小
问题分析:
①装置可能气密性存在问题,导致反应产生的气体一部分泄露,从而测得反应速率变慢
②搅拌速率过慢
③装H 2O 2小试管倒下后并没有充分进入KI溶液,导致实际反应的H 2O 2浓度偏小,反应变慢
根据上直线图,有两点法算得斜率即反应速率常速k 0.1=0.00084s
-1