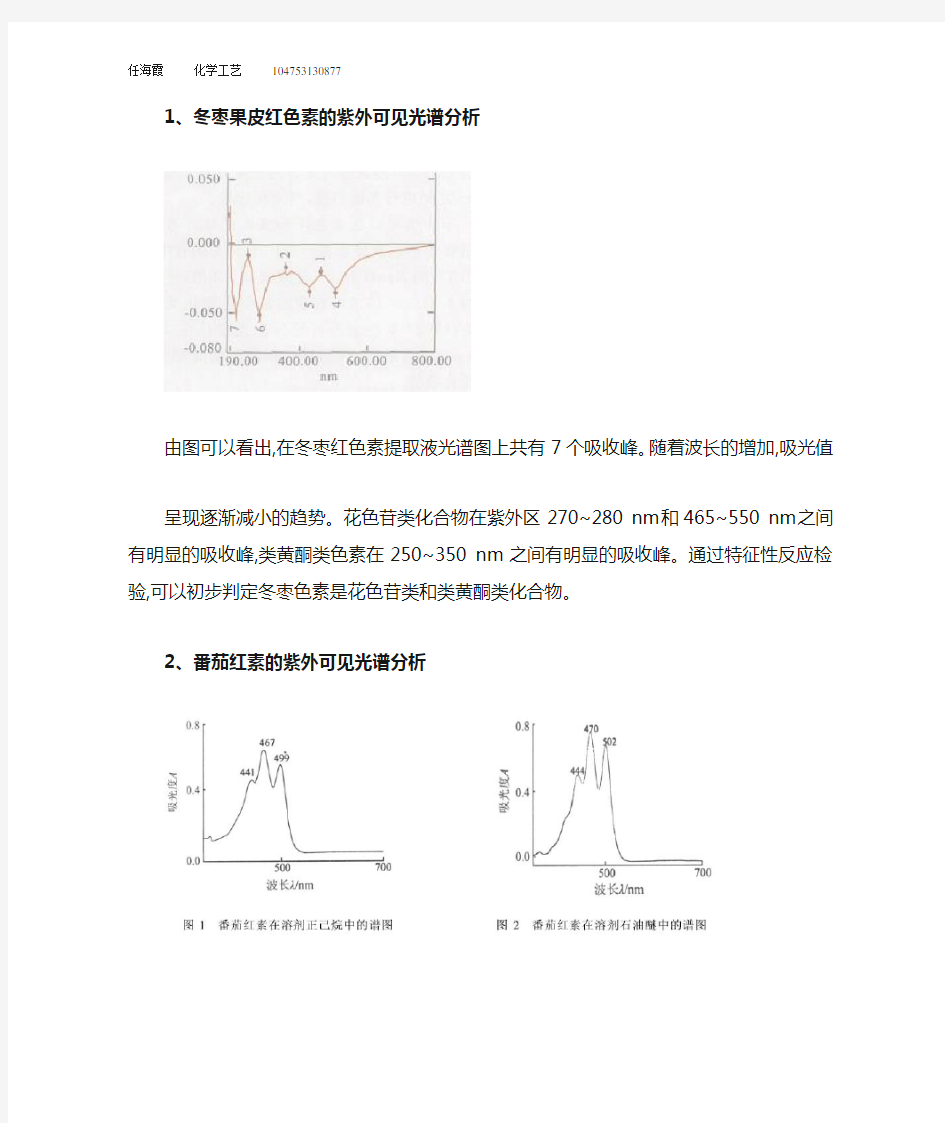

1、冬枣果皮红色素的紫外可见光谱分析
由图可以看出,在冬枣红色素提取液光谱图上共有7个吸收峰。随着波长的增加,吸光值呈现逐渐减小的趋势。花色苷类化合物在紫外区270~280 nm和465~550 nm之间有明显的吸收峰,类黄酮类色素在250~350 nm之间有明显的吸收峰。通过特征性反应检验,可以初步判定冬枣色素是花色苷类和类黄酮类化合物。
2、番茄红素的紫外可见光谱分析
番茄红素在不同极性的溶剂中的紫外光谱的吸收峰的位置、强度、形状常常发生变化是溶质-溶剂分子之间相互作用的结果。番茄红素主吸收带的产生是由其共轭π电子从基态跃迁到第二激发态引起,番茄红素分子所处的介质环境对吸收带波长以及吸收强度有较大影响,由图和表分析得到:番茄红素在具有较低折光率的溶剂-非极性溶剂(正己烷、石油醚)和极性中等的溶剂(丙酮、乙酸乙酯)中特征吸收带波长非常接近,但在较高折光率的溶剂苯、二硫化碳中特征吸收带波长明显红移,可能是高折光率的溶剂对番茄红素激发态的稳定作用比基态强的结果。
用苯和二硫化碳作为溶剂时,与丙酮相比,番茄红素的溶解速度快,颜色变深,番茄红素的3个吸收峰发生明显红移,同时还发现在二硫化碳中,番茄红素吸收光谱的谱带变宽,475nm处的峰值变得模糊。当番茄红素溶于极性溶剂时产生溶剂化,由于激发态和基态的电荷分布不同而使这两种状态的溶剂化程度不同,溶剂的极性愈大,有机分子的成键π轨道向反键π*轨道的跃迁波长愈长,说明激发态的极性比基态大,能级降低的比基态多,从而发生红移效应。溶剂化还限制了分子的自由转动,因而转动光谱表现不出来,如果溶剂的极性很大,分子的振动也受到了限制因而振动引起的精细结构消失。番茄红素溶解在苯和二硫化碳两种溶剂极性不一样的溶剂,产生红移的大小也不一样。由于二硫化碳的极性比苯大,番茄红素的二硫化碳溶液吸收峰的位置红移最为显著。
3、TiO2 纳米膜紫外可见光谱
图1 为膜A05 和膜A′05 的紫外可见光谱,从图上可看出,热处理温度对膜的紫外可见光谱有一定的影响,热处理温度高,膜的可见区的透射率明显下降,这可能是由于高的热处理温度可形成较大的粒子,从而引起较大的光散射. 两种膜未见明显光干涉作用.
图2 为膜B10 和膜B′10 的紫外可见光谱,从图上可看出,膜B′10 的透光率小,最大吸收波长发生红移,这是由于膜B′10 是一次提拉形成的膜,粒子间间隔大,膜较厚,所以透光率就小.膜B10 分两次成膜,粒子间距小、重叠密,膜的厚度相对就小,透光率大. 两种膜在可见区光的干涉作用均较强,且干涉模式不一样.
图3为膜C10和膜C10 的紫外可见光谱,从图上可看出,膜C10和膜C’10 的透光率基
本一样,陈化时间对膜的紫外可见光谱影响不大.两种膜在可见区光的干涉作用均较强,且干涉模式不一样.
4、磷酸铝铬介孔材料的紫外-可见光谱
从图4a可知, CrAlPO-a的紫外-可见漫反射光谱有5个不同的吸收谱带: 691、663、451、359和226nm,且XRD谱图中没有出现铬氧化物的特征衍射峰(见图2),因此, CrAlPO-a在691与663 nm处的吸收峰可归属为磷酸铝骨架上Cr(Ⅲ)离子d-d电子4A2g(F)→2T1g(G)的禁戒
跃迁与4A2g(F)→4T2g(F)自旋允许跃迁[18-20]; 450 nm附近的吸收峰是Cr(Ⅲ)离子进入磷酸铝骨架d-d电子[4A2g(F)→2T1g(F)]跃迁产生的[20-21]; 350 nm附近的吸收峰通常归属为Cr(Ⅵ)离子d电子的电荷转移跃迁,但也有学者把它归属为准八面体Cr(Ⅲ)物种或重铬酸盐物种的第三种转移[11, 21-25]。由于Cr(Ⅳ)与Cr(Ⅴ)很不稳定,容易转化为Cr(Ⅲ)和Cr(Ⅵ); Cr(Ⅱ)是强还原剂,缺氧时才能稳定存在,因此, 230nm以下的吸收峰则是O→Cr(Ⅲ)离子的p-d电子跃迁产生的。由于底物和Cr(Ⅲ)离子所处的微环境不同,会使Cr(Ⅲ)离子的d-d电子跃迁谱带出现红移或蓝移[20, 22, 26-28]。随CTAB用量的增大,CrAlPO-a谱带吸收强度依次增强,并从314 nm处依次红移到359 nm;在450 nm处的谱带依次从466nm蓝移到451 nm;在664与690 nm处谱带吸收峰的相对强度与CTAB的用量呈正相关性。
从图4b可知,CrAlPO-b在350 nm和460 nm处谱带的相对强度几乎不随CTAB用量的变化而改变,相互间也没有特别明显的红移和蓝移,只是在664 nm附近Cr(Ⅲ)离子的d-d电子自旋允许跃迁产生了较强的d-d电子禁戒跃迁,且禁戒跃迁吸收谱带从690 nm红移到700 nm 左右,并且随CTAB用量的增加,禁戒跃迁呈增强趋势。这意味着SO2-4阴离子有利于形成增强Cr(Ⅲ)离子d-d电子禁戒跃迁的微观结构; Cl-有利于形成增强Cr(Ⅲ)离子d-d电子自旋允许跃迁的微观结构。
5、脱水香菇子实体中核苷酸含量的紫外可见光谱分析
单核苷酸分子为芳杂环化合物,结构中具有碱基,其中的嘌呤环和嘧啶环有碳碳、碳氮双键共轭体系,分子中的碱基嘧啶在紫外可见光谱中B吸收带的λmax=244 nm。在pH为7.0时, 5’-IMP的λmax=248nm,由于空间位阻效应引起吸收强度的改变,使吸收波长略向紫移,实际观测值为260 nm。由于每摩尔该物质在一定pH值下的紫外吸收值为常数,可以对嘌呤或嘧啶衍生物进行定量测定。
6、卟啉及其衍生物的紫外-可见光谱
卟啉的衍生物具有特征的紫外-可见吸收光谱,卟吩环特殊的11个共轭双键的高度共轭体系决定了其电子轨道的能级高低。卟吩环π→π*能级差大约位于400—700nm对应的可见光范围,从而形成其特殊的紫外-可见吸收光谱,主要包括Soret带和Q带。其中,Soret带为
单峰吸收一般在420nm左右,Q带一般在500—700nm之间,包括4个吸收峰。通常Soret带吸收峰的吸光系数约是Q带的10—20倍。其中Soret带归属于卟吩环π轨道π→π*(a2u→e*R),Q带的4个弱的吸收峰归属于卟吩环的π→π*(a1u→e*R),其特征的紫外-可见吸收光谱如图。
7、红色核桃仁种皮提取物紫外可见光谱分析
利用紫外-可见光谱对红色核桃仁种皮提取物进行了初步的分析(图1),其最大吸收波长在可见光区为560和591 nm,大于现有报道的花色苷的最大吸收区500~550 nm范围,这可能是由于提取液中花色苷与酚类物质形成复合物,使花色苷稳定性提高,在可见光区出现明显红移,提取物经过醋酸铅沉淀后,利用展开剂正丁醇∶冰醋酸∶水=80∶20∶20在硅胶G板上进行层析,获得Rf值为0.55的斑点,转移,用0.5%的盐酸乙醇溶液溶解后再进行紫外-可见光谱分析,在紫外区有2个吸收峰,波长分别为340和370 nm,在可见光区有2个吸收峰,其波长分别为552和585 nm(图2)。在300~360 nm附近有吸收峰说明色素中有酰基基团存在;其盐酸乙醇溶液加入AlCl3后,发生红移(向长波长方向移动),说明B环存在游离羟基;色素溶液在紫外光下无荧光,说明糖取代基不在5位上。
8、苏丹红Ⅱ在乙醇溶液中的紫外-可见光谱
不同浓度SDⅠ在乙醇溶液中的紫外-可见光谱见图1。由图1可见,在乙醇溶液中,SDⅠ在紫外区出现了200、228nm和308nm 3个吸收峰,紫外区特征吸收峰λmax为228nm,可见区出现了423nm和477nm两个吸收峰,可见区特征吸收峰λmax为477nm,且紫外-可见特征吸收峰的强度随SDⅠ浓度的增加而不断增强。
SDⅠ分子结构中由于偶氮键结构和邻位羟基萘酚偶氮结构的存在,使其分子易发生顺反异构(见图2)和偶氮-醌腙互变异构(见图3)。SDⅠ分子顺反异构和偶氮-醌腙互变异构现象的发生,使其分子所处的共轭平面性发生改变,因而产生了特征性紫外-可见光谱吸收峰。在SD
Ⅰ结构中,通过偶氮键而形成共轭体系的吸收峰在可见区,酚羟基、苯环、萘环结构的吸收峰在紫外区。SDⅠ属萘系邻羟基偶氮染料,在偶氮-醌腙异构体中,由于分子内氢键较强,其主要以醌腙异构体存在。因此,在乙醇溶液中,SDⅠ醌腙异构体的酚羟基产生n→σ*跃迁而形成200nm吸收峰,苯环结构和萘环结构分别在228nm和308nm处产生了紫外吸收峰。偶氮共轭体系在423nm和477nm处产生了可见吸收峰。
9、纳米铝的紫外可见吸收光谱
纳米Al粉微粒紫外-可见光吸收光谱如图4所示,放置一年后的样品(old-nanoAl)和最近制备的样品(new-nanoAl)分别在253. 00 nm和252. 00 nm处出现较强的吸收峰,这是铝纳米颗粒表面等离子体共振吸收峰,它起源于激光电磁场诱导的电子相干共振,此吸收峰的位置、形状与团簇颗粒的大小、形状、分散状态相关,由于纳米微粒具有量子尺寸效应,粒子尺寸相应增大时,相邻能级的能量差减少,相邻束缚态能量差减少,对应吸收峰中心波长增大,将会导致吸收峰的红移。从图4可知,这两种纳米铝粉的吸收峰的位置差1 nm,这表明它们的颗粒度基本相同,但后者的吸收强度比前者大,这是由于新纳米铝粉的表面活性大,被氧化的程度小的缘故。
10、p一毗咯取代四苯基外琳及其金属配合物的电子吸收光谱
p一毗咯硝基取代四苯基叶咐的吸收光谱形状与四苯基外琳的相似,只是B谱带的入max 位置略有移动,摩尔消光系数。略有变化,Q谱带的四个吸收带中的Q.和Q,的。比Q.和Q:的大1一2个数量级这是因为日一毗咯位引入强吸电子基团导致外琳分子对称性降低,而使分子轨道能级发生分裂。它的金属配合物MTPP(一NOZ)[M二Cu·Ni,Zn,C。,Fe〕在可见光区均出现两个吸收带Q,’和Q.‘,而CuTPP在可见光区只有一个吸收带。从分子轨道能级来看,俘一毗咯位引入硝基消除了最低未占据分子轨道(LUMO)e:(二‘)的简并性,使e:(二.)轨道发生能级分裂,并使LUMO和最高占据分子轨道(HOMO)的能级发生不同程度的下降,由于一NOZ对HOMO的诱导作用弱而与LUMO之间的共振作用强,因此LuMO能级下降的幅度大于HOMO的,从光谱图上观察到可见光区的一个吸收带分裂为两个,且发生一定程度的红移(见图2.3).尹一毗咯酚经基取代四苯基叶琳的吸收光谱与H:TPP的基本一致,其金属配合物的吸收光谱与四苯基外琳的相应金属配合物的相似。
各种仪器分析的基本原理及谱图表示方法!!! 紫外吸收光谱UV 分析原理:吸收紫外光能量,引起分子中电子能级的跃迁谱图的表示方法:相对吸收光能量随吸收光波长的变化提供的信息:吸收峰的位置、强度和形状,提供分子中不同电子结构的信息荧光光谱法FS 分析原理:被电磁辐射激发后,从最低单线激发态回到单线基态,发射荧光谱图的表示方法:发射的荧光能量随光波长的变化提供的信息:荧光效率和寿命,提供分子中不同电子结构的信息红外吸收光谱法IR 分析原理:吸收红外光能量,引起具有偶极矩变化的分子的振动、转动能级跃迁谱图的表示方法:相对透射光能量随透射光频率变化提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率拉曼光谱法Ram 分析原理:吸收光能后,引起具有极化率变化的分子振动,产生拉曼散射谱图的表示方法:散射光能量随拉曼位移的变化提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率核磁共振波谱法NMR 分析原理:在外磁场中,具有核磁矩的原子核,吸收射频能量,产生核自旋能级的跃迁谱图的表示方法:吸收光能量随化学位移的变化提供的信息:峰的化学位移、强度、裂分数和偶合常数,提供核的数目、所处化学环境和几何构型的信息电子顺磁共振波谱法ESR 分析原理:在外磁场中,分子中未成对电子吸收射频能量,产生电子自旋能级跃迁谱图的表示方法:吸收光能量或微分能量随磁场强度变化提供的信息:谱线位置、强度、裂分数目和超精细分裂常数,提供未成对电子密度、分子键特性及几何构型信息 质谱分析法MS 分析原理:分子在真空中被电子轰击,形成离子,通过电磁场按不同m/e 分离 谱图的表示方法:以棒图形式表示离子的相对峰度随m/e 的变化提供的信息:分子离子及碎片离子的质量数及其相对峰度,提供分子量,元素组成及结构的信息气相色谱法GC 分析原理:样品中各组分在流动相和固定相之间,由于分配系数不同而分离谱图的表示方法:柱后流出物浓度随保留值的变化提供的信息:峰的保留值与组分热力学参数有关,是定性依据;峰面积与组分含量有关反气相色谱法IGC 分析原理:探针分子保留值的变化取决于它和作为固定相的聚合物样品之间的相互作用力谱图的表示方法:探针分子比保留体积的对数值随柱温倒数的变化曲线提供的信息:探针分子保留值与温度的关系提供聚合物的热力学参数裂解气相色谱法PGC 分析原理:高分子材料在一定条件下瞬间裂解,可获得具有一定特征的碎片谱图的表示方法:柱后流出物浓度随保留值的变化提供的信息:谱图的指纹性或特征碎片峰,表征聚合物的化学结构和几何构型凝胶色谱法GPC 分析原理:样品通过凝胶柱时,按分子的流体力学体积不同进行分离,大分子先流出谱图的表示方法:柱后流出物浓度随保留值的变化提供的信息:高聚物的平均分子量及其分布热重法TG 分析原理:在控温环境中,样品重量随温度或时间变化谱图的表示方法:样品的重量分数随温度或时间的变化曲线提供的信息:曲线陡降处为样品失重区,平台区为样品的热稳定区热差分析DTA 分析原理:样品与参比物处于同一控温环境中,由于二者导热系数不同产生温差,记录温度随环境温度或时间的变化 谱图的表示方法:温差随环境温度或时间的变化曲线提供的信息:提供聚合物热转变温度及各种热效应的信息示差扫描量热分析DSC 分析原理:样品与参比物处于同一控温环境中,记录维持温差为零时,所需能量随环境温度或时间的变化 谱图的表示方法:热量或其变化率随环境温度或时间的变化曲线提供的信息:提供聚合物热转变温度及各种热效应的信息静态热―力分析TMA 分析原理:样品在恒力作用下产生的形变随温度或时间变化谱图的表示方法:样品形变值随温度或时间变化曲线提供的信息:热转变温度和力学状态
光谱分析系统定标操作指南 1.打开WY直流电源和光谱仪电源,预热15分钟,启动 PMS-50/80PLUS软件。 2.在PMS-50/80软件主界面“测试”菜单“系统设置”中的“通讯 选项”对话框里设置相应通讯端口,选择任意一种“测试模式”。 3.把负载线连接在积分球上的“1”“2”接线柱和WY电源输出端之 间(WY305电压电流调至最小位置即逆时针方向调节电压和电流旋钮发出响声) 4.安装标准灯,调节灯杆位置使灯泡处于挡光班的中心高度,以确 保标准灯发出的光线不直射光度探测器和光纤。 5.关闭积分球,在“测试”菜单中或工具栏中选择“光通量定标”, 点击“关灯校零”进行光度校零。 6.校零成功后,手动调节WY电源(也可以在软件中的WY系列功 能中输入标准灯的标定电流和参考电压(输入的电压数值比标识的参考电压高1-2伏以把线路上的压降考虑进去),使其输出电流至标准灯标定电流值并处于稳流状态,等待5分钟以上待发光稳定,进行光通量定标,并“存盘推出”。 7.在“测试”菜单中或工具栏中点击“光谱定标”,进行色温定标, 完毕后“存盘退出”。 8.在PMS-50/80软件主页界面“测试”菜单“系统设置”中的“通 讯选项”对话框里选择另一种“测试模式”。 9.在“测试”菜单中或工具栏中点击“光谱定标”进行色温定标,
完毕后“存盘退出”。 10.把标准灯当做被测光源,在“测试”菜单中或工具栏中点击”电光 源测试“开始测试,测试结束验证测试色温和光通量是否正确:(要求色温偏差在±15K以内,光通量偏差在±1%以内)符合进行11步,如不符合关灯后重新5-10步的操作。 11.把WY电源的输出调至最小,以熄灭标准灯,等标准灯冷却后, 取下放入灯盒。 12.关闭WY电源,取下负载线接至机柜后的负载接线柱,至此完成 定标,即可以正常的测试操作了。 注:早期的PMS-50(即测试时间为2-3分钟的机型不需要8、9两步的操作)!
光谱分析仪 一、概述 光谱分析仪是在平时的光通信波分复用产品中较常使用到的仪表,当WDM系统刚出现时,多用它测试信号波长和光信噪比。其主要特点是动态范围大,一般可达70dB;灵敏度好,可达-90dBm;分辨率带宽小,一般小于0.1nm;比较适合于测试光信噪比。另外测量波长范围大,一般在600~1700nm.,但是测试波长精度时却不如多波长计准确。 在光谱的测量、各参考点通路信号光功率、各参考点光信噪比、光放大器各个波长的增益系数和增益平坦度的测试都可以使用光谱分析仪。光谱分析仪现在也集成了WDM的分析软件,可以很方便地把WDM的各个波长的中心频率、功率、光信噪比等参数用菜单的方式显示出来。 二、常用参数的测试 光谱分析仪的屏幕显示测量条件、标记值、其它数据以及测量波形。屏幕各部分的名称显示如下:
图1:屏幕各部分的名称 1、光谱谱宽的测量 谱宽即光谱的带宽,使用光谱分析仪可以测量LD、发光二极管的谱宽。在光谱的谱宽测量时,要特别注意光谱分析仪系统分辨率的选择,即原理上光谱分析仪的分辨率应当小于被测信号谱宽的1/10.,一般推荐设置为至少小于被测信号谱宽的1/5。 在实际的测量中,为了能够准确测量数据,一般选择分辨率带宽为0.1nm以下。分辨率带宽RES位于SETUP菜单中的第一项,直接输入所要设定的分辨率带宽的大小即可。如下图2、3、4所示(图中只为区别光谱形状的不同),当选择的分辨率带宽不同时,从光谱分析仪观察到的光谱形状有很大的不同,并且所测量得到的谱宽大小的不同。
图2:分辨率带宽RES=0.5nm时的光谱形状 图3:分辨率带宽RES=0.1nm时的光谱形状
化合物结构鉴定紫外-可见光谱分析作业
1.说明纳米Ru、Rh、Ir 等十种纳米材料的紫外可见光谱(附图) 2.说明马尾紫、孔雀绿、多氯代酚、苏丹、peo-ppo-peo、pvp等十种有机物或聚合物的紫外可见光谱(附图) 解答如下: 1(1)、纳米ZnS的紫外-可见光谱分析 紫外吸收光谱表征: 紫外-可见吸收光谱可观察能级结构的变化,通过吸收峰位置变化可以考察能级的变化。由图5可知,硫化锌在200~340 nm波长范围内对紫外光有较强的吸收。 1(2)、NiFeAu纳米材料的紫外-可见光谱分析 紫外吸收光谱表征:
上图比较了相关纳米粒子的紫外-可见吸收光谱.图b是NiFeAu纳米粒子分散在正己烷中的紫外-可见吸收光谱可以看出NiFeAu纳米粒子在约557nm有一个较宽的吸收峰.对比用同样方法合成的NiFe图a在所测试的范围内无特征的吸收峰可以判断多功能性NiFeAu纳米粒子具有源于Au表面等离子共振吸收的光学性质.与用同样方法合成的纳米Au粒径8nm在可见光区526nm有强的吸收峰相比图c NiFeAu纳米粒子的吸收峰形明显变宽并出现红移该观察说明除了粒径大小变化的因素Fe和Ni的存在影响了Au的表面等离子共振吸收也间接证明了NiFeAu纳米复合粒子的生成.Au的特征吸收峰的峰形和强度不同原因在于纳米粒子的组成发生了变化.根据纳米颗粒光学响应模型Mie理论表面等离子共振吸收是由入射光频率和金属纳米颗粒中的自由电子的集体发生共振时产生的而表面等离子共振吸收的共振条件对纳米颗粒周围的环境十分敏感纳米粒子的组成结构尺寸形状电解质或者粒子间的相互作用力不同特征吸收峰的强度和形状都会受到影响而不一样. 1(3)、TiO 纳米材料的紫外-可见光谱分析 2 紫外吸收光谱表征:
第31卷,第4期 光谱学与光谱分析Vol 31,No 4,pp1074 1077 2011年4月 Spectro sco py and Spectr al Analysis A pril,2011 基于紫外 可见光谱分析的水质监测技术研究进展 魏康林,温志渝*,武 新,张中卫,曾甜玲 重庆大学新型微纳器件与系统国家重点学科实验室,微系统研究中心,光电技术及系统教育部重点实验室,重庆 400044 摘 要 光谱分析在水质监测领域的应用是现代环境监测技术的一个重要发展方向。文章论述了基于紫外 可见光谱分析的现代水质监测技术的原理与特点,并从在线监测和原位监测两个方面论述了该技术的主要研究现状与进展,指出了尚需突破的关键技术问题,展望了基于集成化微型光谱仪的多参数水质监测微系统及水质监测微系统网络的技术发展趋势,对我国水资源环境监测技术的发展及现代科学仪器的研发具有一定的参考价值。 关键词 水质监测;光谱分析;微型光谱仪 中图分类号:T P27 文献标识码:A DOI :10 3964/j issn 1000 0593(2011)04 1074 04 收稿日期:2010 07 22,修订日期:2010 11 07 基金项目:科技部国际科技合作项目(2007DFC00040)和国家 863计划 项目(2007AA042101)资助 作者简介:魏康林,1976年生,重庆大学微系统研究中心博士研究生 e mail:zeyu anw ei@https://www.doczj.com/doc/4912888369.html, *通讯联系人 e mail:w zy@https://www.doczj.com/doc/4912888369.html,.en 引 言 基于光谱分析的水质监测技术是现代环境监测的一个重要发展方向,与传统的化学分析、电化学分析和色谱分析等 分析方法相比,光谱分析技术更具有操作简便、消耗试剂量小、重复性好、测量精度高和检测快速的优点,非常适合对环境水样的快速在线监测。目前该技术主要有原子吸收光谱法、分子吸收光谱法以及高光谱遥感法,其中高光谱遥感法由于测量精度不高多数用于定性分析,而原子吸收光谱法精度虽高,但由于首先要把样品汽化,因而耗能较高,系统体积大,不适合广泛使用,比较而言,分子吸收光谱法是目前应用较为广泛的水质分析技术,其中紫外 可见光谱分析法可直接或间接地测定水中大多数金属离子、非金属离子和有机污染物的含量,具有灵敏、快速、准确、简单等优点,并可实现对多种水质参数的检测,在对饮用水、地表水、工业废水等水体的在线监测中具有显著的技术优势,是国内外科研机构与主要分析仪表厂商竞相研发的现代水质监测技术。本文介绍了基于紫外 可见分子吸收光谱分析的现代水质监测技术的原理、特点和主要研究现状与进展,展望了该技术在多参数水质监测方面的发展趋势,并对需要解决的关键技术作了评述。 1 原 理 紫外 可见分子吸收光谱分析是根据物质的吸收光谱来分析物质的成分、结构和浓度的方法,其基本原理是是朗伯 比尔吸收定律(图1),即在一定的吸收光程下,物质的浓度与吸光度成正比,见式(1)。 A =lg I I 0 =kbc (1) 式中:A 为吸光度;I 0为入射光强度;I 为透射光强度;k 为摩尔吸光系数,单位为L (mol cm)-1;b 为液层厚度(吸收光程),单位为cm ;c 为吸光物质的浓度,单位为mol L -1。 Fig 1 Principle of spectrum measurement 在多组分共存的情况下,如各吸光组分的浓度均比较稀,可忽略相互之间的作用,这时体系的总吸光度等于各组 分的吸光度之和如式(2)所示 A =A 1+A 2+A 3+ +A N (2)式中A 为溶液总的吸光度,A i 式第i 个组分的吸光度,依据 吸光度的加和性,可以进行多组分分析和多参数测量。不同化学物质各自不同的特征吸收光谱是对水质进行定性、定量分析的基础。通过紫外/可见光谱仪,采集环境水样在紫外区或可见光区的全波段连续光谱,可以获得待测物质的特征
光谱分析仪应用及功能特点 由于近红外光在常规中有良好的传输特性,且其仪器较简单、分析速度快、非破坏性和样品制备量小、几乎适合各类样品(液体、粘稠体、涂层、粉末和固体)分析、多组分多通道同时测定等特点,成为在线分析仪表中的一枝奇葩。近几年,随着化学计量学、光纤和计算机技术的发展,在线近红外光谱分析技术正以惊人的速度应用于包括农牧、食品、化工、石化、制药、烟草等在内的许多领域,为科研、教学以及生产过程控制提供了一个十分广阔的使用空间。光谱分析仪应用于钢铁冶金、有色金属、石油化工、机械制造、能源电力、铁路运输、航空航天、食品卫生、环境保护以及教学科研等各个领域。 直读光谱仪一般属于原子发射光谱,应用于冶金,铸造,有色,黑色金属鉴别,石化,机械制造等行业。国际上比较有名的有美国热电(收购瑞士ARL),德国斯派克,德国布鲁克,日本岛津等比较有名。 手持式光谱仪属于X射线荧光光谱仪,同样属于原子发射光谱仪,但和直读光谱的激发方式不一样,直读光谱靠高压放电激发,X射线是通过X光管来激发,接收原件也不同,检测元素范围和精度低于直读光谱,但应用于合金材料牌号鉴别以及混料筛选,废料回收,野外材料牌号鉴别有特殊用途,因可以做的小巧,一般做成手持式,方便携带。 性能特点 防返油真空技术,采用两级阀门控制。一级通过真空规管控制并与真空泵联动,为世界光谱仪领域最新技术,避免仪器抽真空带来的噪声、故障,防返油真空技术,避免油蒸汽对光学系统造成的污染,大大提高了仪器的使用寿命。 1.仪器采用的独立出射狭缝为国内首创,世界先进。金属整缝的特点是仪器调试方便、快捷,便于出射狭缝增加通道(用户可仅考虑目前应用的元素,以后需要的通道可随时增加)节约成本。 2.自动高压系统为世界先进水平。该系统可通过计算机控制每个通道提供8档高压,使同一通道可以在不同分析程序中得到应用,提高了通道的利用率和谱线最佳线性范围在分析不同材料中的采用,减少了通道的采用数量,降低了成本。 3.自动描迹为世界领先水平,同类仪器国内空白。自动描迹可大大缩短校准仪器所用的时间,使仪器校准变得简单、方便,非专业人员既可进行描迹操作。仪器设有内部恒温系统。大大减小了环境温度变化对光学系统造成的漂移。 4.WINDOWS系统下的中文操作软件,方便国内使用。不同层次的操作员可随时调用相关帮助菜单来指导对仪器的操作;分析速度快捷,20秒内测完所有通道的化学成分;针对不同的分析材料,通过制作预燃曲线来确定分析时间,使仪器用最短的时间达到最优的分析效果;预制好合理的工作曲线,用户可免购大量标样,节约使用成本,安装后即可投入使用。 5.多功能光源国内空白。多功能光源的采用可扩大元素的分析范围,满足超高含量以及痕量元素的分析;各系统独立供电,单元化设计,维修方便快捷。单元化的设计可达到非专业人员的快速维修,为互联网摇诊仪器故障做好了充分准备。
1. 简述荧光光谱法与紫外-可见光吸收光谱法的原理及两种方法的异同点。 ①荧光光谱法原理: 原子荧光光谱法(AFS)是原子光谱法中的一个重要分支,是介于原子发射(AES)和原子吸收(AAS)之间的光谱分析技术,它的基本原理就是:固态、液态样品在消化液中经过高温加热,发生氧化还原、分解等反应后样品转化为清亮液态,将含分析元素的酸性溶液在预还原剂的作用下,转化成特定价态,还原剂KBH4反应产生氢化物和氢气,在载气(氩气)的推动下氢化物和氢气被引入原子化器(石英炉)中并原子化。特定的基态原子(一般为蒸气状态)吸收合适的特定频率的辐射,其中部分受激发态原子在去激发过程中以光辐射的形式发射出特征波长的荧光,检测器测定原子发出的荧光而实现对元素测定的痕量分析方法。 ②紫外-可见光吸收光谱法的原理: 紫外-可见吸收光谱法是利用某些物质的分子吸收190-750nm的辐射来进行分析测定的方法,是基于分子内电子跃迁产生的吸收光谱。在有机化合物分子中有形成单键的σ电子、有形成双键的π电子、有未成键的孤对n电子。当分子吸收一定能量的辐射能时,这些电子就会跃迁到较高的能级,此时电子所占的轨道称为反键轨道而这种电子跃迁同内部的结构有密切的关系。在紫外吸收光谱中,电子的跃迁有σ→σ*、n→σ*、π→π*和n→π*四种类型,各种跃迁类型所需要的能量依下列次序减小:σ→σ*>n→σ*>π→π*>n→π*。 当某种物质受到光的照射时,物质分子就会与光发生碰撞,其结果是光子的能量传递到了分子上。这样,处于稳定状态的基态分子就会跃迁到不稳定的高能态,即激发态: M(基态)+hv------M*(激发态) 由于物质的能量是不连续的,即能量上一量子化的。只有当入射光的能量(hv)与物质分子的激发态和基态的能量差相等时才能发生吸收:△E=E2-E1= hv=hc/λ 而不同的物质分子因其结构的不同而具有不同的量子化能级,即△E不同,故对光的吸收也不同。这就是对光的吸收作用。 紫外-可见吸收光谱定性分析的依据:光吸收程度最大处的波长叫做最大吸
紫外光谱分析仪基础知识 紫外,可见光谱法及相关仪器 UV-VIS Spectrometry & Instrument 紫外,可见光谱法及相关仪器 一(紫外,可见吸收光谱概述 二(紫外,可见分光光度计2 1(紫外,可见分光光度计的主要部件 2(紫外,可见分光光度计的分类 3(紫外,可见分光光度计的各项指标含义 4(紫外,可见分光光度计的校正 三(紫外,可见分光光度计的应用 四(紫外,可见分光光度计的进展 一(紫外,可见吸收光谱概述 利用紫外,可见吸收光谱来进行定量分析由来已久,可追溯到古代,公元60年古希腊已经知道利用五味子浸液来估计醋中铁的含量,这一古老的方法由于最初是运用人眼来进行检测,所以又称比色法。到了16、17世纪,相关分析理论开始蓬勃发展,1852年,比尔(Beer)参考了布给尔(Bouguer)1729年和朗伯(Lambert)在1760年所发表的文章,提出了分光光度的基本定律,即液层厚度相等时,颜色的强度与呈色溶液的浓度成比例,从而奠定了分光光度法的理论基础,这就是著名的朗伯,比尔定律。 1(紫外,可见吸收光谱的形成 吸光光度法也称做分光光度法,但是分光光度法的概念有些含糊,分光光度是指仪器的功能,即仪器进行分光并用光度法测定,这类仪器包括了分光光度计与原
子吸收光谱仪(AAS)。吸光光度法的本质是光的吸收,因此称吸光光度法比较合理,当然,称分子吸光光度法是最确切的。 紫外,可见吸收光谱是物质中分子吸收200-800nm光谱区内的光而产生的。这种分子吸收光谱产生于价电子和分子轨道上的电子在电子能级跃迁(原子或分子中的电子,总是处在某一种运动状态之中。每一种状态都具有一定的能量,属于一定的能级。这些电子由于各种原因(如受光、热、电的激发)而从一个能级转到另一个能级,称为跃迁。)当这些电子吸收了外来辐射的能量就从一个能量较低的能级跃迁到一个能量较高的能级。因此,每一跃迁都对应着吸收一定的能量辐射。具有不同分子结构的各种物质,有对电磁辐射显示选择吸收的特性。吸光光度法就是基于这种物质对电磁辐射的选择性吸收的特性而建立起来的,它属于分子吸收光谱。跃迁所吸收的能量符合波尔条件: hvEE,,2121 二(紫外,可见分光光度计 1854年,杜包斯克(Duboscq)和奈斯勒(Nessler)等人将此理论应用于定量分析化学领域,并且设计了第一台比色计。到1918年,美国国家标准局制成了第一台紫外可见分光光度计。此后,紫外,可见分光光度计经不断改进,又出现自动记录、自动打印、数字显示、微机控制等各种类型的仪器,仪器的灵敏度和准确度也不断提高,其应用范围也不断扩大。 1(紫外,可见分光光度计的主要部件 全世界的紫外,可见分光光度计生产厂家有上百家,产品型号成千上万,但就基本结构来说,都是由五个部分组成,即光源、单色器(单色仪)、吸收池、检测器和信号指示系统。如下图所示: 信号指光源单色器吸收池检测器示系统光源
紫外—可见光谱分析方法在环境监测中的应用 紫外—可见光谱分析水质监测技术是现代环境监测的一个重要发展方向, 与传统的化学分析、电化学分析和色谱分析等分析方法相比, 光谱分析技术更具有操作简便、消耗试剂量小、重复性好、测量精度高和检测快速的优点, 非常适合对环境水样的快速在线监测。目前该技术主要有原子吸收光谱法、分子吸收光谱法以及高光谱遥感法, 其中高光谱遥感法由于测量精度不高多数用于定性分析, 而原子吸收光谱法精度虽高, 但由于首先要把样品汽化, 因而耗能较高, 系统体积大, 不适合广泛使用, 比较而言, 分子吸收光谱法是目前应用较为广泛的水质分析技术, 其中紫外—可见光谱分析法可直接或间接地测定水中大多数金属离子、非金属离子和有机污染物的含量, 具有灵敏、快速、准确、简单等优点, 并可实现对多种水质参数的检测, 在对饮用水、地表水、工业废水等水体的在线监测中具有显著的技术优势, 是国内外科研机构与主要分析仪表厂商竞相研发的现代水质监测技术。 1、UV-VIS分光光度计的发展情况 紫外可见分光光度计的发展从历史上看,分光光度计按其光路可分为两类。第一类是单光束仪器,这类仪器的优点是光效率高,结构简单和价格便宜,缺点是稳定性差,漂移较大。第二类是双光束仪器,这类仪器具有稳定性高、漂移小的优点,但结构复杂、价格较贵、效率较低。后来开发的一种分光束系统吸取了单光束仪器光效率高的优点,它使初始光束的小部分直接导向光强检测器,大部分经过样品,从而可使仪器信噪比高、反应快。 随着计算机技术在分析仪器领域的广泛应用,单光束、双光束UV-VIS分光光度计均得到了极大的发展。如利用计算机技术在单光束型分光光度计上可实现波长自动扫描的功能。在微机控制下,这种仪器(如国内的721型)还可实现光门开闭、调零、透过率与吸光度测定的自动化及部分校正仪器漂移的功能。在实验室常规分析、在线分析及流动注射分析中均有应用。双光束型仪器在计算机控制下,可以任意选择单光束、双光束或双、单光束模式进行扫描。如有些仪器可进行固定波长分析、全波长扫描和时间动力学测定等,在固定波长方式下,最多可同时测定12个波长,同时读取相应波长下的吸光度或透过率,并可同时乘以相应的计算因子在波长扫描方式下,可以在全波长范围内任意选择所需要的扫描波段,并可计算拾取的峰、谷、点、一至多阶导数、对数光密度、散射光校正、光谱的相加、减、相乘和净吸收值,可完成多次重复的扫描并将光谱图显示在同一屏幕上,根据需要对图形进行电子图形放大、自动标尺处理、峰形平滑处理,时间动力学测定方式适用于测定不同反应时间样品光密度或透过率的动态变化。双光束型仪器可
一、关于组合式光色电分析系统的数量清单,提供如下: 积分球/光谱分析仪可以配置电脑直接检测光源(节能灯,荧光灯,HID灯,白织灯,LED灯等)的相对光谱功率分布、色品坐标、相关色温、显色指数、色容差、峰值波长、光通量、光效、电压、电流等光色电参数组合式综合测试仪,由以下仪器组成. HSP系列组合式光谱分析系统 1、HSP-3000光谱分析仪(进口器件) 可测试参数: 相对光谱功率分布:P(λ);色品坐标:(x,y)、(u,v);相关色温:(Tc); 显色指数:Ra; Ri(I=1~14);色容差 (含国际和国内标准); 峰值波长、半宽度(光谱辐射带宽);红色比。 可自动测试光电变化曲线,适时监测电参数,光参数以及光效等。可直接保存为EXCEL文档,方便存档记录数据。 主要技术性能指标: 波长:380-780nm;波长准确度:±0.2nm; 波长重复性:±0.1nm;采样间隔:5nm; 光通量测试:根据积分球大小决定 光度线性:0.3%;光度准确度:一级(全范围); 色品坐标准确度:±0.0003(相对于稳定度优于0.0001的标 准光源和中国计量院直接传值); 色温测量范围:1500k-25000k; 色温准确度:±0.3%(相对于稳定度优于±0.1%的标 准光源和中国计量院直接传值)
显色指数测量范围:0-100.0;显色指数测量误差:±(0.3%rd+0.5); 色容差准确度:±0.5(相对于稳定度优于0.15的标准光 源和中国计量院直接量传计算值); 环境温度测量范围:―10℃∽80℃;球内温度测量范围:―10℃∽100℃; 新增功能: ㈠采用RS-232-C串口通讯或USB转RS-232-C串口通讯,无需插卡。 操作系统Windows/2000或Windows/XP。 ㈡快速负高压自动调节,不仅使测量时间更快,更大大降低了仪器的磨损。 ㈢仪器可自动校准系统误差,并增加了定时器功能,能自动进入测量。 ㈣环境温度、测光球内温度的同步监测,使测量条件更直观,资料更可靠。 ㈤光谱功率分布可选择彩色和黑白显示及打印。 ㈥测试报告中色品图与色容差图可自由转换,适合各类光源的测试㈦采用了更高精度的A/D转换,测量灵敏度和重复性更高。 2、1.5米导光纤维 主要用于HSP-3000光谱分析仪和积分球之间的光信号传输。 3、HP502标准灯专用电源 标准光源的供电电源,恒流源,带四位半数显电流表头。 ●输出范围:电压0.00 —30.00V,电流0.000 — 5.000A; ●稳压时电压稳定度:0.10 V —30.00V:≤5mV ●稳流时电流稳定度: 0.000 A —1.000 A:≤0.2mA 1.000 A —3.000 A:≤0.8mA 3.000 A —5.000 A:≤2mA 4、24V/50W通用标准光源(德国OSRAM) ●在标定的工作电流下具有稳定的可复现的色温(光谱分布)及光通量,用于HSP系列光谱分析系统的色温(光谱分布)定标及HP系列等光度计的光通量定标,量值可溯源至中国计量院。 5、2.0米积分球(特殊工艺喷涂) ●设计完全符合相应国际及国内标准的要求,内壁涂层主要材料选用分析纯硫酸钡(BaSO4),化学稳定性好,日久不易泛黄;球体材料选用冷轧钢板,不易变形;底座高度可调,能确保积分球的水平放置;多个接口可满足光源多项测试同时进行。 6、HP105电参数测量仪 在测量光源光参数的同时,监测光源的电压、电流、功率、功率因子/频率。可与HSP-3000 软件自动通讯。 ●四窗口同时显示:电压、电流、功率、功率因数/频率;
第三张紫外吸收光谱分析习题及答案
一填空 1.紫外吸收光谱研究的是分子的(电子)能级跃迁,它还包括了(振动)和 (转动)能级跃迁。 2朗伯-比尔定律适用于(平行单色光)对(均匀非散射性)溶液的测定 3 .在朗伯—比尔定律I/I o = 10-abc中, I o是入射光的强度, I是透射光的强度, a是吸光系数, b是光通过透明物的距离, 即吸收池的厚度, c是被测物的浓度, 则透射比T =_I/I o________, 百分透过率T% =_I/I o ×100%_____, 吸光度A与透射比T的关系为____-logT___。 4 .振动能级间跃迁产生的光谱叫振动光谱,又叫红外光谱。 5紫外-可见光光谱中(最大吸收峰)所对应的波长称最大吸收波长。 二选择 1不需要选择的吸光度测量条件为(D) A入射光波长 B参比溶液 C吸收光读数范围 D测定温度 2某溶液的渗透率为30%,其吸光度为(A) A-lg0.3 B-lg7.0 C3-lg30 D-lg0.7 3指出下列化合物中,哪个化合物的紫外吸收波长最大( A )。 A. CH 3CH 2 CH 3 B. CH 3 CH 2 OH C. CH 2=CHCH 2 CH=CH 2 D. CH 3 CH=CHCH=CHCH 3 4电磁辐射的微粒性表现在哪种性质上(B)。 A. 能量 B. 频率 C. 波长 D. 波数 5测量某样品,如何测量时吸收池透光面有污渍没有擦干净,对测量结果有何 影响(D)
A影响不确定 B无影响 C偏高 D偏低 三判断 1溶液的透射比越大,表示物质对光的吸收越小(正确) 2在符合朗波比尔定律的范围内,有色物质的浓度增加,最大吸收波长不变,则透光度减小(正确) 3分光光度法既可以用于单组份测定,也可以用于多组分测定。(正确) 4不同物质吸收光谱的形状以及波长都不同。(正确) 5分子内部三种运动形式能量大小比较为电子能级>振动能级>转动能级。(正确) 四名词解释 1吸光度A:物质对光的吸收程度。 2透光率T:透射光的强度与入射光强度之比称为透射比与透光率。 3生色团:凡能使化合物在紫外可见光区产生吸收的基团不论是否显现出颜色都称为发色团,主要是带双键的基团。 4长移--吸收峰向长波方向移动的现象;深色效应-吸收峰强度增强的现象。 5跃迁:当分子吸收一定能量的辐射时,就发生相应能级间的电子跃迁。 五简答 1什么是紫外可见光谱法? 答利用被测物质的分子对紫外可见光选择性吸收的特性而建立起来的方法,叫紫外可见光谱法。 2如何采用紫外分光光度发对有机物质进行定性分析。
光谱分析系统使用操作规范 1.本标准规定了光谱分析系统的操作步骤、方法和注意事项。测试前应详细阅读操作规范或用户手册,并注意仪器上的警告语。 2.本标准适用于远方 PMS-80光谱分析系统。 3.操作步骤及方法: 3.1 定标 3.1.1定标周期: a、每次更换积分球测试前需要定标。 b、对测试结果有疑义,或其他需要精确测量前应定标。 c、定期定标:每个月需定标1次。 3.1.2 定标方法: a、积分球电源线接直流电源端口,在积分球内放入标准光源,关闭积分球。手拿标准光源时须待白手套,注意保护好标准光源。 b、打开PmsLAB软件,点选“定标“>“光通量定标“,打开光通量定标界面,点击“关灯较零“校零。 c、点击”WY系统电源”按钮,选择以下设置:COM3口,多机模式,按照标准光源的参数设置标准值电压,电流先设置为标准值的80%,点选恒定电流,设置好后点设定,点亮标准光源,预热20min。 d、预热结束后,把电流设置为标准值,等待1min标准光源稳定后,准备定标。 e、在“设定与输入标准灯参数”栏内,选择“标准A光源”,输入标准光源的型号与编号,输入标准光源的“光通量标准值”和“标准A光源色温”。点击“光通量定标”,开始定标。仪器完成定标操作后,点击“开始检验”,检验定标是否正确。确认定标好之后,点击“保存定标”。光通量定标完成。 f、点选“定标“>“光谱定标“,打开光谱定标界面。 g、“光谱定标类型”选择“电光源“,”定标扫描步长“选择”5nm“,按照标准光源的参数输入”标准灯色温“和“光通量标准值“,点击”开始“,开始定标。定标完成后,点击“保存退出“。3.2 测试方法: 3.2.1 直流定标后,接好传输线,按照待测光源是直流输入还是交流输入,接好相应的电源线。放置好待测光源,准备测试。 3.2.2 打开PmsLAB软件,依次点击“设置”>“主机设置”,选择光谱仪型号为“PMS-80“,选择“精确测试”,端口号全为COM3,点选“自动通讯“和“测试灯参数”。若光源是直流输入,则选择功率计类型为WY(9bit),若光源是交流输入,则选择功率计类型为PF9811/10。 3.2.3 直流光源通过“工具”>“WY系统电源”,设置好输出参数,点击“设置“开始输出。交流光源需打开测试柜,直接调节交流变频电源的输出参数,然后按交流变频电源上的”OUTPUT”开始输出。点亮待测光源。 3.2.4 点击“测试”> “电光源测试”,打开电参数界面,确认待测光源的电参数,预热10min。 3.2.5 点击“确定“,进入光参数界面,设置灵敏度为“自动选择“,”扫描步长“为5nm,”扫描范围“为280-800,点选“测试前光校零”。点击“开始测试”,等待测试完成。 3.2.6 同型号光源批量测试时,第一个光源设置灵敏度为“自动选择“,仪器会自动分析并选择灵敏度。继续测试此批光源时,就可以选择相应的灵敏度,以加快测试速度。 3.2.7 保存并导出测试结果,将测试结果打印为PDF文档。测试结束。 制定:审核:批准:
实用文档之"紫外-可见光谱分析仪的优点:" 1.操作简单方便,不需要复杂的程序,可直接取待测样品置于比色皿中,并且能对待测液体或溶液进行直接测定,检测成本低。 2.分析速度快,一般样品可在1-2 min内完成,比较适用于现场分析或快速分析。 3.检测过程中不破坏样品,可称为无损检测,并可对改样品进行多次重复测量实验且重现性好。 4.检测范围广,根据物质分子对波长为200-760nm这一范围的电磁波的吸收特性所建立起来的一种定性、定量和结构分析方法。 5.稳定性好,抗干扰能力强,易实现在线分析及监测,适合于生产过程和恶劣环境下的样品分析。 6.电子光谱的强度较大,灵敏度高,一般可达4 10-—8 10-g/ml主要用于微量分析。 7.准确度较高,浓度测量相对误差仅有1%左右。 8.分辨率高,在定量分析上,不仅可以进行单一组分的测定,而且还可以对多种混合物同时进行测定。 9.分析结果的准确性是建立在化学分析标样的基础上,因此分析的结果真实可靠。
紫外-可见光谱分析仪的缺点: 1.紫外-可见光谱仪仅适用于微量分析,对于高浓度(一般是指浓度>0.01mol/L)物质,物质的吸光度和浓度之间的关系发生偏离,因此朗伯比尔定律不适用。 2.影响比尔定律偏离的因素较多,如非单色光,杂散光,噪声,化学因素等。且影响光学系统参数等外部或内部因素较多,误差难以很好的修正,对检测结果的准确度影响较大。 3. 不是原始方法,是一种间接测定物质浓度的方式,不能作为仲裁分析方法,检测结果不能做为国家认证依据。 4. 受各企业产品相对垄断的因素,仪器购买和维护成本都比较高,性价比较低。 5. 需要大量代表性样品进行化学分析建模,并建立相应化学体系复杂,实验过程较为复杂,工作量大,并且对于显色剂的选择难度较大,已知文献中并无相关研究。
河北工业大学科技成果——计算机显微荧光光谱图 像分析系统 项目简介 本系统为河北省自然科学基金资助研究项目,利用普通生物显微镜经过改造,可以实现计算机显微荧光光谱图像采集、处理、分析。本系统通过加装单色器、氙灯光源、石英光导纤维、低照度CCD摄像器件,使普通显微镜具有荧光显微镜功能,并且可以实现紫外、可见连续冷光激发光谱。同时,完善的计算机图像分析软件可以对显微荧光图像进行采集、处理、分析,不仅可以提供图像形态分析还可以提供图像的光谱分析。本仪器许多地方具有自主知识产权。本项目包含了4项专利技术。 市场前景 此项目属国内首创。成果可广泛应用于现代医学临床,生命科学研究及材料科学等领域。显微荧光图像连续光谱分析系统研制的成功将使获得光谱信息,图像形态信息和图像光谱分布信息这些研究内容深入到微观领域,为这一新兴研究学科提供一套可获得微观信息的手段,广泛用于医院临床、生命科学研究、卫生防疫、冶金、纺织、公安和学校教学中的显微荧光图像分析。同时是我国目前在医院、公安、材料等科研单位普遍使用的传统荧光显微镜的升级换代产品。 规模与投资 计算机显微荧光光谱图像分析系统成本价为8万元左右,按照月生产5台套规模计算流动资金为40万元,先期投入80万,主要是用
于装调生产环境与计算机等设备。 生产设备 计算机显微荧光光谱图像分析系统主要是一些外协加工配套、购买和自己组装,所以,生产设备不多,主要有:视频监视器一套;CCD 摄像头;计算机一台;装配车间一间;调试用的部分工具若干。 效益分析 目前计算机显微荧光光谱图像分析系统成本价格为8万元,市场售价为16万元,按照月产5台计算,年产量为60台毛利润为960万元。 光谱图像分析软件可根据用户要求开发专用软件。 计算机显微荧光光谱图象分析系统 合作方式技术转让
光谱分析仪的基本原理 一、原子光谱的产生原子发射光谱分析是根据原子所发射的光谱来测定物质的化学组分的。不同物质由不同元素的原子所组成,而原子都包含着一个结构紧密的原子核,核外围绕着不断运动的电子。每个电子处于一定的能级上,具有一定的能量。在正常的情况下,原子处于稳定状态,它的能量是最低的,这种状态称为基态。但当原子受到能量(如热能、电能等)的作用时,原子由于与高速运动的气态粒子和电子相互碰撞而获得了能量,使原子中外层的电 一、原子光谱的产生 原子发射光谱分析是根据原子所发射的光谱来测定物质的化学组分的。不同物质由不同元素的原子所组成,而原子都包含着一个结构紧密的原子核,核外围绕着不断运动的电子。每个电子处于一定的能级上,具有一定的能量。在正常的情况下,原子处于稳定状态,它的能量是最低的,这种状态称为基态。但当原子受到能量(如热能、电能等)的作用时,原子由于与高速运动的气态粒子和电子相互碰撞而获得了能量,使原子中外层的电子从基态跃迁到更高的能级上,处在这种状态的原子称激发态。电子从基态跃迁至激发态所需的能量称为激发电位,当外加的能量足够大时,原子中的电子脱离原子核的束缚力,使原子成为离子,这种过程称为电离。原子失去一个电子成为离子时所需要的能量称为一级电离电位。离子中的外层电子也能被激发,其所需的能量即为相应离子的激发电位。处于激发态的原子是十分不稳定的,在极短的时间内便跃迁至基态或其它较低的能级上。 当原子从较高能级跃迁到基态或其它较低的能级的过程中,将释放出多余的能量,这种能量是以一定波长的电磁波的形式辐射出去的,其辐射的能量可用下式表示:(1)E2、E1分别为高能级、低能级的能量,h为普朗克(Planck)常数;v及λ分别为所发射电磁波的频率及波长,c为光在真空中的速度。 每一条所发射的谱线的波长,取决于跃迁前后两个能级之差。由于原子的能级很多,原子在被激发后,其外层电子可有不同的跃迁,但这些跃迁应遵循一定的规则(即“光谱选律”),因此对特定元素的原子可产生一系列不同波长的特征光谱线,这些谱线按一定的顺序排列,并保持一定的强度比例。光谱分析就是从识别这些元素的特征光谱来鉴别元素的存在(定性分析),而这些光谱线的强度又与试样中该元素的含量有关,因此又可利用这些谱线的强度来测定元素的含量(定量分析)。这就是发射光谱分析的基本依据。 二、发射光谱分析的过程 1.把试样在能量的作用下蒸发、原子化(转变成气态原子),并使气态原子的外层电子激发至高能态。当从较高的能级跃迁到较低的能级时,原子将释放出多余的能量而发射出特征谱线。这一过程称为蒸发、原子化和激发,需借助于激
紫外可见光谱分析技术及其发展和应用 医学院宋宗辉2016201632 紫外-可见吸收光谱法概述 分子的紫外-可见吸收光谱法是基于分子内电子跃迁产生的吸收光谱进行分析的一种常用的光谱分析法。分子在紫外-可见区的吸收与其电子结构紧密相关。紫外光谱的研究对象大多是具有共轭双键结构的分子。紫外-可见以及近红外光谱区域的详细划分如下图所示。紫外-可见光区一般用波长(nm)表示。其研究对象大多在200-380 nm的近紫外光区和/或380-780 nm的可见光区有吸收。紫外-可见吸收测定的灵敏度取决于产生光吸收分子的摩尔吸光系数。该法仪器设备简单,应用十分广泛。如医院的常规化验中,95%的定量分析都用紫外-可见分光光度法。在化学研究中,如平衡常数的测定、求算主-客体结合常数等都离不开紫外-可见吸收光谱。 紫外可见区域 1.1分子结构与吸收光谱 1.1电子能级和跃迁 从化学键性质考虑,与有机物分子紫外-可见吸收光谱有关的电子是:形成单键的σ电子,形成双键的π电子以及未共享的或称为非键的n电子。有机物分子内各种电子的能级高低次序下图所示,σ*>π*>n>π>σ。标有*者为反键电子。
电子能级及电子跃迁示意图 可见,σ→σ*跃迁所需能量最大,λmax<170 nm,位于远紫外区或真空紫外区。一般紫外-可见分光光度计不能用来研究远紫外吸收光谱。如甲烷,λmax =125 nm。饱和有机化合物的电子跃迁在远紫外区。 1.2生色团 π→π*所需能量较少,并且随双键共轭程度增加,所需能量降低。若两个以上的双键被单键隔开,则所呈现的吸收是所有双键吸收的叠加;若双键共轭,则吸收大大增强,波长红移,λmax和εmax均增加。如单个双键,一般λmax为150-200nm,乙烯的λmax = 185nm;而共轭双键如丁二烯λmax = 217nm,己三烯λmax = 258nm。 n→π*所需能量最低,在近紫外区,有时在可见区。但π→π*跃迁几率大,是强吸收带;而n→π*跃迁几率小,是弱吸收带,一般εmax<500。许多化合物既有π电子又有n 电子,在外来辐射作用下,既有π→π*又有n→π*跃迁。如-COOR基团,π→π*跃迁λmax=165 nm,εmax=4000;而n→π*跃迁λmax=205nm,εmax=50。π→π*和n→π*跃迁都要求有机化合物分子中含有不饱和基团,以提供π轨道。含有π键的不饱和基团引入饱和化合物中,使饱和化合物的最大吸收波长移入紫外-可见区。这类能产生紫外-可见吸收的官能团,如一个或几个不饱和键,C=C,C=O,N=N,N=O等称为生色团(chromophore)。某些生色团的吸收特性见下表。 某些生色团及相应化合物的吸收特性
第九章紫外吸收光谱分析ultraviolet spectrometry,UV 第一节紫外吸收光谱分析基本原理principles of UV 一、紫外吸收光谱的产生formation of UV 1.概述 紫外吸收光谱:分子价电子能级跃迁。 波长范围:100-800 nm (1) 远紫外光区:100-200nm (2) 近紫外光区:200-400nm (3)可见光区:400-800nm 可用于结构鉴定和定量分析。 电子跃迁的同时,伴随着振动转动能级的跃迁;带状光谱。 2.物质对光的选择性吸收及吸收曲线 ?E = E2 - E1 = hν 量子化;选择性吸收 吸收曲线与最大吸收波长λ max 用不同波长的单色光照射,测吸光度 吸收曲线的讨论: ①同一种物质对不同波长光的吸光度不同。吸光度最大处对应的波长称为最大吸收波长λmax ②不同浓度的同一种物质,其吸收曲线形状相似λmax不变。而对于不同物质,它们的吸收曲线形状和λmax则不同。 ③吸收曲线可以提供物质的结构信息,并作为物质定性分析的依据之一。 ④不同浓度的同一种物质,在某一定波长下吸光度A 有差异,在λmax处吸光度A 的差异最大。此特性可作作为物质定量分析的依据。 ⑤在λmax处吸光度随浓度变化的幅度最大,所以测定最灵敏。吸收曲线是定量分析中选择入射光波长的重要依据。 3.电子跃迁与分子吸收光谱 物质分子内部三种运动形式: (1)电子相对于原子核的运动; (2)原子核在其平衡位置附近的相对振动; (3)分子本身绕其重心的转动。 分子具有三种不同能级:电子能级、振动能级和转动能级 三种能级都是量子化的,且各自具有相应的能量。 分子的内能:电子能量E e 、振动能量E v 、转动能量E r 即:E=E e+E v+E r ΔΕe>ΔΕv>ΔΕr 能级跃迁 电子能级间跃迁的同时,总伴随有振动和转动能级间的跃迁。即电子光谱中总包含有振动能级和转动能级间跃迁产生的若干谱线而呈现宽谱带。 讨论: (1)转动能级间的能量差ΔΕr:0.005~0.050eV,跃迁产生吸收光谱位于远红外区。远红外光谱或分子转动光谱; (2)振动能级的能量差ΔΕv约为:0.05~1eV,跃迁产生的吸收光谱位于红外区,红外光谱或分子振动光谱;