
2014-2015学年加美学校高一下学期期中考试
化学试题
总分:100分考试时间:90分钟
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Cu64 Zn 65
一、单项选择题(本题有10小题,每小题3分,共30分。每小题只有一个
....选项符合题意)
1.Se是人体必需微量元素,下列有关78
34Se和80
34
Se的说法正确的是
A. 78
34Se和80
34
Se 分别含有44和46个质子 B. 78
34
Se和80
34
Se互为同位素
C. 78
34Se 和80
34
Se互为同素异形体 D. 78
34
Se和80
34
Se都含有34个中子
2.元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
3.对于元素周期表中第VIIA族元素,下列说法不正确
...的是
A.可形成-l价离子B.从上到下原子半径逐渐增大
C.从上到下单质氧化性逐渐增强D.从上到下非金属性逐渐减弱
4.根据元素周期律判断,下列表述正确的是
A.酸性强弱:H3PO4>H2SO4 B.金属性:Na>Al
C.碱性强弱:NaOH<Mg(OH)2 D. 原子半径:Cl>Na
5.下列粒子半径大小的比较中正确的是()
A.r(S2-)>r(O2-)>r(F-)
B.r(Al)>r(Mg)>r(Na)
C.r(Na+)>r(O2-)>r(F-)
D.r(Na)>r(Na+)>r(Cl-)
6.今有A、B两种原子,A原子的M层比B原子的M层多1个电子,B原子的L层电子数是A原子L层电子数的一半。A和B分别为()
A.Na和Mg B.Na和C
C.Mg和Al D.C和Mg
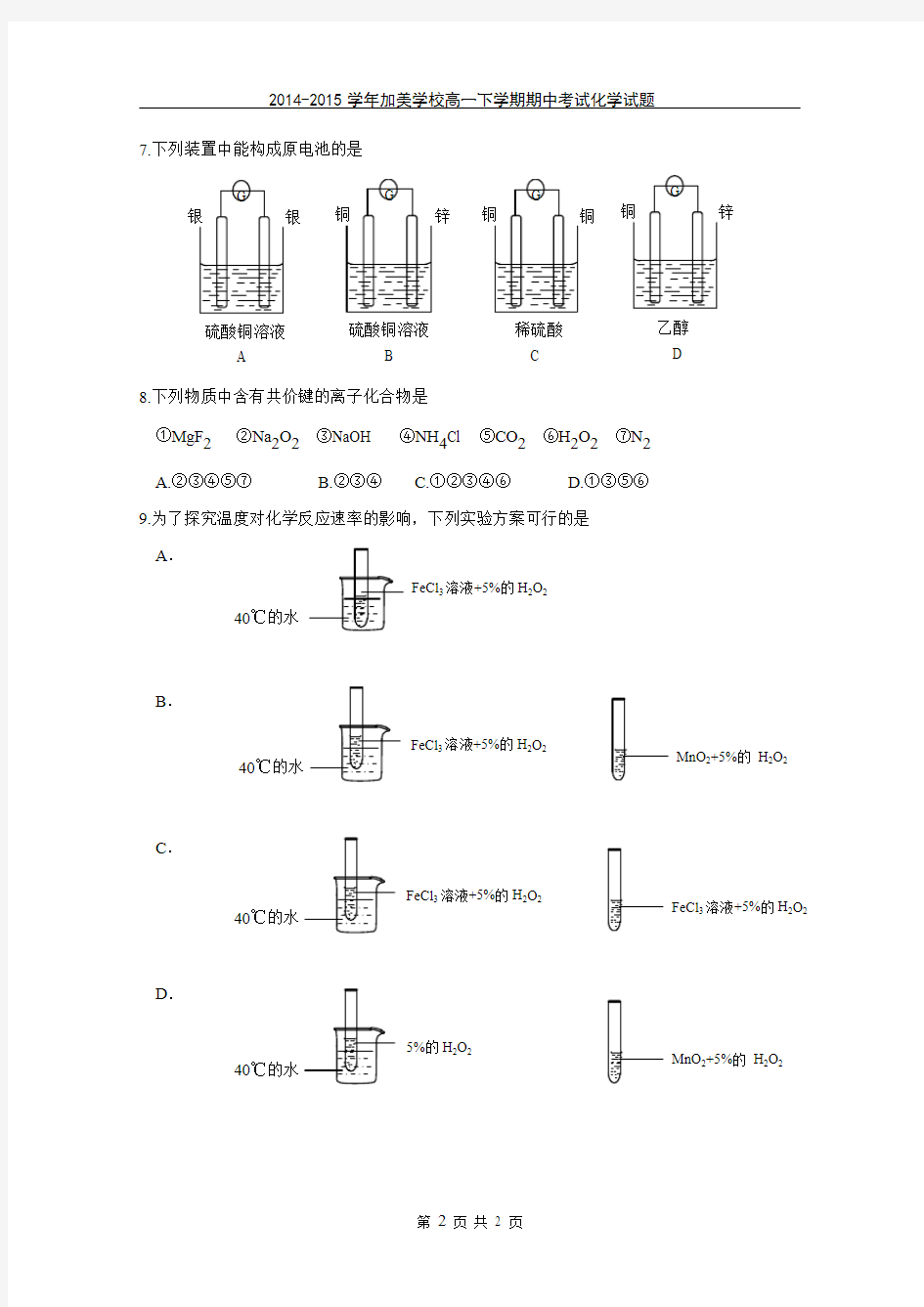
7.下列装置中能构成原电池的是
8.
下列物质中含有共价键的离子化合物是
①MgF 2 ②Na 2O 2 ③NaOH ④NH 4Cl ⑤CO 2 ⑥H 2O 2 ⑦N 2 A.②③④⑤⑦ B.②③④ C.①②③④⑥ D.①③⑤⑥ 9.为了探究温度对化学反应速率的影响,下列实验方案可行的是 A .
B .
C .
D .
40℃的水
FeCl 3溶液+5%的H 2O 2
40℃的水
FeCl 3溶液+5%的H 2O 2 FeCl 3溶液+5%的H 2O 2
40℃的水
5%的H 2O 2
MnO 2+5%的 H 2O 2
40℃的水
FeCl 3溶液+5%的H 2O 2
MnO 2+5%的 H 2O 2
G
银
银
硫酸铜溶液
A
G
铜
铜
稀硫酸 C
G
铜
锌
硫酸铜溶液
B
G 铜
锌
乙醇 D
10.某小组为研究电化学原理,设计如图装置。下列叙述不正确...的是( ) A .a 和b 不连接时,铁片上会有金属铜析出
B .a 和b 用导线连接时,铜片上发生的反应为:Cu 2+
+ 2e - = Cu
C .无论a 和b 是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D .a 和b 用导线连接时,铁片上发生的反应为: Fe - 3e - = Fe 3+
二、双项选择题(本题有5小题,每小题4分,共20分。每小题有两个选项符合题意。每小题未选、错选的给0分;全队给4分;2个答案的只选1个且正确的给2分) 11.下列有关化学用语使用正确的是
A .硫酸的电离方程式:H 2SO 4 = 2H ++SO 42-
B .纯碱的化学式:NaHCO 3
C .硫原子的原子结构示意图:
D .中子数为20的钙原子:
12.下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
元素代号 L M R T 原子半径/nm 0.160 0.143 0.102 0.074 主要化合价
+2
+3
+6、-2
-2
A .L 2+与R 2-的核外电子数相等
B .M 与T 形成的化合物具有两性
C .气态氢化物的稳定性为H 2T <H 2R
D .L 和M 金属性强弱比较:L >M
13.已知R 有多种化合价,其最高正价为+7价。在一定条件下,RO -
3与R -
可发生反应:RO -
3+5R -
+6H +
=3R 2+
3H 2O ,下列关于R 元素的叙述中,正确的是 A .元素R 位于周期表中第VA 族 B .RO -
3中的R 只能被还原 C .R -离子的最外层电子数为8
D .若1 mol RO -
3参与该反应,则转移的电子的物质的量为5mol 14.工业制硫酸中的一步重要反应是SO 2的催化氧化:2SO 2+O 22SO 3(正反应放热),下
列有关说法正确的是
A .升高温度只提高逆反应速率
B .降低温度可提高正反应速率
C .使用催化剂能显著增大反应速率
D .达到化学平衡时正、逆反应速率相等
15.已知aA n+、bB(n+1)+、cC n-、dD(n+1)- 均是具有相同电子层结构的短周期元素形成的简单离子,下列说法正确的是()。
A.原子半径C>D>A>B
B.原子序数b>a>c>d
C.离子半径D>C>A>B
D.单质的还原性A>B>C>D
第Ⅱ卷(非选择题,共50分)
三、填空题:
16..(11分)下表为元素周期表的一部分,请参照元素①~⑥在表中的位置,用化学用语
....回答下列问题。
族
IA 0 周期
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ⑦①②
3 ③④⑤⑥
(1)元素①的原子结构示意图为。
(2)元素⑦的最高价氧化物电子式为_______________;③和⑥可形成化合物,用电子式表示形成其过程。
(3)元素②、③形成离子的半径>。
(4)元素⑤、⑥形成的气态氢化物稳定性>;元素③、④形成的最高价氧化物水化物的碱性>。
(5)元素④的最高价氧化物与元素③最高价氧化物对应的水化物的溶液反应的离子方程式为:。17.(11分)(1)选择适宜的材料和试剂设计一个原电池,完成下列反应:
Zn + CuSO4 = ZnSO4 + Cu
①画出装置图:
②电极材料和电解质溶液各是什么?
③写出电极反应式:
正极:;负极:。
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气L(标准状况下)。导线中通过mol电子。
18.(7分)物质A、B、C的转化关系如图所示:
+X +X
A B C
(1)若A 为常见金属,C为淡黄色固体,则C的电子式为。
(2)若A分子含有10个电子且有刺激性气味的气体,则A的结构式为,写出A生成B的反应方程式为:。
(3)若A为黄绿色气体,则A元素在周期表中的位置。X为常见金属单质,C溶液为浅绿色,写出B与X反应的离子方程式。
四、实验题
19.(一)(4分)化学反应中均伴随着能量的变化。某同学进行如下实验,探究化学反应中的
能量变化。
(1)通过实验测出,反应前后①烧杯中的温度(填“升高”或“降低”);
②烧杯中的温度(填“升高”或“降低”)。
(2)写出Ba(OH)2·8H2O跟NH4Cl的反应的化学方程式:
。
(二)(9分)已知:浓盐酸与高锰酸钾作用能生成氯气,为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,
气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ……
(1)验证氯气的氧化性强于碘的实验现象
是。
(2)B中溶液发生反应的离子方程式是。
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象
是。
(4)过程Ⅲ实验的目的
是。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下随着核电荷数的增加,的增多,逐渐增大,逐渐减弱,得电子能力逐渐减弱。
五、计算题(共8分)
20.在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:(1)2 min末SO3的浓度;(2)2 min内SO2的平均反应速率。(3)2 min末SO2的转化率。