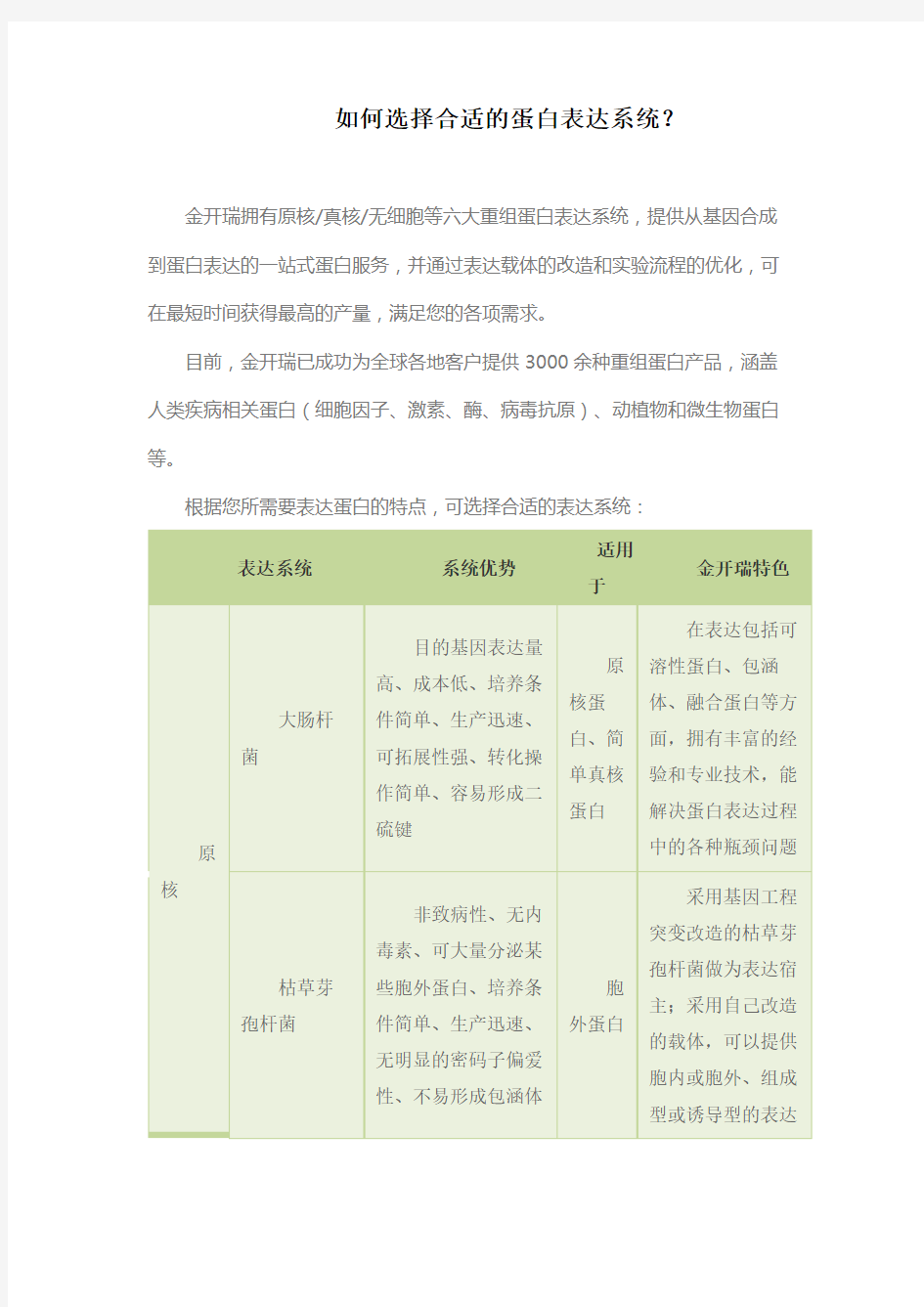
如何选择合适的蛋白表达系统?
金开瑞拥有原核/真核/无细胞等六大重组蛋白表达系统,提供从基因合成到蛋白表达的一站式蛋白服务,并通过表达载体的改造和实验流程的优化,可在最短时间获得最高的产量,满足您的各项需求。
目前,金开瑞已成功为全球各地客户提供3000余种重组蛋白产品,涵盖人类疾病相关蛋白(细胞因子、激素、酶、病毒抗原)、动植物和微生物蛋白等。
根据您所需要表达蛋白的特点,可选择合适的表达系统:
表达系统系统优势
适用
于
金开瑞特色
原核大肠杆
菌
目的基因表达量
高、成本低、培养条件
简单、生产迅速、可拓
展性强、转化操作简单、
容易形成二硫键
原
核蛋
白、简
单真
核蛋
白
在表达包括可溶性
蛋白、包涵体、融合蛋
白等方面,拥有丰富的
经验和专业技术,能解
决蛋白表达过程中的各
种瓶颈问题
枯草芽
孢杆菌
非致病性、无内毒
素、可大量分泌某些胞
外蛋白、培养条件简单、
生产迅速、无明显的密
码子偏爱性、不易形成
包涵体
胞
外蛋
白
采用基因工程突变
改造的枯草芽孢杆菌做
为表达宿主;采用自己
改造的载体,可以提供
胞内或胞外、组成型或
诱导型的表达
真核酵母细
胞
经济高效,放大培
养基廉价、培养条件简
单、生产迅速、可拓展
性强、分泌蛋白或细胞
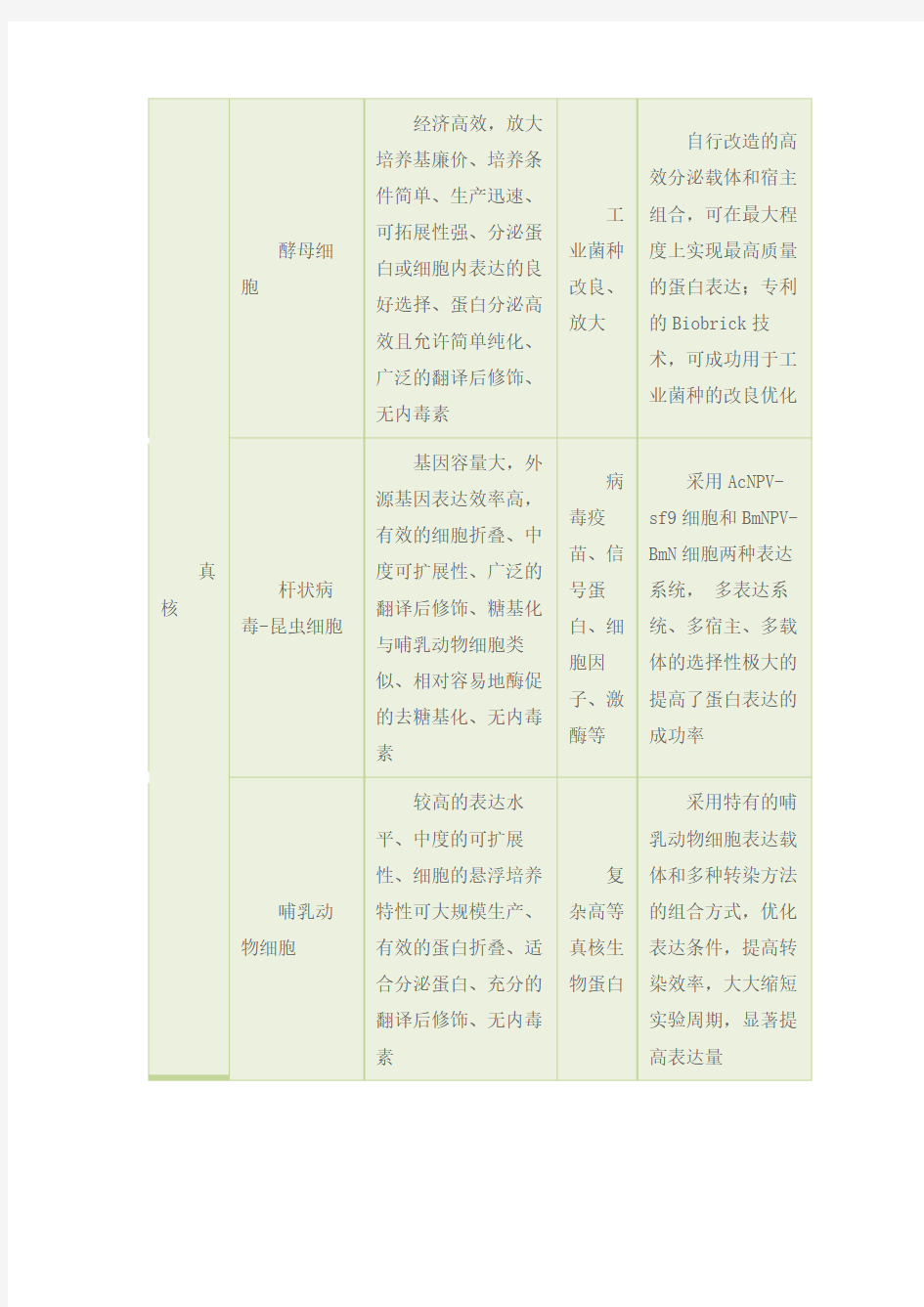
工
业菌
种改
良、放
自行改造的高效分
泌载体和宿主组合,可
在最大程度上实现最高
质量的蛋白表达;专利
内表达的良好选择、蛋白分泌高效且允许简单纯化、广泛的翻译后修饰、无内毒素大的Biobrick技术,可成
功用于工业菌种的改良
优化
杆状病毒-昆虫细胞
基因容量大,外源
基因表达效率高,有效
的细胞折叠、中度可扩
展性、广泛的翻译后修
饰、糖基化与哺乳动物
细胞类似、相对容易地
酶促的去糖基化、无内
毒素
病
毒疫
苗、信
号蛋
白、细
胞因
子、激
酶等
采用AcNPV-sf9细
胞和BmNPV-BmN细胞两
种表达系统,多表达系
统、多宿主、多载体的
选择性极大的提高了蛋
白表达的成功率
哺乳动物细胞
较高的表达水平、
中度的可扩展性、细胞
的悬浮培养特性可大规
模生产、有效的蛋白折
叠、适合分泌蛋白、充
分的翻译后修饰、无内
毒素
复
杂高
等真
核生
物蛋
白
采用特有的哺乳动
物细胞表达载体和多种
转染方法的组合方式,
优化表达条件,提高转
染效率,大大缩短实验
周期,显著提高表达量
无细胞
操作简便,需时短,
表达量高,系统开放较
灵活,轻松表达特殊蛋
白,制备蛋白复合物,
及平行合成多种不同蛋
白等
膜
蛋白、
毒蛋
白
小量表达条件摸
索,专业解决相关难题,
大大缩短实验周期,提
高表达量。
研究者们在分离到某一基因后,要对其编码蛋白质进行研究最理所当然的工作就是表达,即:有目的性地合成外源基因产物。在重组 DNA技术的发展早期,人 们认为在基因的前面有一个强启动子和一个起始密码子就足以在大肠杆菌中获 得很好的表达。随后,认识到获得有效的翻译所需的条件要复杂得多,除了要有强启动子和起始密码子外,良好的表达尚需编码目的蛋白的mRNA中含有核糖体结合位点,表达水平受密码子喜好程度的影响,也受编码序列中其他目前尚未明了的因素影响。通过改变起始密码子前端的序列,或者在不改变蛋白质序列的条件下利用密码子的简并性改变5’末端编码序列往往有助于解决问题。 通常,两个基因之间的融合表达能更快地解决这些问题。在这种方式中,目的基因被引入某个高表达蛋白序列(fusion tag)的3’末端,比如大肠杆菌的一段 序列,或者任一可在大肠杆菌中高度表达的基因,它提供良好表达所必需的信号,而表达出的融合蛋白的N末端含有由fusion tag编码的片段。fusion tag所编码的可能是整个功能蛋白或是其中的部分。比如6x His Tag、β-半乳糖苷酶融合蛋白和trpE融合蛋白、谷胱甘肽S-转移酶(GST)融合蛋白以及硫氧还蛋 白(Trx)融合蛋白等。 由于利用tag 选择融合表达是为了简化重组一是fusion tag位于目的蛋白的N端,这时tag 帮助提高目的蛋白的表达,缺点是纯化的表达产物中可能会有不完整的目的蛋白,原因是在翻译过程中意外中断的少量(C端)不完整的表达产物会一起被纯化。另一是fusion tag位于目的蛋白的C端,这可以保证只有完整的表达产物才会被纯化。当目的蛋白的功能区位于N端时,fusion tag位于C端可能减少对其功 能的影响,反之亦然。 进行融合蛋白的表达经常会遇到三个问题,它们是:表达蛋白的溶解性、稳定性和fusion tag的存在。前两个问题在融合蛋白表达系统和非融合蛋白表达系统都会遇到,而第三个问题是融合蛋白系统所独有的。 裂解融合蛋白以除去fusion tag 为了对目的蛋白进行生化及功能分析,通常要从目的蛋白上去除fusion tag部分。早期已建立了数种对融合蛋白进行位点特异性裂解的方法。化学裂解如溴化氰(Met↓)、BNPS-3-甲基吲哚(Trp↓)、羟胺(Asn↓Gly)等,不但便宜且有效,往往还可以在变性条件下进行反应。但由于裂解位点的特异性低和可能对目的蛋白产生的不必要修饰,使该法渐渐被酶解法取代。酶解的方法相对来说反应条件较温和,更重要的是,普遍用于此用途的蛋白酶都具有高度的特异性。其中有用的酶有:Xa因子、凝血酶、肠激酶、凝乳酶、胶原酶。所有这些 酶都具有较长的底物识别序列(如在凝乳酶中为7个氨基酸),从而降低了蛋白质中其他无关部位生断裂的可能性。而酶解法存在成本高(这些蛋白酶价格一般都相当昂贵),反应时间长等问题,更重要的是蛋白酶本身不可避免地会混入目的蛋白中,造成新的污染,提高纯化的复杂性。
重组蛋白表达系统的选择、表达策略和方法学研究 宁
1. 前言 在生命科学的很多研究和应用领域中,如何获得大量、均一、高纯、有活性的蛋白质都是一个关键问题。现代重组蛋白表达技术为我们提供了多种选择:传统的大肠杆菌、酵母、昆虫和哺乳动物细胞表达系统以及较新的植物和体外表达系统。每种表达系统都有很多成功的例子,但重组蛋白的个性不尽相同,没有任何一个系统和方法是普遍适用的,为目的蛋白选择一个恰当的表达系统也就成为表达工作的重中之重。 关于目的蛋白的一切信息,对表达系统的选择都是有帮助的,有几个最基本的问题一定要在表达之前回答清楚:目的蛋白的来源是原核还是真核生物?具有什么样的功能?分子量和聚合状态?是膜蛋白还是水溶蛋白?胞表达还是分泌表达?是否需要以及需要何种翻译后修饰?有没有配体、底物或产物类似物可以利用?对蛋白酶是否敏感?有多少分子及分子间二硫键?对目的蛋白的表达量、活性、表达速度和成本有怎样的要求?除了摸清目的蛋白的脾性,还要清楚各个表达系统的特点、优势和局限性,才能找到表达工作的大略方向,要获得最适合目的蛋白的表达方案,还需要在具体实验中调整优化。 表1比较了目前常用的表达系统的特点,并给出了粗略的适用围。 大肠杆菌酵母昆虫细胞哺乳动物细胞流程简单简单复杂复杂 培养基简单简单复杂复杂 成本低低中高 产率高中中低 表达量高高较高较低 蛋白折叠中较好较好好 胞外表达周质空间分泌至培养基分泌至培养基分泌至培养基 细胞增殖周期30min 90min 18H 24H 折叠常有错误折叠偶有不当折叠正确折叠正确 二硫键难以形成有有有 N-糖基化无甘露糖残基,高无唾液酸,简单复杂 O-糖基化无有有有 磷酸化无有有有 酰化无有有有 γ-羧基化无无无有 适用原核蛋白、简单 真核蛋白 真核蛋白、分泌 表达蛋白 真核蛋白、分泌 表达蛋白 复杂高等真核生 物蛋白 表1:常用表达系统比较
pET 原核表达 pET 载体中,目标基因克隆到T7 噬菌体强转录和翻译信号控制之下,并通过在宿主细胞提供T7 RNA 聚合酶来诱导表达。Novagen 的pET 系统不断扩大,提供了用于表达的新技术和选择,目前共包括36 种载体类型、15 种不同宿主菌和设计用于有效检测和纯化目标蛋白的许多其它相关产品。 优点 ·是原核蛋白表达引用最多的系统 ·在任何大肠杆菌表达系统中,基础表达水平最低 ·真正的调节表达水平的“变阻器”控制 ·提供各种不同融合标签和表达系统配置 ·可溶性蛋白生产、二硫键形成、蛋白外运和多肽生产等专用载体和宿主菌 ·许多载体以LIC 载体试剂盒提供,用于迅速定向克隆PCR 产物 ·许多宿主菌株以感受态细胞形式提供,可立即用于转化 阳性pFORCE TM 克隆系统具有高效克隆PCR 产物、阳性选择重组体和高水平表达目标蛋白等特点。 pET 系统概述 pET 系统是在大肠杆菌中克隆和表达重组蛋白的最强大系统。根据最初由Studier 等开发的T7 启动子驱动系统,Novagen 的pET 系统已用于表达成千上万种不同蛋白。 控制基础表达水平 pET 系统提供6 种载体- 宿主菌组合,能够调节基础表达水平以优化目标基因的表达。没有单一策略或条件适用于所有目标蛋白,所以进行优化选择是必要的。 宿主菌株 质粒在非表达宿主菌中构建完成后,通常转化到一个带有T7 RNA 聚合酶基因的宿主菌(λDE3 溶原菌)中表达目标蛋白。在λDE3 溶原菌中,T7 RNA 聚合酶基因由lacUV5 启动子控制。未诱导时便有一定程度转录,因此适合于表达其产物对宿主细胞生长无毒害作用的一些基因。而宿主菌带有pLysS 和pLyE 时调控会更严紧。pLys 质粒编码T7 溶菌酶,它是T7 RNA 聚合酶的天然抑制物,因此可降低其在未诱导细胞中转录目标基因的能力。pLysS 宿主菌产生低量T7 溶菌酶,而pLysE 宿主菌产生更多酶,因此是最严紧控制的λDE3 溶原菌。 有11 种不同DE3 溶原化宿主菌。使用最广泛的为BL21 及其衍生菌株,它的优点在于缺失lon 和ompT 蛋白酶。B834 菌株为甲硫氨酸营养缺陷型,因此可用35 S- 甲硫氨酸和硒代甲硫氨酸对目标蛋白进行高特异活性标记。BLR 为recA - 衍生菌株,改善了质粒单体产量,有助于稳定含有重复序列的目标质粒。两个硫氧还蛋白还原酶( trxB ) 突变菌株(AD494,BL21 trxB ) ,有利于大肠杆菌胞浆中二硫键形成。Origami TM 和OrigamiB 菌株为trxB/gor 双突变,这两个酶是主要还原途径的关键酶。Origami 和OrigamiB 宿主菌的主要优点是能形成正确折迭的含有二硫键的蛋白。新的Rosetta TM 菌株补充了四种大肠杆菌稀有密码子的tRNA ,改善了由于密码子使用频率不同而引起的一些真核蛋白低表达。其它菌株背景包括K-12 菌株HMS174 和NovaBlue ,象BLR 一样为recA - 。这些菌株可稳定表达其产物可能导致DE3 噬菌体丢失的某些目标基因。由于存在F 附加体编码
1.培养基的配制 原理步骤 LB培养基,是微生物学实验中最常用的培养基,用于培养大肠杆菌等细菌,其分为液态或是加入琼脂制成的固态培养基。加入抗生素的 LB 培养基可用于筛选以大肠杆菌为宿主的克隆。尽管该培养基的名称被广泛解释为Luria-Bertani 培养基,然而根据其发明人贝尔塔尼(Giuseppe Bertani)的说法,这个名字来源于英语的 lysogeny broth,即溶菌肉汤。 LB培养基的配制: 成分 胰蛋白胨(tryptone) 10g 酵母提取物(yeast extract) 5g 氯化钠(NaCl) 10g 固体培养基另加琼脂粉 15-20g 加双蒸水至1000mL, 用5mol/L NaOH(约)调pH至,121℃灭菌30min 配制方法 (1)称量分别称取所需量的胰化蛋白胨、酵母提取物和NaCl,置于烧杯中。 (2)溶化加入所需水量2/3的蒸馏水于烧杯中,用玻棒搅拌,使药品全部溶化。 (3)调pH 用1mol/L NaOH溶液调pH至。 (4)定容将溶液倒入量筒中,加水至所需体积。 (5)加琼脂加入所需量琼脂,加热融化,补足失水。 (6)分装、加塞、包扎。 (7)高压蒸汽灭菌100Pa灭菌20min。
2、大肠杆菌菌种活化 原理 菌种的活化就是将处于保藏状态的菌种放入合适的培养基中进行培养,逐级增大培养是为了得到纯而壮的培养物,可以理解为就是为了获得活力旺盛的、接种数量足够的培养物进行培养。菌种发酵一般情况下需要2-3代的复壮过程,因为保存时的条件往往和培养时的条件不相同,所以要活化,让菌种逐渐适应培养环境 中药标准对照品研究中心建议实验要明白菌种活化的情况就首选需要了解菌种保藏的方式和方法。目前国际和国内常用的菌种保存方法包括:定期移植法、液体石蜡法、沙土管法、真空冷冻干燥法、80℃冰箱冻结法、液氮超低温冻结法。 对于不同的保存方式活化的方式也不同: 1 定期移植法的菌种复苏较简单,直接转接即可; 2 液体石蜡法保存的菌种在复苏时,挑取少量菌体转接在适宜的新鲜培养基上,生长繁殖后,再重新转接一次; 3 沙土管法保存菌种在复苏时,在无菌条件下打开沙土管,取部分沙土粒于适宜的斜面培养基上,长出菌落后再转接一次。或取沙土粒于适宜的液体培养基中,增殖培养后再转接斜面; 4 真空冷冻干燥法保存菌种在复苏时先用70%酒精棉花擦拭安瓿上部,将安瓿管顶部烧热,用无菌棉签沾冷水,在顶部擦一圈,顶部出现裂纹,用挫刀或镊子颈部轻叩一下,敲下已开裂的安瓿管的顶端,用无菌水或培养液溶解菌块,使用无菌吸管移入新鲜培养基上,进行适温培养; 5 -80℃冰箱冻结法保存菌种复苏时,从冰箱中取出安瓿管或塑料冻存管,应立即放置38℃-40℃水浴中快速复苏并适当快速摇动。直到内部结冰全部溶解为止,约需50秒-100秒。开启安瓿管或塑料冻存管,将内容物移至适宜的培养基上进行培养 6 液氮超低温冻结法保存菌种复苏与-80℃冰箱冻结法保存菌种复苏相似,从液氮罐中取出安瓿管或塑料冻存管,应立即放置在38℃-40℃水浴中快速复苏并适当摇动。直到内部结冰全部溶解为止,一般约需50秒-100秒。开启安瓿管或塑料冻存管,将内容物移至适宜的培养基上进行培养。 步骤
如何选择合适的蛋白表达系统? 金开瑞拥有原核/真核/无细胞等六大重组蛋白表达系统,提供从基因合成到蛋白表达的一站式蛋白服务,并通过表达载体的改造和实验流程的优化,可在最短时间获得最高的产量,满足您的各项需求。 目前,金开瑞已成功为全球各地客户提供3000余种重组蛋白产品,涵盖人类疾病相关蛋白(细胞因子、激素、酶、病毒抗原)、动植物和微生物蛋白等。 根据您所需要表达蛋白的特点,可选择合适的表达系统: 表达系统系统优势 适用 于 金开瑞特色 原核大肠杆 菌 目的基因表达量 高、成本低、培养条件 简单、生产迅速、可拓 展性强、转化操作简单、 容易形成二硫键 原 核蛋 白、简 单真 核蛋 白 在表达包括可溶性 蛋白、包涵体、融合蛋 白等方面,拥有丰富的 经验和专业技术,能解 决蛋白表达过程中的各 种瓶颈问题 枯草芽 孢杆菌 非致病性、无内毒 素、可大量分泌某些胞 外蛋白、培养条件简单、 生产迅速、无明显的密 码子偏爱性、不易形成 包涵体 胞 外蛋 白 采用基因工程突变 改造的枯草芽孢杆菌做 为表达宿主;采用自己 改造的载体,可以提供 胞内或胞外、组成型或 诱导型的表达 真核酵母细 胞 经济高效,放大培 养基廉价、培养条件简 单、生产迅速、可拓展 性强、分泌蛋白或细胞 工 业菌 种改 良、放 自行改造的高效分 泌载体和宿主组合,可 在最大程度上实现最高 质量的蛋白表达;专利
内表达的良好选择、蛋白分泌高效且允许简单纯化、广泛的翻译后修饰、无内毒素大的Biobrick技术,可成 功用于工业菌种的改良 优化 杆状病毒-昆虫细胞 基因容量大,外源 基因表达效率高,有效 的细胞折叠、中度可扩 展性、广泛的翻译后修 饰、糖基化与哺乳动物 细胞类似、相对容易地 酶促的去糖基化、无内 毒素 病 毒疫 苗、信 号蛋 白、细 胞因 子、激 酶等 采用AcNPV-sf9细 胞和BmNPV-BmN细胞两 种表达系统,多表达系 统、多宿主、多载体的 选择性极大的提高了蛋 白表达的成功率 哺乳动物细胞 较高的表达水平、 中度的可扩展性、细胞 的悬浮培养特性可大规 模生产、有效的蛋白折 叠、适合分泌蛋白、充 分的翻译后修饰、无内 毒素 复 杂高 等真 核生 物蛋 白 采用特有的哺乳动 物细胞表达载体和多种 转染方法的组合方式, 优化表达条件,提高转 染效率,大大缩短实验 周期,显著提高表达量 无细胞 操作简便,需时短, 表达量高,系统开放较 灵活,轻松表达特殊蛋 白,制备蛋白复合物, 及平行合成多种不同蛋 白等 膜 蛋白、 毒蛋 白 小量表达条件摸 索,专业解决相关难题, 大大缩短实验周期,提 高表达量。
如何做原核表达 之所以首先介绍Novagen公司的产品是因为用过它的pET系列载 体,感觉很好用。Novagen的母公司是德国默克(Merck)公司,它是国际著名的化学及制药公司总部位于德国的Darmstadt,已有300多年的历史。已在全世界55个主要国家设立了分公司,其中在28个国家建有62个生产基地。Novagen公司出品的pET系列载体是目前应用最为广泛的原核表达系统,已经成功地在大肠杆菌中表达了各种各样的异源蛋白。pET系列载体是利用大肠杆菌T7噬菌体转录系统进行表达的载体,其表达原理见下图。 T7噬菌体具有一套专一性非常强的转录体系,利用这一体系中的元件为基础构建的表达系统称为T7表达系统。T7噬菌体基因编码的T7RNA聚合酶选择性的激活T7噬菌体启动子的转录。它是一种高活性的RNA聚合酶,其合成mRNA 的速度比大肠杆菌RNA聚合酶快5倍左右。并可以转录某些不能被大肠杆菌RNA聚合酶有效转录的序列。在细胞中存在T7 RNA聚合酶和T7噬菌体启动子的情形下,大肠杆菌宿主本身基因的转录竞争不过T7噬菌体转录体系,最终受T7噬菌体启动子控制的基因的转录能达到很高的水平。
T7噬菌体启动子的转录完全依赖于T7 RNA聚合酶,因此T7 RNA聚合酶的转录调控模式就决定了表达系统的调控方式。噬菌体DE3是λ噬菌体的衍生株,一段含有lacⅠ,lacUV5启动子和T7 RNA聚合酶基因的DNA片段倍插入其int基因中,用噬菌体DE3的溶源菌,如BL21(DE3)、HMS174(DE3)等作为表达载体的宿主菌,调控方式为化学信号诱导型,类似于Lac表达系统。 从开始涉及表达的时候可以根据是否要用基因本身的起始密码子进行选择,Novagen公司仅提供三个载体:pET-21(+),pET-24(+)和 pET-23(+)。如果你打算利用载体的起始密码子,那么就有许多选择。 根据是否要可溶性表达,选择加有不同标记的载体。一般说来在大肠杆菌中不加标记外源蛋白都会以不溶的包涵体形式表达。为了让外源蛋白融合表达一般说来有三个策略: 1. 与一个高度可溶的多肽联合一起表达,比如:谷胱甘肽S 转移酶 (glutathione S transferase, GST)、硫氧还蛋白
蛋白质表达的性质 关键词:大肠杆菌,细胞,试剂,标准物质,北京标准物质网 1.所需要的蛋白表达量如果只是需要少量蛋白,比如筛选一系列点突变体的酶活性,酶学检测可以在大肠杆菌粗提物中进行,采用多数通用表达质粒即可,没有必要花很大精力去优化方案来提高表达量。如果实验蛋白需要量大,就有必要尝试不同宿主载体系统和纯化方法,从中找出大批量表达蛋白的可行方案。外源蛋白水平与生理状态下的内源蛋白相仿,有助于蛋白功能或蛋白相互作用研究。 2.表达蛋白的可溶性在抗体制备时不一定要求蛋白可溶,而研究蛋白功能时可溶性蛋白是关键。利用大肠杆菌表达的融合蛋白常常形成包涵体,相对容易进行纯化,不易被降解。若需要的是可溶性蛋白,可以采用降低复性温度,降低表达水平,改变携带蛋白和尝试不同宿主菌株等方法提高蛋白溶解性。 3.表达蛋白的稳定性在大肠杆菌中表达的外源蛋白尤其是真核蛋白常常稳定性不足。将融合蛋白以包涵体形式表达,或者采用缺失已知蛋白酶的大肠杆菌菌株作为宿主,可减少不稳定蛋白质的降解。由于不同菌株内蛋白酶的水平不同,对于某一特定融合蛋白来说,尝试不同菌株有助于提高蛋白稳定性。 4.蛋白质分子量在哺乳动物细胞中,不加标签的外源蛋白和内源蛋白由于分子量相同在免疫印迹上难以区分,表达融合蛋白有助于两者的区分。一般来说小于5kD或者大于100kD的蛋白表达比较困难。蛋白越小,越容易被内源蛋白水解酶所降解,在这种情况下可以采取融合蛋白表达,在每个单体蛋白之间设计蛋白水解或者是化学断裂位点。如果蛋白较小,可以加入GST、Trx、MBP等较大的标签蛋白可能促进蛋白正确折叠:如果蛋白大于60kD则建议用6×His、HA等较小的标签。对于结构研究清楚的大蛋白可以根据实验目的表达截短蛋白(truncated protemin),如果是为抗体制备,一定要保证截取抗原性较强的部分。 5.是否需要活性蛋白如果蛋白表达的目的仅仅是获得一些制备抗体的材料,就没有必要获得活性蛋白。如果目的蛋白表达是用于功能研究,那么保持或者恢复蛋白的活性是非常重要的,纯化难易相对不重要。如果需要表达具有生物学功能的膜蛋白或分泌性蛋白,例如细胞膜表面受体或细胞外的激素和酶,则更需要利用真核细胞表达。当表达蛋白是用于结构研究,最好是以可溶性蛋白的形式。在不同大肠杆菌菌株尝试表达蛋白,减少体内蛋白异常折叠,尽可能减少体外变性从而保持正常蛋白构象。
蛋白表达技术已渗透到生命科学研究的各个领域。越来越多的基因被发现,其中多数基因功能不明,利用蛋白表达系统表达目的基因是研究基因功能及其相互作用的重要手段。常见的蛋白表达系统包括大肠杆菌/原核蛋白表达系统、酵母/真核蛋白表达系统、哺乳动物细胞蛋白表达系统、昆虫细胞蛋白表达系统、植物蛋白表达系统。 在此针对一些常见的问题进行总结,与大家共享,共同学习。 Q1:为什么蛋白表达出来了,SDS-PAGE检测时大小不符? A1:进行SDS-PAGE检测的时候蛋白的净电荷会影响迁移率。带电量高的蛋白会结合较少的SDS,因此阻碍了蛋白的泳动。富含脯氨酸的蛋白会在SDS-PAGE胶中移动得特别慢。但是如果蛋白的等电点在5-9之间,并且组成的氨基酸组分没有明显的偏好,那么目的蛋白迁移率与预期相差较远就很有可能不是由于凝胶电泳造成的。 这个时候最好利用C-端或者N-端的标签进行Western Blot,看是否由于蛋白被蛋白酶降解而导致多条目的条带或者比预期小很多的条带出现。如果蛋白酶过高可以尝试换个缺陷菌株。 Q2:如何得到可溶的蛋白? A2:如果希望得到能行使功能的蛋白,蛋白应该以可溶形式表达。避免包涵体形成的方法很多,比如:选用表达量不高的蛋白表达系统,选择有助于可溶性表达的融合蛋白表达系统等,使用基本培养基等也有助于可溶性表达。另外一个容易忽视的问题是大肠杆菌内还原性过高会导致二硫键不能正确形成,同样容易导致表达产物不溶,更换菌株有助于解决这个问题。 Q3:大肠杆菌蛋白表达实验中需要注意的事项? A3:(1)所有操作尽量在冰上操作,以避免蛋白质发生变性; (2)根据自己的需要选择不同的表达载体,并注意不同的表达载体上的融合标签和携带的抗性基因,其中有些标签是可以去除的。 (3)构建好的载体最好进行测序验证,保证读码框正确,即没有移码。 (4)长期保存的pET重组子在高浓度甘油中会导致质粒不稳定。 (5)37 ℃生长常常会使一些蛋白累积形成包涵体,而30 ℃生长则可能产生可溶的和有活性的蛋白。在某些情况下,低温(15-20℃)延长诱导时间可以使溶解性蛋白的产量达到最大。 (6)进行SDS-PAGE分析时,需优化电泳上样体积。 Q4:毕赤酵母系统具有哪些优点? A4:(1)含有特有的强有力的启动子,这是目前最强、调控机理最严格的启动子之一,用甲醇可严格地调控外源基因的表达; 2)表达水平高,既可在胞内表达,又可分泌型表达。毕赤酵母中,报道的最高表达量为破伤风毒素C为12 g/L,一般大于1 g/L。一般毕赤酵母中外源基因都带有指导分泌的信号肽序列,使表达的外源目的蛋白分泌到发酵液中,有利于分离纯化; (3)发酵工艺成熟,易放大。已经有大规模工业化高密度生产的发酵工艺,且细胞干重达100 g/L以上,表达重组蛋白时,已成功放大到10000 L; (4)培养成本低,产物易分离。毕赤酵母所用发酵培养基十分廉价,一般碳源为甘油或葡萄糖及甲醇,其余为无机盐,培养基中不含蛋白,有利于下游产品分离纯化; (5)外源蛋白基因遗传稳定。一般外源蛋白基因整合到毕赤酵母染色体上,随染色体复制而复制,不易丢失; (6)作为真核表达系统,毕赤酵母具有真核生物的亚细胞结构,具有糖基化、脂肪酰化、蛋白磷酸化等翻译后修饰加工功能。 Q5:一个理想的可诱导蛋白表达系统需要符合哪几个方面的要求?
8.大肠杆菌表达系统与蛋白表达纯化 大肠杆菌表达系统遗传背景清楚,目的基因表达水平高,培养周期短,抗污染能力强等特点, 是分子生物学研究和生物技术产业化发展进程中的重要工具。因此熟练掌握并运用大肠杆菌表达系统的基本原理和常规操作是对每一个研究生来说是非常必要的。本章节介绍了实验室常用的大肠杆菌表达系统的构成特点,归纳了利用大肠杆菌表达系统纯化重组蛋白的基本流程和详细操作步骤,并且结合笔者的操作经验,总结了初学者在操作过程中可能遇到的问题和解决策略。 8.1大肠杆菌表达系统的选择与构建 8.1.1表达载体的选择 根据启动子的不同这些载体大致可以分为热诱导启动子,如λPL,cspA 等和另外一类就是广泛使用的IPTG诱导的启动子,如lac,trc,tac,T5/lac operator,T5/lac operator等。根据表达蛋白质的类型可分为单纯表达载体和融合表达载体。融合表达是在目标蛋白的N端或C端添加特殊的序列,以提高蛋白的可溶性,促进蛋白的正确折叠,实现目的蛋白的快速亲和纯化,或者实现目标蛋白的表达定位。常用的用于亲和纯化融合标签包括Poly-Arg,Poly-His, Strep-Tag Ⅱ,S-tag,MBP等。其中His-Tag 和GST-Tag 是目前使用最多的。His Tag 大多数是连续的六个His 融合于目标蛋白的N端或C端,通过His 与金属离子:Cu2+>Fe2+>Zn2+>Ni2+ 的螯合作用而实现亲和纯化,其中Ni2+是目前使用最广泛的。His 标签具有较小的分子量,融合于目标蛋白的N端和C端不影响目标蛋白的活性,因此纯化过程中大多不需要去除。目前常使用的表达载体主要是由Novagen 提供的pET 系列和Qiagen 公司提供的pQE 系列。 除了His 标签外,还原性谷胱甘肽S-转移酶是另一种实验室常用的融合标签。它可以通过还原性谷胱甘肽琼脂糖亲和层析而快速纯化。此外,与His 相比,GST 很多时候能够促进目标蛋白的正确折叠,提高目标蛋白表达的可溶性,因此,对于那些用his 标签表达易形成包涵体的蛋白,可以尝试用GST融合表达来改进。当然,GST 具有较大的分子量(26kDa),可能对目的蛋白的活性有影响,因此很多时候切除GST是必须的。目前,GST融合表达系统主要是由GE Healthcare (原Amersham)提供。
新颖的融合蛋白表达系统 研究者们在分离到某一基因后,要对其编码蛋白质进行研究最理所当然的工作就是表达——即:有目的性地合成外源基因产物。在重组DNA技术的发展早期,人们认为在基因的前面有一个强启动子和一个起始密码子就足以在大肠杆菌中获得很好的表达。随后,认识到获得有效的翻译所需的条件要复杂得多,除了要有强启动子和起始密码子外,良好的表达尚需编码目的蛋白的mRNA中含有核糖体结合位点,表达水平受密码子喜好程度的影响,也受编码序列中其他目前尚未明了的因素影响。通过改变起始密码子前端的序列,或者在不改变蛋白质序列的条件下利用密码子的简并性改变5’末端编码序列往往有助于解决问题。 通常,两个基因之间的融合表达能更快地解决这些问题。在这种方式中,目的基因被引入某个高表达蛋白序列(fusion tag)的3’末端,比如大肠杆菌的一段序列,或者任一可在大肠杆菌中高度表达的基因,它提供良好表达所必需的信号,而表达出的融合蛋白的N末端含有由fusion tag编码的片段。fusion tag所编码的可能是整个功能蛋白或是其中的部分。比如6x His Tag、β-半乳糖苷酶融合蛋白和trpE融合蛋白、谷胱甘肽S-转移酶(GST)融合蛋白以及硫氧还蛋白(Trx)融合蛋白等。 由于利用tag的特性通常可以对融合蛋白进行亲和层析等分离提纯,更多情况下选择融合表达是为了简化重组蛋白的纯化。因此出现两种融合表达类型:一是fusion tag位于目的蛋白的N端,这时tag可以提供良好表达所必需的信号,帮助提高目的蛋白的表达,缺点是纯化的表达产物中可能会有不完整的目的蛋白,原因是在翻译过程中意外中断的少量(C端)不完整的表达产物会一起被纯化。另一是fusion tag位于目的蛋白的C端,这可以保证只有完整的表达产物才会被纯化。当目的蛋白的功能区位于N端时,fusion tag位于C端可能减少对其功能的影响,反之亦然。 进行融合蛋白的表达经常会遇到三个问题,它们是:表达蛋白的溶解性、稳定性和fusion tag的存在。前两个问题在融合蛋白表达系统和非融合蛋白表达系统都会遇到,而第三个问题是融合蛋白系统所独有的。 裂解融合蛋白以除去fusion tag 为了对目的蛋白进行生化及功能分析,通常要从目的蛋白上去除fusion tag部分。早期已建立了数种对融合蛋白进行位点特异性裂解的方法。化学裂解如溴化氰(Met↓)、BNPS-3-甲
常见蛋白质标签总结 2008-12-08 22:06 Protein tags are peptide sequences genetically grafted onto a recombinant protein. Often these tags are rem ovable by chemical agents or by enzym atic m eans, such as proteolysis or intein splicing. Tags are attached to proteins for various purposes. 一、氨基酸标签(含小肽标签) A stretch of amino acids is added to the protein and enables the recovery of the labelled protein by its unique affinity. Usually its easiest to add the tag to either end of the protein to ensure its accessibility and not to disturb the protein folding. 组氨酸标签(His tag)一般为6个组氨酸,用Ni2+ (Cu2+)亲和层析纯化 FLAG tag :N-DY KDDDDK-C ,recovered with specific antibody HA tag:an epitope derived from the Influenza prot ein haemagglutinin (HA,禽流感病毒血凝素),e.g. N-YPYDVP-C,recovery with an HA antibody MYC tag:an epitope derived from the human proto-oncoprotein MYC,e.g. N-ILKKATAYIL-C, N-EQKLISEEDL-C,recovery with an MYC antibody SBP tag:Streptavidin Binding Peptide,链霉亲合素结合肽,38 amino acid tag (MDEKTTGWRGGHVVEGLAGELEQLRARLEHHPQGQREP),更多参考在Sigma CBP tag:钙调蛋白结合肽(CBP; 26aa)钙调蛋白结合肽与钙调素结合是Ca2+依赖的,这种结合不受标签所处的位置影响(N端和C端均可),在中性pH条件下使用2mM EGTA可以很方便的将目标蛋白洗脱下来。这一系统有如下优点:1 特异性很高,因为大肠杆菌没有可以和钙调素结合的蛋白;2 与His标签相比可以在强还原性条件下纯化。 纤维素结合肽(CBD):能与纤维素介质特异性的结合,可以在温和的条件下洗脱(乙二醇或低盐条件),pET CBD 载体含有纤维素结合肽(CBD)的序列,可方便构建。 二、蛋白质标签 Rather than adding only a few am ino acids a whole protein is fused to the protein to be purified or detected. The affinity of the attached protein enables the recovery of the artificial fusion protein. As for the peptides, the protein tag is added to either end of the target protein. GST tag:the sm all glutathione-S-transferase (GST; 26 kDa),recovery by affinity to substrate glutathione bound to a colum n, e.g. glutathione sepharose MBP tag:麦芽糖结合蛋白(MBP; 40kDa)载体:pMAL IMPACT:Intein-Mediated Purification with an affinity Chitin-binding Tag(几丁质结合肽) 硫氧还蛋白:Thioredoxins are proteins that act as antioxidants by facilitating the reduction of other proteins by cysteine thiol-disulfide exchange. Protein A:a 40-60 kDa MSCRAMM surface protein originally found in the cell wall of the bacteria Staphylococcus aureus. It has found use in biochemical research because of its ability to bind immunoglobulins. It binds proteins from many of
蛋白不表达:常见原因及分析 根据自己体会和蛋白版的既往精华帖子,总结了没有发现蛋白质表达的原因,或者蛋白质不表达的原因,欢迎大家拍砖。 1.载体构建错误。这个屡见不鲜,很多克隆新人经常弄错读码框。比如Qiagen的pQE系列载体,其克隆位点常有一两个碱基的区别;另外有些酶产生粘端有些酶产生平端,这些都容易导致读码框错误,从而表达不出来。 2.宿主菌选择不当。不同的宿主菌其基因型是不一样的。有些经过特殊修饰的载体,或者特殊用途的载体,或者有特殊启动子的载体,必须选择合适的宿主菌进行表达。因此,当你的蛋白没有表达出来时,可以考虑更换宿主菌。见下图 3.密码子的使用频率低。有些基因其本身含有许多稀有密码子,尤
其是起始密码之后的15个碱基之内的稀有密码子,对蛋白表达有着很重要的影响。优化密码子对原核表达似乎效果很好,对真核表达系统未见得有很好的效果。曾经有某人在毕赤酵母表达某蛋白两年未果,试图将密码子优化进行表达,结果还是没有表达。一气之下将该优化的基因序列克隆到原核表达载体,表达量居然出奇地高!这是一个辛酸的笑话,但是一个真实的故事。但是有一点我可以有很大把握的说:对于真核表达,密码子优化只能起锦上添花的作用(确认有表达,以此来提高表达量),而不能雪中送炭(没有表达出来,通过密码子优化极有可能不奏效)。 4、质粒不稳定或者质粒丢失。pET系统通常比较稳定。但是你选用带氨苄青霉素抗性的载体时,也许有可能产生β-lactamase降解了抗生素,使质粒丢失。还有一种情况是表达重组的毒素蛋白,对宿主细胞也有毒性,造成质粒丢失。这种情况多见于真核表达系统。 5、蛋白酶将蛋白降解了。这种情况常由重组蛋白本身的N-或C- 端序列引起的。当蛋白N-端是Arg, Leu, Lys, Phe, Trp,或Tyr 这些氨基酸时,容易遭受蛋白酶降解,此即N-末端规则。N-端是Met时,大肠杆菌可以悄悄地把这个Met偷走,特别是Met后紧跟着一个带小侧链的氨基酸时。C-末端存在非极性氨基酸时,也容易导致蛋白被降解。C末端最后5个氨基酸是极性的或者带电荷的,则不易被降解。
如何选择无细胞蛋白表达系统 【字体:大中小】https://www.doczj.com/doc/3918905329.html, 时间:2009年2月11日0 来源:Promega ------------------------------------------------------------------------------------------------------------------------------------ 摘要:与基于细胞的蛋白表达系统相比较,无细胞蛋白表达系统具有独特的优势,包括节约时间、提高具有功能的、可溶的、全长蛋白的总体产量。至于如何选择无细胞蛋白表达系统,让Promega的专家一一道来。 GARY KOBS, PROMEGA 公司 在此,我们介绍了根据模板类型、期望产率以及下游实验等因素来选择无细胞蛋白表达系统的标准。 介绍 与基于细胞的蛋白表达系统相比较,无细胞蛋白表达系统具有独特的优势,包括节约时间(图1)、提高具有功能的、可溶的、全长蛋白的总体产量。此外,无细胞蛋白表达系统更适用于激酶等毒性蛋白的表达、也可使用经过修饰的tRNA来进行标记,在某特定位点掺入非天然的氨基酸。同时,这些系统还可以用于高通量实验(1)。我们提供完备的无细胞蛋白表达系统,为研究者提供了多种选择,可用于进行蛋白的特征描述,包括免疫沉淀、Pull-down实验和酶学检测。
图1. 与细胞内蛋白表达相比,无细胞蛋白表达系统能够显著地节约时间。 选择一个无细胞蛋白表达系统,最主要的几点考虑因素包括细胞提取物或裂解物的来源、模板以及期望的蛋白产量。本文介绍的信息可帮助研究者选择适合其实验体系和下游应用的无细胞蛋白表达系统。 考虑因素—模板 在使用插入片断或载体进行真核细胞系统蛋白表达时,有以下几个因素需要考虑:(i)ATG起始密码子应该是位于转录起始位点下游的第一个ATG密码子;(ii)理想化而言,在启动子之后,ATG应该包含在Kozak共有序列之内;(iii)在模板序列的3'端应包含终止密码子;(iv)终止密码子之后应带有合成的多聚A尾(2)。此外,使用TNT? T7麦胚偶联系统(TNT? T7 Coupled Wheat Germ System)时,载体还应包含一个T7终止子序列或该载体呈线性化。 在原核系统中,起始密码子的选择几乎无一例外地依赖于核糖体结合位点(ribosomal binding site, RBS)的存在,这个位点包含了阅读框架的起始信号(2)。经过优化的核糖体结合位点能够大大提高原核细胞内蛋白的表达。原核系统不识别位于ATG起始密码子上游的任何ATG,除非这些ATG含有一个处于合适位置的核糖体结合位点。
IPTG诱导蛋白表达的原理 IPTG诱导的产物是重组后表达载体中的插入序列所能够翻译的蛋白,并可视载体构建情况翻译后续的标签序列。 用乳糖操纵子作为启动子进行蛋白质表达的时候,需要诱导物进行诱导(相当于点火),但乳糖可以被细胞利用掉,所以利用IPTG(异丙基-β-D-硫代半乳糖苷)在结构上与乳糖的相似性也可以将基因表达启动,但它不能被细胞利用掉,从而实现持续的表达. IPTG是一种诱导外源基因表达的诱导剂,它不仅仅如我们学过的作为乳糖的类似物诱导大肠杆菌表达半乳糖苷酶,它是一种普遍应用的诱导剂,能诱导菌种表达多种外源基因。 但是它能诱导基因表达的具体原理我却了解的不是很多,我在网上查到以下一些内容,供查阅者借鉴。 最早应用于的表达系统是Lac乳糖操纵子,乳糖的类似物IPTG可以和lacI产物结合,使其构象改变离开lacO,从而激活转录. 这种可诱导的转录调控成为了大肠杆菌表达系统载体构建的常用元件。tac启动子是 trp启动子和lacUV5的拼接杂合启动子,且转录水平更高,比lacUV5更优越。trc启动子是trp启动子和lac启动子的拼合启动子,同样具有比trp更高的转录效率和受lacI 阻遏蛋白调控的强启动子特性。在常规的大肠杆菌中,lacI 阻遏蛋白表达量不高,仅能满足细胞自身的lac操纵子,无法应付多拷贝的质粒的需求,导致非诱导条件下较高的本底表达,为了让表达系统严谨调控产物表达,能过量表达lacI阻遏蛋白的 lacIq
突变菌株常被选为Lac/Tac/trc表达系统的表达菌株。现在的Lac/Tac/trc载体上通常还带有lacIq 基因,以表达更多 lacI阻遏蛋白实现严谨的诱导调控。IPTG 广泛用于诱导表达系统,但是IPTG 有一定毒性,有人认为在制备医疗目的的重组蛋白并不合适,因而也有用乳糖代替IPTG作为诱导物的研究。另外一种研究方向是用lacI的温度敏感突变体,30度下抑制转录,42度开发。热诱导不用添加外来的诱导物,成本低,但是由于发酵过程中加热升温比较慢而影响诱导效果,而且热诱导本身会导致大肠杆菌的热休克蛋白激活,一些蛋白酶会影响产物稳定. T7启动子是当今大肠杆菌表达系统的主流,这个功能强大兼专一性高的启动子经过巧妙的设计而成为原核表达的首选,尤其以Novagen公司的pET系统为杰出代表。强大的T7启动子完全专一受控于T7 RNA 聚合酶,而高活性的T7 RNA 聚合酶合成 mRNA 的速度比大肠杆菌RNA聚合酶快5倍——当二者同时存在时,宿主本身基因的转录竞争不过T7表达系统,几乎所有的细胞资源都用于表达目的蛋白;诱导表达后仅几个小时目的蛋白通常可以占到细胞总蛋白的50%以上。由于大肠杆菌本身不含T7 RNA 聚合酶,需要将外源的T7 RNA 聚合酶引入宿主菌,因而T7 RNA 聚合酶的调控模式就决定了T7系统的调控模式——非诱导条件下,可以使目的基因完全处于沉默状态而不转录,从而避免目的基因毒性对宿主细胞以及质粒稳定性的影响;通过控制诱导条件控制T7 RNA 聚合酶的量,就可以控制产物表达量,某些情况下可以提高产物的可溶性部分。