
生物化学学号: 淀粉酶酶学性质的研究 学生姓名:#### 指导教师:##### 所在院系:生命科学学院 所学专业:####### 学号:##### #### 大学 中国·哈尔滨 2011 年12 月
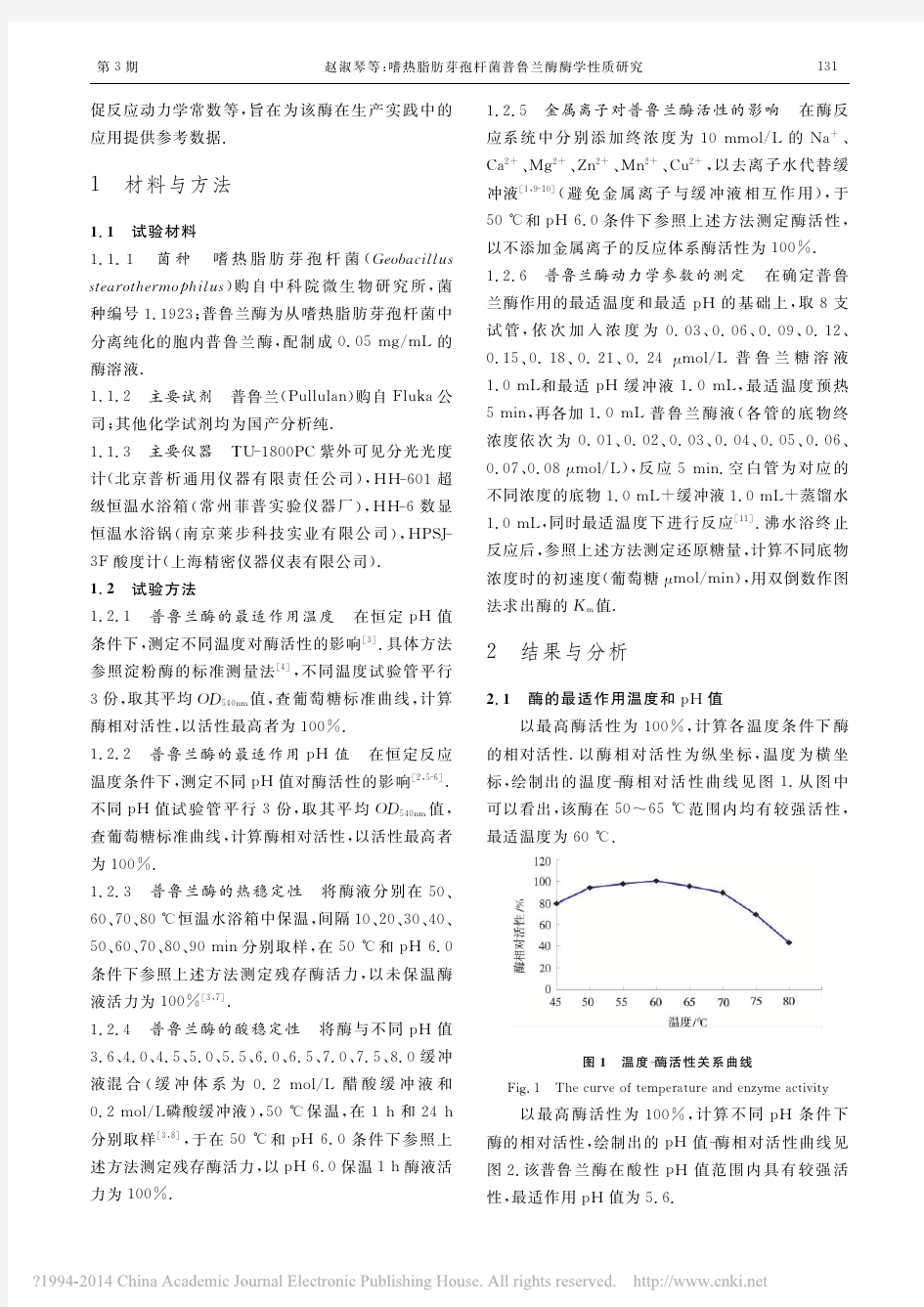
摘要: 酶是酶是一种生物催化剂,它具有催化剂属性,同是也具有一些无机催化剂所不具有的特性。催化特定化学反应的蛋白质、RNA或其复合体。是生物催化剂,能通过降低反应的活化能加快反应速度,但不改变反应的平衡点。本实验通过利用淀粉酶水解还原糖,还原糖能使3,5-二硝基水杨酸还原,生成棕色的3-氨基-5硝基水杨酸。淀粉酶活力与还原糖的量成正比,用比色法测定淀粉酶作用于淀粉后生成的还原糖的量,以单位质量样品在一定时间内生成还原糖的量表示酶活力。酶的活性又同时受到温度、PH、激活剂抑制剂等的影响。 关键词: 淀粉酶活力温度 PH 激活剂和抑制剂 前言: 淀粉酶是水解淀粉和糖原的酶类总称,通常通过淀粉酶催化水解织物上的淀粉浆料,由于淀粉酶的高效性及专一性,酶退浆的退浆率高,退浆快,污染少,产品比酸法、碱法更柔软,且不损伤纤维。淀粉酶的种类很多,根据织物不同,设备组合不同,工艺流程也不同,目前所用的退浆方法有浸渍法、堆置法、卷染法、连续洗等,由于淀粉酶退浆机械作用小,水的用量少,可以在低温条件下达到退浆效果,具有鲜明的环保特色。 此酶以Ca2+为必需因子并作为稳定因子和激活因子,也有部分淀粉酶为非Ca2+依赖型。淀粉酶既作用于直链淀粉,亦作用于支链淀粉,无差别地随机切断糖链内部的α-1,4-链。因此,其特征是引起底物溶液粘度的急剧下降和碘反应的消失,最终产物在分解直链淀粉时以葡萄糖为主,此外,还有少量麦芽三糖及麦芽糖,其中真菌a-淀粉酶水解淀粉的终产物主要以麦芽糖为主且不含大分子极限糊精,在烘焙业和麦芽糖制造业具有广泛的应用。另一方面在分解支链淀粉时,除麦芽糖、葡萄糖、麦芽三糖外,还生成分支部分具有α-1,6-键的α-极限糊精(又称α-糊精)。一般分解限度以葡萄糖为准是35-50%,但在细菌的淀粉酶中,亦有呈现高达70%分解限度的(最终游离出葡萄糖)。 通过研究淀粉酶的性质,能使我们更好的了解它,并充分利用于工业生产、食品加工、医疗等产业。
3结 论 植物乳杆菌素L-1经硫酸铵沉淀,透析除盐后效价达1280AU/ml,作用方式为杀菌。在7、15、30、37℃下,添加植物乳杆菌素L-1对单增李斯特菌都有一定的抑制作用。7℃下该细菌素在144h内控制住初始菌数,温度较高的情况下则可以在短时间内迅速降低活菌数。在选用的六种pH下,pH7.0时植物乳杆菌素L-1的抑菌效果最好。不论在培养基中还是pH7.0,5mmol/L的磷酸缓冲液中,盐对该细菌素具有一定的拮抗作用,各盐分之间和同种盐不同浓度之间差异不显著。有关吸附作用的研究发现:低pH(5.0~5.5)下,植物乳杆菌素L-1不能吸附在单核细胞增生李斯特氏菌上,而pH6.0~7.5下有50%吸附在指示菌上。盐对该细菌素吸附单核细胞增生李斯特氏菌没有显著影响。 参考文献: [1] 吕燕妮, 李平兰, 江志杰. 乳酸菌31-1菌株产细菌素的初步研究[J]. 中国食品学报, 2003, 增刊: 130-133. [2]郁庆福, 蔡宏道, 何晓青, 等. 现代卫生微生物学[M]. 北京: 人民卫生出版社, 1995. 116-117. [3] Sophie M P, Emilia F, Richard J. Purification, Partial characterizationand mode of action of enterococcin EFS2, an antilisterial bacteriocinproduced by a strain of Enterococcus faecalis isolation from a cheese[J].International Journal of Food Microbiology, 1996, 30: 255-270. [4] Atrih A, Rekhif N, Moir A J G, et al. Detection and characterization of abacteriocin produced by Lactobacillus plantarum C19[J]. CanadanJournal of Microbiology, 1993, 39: 1173-1179. [5] Atrih A, Rekhif N, Moir A J G, et al. Mode of action,purification andamino acid sequence of plantaricin C19, an anti-Listera bacteriocin pro-duced by Lactobacillus plantarum C19[J]. International Journal of FoodMicrobiology, 2001, 68: 93-104. [6] Rongguang Y, Monty C J, Bibek R. Novel method to extract largeamounts of bacteriocins from lactic acid bacteria[J]. Applied and Envi-ronment Microbiology, 1992, 58: 3355-3359. [7]还连栋, 贾士芳, 庄增辉, 等. 乳链菌肽(NISIN)的杀菌作用机制[J].中国食品添加剂, 1997, (4): 20-23. [8] S Todorov, B Onno, O Sorokine, et al. Detection and characterization ofa novel antibacterial substance produced by Lactobacillus plantarumST 31 isolated from sourdough[J]. Int J Food Microbiol, 1999, 48: 167-177. 收稿日期:2005-01-21 作者简介:毕金峰(1970-),男,副教授,博士后,主要从事食品化学与生物技术研究。 耐高温α-淀粉酶的酶学性质研究 毕金峰1,董福奎2 (1.中国农业科学院农产品加工研究所 农业部农业核技术与农产品加工重点实验室,北京 100094; 2.内蒙古呼和浩特市赛罕区蔬菜技术推广站,内蒙古 呼和浩特 010020) 摘 要:耐高温α-淀粉酶是淀粉生产麦芽糖的关键酶。本文对两种耐高温α-淀粉酶的酶学性质进行了对比研究。结果表明:两种酶的耐高温能力差别较大,酶活差别明显;最适pH值均为7.0,耐酸性较差;当Ca2+浓度在7~9mmol/L时,酶活提高明显。关键词:耐高温α-淀粉酶;性质 Studies on Enzyme Properties of Heat-resisting α-amylase BI Jin-feng1,DONG Fu-kui2 (1.Institute of Agro-Food Science and Technology, Chinese Academy of Agricultural Sciences, Key Laboratory of Agricultural Nuclear Technology and Agro-Food Processing, MOA, Beijing 100094, China;2.Vegetable Technology Popularize Station of Saihan District in Huhehaote City, Huhehaote 010020, China) Abstract :Heat-resisting α-amylase is a critical enzyme for producing maltose. Enzyme properties of two species of heat-resistingα-amylases were studied. The results were as follows: the heat-resisting ability for two species of enzymes was different,and there was an evident difference in enzyme activity. The optimum pH was 7.0, and the acid-resisting ability was poor. The
1.6 酶学性质研究 (1)pH 的影响:分别测定粗酶液在pH3.0、4.0、5.0、6.0、7.0、8.0下的酶活力,确定其最适反应pH 值;将粗酶液用上述pH 缓冲液稀释后,45℃水浴保温4小时后,测定其剩余酶活力。 (2)温度的影响:分别在40~95℃下测定酶活力,确定其最适反应温度;将酶液在40~90℃范围内的不同温度下保温60 min 后,测定其剩余酶活力。 (3)金属离子的影响:在酶液中分别添加各种金属离子,使其浓度为4 mmol /L ,然后测定酶活力。 2.5 纤维素酶粗酶液酶学性质 2.5.1酶反应的最适pH 值和酶的pH 稳定性 粗酶液在不同pH 值下测得的酶活及在不同pH 值下处理4小时后测得的相对酶活示于图11。结果表明,CMCase 在pH 3.5~4.5有较高的酶活力,最适反应pH 值为4.0;β-Gluase 在pH 4.5~5.5酶活力较高,最适反应pH 值为5.0,同样方法测得FPA 最适反应pH 为5.0。可见,该菌株所产的各组分纤维素酶是酸性酶。 图11表明,该菌产CMCase 在pH3.0~6.0的范围内,β-Gluase 在pH3.5~5.5的范围内,酶活力均可保持在80%以上,说明该菌株所产酸性纤维素酶可在较宽的pH 值范围内保持其酶活力的稳定性。2.5.2 酶反应的最适温度和酶的热稳定性 在不同温度下直接进行酶促反应测得的酶活及在不同温度下热处理60 min 后于最适反应温度和最适pH 下测得的相对酶活(以4℃保存的酶液活力为100%)示于图12。结果表明,CMCase 、β-Gluase 及FPA 最适反应温度均为65℃。 c e l l u l a s e a c t i v i t y ( U .m l -1) pH r e l a t i v e y a c t i v i t y (%) c e l l u l a s e a c t i v i t y ( U .m l -1) temperature ( o C ) r e l a t i v e y a c t i v i t y (%) 图11 pH 值对酶活力及酶稳定性的影响 Fig.10 Effects of pH value on Cellulase activity and stability 图12 温度对酶活力及酶稳定性的影响 Fig.11 Effects of temperature on activity and stability of cellulase
实验四酶学性质研究 一、实验目的 1、了解pH、温度、金属离子对酶的活性的影响机理; 2、掌握如何选择酶催化反应的最适pH、温度和获得最适pH条件的确定、以及Km常数的测定。 二、实验原理 酶促反应速度受介质pH的影响,一种酶在几种pH介质中测其活力,可看到在某一pH时酶促效率最高,这个pH称为该酶的最适pH。pH影响酶分子的活性部位的解离,另外,也影响底物的解离状态,从而影响酶活性中心的结合与底物或催化。其次,有关基团解离状态的改变影响酶的空间构象,甚至会使酶变性。酶的最适pH不是酶的特征性常数,如缓冲液的种类与浓度,底物浓度等均可改变酶作用的最适pH。 在一定温度范围内,酶促反应速率随温度的升高而加快;但当温度高到一定限度时,酶促反应速率不仅不再加快反而随着温度的升高而下降,最终,酶因高温变性失去活性,失去了催化能力。在一定条件下,每一种酶在某一温度时活力最大,这个温度称为这种酶的最适温度 在进行酶学研究时一般都要制作一条pH与酶活性的关系曲线,即保持其他条件恒定,在不同pH条件下测定酶促反应速度,以pH值为横坐标,反应速度为纵坐标作图。由此曲线,不仅可以了解反应速度随pH值变化的情况,而且可以求得酶的最适pH。最适温度的实验方法和pH类似。 酶促动力学研究酶促反应的速度及影响速度的各种因素,而米氏常数K m值等于酶促反应速度为最大速度一般时所对应的底物浓度,其值大小与酶的浓度无关,是酶促反应的特征常数。不同酶的K m值不同,同一种酶与不同的底物反应
时,其Km值也不同,Km值反映了酶和底物亲和力的强弱程度,Km值越大,表明酶和底物的亲和力越弱;Km值越小,表明酶与底物的亲和力越强。 酶的活力就是酶所催活的反应速度,通常用单位时间内底物的减少或产物的增加来表示。酶反应过程中产物的生成和时间的关系可以用进程曲线来说明,曲线的斜率就是酶反应过程中的反应速度。从进程曲线来看,在一定时间内反应速度维持恒定,但随着时间的延长,反应速度逐渐降低,这是由多种因素造成的。所以,为了准确表示酶的反应速度必须采用初速度,即保持恒定时的速度。同样,不同酶浓度下的反应进程曲线也可以说明这个问题。V=Vmax[S]/Km+[S],Vmax 指该酶促反应的最大速度,[S]为底物浓度,Km是米氏常数,V是在某一底物浓度时相应的反应速度。双倒数作图(将米氏方程两边取倒数,可转化为下列形式:1/V=Km/Vmax.1/[S]+1/Vmax,可知,1/V对1/[S]的作图得一直线,其斜率是Km/V,在纵轴上的截距为1/Vmax,横轴上的截距为-1/Km。此作图除用来求Km和Vmax值外,在研究酶的抑制作用方面还有重要价值 三、实验器材与试剂 1、试剂:磷酸二氢钠、柠檬酸、ABTS、酸性靛蓝。 2、器材:可见分光光度计、恒温水浴锅、试管、酸度计 四、操作步骤 1、配置缓冲溶液 按下表配置缓冲溶液,其溶液pH值以酸度计测定值为准。
萌发小麦种子中淀粉酶酶学性质研究(东北农业大学,生命科学学院,黑龙江省哈尔滨市 150030) 摘要: 酶是酶是一种生物催化剂,它具有催化剂属性,同是也具有一些无机催化剂所不具有的特性。催化特定化学反应的蛋白质、RNA或其复合体。是生物催化剂,能通过降低反应的活化能加快反应速度,但不改变反应的平衡点。本实验通过利用淀粉酶水解还原糖,还原糖能使3,5-二硝基水杨酸还原,生成棕色的3-氨基-5硝基水杨酸。淀粉酶活力与还原糖的量成正比,用比色法测定淀粉酶作用于淀粉后生成的还原糖的量,以单位质量样品在一定时间内生成还原糖的量表示酶活力。以淀粉在碘液中显蓝色性质,探究酶活性影响因素,常见的影响因素有:温度 pH 活性剂和抑制剂等。 Abstract:Enzyme is a biological catalyst is an enzyme, the catalyst having the property, the same also has some inorganic catalysts do not have the characteristics. Proteins catalyze specific chemical reactions,RNA or a composite thereof. Are biological catalysts,by reducing the activation energy of the reaction to accelerate the reaction rate, but does not change the equilibrium reaction. In this study, the use of enzymatic hydrolysis of starch sugar, sugar makes 3,5-dinitrosalicylic acid reduction ,a brown 3-amino-nitro-salicylic acid.Proportional to the amount of amylase activity and reducing sugars,measuring the amount of amylase in starch sugar produced by colorimetry ,a unit mass of the sample at the certain time. 关键词: 淀粉酶活性温度 PH 激活剂和抑制剂 引言: 新陈代谢是生命活动的基础,是生命活动最重要的特征。而构成新陈代谢的许多复杂而有规律的物质变化与能量变化,都是在酶催化下进行的。生物的生长发育、繁殖、遗传、运动、神经传导等生命活动都与酶的催化过程紧密相关,可以说,没有酶的参与,生命活动一刻也不能进行。酶是细胞产生的,受多种因素调节控制的具有催化能力的生物催化剂,与一般催化剂比较有以下不同点:酶易失活、酶具有很高的催化效率、酶具有高度专一性、酶活性受到调节和控制。而调节和控制又包括调节酶浓度、抑制剂和激活剂的调节等。[1] 按照淀粉酶水解淀粉的作用方式,可以分为α-淀粉酶、β-淀粉酶、异淀粉酶和麦芽糖酶四种类型。实验证明,当谷类种子萌发时,两类淀粉酶(α,β型)都存在,淀粉酶总酶活性随种子萌发将升高,有利于淀粉被降解为植物生长发育所需的葡萄糖。许多微生物包括
实验四多酚氧化酶的活性的测定及酶学性质 This model paper was revised by the Standardization Office on December 10, 2020
实验四、马铃薯块茎多酚氧化酶(PPO)活性测定及酶学性质一、实验目的 1掌握分光光度法测定多酚氧化酶活性的一般原理及操作技术方法。 2了解酶的活性与植物组织褐变以及生理活动之间的关系。 二、实验原理 马铃薯不耐储藏,在加工过程中去皮切分后非常容易发生酶促褐变,使外观品质和营养价值大为降低,制约着马铃薯的开发利用。酶促褐变是马铃薯加工产业必须解决的难题。其中多酚氧化酶是导致马铃薯等果蔬发生酶促褐变的重要酶类。多酚氧化酶活性大小直接影响酶促褐变程度。 多酚氧化酶(polyphenol oxidase,PPO)又称酪氨酸酶、儿茶酚酶、酚酶等.是自然界中分布极广的一种含铜氧化酶.普遍存在于植物、真菌、昆虫的质体中。植物受到机械损伤和病菌侵染后,PPO催化酚与O2氧化形成醌,使组织形成褐变.以便损伤恢复,防止或减少感染,提高抗病能力。研究多酚氧化酶的特性对食品的加工与保藏工艺有非常重要的意义。因此,检测食品中多酚氧化酶具有重要意义。 多酚氧化酶是一种含铜的氧化酶,在一定的温度、pH条件下,有氧存在时,能使催化邻苯二酚氧化生成有色物质,单位时间内有色物质在410nm处的吸光度与酶活性强弱成正相关,在分光光度计410nm处使反应体系的OD值产生变化,通过OD值的变化确定PPO的酶活大小。 多酚氧化酶 邻苯二酚(儿茶酚)+1∕2O 2——————→邻醌+H 2 O
三、试验材料、试剂及试验用品 1.材料:马铃薯块茎。 2.仪器:分光光度计;离心机;恒温水浴;研钵;试管;移液管;容量瓶 3.试剂:L 磷酸缓冲液(pH=);L邻苯二酚;L磷酸氢二钠;L磷酸二氢钠;10mmol/L 柠檬酸;10mmol/L抗坏血酸;10mmol/L乙二胺四乙酸二钠(EDTA);10mmol/L亚硫酸钠 四、实验方法: 1.多酚氧化酶的提取 取马铃薯块茎样品,加入预冷的磷酸缓冲液()3ml,研磨匀浆,转移到离心管中,再用7mL磷酸缓冲液冲洗研钵,合并提取液,在4℃下离心(8000r/min)5min,取上清液为多酚氧化酶提取液,并量取粗酶液体积。 2.多酚氧化酶活性测定 采用比色法测定。将ml邻苯二酚加入2ml磷酸缓冲液(pH)中,加入ml酶提取液,立即于波长410nm下测定吸光值,2min后再计吸光值,以不加酶提取液的反应液做对照(注意空白为: ml缓冲液和 mL邻苯二酚溶液)。以每分钟吸光度变化为1个多酚氧化酶活性单位。 表1 多酚氧化酶活性测定
萌发小麦种子中淀粉酶酶学性质 XXX A091100XX 生学1101 Enzymatic properties of amylases from germinant wheat 摘要:在小麦种子中提取淀粉酶,研究相关酶学性质,了解温度、PH值以及激活剂和抑制剂对淀粉酶活性的影响,并且对酶的活力进行测定。不同的温度、PH条件下和加激活剂或抑制剂情况下淀粉酶将淀粉水解的程度不同,产物遇碘呈现不同的颜色,由此可知道酶活性的最适温度和最适PH,也可知道激活剂能使酶的性增加,抑制剂能使酶的活性降低。对酶的活力进行测定时,是测定产物麦芽糖的量,来表示酶的活力。麦芽糖能将3、5—二硝基水杨酸还原成棕红色的氨基化合物(520nm处有最大吸收峰),其颜色深浅与麦芽糖浓度成正比,利用分光光度法测定棕红色的氨基化合物吸光值,从而得到产物麦芽糖的量,来表示酶的活力[1]。 关键词:淀粉酶、温度、PH值、激活剂、抑制剂、分光度计 研究背景:二十一世纪是生物信息时代,各种生物学领域研究层出不穷 ,对酶的研究是其中一个重要方面,目前对酶的研究已转入了后期,各种酶的生化性质也相继被研究出,酶是一种具有催化活性的蛋白质,由氨基酸通过肽链连接而成,只有在适当的温度、pH和离子强度下才具有生物活性,有些酶还需要辅酶或者辅因子[2]。通过此次实验研究,让我们进一步加深对淀粉酶的认识和学习,同时培养我们设计实验的基本思路,学会科学的实验组合,提出合理的实验方案,为以后研究其他种类的酶提供了研究方法和实验依据,也为我们以后更多的设计型实验作好铺垫。 原理:淀粉是植物最主要的储藏多糖,也是人和动物的重要食物和发酵工业的基本
小麦种子淀粉酶酶学性质的研究 小麦种子淀粉酶酶学性质的研究Enzymatic properties of amylases from wheat 摘要:在小麦种子中提取淀粉酶,研究相关酶学性质,了解温度、PH值以及激活剂和抑制剂对淀粉酶活性的影响,并且对酶的活力进行测定。不同的温度、PH条件下和加激活剂或抑制剂情况下淀粉酶将淀粉水解的程度不同,产物遇碘呈现不同的颜色,由此可知道酶活性的最适温度和最适PH,也可知道激活剂能使酶的性增加,抑制剂能使酶的活性降低。对酶的活力进行测定时,是测定产物麦芽糖的量,来表示酶的活力。 麦芽糖能将3、5—二硝基水杨酸还原成棕红色的氨基化合物(520nm处有最大吸收峰),其颜色深浅与麦芽糖浓度成正比,利用分光光度法测定棕红色的氨基化合物吸光值,从而得到产物麦芽糖的量,来表示酶的活力[1]。 关键词:小麦种子;淀粉酶;温度;PH值;激活剂;抑制剂;酶的活力;分光光度计 研究背景:二十一世纪是生物信息时代,各种生物学领域研究层出不穷 ,对酶的研究是其中一个重要方面,目前对酶的研究已转入了后期,各种酶的生化性质也相继被研究出,酶是一种具有催化活性的蛋白质,由氨基酸通过肽链连接而成,只有在适当的温度、pH和离子强度下才具有生物活性,有些酶还需要辅酶或者辅因子[2]。通过此次实验研究,让我们进一步加深对淀粉酶的认识和学习,同时培养我们设计实验的基本思路,学会科学的实验组合,提出合理的实验方案,为以后研究其他种类的酶提供了研究方法和实验依据,也为我们以后更多的设计型实验作好铺垫。 目的:通过此次实验研究让我们进一步的加深对淀粉酶的学习和认识。同时,培养我们设计
β-淀粉酶 淀粉酶是水解淀粉和糖原酶类的统称,按水解淀粉方式不同,淀粉酶可分为α- 淀粉酶、β-淀粉酶、脱枝酶及葡萄糖淀粉酶4 大类.按照结构的差异,又可将其分为α、β型两大类.β-淀粉酶是一种外切酶,其作用于淀粉时,从α- 1,4糖苷键的非还原性末端顺次切下一个麦芽糖单位,产物为麦芽糖和大分子的β-界限糊精.因为该酶作用于底物时,发生沃尔登转化(Waldeninversion),使产物由α型变为β型麦芽糖,释放的β-麦芽糖在C1位上有一个自由H基,为β型,故名β-淀粉酶.近年来,β-淀粉酶的研究引起了酶制剂行业的广泛关注.本文对β-淀粉酶的来源、性质、分离纯化及应用等方面的研究进展进行了综述,最后对β-淀粉酶在酶制剂行业的研究及应用进行了展望。 一、来源 β—淀粉酶广泛存在于大麦、小麦甘薯、大豆等高等植物中,目前商品β—淀粉酶绝大部份均是从植物中提取的,芽孢杆菌β—淀粉酶生产量极低。很多微生物通过发酵能产生β-淀粉酶,如蜡状芽孢杆菌、巨大芽孢杆菌、环状芽孢杆菌、多粘芽孢杆菌、假单胞菌等.但通过微生物发酵生产的β-淀粉酶耐热性差,且成本较高,要达到工业化生产还需一定距离.植物中β-淀粉酶酶活力高、耐热性好、作用 pH 范围较广,适合于高麦芽糖浆的生产要求.植物体中的β-淀粉酶主要存在于质体内,而在其他亚细胞区域内β-淀粉酶的分布都较少.甘薯
在自然栽培的条件下,只有块根中存在β-淀粉酶,其余的部位几乎检测不出β-淀粉酶的存在,但是只有存在于质体外的β-淀粉酶才具备活性.Zieglar认为β-淀粉酶在液泡中也有所分布,并且在多糖代谢中起到作用.单子叶植物中β-淀粉酶存在于胚乳细胞中,在其他器官中很少有分布,当种子萌发时,β-淀粉酶与其他相关酶一起协同完成淀粉的降解.而在高等植物中,存有两种不同酶活力的β-淀粉酶,它们分别存在于植物的不同组织器官中:一种是以高活力存在的β-淀粉酶,主要存在于禾本科植物的胚乳中,当这类植物的种子开始发芽时,β-淀粉酶的酶活力会显著升高;而另一种则是以相对酶活性较低的形式,普遍存在于植物的各个组织器官中的β-淀粉酶.这两种形式的β-淀粉酶虽然在抗原性上较相似,但在其他方面存在着较大的区别,而且它们的生成方式也不尽相同,推测得出,前一种β-淀粉酶可能是由后一种β-淀粉酶的基因转变而来的。β-淀粉酶在高等植物体内是以游离态和结合态两种形式存在的,用水提的方法可以将植物中游离态的β-淀粉酶提取出来,而以结合态形式存在的β-淀粉酶的提取还需要添加还原剂或蛋白水解酶,这种结合态的β-淀粉酶由于与种子中的其他蛋白结合会成为复杂的不溶物质.这两种形态的β-淀粉酶在大麦种子中占所有蛋白含量的1%左右。 二、β—淀粉酶性质 β—淀粉酶能将直链淀粉分解成麦芽糖的淀粉酶。可耐酸。将麦芽汁调节pH值为3.6,在0℃下可使α-淀粉酶失去活力,而余下β-淀粉酶。β-淀粉酶的唯一产物是麦芽糖,不是葡萄糖。β-淀粉酶水
Breeding of D (–)-Lactic Acid High Producing Strain by Low-energy Ion Implantation and Preliminary Analysis of Related Metabolism Ting-Ting Xu &Zhong-Zhong Bai &Li-Juan Wang &Bing-Fang He Received:21January 2008/Accepted:5May 2008/Published online:24June 2008#Humana Press 2008 Abstract The low-energy nitrogen ion beam implantation technique was used in the breeding of mutant D (–)-lactic-acid-producing strains.The wild strain Sporolactobacillus sp.DX12was mutated by an N +ion beam with energy of 10keV and doses ranging from 0.4×1015to 6.60×1015ions/cm https://www.doczj.com/doc/3217209287.html,bined with an efficient screening method,an efficient mutant Y2-8was selected after two times N +ion beam implantation.By using the mutant Y2-8,121.6g/l of D -lactic acid was produced with the molar yields of 162.1%to the glucose.The yield of D -lactic acid by strain Y2-8was 198.8%higher than the wild strain.Determination of anaerobic metabolism by Biolog MT2was used to analyze the activities of the concerned enzymes in the lactic acid metabolic pathway.The results showed that the activities of the key enzymes responded on the substrates such as 6-phosphofructokinase,pyruvate kinase,and D -lactate dehydrogenase were considerably higher in the mutants than the wild strain.These might be affected by ion beam implantation. Keywords Nitrogen ion beam implantation .D (–)-Lactic-acid-producing strain .Mutation .Breeding .Metabolic influence Introduction For centuries,lactic acid has traditionally been used in the food,textile,chemical,and pharmaceutical industries.In recent years,poly-L -lactic acid (PLLA)has attracted much interest as a renewable alternative to conventional petroleum-based plastics.Its properties make it useful for many applications such as biodegradable packaging and agricultural mulch film [1].However,thermal stability of PLA is not sufficiently high to some Appl Biochem Biotechnol (2010)160:314–321DOI 10.1007/s12010-008-8274-4 T.-T.Xu :Z.-Z.Bai :L.-J.Wang :B.-F.He (*) College of Life Science and Pharmaceutical Engineering,Nanjing University of Technology,Xinmofan Road 5,Nanjing,210009Jiangsu,China e-mail:bingfanghe@https://www.doczj.com/doc/3217209287.html,
The effects of protein content to starch’s enzymolysis character ZhongDong Liu Henan University of Technology ZhengZhou, China liuzhongdong@https://www.doczj.com/doc/3217209287.html, LiZheng Bi Henan University of Technology ZhengZhou, China bilizheng123@https://www.doczj.com/doc/3217209287.html, Guojin Yan Henan University of Technology ZhengZhou, China yanguojin@https://www.doczj.com/doc/3217209287.html, Shijie Yang Henan University of Technology ZhengZhou, China lzd@https://www.doczj.com/doc/3217209287.html, Chao Yang Henan University of Technology ZhengZhou, China drlzd@https://www.doczj.com/doc/3217209287.html, Liu Boxiang Illinois Wesleyan University IL, USA jollier.liu@https://www.doczj.com/doc/3217209287.html, Abstract:The research studied the best condition for protein purification in the wheat starch , for preparation of the wheat starch and the influence of the starch grain protein in the structure and properties when the starch is hydrolyzed . Firstly, we ensured the optimum condition for the Wheat protein purification by orthogonal test, at the same time , we obtained different protein content of wheat starch ,the next step is to measure the protein content by the Kjedahl determination. Contrast between the SDS and protease in nitrogen function before setting-out the Enzymatic hydrolysis degree and the crystallinity in the starch samples of different nitrogen.It can be concluded from those experiments that compared with the SDS, the Protease is more effectively to remove the starch grain protein, which is useful to hydrolyze starch particles. Keywords:The wheat starch ; Protein purification; The Enzymatic hydrolysis degree 淀粉中蛋白含量对淀粉酶解性质的影响 刘钟栋1,毕礼政 1 ,阎国进1,杨士杰1,杨超1,Liu Boxiang2 1.河南工业大学,郑州,中国,450052 2. Illinois Wesleyan University ,1312 Park Street Bloomington, IL, USA 【摘要】本文主要对小麦粉洗淀粉过程中影响淀粉蛋白含量的因素及淀粉颗粒蛋白对淀粉酶解性质的影响进行了研究。首先对洗淀粉过程中影响其蛋白含量的条件进行了单因素试验,再用SDS溶液和蛋白酶除去其中的蛋白质成分,得到不同蛋白含量的小麦淀粉,以凯氏定氮法测定其中蛋白质含量。然后对除去蛋白的小麦淀粉样品进行定氮,对比两种除蛋白方法之间的优劣,然后以不同蛋白质含量的淀粉样品同时做酶解度测定试验,讨论蛋白质对淀粉在酶解过程中性质和结构的影响。试验表明,蛋白酶比较有效地除去淀粉颗粒蛋白,而颗粒蛋白确实有助于淀粉的水解。 【关键词】小麦淀粉;蛋白纯化;酶解 1 引言 淀粉中含有少量的蛋白质,但是这少量的蛋白质在淀 粉的水解和参与其他化学反应中起到重大作用,然而关于 这方面的研究却至今没有准确的答案,从整个研究淀粉及2010 First International Conference on Cellular, Molecular Biology, Biophysics and Bioengineering (CMBB) 978-1-4244-9158-2/10/$26.00 ?2010 IEEE CMBB2010
根据淀粉酶对淀粉的水解方式不同,可将其分为α-淀粉酶、β-淀粉酶、葡萄糖淀粉酶和异淀粉酶等。其中,α-淀粉酶(α-1,4-葡聚糖-4-葡聚糖苷酶)多是胞外酶,其作用于淀粉时可从分子内部随机地切开淀粉链的α-1,4糖苷键,而生成糊精和还原糖,产物的末端残基碳原子构型为α-构型,故称α-淀粉酶。 α-淀粉酶来源广泛,主要存在发芽谷物的糊粉细胞中,当然,从微生物到高等动、植物均可分离到,是一种重要的淀粉水解酶,也是工业生产中应用最为广泛的酶制剂之一。它可以由微生物发酵制备,也可以从动植物中提取。不同来源的α-淀粉酶的性质有一定的区别,工业中主要应用的是真菌和细菌α-淀粉酶。 目前,α-淀粉酶已广泛应用于变性淀粉及淀粉糖、焙烤工业、啤酒酿造、酒精工业、发酵以及纺织等许多行业,是一种重要工业用酶。如在淀粉加工业中,微生物α-淀粉酶已成功取代了化学降解法;在酒精工业中能显著提高出酒率。其应用于各种工业中对缩短生产周期,提高产品得率和原料的利用率,提高产品质量和节约粮食资源,都有着极其重要的作用。相对地,关于α-淀粉酶抑制剂国内外也有很多研究报道,α-淀粉酶抑制剂是糖苷水解酶的一种。它能有效地抑制肠道内唾液及胰淀粉酶的活性,阻碍食物中碳水化合物的水解和消化,降低人体糖份吸收、降低血糖和血脂的含量,减少脂肪合成,减轻体重。有报道表明,α-淀粉酶可以帮助改善糖尿病患者的耐糖量。 α-淀粉酶是淀粉及以淀粉为材料的工业生产中最重要的一种水解酶,其最早的商业化应用在1984年,作为治疗消化紊乱的药物辅助剂。现在,α-淀粉酶已广泛应用于食品、清洁剂、啤酒酿造、酒精工业和造纸工业。 在焙烤工业中的应用: α-淀粉酶用于面包加工中可以使面包体积增大,纹理疏松;提高面团的发酵速度;改善面包心的组织结构,增加内部组织的柔软度;产生良好而稳定的面包外表色泽;提高入炉的急胀性;抗老化,改善面包心的弹性和口感;延长面包心储存过程中的保鲜期 在啤酒酿造中的应用: 啤洒是最早用酶的酿造产品之一,在啤洒酿造中添加α-淀粉酶使其较快液化以取代一部分麦芽,使辅料增加,成本降低,特别在麦芽糖化力低,辅助原料使用比例较大的场合,使用α-淀粉酶和β-淀粉酶协同麦芽糖化,可以弥补麦芽酶系不足,增加可发酵糖含量,提高麦汁率,麦汁色泽降低,过滤速度加快,提高了浸出物得率,同时又缩短了整体糊化时间。在酒精工业中的应用: 在玉米为原料生产酒精中添加α-淀粉酶低温蒸煮的新工艺,每生产1t酒精可节煤 224.42kg。又可减少冷却用水,提高出酒率8.8%,酒精成品质量也有显著提高。酒精生产应用耐高温α-淀粉酶。采用中温95℃~105℃蒸煮,既可有效地杀死原料中带来的杂菌,降低入池酸度和染菌机率,又可保护原材料中的淀粉组织不被破坏,形成焦糖或其它物质而损失,从而提高原料利用率 在造纸工业中的应用: 当代造纸工业中,造纸用化学品在提高纸品质量、增加纸品功能、提高生产效率和降低生产成本等方面发挥着极为重要的作用。由于淀粉与造纸用植物纤维素结构相近,相互间有良好的亲和作用,资源广泛,廉价易得,尤其是经变性处理的淀粉,能赋予纸张优异的性能,因此各类变性淀粉在造纸中广泛用于湿部添加、层间喷雾、表面施胶和涂布粘合。α-淀粉酶可以生产涂布粘合用变性淀粉
淀粉酶【拼音:diàn-fěn méi;英文:Amylase】是一种水解酶,是目前发酵工业上应用最广泛的一类酶。淀粉酶一般作用于可溶性淀粉、直链淀粉、糖原等α-1,4-葡聚糖,水解α-1,4-糖苷键的酶。根据作用的方式可分为α-淀粉酶(EC3.2.1.1.)与β-淀粉酶(EC3.2.1.2.)。 α-淀粉酶广泛分布于动物(唾液、胰脏等)、植物(麦芽、山萮菜)及微生物。微生物的酶几乎都是分泌性的。此酶以Ca2+为必需因子并作为稳定因子,既作用于直链淀粉,亦作用于支链淀粉,无差别地切断α-1,4-链。因此,其特征是引起底物溶液粘度的急剧下降和碘反应的消失,最终产物在分解直链淀粉时以麦芽糖为主,此外,还有麦芽三糖及少量葡萄糖。另一方面在分解支链淀粉时,除麦芽糖、葡萄糖外,还生成分支部分具有α-1,6-键的α-极限糊精。一般分解限度以葡萄糖为准是35-50%,但在细菌的淀粉酶中,亦有呈现高达70%分解限度的(最终游离出葡萄糖)。 β-淀粉酶与α-淀粉酶的不同点在于从非还原性末端逐次以麦芽糖为单位切断α-1,4-葡聚糖链。主要见于高等植物中(大麦、小麦、甘薯、大豆等),但也有报告在细菌、牛乳、霉菌中存在。对于象直链淀粉那样没有分支的底物能完全分解得到麦芽糖和少量的葡萄糖。作用于支链淀粉或葡聚糖的时候,切断至α-1,6-键的前面反应就停止了,因此生成分子量比较大的极限糊精。从上述的α-淀粉酶和β-淀粉酶的作用方式,分别提出α-1,4-葡聚糖-4-葡萄糖水解酶(α-1,4-glucan 4-glucanohydrolase)和α-1,4-葡聚糖-麦芽糖水解酶(α -1,4-glucan maltohydrolase)的名称等而被使用。 α-淀粉酶是一种内切葡萄糖苷酶,属于淀粉酶α-淀粉酶催化水解淀粉会使淀粉黏度迅速下降,所以又称为液化淀粉酶。 理化性质:米黄色、灰褐色粉末。能水解淀粉中的α-1,4,葡萄糖苷键。能将淀粉切断成长短不一的短链糊精和少量的低分子糖类,从而使淀粉糊的黏度迅速下降,即起到降低稠度和“液化”的作用,所以此类淀粉酶又称为液化酶。作用温度范围60~90℃,最适宜作用温度为60~70℃,作用pH值范围5.5~7.0,最适pH值为6.0。Ca2+具有一定的激活、提高淀粉酶活力的能力,并且对其稳定性的提高也有一定效果。可催化水解α-1,4-糖苷键,但只能催化水解直链淀粉,生成α-麦芽糖和少量葡萄糖。主要存在于人的唾液和胰脏中,也存在于麦芽、蟑螂涎腺、芽胞杆菌、枯草杆菌、黑曲霉和米曲霉中。可由米曲霉、嗜酸性普鲁士蓝杆菌、淀粉液化杆菌、地衣芽孢杆菌和枯草杆菌分别经发酵、精制、干燥而得。
碱性磷酸酶的分离纯化与酶学性质研究 董静 201131301031 摘要:以猪肝为原料,采用低浓度醋酸钠(低渗破膜作用)制备肝匀浆,醋酸镁则有保护和稳定AKP 的作用,匀浆中加入正丁醇可使部分杂蛋白变性,释出膜中酶,过滤后,以去除杂蛋白。含有AKP 的滤液用冷丙酮和冷乙酸进行重复分离纯化。根据AKP 在33%的丙酮或30%的乙醇中溶解,而在50%的丙酮或60%的乙酸中不溶解的性质,用冷丙酮和冷乙醇重复分离提取,可从含有AKP 的滤液中获得较为纯净的碱性磷酸酶。酶学性质研究表明该酶催化对磷酸苯二钠水解反应的最适PH值为10.0,最适温度为37℃,米氏常数值Km为3.154mmol/L,酶的热稳定性研究表明该酶在pH在8-9区间和温度在25℃-37℃区间下稳定。 关键字:碱性磷酸酶分离纯化热稳定性酸碱稳定性 碱性磷酸酶(Alkalinephosphatase,EC3.1.3.1,简称AKP)广泛存在于微生物界和动物界,它在动物机体的骨化过程中及在磷化物和其他一些营养物质的消化、吸收和转运过程中起着重要作用。此外,通过催化磷蛋白的水解,碱性磷酸酶在细胞调节过程中也具有一定的作用。它可专一性的水解磷酸单酯化合物而释放无机磷,主要用于核酸研究,分析、测定核苷酸顺序及其基团的重组、分离,也是酶标免疫测定技术的常用工具酶之一。药用化妆品中添加碱性磷酸酶有益于皮肤细胞的再生和新陈代谢,还可用于核苷酸脱磷产生核苷等。它是一种膜结合蛋白,在生物体内直接参与磷酸基团的转移和代谢等生理过程[1]。临床上通过测定AKP的活力,可作为诊断骨骼及肝脏疾病的重要生化指标。因此纯化和研究AKP的性质、调控等有重要意义。本实验尝试以猪肝为材料,分离纯化猪肝碱性磷酸酶,研究其酶学性质,旨在探讨以猪肝研制科研用碱性磷酸酶生化试剂的方法,同时也为进一步的深入研究该酶提供理论上的参考。此外,猪肝来源广泛,价格便宜,可以作为生产碱性磷酸酶生化试剂的原料[2-3]。 研究酶的生物学特性,其之一是它对酸碱度的敏感性, pH对酶活性的影响极为显著,通常各种酶只有在一定的范围内才表现出活性,同一种酶在不同的pH条件下所表现的活性不同,其表现活性最高时的pH值称为酶的最适pH。pH 不仅对酶活性有很大影响,而且对酶的稳定性也有很大的影响,而且对酶的稳定