
2016年药品不良反应分析报告
一、药品不良反应类型统计:
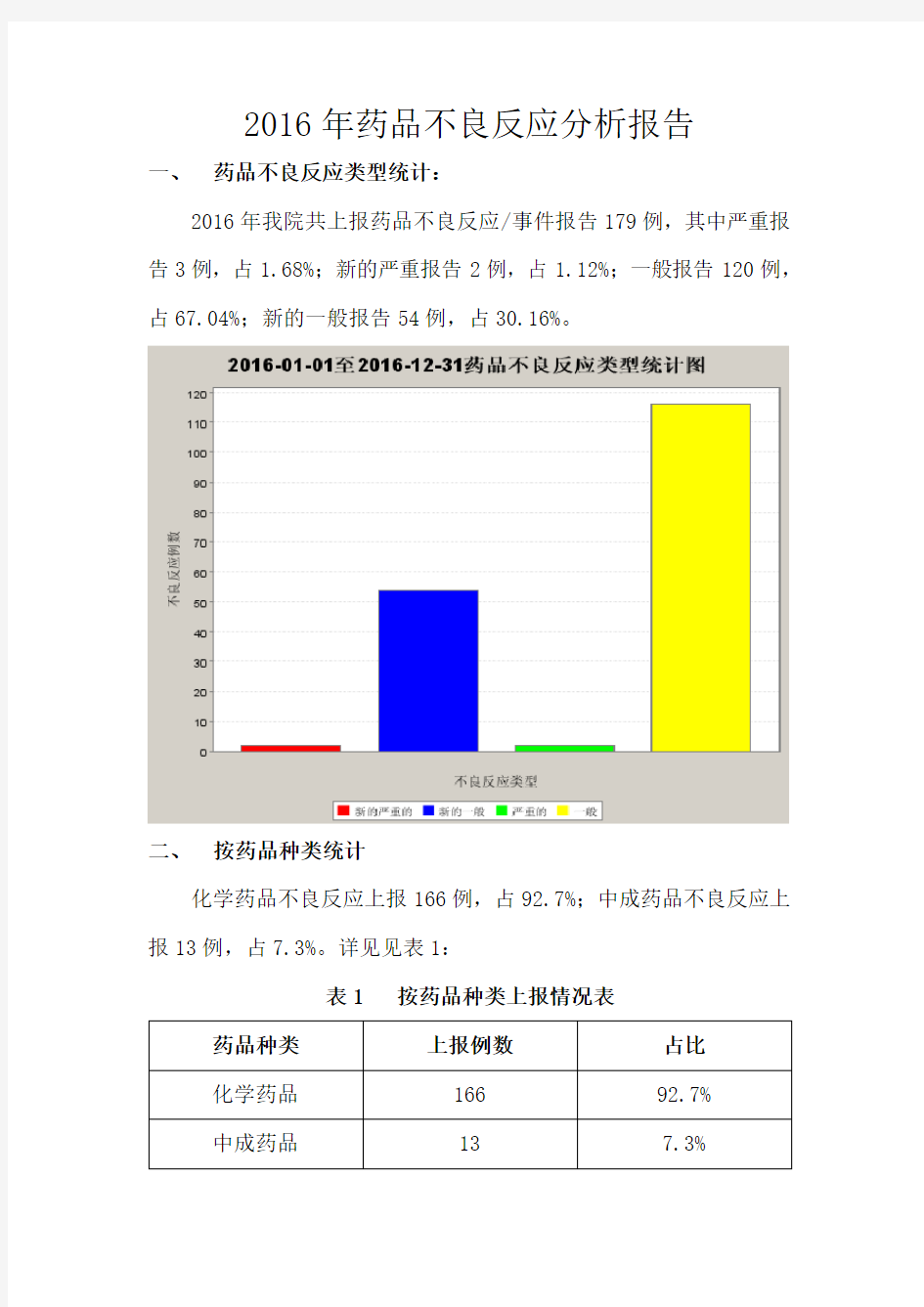
2016年我院共上报药品不良反应/事件报告179例,其中严重报告3例,占1.68%;新的严重报告2例,占1.12%;一般报告120例,占67.04%;新的一般报告54例,占30.16%。
二、按药品种类统计
化学药品不良反应上报166例,占92.7%;中成药品不良反应上报13例,占7.3%。详见见表1:
表1 按药品种类上报情况表
三、按药理作用统计
抗感染药品不良反应上报112例,占62.57%;非抗感染药品不良反应上报67例,占37.43%。见表2:
表2 按药理作用上报情况表
四、抗感染药品不良反应报告:
硝基咪唑类上报6例,占5.36%;头孢菌素类上报36例,占32.14%;青霉素类上报1例,占0.89%;其他B-内酰胺类上报5例,占4.46%;喹诺酮类上报54例,占48.12%;大环内酯类上报3例,占2.68%;其他抗生素上报6例,占5.36%;抗病毒药品上报1例,占0.89%。见表3:
表3 抗感染药品ADR上报情况表
五、报告科室分布
药品不良反应报告来自全院18科室,其中住院患者162例,门急诊患者17例。详见表4:
表4 ADR科室上报情况表
六、药品不良反应报告性别和年龄分布
在报告的179例ADR中,男性75例,女性104例。年龄分布区间为1-90岁,具体情况见表5:
表5 患者年龄分布情况
七、用药途径情况分析:
用药途径包括静脉给药及口服、皮下注射等。最常见仍为静脉滴注,占%。详见表6
表6 给药途径情况表
八、药物不良反应涉及的系统、器官及表现情况分析
上报的ADR涉及的系统损害多为皮肤及其附件损害,常见症状为皮疹、瘙痒等,具体内容见表7:
表7 药物不良反应所涉及的系统、器官及临床表现情况
九、统计ADR报表中发现的问题
1.上报药品不良反应类型单一:由表7可见,我院上报的药品不良反应多局限为各种药物致皮疹,且均为轻微皮疹,停药后多自行消散,所涉及药物无上市5年内的新药。医务人员应对不良反应类别的定义严格掌握,临床应鼓励医务人员积极发现新的、严重的不良反应,对于造成器官损害、致残、致畸、致死、导致住院治疗甚至延长住院时间的药物不良反应,要在规定时限内准确上报。
2.药物不良反应报表书写不规范:本次回顾分析发现,本院ADR 报表书写虽比往年有很大提高,但仍存在部分不规范的情况,如填写漏项、不良反应发生经过描述不详、阐述内容无逻辑关系等,导致这一现象的主要原因是上报人对于表格各项目的要求理解不到位。
3.抗菌药物使用的安全隐患:与国内文献报道一致,我院2016年收集到的ADR病例怀疑由抗菌药物引起的不良反应所占比例最大,其中以喹诺酮类抗菌药物为主,由此提示临床科室在用药过程中应告知患者,如感觉不适应立即反馈。
4.开展ADR监测工作需要医务人员的共同努力,全面配合。做好药物不良反应事件的管理工作是医务人员的责任,与医疗安全息息相关,希望我院医务人员提高对ADR监测工作的积极性和主动性,进一步推进此项工作,促进临床安全合理用药。
药品不良反应分析报告 (20 年月--20 年月) 生产企业:(盖章) 地址: 联系人: 电话: 报告日期: 一、企业监测体系建设概况
我司于2006年已建立药品不良反应报告和监测体系,并有效实施。2012年按《药品不良反应报告和监测管理办法》(卫生部令第81号)》和《浙江省药品不良反应报告和监测管理实施细则》完善我司药品不良反应监测体系、组织机构,明确其职责。 我司监管网络为一线销售人员从医院收集药品不良反应报告,汇总至市场部相关人员。市场部相关人员将数据汇总至相应QA人员,QA人员将数据上报至国家药品不良反应监测系统中。 组织机构: 我司处理药品不良反应/事件的专职部门为质量保证部,监测部门为市场部。 组成人员: 质量负责人、质保部负责人、一名市场部人员、一名QA人员。 职责: (1)市场部人员和QA人员及时收集与公司生产的药品有关的安 全性信息,发现与公司有关的药品不良反应,及时通过药品不良反应监测信息网络报告。每年向所在地药品不良反应监测机构提交药品不良反应监测工作报告; (2)对严重药品不良反应或者药品群体不良事件进行调查,必要时对药品采取紧急控制措施,如召回; (3)配合各级食品药品监督管理局、卫生行政部门和药品不良反应监测机构对药品不良反应或者群体不良事件的调查,并提供调查所需的资料,并填写《药品不良反应/事件报告表》,填报内容应真实、完整、准确。 (4)开展药品不良反应报告数据与药品质量的关联性研究,必要时进行重点监测或再评价;
(5)按要求撰写和提交定期安全性更新报告; (6)正确介绍药品的使用要求和注意事项等,将说明书修改等安全性信息及时告知相关药品经营企业和医疗机构。 (7)经常查阅国家食品药品监督管理局定期通报国家药品不良反应报告和监测情况。 二、公司品种概况 我司现有1个品种:****(批准文号:国药准字*****)。20**年1月1日至9月30日,我司对该品种进行了生产......... 无监测期品种和重点监测品种。 三、产品基本信息和不良反应收集情况 (一)不良反应反馈数据核实情况: 无。 (二)反馈数据涉及产品的基本信息: 产品的批准文号、通用名称、剂型、统计周期内的销量、不良反应报告例数、严重的不良反应例数及其构成比、新的一般的不良反应例数及其构成比、死亡病例数见附表1。 我司无文号转入或转出情况。 (三)其他不良反应信息收集情况: 在此次报告时间段内,我司未收集到到涉及本企业药品的不良反应或可疑不良反应信息情况。
药品不良反应/ 事件报告表 首次报告□跟踪报告□编码: 报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□
药品不良反应/ 事件报告表示例 首次报告□跟踪报告□编码:
1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。 2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。 3. 新的□严重□一般□ (1)新的药品不良反应:是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。 根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应: 1) 导致死亡; 2)危及生命; 3)致癌、致畸、致出生缺陷; 4)导致显着的或者永久的人体伤残或者器官功能的损伤; 5)导致住院或者住院时间延长; 6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。 (3)一般:指新的、严重的药品不良反应以外的所有不良反应。 4. 单位名称:必须填写单位的完整全称,如日照市人民医院。 5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。 6. 电话:填写报告部门(即科室)的电话。 7. 报告日期:指上交不良反应/事件报告的时间。新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。有随访信息的,应当及时报告。 8. 患者姓名:填写患者真实全名。 9. 体重:以千克为单位。如果不知道准确体重,请做一个最佳的估计。 10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。 11. 家族药品不良反应/事件及既往药品不良反应/事件情况:请选择正确选项。如果选择“有”,则在报告的空白处清晰叙述。 12. 不良反应/事件名称:应填写不良反应中最主要、最明显的症状。 13. 不良反应/事件发生时间:应填写发生不良反应/事件的确切时间。 14. 病历(门诊)号:请如实填写,便于查找病例,具体分析不良反应/事件。 15. 不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况: 不良反应过程描述应具体、规范,须体现出“3个时间、3个项目和2个尽可能”。 *3个时间:①不良反应发生的时间;②采取措施干预不良反应的时间;③不良反应终结的时间; *3个项目:①第一次药品不良反应出现时的相关症状、体征和相关检查;②药品不良反应动态变化的相关症状、体征和相关检查;③发生药品不良反应后采取的干预措施结果;
药品不良反应分析报告 药品不良反应(ADR)监测是合理用药的重要依据,是关系到广大患者用药安全,减少医患纠纷的一项重要工作。我院2019年第一季度共收集报告146例,现就2019年第一季度的ADR报告进行统计、分析,了解ADR发生的一般规律和特征,为临床合理用药提供参考。 一、ADR监测统计结果及分析 1、性别与年龄分布 我院2019年第一季度共收到146例ADR报告,其中男性66人,占比45.21 %,女性80人,占比54.79%。患者的年龄分布见表1: 表1 发生ADR患者的年龄分布 年龄/岁例数/n 构成比/% 0~10 32 21.92 11~20 4 2.74 21~30 8 5.48 31~40 14 9.59 41~50 24 16.44 51~60 19 13.01 > 60 45 30.82
合计146 100.00 2、患者家族史、既往史情况 146例ADR报告中,患者既往有过敏史的26例,占17.81%;无过敏史的113例,占77.40%;不详的7例,占4.79%。146例患者中有家族药物过敏史的0例,占0%;无家族药物过敏史的51例,占34.93%;不详的95例,占65.07%。
3、患者转归情况 146例ADR中,其中痊愈77例,占52.74%;好转45例,占30.82%;不详24例,占16.44%。大多数患者经积极治疗均好转或痊愈(占83.56%),不详占16.44%,主要因为观察时间不够长,说明我院医务人员发现药品不良反应能够及时上报。 4、药品剂型及用药途径分布 药品剂型 146例病例报告涉及药品剂型17种,以注射剂为主。本季度涉及药品剂型分布及所占比例见表2。 表2 药物剂型分布 剂型例次/n 构成比/% 注射剂142 64.25 粉针剂21 9.50
药品不良反应报告表的填写要求《药品不良反应/事件报告表》是药品安全性监测工作的重要档案资料,需要永久保存,务必要用钢笔填写。填写的内容和字迹要清楚、整洁;不用不规范的符号、代号,不用草体签名。报告表中选择项划√,叙述项应准确、简明。 1. 药品不良反应/事件报告表的填写 每一个患者填写一张报告表。个人报告建议由专业人员填写,可以是诊治医务人员、生产企业、经营企业专(兼)职人员及专业监测机构人员。尽可能详细填写所有项目。无法获得的项目,填写“不详”。空间不够时可附页,注明“附件”。所有附件应按顺序表明页码,并指出所描述的项目的名称。 如果报告的是补充报告请填写与原始报告相同的编号并在报告左上 方注明“补充报告”与原始报告重复的部分可不必再填写。补充报告也可不填写报告表只需要对补充部分附纸说明即可。 填写详细要求: (1)新的□严重□一般□ “一般”是指新的、严重的药品不良反应以外的所有药品不良反应。“新的”可与“严重”或“一般”复选,而“严重”与“一般”只能二选一。 (2)编码 编码为各级药品不良反应监测机构在网络报告时自动生成。 (3)单位名称 填写发现并报告药品不良反应的单位名称,要求填写全称,如不可填“人民医院”,应填写“﹡﹡省人民医院”,“﹡﹡省﹡﹡市人民医院”。 (4)部门 部门应填写标准全称或简称,如“普通外科二病房”或“普外二”,“质保部”。 (5)电话 电话号码应填写报告部门电话,注意填写区号,如:。 (6)报告日期 报告日期应为填写报告日期,如:2004年3月3日。 (7)患者姓名 填写患者真实全名。 当新生儿被发现有出生缺陷时,如果报告者认为这种缺陷可能与孕妇在怀孕期间服用药品有关,患者为新生儿。
2018年度药品不良反应报告分析 一、资料与方法 1. 资料来源:医院各科室上报。 2. 方法:采用回顾性研究方法,分别对5例药品不良反应患者的年龄、性别、给药途径、临床表现等进行调查,并对上述结果进行分类统计、分析和评价。 二、结果与分析 1. 性别与年龄分布 5例药品不良反应报告中男性患者3例(60%),女性患者2例(40%),患者年龄最小的1岁,最大的81岁,年龄分布情况见表1。 表1:发生ADR的年龄与性别分布(例) 性别1岁以 下1-9岁10-19岁20-29岁30-39岁40-49岁50-59岁≥60 合 计 构成比例/% 男性0 1 0 0 0 1 0 1 3 60 女性0 0 0 0 0 0 0 2 2 40 合计0 1 0 0 0 1 0 3 5 构成比例/% 0 20 0 0 0 20 0 60 100 2.引发ADR的给药途径分布 药物ADR发生率与给药途径密切相关,静脉给药引发的ADR最多,有例4(占80%)。引发ADR的给药途径分布见表2。 表2:引发ADR的给药途径分布 给药途径例数构成比例/% 肌肉注射 1 20 静脉给药 4 80 口服给药0 0 局部给药0 0 吸入给药0 0 合计 5 100 3.ADR累及器官系统及临床表现 引发ADR累及器官或系统以皮肤及其附件损害、消化系统损害为主。ADR累及器官或系统及临床表现见表3。
表3:ADR累及器官或系统及临床表现 累及器官或 系统例数构成 比例/% 主要临床表现 皮肤及其附 件 4 80 全身或局部皮疹、瘙痒、红肿、药疹、荨麻疹、皮 炎 消化系统 0 0 恶心、呕吐、腹痛、腹胀、腹泻、肝功能异常 神经系统 1 20 头痛、头晕、失眠、嗜睡、耳鸣、烦躁、肢体麻木、抖动呼吸系统 0 0 气短、咳嗽、呼吸困难 全身反应 0 0 过敏样反应、寒战、发热、过敏性休克、水肿 泌尿系统 0 0 血尿、排尿困难、急性肾功能衰竭、头皮发麻、其他 0 0 眼结膜出血、关节疼痛 合计 5 100 4.ADR报告中涉及药品种类 5例患者中共涉及3种药品。引起ADR药品种类、例数及构成比例见表4。 表4:ADR报告中涉及药品种类例数及构成比例 药物类别例数构成比(%) 抗菌药物 4 80 消化系统药物0 0 中药制剂0 0 呼吸系统药物0 0 抗肿瘤药物0 0 神经系统药物0 0 营养药物0 0 抗过敏药0 0 激素类药物0 0 止痛药0 0 妇科用药0 0 增强免疫类药物0 0 造影剂0 0 其他 1 20 合计 5 100 三、讨论与整改措施 2018年度ADR发生共5例,其中全部集中于2018年上半年。2018年上半年,ADR发生率男性大于女性,男性ADR发生率为60%,这可与统计例数少有关。60岁以上发生ADR的频率最高,为60%。这与我中心服务人口分布及老年人的生理特性有关:随着年龄增加,脏器功能逐步衰退,影响药物的代谢和排泄,造成
附表1 药品不良反应/ 事件报告表 首次报告□跟踪报告□编码:
填写说明 一、严重药品不良反应就是指因使用药品引起以下损害情形之一得反应: 1) 导致死亡; 2)危及生命; 3)致癌、致畸、致出生缺陷; 4)导致显著得或者永久得人体伤残或者器官功能得损伤; 5)导致住院或者住院时间延长; 6)导致其她重要医学事件,如不进行治疗可能出现上述所列情况得。 二、新得药品不良反应就是指药品说明书中未载明得不良反应。 药品不良反应在说明书中已有描述,但不良反应发生得性质、程度、后果或者频率与说明书描述不一致或者更严重得,按照新得药品不良反应处理。 三、报告时限 新得、严重得药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其她药品不良反应30日内报告。有随访信息得,应当及时报告。 四、关联性评价指标 肯定:用药及反应发生时间顺序合理;反应符合该药已知得不良反应类型;停药或减量后,反应停止或减轻;再次使用可疑药品,反应再现;已排除并用药、原患疾病等其它因素影响。 很可能:用药及反应发生时间顺序合理;反应符合该药已知得不良反应类型;停药或减量后,反应停止或减轻;已排除并用药、原患疾病等其它因素影响。 可能:用药及反应发生时间关系密切;反应表现与已知该药ADR不相吻合;无法排除并用药、原患疾病等其它因素影响。 可能无关:用药及反应发生时间相关性不密切;反应表现与已知该药ADR不相吻合;无法排除并用药、原患疾病等其它因素影响。 待评价:需要补充材料才能评价。 无法评价:评价得必需资料无法获得。 五、其她说明 怀疑药品:就是指患者使用得怀疑与不良反应发生有关得药品。 并用药品:指发生此药品不良反应时患者除怀疑药品外得其她用药情况,包括患者自行购买得药品或中草药等。 用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。 六、报告得处理 所有得报告将会录入数据库,专业人员会分析药品与不良反应/事件之间得关系。根据药品风险得普遍性或者严重程度,决定就是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用得信息等。在极少数情况下,当认为药品得风险大于效益时,药品也会撤市。 附表2 药品群体不良事件基本信息表
2016年药品不良反应分析报告 一、药品不良反应类型统计: 2016年我院共上报药品不良反应/事件报告179例,其中严重报告3例,占1.68%;新的严重报告2例,占1.12%;一般报告120例,占67.04%;新的一般报告54例,占30.16%。 二、按药品种类统计 化学药品不良反应上报166例,占92.7%;中成药品不良反应上报13例,占7.3%。详见见表1: 表1 按药品种类上报情况表
三、按药理作用统计 抗感染药品不良反应上报112例,占62.57%;非抗感染药品不良反应上报67例,占37.43%。见表2: 表2 按药理作用上报情况表 四、抗感染药品不良反应报告: 硝基咪唑类上报6例,占5.36%;头孢菌素类上报36例,占32.14%;青霉素类上报1例,占0.89%;其他B-内酰胺类上报5例,占4.46%;喹诺酮类上报54例,占48.12%;大环内酯类上报3例,占2.68%;其他抗生素上报6例,占5.36%;抗病毒药品上报1例,占0.89%。见表3: 表3 抗感染药品ADR上报情况表
五、报告科室分布 药品不良反应报告来自全院18科室,其中住院患者162例,门急诊患者17例。详见表4: 表4 ADR科室上报情况表
六、药品不良反应报告性别和年龄分布 在报告的179例ADR中,男性75例,女性104例。年龄分布区间为1-90岁,具体情况见表5: 表5 患者年龄分布情况 七、用药途径情况分析: 用药途径包括静脉给药及口服、皮下注射等。最常见仍为静脉滴注,占%。详见表6 表6 给药途径情况表
八、药物不良反应涉及的系统、器官及表现情况分析 上报的ADR涉及的系统损害多为皮肤及其附件损害,常见症状为皮疹、瘙痒等,具体内容见表7: 表7 药物不良反应所涉及的系统、器官及临床表现情况
药品不良反应报告表 部分项目填报注意事项 一、药品不良反应事件名称及描述 1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”, 对于皮疹的发生部位、大约形态进行描述; 2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述; 3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征; 例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。 4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述; 例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状; 例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。 二、药品不良反应发生后采取的措施及转归 1、药品不良反应发生以后,主要采取的治疗措施要进行描述。例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。 2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。 国家规定药品不良反应报告的上报时限。大家应当按照规定时限完整的对药品不良反应进行上报。 备注:提供一个药品不良反应/事件报告表填写模板(见附表),供大家参考。
红河州第四人民医院 鼓励药品不良反应与药害事件报告措施 一、目的 为了加强医院临床用药的安全监管,规范药品不良反应与药害事件监测报告管理程序,研究药品不良反应与药害事件的因果关系和诱发因素,保障临床用药的安全性,同时也为评价淘汰药品提供服务和依据,根据《中华人民共和国药品管理法》和《药品不良反应报告和监测管理办法》(卫生部令第81号)的相关规定,医院实行药品不良反应与药害事件监测报告管理制度,医院鼓励各临床科室和个人报告药品不良反应。 二、报告人: 负责本院药品不良反应与药害事件监测报告管理工作的专职或兼职人员、临床药师及药剂科各部门负责人。 三、主要内容 (一)定义 1.药品不良反应(ADR):是指合格药品在正常用法下出现与用药目的无关的或意外的有害反应。ADR主要包括副作用、毒性作用、后遗效应、变态反应、继发反应、特异性遗传素质反应、药物依赖性、致癌、致突变、致畸作用等。 2.药品不良事件(ADE):是指药物治疗期间所发生的任何不利的医学事件,但该事件并非一定与用药有因果关系。为了最大限度的降低人群的用药风险,本着“可疑即报”的原则,对有重要意义的ADE也要进行监测。
3. 药品群体不良事件:是指同一药品在使用过程中,在相对集中的时间、区域内,对一定数量人群的身体健康或者生命安全造成损害或者威胁,需要予以紧急处置的事件。 4.药害事件:泛指由药品使用导致的患者生命或身体健康损害的事件,包括药品不良反应以及其他一切非预期药物作用导致的意外事件。相对于药品不良反应,药害事件概念的内涵和外延都被扩大。药害既包括非人为过失的不良反应,也包括人为过失导致的其他负面药物作用。药害事件主要有三种类型:一是由于药品质量缺陷(假药、劣药)导致损害的事件;二是由于合格药品使用过错(超剂量中毒、用错药和不合理用药等)导致损害的事件;三是合格药品在按说明书正常使用的情况下发生的不良反应损害,即药品不良反应事件。 5. 药品不良反应与药害事件监测报告:是指药品不良反应与药害事件监测报告的发现、报告、评价和控制的过程。 6. 药品重点监测:是指为进一步了解药品的临床使用和不良反应发生情况,研究不良反应的发生特征、严重程度、发生率等,开展的药品安全性监测活动。 7. 同一药品:指同一生产企业生产的同一药品名称、同一剂型、同一规格的药品。 (二)机构设置和职责 机构:医院药品不良反应与药害事件监测管理机构由医院药事管理与药物治疗学委员会领导的医院药物安全性监测管理组、药品不良反应与药害事件监测办公室及临床药品不良反应与药害事件监测网组成,其主要任务是负责全院药品不良反应与药害事件报告的收集、
药物不良反应报告的判断、评价及 药物不良反应(Adverse Drug Reactions,ADRs)监测,在欧洲国家也习惯称为“上市后药物监测(Postmarketing Drug Surveillance,PMDS)”,以1964年英国黄卡制度(Yellow card system)的问世而宣告诞生。ADRs监测有志愿报告体系(SPontaneous Reporting system,SRS)、集中(或强化)监测体系(intensivereporting system)等多种方式。由于SRS一直是ADRs监测的主要方式,近年来,似乎已约定俗成,ADRs监测一般指的即是SRS。SRS主要目标是尽早获得药物安生性问题的信号,为药政管理提供依据以及向卫生专业人员传递信息。 药品不良反应常成为医疗、科学、道德、商业与诉讼的焦点。法律判决依据的事实。而药品不良反应监测报告的不确切性,常使得问题的讨论难以为继。 ADR报告的获得过程可分析如下:(1) 不良反应事件的发生和发现;(2) 把事件的发生归因于药物,这一判断很多源于经验,通常考虑的是时间上有联系,以及没有混杂因素等; (3) 把归咎于药物的不良事件以可疑的ADR的名义向卫生行政部门或制药公司报告。而报告的只占实际发生的不良反应事件的极少部分。 为了减少漏报,提高检测的灵敏性,一般都提倡“有疑即报”,即不必在肯定了药物与不良事件的因果关系后再报告。 监测方法的优劣,不但要看其灵敏性,还要看其特异性。70年代后期以来,为了提高药品不良反应监测的特异性,许多专家探讨、研究了各种因果判断方法,有的国家将其作为对厂方报告ADR时的一种要求。这一倾向曾使人们以为应用这些方法能测定具体病人或个例报告的因果关系,能解决不确定性问题。现在已逐渐认识到这是一种偏向,但“因果”方法也并非一无是处,它们可以告诉初报者如何考虑这是一起ADR,该收集哪些资料,该从哪些方面描述。 为了更准确、更有质量地报告ADR,系统地了解药物不良反应判断的思路十分必要。而为了高屋建瓴,从战略角度全面地了解药品不良反应监测的作用与地位,探讨药物警戒中的信号问题就十分必需。 1 药物不良反应报告归因判断 1.1 因果性质的标准——ADR判断时的考虑因素 ①与现有资料要有一致性(或生物学合理性) 即从已有的文献资料中其他类型信息的观点看因果联系的合理性。其他类型信息是指其他人体研究的数据,其他有关问题研究的数据,动物实验的数据以及科学的病理生理学理论。如果某项发现能为已有的资料和理论所解释,一般就会更令人信服。 ②以往的经验,即是否已有该药反应的报道、评述等——联系的一贯性
《药品不良反应/事件报告表》填写要求 《药品不良反应报告和监测管理办法》第十三条明确规定:药品生产、经营企业和医疗卫生机构必须指定专(兼)职人员负责本单位生产、经营、使用药品的不良反应报告和监测工作,发现可能与用药有关的不良反应应详细记录、调查、分析、评价、处理,并填写《药品不良反应/事件报告表》,每季度集中向所在地的省、自治区、直辖市药品不良反应监测中心报告,其中新的或严重的药品不良反应应于发现之日起15日内报告,死亡病例须及时报告。 (一)填写注意事项: 1.《办法》第十四条规定:《药品不良反应/事件报告表》的填报内容应真实、完整、准确。 2.《药品不良反应/事件报告表》是药品安全性监测工作的重要档案资料,手工报表需要长期保存,因此需用钢笔、签字笔书写,填写内容、签署意见(包括有关人员的签字)字迹要清楚,不得用报告表中未规定的符号、代号、不通用的缩写形式和花体式签名。其中选择项画“√”,叙述项应准确、完整、简明,不得有缺漏项。 3.每一个病人填写一张报告表。 4.个人报告建议由专业人员填写,可以是诊治医务人员、药品生产、经营企业专(兼)职人员及专业监测机构人员。 5.尽可能详细地填写报告表中所要求的项目。有些内容无法获得时,填写“不详。 6.对于报告表中的描述性内容,如果报告表提供的空间不够,可另附A4纸说明。在纸的顶部注明“附件”,所有的附件应按顺序标明页码,附件中必须指出描述项目的名称。
7.补充报告:如需作补充报告时,请注意与原报表编号保持一致,并在报告左上方注明“补充报告”,与原报表重复的部分可不必再填写。补充报告也可不填写报告表,只需附纸说明补充内容即可,但须注明原报表编号、单位名称、补充报告时间、报告人。 (二)填写详细要求 1.新的、严重、一般: 新的ADR:是指药品说明书中未载明的ADR。 严重ADR:是指因服用药品引起以下损害情形之一的反应: ⑴引起死亡; ⑵致癌、致畸、致出生缺陷; ⑶对生命有危险并能够导致人体永久的或显著的伤残; ⑷对器官功能产生永久损伤; ⑸导致住院或住院时间延长。 一般的ADR:是指除新的、严重的ADR以外的所有ADR。 2.单位名称:填写医疗卫生机构、药品生产企业或经营企业的完整全称。如:“镇江市第一人民医院”,不可填“一院”。 3.部门:填写报告单位的具体报告部门, 应填写标准全称或简称,如:“普通外科二病房”或“普外二”,如连锁药店应填具体的门店,零售药店可填写药店名称。
医院药品不良反应总结分析报告 年药品不良反应分析、反馈报告2014监测是合理用药的重)药品不良反应(ADR减少医患是关系到广大患者用药安全,要依据,年共收集上报2014纠纷的一项重要工作。我院
。例增加了年的7190.14%135例ADR,较2013了解ADR报告进行统计、分析,现就2014年的的一般规律和特征,为临床合理用药提供ADR 依据。报告人包括医生报告人职业和科室分布;药份,占90.37%和药师,其中医生上报12218ADR报告来自全院份,占9.63%。13师上报例门诊患者。详见3个科室,132例住院患者,。表1上报科室排序1 2014年ADR表例数(例)构成比科室11.85% 16 外三病区
11.11% 15 内一病区 11.11% 15 内二病区 10.37% 14 内四病区 8.89% 12 内三病区 7.41% 临床药学室10 5.93% 8 外一病区 5.83% 8 儿科病区 5.19% (肛中医二病区7 肠)5.19% 7 中医一病区 3.70% 5 外四病区 3.70% (康中医二病区5 复)
2.96% 4 ICU综合组 1.48% 2 妇产科病区 1.48% 2 住院药房 1.48% 2 门诊急诊科 1.48% 2 外二病区0.74% 门诊西药房 1 100% 135 合计 发AD的患者性别及年龄分布情例,中,男81例,女54ADR在报告的135例 1-95
岁,情况详见表2。年龄分布区间为表2 患者年龄分布情况百分比年龄例数1.48% 2 1小于岁2.22% 1-4岁 3 2.96% 4 5-14岁22.96% 31 岁 15-4428.15% 岁38 45-6442.22% 6557 岁及其以上100% 总计135 用药情况分析用药途径包括静脉给药及 口服、皮下注射等。最常见仍为静脉滴注,占. 3:74.85%。详细统计见表表3:给药途 径统计排名 给药途径一般严重总计 例次百分例次百分比例次
药品不良反应报告表填写要求 (试用教案) 培训题目:药品不良反应报告表如何填写 培训学时:1个学时 培训方式:集中授课 主要容: 第一部分:药品不良反应/事件的填写要求 第二部分:药品群体不良事件基本信息表的填写要求 药品不良反应报告表填写要求 一、药品不良反应报告表填写要求 《药品不良反应报告和监测管理办法》(以下简称《办法》)(卫生部令第81号)2011年05月04日发布,《办法》中针对不同报告类型提供了三份表格,分别是《药品不良反应/事件报告表》、《群体不良事件基本信息表》和《境外发生品不良反应/事件报告表》;为全面贯彻落实《办法》,下面将分别对三份表格填写要求进行详细的说明。 二、《药品不良反应/事件报告表》 1.法规依据 《药品不良反应报告和监测管理办法》 第十九条药品生产、经营企业和医疗机构应当主动收集药品不良反应,获知或者发现药品不良反应后应当详细记录、分析和处理,填写《药品不良反应/事件报告表》(见附表1)并报告。 第二十条新药监测期的国产药品应当报告该药品的所有不良反应;其他国产药品,报告新的和严重的不良反应。 进口药品自首次获准进口之日起5年,报告该进口药品的所有不良反应;满5年的,报告新的和严重的不良反应。 第二十一条药品生产、经营企业和医疗机构发现或者获知新的、严重的药品不良反应应当在15日报告,其中死亡病例须立即报告;其他药品不良反应应当在30日报告。有随访信息
的,应当及时报告。 2.新旧表格的不同--详见ppt 3.填写详细要求 目前国家药品不良反应监测中心制定的《药品不良反应/事件报告表》可大致分为报告基本情况、患者基本情况、使用药品情况、ADR过程描述、关联性评价、报告人报告单位信息六部分。 3.1报告的基本信息 首次报告□跟踪报告□ 如果报告的是跟踪报告,如果报告的是跟踪报告,搜索到原始报告后在原始报告上进行修改,补充资料后保存。 编码 是报告单位部编码,电子上报后自动形成的编码,报告单位要记录在纸制报告上 报告类型 新的□严重□一般□ 新的药品不良反应,是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。 (原:新的药品不良反应是指药品说明书中未载明的不良反应。) 严重药品不良反应,是指因使用药品引起以下损害情形之一的反应: 1.导致死亡; 2.危及生命; 3.致癌、致畸、致出生缺陷; 4.导致显著的或者永久的人体伤残或者器官功能的损伤; 5.导致住院或者住院时间延长; 6.导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。 一般:新的、严重的药品不良反应以外的所有不良反应 报告单位类别 医疗机构□生产企业□经营企业□个人□其他 选择药品不良反应报告表的填报单位的类型
我院药品不良反应上报情况分析与评价 目的分析我院药品不良反应(ADR)发生的特点及规律,为临床合理用药提供参考。方法对我院2015年上报的ADR报告进行分析、评价。结果2015年我院共上报201例ADR。其中,一般的ADR 108例(53.7%),新的一般的ADR 67例(33.3%),严重的ADR 20例(10.0%),新的严重的ADR 6例(3.0%);男性患者90例(44.8%),女性患者111例(55.2%);40~79岁患者构成比最高;给药途径中以静脉滴注的比例最高(84.6%);引起ADR发生率最高的药物为抗感染药(26.7%);主要累及的系统/ 器官为皮肤及附件(37.3%)。结论我院应进一步加强ADR的监管与防范,规范临床用药,加强患者用药宣传,确保用药安全。 [Abstract] Objective To analyze the characteristics,regularity of adverse drug reaction (ADR)reports so as to provide reference for the rational use of drugs in clinic. Methods ADR reports collected in Affiliated Hospital of North Sichuan Medical College in 2015 were analyzed and evaluated. Results There were 201 ADR reports collected in our hospital in 2015.Among the ADR reports,there were 108 cases(53.7%)common ADR,67 cases (33.3%)of new and common ADR,20 cases (10.0%)were severe ADR and 6 cases (3.0%)were new and severe ADR; 90 cases (44.8%)were male and 111 cases (55.2%)were female;Patients aged from 40 to 79 years accounted for the largest proportion;The main administration route causing ADR was intravenous infusion (84.6%);The most frequency in suspected drugs was anti-infective drugs (26.7%);Skin and appendages damage was the most frequent ADR (37.3%). Conclusion Our hospital should strengthen ADR monitoring and prevention,clinical medication should be further standardized and the related knowledge of drugs should be publicized to ensure the patients′ medication safety. [Key words] Adverse drug reaction;Analysis;Evaluation 药品不良反应(adverse drug reaction,ADR)是指合格药品在正常用法用量下出现的与用药目的无关的有害反应[1],不仅加重患者的不适和痛苦,还会带给家庭、社会沉重的负担。近年来,随着临床用药品种日益增多,人均用药率、群体用药频度和数量不断上升,ADR引发的问题更加突出和严峻[2]。对ADR 进行监测和处理,分析评价报告是设置药物安全界限的有效保障,同时也是促进临床安全、合理用药的重要手段[3]。现通过回顾性分析统计我院2015年上报的ADR,探讨ADR的发生规律及特点,以保障临床安全合理用药。 1 资料与方法 1.1 资料来源 检索2015年由我院上报国家药品不良反应监测系统中所有的ADR报告。
目的:确保药品不良反应报告和监测工作的有效开展,有效控制药品风险,保障公众用药安全,建立药品不良反应组织机构及运行体系。 适用范围:适用于公司药品不良反应报告和监测工作。 责任人:药品不良反应办公室、质量保证部、后勤部、销售公司、科研中心 内容: 1.组织机构简图 2. 体系运行 2.1 信息采集途径 2.1.1 信息采集途径包括被动收集:销售人员、400热线投诉电话,和主动收集:上市前和上市后的临床研究、文献检索、国内外政府网站。 2.1.2 信息采集技巧:第一时间了解:判断事情的严重性。是否停药?是否上报?是否召回? 第一时间控制:控制医生态度,控制患者情绪; 第一时间反馈:及时反馈至ADR管理员或药品不良反应办公室主任; 长期应对准备:掌握我公司产品主要不良反应及质量特性等,并具有一定的ADR判断能力,若不能独立解答患者疑问,切忌给予医疗服务建议,药品不良反应办公室给予支持。 信息收集要全:因其他原因不能全面收集ADR信息,至少收集以上四要素及时反馈至ADR管理员处,协助做好相关沟通工作。 2.2 单个病例管理 2.2.1 单个病例处理流程:收集(多渠道)→报告公司关联性评价→随访→上报ADR监测系统→纳入公司不良反应病例数据库。 2.2.2 出现药品不良反应及出现其他情况均应报告,即使没有伴随具体的不良事件,如: ·说明书已知一般不良反应、严重不良反应和新的不良反应 ·因药品停用而发生的事件 ·超适应症用药 ·孕妇暴露
·药品无效 ·用药错误 ·死亡结局 ·出现未预期的治疗/临床益处 2.2.3 临床试验安全性信息报告 临床试验定义:任何在人体(病人或健康志愿者)进行的药物系统性研究,以证实或揭示试验药物的作用、不良反应或试验药物吸收、分布、代谢和排泄,其目的是确定试验药物的疗效与安全性。 临床试验类别:I、Ⅱ、Ⅲ、IV期临床试验、生物等效性试验、重点监测、一致性评价、临床有效性试验及其他安全与疗效对比研究等。 上报流程: 研究者上报所有不良事件;申办方上报严重不良事件(时限:死亡和危及生命为7天,其他情况15天),以电话、传真或EMS邮寄的形式向CFDA注册司、BFDA注册处及卫计委提交首次报告,及时提交随访报告,并将收集的所有不良事件报告1个工作日内反馈至公司不良反应办公室;不良反应办公室按法规时限要求上报上市后临床研究不良反应,上市前不良反应长期保存,待产品上市后纳入不良反应数据库并带入PSUR中。 2.2.4 个例不良反应/事件评价、上报 2.2.4.1 不良反应/事件类型: 依据《药品不良反应和监测管理办法》对一般的、新的和严重的不良反应的定义,对比说明书中不良反应描述,确定不良反应/事件的类型。 2.2.4.2 不良反应/事件关联性评价: 从时间相关性、药理作用/同类药物反应、去激发、再激发、剂量等方面对不良事件与药品之间关系进行评定。同时考虑的其他因素:原患疾病、相互作用、伴随药物、伴发疾病。时间相关性:用药前、用药过程中或延迟发生不良反应的可能。 2.2.4.3 药理作用/同类药物反应:不良事件发生时间是否与药理/毒理反应一致,同类药物的不良反应。 去激发:停药观察,去激发是否为阳性 再激发:去激发后再次给药观察,再激发是否为阳性。 给药剂量:规定给药剂量与实际给药剂量是否一致。 原患疾病:分析不良事件是否为原患疾病的症状,或治疗适应症的自然进程。 药物相互作用:协同作用、拮抗作用、配伍禁忌。 伴随药物/伴发疾病:是否导致不良事件的发生。 其他因素:是否存在其他风险因素,如吸烟史、饮酒史、过敏史、家族病史及不良反应病史等。
药品不良反应病例报告填写录入规范 (试行) 总则 1.目的:为了规范报表填写录入,提高报表质量,加快上报效率,提取有效预警信号,综合我院日常报表填写录入存在的问题和药品不良反应监测报告填报要求,特制定本规范。 2.依据:《药品不良反应报告和监测管理办法》和《江苏省药品不良反应监测工作暂行规定》。第二章基本要求 3.《药品不良反应报告表》的填报内容应真实、完整、准确,符合规定时限。 新的、严重的药品不良反应应当在15日内报告,其中死亡病例须立即报告;其他药品不良反应应当在30日内报告。有随访信息的,应当及时报告。(此为上报监测中心时限) 4.药品不良反应名称填写应准确、完整。新的药品不良反应要认真核对说明书。 5.所有的不良反应要核对是否有并用药品。 6.不良反应过程描述及处理情况应详细规范填写,如有并用药品,则应包含并用药品使用情况。 7.药品信息项下的怀疑和并用药品的药品通用名称、药品生产企业名称、药品生产批号应真实、完整、准确。生产批号应认真核对,必要时进行核实。有并用药品的,药品信息项不能缺少并用药品信息。 8.审核员在收到报告表之后,要对报告表进行认真审核,如发现生产企业名称相同、不良反应表现类似、不良反应发生时间和地点比较集中、药品名称和批号相同等聚集性特点的报告,应密切关注,及时进行核实,报告医院药品不良反应监测办公室,由医院药品不良反应监测办公室报告市级药品监督管理部门,上报省药品不良反应监测中心。 第三章一般信息 9.报告类别:新的□严重□一般□ 分一般的、严重的、新的一般、新的严重四类。 (1)一般的:是指药品说明书中载明的不良反应; (2)严重的:是指药品说明书中载明且符合严重药品不良反应判定5条标准之一的;
2014年药品不良反应分析、反馈报告 药品不良反应(ADR)监测是合理用药的重要依据,是关系到广大患者用药安全,减少医患纠纷的一项重要工作。我院2014年共收集上报135例ADR,较2013年的71例增加了90.14%。现就2014年的ADR报告进行统计、分析,了解ADR的一般规律和特征,为临床合理用药提供依据。 报告人职业和科室分布报告人包括医生和药师,其中医生上报122份,占90.37%;药师上报13份,占9.63%。ADR报告来自全院18个科室,132例住院患者,3例门诊患者。详见表1。 表1 2014年ADR上报科室排序 科室例数(例)构成比 外三病区16 11.85% 内一病区15 11.11% 内二病区15 11.11% 内四病区14 10.37% 内三病区12 8.89% 临床药学室10 7.41% 外一病区8 5.93% 儿科病区8 5.83% 中医二病区(肛肠)7 5.19% 中医一病区7 5.19% 外四病区 5 3.70% 中医二病区(康复) 5 3.70% ICU综合组 4 2.96% 妇产科病区 2 1.48% 住院药房 2 1.48% 门诊急诊科 2 1.48% 外二病区 2 1.48% 门诊西药房 1 0.74% 合计135 100% 发生ADR的患者性别及年龄分布情况在报告的135例ADR中,男81例,女54例,年龄分布区间为1-95岁,情况详见表2。 表2 患者年龄分布情况 年龄例数百分比 小于1岁 2 1.48% 1-4岁 3 2.22% 5-14岁 4 2.96% 15-44岁31 22.96%
45-64岁38 28.15% 65岁及其以上57 42.22% 总计135 100% 用药情况分析用药途径包括静脉给药及口服、皮下注射等。最常见仍为静脉滴注,占 74.85%。详细统计见表3: 表3:给药途径统计排名 给药途径一般严重总计 例次百分比例次百分比例次静脉滴注116 95.08% 6 4.92% 122 口服19 76.0% 6 24.0% 25 皮下注射 3 75.0% 1 25.0% 4 泵内注射 2 100.0% 0 0.0% 2 皮内注射 2 100.0% 0 0.0% 2 静脉注射 1 50.0% 1 50.0% 2 鞘内给药0 0.0% 2 100.0% 2 灌注 1 100.0% 0 0.0% 1 肌内注射 1 100.0% 0 0.0% 1 阴道给药 1 100.0% 0 0.0% 1 鼻饲 1 100.0% 0 0.0% 1 总计147 90.18% 16 9.82% 163 引起ADR的可疑药物共包含73个品种,可疑药品依据药理作用分类,共包括10种药 物;其品种数及上报次数排名统计结果见表4所示: 表4 药物类别品种数排名及上报次数排名 药物类别品种数构成比(%)上报次数构成比(%) 抗感染药物21 28.77 55 33.74 中药注射剂7 9.59 41 25.15 循环系统药物 5 6.85 9 5.52 血液系统药物8 10.96 11 6.75 神经系统药物 4 5.48 9 5.52 呼吸系统药物 2 2.74 4 2.45 消化系统药物 3 4.11 4 2.45 镇痛药物 6 8.22 10 6.13 内分泌系统药物 6 8.22 7 4.29 其他专科用药11 10.87 13 12.90 合计73 100.00 163 100.00 由表4可见,引起ADR例数最多的为抗感染药物,其所含品种数也最多,排名第二 的则为中药注射剂。 将2014年上报次数排名前10位的药品进行排序,见表5所示: