
新型絮凝剂絮凝沉降矿山尾矿水试验报告
一、试验目的
了解一种新型絮凝剂的作用效果。
二、基本原理
悬浮液中的细小固体颗粒表面带有电荷,由于排斥作用而分散。为达到悬浮颗粒快速沉降的目的,可以通过两种技术手段实现。
1.消除或减少矿物颗粒表面电荷,使颗粒间静电斥力消失或较少,从而使固体颗粒间相互依附而团聚成絮体。通常采用无机电解质凝聚剂可以抵消颗粒表面的电荷,然后靠颗粒间的吸附作用聚团。
2. 有机高分子凝剂,主要通过高分子的活性基团的架桥作用使颗粒形成絮团,利用吸附架桥、网捕作用使悬浮颗粒相互粘附,形成絮体而沉降。
以上两种方式的配合使用往往效果更佳。
实验采用新药剂与传统药剂聚丙烯酰胺进行对比。加入药剂以后,搅拌,沉淀,观察上清液状态,并抽取上清液测定SS含量,计算SS去除率。
三、仪器设备及材料
1. 带橡胶塞的磨口圆柱量筒,容量为1000ML;
2.烧杯与锥形瓶,容量分别为1000mL和500mL;
3.磁力搅拌器,调速范围250~1000r/min;
4.直管吸管,容量50mL;
5.大肚吸管,容量50mL和100mL;
6.称量瓶,60×30mm;
7.粉状聚丙烯酰胺;
8.粉状新药剂
9.浮选尾矿废水50升。
四、试验过程及步骤
(一)药剂配制
聚丙烯酰胺,配制0.5%浓度,200mL;
新型药剂,①研成细粉,-200目75%,干粉;②配制0.5%浓度,200mL。
(二)进行沉降试验
采用对比试验进行,每种废水均分成2份,进行两种药剂沉淀对比试验。
将废水混匀,注入500mL烧杯,进行磁力搅拌,加入药剂,搅拌5分钟,
而后注入500mL量筒,上下颠倒5次混匀,静止观察沉淀效果,测定泥水界面形成时间和位置,15分钟后,抽取上清液至泥水界面上1cm处。
测量沉积物高度,测定上清液及剩余沉泥中SS含量。
(三)计算原水SS含量,计算SS去除率,计算泥水界面沉降速度。
(四)改变药剂投加量重复上述过程。
五、试验数据处理及实验报告
处理对象:选矿厂尾矿废水
试验开始新药剂采用干粉添加,水样为含高浓度SS的矿山尾矿浆,从现象看,当新药剂用量达到100mg/L时,配合强烈的搅拌,絮体生成较快,沉降迅速,500mL烧杯中5分钟上清液即清澈透明。沉淀效果较好。试验中发现搅拌时间越长效果越好,分析可能是药剂分散不足。后改为0.5%浓度的水溶液添加。
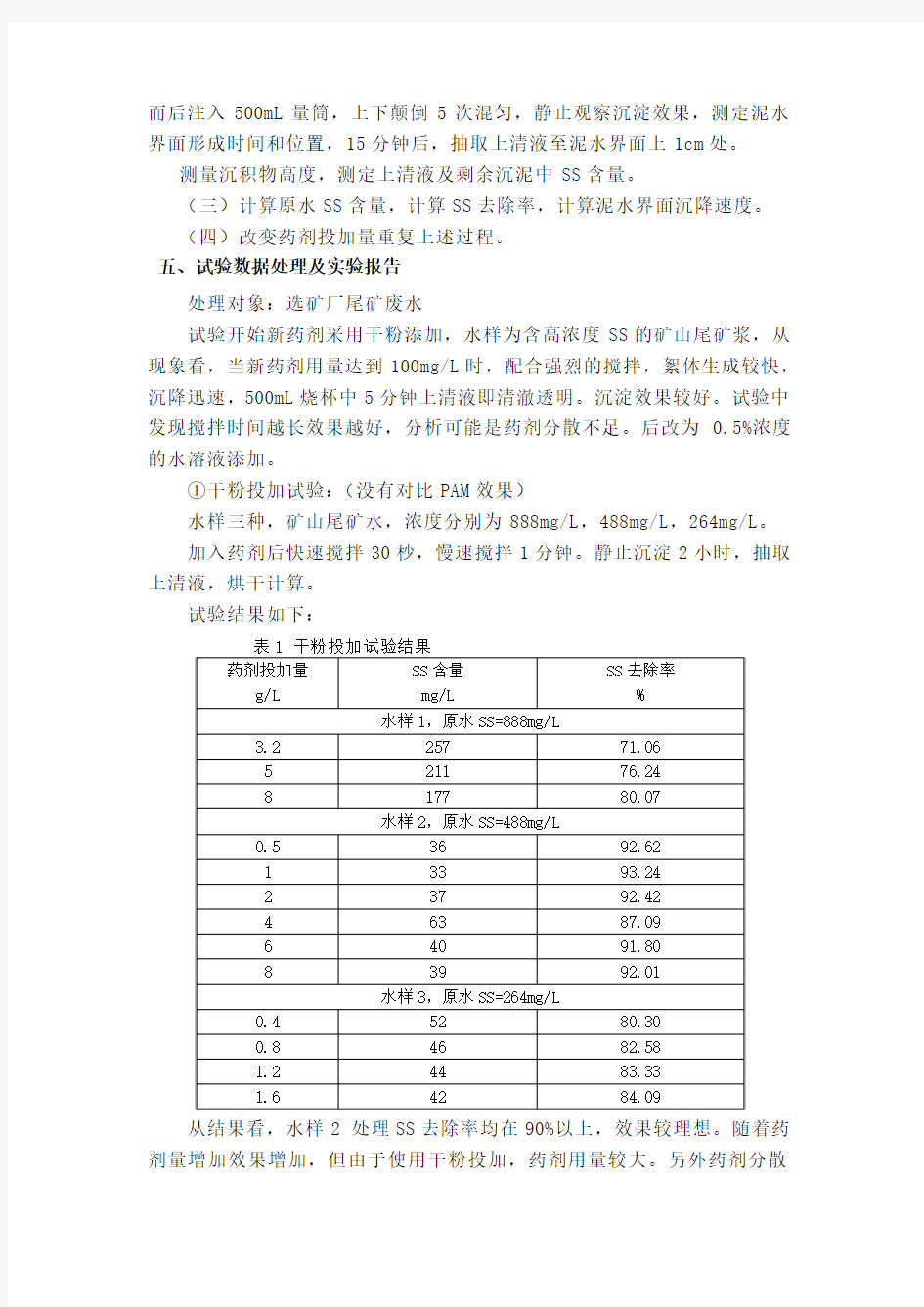
①干粉投加试验:(没有对比PAM效果)
水样三种,矿山尾矿水,浓度分别为888mg/L,488mg/L,264mg/L。
加入药剂后快速搅拌30秒,慢速搅拌1分钟。静止沉淀2小时,抽取上清液,烘干计算。
试验结果如下:
从结果看,水样2 处理SS去除率均在90%以上,效果较理想。随着药剂量增加效果增加,但由于使用干粉投加,药剂用量较大。另外药剂分散
性对最终效果影响较大。
②用水配制成0.5%水溶液药剂投加。
送来的药剂颗粒较大,溶解时,水溶液中存在较多大颗粒不溶物,后经磨细处理再配制水溶液,仍有小颗粒不溶物,吸水后颗粒会膨胀变大。
试验中药剂投加后,首先快速搅拌30秒,再慢速搅拌60秒。倒入500mL 量筒中,反复颠倒混合5次,然后静止沉淀。
试验共使用了三种水样,均为矿山尾矿,第一种SS含量很高,达45600mg/L,里面含有少量沉降速度较快的粗颗粒铁矿砂及石英矿砂,第二种SS浓度为16800mg/L,含少量细颗粒铁矿砂和石英砂,第三种SS为810mg/L,主要为细颗粒石英砂及细泥。
首先做了高浓度SS废水的沉淀试验,药剂用量均为50mg/L,从试验现象看两者处理效果都非常理想,形成絮体速度均较快,矾花较大,沉降速度快,泥水界面在30秒左右均沉降至50mL位置。10分钟内上清液即外观清澈。鉴于沉降效果较好,降低用药量至10mg/L,从试验现象看,SS沉降速度仍然较快,上清液在12分钟内即达到外观澄清。
可见采用事先配制成0.5%的药剂,由于药剂溶解,分散性较好,用药量大幅度降低。从新药剂的作用效果看,处理高浓度矿山尾矿,新药剂与PAM作用效果相当。处理较低浓度的尾矿废水,新药剂较单独使用聚丙烯酰胺效果要好,三种水样采用新药剂絮凝沉淀,对SS的去除率均在90%以上。
六、实验结论
新药剂具有良好的絮凝作用,絮体沉降速度较快。采用新药剂处理矿山尾矿沉降效果良好,尤其对高浓度的尾矿水,SS去除率均达到90%以上,且沉淀时间短。考虑实际应用,新药剂投加量可设定在10~50mg/L废水。
本次试验只对送来的新型药剂及就矿山尾矿水沉淀效果负责。
六、建议
新药剂实验室试验沉降效果较好,建议到矿山尾矿处理车间进行工业试验。试验时采用浓度1~2%水溶液投加,药剂提前24小时配制,药剂用量每立方米尾矿水投加1%浓度药剂1L~5L,相当于10~50mg/L尾矿废水。实验室试验时发现配制的水溶液中,有一定量的絮体形式药剂不能充分溶解,不影响正常使用,但要注意防止对投加管路的阻塞,建议溶解前进行磨细处理。
试验人:
2009年9月28日
实验一自由沉降实验 一、实验目的 1、观察自由沉降过程; 2、通过沉降实验学会绘制E~t 关系曲线和E~u 关系曲线; 3、能正确运用数据求解总去除率E T 。 二、实验原理 在含有离散颗粒的废水静置沉淀过程中,若试验柱内有效水深为H ,通过不同的沉淀时间t ,可求得不同的颗粒沉淀速度u ,u=H/t 。如以p 0表示沉速u 免疫共沉淀实验原理与方法
免疫共沉淀实验原理及方法 免疫共沉淀(CoIP)概述及原理 免疫共沉淀(Co-Immunoprecipitation,CoIP)是研究蛋白-蛋白间相互作用的经典方法,属于免疫沉淀技术的一类,常被用于鉴定特定蛋白复合物的中未知蛋白组分。免疫共沉淀的设计理念是,假设一种已知蛋白是某个大的蛋白复合物的组成成员,那么利用这种蛋白的特异性抗体,就可能将整个蛋白复合物从溶液中“拉”下来(常说的“pull-down”),进而可以用于鉴定这个蛋白复合物中的其他未知成员。免疫共沉淀的特点可以概括为两点,第一是天然状态,第二是蛋白复合物。 免疫共沉淀的优势: 与其他研究蛋白质相互作用技术(如GST-Pull down、酵母双杂交等)相比,免疫共沉淀鉴定的相互作用蛋白是在细胞内与目的蛋白发生的天然结合,避免了人为的影响,因此符合体内实际情况,得到的蛋白可信度更高。 免疫共沉淀的局限性和注意事项: 1. 免疫共沉淀是建立在蛋白复合物成员间彼此紧密结合的基础上,意味着松散结合的蛋白组分很可能检测不到; 2. 由于蛋白质形成复合物以后,某些表位就会被掩盖,因此可能导致使用某一种pull-down抗体,无论怎么增加抗体浓度,也极少能将不到一半的目标蛋白复合物沉淀出来,如有必要最好使用多种不同抗体分别进行CoIP;
3. 由于检测的是天然状态,因此在不同的时间和不同的处理下,CoIP拉下来的蛋白复合物都可能是不同的,当然随着实验次数的增加,得到的蛋白复合物成员也会越来越庞大; 4. 如果使用Western Blot的方法检测的蛋白复合物中的目标蛋白,则需要在试验前进行预测,具有一定的冒险性;当然如果将蛋白复合物直接进行质谱分析就不存在上述问题,但需要得到较高纯度和浓度的蛋白复合物样品也非易事,并且成本较高; 5. CoIP鉴定得到的蛋白间相互作用可能是直接作用也可能是间接作用,进一步区分还需要进行GST-Pull down等实验检测; 6. 为了保证CoIP实验的可靠性和严谨性,需要使用复合物的不同成员分别独立进行CoIP实验,并且结果应该能够彼此验证,因为原则上使用复合物的任一成员进行CoIP都会得到其他所有成员[1] 免疫共沉淀的一般操作流程(中英文对照):
实验项目名称: 颗粒自由沉淀实验 (所属课程: 水污染控制工程 ) 院 系: 专业班级: 姓 名: 学 号: 实验日期: 实验地点: 合作者: 指导教师: 本实验项目成绩: 教师签字: 日期: 一、实验目的 (1) 加深对自由沉淀特点、基本概念及沉淀规律的理解。 (2) 掌握颗粒自由沉淀实验的方法,并能对实验数据进行分析、整理、计算和绘制颗粒自由沉淀曲线。 二、实验原理 浓度较稀的、粒状颗粒的沉淀属于自由沉淀,其特点是静沉过程中颗粒互不 干扰、等速下沉,其沉速在层流区符合 Stokes 公式。但是由于水中颗粒的复杂性,颗粒粒径、颗粒比重很难或无法准确地测定,因而沉淀效果、特性无法通过公式求得,而是要通过静沉实验确定。 由于自由沉淀时颗粒是等速下沉,下沉速度与沉淀高度无关,因而自由沉淀 可在一般沉淀柱内进行,但其直径应足够大,一般应使 D ≥100mm 以免颗粒沉淀受柱壁干扰。 具有大小不同颗粒的悬浮物静沉总去除率E 与截留速度u0、颗粒质量分数的关系如下 此种计算方法也称为悬浮物去除率的累积曲线计算法。 设在一水深为H 的沉淀柱内进行自由沉淀实验,实验开始时,沉淀时间为0,此时沉淀柱内悬浮物分布是均匀的,即每个断面上颗粒的数量与粒径的组成相同,悬浮物浓度为C0(mg/L ),此时去除率E=0。 实验开始后,悬浮物在筒内的分布变得不均匀。不同沉淀时间ti ,颗粒下沉到池底的最小沉淀速度u i 相应为u i =H/t i 。此时为t i 时间内沉到池底(此处为取样点)的最小颗粒d i 所具有的沉速。此时取样点处水样水样悬浮物浓度为Ci ,则颗粒总去除率: 00011C C C C C P E i i i -=-= -=。
自由沉淀实验报告 一、实验目的 1. 加深对自由沉淀特点、基本概念及沉淀规律的理解。 2. 掌握颗粒白由沉淀实验的方法,并能对实验数据进行分析、整理、计算和绘制颗粒自由沉淀曲线。 二、实验原理 浓度较稀的、粒状颗粒的沉淀属于自由沉淀.其特点是静沉过程中颗粒互不干扰、等速下沉,其沉速公层流区符合Stokes(斯托克斯)公式。但是由于水中颗粒的复杂性,颗粒粒径、颗粒密度很难或无法准确地测定,因而沉淀效果、特性无法通过公式求得而是通过静沉实验确定。 由于自由沉淀时颗粒是等速下沉,下沉速度与沉淀高度无关、因而自由沉淀可在一般沉淀柱内进行,但其直径应足够大,一般应使D>100mm,以免颗粒沉淀受柱壁干扰。 具有大小不同颗粒的悬浮物静沉总去除率E与截留速度u o、颗粒质量分数的关系如下: E=1?P0+ u s u0 dp P0 此种计算方法也称为悬浮物去除率的累积曲线计算法。 设在一水深为H的沉淀柱内进行自由沉淀实验,如图2-1所示。实验开始,沉淀时间为0,此时沉淀柱内悬浮物分布是均匀的,即每个断面上颗粒的数量与粒径的组成相同,悬浮物浓度为C0(mg/L),此时去除率E=0。
图2-1 自由沉淀示意 实验开始后,不同沉淀时间t i颗粒最小沉淀速度u i相应为 u i=H i 此即为t i时间内从水面下沉到池底(此处为取样点)的最小颗粒d i所具有的沉速。此时取样点处水样悬浮物浓度为C i而 C0?C i C0=1? C i C0 =1?P i P i=E0 此时去除率E0,表示具有沉速u≥u i(粒径d≥d i)的颗粒去除率,而 P i=C i C0 则反映了t i时,未被去除之颗粒即d<d i的颗粒所占的百分比。 实际上沉淀时间t i内,由水中沉至池底的颗粒是由两部分颗粒组成。即沉速u≥u i 的那一部分颗粒能全部沉至池底;除此之外.颗粒沉速u0<u i的那一部分颗粒,也有一部分能沉至池底。这是因为,这部分颗粒虽然粒径很小,沉速u0<u i,但是这部分颗粒并不都在水面,而是均匀地分布在整个沉淀柱的高度内。因此只要在水面下,它们下沉至池底所用的时间能少于或等于具有沉速u i的颗粒由水面降至池底所用的时间t i,那么这部分颗粒也能从水中被除去。 沉速u0<u i的那部分颗粒虽然有一部分能从水中去除,但其中也是粒径大的沉到池底的多,粒径小的沉到池底的少.各种粒径颗粒去除率并不相同。因此若能分别求出各种粒径的颗粒占全部颗粒的百分比,并求出该粒径颗粒在时间t i内能沉至池底的颗粒占本粒径颗粒的百分比,则二者乘积即为此种粒径颗粒在全部颗
实验二自由沉淀 一、实验目的 1、观察沉淀过程,加深对自由沉淀特点、基本概念及沉淀规律的理解; 2、掌握颗粒自由沉淀实验的方法,求出沉淀曲线。 二、实验原理 浓度较稀的、粒状颗粒的沉淀属于自由沉淀,其特点是静沉过程中颗粒互不干扰、等速下沉,其沉速在层流区符合Stokes公式。 由于水中颗粒的复杂性,颗粒粒径、颗粒比重很难或无法准确地测定,因而沉淀效果、特性无法通过公式求得,而是要通过静沉实验确定。 由于自由沉淀时颗粒是等速下沉,下沉速度与沉淀高度无关,因而自由沉淀可在一般沉淀柱内进行,但其直径应足够大,一般应使D≥100mm以免颗粒沉 图1 自由沉淀实验装置图 1、沉淀柱 2、水泵 3、水箱 4、支架 5、气体流量计 6、气体入口 7、排水口 8、取样口 一般来说,自由沉淀实验可按以下两个方法进行: (一)底部取样法 底部取样法的沉淀效率通过曲线积分求得。设在一水深为H的沉淀柱内进行自由沉淀实验,如图1所示。将取样口设在水深H处,实验开始时(t=0),整个实验筒内悬浮物颗粒浓度均为C0。分别在t1、t2、……、t n时刻取样,分别测
得浓度为C 1、C 2、……C n 。那么,在时间恰好为t 1、t 2、……、t n 时,沉速为h/t 1=u 1、h/t 2=u 2、……、h/t n =u n 的颗粒恰好通过取样口向下沉,相应地这些颗粒在高度H 中已不复存在了。记p i =C i /C 0,则1-p i 代表时间t i 内高度H 中完全去除的颗粒百分数,p j -p k (k>j≥i )代表沉速位于u j 和u k 之间的颗粒百分数,在时间t i 内,这部分颗粒的去除百分数为()/2 ()j k j k i u u p p u +?-,当j 、k 无限接近时, ()/2 ()j k j j k j i i u u u p p dp u u +?-= 。这样,在时间t i 内,沉淀柱的总沉淀效率0(1)i p j i j i u P p dp u =-+? 。实际操作过程中,可绘出p-u 曲线并通过积分求出沉淀 效率。 (二) 中部取样法 与底部取样法不同的是,中部取样法将取样口设在沉淀柱有效沉淀高度(H )的中部。 实验开始时,沉淀时间为0,此时沉淀柱内悬浮物分布是均匀的,即每个断面上颗粒的数量与粒径的组成相同,悬浮物浓度为C 0(mg/l ),此时去除率E=0。 实验开始后,悬浮物在筒内的分布变得不均匀。不同沉淀时间t i ,颗粒下沉到池底的最小沉淀速度u i 相应为i i t H u =。严格来说,此时应将实验筒内有效水深H 的全部水样取出,测量其悬浮物含量,来计算出t i 时间内的沉淀效率。但这样工作量太大,而且每个实验筒只能求一个沉淀时间的沉淀效率。为了克服上述弊病,又考虑到实验筒内悬浮物浓度随水深的变化,所以我们提出的实验方法是将取样口装在H/2处,近似地认为该处水样的悬浮物浓度代表整个有效水深内悬浮物的平均浓度。我们认为这样做在工程上的误差是允许的,而实验及测定工作也可以大为简化,在一个实验筒内就可以多次取样,完成沉淀曲线的实验。假设此时取样点处水样水样悬浮物浓度为C i ,则颗粒总去除率000011C C C C C P E i i i -=-=-=。而0 C C P i i =则反映了t i 时未被去除的颗粒(即d 实验项目名称:絮凝沉淀实验 (所属课程:水污染控制工程) 院系:专业班级:姓名:学号: 实验日期:实验地点:合作者:指导教师: 本实验项目成绩:教师签字:日期: 一、实验目的 (1)加深对絮凝沉淀的特点、基本概念及沉淀规律的理解。 (2)掌握絮凝实验方法,并能利用实验数据绘制絮凝沉淀静沉曲 二、实验原理 悬浮物浓度不太高,一般在600~700mg/L以下的絮状颗粒的沉淀属于絮凝沉淀,如给水工程中混凝沉淀、污水处理中初沉池内的悬浮物沉淀均属此类。沉淀过程中由于颗粒相互碰撞,凝聚变大,沉速不断加大,因此颗粒沉速实际上是一变速。这里所说的絮凝沉淀颗粒沉速,是指颗粒沉淀平均速度。在平流沉淀池中,颗粒沉淀轨迹是一曲线,而不同于自由沉淀的直线运动。在沉淀池内颗粒去除率不仅与颗粒沉速有关,而且与沉淀有效水深有关。因此沉淀柱不仅要考虑器壁对悬浮物沉淀的影响,还要考虑柱高对沉淀效率的影响。 静沉中絮凝沉淀颗粒去除率的计算基本思想与自由沉淀一致,但方法有所不同。自由沉淀采用累积曲线法,而絮涨沉淀采用的是纵深分析法,颗粒去除率按下式计算。 三、实验设备与试剂 (1)沉淀柱:有机玻璃沉淀柱,内径D≥100mm,高H=3.6m,沿不同高度设有取样口,如图所示。管最上为溢流孔,管下为进水孔,共五套。 (2)配水及投配系统:钢板水池,搅拌装置、水泵、配水管。 (3)定时钟、烧杯、移液管、瓷盘等。 (4)悬浮物定量分析所需设备及用具:万分之一分析天平,带盖称量瓶、干燥皿、烘箱、抽滤装置,定量滤纸等。 (5)水样:城市污水、制革污水、造纸污水或人工配制水样等。 四、实验步骤 (1)将欲测水样倒入水池进行搅拌,待搅拌匀后取样测定原水悬浮物浓度SS值。(2)开启水泵,打开水泵的上水闸门和各沉淀柱上水管闸门。 (3)放掉存水后,关闭放空管闸门,打开沉淀柱上水管闸门。 (4)依次向1~5沉淀柱内进水,当水位达到溢流孔时,关闭进水闸门,同时记录沉淀时间。5根沉淀柱的沉淀时间分别是20min、40 min、60 min、80 min、120 min。(5)当达到各柱的沉淀时间时,在每根柱上,自上而下地依次取样,测定水样悬浮物的浓度。 (6)记录见表1。 五、实验结果 (1)实验基本参数整理 实验日期水样性质及来源:生活污水 沉淀柱直径d= 110mm 柱高H=170cm 水温/℃=20 原水悬浮物浓度C (mg/L)=962 绘制沉淀柱及管路连接图 (2)实验数据整理 沉淀实验实验报告 篇一:自由沉淀实验报告 六、实验数据记录与整理 1、实验数据记录 沉降柱直径水样来源柱高 静置沉淀时间/min 表面皿表面皿编号质量/g 表面皿 和悬浮物总质量/g 水样中悬浮物质量/g 水样体积/mL 悬浮物沉降柱浓度/工作水(g/ml)深/mm 颗粒沉沉淀效 速/率/%(mm/s) 残余颗 粒百分比/% 0 5 10 20 30 60 120 0 1 2 3 4 5 6 79.0438 80.7412 1.6974 81.7603 83.2075 1.4472 64.1890 65.4972 1.3082 66.1162 67.3286 1.2124 73.7895 74.9385 1.1490 83.4782 84.6290 1.1508 75.0332 76.1573 1.1241 31.0 30.0 30.0 30.0 30.0 31.0 31.0 0.0548 0.0482 0.0436 0.0404 0.0383 0.0371 0.0363 846.0 808.0 780.0 724.0 664.0 500.0 361.0 1.860 0.883 0.395 0.230 0.069 0.021 11.40 20.44 26.28 30.11 32.30 33.76 100 87.96 79.56 73.72 69.89 67.70 66.24 2、实验数据整理 (2)绘制沉淀曲线:E-t 、E-u 、ui~pi曲线如下: 2-1、绘制去除率与沉淀时间的曲线如下: 图2.2:沉淀时间t与沉淀效率E的关系曲线 2-2、绘制去除率与沉淀速度的曲线如下: 图2.2:颗粒沉速u与沉淀效率E的关系曲线 2-3、绘制去除率与沉淀速度的曲线如下: 图2.3:颗粒沉速u与残余颗粒百分比的关系曲线 (1)选择t=60min 时刻:(大家注意哦!这部分手写的,不要直接打印!) 水样中悬浮物质量=表面皿和悬浮物总质量-表面皿质量,如表格所示。原水悬浮物的浓度:C0? 水样中悬浮物质量1.6974 ??0.0548g/ml 水样体积31.0 悬浮物的浓度:C5? 水样中悬浮物质量1.1508 项目一颗粒自由沉淀实验 一、实训目标 1.加深对自由沉淀特点、基本概念及沉淀规律的理解。 2.掌握颗粒自由沉淀实验的方法,并能对实验数据进行分析、整理、计算和绘制颗粒自由沉淀曲线。 二、技能要求 1、掌握颗粒静置自由沉淀实验的操作过程。 2、掌握取样、过滤和称量的操作方法。 三、课时 6课时 四、实验原理 颗粒的自由沉淀是指在沉淀的过程中,颗粒之间不互相干扰、碰撞、呈单颗粒状态,各自独立完成的沉淀过程。自由沉淀有两个含义: (1)颗粒沉淀过程中不受器壁干扰影响; (2)颗粒沉降时,不受其它颗粒的影响。 当颗粒与器壁的距离大于50d(d为颗粒的直径)时就不受器壁的干扰。当污泥浓度小于5000mg/l时就可假设颗粒之间不会产生干扰。 颗粒在沉砂池中的沉淀以及低浓度污水在初沉池中的沉降过程均是自由沉淀,自由沉淀过程可以由Stokes(斯笃克斯)公式进行描述。 但是由于水中颗粒的复杂性,颗粒粒径、颗粒比重很难或无法准确地测定,因而沉淀效果、特性无法通过公式求得而是通过静沉实验确定。 取一定直径、一定高度的沉淀柱,在沉淀柱中下部设有取样口,如图1.1所示,将已知悬浮物浓度为C0的水样注入沉淀柱,取样口上水深为h0,在搅拌均匀后开始沉淀实验,并开始计时,经沉淀时间t1,t2,…ti从取样口取一定体积水样,分别记下取样口高度,分析各水样的悬浮物浓度C1、C2…Ci,从而通过公式 η=C0-C i/C0×100% 式中:η—颗粒被去掉百分率; C0—原水悬浮物的浓度(mg/l) Ci—ti时刻悬浮物质量浓度(mg/l) 同时计算: p=C i/C0×100% 式中:p—悬浮颗粒剩余百分率; C0—原水悬浮物的浓度(mg/l) C i—t i时刻悬浮物质量浓度(mg/l) 1:自由沉降试验及其沉降曲线 自由沉降适用于悬浮固体浓度较低,且为非絮凝性或弱絮凝性的水质状况。试验是在设有一个取样口的透明沉降柱中进行的。柱的内径为100mm,有效高度为1.5~2.0m。取样口可设在工作水深为H的低部,也可设在H/2的中部,二者分别称为底部取样和中部取样。目前趋向于采用中点取样法,这是因为:随着沉降时间的延长,沉降柱内的悬浮固体浓度势必形成上稀下浓的线形不均匀分布态势,而我们要测定的是沉降柱内整个水层的残留SS浓度,用H/2处的SS浓度代表柱内的SS平均浓度,能减小采用底部取样带来的沉降效率的负偏差。 沉降试验及沉降曲线绘制的方法 (1)将水样在试验装置内循环搅拌均匀后,从取样口取两份100mL水样,用重量法测定初始SS浓度C0; (2)将柱内水位迅速调整至溢流口处,开始记时; (3)当累计沉降历时为t1、t2、t3…tn(常取5、10、30、60、90和120min) 时,各取100mL水样两份,用来测定对应沉降时间的残留SS浓度C1、C2、C3…Cn,同时记录各次取样后的水面累计下降高度Δh1、Δh2、Δh3…Δhn-1; (4)列表计算与各沉降时间对应的沉降效率E; (5)在标准计算纸上绘制E-t和E-u沉降曲线。 目前常用的沉降试验数据处理方法有两种:一种是常规计算法,另一种是Camp图解积分法。前者计算简单,但误差较大,得到的E-t和E-u曲线;后者比较复杂,但结果精确,得到的是ET-t和ET-u曲线。 (一)常规计算法 (1)由沉降时间t(h)和对应的工作水深H(m),按公式u=H/t计算 沉降速度u(m/h)式中的工作水深H是指由水面到柱底零断面的实际高度,而与取样口位置无关。 工作水深随沉降历时的变化情况如图3-5。由图可见,在[t0,tn]区间内,H随t呈跳跃式的不连续变化。如忽略[t0,ti]范围内所经历的各次水深变化,则工作水深可按下式近似计算。2: 自由沉淀中颗粒沉速受颗粒大小的影响,特别是小颗粒在布朗运动作用下不沉淀。絮凝沉淀完全克服了布朗运动的影响;因为絮凝剂形成的矾花越大,颗粒密度与溶液密度的差越大,沉降越快。 自由沉淀的颗粒,彼此互不干扰,也不受容器壁的干扰,只受颗粒在水中的重力作用。絮凝沉淀的颗粒,其尺寸、沉速都会逐渐增大 自由沉降是物理过程,是针对水中较大颗粒物;而混凝沉降是借助混凝剂.助凝剂,通过脱稳.电中和,桥联,网捕卷扫作用,是不易沉淀的细小悬浮物和胶体相互凝结长大,然后自由沉降,是一个化学物理过程. 水处理中没有纯粹的自由沉淀,也没有纯粹的絮凝沉淀。象初沉池和终沉池中,两种沉淀作用都有。只不过为了达到好的沉淀效果和节省占地面积,一般会采取一些措施增强絮凝沉淀作用:如设计合理的沉淀池中心桶中可发生絮凝作用。至于化学混凝和絮凝则另当别论。在自由沉降中,由于悬浮物固体浓度低,而且颗粒之间不发生凝聚,因此在沉降过程中颗粒的形状.粒径和密度都保持不变,互不干扰的各自独立完成匀速沉降过程.固体颗粒在沉砂池及初次沉淀池内的初期沉降就属于自由沉降. 絮凝沉淀,颗粒在沉淀过程中接触碰撞势能相互凝聚为较大的絮体,颗粒粒径和沉降速度随沉降时间的延续而增大. 投入的药量应根据胶体浓度及无机金属盐水解产物的分子形态、荷电性质和荷电量等确定。 建筑与测绘工程学院 《水处理实验设计与技术》 实验报告 实验1 颗粒自由沉淀实验 颗粒自由沉淀实验是研究浓度较低时的单颗粒的沉淀规律。一般是通过沉淀柱静沉实验,获取颗粒沉淀曲线。它不仅具有理论指导意义,而且也是给水排水处理工程中沉砂池设计的重要依据。 一、实验目的 加深对自由沉淀特点、基本概念及沉淀规律的理解。 掌握颗粒自由沉淀实验的方法,并能对实验数据进行分析、整理、计算和绘制颗粒自由沉淀曲线。 二、实验原理 浓度较低的、粒状颗粒的沉淀属于自由沉淀,其特点是静沉过程中颗粒互不干扰、等速下沉,其沉速在层流区符合Stokes (斯托克斯)公式。 但是由于水中颗粒的复杂性,颗粒粒径、颗粒相对密度很难或无法准确地测定,因而沉淀效果、特性无法通过公式求得而是通过静沉实验确定。 由于自由沉淀时颗粒是等速下沉,下沉速度与沉淀高度无关,因而自由沉淀可在一般沉淀柱内进行,但其直径应足够大,一般应使内径D ≥100mm 以免颗粒沉淀受柱壁干扰。 具有大小不同颗粒的悬浮物静沉总去除率η与截留沉速u 0剩余颗粒重量百分率P 的关系如下: ()dP P u u P s ?+-=00 001η ( 1 ) 此种计算方法也称为悬浮物去除率的累积曲线计算法。 设在一水深为H 的沉淀柱内进行自由沉淀实验,如图1所示。实验开始,沉淀时间为0,此时沉淀柱内悬浮物分布是均匀的,即每个断面上颗粒的数量与粒径组成相同,悬浮物浓度为C 0(mg/L ),此时去除率η=0。 实验开始后,不同沉淀时间t i ,颗粒最小沉淀速度u i 相应为: i i t H u = ( 2 ) 此即为t i 时间内从水面下沉到池底(此处为取样点)的最小颗粒d i 所具有的沉速。此时取样点处水样悬浮物浓度为C i ,而: 00 0011η=-=-=-i i i P C C C C C ( 3 ) 此时去除率η0,表示u ≥u i (d ≥d i )的颗粒除去率,而: 实验一 自由沉淀实验 一、实验目的 (1)加深对自由沉淀特点、基本概念及沉淀规律的理解; (2)掌握颗粒自由沉淀的实验方法; (3)对实验数据进行分析、整理、计算和绘制颗粒自由沉淀曲线。 二、实验原理 如果不明白也可以仔细阅读课本P33的内容。 浓度较稀的、粒状颗粒的沉淀属于自由沉淀,其特点是静沉过程中颗粒互不干扰、等速下沉,其沉速在层流区符合Stokes(斯笃克斯)公式。非絮凝性或弱絮凝性固体颗粒在稀悬浮液中的沉淀,属于自由沉淀。由于悬浮固体浓度低,而且颗粒之间不发生聚集,因此在沉降过程中颗粒的形状、粒径和密度都保持不变,互不干扰地各自独立完成匀速沉降过程。 自由沉淀实验一般在沉淀柱里进行,其直径应足够大,一般应使D ≥100mm ,以免颗粒沉淀受柱壁干扰。 在沉淀柱内,某个沉淀时长t 对应着一个颗粒沉速u0 = H / t 。此时颗粒物的总去除效率为 ?+-=00001 )1(P udP u P E 式中 E----总沉淀效率; P 0----沉速小于u 0的颗粒在全部悬浮颗粒中所占的百分数(也就是我们测定的残留率); 1-P 0----沉速大于或等于u0的颗粒去除百分数; u 0----某一指定颗粒的最小沉降速度; u----小于最小沉降速度u 0的颗粒沉速。 工程上常用下式计算 0)1(u u P P E ∑??+ -= 三、实验设备与试剂 1. 沉淀用有机玻璃柱,内径D=150mm ,高H=1700mm 。工作水深即由柱内液面至取样口的距离。 2. 配水系统一套。 3. 计量水深用标尺、计时用秒表; 4. 本实验使用浊度来代替悬浮物的测定。 实验一活性炭吸附实验 1. 2.间歇吸附和连续流吸附相比,吸附容量q和N是否相等?怎样通过实验求出N值? 答:间歇吸附指定量的吸附剂和定量的溶液经过长时间的充分接触而达到平衡。间歇吸附平衡的测定方法有:(1)保持气相的压力不变,经过一段时间吸附后,测定气体容积减少值的容量法;(2)吸附剂和气体充分接触,测定吸附剂重量增加值的重量法 2.通过本实验、你对活性炭吸附有什么结论性意见?本实验如何进一步改进? 答:通过本实验,可以得出结论:在一定程度内,吸附作用的去除率随着吸附剂的增加而增大,当到达某一个值时,去除率的增大不再明显,我对活性炭吸附的意见是:找到那个转折点,尽可能的保障投入有效。 实验二混凝实验 1. 2.根据最佳投药量实验曲线,分析沉淀水浊度与混凝剂加注量的关系 答:在一定范围内,混凝效果随混凝剂的投加量增加而增大,超过一定剂量时,效果反而减小。 2.本实验与水处理实际情况有哪些区别?如何改进? 答:(1)水环境的温度因素没有考虑进去,需多设一个因素(2)水平梯度跨越过大,可能最佳条件在梯度中间值。可在两个最佳条件范围内再设细分梯度,进行试验(3)实际环境中污水的污染物质种类多样,不单单是土壤颗粒,所以最好的水样,应该取自污水处理厂处理前的水。 实验三压力溶气气浮实验 1. 2.气浮法与沉淀法有什么相同之处?有什么不同之处? 答:(1)两者都是污水初期处理的物理方法。用来去除污水中的悬浮固体。 (2)气浮法通过向池内鼓气,使憎水的悬浮颗粒与气泡相吸附结合,使其整体密度变小,上浮,再通过刮渣机除去。沉淀法是通过悬浮颗粒的自由沉淀和絮凝作用,在重力作用下下沉。从而与水分离,沉入下层。 实验四曝气设备充氧能力的测定 1. 染色质免疫共沉淀(ChIP)实验具体方法及步骤 在保持组蛋白和DNA联合的同时,通过运用对应于一个特定组蛋白标记的生物抗体,染色质被切成很小的片断,并沉淀下来。 IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“prorein A”特异性地结合到免疫球蛋白的FC片段的现象活用开发出来的方法。 目前多用精制的prorein A预先结合固化在argarose的beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A就能吸附抗原达到精制的目的。 一、细胞的甲醛交联与超声破碎(第一天) 1. 取出1平皿细胞(10 cm平皿),加入243 ul 37%甲醛,使得甲醛的终浓度为1%(培养基共有9 ml)。 2. 37℃孵育10 min。 3. 终止交联:加甘氨酸至终浓度为0.125 M。450 ul 2.5 M甘氨酸于平皿中。混匀后,在室温下放置5 min即可。 4. 吸尽培养基,用冰冷的PBS清洗细胞2次。 5. 细胞刮刀收集细胞于15 ml离心管中(PBS依次为5 ml,3 ml和3 ml)。预冷后2 000 rpm 5 min收集细胞。 6. 倒去上清。按照细胞量,加入SDS Lysis Buffer。使得细胞终浓度为每200ul含2x106个细胞。这样每100 ul溶液含1x106个细胞。再加入蛋白酶抑制剂复合物。假设MCF7长满板为5x106个细胞。本次细胞长得约为80%。即为 4x106个细胞。因此每管加入400 ul SDS Lysis Buffer。将2管混在一起,共800 ul。 7. 超声破碎:VCX750,25%功率,4.5 s冲击,9 s间隙。共14次。 二、除杂及抗体哺育(第一天) 1. 超声破碎结束后,10 000 g 4℃离心10 min。去除不溶物质。 2. 留取300ul做实验,其余保存于-80℃。 3. 300 ul中,100 ul加抗体做为实验组;100 ul不加抗体做为对照组;100 ul加入4 ul 5 M NaCl(NaCl终浓度为0.2 M),65℃处理3 h解交联,跑电泳,检测超声破碎的效果。 竭诚为您提供优质文档/双击可除 絮凝沉淀实验报告 篇一:环境工程专业----实验报告 颗粒自由沉淀实验 一、实验目的 1、过实验学习掌握颗粒自由沉淀的试验方法。 2、进一步了解和掌握自由沉淀的规律,根据实验结果 绘制时间-沉淀率(t-e)、沉速-沉淀率(u-e)和ct/co~u 的关系曲线。 二、实验原理 沉淀是指从液体中借重力作用去除固体颗粒的一种过程。根据液体中固体物质的浓度和性质,可将沉淀过程分为自由沉淀、沉淀絮凝、成层沉淀和压缩沉淀等4类。本实验是研究探讨污水中非絮凝性固体颗粒自由沉淀的规律。实验用沉淀管进行。设水深为h,在t时间内能沉到深度h颗粒 的沉淀速度vh/t。根据给定的时间to计算出颗粒的沉速uo。凡是沉淀速度等于或大于u0的颗粒在t0时就可以全部去除。设原水中悬浮物浓度为co则 沉淀率=(co-ct)/c03100% 在时间t时能沉到深度h颗粒的沉淀速度u: u=(h310)/(t360)(mm/s) 式中:c0——原水中所含悬浮物浓度,mg/l c1————经t时间后,污水中残存的悬浮物浓度,mg/l;h——取样口高度cm;t——取样时间,min。 三、实验步骤 1、做好悬浮固体测定的准备工作。将中速定量滤纸选好,放入托盘,调烘箱至 105±1℃,将托盘放入105℃的烘箱烘45min,取出后放入干燥器冷却30min,在1/10000天平上称重,以备过滤时用。 2、开沉淀管的阀门将软化淤泥和水注入沉淀管中曝气搅拌均匀。 3、时用100ml容量瓶取水样100ml(测得悬浮物浓度为c0)记下取样口高度,开动秒表。开始记录沉淀时间。 4、时间为 5、10、15、20、30、40、60min时,在同一取样口分别取100ml水样,测其悬浮物浓度为(ct)。 5、一次取样应先排出取样口中的积水,减少误差,在取样前和取样后必须测量沉淀管中液面至取样口的高度,计算时采用二者的平均值。 6、已称好的滤纸取出放在玻璃漏斗中,过滤水样,并用蒸馏水冲净,使滤纸上得到全部悬浮性固体,最后将带有 实验一 颗粒自由沉淀实验 一、实验目的 1.加深对自由沉淀特点、基本概念及沉淀规律的理解。 2.掌握颗粒自由沉淀的实验方法,并能对实验数据进行分析、整理,计算和绘制颗粒自由沉淀曲线。 二、实验原理 沉淀是水污染控制中用以去除水中杂质的常用方法。根据水中悬浮颗粒的凝聚性能和浓度,沉淀通常可以分成四种不同的类型:自由沉淀、絮凝沉淀、区域沉淀、压缩沉淀。 浓度较稀的、粒状颗粒的沉降称为自由沉淀,其特点是在静沉过程中颗粒互不干扰、等速下沉,其沉淀在层流区符合Stokes(斯托克斯)公式。但是由于水中颗粒的复杂性,颗粒粒径、颗粒密度很难或无法准确地测定,因而沉淀效果、特性无法通过公式求得而是通过静沉实验确定。 由于自由沉淀时颗粒是等速下沉,下沉速度与沉淀高度无关,因而自由沉淀可在一般沉淀柱内进行,但其直径应该足够大,一般应使D≥100mm,以免沉淀颗粒受柱壁的干扰。 自由沉淀所反映的一般是沙砾、河流等的沉淀特点。具有大小不同颗粒的悬浮物静沉总去除率E 与截留速度u 0、颗粒质量分数的关系如下: dp u ui P E p ?+-=0 01)1( (1-1) 式中 E ——总沉淀效率; P 0——沉速小于u i 的颗粒在全部悬浮颗粒中所占的百分数; 1-P 0——沉速大于或等于u i 的颗粒去除百分数; u i ——某一指定颗粒的最小沉降速度; u ——小于最小沉降速度u i 的颗粒沉速。 公式推导如下: 设在水深为H 的沉淀柱内进行自由沉淀实验。实验开始,沉 淀时间为0,此时沉淀柱内悬浮物分布是均匀的,即每个断面上颗粒的数量与粒径的组成相同,悬浮物浓度为C 0(mg/L),此时去除率E=0。 实验开始后,不同沉淀时间t i ,颗粒最小沉淀速度u i 相应为 u i = i t H (1-2) u i 此即为t i 时间内从水面下沉到取样点的最小颗粒d i 所具有 图1-1 自由沉淀实验示意 的沉速。此时取样点处水样悬浮物浓度为C i ,未被去除之颗粒即示意d 实验报告 课程名称:水处理实验技术 实验名称:颗粒自由沉淀实验 实验小组:徐啸、郑璞、丁鸣、冉琳 指导教员:施培俊 专业:环境工程 中国人民 理工大学工程兵工程学院研究生一队解放军 二〇〇八年十月七日 颗粒自由沉淀实验 颗粒自由沉淀实验是研究浓度较稀时的单颗粒的沉淀颗规律。一般是通过沉淀柱静沉实验,获取颗粒沉淀曲线。它不仅具有理论指导意义,而且也是给水排水处理工程中沉砂池设计的重要依据。 一、实验目的: 1. 掌握颗粒自由沉淀的实验方法,加深对颗粒自由沉淀特点、基本概念及沉淀规律的理解。 2. 能对实验结果进行分析、整理、计算,并能绘制颗粒自由沉淀曲线。 二、实验原理 沉淀是借重力作用从液体中去除固体颗粒的一种过程。根据液体中固体物质的浓度和性质,可将沉淀过程分为自由沉淀、絮凝沉淀、成层沉淀和压缩沉淀等四类。 浓度较稀、粒状颗粒的沉淀属于自由沉淀。其特点是静沉过程中颗粒互不干扰、等速下沉,且其沉速在层流区符合Stocks公式。但由于水中颗粒的复杂性,颗粒粒径、颗粒比重很难或无法准确的测定,因而沉淀效果、特性无法通过公式求得,只能通过静沉实验即颗粒自由沉淀实验确定。 具有大小不同颗粒的悬浮物静沉总去除率η与截留速度μ0、颗粒重量百分比率的关系如下: dP P P s ?+ -=0 0)1(μμη 设在一水深为H 的沉淀柱内进行自由沉淀实验,如下图所示。设实验开始时沉淀时间为0,柱内悬浮物均匀分布,即每个断面上颗粒的数量与粒径的组成相同,悬浮物浓度为C 0(mg/L ),去除率η=0。 取样口 u 1 u x 颗粒自由沉淀示意 实验开始后,不同沉淀时间t i ,颗粒最小沉淀速度u i 相应为: i i t H u = 此即为t i 时间内从水面下沉到池底(取样点)的最小颗粒d i 所具有的沉速。此时取样点处水样悬浮物浓度为C i ,而: 00 0011η=-=-=-i i i P C C C C C 此时去除率η0,表示具有沉速u≥u i (粒径d≥d i )的颗粒去除率,而: C C P i i = 则反映了t i 时,未被去除的颗粒即d 关于染色质免疫共沉淀ChIP实验原理及实验总结 ChIP实验原理 在活细胞状态下固定蛋白质-DNA复合物,并将其随机切断为一定长度范围内的染色质小片段,然后通过免疫学方法沉淀此复合体,特异性地富集目的蛋白结合的DNA片段,通过对目的片断的纯化与检测,从而获得蛋白质与DNA相互作用的信息。 可以利用ChIP研究转录因子(transcription factor, TF)与启动子(promoter)的关联性。由于ChIP采用甲醛固定活细胞或者组织的方法,所以能比较真实的反映细胞内TF与Promoter 的结合情况。这个优势是EMSA这个体外研究核酸与蛋白相互结合的实验方法所不能比拟的。当用甲醛处理时,相互靠近的蛋白与蛋白,蛋白与核酸(DNA或RNA)之间会产生共价键。细胞内,当TF与Promoter相互结合(生物意义上的结合)时,它们必然靠的比较近,或者契合在一起,这个时候用甲醛处理,能使它们之间产生共价键。 一般ChIP的流程是:甲醛处理细胞——收集细胞,超声破碎——加入目的蛋白的抗体,与靶蛋白-DNA复合物相互结合——加入Protein A,结合抗体-靶蛋白-DNA复合物,并沉淀——对沉淀下来的复合物进行清洗,除去一些非特异性结合——洗脱,得到富集的靶蛋白-DNA 复合物——解交联,纯化富集的DNA-片断——PCR分析。 ChIP实验步骤 第一天: (一)、细胞的甲醛交联与超声破碎。 1、取出1平皿细胞(10cm平皿),加入243ul 37%甲醛,使得甲醛的终浓度为1%。(培养基共有9ml) 2、37摄氏度孵育10min。 3、终止交联:加甘氨酸至终浓度为0.125M。 450ul 2.5M甘氨酸于平皿中。混匀后,在室温下放置5min即可。 4、吸尽培养基,用冰冷的PBS清洗细胞2次。 5、细胞刮刀收集细胞于15ml离心管中(PBS依次为5ml,3ml和3ml)。预冷后2000rpm 5min 收集细胞。 6、倒去上清。按照细胞量,加入SDS Lysis Buffer。使得细胞终浓度为每200ul含2×106个细胞。这样每100ul溶液含1×106个细胞。再加入蛋白酶抑制剂复合物。 假设MCF7长满板为5×106个细胞。本次细胞长得约为80%。即为4×106个细胞。因此每管加入400ul SDS Lysis Buffer。 将2管混在一起,共800ul。 7、超声破碎:VCX750,25%功率,4.5S冲击,9S间隙。共14次。当然,如果实验室有Bioruptor这种神器的话那就轻松了。 (二)、除杂及抗体哺育。 免疫共沉淀原理及步骤 免疫沉淀(Immunoprecipitation, IP)原理 IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“protein A/G"特异性地结合到抗体(免疫球蛋白)的FC片段的现象开发出来的方法。目前多用protein A/G预先结合在argarose beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A/G就能达到吸附抗原的目的。通过低速离心,可以从含有目的抗原的溶液中将目的抗原与其它抗原分离。 免疫沉淀实验的操作步骤比较多,同时由于在非变性条件下进行实验,所以要得到一个完美的实验结果,不仅需要高质量的抗体,同时对免疫沉淀体系也需要有严格的控制指标。免疫沉淀实验从:蛋白样品处理;抗体-agarose beads孵育;抗体-agarose beads复合物洗涤到最后的鉴定,每步都非常关键,需要严格控制实验流程中每个关键步骤的质量,才能最终达到你的实验目的。 IP实验步骤 基本实验步骤 (1)收获细胞,加入适量细胞IP裂解缓冲液(含蛋白酶抑制剂),冰上或者4℃裂解30min, 12,000g 离心30 min后取上清; (2) 取少量裂解液以备Western blot分析,剩余裂解液将1μg相应的抗体和10-50 μl protein A/G-beads加入到细胞裂解液,4°C缓慢摇晃孵育过夜; (3)免疫沉淀反应后,在4°C 以3,000 g速度离心5 min,将protein A/G-beads离心至管底;将上清小心吸去,protein A/G-beads用1ml裂解缓冲液洗3-4次;最后加入15μl的2×SDS 加样缓冲液,沸水煮10分钟; (4)SDS-PAGE, Western blotting或进行质谱分析。一、样品处理: 免疫沉淀实验成功与否,第一步处理样品非常关键。免疫沉淀实验本质上是处于天然构象状态的抗原和抗体之间的反应,而样品处理的质量决定了抗原抗体反应中的抗原的质量,浓度以及抗原 沉淀试验——双向免疫扩散试验 一、目的要求 1. 掌握双向免疫扩散试验的原理和用途; 2. 熟悉双向免疫扩散试验的操作方法。 二、实验原理 可溶性抗原(如细菌的外毒素、内毒素、菌体裂解液、病毒、组织浸出液等)与相应的抗体结合后,在适量电解质存在下,形成肉眼可见的白色沉淀线,称为沉淀试验(precipitation)。在生理条件下,抗原抗体均带负电荷,使极化的水分子在其周围形成水化膜,成为亲水胶体。当抗原与抗体结合后,表面电荷减少,水化膜变薄;而且由于抗原抗体复合物形成后,与水接触的表面积减少,由亲水胶体转化为疏水胶体。在电解质作用下,各疏水胶体之间靠拢,形成可见的抗原抗体复合物。 如果抗原成分不纯,免疫动物后可以产生针对不同抗原成分的多种抗体,于是就形成多条沉淀线,如图2-1所示。 图2-1双向免疫扩散试验原理示意图 双向免疫扩散试验(double agar immunodiffusion test):将可溶性抗原和抗体分别加到琼脂板上相应的小孔内,由于抗原和抗体各自向四周扩散,故称双向琼脂扩散试验。若抗原 与抗体相对应,两者相遇即发生特异性结合 形成抗原抗体复合物,由于该复合物的体积大于琼脂的微小孔隙,于是不能扩散,并逐步聚集在一起形成白色沉淀线。每一对应抗原和抗体可出现一条沉淀线,出现沉淀带的抗体最大稀释倍数即为抗体效价。由于抗原抗体在琼脂内的扩散受到浓度、分子量大小与表面电荷的影响,所以沉淀线可以出现在抗原孔与抗体孔之间的不同位置。当抗体浓度过高时,沉淀线就靠近抗原孔,为前带;相反,则沉淀线靠近抗体孔,为后带。如果抗原与抗体的比例合适,则沉淀线位于两孔中间,为等价带,如图2-2所示。 图2-2 抗原-抗体结合的沉淀带形成原理示意图 三、实验用途: 沉淀试验广泛应用于病毒抗原、细菌毒素或寄生虫抗原等的诊断(图2-3),以及各种免疫血清效价和毒素、抗毒素的测定等。 四、材料: 实验三颗粒自由沉淀实验 一、目的 通过沉淀实验,熟悉沉淀类型及各自特点,掌握沉淀曲线测试与绘制方法。 二、原理 浓度较稀的、粒状颗粒的沉淀属于自由沉淀,其特点是静沉过程中颗粒互不干扰、等速下沉。一般当污泥浓度小于5000mg/l时刻可假定颗粒之间不产生干扰,为自由沉淀。 自由沉淀速度在层流区符合Stokes(斯笃克斯)公式。但由于水中颗粒的复杂性,颗粒粒径、颗粒密度很难或无法准确地测定.因而沉淀效果、特性无法通过公式求得而是通过静沉实验确定。 三. 实验设备材料 1. 沉淀用有机玻璃柱,上设溢流管、取样口、进水管及放空管; 2. 计量水深用标尺、计时用秒表; 3. 悬浮物定量分析用电子天平、定量滤纸、称量瓶、烘箱、抽滤装置、干燥器等装置; 4. 取样用100ml比色管、100ml量筒、瓷盘等。 四实验方法和步骤 1. 检查沉淀装置连接情况、保证各个阀门完全闭合;各种用具是否齐全。 2. 将水样注入沉淀柱,搅匀,开始计时 3.用量筒取样100ml,测悬浮物浓度C0。 4. 在开始后1、5、10、15、20、40、60min时分别在取样 口取样100ml,测悬浮物浓度。同时观察悬浮颗粒沉淀特点、现象。 5. 悬浮物测定方法:1将定量滤纸置于称量瓶内烘至恒重W1;2将过滤水样后的滤 纸放入称量瓶中,烘至恒重W2;3悬浮物浓度 五注意事项 1.向沉淀柱内进水时,速度要适中,既要较快完成进水,以防进水中一些较重颗粒沉淀,又要防止速度过快造成柱内水体紊动,影响静沉实验效果。 2.取样时,先排除管中积水而后取样(排出20ml左右),每次取样100 mL。 3. 每次取样都会造成液面下降,需记录每次取样时的液面与取样口高度差 六实验结果整理 ?计算悬浮物去除率、剩余率及沉降速度 ?绘制去除率-沉淀历时、去除率-沉淀速度、剩余率-沉淀速度曲线 实验四 ?一、实验目的 针对不含耗氧微生物的污水和含耗氧微生物的污水进行曝气充氧实验,测定氧传递修正系数α和β,并了解两种情况下氧转移过程的区别 ?二、原理 略 三. 实验设备材料 1、溶解氧测定仪絮凝沉淀实验
沉淀实验实验报告
项目一 颗粒自由沉淀实验
自由沉降试验及其沉降曲线问题解析
颗粒自由沉淀实验报告
实验一_自由沉淀实验报告说明.doc
水处理实验问答题
染色质免疫共沉淀(ChIP)实验具体方法及步骤
絮凝沉淀实验报告
自由沉淀实验
颗粒自由沉淀实验报告
关于染色质免疫共沉淀ChIP实验原理及实验总结
免疫共沉淀原理及步骤
沉淀试验-双向免疫扩散
实验三 颗粒自由沉淀实验