第四章 离子聚合和配位聚合-习题参考答案
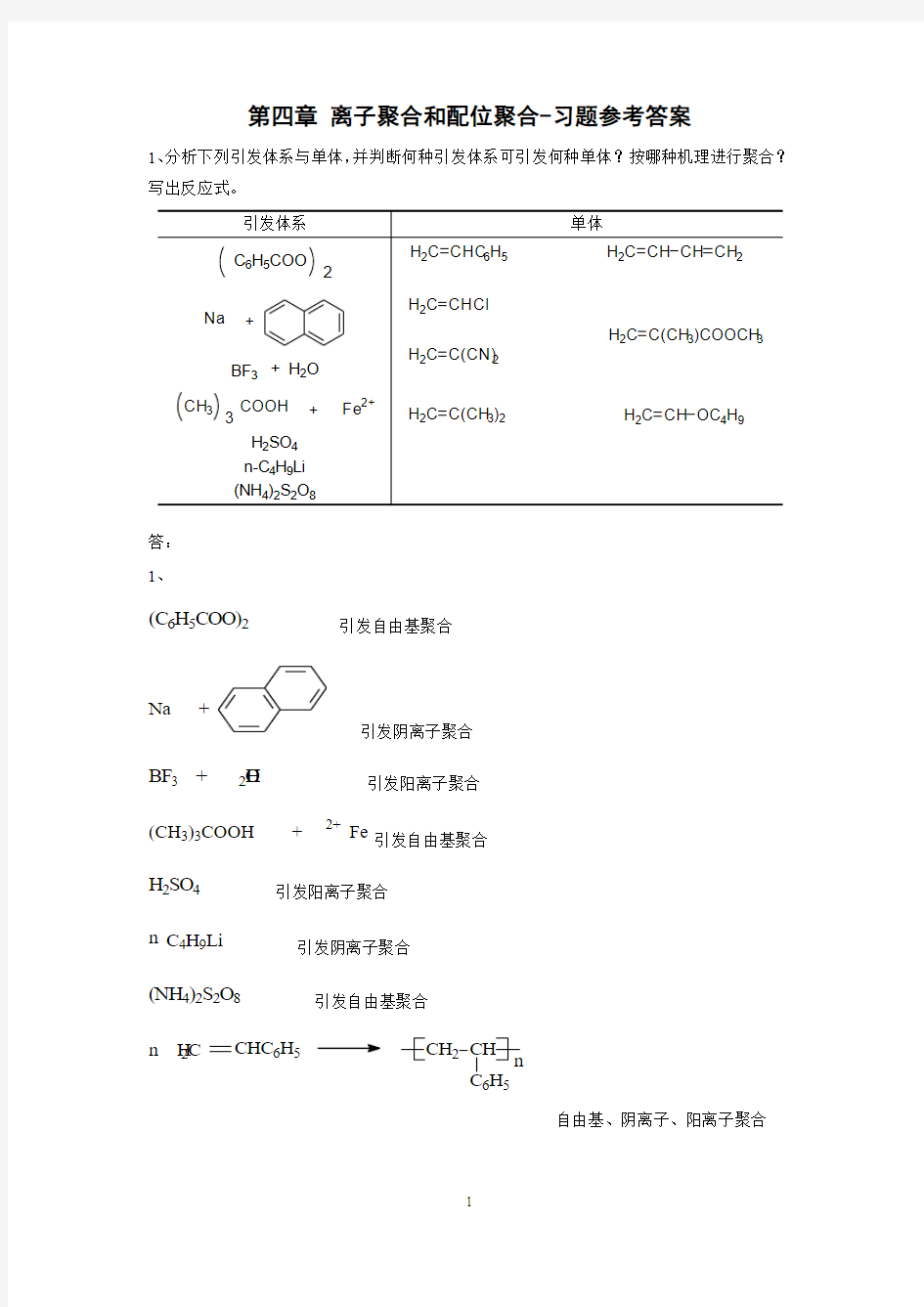
1、分析下列引发体系与单体,并判断何种引发体系可引发何种单体?按哪种机理进行聚合?写出反应式。
答: 1、
(C 6H 5COO)2 引发自由基聚合
Na +
引发阴离子聚合
BF 3 + H 2O 引发阳离子聚合
(CH 3)3COOH + Fe 2+ 引发自由基聚合
H 2SO 4 引发阳离子聚合 n C 4H 9Li
引发阴离子聚合
(NH 4)2S 2O 8 引发自由基聚合 n H 2C
CHC 6H 5
CH 2CH
C 6H 5
n
自由基、阴离子、阳离子聚合
n H 2C
CH CH CH 2CH 2CH CH CH 2
n
自由基、阴离子、阳离子聚合
n H 2C
CHCl
CH 2
CHCl
n
自由基聚合
n H 2C
C(CN)
CH 2
C
2
n
阴离子聚合
n H 2C
C(CH 3)COOCH 3
CH 2
C COOCH 3
CH 3
n
自由基聚合
n H 2C
C(CH 3)2
CH 2
C
CH 3
3
n
阳离子聚合
n H 2C
CH OC 4H 9CH 2
CH
4H 9
n
阳离子聚合
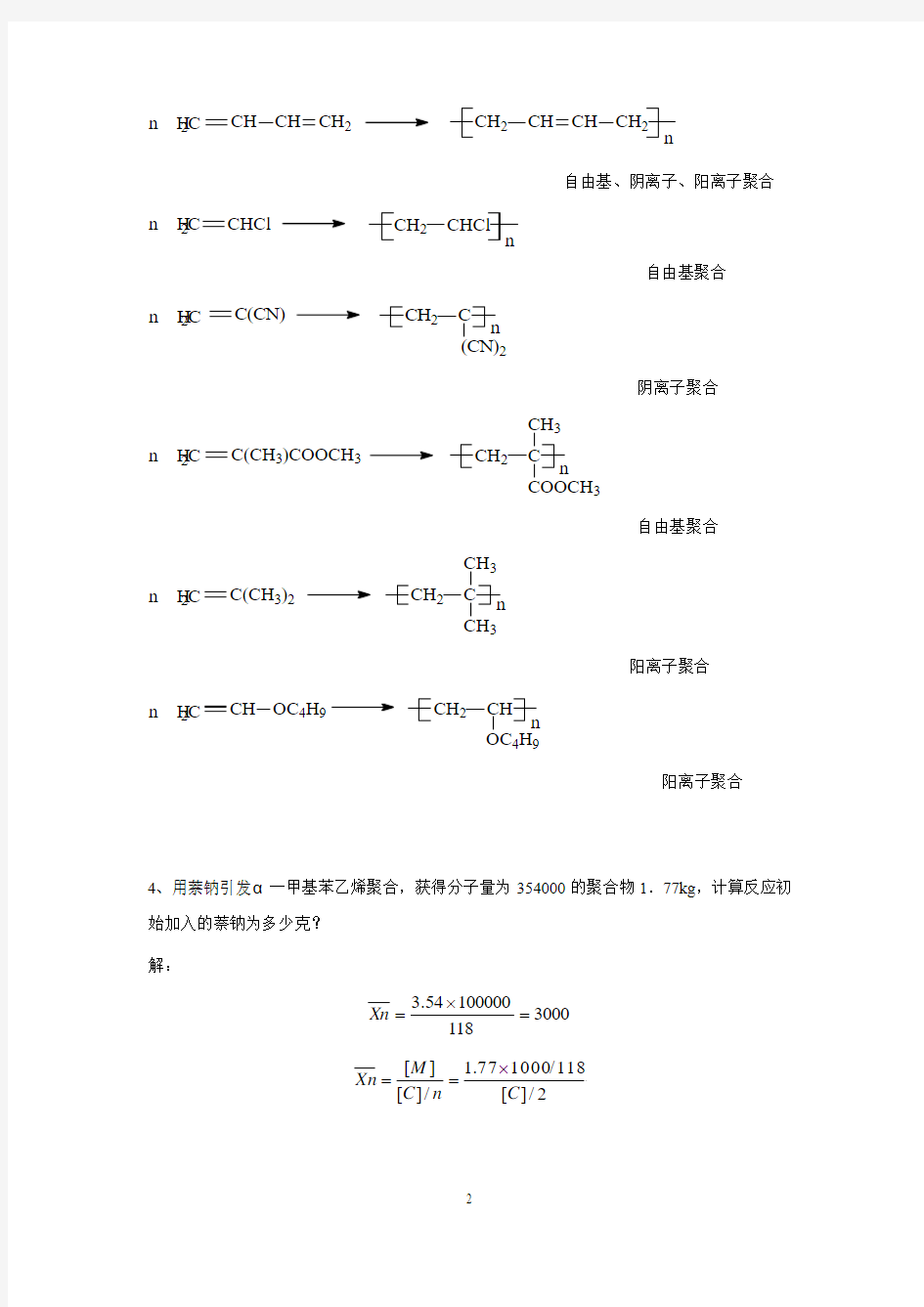
4、用萘钠引发α一甲基苯乙烯聚合,获得分子量为354000的聚合物1.77kg ,计算反应初始加入的萘钠为多少克? 解:
3000118
100000
54.3=?=
Xn
2
/][118
/100077.1/][][C n C M Xn ?==
[C]=
mol 01.03000
30
萘钠用量为:0.01×23=0.23克。
高中化学奥林匹克竞赛辅导 配合物(配位化合物)化学基础 【竞赛要求】 配位键。常见的配合物的中心离子(原子)和常见的配体(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。螯合物及螯合效应。常见的络合剂及常见的配合反应。定性说明配合反应与酸碱反应、沉淀反应、氧化还原反应的联系。配合物几何构型和异构现象的基本概念。配合物的杂化轨道理论。八面体配合物的晶体场理论。Ti(H2O)6的颜色。路易斯酸碱的概念。 1.配合物:由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子 络合物。如[Co(NH3)6]3+、[Cr(CN)6]3–、Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。判断物质是配合物的关键在于物质是否含有配位单元。配合物和复盐的区别:前者一定含有配位键,后者没有配位键,如KCl·MgCl2·6H2O是复盐,不是配合物。 2.配合物的组成: 为外界,内外界(1)配合物的内界和外界:以[Cu(NH3)4]SO4为例,[Cu(NH3)4]2+为内界,SO-2 4 之间是完全电离的。内界是配位单元,外界是简单离子。又如K3[Cr(CN)6]之中,内界是[Cr(CN)6]3–,外界是K+。配合物可以无外界,但不能没有内界,如Ni(CO)4。 (2)中心离子(原子)和配位体: a.中心离子(原子):又称配合物的形成体或中心体,多为过渡金属离子,如Fe3+、Fe2+、Co2+、Ni2+、Cu2+,也有电中性的原子为配合物的中心原子,如Ni(CO)4、Fe(CO)5中的Ni和Fe都是电中性的原子。只要能提供接纳孤对电子的空轨道的离子或原子均可作中心体。 b.配位体:含有孤对电子的阴离子或分子。如NH3、Cl—、CN—等。配位体中直接同中心原子配合的原子,叫做配位原子。如[Cu(NH3)4]2+配阳离子中,NH3是配位体,其中N原于是配位原子。配位原子经常是含有孤对电子的原子。 (3)配位原子和配位数:配体中给出孤对电子与中心体直接形成配位键的原子,叫配位原子。配位单元中,中心体周围与中心体直接形成配位键的配位原子的个数,叫配位数。中心离子的配位数一般为2、4、6、8(配位数为8的较少见),如在[Pt(NH3)6]C14中,配位数为6,配位原子为NH3分子中的6个氮原子。一般说来,配位数大多是中心体电荷数的两倍,如Cu+、Ag+、Au+的配位数均为2,Cu2+、Zn2+的配位数均为4,Fe3+、Cr3+的配位数均为6,但也有例外。配位数与中心体和配体的性质有关:若中心离子的电荷高,半径大,则利于高配位;而配体的电荷高,半径大,则利于低配位。
第5章配位滴定法习题答案 1.EDTA与金属离子的配位反应有何特点? 答:广泛,EDTA几乎能与所有的金属离子形成络合物;稳定,一般lg K MY> 15; 络合反应速度快,水溶性好;EDTA与无色的金属离子形成无色的络合物,与有色的金属离子形成颜色更深的络合物;络合比简单,一般为1:1。 2. EDTA与金属离子配合物的稳定常数与条件稳定常数有什么不同?影响条件稳定常数大小的因素有哪些? 答:在无副反应存在的情况下用平衡常数来衡量反应进行的程度,在有副反应存在的情况下用条件平衡常数来衡量反应进行的程度;响条件稳定常数大小的因素有:酸效应、配位效应、干扰离子效应等。 3. 影响配位滴定图月范围大小的因素有哪些?是怎样影响的? 答:(1)lg K′的影响:K′增大10倍,lg K′增加1,滴定突跃增加一个单位。 (2)C M的影响:C M增大10倍,滴定突跃增加一个单位。 4. 为什么大多数的配位滴定需要在一定的缓冲溶液中进行? 答:络合滴定中广泛使用pH缓冲溶液来保持酸度相对稳定,因为:(1)滴定过程中的[H+]变化:M + H2Y = MY + 2H+ (2)K′MY与pH有关; (3)指示剂需在一定的酸度介质中使用 5. 金属指示剂的作用原理是什么?应当具备的主要条件是什么? 答:金属指示剂本身是弱的配位剂,在一定条件下,指示剂与金属离子形成有一定稳定性的配合物,该配合物与指示剂本身具有显著不同的颜色。 6. 指示剂为什么会被封闭?如何消除? 答:指示剂的封闭现象是指某些指示剂能与某些金属离子生成极为稳定的络合物,这些络合物较对应的MY络合物更稳定,以致到达化学计量点时滴入过量的EDTA,也不能夺取指示剂络合物(MIn)中的金属离子,指示剂不能释放出来,看不到颜色的变化,这种现象就叫指示剂的封闭现象。 可能原因:(1)MIn(或共存离子N的NIn)的稳定性大于MY。 (2)终点变色反应的可逆性差。 解决方法:(1)若封闭现象是滴定离子本身M引起的,则可采用返滴定法。例二甲酚橙XO,Al3+对其有封闭现象。可加过量EDTA,采用返滴法测定铝。
聚合工艺作业-判断题 特种作业人员危险化学品安全作业聚合工艺作业1 [ 对 ] 1、干燥机发生断料后,如果是洗涤水泵跳闸所致,应立即打开洗胶罐补水阀,先恢复干燥机的正常进料。 [ 错] 2、汽提是直接通入水蒸汽,水蒸气既作为惰性气体,又作为加热介质的一种脱吸方法。 [ 对 ] 3、爆炸并不是在达到着火的临界条件时就立即发生。 [ 错 ] 4、石油化工装置检修现场,可以用汽油等易挥发性物质擦洗设备或零部件。 [ 对 ] 5、生产中在聚合压力很低情况下,提高聚合压力,聚合反应温度则会有明显增高。 [ 对 ] 6、聚合车间和岗位严禁携带移动、照相机和录像机进入。 [ 对 ] 7、油品从液体变为固体的过程为凝固。 [错 ] 8、防护罩、安全阀不属于安全防护装置。 [ 错 ] 9、仪表风就是压缩空气。 [ 对 ] 10、密封油泵不能空运转。 [ 对 ]11、在对接地连接系统的维护工作中,应重点检查螺栓紧固接点,及时更换腐蚀了的垫片。 [ 对 ] 12、用沸腾床干燥聚合物时,由于多数聚合物的热稳定性小,密度小,粒度细,因而限制了干燥气的流速和温度。 [ 对 ]13、安全阀进行校验和压力调整时,调整及校验装置用的压力表精度等级应不低于Ⅰ级。 [错 ] 14、自由基聚合反应根据引发的方式不同,可分为热引发、光引发、辐射引发、引发剂引发和链引发。 [ 对 ] 15、聚合度越大,聚合物的分子量越大。 [ 错 ] 16、往复泵也可以用安装出口阀门的方法来调节流量。 [ 对 ] 17、凝胶渗透色谱法(GPC)较为常用的各种平均分子量及分子量分布宽度的测试方法。 [ 错 ] 18、在列管换热器中腐蚀性流体应走壳程。 [ 对 ] 19、装置停工大检修就是对装置进行全面检查、检修和工艺改造等。 [ 对 ] 20、吹扫的标准:空气吹扫时,首先是保证气源的压力和吹扫时的流速,当吹扫时从排出口流体中见不到颜色、混浊固体物,或者对塔槽类来说,其部无沉淀物、异物,其吹扫即可停止。 [错] 21、生产中膨胀干燥机突然断料,极易引起聚合物塑化着火,其原因是断料后膨胀干燥机压力直线上升所致。 [ 错 ] 22、当聚合釜系统出现超压时,必须打开事故阀。 [ 错 ] 23、演练要素中宜明确应急演练的规模、方式、频次、围、容、组织、评估、总结等容。 [ 错] 24、生产经营单位应当制定本单位的应急预案演练计划,根据本单位的事故预防重点,每半年至少组织一次综合应急预案演练或者专项应急预案演练。 [ 错 ] 25、单位要根据需要,没有必要引进、采用先进适用的应急救援技术装备。 [ 对 ] 26、现场处置即根据事故情景,按照相关应急预案和现场指挥部要求对事故现场进行控制和处理。 [ 错 ] 27、对于危险性较大的重点设备、重点岗位和重点场所,生产经营单位应当制定重点工作岗位的现场处置方案。 [ 对 ] 28、二氧化硫会引起酸雨。 [ 对 ] 29、设备出厂检修,应进行充分置换,以防治污染物转移。 [ 对 ] 30、接触危险化学品的废包装物应作为危险废物处置。 [ 对 ] 31、工业废水包括生产废水和生产污水。 [ 对 ] 32、氧含量高于40%时,会造成氧中毒,长期吸入可能发生眼损害甚至失明。
配位化学试题 1. 利用Pt (Ⅱ)配合物中的反位效应,试说明如何以 K 2PtCl 为原料制备 :(1) [ PtPyNH 3Cl ] 所有可能的异构体,(2)下列配合物: Pt Cl NH 3H 3N Py Pt Cl Py H 3N H 3N Pt Cl NH 3C 2H 4Cl 2. 下列各组中,哪种配位体与同一中心离子形成的配合物稳定性高,为什么? C l -,F -和AL 3+;I -,Br --和Hg 2+;2CH 3NH 2,en 和Cu 2+ 3. 从常数手册上查出 [Cu (gly )2 ] 的lgk 1=9.76,lgk 2=2.47。测定条件是: T=25℃,[ NaClO 4 ]=1.0 mol/L ,此常数代表什么意义?具有什么性质?如测定 的方法是pH 法,叙述此方法的原理以及测定过程(gly :甘氨酸)。 4. 解释下列各胺与 Cu (Ⅱ)形成配离子稳定性的差别: 配体 lgk 1(25℃,I=0.1) 乙二胺 1055 1,2—二氨基丙烷 10.65 1,3—二氨基丙烷 9.98 1,2,3—三氨基丙烷 11.1 5. 下列二组试剂与同一金属离子形成螯合物时,估计lgk 大小次序: M(en)3M(Pn)3M(dien)2(1), ,,(2)N OH Cl N OH N OH CH 3N OH CH(CH 3)2 6、试为制备下列各化合物写出适合的配平方程式,并给出大致的反应条件。 (1)以 [Ir(NH 3)5H 2O]3+ 为原料,制备 [Ir(NH 3)5ONO]2+ (2)以 K 2PtCl 4 为原料,制备 [Pt(NH 3)4Cl 2] (3)以 CoBr 2·6H 2O 为原料,制备 [Co(NH 3)5Br]Br 2 (4)以 [Co(NH 3)5Cl]Cl 2 为原料,制备 [Co(en) 3]Cl 3 (5)以 [Pt(NH 3)4SO 4 为原料,制备 trans-[Pt(NH 3)4(OH)2]SO 4 7、何谓配位场谱项?它是如何产生的? 8、为什么Mn(NO 3)2的水溶液是很淡的粉红色?请解释。
配合物习题及答案 一、判断题: 1.含有配离子的配合物,其带异号电荷离子的内界和外界之间以离子键结合,在水中几乎完全解离成内界和外界。 .... () 2.在1.0 L 6.0 mol·L-1氨水溶液中溶解0.10 mol CuSO4固体,假定Cu2+ 全部生成[ Cu (NH3 )4 ]2+,则平衡时NH3的浓度至少为 5.6 mol·L-1 。.........................() 3.在M2+溶液中,加入含有X-和Y-的溶液,可生成MX2沉淀和[MY4]2-配离子。如果K( MX2 )和K([ MY4]2- ) 越大,越有利于生成[MY4]2-。() 4.金属离子A3+、B2+可分别形成[ A(NH3 )6 ]3+和[ B(NH3 )6 ]2+,它们的稳定常数依次为 4 ?105 和 2 ?1010,则相同浓度的[ A(NH3 )6 ]3+和[ B(NH3 )6 ]2+溶液中,A3+和B2+ 的浓度关系是c ( A3+ ) > c ( B2+ ) 。() 5.在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。.........................................................................................................................() 6. 已知K2 [ Ni (CN)4 ] 与Ni (CO)4均呈反磁性,所以这两种配合物的空间构型均为平面正方形。.....................................................................................() 7.某配离子的逐级稳定常数分别为K、K、K、K,则该配离子的不稳定常数K= K·K·K·K。.......................................................... () 8.HgS 溶解在王水中是由于氧化还原反应和配合反应共同作用的结果。............ () 9.在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。.........................................................................................................................() 二、选择题: 1.下列配离子在水溶液中稳定性大小关系中正确的是 . ()。 (A) [ Zn (OH)4 ]2- ( lg K= 17.66 ) > [Al (OH)4 ]- ( lg K= 33.03 ); (B) [ HgI4 ]2- ( lg K= 29.83 ) > [ PbI4 ]2- ( lg K= 4.47 ); (C) [ Cu (en)2 ]+ ( lg K= 10.8 ) > [ Cu (en)2 ]2+ ( lg K= 20.0 ); (D) [ Co (NH3 )6 ]2+ ( lg K= 5.14 ) > [ CoY ]2- ( lg K= 16.31) 。 2.下列配合物中,属于内轨型配合物的是.............................................()。 (A) [ V(H2O)6 ]3+,μ = 2.8 B. M.;(B) [ Mn (CN)6 ]4-,μ = 1.8 B. M.; (C) [Zn (OH)4]2-,μ= 0 B. M.;(D) [ Co(NH3)6 ]2+,μ = 4.2 B. M.。 3.在一定温度下,某配离子ML4的逐级稳定常数为K(1)、K(2)、K(3)、K(4),逐级不稳定常数为K(1)、K(2)、K(3)、K(4)。则下列关系式中错误的是.................................................................................. ()。 (A) K(1)·K(2)·K(3)·K(4) = [ K(1)·K(2)·K(3)·K(4) ]-1; (B) K(1) = [K(1) ]-1; (C) K(4) = [K(1) ]-1; (D)K(2) = [K(3) ]-1。 4.下列叙述中错误的是............................................................................... ()。 (A) 配合物必定是含有配离子的化合物; (B) 配位键由配体提供孤对电子,形成体接受孤对电子而形成; (C) 配合物的内界常比外界更不易解离; (D) 配位键与共价键没有本质区别。
高中化学竞赛专题练习 配位化合物 1、画出下列配合物可能有的旋光异构体的结构。 (1)[FeCl2(C2O4)en] ;(2) [Co(C2O4)3]3-;(3)[Co(en)2Cl2]+。 2、一些顺式铂的配合物可以作为活性抗癌药剂,如cis-PtCl4(NH3)2、cis-PtCl2(NH3)2、 cis-PtCl2(en)等。实验测得它们都是反磁性物质,试用杂化轨道理论说明它们的成键情况,指出它们是内轨型配合物还是外轨型配合物。 3、已知下列配合物的磁矩,根据价键理论指出各中心离子的价层电子排布、轨道杂化类型、 配离子空间构型,并指出配合物属内轨型还是外轨型。 (1) Mn(CN)63-(μ=2.8 B.M); (2) Co(H2O)62+(μ=3.88 B.M); 4、实验测得配离子Co(NH3)63+是反磁性的,问它属于什么几何构型?根据价键理论判断中心 离子采取什么杂化状态? 5、通过计算说明,在标准状况下金难溶于水,但用氰化钠溶液却可以浸取金矿砂中的金。 已知E°(Au+/Au)=1.69V,E°(O2/OH-)=0.401V,K稳°[Au(CN)2-]=2×1038 6、已知E°(Fe3+/Fe2+)=0.771V,E°(I2/I-)=0.535V,在标准状况下Fe3+可以将I-氧化为单 质I2。通过计算说明在标准状况下,下列反应能否自发进行? 2Fe(CN)63-+2I-=Fe(CN)64-+I2 已知K稳°(Fe(CN)63-)=1.0×1042,K稳°(Fe(CN)64-)=1.0×1035。 7、已知E°(Fe3+/Fe2+)=0.771V,E°(Sn4+/Sn2+)=0.14V,K稳°(FeF3)=1.15×1012。通过计算说明,下列氧化还原反应在标准状态下能否发生。若能发生写出有关的化学反应方程式。 (1)向FeCl3溶液中加入NaF,然后再加SnCl2; (2)向Fe(SCN)3溶液中加入SnCl2(K稳°(Fe(SCN)3)=4.4×105); (3)向Fe(SCN)3溶液中加入KI(E°(I2/I-)=0.535V)。 8、某Ⅷ族不活泼金属A溶于足量的王水生成B的溶液(A的含量为47.60%);将SO2通入B 的溶液中,得到C的溶液(A的含量为57.56%)。已知B、C的组成元素完全相同,且阴离子所带电荷也相同。 (1)通过计算推理,确定A的元素符号; (2)写出所涉及反应的化学方程式。 (3)画出B、C阴离子的空间构型。 9、铝与三乙胺形成的单核配合物是电中性分子,实验测得其氢的质量分数为14.32%,画出 它的立体结构,指出中心原子的氧化态和杂化类型。要给出推理过程。 10、将2,2-联吡啶,冰醋酸和过氧化氢的混合物在75℃时水浴加热3小时后,析出细小的 针状晶体A。A可作为配体与许多过渡金属生成配合物,如与铬形成红紫色配合物B:CrA x Cl y(ClO4)z·H2O,元素分析结果如下:Cr 8.43%、C 38.95%、H 2.94%、Cl 17.25%、N 9.08%、O 23.35%。 (1)若A是双齿配体,易配位形成七元环,写出A的结构式。 (2)确定B的化学式,并计算该化合物的磁矩。 (3)写出B中的配离子所有可能的结构式。
配位滴定法课后练习题及参考答案 一、选择题 1.直接与金属离子配位的EDTA型体为() (A)H 6Y2+ (B)H4Y(C)H 2 Y2-(D)Y4- 2.一般情况下,EDTA与金属离子形成的络合物的络合比是() (A)1:1(B)2:1(C)1:3 (D)1:2 3.铝盐药物的测定常用配位滴定法。加入过量EDTA,加热煮沸片刻后,再用标准锌溶液滴定。该滴定方式是()。 (A)直接滴定法(B)置换滴定法 (C)返滴定法(D)间接滴定法 4.αM(L)=1表示() (A)M与L没有副反应(B)M与L的副反应相当严重 (C)M的副反应较小(D)[M]=[L] 5.以下表达式中正确的是() (A) >(B) > (C) > (D) > 6.用EDTA直接滴定有色金属离子M,终点所呈现的颜色是()(A)游离指示剂的颜色(B)EDTA-M络合物的颜色 (C)指示剂-M络合物的颜色(D)上述A+B的混合色 7.配位滴定中,指示剂的封闭现象是由()引起的 (A)指示剂与金属离子生成的络合物不稳定 (B)被测溶液的酸度过高
(C)指示剂与金属离子生成的络合物翁定性小于MY的稳定性 (D)指示剂与金属离子生成的络合物稳定性大于MY的稳定性 8.下列叙述中错误的是() (A)酸效应使络合物的稳定性降低 (B)共存离子使络合物的稳定性降低 (C)配位效应使络合物的稳定性降低 (D)各种副反应均使络合物的稳定性降低 9.用Zn2+标准溶液标定EDTA时,体系中加入六次甲基四胺的目的是()(A)中和过多的酸(B)调节pH值 (C)控制溶液的酸度(D)起掩蔽作用 10.在配位滴定中,直接滴定法的条件包括( ) ≤8 (B)溶液中无干扰离子 (A) > (C)有变色敏锐无封闭作用的指示剂(D)反应在酸性溶液中进行 11.测定水中钙硬时,Mg2+的干扰用的是( )消除的。 (A)控制酸度法(B)配位掩蔽法(C)氧化还原掩蔽法(D)沉淀掩蔽法12.配位滴定中加入缓冲溶液的原因是( ) (A)EDTA配位能力与酸度有关(B)金属指示剂有其使用的酸度范围
1 、(判断题)根据重大事故发生的特点,应急救援的特点是行动必须做到迅速、准确和有效,应急救援的首要任务是抢救受害人员。 参考答案:正确 2 、(判断题)环境危害极大的“酸雨”中主要成分为二氧化硫。 参考答案:正确 3 、(判断题)橡胶制品业属于职业病危害严重的行业。 参考答案:正确 4 、(判断题)电动机轴承温度超过允许值是轴承磨损一种因素造成的。 参考答案:错误 5 、(判断题)离心泵试车前要检查填料密封是否有压得过紧过松现象。 参考答案:正确 6 、(判断题)水污染物实行总量控制,企业可以暂时性的超标排放。 参考答案:错误 7 、(判断题)管道检修完毕验收时,必须提交检修记录,且含单线图。 参考答案:正确 8 、(判断题)消防安全重点部位应设置明显的防火标志,实行严格管理。 参考答案:正确 9 、(判断题)脱脂作业场所,应画出安全警戒区,并挂有“严禁烟火”“有毒危险”等警示牌。 参考答案:正确 10 、(判断题)聚合物是由一种或几种简单的低分子化合物(单体)经聚合反应,形成以简单结构单元以重复方式连接成高分子化合物。 参考答案:正确 11 、(判断题)设备检修进入作业前要求设备内氧含量大于18%,可燃气小于10%。
参考答案:错误 12 、(判断题)爆炸分为物理爆炸、化学爆炸和核爆炸。 参考答案:正确 13 、(判断题)管子切断前应移植原有标记,低温钢管及钛钢管,严禁使用钢印。 参考答案:正确 14 、(判断题)检修离心泵叶轮时,将泵体内物料排出即可交出检修。 参考答案:错误 15 、(判断题)阀门在关闭期间,常出现物料泄漏现象,原因是阀门未完全关死。 参考答案:错误 16 、(判断题)进入容器内作业时,必须办理《进入受限空间作业证》。但当头部探入换热器封头内进行检查的作业可不必办理《进入受限空间作业证》。 参考答案:错误 17 、(判断题)甲醇在空气中的允许浓度为50mg/?。 参考答案:正确 18 、(判断题)离子聚合不能以水作介质。 参考答案:正确 19 、(判断题)生产单位应当组织有关专家对本部门编制的应急预案进行审定;必要时,可以召开听证会,听取社会有关方面的意见。 参考答案:错误 20 、(判断题)油脂不会引起污水COD升高。 参考答案:错误 21 、(判断题)离心泵发生气蚀时,会产生振动。 参考答案:正确
§16-2 配位化合物的同分异构现象 The Isomerism of Complexes 一、总论: 1.Definition:凡是化学组成相同的若干配合物,因原子间的连接方式或空间排列方式的不同而引起的结构和性质不同的现象,称为配合物的同分异构现象(isomerism)。 2.Classification (1) 化学结构异构现象(chemical structure isomerism):化学组成相同,原 子间的连接方式不同而引起的异构现象,称为化学结构异构现象。例如: [Co(NH3)5(NO2)]2+和 [Co(NH3)5(ONO)]2+ (2) 立体异构现象(stereo isomerism):化学组成相同,空间排列不同而引起 的异构现象,称为立体异构现象。例如:Pt(NH3)2Cl2
cis – 二氯·二氨合铂(II) trans - 二氯·二氨合铂(II) 二、化学结构异构现象,大致分为五类: Ionization isomerism, Hydrate isomerism, Linkage isomerism, Coordination isomerism, Polymerization isomerism. 1.Ionization isomerism (1) Two coordination compounds which differ in the distribution of ions between those directly coordinated and counter-ions present in the crystal lattice are called ionization isomers. (2) e.g. [Cr(NH 3)5Br]SO 4 and [Cr(NH 3)5SO 4]Br 2.Hydrate isomerism (Solvent isomerism) (1) Hydrate isomerism is similar to ionization isomerism except that an uncharged ligand changes from being coordinated to a free-lattice position whilst another ligand moves in the opposite sense. (2) e.g. [Cr(H 2O)6]Cl 3 ,[Cr(H 2O)5Cl]Cl 2·H 2O ,[Cr(H 2O)4Cl 2]Cl ·2H 2O 3.Linkage isomerism (1) The first example of this type of isomerism was provided by J φrgensen, W erner’s contemporary. His method of preparation was as follows : A"solution "Cl]Cl )[Co(NH 23N aN O H Cl N H 253???→???→???→? red Co(ONO)]Cl )[(NH A"solution "253cold in stand let ?????→? yellow )]Cl Co(NO )[(NH A"solution "2253H Cl conc heat ???→???→?? (2) It deals with a few ligands (ambidenatate) that are capable of bonding through are type of donor atom in one situation not a different atom in another complex. Some authors refer to this type of isomerism as “structura l i somerism” but inasmuch as all isomerism is basically “structural” , the term linkage isomerism is preferable. (3) e.g. +252SCN]O)[Cr(H and +252NCS]O)Cr(H [ +]SSO )Co(NH [353 and +S]OSO )[Co(NH 253 4.Coordination isomerism (1) This may occur only when the cation and anion of a salt are both complexes, the two isomers differing in the distribution of ligands between the cation and anion (2) e.g. ]Cr(Ox)][)Co(NH [363 and ]][Co(Ox))[Cr(NH 363 ] ][Cr(SCN))[Cr(NH 663 and ](SCN))][Cr(NH (SCN))[Cr(NH 423243 ]PtCl ][)[Pt(NH 643 and ]][PtCl Cl )[Pt(NH 4243
滴定分析习题及答案标准化管理部编码-[99968T-6889628-J68568-1689N]
第三章滴定分析 一、选择题 1.滴定分析中,对化学反应的主要要求是(? ? ) (A)反应必须定量完成 (B)反应必须有颜色变化 (C)滴定剂与被测物必须是1:1的计量关系 (D)滴定剂必须是基准物 2.在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。这一点称为(? ? ) (A)化学计量点?(B)滴定误差?(C)滴定终点?(D)滴定分析 3.直接法配制标准溶液必须使用(? ? ) (A)基准试剂(B)化学纯试剂(C)分析纯试剂(D)优级纯试剂 4.将称好的基准物倒入湿烧杯,对分析结果产生的影响是(? ? ) (A)正误差? ? ? (B)负误差? (C)无影响(D)结果混乱 5.硼砂(Na2B4O7?10H2O)作为基准物质用于标定盐酸溶液的浓度,若事先将其置于干燥器中保存,则对所标定盐酸溶液浓度的结果影响是(? ? ) (A)偏高? ? ? ? ? (B)偏低? ? ? ? (C)无影响? ? ? (D)不能确定 6.滴定管可估读到±,若要求滴定的相对误差小于%,至少应耗用体积(? ? )mL (A) 10? ? ? ? ? (B) 20? ? (C) 30? ? ?(D) 40
(A) ? (B) ? (C) ? ? ? (D) 8.欲配制1000mL L HCl溶液,应取浓盐酸(12mol/L HCl) (? ? )mL。 (A) ? ? (B)? ? (C);? ? (D)12mL 9.既可用来标定NaOH溶液,也可用作标定KMnO4的物质为(? ? ) (A)H2C2O4?2H2O?(B) Na2C2O4? ? ? (C)HCl? ? ? (D)H2SO4 10.以甲基橙为指示剂标定含有Na2CO3 的NaOH标准溶液,用该标准溶液滴定某酸以酚酞为指示剂,则测定结果(? ? ) (A)偏高? ? ? (B)偏低? ? ? ? (C)不变? ? ? ? (D)无法确定 二、填空题 1.滴定分析法包括(? ? ? ? ? )、(? ? ? ? ? )、(? ? ? ? ? )和(? ? ? ? )四大类。 2.欲配制 mol?L的NaOH溶液500 mL,应称取(? ? ? ? )固体。 3.称取纯金属锌 g,溶于HCl后,稀释定容到250 mL的容量瓶中,则Zn2+ 溶液的物质的量浓度为(? ? ? ? )。 4.称取 H2C2O4?2H2O来标定NaOH溶液,消耗,则cNaOH=(? ? ? ? )。HCl=mL表示每(? ? ? ? )相当于(? ? ? ? ? )。 6.进行滴定分析计算时,如果选取分子、离子或这些粒子的某种特定组合作为反应物的基本单元,这时滴定分析结果计算的依据为: (? ? ? ? ? ? ? ? ? ? ? ? ? ? )。 三、判断题 1.(? )所谓化学计量点和滴定终点是一回事。
泰山学院课程考试专用 泰山学院化学化工学院2010级化学专业本科 2012~2013学年第一学期 《配位化学》试卷A (试卷共6页,答题时间120分钟) 一、选择题(每小题 2 分,共 20 分。请将答案填在下面的表格内) 1、关于影响配位数的主要因素的叙述,正确的是( ) A. 不论何种配体,中心离子的电荷越高、半径越小,配位数越大 ; B. 不论何种中心原子,配体的体积都是对配位数影响最大的因素 ; C. 讨论配位数的大小要从外部条件、中心离子、配体等方面考虑 ; D. 中心离子的电荷与半径,决定了形成配合物的配位数高低 ; 2、下面关于中心离子的描述,正确的是( ) A. Nb(V)、La(III)、Co(III) 为外层具有9-17电子结构的过渡金属离子; B. Cu(I)、Sn(II)、Hg(II) 为外层具有18 电子结构的离子 ; C. Ge(II)、Sn(II)、Pb(II) 为外层具有18+2电子结构的离子 ; D. Al(III)、Si(IV)、Ti(III) 为外层具有8电子结构的离子; 3、说明Zn 2+,Cd 2+,Hg 2+形成配合物的稳定性顺序,错误的是( ) A. [ZnI 4]2- > [HgI 4]2- ; B. [ZnCl 4]2- < [CdCl 4]2- ;
C. [CdF4]2-< [HgF4]2-; D. [CdF4]2-< [ZnF4]2-; 4、下列光谱化学序列中配体强弱顺序排列,正确的是( ) A. en > NO2-; B. F-< C2O42-; C. NH3> en ; D. OH-> CN-; 5、下列有关配合物的立体结构与配位数的描述,不正确的是( ) A. 配位数为3的配合物,有平面三角形和三角锥型两种构型; B. 一维无限链式结构的Cs[CuCl3]n的配位数为4 ; C. 具有角锥形结构的[SnCl3]-配位数为3 ; D. 配合物[(Ph3P)3Cu2Cl2]中铜(I)的配位数有3、4两种模式; 6、下列有关配位数与配合物的结构描述,不正确的是( ) A. 配离子[PdCl4]2-和[AuCl4]-都具有平面四方形结构; B. 配合物[VO(acac)2] 和[Cu(NH3)4]SO4·H2O都具有四方锥结构; C. 配离子[Ni(CN)5]3-和[CdCl5]3-都具有三角双锥构型; D. 配离子Cd(CN)4]2-和[Cu(CN)4]2-都具有四面体结构; 7、下列关于配合物几何异构体的叙述,正确的是( ) A. 配合物[Co(NO2)3(NH3)3] ,有2种几何异构体; B. 配离子[Co(en)2Cl2]+,有5种几何异构体; C. 配离子[Co(NH3)2(H2O)2(Py)2]3+,共有6种几何异构体; D. 配合物[Cr(gly)3] ,有4种几何异构体; 8、外文期刊Angew.Chem.Int.Ed可从哪个数据库网址中查得?() A. https://www.doczj.com/doc/2b17439323.html, ; B. https://www.doczj.com/doc/2b17439323.html, ; C. https://www.doczj.com/doc/2b17439323.html, ;
高中化学奥林匹克竞赛辅导讲座 第9讲络合物(配位化合物)化学基础 【竞赛要求】 配位键。重要而常见的配合物的中心离子(原子)和重要而常见的配位(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。螯合物及螯合效应。重要而常见的络合剂及其重要而常见的配合反应。配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明)。配合物几何构型和异构现 的颜色。路易斯酸碱的概念。象基本概念。配合物的杂化轨道理论。八面体配合物的晶体场理论。Ti(H2O)+3 6 【知识梳理】 一、配合物基本知识 1、配合物的定义 由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。凡是含有配位单元的化合物都称作配位化合物,简称配合物,也叫络合物。 [Co(NH3)6]3+,[Cr(CN)6]3–,Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。 [Co(NH3)6]Cl3、K3[Cr(CN)6]、Ni(CO)4都是配位化合物。[Co(NH3)6]、[Cr(CN)6] 也是配位化合物。判断的关键在于是否含有配位单元。 思考:下列化合物中哪个是配合物 ①CuSO4·5H2O②K2P t Cl6 ③KCl·CuCl2 ④Cu(NH2CH2COO)2 ⑤KCl·MgCl2·6H2O ⑥Cu(CH3COO)2 注意:①配合物和配离子的区别 ②配合物和复盐的区别 2、配合物的组成 中心离子 内界单齿配体 配位体多齿配体 配合物螯合配体 外界 (1)配合物的内界和外界 以[Cu(NH3)4]SO4为例: [Cu(NH3)4]2+ SO-2 4 内界外界 内界是配位单元,外界是简单离子。又如K3[Cr(CN)6] 之中,内界是[Cr(CN)6]3–,外界是K+。可以无外界,如Ni(CO)4。但不能没有内界,内外界之间是完全电离的。 (2)中心离子和配位体 中心离子:又称配合物的形成体,多为金属(过渡金属)离子,也可以是原子。如Fe3+、Fe2+、Co2+、Ni2+、Cu2+、Co等,只要能提供接纳孤对电子的空轨道即可。 配位体:含有孤对电子的阴离子或分子。如NH3、H2O、Cl-、Br-、I-、CN-、CNS-等。
第六章配位滴定法 计算pH=5时EDTA的酸效应系数αY(H)。若此时EDTA各种存在形式的总浓度为·L-1,则[Y4-]为多少 pH=5时,锌和EDTA配合物的条件稳定常数是多少假设Zn2+和EDTA的浓度皆为10-2 mol·L-1(不考虑羟基配位等副反应)。pH=5时,能否用EDTA标准溶液滴定Zn2+ 假设Mg2+和EDTA的浓度皆为10-2 mol·L-1,在pH=6时,镁与EDTA配合物的条件稳定常数是多少(不考虑羟基配位等副反应)并说明在此pH条件下能否用EDTA 标准溶液滴定Mg2+。如不能滴定,求其允许的最小pH。
试求以EDTA滴定浓度各为mol·L-1的Fe3+和Fe2+溶液时所允许的最小pH。 计算用mol·L-1 EDTA标准溶液滴定同浓度的Cu2+离子溶液时的适宜酸度范围。 称取0.1005g纯CaCO3溶解后,用容量瓶配成100mL溶液。吸取25mL,在pH﹥12时,用钙指示剂指示终点,用EDTA标准溶液滴定,用去。试计算: (1)EDTA溶液的浓度; (2)每毫升EDTA溶液相当于多少克ZnO和Fe2O3。
用配位滴定法测定氯化锌(ZnCl2)的含量。称取0.2500g试样,溶于水后,稀释至250mL,吸取,在pH=5~6时,用二甲酚橙作指示剂,用mol·L-1 EDTA标准溶液滴定,用去。试计算试样中含ZnCl2的质量分数。 称取1.032g氧化铝试样,溶解后移入250mL容量瓶,稀释至刻度。吸取,加入T Al2O3=mL的EDTA标准溶液,以二甲酚橙为指示剂,用Zn(OAc)2标准溶液进行返滴定,至红紫色终点,消耗Zn(OAc)2标准溶液。已知1mL Zn(OAc)2溶液相当于EDTA溶液。求试样中Al2O3的质量分数。
聚合工艺模拟考试 1、【判断题】用人单位工作场所存在职业病目录所列职业病危害因素的,应当及时、如实向所在地安全生产监督管理部门申报危害项目,接受监督。(√) 2、【判断题】单位或者个人违反《中华人民共和国突发事件应对法》,导致突发事件发生或者危害扩大,给他人人身、财产造成损害的,应当依法承担刑事责任。(×) 3、【判断题】达到总量控制目标,应从降低污染物浓度,减少污染物排放着手。(√) 4、【判断题】合成氨装置的特点是:高温高压、易燃易爆、点多面长、有毒有害,发生事故可能性较大。(√) 5、【判断题】用人单位不承担职业健康检查费用,给予警告,责令限期改正,可以并处3万元以下的罚款。(√) 6、【判断题】县级以上人民政府及其有关部门应当根据自然灾害、事故灾难和公共卫生事件的种类和特点,建立健全基础信息数据库,完善监测网络,划分监测区域,确定监测点,明确监测项目,提供必要的设备、设施,配备专职或者兼职人员,对可能发生的突发事件进行监测。(√) 7、【判断题】建设项目职业病防护设施建设期间,建设单位应当对其进行经常性的检查,对发现的问题及时进行整改。(√)
8、【判断题】严禁将氧气管道与电缆安装在同一管沟内。(√) 9、【判断题】稀释液氨、硫化氢等物料的水可以直接排放。(×) 10、【判断题】安全阀与压力容器之间一般不宜装设截止阀门。(√) 11、【判断题】离心泵排出量过大,超负荷,会引起离心泵电机电流过大。(√) 12、【判断题】硫化氢的伤害途径为呼吸道吸入。(√) 13、【判断题】锅炉与压力容器的设计,必须由具有相应专业技术水平的单位负责,并应经过规定的审批手续。(√) 14、【判断题】动火作业分为特殊危险动火和一级动火。(×) 15、【判断题】石油化工企业中,无飞火的明火设备,应布置在有散发可燃气体的设备、建筑物的主导风向下风头。(×) 16、【判断题】两种不同性质的金属接触摩擦时不会起静电。(×) 17、【判断题】只要是装置发生火灾,那么就只能等消防人员来救火。(×) 18、【判断题】报废设备无需置换干净,以节约能源。(×) 19、【判断题】防护服包括帽、衣、裤、围裙、套裙、鞋罩等,有防止或减轻热辐射和化学污染机体的作用。(√)
级《配位化学》期末考试试题(A 卷)
————————————————————————————————作者:————————————————————————————————日期: 2
泰山学院化学与环境科学系2007级化学系各专业本科 2009~2010学年第二学期 《配位化学》试卷 A (试卷共6页,答题时间120分钟) 题号 一 二 三 四 五 总分 统分人 复核人 得分 一、选择题(每小题 2 分,共 20 分。请将答案填在下面的表格内) 1、中心原子具有18+2电子结构的是( ) A. Al(III); B. Zn(II); C. Pb(II); D. Fe(III); 2、下列关于配合物几何异构体数目的叙述,正确的是( ) A.[Co(NO 2)3(NH 3)3]配合物有3种几何异构体; B.平面四边形配合物[M(abcd)]型配合物,只有1种几何异构体 ; C. [M(a 2b 2b 2]型的八面体配合物存在5种几何异构体; D.八面体[M(ab)3]配合物,不存在几何异构体; 3、配合物晶体场稳定化能的计算结果,错误的是( ) A. [Fe(H 2O)6]2+ 的CFSE=-0.4Δo B. [Mn(H 2O)6]2+ 的CFSE=-2.0Δo 得分 阅卷人 题号 1 2 3 4 5 6 7 8 9 10 答案
C. [Ni(H2O)6]2+的CFSE=-1.2Δo D. [Cu(H2O)6]2+的CFSE=-0.6Δo 4、指出下列配体的光谱化学序列中错误的排列顺序( ) A. en < NO2-; B. SCN- > CN-; C. NH3 < en ; D. H2O > C2O42-; 5、配合物荷移跃迁能排列顺序存在错误的是:() A. [OsCl6]2- > [OsBr6]2- > [OsI6]2- B. [Ru III Cl6]3- > [Ru IV Cl6]2- C. VO43 > CrO42- > MnO4- D. HgCl42- < HgBr42- < HgI42- 6、期刊https://www.doczj.com/doc/2b17439323.html,mun.主要收录在哪个数据库网址中?() A. https://www.doczj.com/doc/2b17439323.html, ; B. https://www.doczj.com/doc/2b17439323.html, ; C. https://www.doczj.com/doc/2b17439323.html, ; D. https://www.doczj.com/doc/2b17439323.html, ; 7、找出有关d n组态自由离子基谱项,错误的是:( ) A. d1组态的自由离子基谱项是2D ; B. d2组态的自由离子基谱项是1P; C. d3组态的自由离子基谱项是4F; D. d4组态的自由离子基谱项是5D; 8、配合物的立体结构与配位数的描述,错误的是( ) A. [Ag(NH3)2]+的配位数为2; B. 配位数为4的配合物,主要有四面体和平面四边形两种构型; C. 配位数为3的配合物只有平面三角形结构; 2 / 8