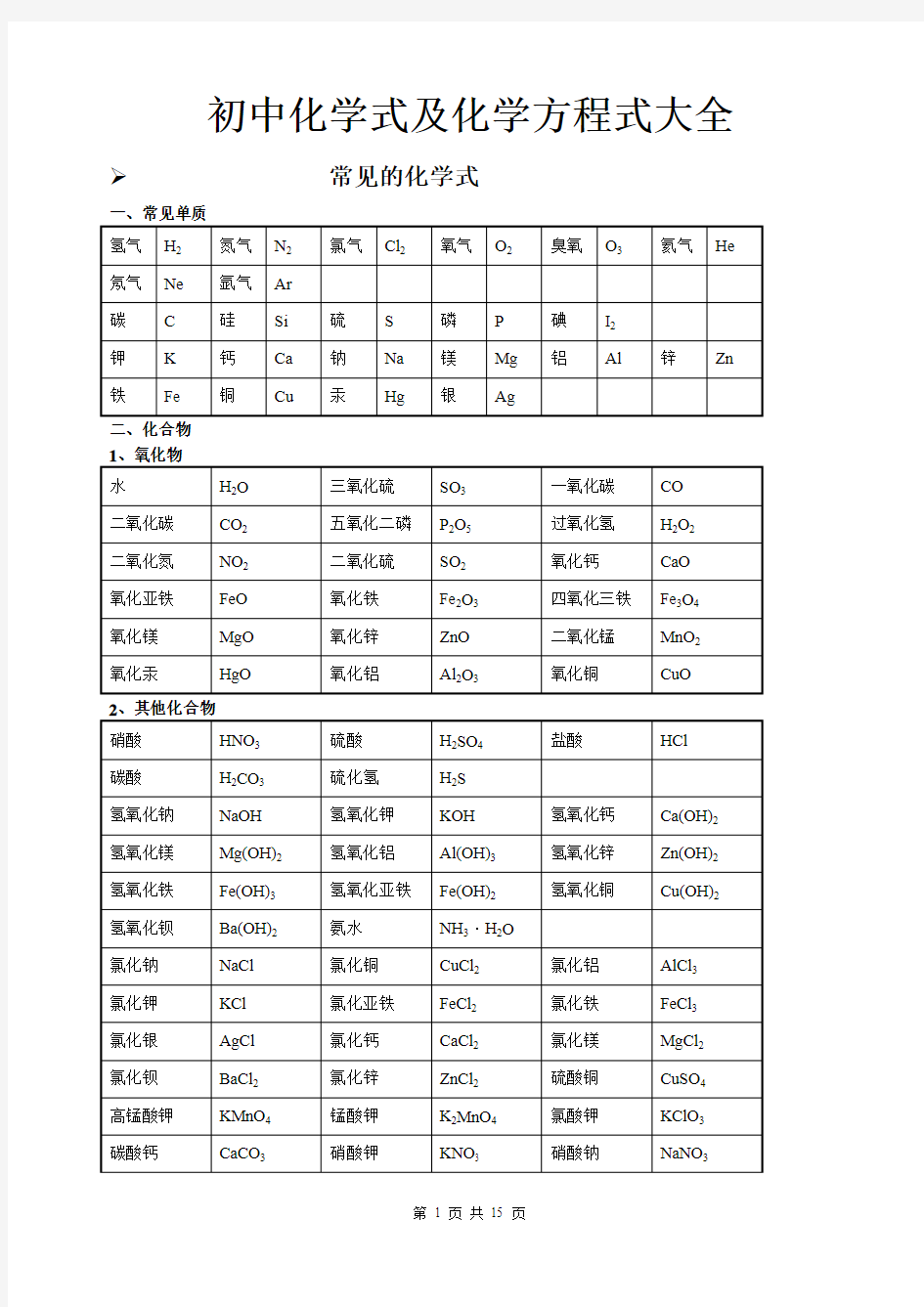

初中化学式及化学方程式大全 常见的化学式
一、常见单质
二、化合物
初中化学方程式全(已配平).
一、化合反应
1、镁在空气中燃烧:2Mg+ O2点燃 2MgO
2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O4
3、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O3
4、氢气在空气中燃烧:2H2 +O2点燃 2H2O
5、红磷在空气中燃烧:4P +5O2点燃 2P2O5
6、硫粉在空气中燃烧: S+ O2点燃 SO2
7、碳在氧气中充分燃烧:C +O2 点燃 CO2
8、碳在氧气中不充分燃烧:2C +O2点燃 2CO
9、二氧化碳通过灼热碳层: C +CO2高温 2CO
10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO2
11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO3
12、生石灰溶于水:CaO+ H2O === Ca(OH)2
13、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O
14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl
二、分解反应
15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑
16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 +O2↑
17、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑
18、碳酸化学不稳定而分解:H2CO3 === H2O +CO2↑
19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑
三、置换反应
20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu
21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑
22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑
23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O
24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑
25、甲烷在空气中燃烧:CH4 +2O2 点燃 CO2+2H2O
26、水蒸气通过灼热碳层:H2O +C 高温 H2 +CO
27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑
其他
28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO4
29、甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O
30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O
31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO2
32、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO2
33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2==== CaCO3 ↓+ H2O
34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O
35、石灰石(大理石)与稀盐酸反应(二氧化碳的实验室制法):
CaCO3 +2HCl === CaCl2 +H2O +CO2↑
36、碳酸钠与浓盐酸反应(泡沫灭火器的原理):
Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑
一.物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO
2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O4
3. 铜在空气中受热:2Cu+ O2加热 2CuO
4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 +O2点燃 2H2O
6. 红磷在空气中燃烧:4P+ 5O2点燃 2P2O5
7. 硫粉在空气中燃烧: S +O2 点燃 SO2
8. 碳在氧气中充分燃烧:C+ O2点燃 CO2
9. 碳在氧气中不充分燃烧:2C+ O2点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO2
11. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 2H2O
12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2+3H2O
二.几个分解反应:
13. 水在直流电的作用下分解:2H2O 通电 2H2↑+ O2↑
14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO2↑
15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl+ 3O2↑
16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 +MnO2 +O2↑
17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑
18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑
三.几个氧化还原反应:
19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O
20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑
2 初三化学方程式大合集
21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe+ 3CO2↑
22. 焦炭还原四氧化三铁:2C +Fe3O4高温 3Fe+ 2CO2↑
23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO2
24. 一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe +3CO2
25. 一氧化碳还原四氧化三铁:4CO +Fe3O4高温 3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质+酸 -------- 盐+氢气(置换反应)
26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑
27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑
28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑
29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑
30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑
31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑
32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑
33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑
(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu
35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu
36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg
(3)碱性氧化物+酸 -------- 盐+水
37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O
38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O
39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O
40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O
41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O
42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O
(4)酸性氧化物+碱 -------- 盐+水
43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O
44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O
45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O
46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O
47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O
(5)酸+碱 -------- 盐+水
48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O
49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O
50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2 ==== CuCl2 +2H2O
51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O
52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O
53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O
54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O
55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O
56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O
57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O
58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
(6)酸+盐 -------- 另一种酸+另一种盐
59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑ 62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO3
63.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑
64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl (7)碱+盐 -------- 另一种碱+另一种盐
65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO4 66.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl
68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl
69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH
(8)盐+盐 ----- 两种新盐
70.氯化钠溶液和硝酸银溶液:
NaCl +AgNO3==== AgCl↓+ NaNO3
71.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl 五.其它反应:
72.二氧化碳溶解于水:CO2+ H2O === H2CO3
73.生石灰溶于水:CaO+ H2O === Ca(OH)2
74.氧化钠溶于水:Na2O +H2O ==== 2NaOH
75.三氧化硫溶于水:SO3 +H2O ==== H2SO4
76.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O
77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2
化学方程式反应现象应用
2Mg+ O点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验
2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体
4Al+ 3O点燃或Δ2Al2O3银白金属变为白色固体
3Fe+ 2O点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O高温2Fe2O3 C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊
S +O2点燃SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰
2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料
4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量
CH4+2O点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧
2C2H2+ 5O点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属
2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气
2KMnO4Δ K2MnO4 MnO2 +O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气
2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水
Cu2(OH)2CO3Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热
NH4HCO3ΔNH3↑+ H2O+ CO2↑
白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失
Zn+ H2SO4=ZnSO4 +H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解
Mg +H2SO4 =MgSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解
2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑ 有大量气泡产生、金属颗粒逐渐溶解
Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 +4H2 Δ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 +3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性
MoO3 +3H2ΔMo +3H2O 冶炼金属钼、利用氢气的还原性
2Na+ Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、
H2 +Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验
2C +O点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因
2CO +O点燃2CO2蓝色火焰煤气燃烧
C+ CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属
2Fe2O3+ 3C 高温4Fe+ 3CO2↑ 冶炼金属
Fe3O4 +2C高温3Fe+ 2CO2↑ 冶炼金属
C+ CO2 高温2CO
CO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性
H2CO3 ΔCO2↑+ H2O 石蕊红色褪去
Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁
CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+ H2O +CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成
2NaHCO3ΔNa2CO3+ H2O +CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO +CO2↑ 工业制备二氧化碳和生石灰
CaCO3 +2HCl=CaCl2+ H2O +CO2↑
固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢
初中化学方程式汇总
一、氧气的性质:
(1)单质与氧气的反应:(化合反应)
1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO
2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O4
3. 铜在空气中受热:2Cu+ O2加热 2CuO
4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O3
5. 氢气中空气中燃烧:2H2 +O2 点燃 2H2O
6. 红磷在空气中燃烧(研究空气组成的实验):4P +5O2点燃 2P2O5
7. 硫粉在空气中燃烧: S +O2 点燃 SO2
8. 碳在氧气中充分燃烧:C +O2点燃 CO2
9. 碳在氧气中不充分燃烧:2C +O2点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO+O2点燃 2CO2
11. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O
12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2 +3H2O
(3)氧气的来源:
13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2 ↑
14.加热高锰酸钾:2KMnO4加热 K2MnO4+ MnO2 +O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO22H2O+ O2↑(实验室制氧气原理2)
二、自然界中的水:
16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+O2 ↑ 17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)2
18.二氧化碳可溶于水: H2O+CO2==H2CO3
三、质量守恒定律:
19.镁在空气中燃烧:2Mg+ O2点燃 2MgO
20.铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu
21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O
22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO
四、碳和碳的氧化物:
(1)碳的化学性质
23. 碳在氧气中充分燃烧:C + O2点燃 CO2
24.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑
25.焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑
(2)煤炉中发生的三个反应:(几个化合反应)
26.煤炉的底层:C +O2 点燃 CO2
27.煤炉的中层:CO2+ C 高温 2CO
28.煤炉的上部蓝色火焰的产生:2CO +O2点燃 2CO2
(3)二氧化碳的制法与性质:
29.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3+ 2HCl == CaCl2+ H2O +CO2↑
30.碳酸不稳定而分解:H2CO3 == H2O +CO2↑
31.二氧化碳可溶于水: H2O +CO2== H2CO3
32.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑ 33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 +CO2 === CaCO3↓+H2O
(4)一氧化碳的性质:
34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO2
35.一氧化碳的可燃性:2CO +O2点燃 2CO2
其它反应:
36.碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3 2HCl == 2NaCl+ H2O +CO2↑
五、燃料及其利用:
37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O
38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2 +3H2O
39.氢气中空气中燃烧:2H2+ O2点燃 2H2O
六、金属
(1)金属与氧气反应:
40.镁在空气中燃烧:2Mg+ O2点燃 2MgO
41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O4
42. 铜在空气中受热:2Cu +O2加热 2CuO
43. 铝在空气中形成氧化膜:4Al+ 3O2 = 2Al2O3
(2)金属单质酸 -------- 盐氢气(置换反应)
44. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑
45. 铁和稀硫酸Fe +H2SO4 = FeSO4 +H2↑
46. 镁和稀硫酸Mg +H2SO4 = MgSO4+ H2↑
47. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑
48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑
49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑
50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑
51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑
(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐
52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4 +Cu
53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4 +Cu
54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 == Cu(NO3)2 +Hg
(3)金属铁的治炼原理:
55.3CO +2Fe2O3 高温 4Fe +3CO2↑
七、酸、碱、盐
1、酸的化学性质
(1)酸金属 -------- 盐氢气(见上)
(2)酸金属氧化物-------- 盐水
56. 氧化铁和稀盐酸反应:Fe2O3 +6HCl ==2FeCl3 +3H2O
57. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 == Fe2(SO4)3 +3H2O
58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2 +H2O
59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O
(3)酸碱 -------- 盐水(中和反应)
60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O
61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O
62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3 +3H2O
63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 +2H2O
(4)酸盐 -------- 另一种酸另一种盐
64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2 +H2O+ CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl+ H2O+ CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 +BaCl2 == BaSO4↓+2HCl
2、碱的化学性质
(1)碱非金属氧化物 -------- 盐水
68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3 +H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4 +H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2 == CaCO3↓+H2O
72. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 == CaSO3↓+ H2O
(2)碱酸-------- 盐水(中和反应,方程式见上)
(3)碱盐 -------- 另一种碱另一种盐
73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH
3、盐的化学性质
(1)盐(溶液)金属单质------- 另一种金属另一种盐
74. 铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu
(2)盐 酸-------- 另一种酸 另一种盐
75.碳酸钠与稀盐酸反应: Na 2CO 3 +2HCl == 2NaCl +H 2O+ CO 2↑ 碳酸氢钠与稀盐酸反应:NaHCO 3 +HCl== NaCl+ H 2O +CO 2↑ (3)盐 碱 -------- 另一种碱 另一种盐
76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH (4)盐 盐 ----- 两种新盐
77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3 == AgCl↓+NaNO 3 78.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl
一、其他反应类型
1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O
2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O
3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O
4、一氧化碳还原氧化铜:CO + CuO Cu + CO 2
5、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O
6、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O
△ 点燃 点燃
初中化学反应方程式汇总 一、氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧:2Mg + O2点燃 2MgO 2. 铁在氧气中燃烧:3Fe + 2O点燃 Fe3O4 3. 铜在空气中受热:2Cu + O2加热 2CuO 4. 铝在空气中燃烧:4Al + 3O2点燃 2Al2O3 5. 氢气中空气中燃烧:2H2 + O2点燃 2H2O 6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2点燃 2P2O5 7. 硫粉在空气中燃烧: S + O2点燃 SO2 8. 碳在氧气中充分燃烧:C + O2点燃 CO2 9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO + O2点燃 2CO2 11. 甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O 12. 酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O (3)氧气的来源: 13.玻义耳研究空气的成分实验 2HgO 加热 Hg+ O2↑ 14.加热高锰酸钾:2KMnO4加热 K2MnO4 + MnO2 + O2↑(实验室制氧气原理1) 15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO22H2O+ O2↑(实验室制氧气原理2) 二、自然界中的水: 16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑
17.生石灰溶于水:CaO + H2O == Ca(OH)2 18.二氧化碳可溶于水: H2O + CO2==H2CO3 三、质量守恒定律: 19.镁在空气中燃烧:2Mg + O2点燃 2MgO 20.铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu 21.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O 22. 镁还原氧化铜:Mg + CuO 加热 Cu + MgO 四、碳和碳的氧化物: (1)碳的化学性质 23. 碳在氧气中充分燃烧:C + O2点燃 CO2 24.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑ 25.焦炭还原氧化铁:3C+ 2Fe2O3高温 4Fe + 3CO2↑ (2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层:C + O2点燃 CO2 27.煤炉的中层:CO2 + C 高温 2CO 28.煤炉的上部蓝色火焰的产生:2CO + O2点燃 2CO2 (3)二氧化碳的制法与性质: 29.大理石与稀盐酸反应(实验室制二氧化碳): CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑ 31.二氧化碳可溶于水: H2O + CO2== H2CO3 32.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO + CO2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳): Ca(OH)2 + CO2 == CaCO3 ↓+ H2O (4)一氧化碳的性质:
1.元素符号: H He C N O F Ne Na Mg Al Si P S Cl 氢氦碳氮氧氟氖钠镁铝硅磷硫氯 Ar K Ca Mn Fe Cu Zn Ag Ba Pt Au Hg I 氩钾钙锰铁铜锌银钡铂金汞碘 2.常见离子和化合物中元素的化合价: H+ Na+ K+ Ag+ NH4+ +1价 氢离子钠离子钾离子银离子铵根离子 Ca2+ Mg2+ Cu2+ Ba2+ Zn2+ Fe2+ +2价 钙离子镁离子铜离子钡离子锌离子亚铁离子 Fe3+ Al3+ +3价 铁离子铝离子 Cl- OH- NO3- -1价 氯离子氢氧根离子硝酸根离子 O2- SO42- CO32- -2价 氧离子硫酸根离子碳酸根离子 3.常见物质的化学式与名称: 单质: C:碳S:硫P:磷Fe:铁Mg:镁Al:铝Hg:汞Zn:锌Cu:铜Ag:银O2:氧气H2:氧气N2:氮气O3:臭氧 氧化物: CO:一氧化碳CO2:二氧化碳SO2:二氧化硫MnO2:二氧化锰 SO3:三氧化硫H2O2:过氧化氢CuO:氧化铜CaO:氧化钙 MgO:氧化镁HgO:氧化汞Fe2O3:氧化铁Al2O3:氧化铝 H2O:水P2O5:五氧化二磷Fe3O4:四氧化三铁 酸: HCl:盐酸H2SO4:硫酸HNO3:硝酸H2CO3:碳酸
H2S亚硫酸CH3COOH:醋酸 碱: NaOH:氢氧化钠Ca(OH)2:氢氧化钙 KOH:氢氧化钾Mg(OH)2:氢氧化镁Cu(OH)2:氢氧化铜NH3 .H2O氨水Fe(OH)3:氢氧化铁Al(OH)3:氢氧化铁 盐酸盐: KCl:氯化钾NaCl:氯化钠KCl:氯化钾AgCl:氯化银CuCl2:氯化铜CaCl2:氯化钙MgCl2:氯化镁ZnCl2:氯化锌BaCl2:氯化钡FeCl2:氯化亚铁AlCl3:氯化铝FeCl3:氯化铁碳酸盐: CaCO3:碳酸钙Na2CO3:碳酸钠NaHCO3:碳酸氢钠BaCO3:碳酸钡K2CO3:碳酸钾NH4HCO3:碳酸氢铵硫酸盐: Na2SO4:硫酸钠ZnSO4:硫酸锌MgSO4:硫酸镁CaSO4:硫酸钙CuSO4:硫酸铜BaSO4:硫酸钡FeSO4:硫酸亚铁Fe2(SO4)3:硫酸铁Al2(SO4)3:硫酸铝(NH4)2SO4:硫酸铵Na2SO3:亚硫酸钠 硝酸盐: AgNO3:硝酸银NaNO3:硝酸钠Cu(NO3)2:硝酸铜KNO3:硝酸钾NH4NO3:硝酸铵NaNO2:亚硝酸钠钾盐: KMnO4:高锰酸钾K2MnO4:锰酸钾KClO3:氯酸钾 有机化合物:
初中常见化学式和化学方程式 第一部分八年级内容一、常见单质 二、化合物 1、氧化物 2、其他化合物
3、常见有机化合物 三、常见反应的化学方程式 1. 镁在空气中燃烧:2Mg + O2 点燃2MgO 2. 铁在氧气中燃烧:3Fe + 2O点燃Fe3O4 3. 氢气中空气中燃烧:2H2 + O2 点燃2H2 O 4. 红磷在空气中燃烧:4P + 5O点燃2P2 O5 5. 硫粉在空气中燃烧:S + O点燃SO2 6. 碳在氧气中充分燃烧:C + O2 点燃CO2 7. 碳在氧气中不充分燃烧:2C + O点燃2CO 8. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO2 9. 甲烷在空气中燃烧:CH4 + 2O点燃CO2 +2H2 O 10. 酒精在空气中燃烧:C2 H5OH + 3O点燃2CO2 +3H2 O
11. 水在直流电的作用下分解:2H2 O 通电2H2 ↑+ O2 ↑ 12. 过氧化氢的分解:2H2O2MnO22H2O+O 2↑ 13. 加热氯酸钾(有少量的二氧化锰):2KClO3△2KCl + 3O2 ↑ 14. 加热高锰酸钾:2KMnO△K2 MnO4 + MnO2 + O2 ↑ 15. 碳酸不稳定而分解:H2 CO3H2 O + CO2↑;H2 CO3△H2 O + CO2↑ 16. 高温煅烧石灰石(工业制CO2):CaCO3高温CaO + CO2 ↑ 17. 氢气还原氧化铜:H2 + CuO△Cu + H2 O 18. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2 ↑ 19. 焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑ 20. 焦炭还原四氧化三铁:2C+ Fe3O高温3Fe + 2CO2↑ 21. 一氧化碳还原氧化铜:CO+ CuO △Cu + CO2 22. 一氧化碳还原氧化铁:3CO+ Fe2 O3高温2Fe + 3CO2 23. 一氧化碳还原四氧化三铁:4CO+ Fe3O高温3Fe + 4CO2 24. 锌和稀盐酸(实验室制氢气):Zn + 2HCl === ZnCl2 + H2 ↑ 25. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 26.检验CO2 :Ca(OH) 2 + CO2 ==== CaCO 3↓+ H2 O 27.大理石(或石灰石)与稀盐酸反应(实验室制CO2): CaCO 3+ 2HCl === CaCl2 + H2 O + CO2↑ 28.氢氧化钠与硫酸铜:2NaOH + CuSO4==== Cu(OH) 2↓+ Na2 SO4
. 初中化学方程式汇总 一、物质与氧气的反应: (1)单质与氧气的反应: 1. 镁在空气中燃烧: 2Mg + O2点燃 2MgO 2. 铁在氧气中燃烧: 3Fe + 2O2点燃 Fe3O4 3. 铜在空气中受热: 2Cu + O2加热 2CuO 4. 铝在空气中燃烧: 4Al + 3O2点燃 2Al2O3 5. 氢气中空气中燃烧: 2H2 + O2点燃 2H2O 6. 红磷在空气中燃烧: 4P + 5O2点燃 2P2O5 7. 硫粉在空气中燃烧: S + O2点燃 SO2 8. 碳在氧气中充分燃烧: C + O2点燃 CO2 9. 碳在氧气中不充分燃烧: 2C + O2点燃 2CO
(2)化合物与氧气的反应: 10.一氧化碳在氧气中燃烧: 2CO + O2点燃 2CO2 11.甲烷在空气中燃烧: CH4 + 2O2点燃 CO2 + 2H2O 12.酒精在空气中燃烧: C2H5OH + 3O2点燃 2CO2 + 3H2O 二、几个分解反应: 13.水在直流电的作用下分解: 2H2O 通电 2H2↑+ O2 ↑ 14.加热碱式碳酸铜: C u2(OH)2CO3加热2CuO + H2O + CO2↑ 15.加热氯酸钾(有少量的二氧化锰):2KClO3Mn O2 2KCl + 3O2 ↑ 16.加热高锰酸钾: 2KMnO4加热K2MnO4 + MnO2 + O2 ↑ 17.碳酸不稳定而分解: H2CO3 === H2O + CO2↑ 18.高温煅烧石灰石: CaCO3高温CaO + CO2↑ 18-1.双氧水(过氧化氢)催化分解:2H2O2Mn O22H2O + O2↑ 三、几个氧化还原反应: 19.氢气还原氧化铜: H2 + CuO加热 Cu + H2O 20.木炭还原氧化铜: C + 2CuO 高温2Cu + CO2↑ 21.焦炭还原氧化铁: 3C + 2Fe2O3高温4Fe + 3CO2↑ 22.焦炭还原四氧化三铁: 2C + Fe3O4高温3Fe + 2CO2↑ 23.一氧化碳还原氧化铜: CO + CuO 加热Cu + CO2 24.一氧化碳还原氧化铁: 3CO + Fe2O3高温2Fe + 3CO2 25.一氧化碳还原四氧化三铁: 4CO + Fe3O4高温3Fe + 4CO2 四、单质、氧化物、酸、碱、盐的相互关系 (1)金属单质 + 酸┈┈┈┈盐 + 氢气(置换反应) 26.锌和稀硫酸 Zn + H2SO4 === ZnSO4 + H2↑ 27.铁和稀硫酸 Fe + H2SO4 === FeSO4 + H2↑ 28.镁和稀硫酸 Mg + H2SO4 === MgSO4 + H2↑ 29.铝和稀硫酸 2Al +3H2SO4 === Al2(SO4)3 +3H2↑ 30.锌和稀盐酸 Zn + 2HCl=== ZnCl2 + H2↑
常见物质的化学式 单质 化合物 氧化物 酸 碱
有机物 其他:氨气NH3 常见物质的俗名
常见的化学方程式 说明:用楷体标示的内容不是重点。 化合反应 ●红磷在空气中燃烧,产生白烟:4P+5O22P2O5 白磷自燃:4P+5O2=2P2O5 ●木炭充分燃烧:C+O2CO2 ●木炭不充分燃烧:2C+O22CO ●硫在空气(氧气)中燃烧:S+O2SO2 ●铁丝在氧气中燃烧:3Fe+2O2Fe3O4 ●铝在氧气中燃烧:4Al+3O22Al2O3 铝不易生锈的原因:4Al+3O2=2Al2O3 ●镁在空气中燃烧:2Mg+O22MgO ●铜在空气中加热:2Cu+O22CuO ●氢气在氧气中燃烧:2H2+O22H2O ●将CO2变成CO:C+CO22CO ●二氧化碳溶于水形成碳酸:CO2+H2O=H2CO3 ●用生石灰制取熟石灰:CaO+H2O=Ca(OH)2 ●一氧化碳燃烧:2CO+O22CO2 ●向澄清的石灰水中通入过量的二氧化碳,变浑浊的石灰水又变澄清: CaCO3+CO2+H2O=Ca(HCO3)2 ●氢气在氯气中燃烧:H2+Cl22HCl 钠在氯气中燃烧:2Na+Cl22NaCl 镁在氮气中燃烧:3Mg+N2Mg3N2(注意氮元素的化合价) 上面三个化学方程式给我们的启示是:燃烧不一定有氧气参与。 分解反应 ●汞在空气中加热:2Hg+O22HgO ●氧化汞加强热:2HgO2Hg+O2↑ ●分解过氧化氢制取氧气(实验室制取氧气的反应原理之一):2H2O22H2O+O2↑ 加热高锰酸钾制取氧气(实验室制取氧气的反应原理之一):2KMnO4K2MnO4+MnO2+O2↑ 加热氯酸钾制取氧气(实验室制取氧气的反应原理之一):2KClO32KCl+3O2↑ 分解过氧化氢制取氧气符合绿色化学的观念,是三种方案中最安全、最节约资源的一种。 ●电解水生成氢气和氧气:2H2O2H2↑+O2↑ ●工业制取生石灰和CO2的反应原理:CaCO3CaO+CO2↑ ●干粉灭火器的反应原理(碳酸氢钠受热分解):2NaHCO3Na2CO3+H2O+CO2↑ ●碱式碳酸铜受热分解:Cu2(OH)2CO32CuO+H2O+CO2↑ ●过氧化氢溶液不稳定,发生分解:2H2O2=2H2O+O2↑ ●碳酸不稳定,分解成水和二氧化碳:H2CO3=H2O+CO2↑ ●碳铵(碳酸氢铵)“消失”并发出刺激性气味:NH4HCO3=NH3↑+CO2↑+H2O
初中化学方程式大全 一、氧气的性质: (1)单质与氧气的反应:(化合反应) 1.镁在空气中燃烧:2Mg + O2 点燃 2MgO 2.铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4 3.铜在空气中受热:2Cu + O2 加热 2CuO 4.铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3 5.氢气中空气中燃烧:2H2 + O2 点燃 2H2O 6.红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃 2P2O5 7.硫粉在空气中燃烧: S + O2 点燃 SO2 8.碳在氧气中充分燃烧:C + O2 点燃 CO2 9.碳在氧气中不充分燃烧:2C + O2 点燃 2CO (2)化合物与氧气的反应: 10.一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2 11.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 12. 酒精在空气中燃烧:C2H5OH+ 3O2 点燃 2CO2+ 3H2O (3)氧气的来源: 13. 玻义耳研究空气的成分实验 2HgO 加热Hg+ O2 ↑ 14. 加热高锰酸钾:2KMnO4加热K2MnO4+ MnO2 + O2↑(实验室制氧气原理1)加热氯酸钾:2KClO3加热2KCl + 3O2↑(实验室制氧气原理2) 15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理3) 二、自然界中的水: 16. 水在直流电的作用下分解(研究水的组成实验):2H2O通电2H2↑+ O2 ↑ 17. 生石灰溶于水:CaO + H2O= Ca(OH)2 18. 二氧化碳可溶于水: H2O+ CO2= H2CO3 三、质量守恒定律: 19. 镁在空气中燃烧:2Mg+ O2 点燃2MgO 20. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4+ Cu
初中化学常见物质化学式、名称及其俗称 一、必须掌握部分 1. C :碳,金刚石、石墨、木炭、活性炭、焦炭、煤的主要成分; 2.CO2:二氧化碳,干冰; 3.CO :一氧化碳,煤气; 4.水煤气:CO和H2混合气; 5.CH4:甲烷,天然气、瓦斯、沼气的主要成分; 6.CH3OH :甲醇; 7.> 8.C2H5OH :乙醇,酒精; 9.CH3COOH :乙酸,醋酸; 10.C6H12O6:葡糖糖; 11.Hg :汞,水银; 12.P :磷,白磷、红磷、黄磷为同素异形体; 13.S :硫,硫磺; 14.Fe :铁,生铁、钢、不锈钢的主要成分; 15.HCl :氯化氢,盐酸(氢氯酸)、胃酸的主要成分; 16.] 17.H2O2:过氧化氢,双氧水; 18.KOH :氢氧化钾,苛性钾; 19.K2CO3:碳酸钾,草木灰的主要成分; 20.CaO :氧化钙,生石灰; 21.Ca(OH)2:氢氧化钙,消石灰、熟石灰,石灰浆/乳、石灰水的主要成分; 22.CaCO3:碳酸钙,大理石、石灰石的主要成分; 23.漂白粉(有效成分为Ca(ClO)2):次氯酸钙Ca(ClO)2 和氯化钙CaCl2混合物; 24.水垢的主要成分:CaCO3 和 Mg(OH)2; 25.~ 26.NaCl :氯化钠,食盐;生理盐水是%的NaCl溶液; 27.NaNO2:亚硝酸钠(工业用盐,有毒); 28.NaOH :氢氧化钠,火碱、烧碱、苛性钠; 29.Na2CO3:碳酸钠,纯碱、苏打; 30.NaHCO3:碳酸氢钠,小苏打; 31.Al2O3:三氧化二铝,铝土矿(存在刚玉,即红宝石、蓝宝石)的主要成分; 32.Al(OH)2 :氢氧化铝,胃舒平的主要成分; 33.Fe2O3:氧化铁,铁锈和赤铁矿的主要成分; 34./ 35.Fe3O4:四氧化三铁,磁铁矿、烤蓝、考黑; 36.NH4HCO3:碳酸氢铵,碳铵; 37.(NH4)2SO4:硫酸铵,硫铵; 38.NH4NO3:硝酸铵,硝铵;
初中化学常见化学方程式大全一.物质与氧气的反应: (1)单质与氧气的反应: 1. 镁在空气中燃烧:2Mg+O22MgO 2. 铁在氧气中燃烧:3Fe + 2O2Fe3O4 3. 铜在空气中受热:2Cu + O22CuO 4. 铝在空气中燃烧:4Al +3O22Al2O3 5. 氢气中空气中燃烧:2H2+O22H2O 6. 红磷在空气中燃烧:4P+5O22P2O5 7. 硫粉在空气中燃烧:S+O2SO2 8. 碳在氧气中充分燃烧:C + O2CO2 9. 碳在氧气中不充分燃烧:2C + O22CO (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO + O22CO2 11. 甲烷在空气中燃烧:CH4 + 2O2CO2 + 2H2 O 12. 酒精在空气中燃烧:C2 H5OH + 3O22CO2+ 3H2 O 二.几个分解反应: 13. 水在直流电的作用下分解:2H2O2H2↑+O2↑ 14. 用过氧化氢制氧气:2H2O22H2O+O2↑ 15. 用氯酸钾制取氧气(有少量的二氧化锰):2KClO32KCl+3O2↑ 16. 用高锰酸钾制氧气:2KMnO4K2 MnO4 + MnO2+ O2↑ 17. 碳酸不稳定而分解:H2 CO3 === H2 O + CO2↑ 18. 高温煅烧石灰石:CaCO3CaO + CO2↑ 三.几个氧化还原反应: 19. 氢气还原氧化铜:H2+ CuO Cu + H2 O 20. 木炭还原氧化铜:C+ 2CuO 2Cu + CO2↑
21. 焦炭还原氧化铁:3C+ 2Fe2O34Fe + 3CO2↑ 22. 焦炭还原四氧化三铁:2C+ Fe3O43Fe + 2CO2↑ 23. 一氧化碳还原氧化铜:CO+ CuO Cu + CO2 24. 一氧化碳还原氧化铁(炼铁):3CO+ Fe2 O32Fe + 3CO2 25. 一氧化碳还原四氧化三铁:4CO+ Fe3O43Fe + 4CO2 四.单质、氧化物、酸、碱、盐的相互关系 (1)金属单质+ 酸-------- 盐+ 氢气(置换反应) 26. 实验室用锌与稀硫酸反应制取氢气Zn + H2 SO4 = ZnSO 4+ H2↑ 27. 铁和稀硫酸Fe +H2SO4=FeSO4+ H2↑ 28. 镁和稀硫酸Mg + H2 SO4 = MgSO4 + H2↑ 29. 铝和稀硫酸2Al+ 3H2SO4= Al2(SO4)3 + 3H2↑ 30. 锌和稀盐酸Zn + 2HCl=ZnCl2 + H2↑ 31. 铁和稀盐酸Fe + 2HCl = FeCl2 + H2↑ 32. 镁和稀盐酸Mg+ 2HCl === MgCl 2 + H2↑ 33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + H2↑ (2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐 34. 铁和硫酸铜溶液反应:Fe+CuSO4====Cu+FeSO4 35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu 36. 铜和硝酸汞溶液反应:Cu + Hg(NO3) 2=== Cu(NO3) 2 + Hg 铜和硝酸银溶液反应:Cu + 2A gNO3=== Cu(NO3) 2 + 2A g (3)碱性氧化物+酸-------- 盐+ 水 37. 氧化铁和稀盐酸反应(除铁锈):Fe2O3 + 6HCl ===2 FeCl 3+ 3H2O 38. 氧化铁和稀硫酸反应(除铁锈):Fe2O3 + 3H2SO4 === Fe2 (SO4) 3+ 3H2O 39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2 O 40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2 O 41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O 42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2+ H2 O (4)酸性氧化物+碱-------- 盐+ 水 43.氢氧化钠暴露在空气中变质(除去二氧化碳)2NaOH + CO2 =Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3==== Na2SO4 + H2O 46.用石灰水检验二氧化碳/石灰水在空气中变质/用石灰浆粉刷墙壁: Ca(OH) 2+ CO2==== CaCO 3↓+ H2 O 47. 消石灰吸收二氧化硫:Ca(OH) 2+ SO2==== CaSO 3↓+ H2 O (5)酸+ 碱-------- 盐+ 水 48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2 O 49.盐酸和氢氧化铜反应:2HCl + Cu(OH) 2==== CuCl2 + 2H2 O 50. 盐酸和氢氧化钙反应:2HCl + Ca(OH) 2 ==== CaCl2+ 2H2 O
常见化学式和化学方程 式含答案 集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]
常见化学式和化学方程式 化学式 1.单质: 非金属:氢气、氧气、臭氧、氮气、氯气、碳、硫、磷、碘 H 2、O 2 、O 3 、N 2 、Cl 2 、C、S、P、I 2 稀有气体:氦气、氖气、氩气:He、Ne、Ar 金属:钠、钾、镁、铝、钙、锌、铁、铜、金、银、汞、锰 Na、K、Mg、Al、Ca、Zn、Fe、Cu、AuAg、Hg、Mn 2.氧化物: 非金属氧化物:一氧化碳、二氧化碳、二氧化硫、三氧化硫、一氧化氮、 CO、CO 2、SO 2 、SO 3 、NO 二氧化氮、五氧化二氮、五氧化二磷、水、过氧化氢、二氧化硅 NO 2、N 2 O 5 、P 2 O 5 、H 2 O、H 2 O 2 、SiO 2 金属氧化物:氧化钠、氧化镁、氧化钙、氧化铜、氧化汞、二氧化锰、 Na 2O、MgO、CaO、CuO、HgO、MnO 2 氧化铝、氧化铁、氧化亚铁、四氧化三铁、氧化亚铜 Al 2O 3 、Fe 2 O 3 、FeO、Fe 3 O 4 、Cu 2 O 3.酸:盐酸、硝酸、硫酸、碳酸、醋酸 HCl、HNO 3、H 2 SO 4 、H 2 CO 3 、CH 3 COOH 4.氢氧化物:氢氧化钠、氢氧化钙、氢氧化镁、氢氧化铜、氢氧化铝、氢氧化铁 NaOH、Ca(OH) 2、Mg(OH) 2 、Cu(OH) 2 、Al(OH) 3 、Fe(OH) 3 5.氯化物:氯化钠、氯化镁、氯化钙、氯化铜、氯化锌、氯化铝、氯化铁、氯化亚铁 NaCl、MgCl 2、CaCl 2 、CuCl 2 、ZnCl 2 、AlCl 3 、FeCl 3 、FeCl 2 6.硝酸盐:硝酸钾、硝酸镁、硝酸钙、硝酸铜、硝酸银、硝酸铝、硝酸铁、硝酸汞 KNO 3、Mg(NO 3 ) 2 、Ca(NO 3 ) 2 、Cu(NO 3 ) 2 、AgNO 3 、Al(NO 3 ) 3 、Fe(NO 3 ) 3 、Hg(NO 3 ) 2 7.硫酸盐:硫酸钠、硫酸镁、硫酸钙、硫酸铜、硫酸锌、硫酸铝、硫酸铁、硫酸亚铁 Na 2SO 4 、MgSO 4 、CaSO 4 、CuSO 4 、ZnSO 4 、Al 2 (SO 4 ) 3 、Fe 2 (SO 4 ) 3 、FeSO 4 8.碳酸盐:碳酸钠、碳酸镁、碳酸钙、碳酸铜、碳酸锌、碳酸钡、碱式碳酸铜 Na 2CO 3 、MgCO 3 、CaCO 3 、CuCO 3 、ZnCO 3 、BaCO 3 、Cu 2 (OH) 2 CO 3 9.其它盐:氯酸钾、高锰酸钾、锰酸钾 KClO 3、KMnO 4 、K 2 MnO 4 10.有机物:甲烷、酒精、葡萄糖、蔗糖、淀粉 CH 4、C 2 H 5 OH、C 6 H 12 O 6 、C 12 H 22 O 11 、(C 6 H 10 O 5 ) n 11.氢化物:氨气、氯化氢、硫化氢 NH 3、HCl、H 2 S 化学方程式 一、氧气的性质(燃烧): 1.镁在空气中燃烧:2Mg+O 2 2MgO 2.铁在氧气中燃烧:3Fe+2O 2Fe 3 O 4
初中常见化学式及化学方程式 常见的化学式
初中化学方程式全(已配平). 一、化合反应 1、镁在空气中燃烧:2Mg+ O2点燃2MgO 2、铁在氧气中燃烧:3Fe +2O2点燃Fe3O4 3、铝在空气中燃烧:4Al+ 3O2点燃2Al2O3 4、氢气在空气中燃烧:2H2 +O2点燃2H2O 5、红磷在空气中燃烧:4P +5O2点燃2P2O5 6、硫粉在空气中燃烧:S+ O2点燃SO2 7、碳在氧气中充分燃烧:C +O2 点燃CO2 8、碳在氧气中不充分燃烧:2C +O2点燃2CO 9、二氧化碳通过灼热碳层:C +CO2高温2CO 10、一氧化碳在氧气中燃烧:2CO +O2 点燃2CO2 11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO3 12、生石灰溶于水:CaO+ H2O === Ca(OH)2 13、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O 14、钠在氯气中燃烧:2Na+ Cl2点燃2NaCl 二、分解反应 15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑ 16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2+O2↑
17、水在直流电的作用下分解:2H2O 通电2H2↑+O2↑ 18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑ 19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑ 三、置换反应 20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu 21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+ H2↑ 22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑ 23、氢气还原氧化铜:H2 +CuO 加热Cu +H2O 24、木炭还原氧化铜:C+ 2CuO 高温2Cu +CO2↑ 25、甲烷在空气中燃烧:CH4 +2O2 点燃CO2+2H2O 26、水蒸气通过灼热碳层:H2O +C 高温H2 +CO 27、焦炭还原氧化铁:3C +2Fe2O3高温4Fe +3CO2↑ 其他 28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO4 29、甲烷在空气中燃烧:CH4 +2O2点燃CO2 +2H2O 30、酒精在空气中燃烧:C2H5OH+ 3O2点燃2CO2 +3H2O 31、一氧化碳还原氧化铜:CO +CuO 加热Cu+ CO2 32、一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe+ 3CO2 33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O
中学常见化学式一、常见单质 二、化合物 1、氧化物 2、其他化合物
3、常见有机化合物 初中化学方程式汇总 一、氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧:2Mg+ O 点燃 2MgO 2 2. 铁在氧气中燃烧:3Fe+ 2O 点燃 FeO 423 3. 铜在空气中受热:2Cu+ O 加热 2CuO 2 4. 铝在空 气中燃烧:4Al +3O2 点燃2AlO 32 5. 氢气中空气中燃烧:2H +O点燃 2HO 222 6. 红磷在空气中燃烧(研究空气组成的实验):4P +5O 点燃 2PO 522 7. 硫粉在空气中燃烧: S +O点燃 SO 2 2 8. 碳在氧气中充分燃烧:C +O 点燃 CO 229. 碳在氧气中不充分燃烧: 2C +O 点燃 2CO 2(2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO+O 点燃 2CO 2 211. 甲烷在空气中燃烧:CH +2O 点燃 CO +2HO 222412. 酒精在空气中燃烧:CHOH +3O 点燃 2CO +3HO 25222(3)氧气的来源: 13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O↑ 2 14.加热高锰酸钾:2KMnO 加热 KMnO+ MnO +O↑(实验室制氧气原理1)22244 15.过氧化氢在二氧化锰作催化剂条件下分解反应: HO MnO2HO+ O ↑
(实22222验室制氧气原理2) 二、自然界中的水: 16.水在直流电的作用下分解(研究水的组成实验):2HO 通电 2H↑+O ↑ 2 22 17.生石灰溶于水英语六级作文:CaO +HO == Ca(OH) 2218.二氧化碳可溶于水: HO+CO==HCO 3222三、质量守恒定律: 19.镁在空气中燃烧:2Mg+ O 点燃 2MgO 220.铁和硫酸铜溶液反应:Fe+ CuSO === FeSO+ Cu 4421.氢气还原氧化铜:H+CuO 加热 Cu +HO 22 22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO 四、碳和碳的氧化物: (1)碳的化学性质 23. 碳在氧气中充分燃烧:C + O 点燃 CO 2224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO↑225.焦炭还原氧化铁:3C + 2Fe2O 高温 4Fe + 3CO ↑23(2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层:C +O点燃 CO 22 27.煤炉的中层:CO+ C 高温 2CO 228.煤炉的上部蓝色火焰的产生:2CO +O 点燃 2CO 22(3)二氧化碳的制法与性质: 29.大理石与稀盐酸反应(实验室制二氧化碳): CaCO+ 2HCl == CaCl+ HO +CO↑232230.碳酸不稳定而分解:HCO == HO +CO↑ 222331.二氧化碳可溶于水: HO +CO== HCO 3 22232.高温煅烧石灰石(工业制二氧化碳):CaCO 高温 CaO+ CO↑2333.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳): Ca(OH) +CO=== CaCO ↓+HO 232 2(4)一氧化碳的性质: 34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO 235.一氧化碳的可燃性:2CO +O 点燃 2CO 22其它反应: 36.碳酸钠与稀盐酸反应(灭火器的原理): NaCO 2HCl == 2NaCl+ HO +CO↑2322五、燃料及其利用: 37.甲烷在空气中燃烧:CH +2O 点燃 CO +2HO 224238.酒精在空气中燃烧:CHOH +3O2 点燃 2CO +3HO 225239.氢气中空气中燃烧:2H+ O 点燃 2HO 222六、金属 (1)金属与氧气反应: 40.镁在空气中燃烧:2Mg+ O 点燃 2MgO 241.铁在氧气中燃烧:3Fe +2O 点燃 FeO 43242. 铜在空气中受热:2Cu +O 加热 2CuO 243. 铝在空气中形成氧化膜:4Al+ 3O = 2AlO 322. (2)金属单质酸 -------- 盐氢气(置换反应) 44. 锌和稀硫酸Zn+ HSO = ZnSO+ H↑242445. 铁和稀硫酸Fe +HSO= FeSO +H↑24 2446. 镁和稀硫酸Mg +HSO = MgSO+ H↑224447. 铝和稀硫酸2Al+ 3HSO = Al(SO)
曾鸿迪VIP一对一化学培优第7讲 书写化学方程式及配平方法 知识小清单 一、化学方程式的书写原则: 1、:即不能凭空臆造不存在的反应,也不能乱书写不存在的物质的化学式; 2、:即等号两边的各种原子的数目要相等。 二、化学方程式的书写步骤: 1、写:根据实验事实写出反应物和生成物的化学式,中间用短线连接; 2、注:注明反应条件; 3、配:配平化学方程式,在化学式前面添上适当的化学计量数,使各种元素的原子个数反应前后相等,从而体现质量守恒定律; 4、等:将短线(或箭头线)改为等号; 5、标:标明生成物的状态,有气体用“↑”,沉淀物用“↓”。注意:气体生成是指反应物中本身无气态物质,反应后产生了气体物质才使用,而沉淀是针对溶液中进行的反应,原来无固态物质,现在产生了固态物质才使用。 三、化学方程式配平方法 ①、最小公倍数法: (找出两边同种原子的个数最多的原子,然后求最小公倍数,得原子个数。) 1、 Al + O 2—— Al 2 O 3 2、Al + Fe 3 O 4 —— Fe + Al 2 O 3 3、 Fe + O 2—— Fe 3 O 4 4、Al + MnO 2 —— Mn + Al 2 O 3 5、 N 2 + H 2 —— NH 3 6、Al + H 2 SO 4 —— Al 2 (SO 4 ) 3 + H 2 ②、观察法: (观察顺序:从复杂入手,推导其它)(具体观察顺序——O、C、Fe) 1、 CO + Fe 2O 3 —— Fe + CO 2 2、 C + Fe 2 O 3 —— Fe + CO 2 3、 CO + Fe 3O 4 —— Fe + CO 2 4、 C + Fe 3 O 4 —— Fe + CO 2 5、 CO + FexOy —— Fe + CO 2 6、 C + FexOy—— Fe + CO 2 7、 H 2 + Fe 2 O 3 —— Fe + H 2 O 8、H 2 + Fe 3 O 4 —— Fe + H 2 O 9、 H 2 + Fe X O Y —— Fe + H2O 10、H 2 + WO 3 —— W + H 2 O 11、 CO + O 2 —— CO 2 12、Fe + H 2 O—— H 2 + Fe 3 O 4 13、 Al(OH) 3 + HCl ——AlCl 3 + H2O ③、奇数配偶法: (找出左右两边出现次数较多的元素,该元素的原子个数在两边为一基数一偶数) 1、 FeS 2 + O 2 —— Fe 2 O 3 + SO 2 2、 C 2 H 2 + O 2 ——CO 2 + H 2 O 3、 C + Fe 2 O 3 —— Fe + CO 2 4、 MnO 2 + HCl—— MnCl 2 + Cl 2 + H 2 O 5、 Cl 2 + Ca(OH) 2 —— CaCl 2 + Ca(ClO) 2 + H 2 O ④、归一法: (找出化学式中原子数目最多的化学式,使其化学计量数为“1”,观察配平,若是分数再进行通分 去掉分母,保证最后得到最简整数比) 1、 C 2 H 2 + O 2 ——CO 2 + H 2 O 2、C 6 H 6 + O 2 —— CO 2 + H 2 O 3、 C 22 H 46 + O 2 ——CO 2 + H 2 O 4、 NH 3 + Cl2 —— NH 4 Cl + N 2 5、 As 2 O 3 + Zn + HCl——AsH 3 + ZnCl 2 + H 2 O 6、C X H Y + O 2 ——CO 2 + H 2 O 易混淆清单 化学反应方程式中的“↑”和“↓”使用范围:气体生成是指反应物中本身无气态物质,反应后 产生了气体物质才使用,而沉淀是针对溶液中进行的反应,原来无固态物质,现在产生了固态物质 才使用。
初三化学常见物质的化学式 1、单质:H2氢气O2氧气N2氮气C碳P磷S硫Fe铁Cu铜Hg汞 2、化合物 (1)氧化物:H2O水CO2二氧化碳CO一氧化碳SO2二氧化硫SO3三氧化硫 P2O5五氧化二磷Fe2O3氧化铁Fe3O4四氧化三铁CaO氧化钙MgO氧化镁 CuO氧化铜ZnO氧化锌FeO氧化亚铁MnO2二氧化锰 Na2O氧化钠 (2)酸:HCl盐酸H2SO4硫酸HNO3硝酸H3PO4磷酸H2CO3碳酸H2SO3亚硫酸 (3)碱:NaOH氢氧化钠KOH氢氧化钾Ca(OH)2氢氧化钙Ba(OH)2氢氧化钡Cu(OH)2 氢氧化铜Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁Al(OH)3氢氧化铝Mg(OH)2氢氧化镁 (4)盐:NaCl氯化钠Na2CO3碳酸钠ZnCl2氯化锌CaCl2氯化钙KCl氯化钾Na2SO4硫酸 钠 CuSO4硫酸铜AgCl氯化银FeCl3氯化铁FeCl2氯化亚铁AlCl3氯化铝FeSO4硫酸亚铁 Fe2(SO4)3硫酸铁ZnSO4硫酸锌CaCO3碳酸钙BaCl2氯化钡BaSO4硫酸钡KClO3氯酸钾KMnO4高锰酸钾K2MnO4锰酸钾KNO3硝酸钾Cu(NO3)2硝酸铜Hg(NO3)2硝酸汞NH4Cl 氯化铵NH4NO3 硝酸铵(NH4)2SO4硫酸铵NH4HCO3碳酸氢铵NaHCO3碳酸氢钠Cu2(OH)2CO3碱式碳酸 铜 (5)有机物:CH4甲烷C2H5OH乙醇(酒精)CH3OH甲醇CH3COOH乙酸(醋酸)CO(NH2)2 尿素,葡萄糖:C6H12O6淀粉:(C6H10O5)n 初三化学必需的记忆性知识 一、常见物质的颜色的状态 1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH) 2、KClO 3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态) 2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色 3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色 4、溶液的颜色:凡含Cu2+的溶液呈蓝色(如:CuSO4溶液、CuCl2溶液、Cu(NO3)2溶液);凡 含Fe2+的溶液呈浅绿色(如:FeSO4溶液、FeCl2溶液、Fe (NO3)2溶液);凡含Fe3+的溶液呈棕 黄色(如:Fe2(SO4)3溶液、FeCl3溶液、Fe (NO3)3溶液),其余溶液一般为无色。(高锰酸 钾溶液为紫红色) 5、沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸) AgCl、BaSO4(也 不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:其余不溶性碱为白色。 二、常见物质的学名、俗名及化学式 化学式名称俗称化学式名称俗称
常见化学式和化学方程式含答案修订版 IBMT standardization office【IBMT5AB-IBMT08-IBMT2C-
常见化学式和化学方程式 化学式 1.单质: 非金属:氢气、氧气、臭氧、氮气、氯气、碳、硫、磷、碘 H 2、 O 2 、 O 3 、 N 2 、 Cl 2 、 C、 S、 P、 I 2 稀有气体:氦气、氖气、氩气: He、Ne、Ar 金属:钠、钾、镁、铝、钙、锌、铁、铜、金、银、汞、锰 Na、K、 Mg、 Al、Ca、 Zn、 Fe、 Cu、 Au Ag、 Hg、Mn 2.氧化物: 非金属氧化物:一氧化碳、二氧化碳、二氧化硫、三氧化硫、一氧化 氮、 CO 、 CO 2 、 SO 2 、 SO 3 、 NO 二氧化氮、五氧化二氮、五氧化二磷、水、过氧化氢、二氧化硅
NO 2、 N 2 O 5 、 P 2 O 5 、H 2 O 、 H 2 O 2 、 SiO 2 金属氧化物:氧化钠、氧化镁、氧化钙、氧化铜、氧化汞、二氧化锰、 Na 2O 、 MgO 、 CaO 、 CuO 、 HgO 、 MnO 2 氧化铝、氧化铁、氧化亚铁、四氧化三铁、氧化亚铜 Al 2O 3 、 Fe 2 O 3 、 FeO、 Fe 3 O 4 、 Cu 2 O 3.酸:盐酸、硝酸、硫酸、碳酸、醋酸 HCl、 HNO 3、H 2 SO 4 、H 2 CO 3 、CH 3 COOH 4.氢氧化物:氢氧化钠、氢氧化钙、氢氧化镁、氢氧化铜、氢氧化铝、氢氧化铁 NaOH、 Ca(OH) 2、 Mg(OH) 2 、 Cu(OH) 2 、 Al(OH) 3 、 Fe(OH) 3 5.氯化物:氯化钠、氯化镁、氯化钙、氯化铜、氯化锌、氯化铝、氯化铁、氯化亚铁
△ K2422 4 15、加热氯酸钾:2KClO3 MnO2 2KCl + 3O2↑现象:同上 + CuO △ Cu + H2 2
62、氧化铜和稀盐酸反应:CuO + 2HCl = CuCl2 + H2O 现象:黑色固体溶解,生成黄绿色的溶液 63、氧化铜和稀硫酸反应:CuO + H2SO4 = CuSO4 + H2O 现象:黑色固体溶解,生成蓝色溶液 7.2. 酸+ 碱= 盐+ 水(中和反应) 64、盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O 现象:不明显 65、盐酸和氢氧化钙(氢氧化钾)反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O HCl + KOH = KCl + H2O 66、盐酸和氢氧化铁反应:Fe(OH)3 + 3HCl = FeCl3 + 3H2O 现象:红棕色絮状沉淀溶解,形成了黄色的溶液 67、盐酸和氢氧化铜反应:Cu(OH)2 + 2HCl = CuCl2 + 2H2O 现象:蓝色沉淀溶解,形成黄绿色的溶液 68、氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O 69、硫酸和烧碱反应:H2SO4 + 2NaOH = Na2SO4 + 2H2O 现象:不明显 70、硫酸和氢氧化铜反应:Cu(OH)2+H2SO4 = CuSO4 ↓+ 2H2O 现象:蓝色沉淀溶解,生成蓝色溶液 7.3. 酸+ 盐= 另一种酸+ 另一种盐 71、大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑现象:白色固体溶解,生成能使纯净石灰水变浑浊的气体 72、硝酸银与稀盐酸反应:HCl+AgNO3= AgCl↓+HNO3现象:有白色沉淀生成,这个反应用于检验氯离子 73、碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 74、碳酸氢钠与稀盐酸反应:NaHCO3 + HCl = NaCl + H2O + CO2↑ 75、硫酸和氯化钡溶液反应:H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl 现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子 B、碱的化学性质 7.4. 碱+ 非金属氧化物= 盐+ 水 76、苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O 现象:不明显 77、苛性钠吸收二氧化硫气体:2NaOH + SO2 = Na2SO3 + H2O 78、苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O 79、消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O 现象:生成白色的沉淀 80、消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O 7.4. 碱+ 酸= 盐+ 水(中和反应,方程式见上) 7.5. 碱+ 盐= 另一种碱+ 另一种盐 81、氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH C、盐的化学性质 7.6. 盐(溶液)+ 金属单质= 另一种金属+ 另一种盐 82、铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu 7.7. 盐+ 酸= 另一种酸+ 另一种盐(见上) 7.8. 盐+ 碱= 另一种碱+ 另一种盐(见上) 7.9. 盐+ 盐----- 两种新盐 83、氯化钠和硝酸银溶液:NaCl + AgNO3 = AgCl↓ + NaNO3 现象:有白色沉淀生成,这个反应可用于检验氯离子 84、硫酸钠和氯化钡:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl 八、补充化学方程式: 85、二氧化碳溶解于水:CO2 + H2O = H2CO3 86、生石灰溶于水:CaO + H2O = Ca(OH)2 87、氧化钠溶于水:Na2O + H2O = 2NaOH 88、三氧化硫溶于水:SO3 + H2O = H2SO4 89、硫酸铜晶体受热分解:CuSO4·5H2O △ CuSO4 + 5H2O 现象:固体由蓝色变为白色 90、无水硫酸铜作干燥剂:CuSO4 + 5H2O = CuSO4·5H2O 以下仅供参考: 91、CaCO3 + CO2 + H2O = Ca(HCO3)2现象:白色固体逐渐溶解 92、Ca(HCO3) △ CaCO3↓ + CO2↑ + H2O 现象:生成白色的沉淀,同时有使纯净的石灰水变浑的气体生成