
HEREDITAS (Beijing)
2012年1月, 34(1): 5―18 ISSN 0253-9772 https://www.doczj.com/doc/2411477767.html,
综 述
收稿日期: 2011?06?03; 修回日期: 2011?08?19
基金项目:转基因生物新品种培育重大专项(编号:2009ZX08009-148B)资助
作者简介:陈科, 博士研究生, 研究方向:动物发育遗传学。E-mail: chenke@https://www.doczj.com/doc/2411477767.html,
通讯作者:周荣家, 教授, 博士生导师, 研究方向:动物发育遗传学。E-mail: rjzhou@https://www.doczj.com/doc/2411477767.html,
网络出版时间: 2011-8-24 11:11:40
URL: https://www.doczj.com/doc/2411477767.html,/kcms/detail/11.1913.R.20110824.1111.004.html
DOI: 10.3724/SP.J.1005.2012.00005
自噬与泛素化蛋白降解途径的分子机制及其功能
陈科, 程汉华, 周荣家
武汉大学生命科学学院, 武汉 430072
摘要: 细胞内所有的蛋白质和大多数的细胞外蛋白都在不断的进行更新, 即它们在不断地被降解, 并被新合成
的蛋白质取代。细胞内蛋白的降解主要通过两个途径, 即自噬和泛素蛋白酶体系统。自噬是一种由溶酶体介导的细胞内过多或异常蛋白质的降解机制。在细胞内主要有3种类型的自噬, 即分子伴侣介导的自噬、微自噬和巨自噬。泛素蛋白酶体系统是由泛素介导的一种高度复杂的蛋白降解机制, 它参与降解细胞内许多蛋白质并且这个过程具有高度特异性。细胞内蛋白质的降解参与调节许多细胞过程, 包括细胞周期、DNA 修复、细胞生长和分化、细胞质量的控制、病原生物的感染反应和细胞凋亡等。许多严重的人类疾病被认为是由于蛋白质降解系统的紊乱而引起的。文章综述了自噬和泛素化途径及其分子机制, 以及蛋白质降解系统紊乱的病理学意义。
关键词: 蛋白质降解; 自噬; 泛素蛋白酶体系统
Molecular mechanisms and functions of autophagy and the ubiq-uitin-proteasome pathway
CHEN Ke, CHENG Han-Hua, ZHOU Rong-Jia
Life Science College , Wuhan University , Wuhan 430072, China
Abstract: All proteins in eukaryotic cells are continually being degraded and replaced. Autophagy and the ubiq-uitin-proteasome system are two mechanisms for intracellular protein degradation. Autophagy is mediated by lysosome, and is further divided into chaperone-mediated autophagy, microautophagy and macroautophagy. The ubiquitin-proteasome system is highly complex and mediated by ubiquitin, which participates in intracellular protein degradation in a specific manner. It is now known that degradation of intracellular proteins is involved in regulation of a series of cellular processes, including cell-cycle division, DNA repair, cell growth and differentiation, quality control, pathogen infection, and apoptosis. The aberrations in the protein degradation systems are involved in many serious human diseases. The present review sum-marizes the mechanisms of protein degradation and related human diseases.
Keywords: protein degradation; autophagy; ubiquitin-proteasome system
细胞内所有的蛋白质和大多数的细胞外蛋白都在不断的进行更新, 即它们在不断地被降解和被新
合成的蛋白质取代。虽然不断降解细胞内的蛋白似乎很浪费, 但是这个过程在功能上却是非常重要
6 HEREDITAS
(Beijing) 2012第34卷
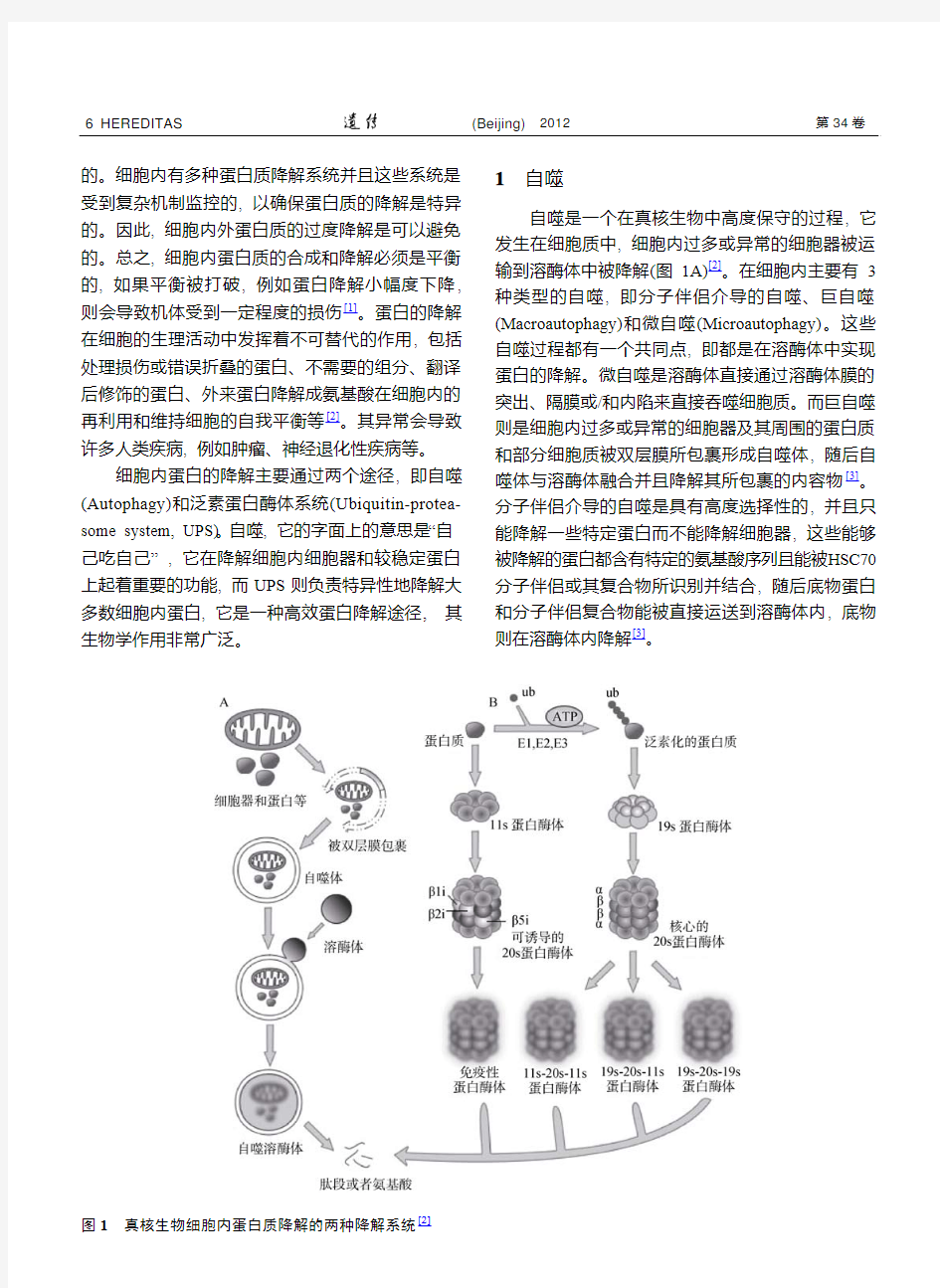
的。细胞内有多种蛋白质降解系统并且这些系统是受到复杂机制监控的, 以确保蛋白质的降解是特异的。因此, 细胞内外蛋白质的过度降解是可以避免的。总之, 细胞内蛋白质的合成和降解必须是平衡的, 如果平衡被打破, 例如蛋白降解小幅度下降, 则会导致机体受到一定程度的损伤[1]。蛋白的降解在细胞的生理活动中发挥着不可替代的作用, 包括处理损伤或错误折叠的蛋白、不需要的组分、翻译后修饰的蛋白、外来蛋白降解成氨基酸在细胞内的再利用和维持细胞的自我平衡等[2]。其异常会导致许多人类疾病, 例如肿瘤、神经退化性疾病等。
细胞内蛋白的降解主要通过两个途径, 即自噬(Autophagy)和泛素蛋白酶体系统(Ubiquitin-protea- some system, UPS)。自噬, 它的字面上的意思是“自己吃自己”, 它在降解细胞内细胞器和较稳定蛋白上起着重要的功能, 而UPS则负责特异性地降解大多数细胞内蛋白, 它是一种高效蛋白降解途径, 其生物学作用非常广泛。1自噬
自噬是一个在真核生物中高度保守的过程, 它发生在细胞质中, 细胞内过多或异常的细胞器被运输到溶酶体中被降解(图1A)[2]。在细胞内主要有3种类型的自噬, 即分子伴侣介导的自噬、巨自噬(Macroautophagy)和微自噬(Microautophagy)。这些自噬过程都有一个共同点, 即都是在溶酶体中实现蛋白的降解。微自噬是溶酶体直接通过溶酶体膜的突出、隔膜或/和内陷来直接吞噬细胞质。而巨自噬则是细胞内过多或异常的细胞器及其周围的蛋白质和部分细胞质被双层膜所包裹形成自噬体, 随后自噬体与溶酶体融合并且降解其所包裹的内容物[3]。分子伴侣介导的自噬是具有高度选择性的, 并且只能降解一些特定蛋白而不能降解细胞器, 这些能够被降解的蛋白都含有特定的氨基酸序列且能被HSC70分子伴侣或其复合物所识别并结合
, 随后底物蛋白
和分子伴侣复合物能被直接运送到溶酶体内, 底物
则在溶酶体内降解[3]。
图1真核生物细胞内蛋白质降解的两种降解系统[2]
第1期陈科等:自噬与泛素化蛋白降解途径的分子机制及其功能7
自噬是一个在真核生物中高度保守的过程, 通常细胞内自噬维持在很低的水平, 但是在应激条件下被诱导, 它在细胞内起着各种各样的功能。例如, 在酵母中, 营养缺乏诱导细胞内自噬的水平显著增加, 它能降解一些不需要的蛋白质回收氨基酸以供合成生存所必需的蛋白质。在高等的真核生物中, 动物出生后胎盘食物供应中断, 以及培养的细胞和组织在营养饥饿下也能诱导自噬的增加[4,5]。此外, 自噬还参与细胞的生理活动, 例如细胞的生长和分化。自噬还可能参与调节一些人类疾病的过程, 例如癌症、肌肉疾病和神经退行性疾病。它还可以作为一种细胞防御机制防止某些病原菌和病毒的感染。自噬是一个受到紧密调控的过程, 它在细胞生长、发育和动态平衡过程中起着重要的作用[6]。1.1自噬过程及其分子机制
目前, 在酵母和其他真核生物中鉴定了许多参与自噬的基因, 这些基因被命名为自噬相关基因(Auto-phagy-related genes, ATG)。一系列由atg基因的产物组成的复合物参与协调自噬体(Autophagosomes)的形成(图2)。Atg1/ULK1(在酵母中命名为Atg1其哺乳动物同源蛋白命名为ULK1)复合物是自噬体形成过程中的一个重要的正调控因子, 这个复合物主要由ATG1、ATG13和ATG173个蛋白组成[7,8]。当营养足够时, 哺乳动物雷帕霉素靶蛋白复合物1(Mammalian target of rapamycin complex 1, mTORC1)与Atg1/ ULK1复合物与结合从而抑制自噬。mTORC1是细胞生长和代谢的重要调节因子, 它由5个亚基组成, 其中包括Raptor(与ULK1相互作用)和mTOR(具有的丝氨酸/苏氨酸激酶活性)。mTORC1通过磷酸化Atg1/ULK1和ATG13从而抑制自噬的起始。在饥饿的条件下, mTORC1从Atg1/ULK1复合物上分离, 从而诱导自噬体的成核(Nucleation)和延伸(Elongation)[8]。
自噬小泡的成核需要含有ATG6(其哺乳动物同源蛋白命名为Beclin 1)的复合物, 这个复合物能够与第三类磷酸肌醇3激酶VPS34形成超级复合物(第三类磷酸肌醇3激酶复合物)并使其激活产生磷脂酰肌醇3磷酸(Phosphatidylinositol-3-phosphate, PI3P)[9]。
自噬体膜的延伸涉及两个类泛素的蛋白质(ATG12和ATG8/ LC3)和两个相关的连接系统。其中一个途径是在类E1连接酶ATG7和类E2连接酶ATG10的作用下把ATG12共价连接到ATG5上, 并与Atg16L1形成前自噬体结构(Pre-autophagosomal structures, PAS)。第二个类泛素化途径是ATG8/LC3首先被蛋白酶ATG4剪切, 磷脂酰乙醇胺(Phospha-tidylethanolamine, PE)在类E1连接酶ATG7和类E2
图2真核生物细胞内自噬的过程[9]
8 HEREDITAS
(Beijing) 2012第34卷
连接酶ATG3的作用下共价连接到剪切过的ATG8/ LC3上。这个过程导致LC3由可溶形式(LC3-I)转变为脂溶形式(LC3-II), LC3-II能够与新形成的自噬体膜结合。LC3-II一直结合在自噬体膜上直到自噬体与溶酶体融合, 因此, 它也经常被用作细胞内自噬的标记物[8,10]。ATG9复合物在自噬体形成的过程中也起着重要的作用, 它可能为自噬体的形成提供膜来源[9]。其机制还不是很清楚。
最后, 自噬体通过与溶酶体融合而形成成熟的自噬体即自噬溶酶体(Autolysosomes)。在自噬溶酶体内, 自噬体内层膜以及内容物在溶酶体内被降解。然后, 溶酶体通透酶释放出降解产物到细胞质中以供生物合成和代谢, 这些降解产物包括氨基酸、脂类、核苷酸和碳水化合物等[8,10]。
1.2自噬的底物
自噬根据其降解底物的特异性可以分为两类, 即选择性自噬和非选择性自噬。非选择性自噬能够大量地降解多余的细胞质成分和细胞器为细胞在饥饿时进行新陈代谢提供物质。它同样在组织重构过程中起着重要的作用, 例如果蝇的形态发生[11]。细胞内是否存在某种机制来阻止非选择性自噬消耗细胞生存的必需组分还不是很清楚, 在某些情况下, 细胞内这种过度消耗能够导致细胞的死亡。
在某些情况下, 蛋白质或者一些细胞器也能够被选择性自噬所降解, 例如线粒体自噬(Mitophagy)、核糖体自噬(Ribophagy)、内质网自噬(Reticulopha-gy)、过氧化物酶体自噬(Pexophagy)和脂类自噬(Lipophagy)[8]。在哺乳动物细胞中, 不管是在蛋白酶体降解还是自噬途径降解, 蛋白质的降解信号都是泛素化。许多蛋白质在自噬缺陷性细胞内聚集, 这说明自噬在控制细胞内蛋白质代谢上具有重要的作用, 并且表明蛋白酶体介导的蛋白质降解不能弥补自噬的缺陷。为了使目标蛋白发生自噬性降解, 泛素化修饰的靶蛋白能够结合到自噬受体上, 例如p62可以作为自噬受体与泛素化的蛋白质并可以与自噬体膜蛋白LC3相互作用从而能够把泛素化的蛋白质运送到自噬体内降解[12]。
细胞器选择性自噬的调节机制比较复杂。在酵母中, Atg32定位于线粒体能够与Atg8/LC3和Atg11相互作用, 并作为一个自噬受体介导线粒体体自噬[13]。在哺乳动物细胞中, 去极化线粒体的自噬能够保护细胞免受由活性氧造成的损伤, 这个过程由Pink-1促使E3泛素连接酶Parkin发生易位到线粒体上, 从而促进线粒体蛋白VDAC1的K27位连接的多聚泛素化, 随后泛素化的VDAC1被p62所招募并运送到自噬体内降解[14]。
1.3自噬的调节
近几年来, 对自噬调节分子机制的研究已经取得了很大的进展。细胞可以通过一系列信号通路对外部营养的供应、生长因子和激素的刺激、应激和内部能量供应做出许多生物学反应, 其中包括自噬。
对mTORC1活性的调节是自噬调节的重要组成部分。mTORC1促进细胞生长和代谢, 而通过结合ULK1复合物抑制自噬。mTORC1的活性受到许多信号的调控, 其主要调控因子是TSC蛋白质。TSC2与TSC1形成复合物具有GTP酶激活蛋白(GTPase- activating protein, GAP)活性, 它能够促使Rheb由活化形式转变为非活化形式, 从而抑制mTORC1的活性[15]。
mTORC1能够被PI3K-PKB信号通路激活。其机制是活化的PKB能够磷酸化TSC2从而阻止TSC复合物的形成, 进一步导致mTORC1的激活[16]。相反的, PTEN通过抑制PI3K-PKB信号通路的活性能够诱导自噬[17]。
LKB1-AMPK信号通路能够调节mTORC1的活性。LKB1-AMPK信号通路被认为是真核生物的“细胞能量调节器”, 其活性受AMP/ATP比值的调控。活化的AMPK可以介导TSC2的磷酸化进一步抑制mTORC1的活性, 从而诱导自噬[18]。此外LKB1- AMPK信号通路信号通路还可以通过调节p27蛋白的稳定性来影响自噬。在应激条件下, 如果缺失p27细胞则发生凋亡, 但是在存在p27时, 细胞则发生自噬[19]。最近, 有研究表明AMPK通过直接与ULK1相互作用并使其磷酸化, 从而诱导自噬[20.21]。
mTORC1还是一个细胞内重要的“压力传感器”。缺氧可以可以激活HIF从而诱导REDD1的表达, 而REDD1能通过调节TSC复合物的活性来抑制mTORC1的活性, 从而诱导自噬[22]。此外, HIF还可以诱导许多自噬相关基因的表达[23]。研究表明, 肿瘤抑制蛋白p53也可以调节细胞的自噬。在基因组
第1期陈科等:自噬与泛素化蛋白降解途径的分子机制及其功能9
损伤时, p53的激活可以促进AMPK的激活进而抑制mTORC1的活性来诱导自噬[24]。此外, p53可以通过转录激活自噬调节蛋白DRAM从而诱导细胞的自噬[25]。p53的下游基因sestrin1和sestrin2也能够激活AMPK的活性进而抑制mTORC1的活性来诱导自噬[26]。但是最近的研究表明, 细胞质的p53抑制了细胞的自噬[27]。
在哺乳动物细胞中, 胰岛素(Insulin)可以通过两个途径来抑制自噬:(1)在氨基酸的协同作用下激活mTOR使Atg1/ULK1磷酸化从而抑制自噬;
(2)Insulin激活PKB/Akt的活性从而使转录因子FoxO3磷酸化并抑制其转录活性, FoxO3负责许多自噬相关基因的表达[28]。
细胞内也存在一些不依赖mTOR的自噬, 例如氨基酸代谢的副产物—氨(Ammonia)能够激活自噬阻止由TNF–α诱导的细胞凋亡[8]。在肝脏中, 胰高血糖素(Glucagon)作为细胞内一种促进分解代谢的激素也可以诱导自噬[8]。
1.4自噬的生理学意义
自噬作为一个在真核生物细胞中保守的降解途径, 它能够免除各种类型的细胞应激。自噬在细胞清除废物、结构重建、生长发育中起着重要作用, 研究表明它们与人类疾病存在着很密切的联系。目前, 研究最为详细的一种自噬是巨自噬, 它与许多人类疾病相关, 例如某些神经退行性疾病的发生与蛋白质聚集存在很大的联系, 巨自噬能够通过清除某些有害的蛋白来防止或减少由这些聚集蛋白所引起的细胞毒性。自噬受到自噬基因的调控,自噬基因缺失或者突变导致功能障碍时可以导致一些疾病的发生。
1.4.1 自噬与蛋白质聚集类疾病
近年来, 对自噬与蛋白质聚集引发疾病之间联系的研究已经取得了很大的进展。这些疾病的分子机理有以下几个普遍特性:(1)突变导致蛋白构象的变化和错误折叠; (2)当错误折叠的蛋白质积累到很高水平就形成聚集体或包涵体; (3)正常的降解途径无法降解这些包涵体和/或改变其形式。通常, 当这些突变蛋白积累到很高的水平时, 它们阻碍了正常的细胞功能。在这个时候, 蛋白质降解系统可能被激活, 消除由此产生的异常包涵体。泛素蛋白酶体系统和自噬都能够被异常包涵体所激活, 但是它们的底物是不同的[29]。例如, α-1 -抗胰蛋白酶(AT)基因的突变导致其错误折叠并使其以包涵体的形式保留在内质网内。AT基因的这种突变会导致肝炎和肿瘤。在AT基因突变病人的肝细胞内, 自噬体明显地增强以用于降解这些突变的AT包涵体[30]。数据表明, 自噬在缓解与相关异常蛋白质聚集在内质网内所引发的细胞毒性起着保护性作用。
关于由蛋白质聚集在细胞质内所引发的疾病, 已经证实自噬在某些神经退行性疾病中起着重要的作用, 例如帕金森氏症、亨廷顿氏病(HD)和阿尔茨海默氏病(AD)[31]。在这些疾病病人或者这些疾病的老鼠模型的神经细胞中、细胞系中自噬体明显增加, 这说明了自噬活性的上调和自噬体与溶酶体的融合存在缺陷[31]。例如, 亨廷顿氏病是由于多聚谷氨酰胺共价连接到突变的亨廷顿蛋白上从而容易在细胞质内聚集形成包涵体[32]。此外, 自噬被激活来降解细胞内形成的包涵体。因此, 亨廷顿氏病的病理学机制可能是自噬不能完全清除细胞内突变的亨廷顿蛋白[29]。因此, 自噬在神经退行性疾病中起着重要的作用。
从目前的研究来看, 自噬通过清除细胞内聚集的蛋白在由蛋白聚集引起的疾病中起着保护细胞的作用, 它可以减轻由包涵体导致的细胞毒性。细胞内本底的自噬水平可以清除那些可溶的蛋白以免它们聚集后引起细胞毒性。虽然自噬具有保护由聚集蛋白质所造成的细胞毒性, 但是其活动必须控制在一个适当的水平, 因为过多的自噬可能会导致细胞死亡。
1.4.2 自噬与肌病和溶酶体贮积症
溶酶体是细胞内降解细胞器和较稳定蛋白的主要场所。当溶酶体的功能受到损伤, 则许多未降解的物质聚集在溶酶体内最终会产生细胞毒性。这个表型在许多疾病中得到了证实, 例如心肌病和其他的肌病。此外, 自噬也与这些疾病存在一定的联系, 这类疾病被归为自噬泡肌病。Danon疾病是由于糖原贮积在溶酶体引起的疾病, 并且是与自噬存在联系的一种心肌病, 其临床表现为心肌病、肌病和各种神经发育迟滞[29]。由于溶酶体膜蛋白LAMP-2b基因的突变导致自噬泡与溶酶体不能融合, 导致在患者
10 HEREDITAS
(Beijing) 2012第34卷
心脏和骨骼肌细胞中聚集了大量的自噬泡[33]。庞培氏病(Pompe)与Danon疾病相似, 在患者细胞内聚集大量的自噬泡, 它是由于酸性α-葡萄糖苷酶基因突变导致糖原大量贮积在溶酶体导致的疾病。α-葡萄糖苷酶敲除小鼠肌肉细胞内许多自噬相关基因的表达明显上调, 例如Beclin1、ATG12和ATG8[34]。最近的研究证实这种疾病是由于在肌肉细胞内大量自噬泡的聚集而不是糖原大量贮积扰乱正常的肌肉收缩导致的[31]。揭开自噬在这些疾病中的功能以及机理将有助于这些疾病的治疗。
1.4.3 自噬与肿瘤的发生
虽然很早就发现了自噬与肿瘤之间存在相关性,但是其可能的分子机制的阐明最近才取得了一些进展。虽然大多数证据都支持自噬具有维持细胞存活的功能, 矛盾的是, 自噬相关基因的缺失被频繁发现于各类肿瘤中, 这些基因包括Beclin1、MAP1LC3和ATG7[33]。此外, PI3K-PKB和mTOR等抑制自噬的信号通路在许多肿瘤中被激活[12]。
自噬的缺陷导致它失去促进细胞存活的能力, 但是为什么会促进肿瘤的发生呢?自噬缺陷尽管降低了细胞的健康程度, 但是它导致了细胞内损伤的聚集。自噬缺陷的肿瘤细胞在应激条件下其基因组通常表现出很高程度的损伤, 这说明自噬缓解损伤是其发挥肿瘤抑制功能的一种机制[35]。此外, 在那些细胞周期检验点失活的肿瘤细胞内, 自噬能够限制基因组的损伤和抑制突变率[35,36]。这说明自噬具有维持基因组的稳定性的功能从而抑制肿瘤的发生。凋亡是抑制肿瘤发生的一个重要机制, 在肿瘤细胞中, 自噬在某些情况下能够增加细胞的凋亡。例如, p53能够通过转录激活DRAM来诱导自噬, 进一步诱导细胞的凋亡[25]。此外, 自噬相关蛋白也可以作为一个促凋亡因子来引发细胞的凋亡, 例如ATG5被剪切后能够诱导细胞的凋亡[37]。
由于应激引起聚集的蛋白也能够通过自噬降解, 在这个过程中p62起着重要的作用。蛋白质的聚集可能是一种保护机制, 它可以通过隔离、有效的包裹和运输机制收集那些损伤的蛋白质运送到自噬体从而使细胞免受这些蛋白质的毒害[12]。小鼠肝脏特异的自噬缺陷导致了p62蛋白的聚集、氧化应激和依赖于p62的细胞死亡[38]。这说明由于自噬缺陷而不能清除聚集的p62蛋白对正常细胞来说是有害的。在自噬缺陷的肿瘤细胞中, 代谢压力可以导致肿瘤细胞内聚集p62蛋白、内质网分子伴侣和蛋白二硫异构酶等, 这说明蛋白质的质量控制是有缺陷的。此外, 自噬的缺陷通常伴随着损伤的线粒体的聚集、氧化应激的上调和DNA损伤反应的激活, 这些反应都可能与p62的聚集有关。在这些自噬缺陷的肿瘤细胞中清除p62则可以抑制这些细胞毒性反应。这说明自噬还可以通过抑制p62的聚集来抑制肿瘤的发生[12]。
在肿瘤细胞中, 许多调节自噬信号的信号通路发生了紊乱, 并且自噬在许多治疗肿瘤的药物作用下被激活, 这些药物有些直接抑制了mTOR的活性[39]。
虽然现在许多证据表明自噬具有肿瘤抑制的功能, 但是不可否认, 自噬可以促进肿瘤的存活。可能是由于自噬具有细胞保护作用和营养的回收再利用的功能。在营养缺乏的条件下, 抑制自噬可以诱导HeLa细胞的凋亡[40]。因此, 自噬在肿瘤的发生过程中起着双重的作用, 它在肿瘤发生过程中的具体机制还需要更加进一步的研究。
1.4.4 自噬与致病菌和病毒感染
细菌是一种主要的病原体, 它的感染能够导致许多人类的疾病。在致病菌的入侵过程中, 它们进入宿主细胞内并进行复制, 通常还扩散到邻近细胞和组织从而导致细胞的死亡。面临微生物入侵的威胁, 免疫系统已进化出多种机制来消除这些入侵者。例如, 侵入的细菌可以通过内吞途径进入自噬体随后与溶酶体融合从而被降解[41]。
病毒通过把他们的DNA或者RNA注射到宿主细胞的细胞质中来感染宿主细胞。一旦被感染, 宿主细胞则可能分泌一种称为干扰素(IFN)的细胞因子, IFN能够引发细胞的一些抗病毒的机制来限制病毒复制。最近有研究证实IFN能上调细胞内自噬的水平[42]。此外, 有些细菌和病毒已经进化出一些机制来阻止或利用自噬。例如, 有些单纯疱疹病毒编码ICP34.5基因可以阻止PKR依赖的自噬从而使病毒得以逃避以免被降解[43]。有些正链RNA病毒能够诱导自噬体的形成然后利用自噬体来进行自身的复制,
第1期陈科等:自噬与泛素化蛋白降解途径的分子机制及其功能 11
但是其具体机制还需要更进一步的研究[44]。
2泛素蛋白酶体系
早在20世纪70年代就证实动物细胞内蛋白质的降解是具有高度选择性的[45]。有一些模型提出来解释这种选择性降解蛋白的现象, 例如, 有人提出所有的蛋白都能迅速地进入溶酶体, 但是只有那些短暂的蛋白被降解, 而长寿命的蛋白质则从溶酶体中逃出重新回到细胞质[46]。实际上, 后期的实验证实溶酶体降解蛋白是特异性很低的, 并且溶酶体降解所有的蛋白速率都一样[47]。此外, 用特定的抑制剂抑制溶酶体的功能对细胞内蛋白质降解的影响很小。这很明显的说明了溶酶体并不是负责特异性降解细胞内蛋白的细胞器。最终, 发现了负责细胞内特异降解蛋白的系统, 即泛素蛋白酶体系统。在细胞内, UPS能够快速地降解那些不正常的蛋白质和一些短暂的控制一系列基本细胞生命活动的调节蛋白[48]。UPS降解蛋白质是一个复杂的和受到严密调控的, 并且是高度特异性的降解细胞内许多蛋白质的过程[49]。细胞是如何选择并以高度特异的方式来降解蛋白质的呢?它是通过给需要降解的蛋白质加上许多小的标签—泛素来标记需被降解的蛋白随后这些蛋白被泛素蛋白酶体降解。
蛋白酶体存在于细胞核和细胞质, 它是由10~20个亚基组成的蛋白复合物。细胞内普遍存在的蛋白酶体是26S蛋白酶体, 由一个核心的20S蛋白酶体和两个具调节作用的19S蛋白酶体组成。20S蛋白酶体为中空结构, 是一个大的具有催化活性的蛋白酶, 由2个外环(7个a亚基)和2个内环(7个β亚基)组成(图1B)[2]。在细胞内, 20S蛋白酶体具有潜在的催化能力, 需要激活才具有蛋白酶活性, 至少有2类蛋白酶体激活剂被发现在能够结合核心的20S蛋白酶体并增强它的催化活性。如图1A所示, 19S调节颗粒能够结合到20S蛋白酶体的外环上, 形成26S蛋白酶体, 它们主要负责降解泛素化的蛋白质。细胞内大多数的蛋白质是由26S蛋白酶体降解的。11S调节颗粒又被称为PA28或REG, 它也能够结合到26S 蛋白酶体并以一种不需要ATP和泛素化的方式起始短肽而不是完整的蛋白质的降解[2]。
2.1泛素化
泛素是一个由76个氨基酸组成的高度保守的多肽链,因其广泛分布于各类细胞而得名。泛素共价地结合于底物蛋白质的赖氨酸残基, 被泛素标记的蛋白质将被特异性地识别并迅速降解。靶蛋白的泛素化降解涉及以下3个连续的过程:(1)泛素的活化, 这个过程需要以ATP作为能量, 泛素C端的羧基连接到泛素活化酶E1的巯基, 最终形成一个泛素和泛素活化酶E1之间的硫酯键; (2)泛素活化酶E1将活化后的泛素通过交酯化过程传递给泛素结合酶E2;
(3)泛素连接酶E3将结合E2的泛素连接到靶蛋白上。靶蛋白在泛素激活酶E1、泛素结合酶E2和蛋白泛素连接酶E3的作用下共价连接上几个泛素分子, 然后被26S蛋白酶体所降解。蛋白质的降解是在20S核心颗粒中的β亚基进行的, 一般不生成部分降解的产物, 而是将底物蛋白完全降解为长度一定的肽段。26S蛋白酶体只识别泛素化的蛋白并将其降解为小肽, 泛素在去泛素连接酶作用下回收再利用(图3)。这些小肽随后被细胞质中的蛋白酶降解为氨基酸。在哺乳动物细胞内, UPS系统是一个层次非常鲜明体系:细胞内只表达一种泛素激活酶E1把泛素转移到大约50种泛素结合酶E2上, 每种E2都可以与许多E3泛素连接酶相互作用, 而E3泛素连接酶在细胞内大约有 1 000个, 它们负责特异性地结合底物使其发生泛素化从而能被蛋白酶体降解。
图3 26S蛋白酶体降解泛素化蛋白底物的示意图
2.2泛素蛋白酶体系统的生物学意义
在细胞内, 绝大多数蛋白质都是通过泛素-蛋白
12 HEREDITAS
(Beijing) 2012第34卷
酶体系统降解的。细胞内蛋白的降解主要具有两个方面的作用, 一方面是通过降解错误折叠、突变或者损伤的蛋白来维持细胞的质量控制, 另一方面是通过降解关键的调节蛋白来控制细胞的基本生命活动, 例如生长、代谢、细胞凋亡、细胞周期和转录调节等。
2.2.1 蛋白质的加工
虽然蛋白酶体降解成非常短的片段, 但是在有些情况下, 降解产物也是具有生物学活性的。一些转录因子复合物中的成分, 合成后以无活性的前体分子存在, 在经过泛素化和蛋白酶降解后, 才转变为活性分子。例如, NF-kappa B、Spt23p 和Mga2p等[50]。
2.2.2 细胞周期的调控
细胞周期的进程是由一系列细胞周期蛋白依赖性激酶(CDK)来进行调控的, 而CDK的激活需要细胞周期蛋白(Cyclin)的结合。在细胞有丝分裂过程中, 细胞周期蛋白的寿命很短, 大约只有几分钟。在Cyclin-CDK复合物执行完功能后, 复合物中的Cyclin则会很快速地被泛素-蛋白酶体系统降解, 从而保证细胞周期的正常运转。此外, 在细胞退出有丝分裂的过程中, Cyclin B需要从有丝分裂促进因子上解离下来, 而这一过程也依赖于蛋白酶体。例如, Cyclin A的降解是由一种E3泛素连接酶-后期促进因子(APC)来进行的, APC的各组分在细胞分裂间期中表达, 但是它只有在M期才具有E3连接酶活性, 从而降解M期周期蛋白, 细胞则有中期向后期转化[51]。
细胞周期的进程也受到细胞周期检验点的调控。例如, 有丝分裂前期检查点Chfr蛋白在细胞分裂过程中发挥着重要作用。Chfr是一个E3泛素连接酶, 其底物包括HDAC1、Plk1、Kif22、HLTF等, 许多研究表明Chfr在细胞分裂过程中发挥着重要作用, 细胞分裂存在有丝分裂应激时, Chfr通路激活引起PLK1的泛素化并降解, 控制Cdc2激酶的活性, 延迟染色体凝集和中心体分离, 阻止细胞于有丝分裂前期, 它的表达增强细胞对应激的生存能力[52~55]。一旦有丝分裂应激解除并且缺陷修复, Chfr连接酶即失活, Plk1再合成驱使细胞进入有丝分裂期。
因此, 泛素蛋白酶体系统在细胞周期的调控上具有非常重要的作用。2.2.3 细胞凋亡
细胞凋亡对个体发育的正常进行, 自稳平衡的保持以及抵御外界各种因素的干扰方面起着非常重要的作用。在细胞凋亡发生前, 细胞内泛素化的蛋白质、泛素连接酶的表达明显上调[56,57]。此外, 在细胞凋亡过程中, 蛋白酶体的定位出现了明显的改变, 它由细胞核移位到调亡小泡的外膜。利用药物抑制蛋白酶体的活性可以影响不同类型细胞凋亡。在大多数被研究的细胞类型中, 抑制蛋白酶体的活性可以促进细胞调亡。但是, 蛋白酶体的活性并不是凋亡所必需的, 在原代培养的静止和分化的细胞, 如神经元细胞, 抑制蛋白酶体的活性阻止了细胞的凋亡。但是这一机制到目前还不是很清楚[57]。
2.2.4 DNA修复
蛋白质p53是一个抑癌基因, 被誉为“基因卫士”。至少有50%的人类癌症是由于p53的突变导致的。在正常细胞中, p53始终处于合成与降解的动态平衡状态, 并维持在较低水平上。这种平衡状态的维持是离不开泛素蛋白酶体系统的。正常情况下, MDM2这一E3泛素连接酶与p53相互作用并使p53不断地降解。当DNA受到损伤时, p53被磷酸化而不再与MDM2相互作用, 从而不再被泛素化降解, 细胞内p53的蛋白水平迅速增加。p53是一个重要的转录因子, 能够控制许多基因的表达, 这些基因能够调控细胞周期、DNA的修复和细胞的凋亡等。如果p53的蛋白水平上升, 细胞周期会被阻断, 为DNA 修复提供时间[58]。
2.2.5 细胞应激反应
当细胞应激反应发生时, 热休克蛋白大量表达, 其作用是识别错误折叠的蛋白质, 并标记他们以供蛋白酶体的降解。目前, 已经证实Hsp27和Hsp90具有提高泛素-蛋白酶体活性的功能。例如, Hsp27能够直接与多聚泛素链和26S蛋白酶体相互作用。在应激条件下, Hsp27促进泛素化蛋白质的降解, 例如, 磷酸化的I-κBα蛋白。I-κBα是转录因子NF-κB的一个主要的抑制剂。因此, 在应激条件下, 促进泛素-蛋白酶体降解I-κBα, 从而可以激活NF-κB的活性[59]。此外, Hsp70可以结合到错误折叠的蛋白质上, 并引导E3泛素连接酶(如CHIP)将错误折叠的蛋白质
第1期陈科等:自噬与泛素化蛋白降解途径的分子机制及其功能 13
标记上泛素, 使得蛋白酶体能够降解它们[59]。
对于氧化损伤的蛋白质, 泛素蛋白酶体系统也以类似的机制把它们降解。例如, 细胞核内的蛋白酶体可以选择性地降解氧化损伤的组蛋白, 这个过程是由PARP蛋白所调控进行的。泛素蛋白酶体系统选择性地降解一些损伤的蛋白质可以减轻对细胞的损害。
2.2.6 调节免疫反应
大多数蛋白由蛋白酶体降解为特定长度的短肽, 然而, 也有一些蛋白能够逃脱这个过程而转运到内质网, 在内质网内这些多肽结合到主要组织相容性复合物(MHC)类型I蛋白上, 随后传递到抗原呈递细胞表面。如果这些蛋白不是来源于此细胞, 例如, 侵入机体的病毒、细菌或肿瘤, 细胞毒性T淋巴细胞则会破坏这个细胞[60]。虽然一般的蛋白酶体就可以参与这个过程, 但是在这个过程中起主要作用的是一种特殊的复合物, 其可以生成合适大小和成分的降解片断以供MHC结合。这种复合物是由11S调节颗粒和特殊的β亚基(β1i、β2i、β5i, 具有不同的底物特异性)组成的, 它们的表达由γ干扰素所诱导[61]。
NF-κB是一种抗凋亡和促炎症调控因子, 它能够调控细胞因子的表达。26S蛋白酶体在NF-κB的激活中起着非常重要的作用, 在NF-κB的激活过程中, NF-κB的抑制剂I-κB的快速降解和其前体p105加工成活性的NF-κB即p50。因此, 泛素蛋白酶体系统被认为与炎症反应和自身免疫性疾病相关。
2.2.7 调节生长和发育
在植物的生长和发育过程中, 泛素蛋白酶体系统起着必不可少的作用, 它参与了许多发育过程, 包括激素反应、光形态、昼夜节律、花发育和衰老等[62]。例如, 茁长素(Auxin)或植物激素(Phytohormone)的作用是调控植物生长的方向和向性, 它们通过细胞信号通路来诱导一系列转录因子的抑制蛋白(Aux/IAA蛋白)进入蛋白酶体降解途径。这些抑制蛋白被SCFTIR1蛋白或者SCF蛋白进行泛素化降解。Aux/IAA蛋白降解后, 对Auxin反应因子(ARF)家族的转录因子的抑制就被解除, 从而诱导ARF基因的表达[63]。ARF的激活参与了对根和叶脉生长的指导。ARF蛋白和Aux/IAA蛋白之间配对的特异性被认为是ARF的去抑制作用具有反应特异性的原因[60]。
在个体的正常发育过程中, 通过有丝分裂来增加细胞数目、通过有序的细胞分化来增加细胞类型, 进而由不同类型的细胞组成组织和器官。显然, 这个生长和发育的过程是受到高度调控的, 其中, 蛋白质降解起着非常重要的作用, 特别是泛素蛋白酶体对特异蛋白的降解。例如, NEDD4通过调节IGF-1信号通路来调节动物的生长。在哺乳动物中, 胰岛素样生长因子(IGF)信号轴是胎儿和出生后生长的主要调节者。这个信号轴主要包括3个配体(IGF-1、IGF-2和胰岛素)和两个跨膜的酪氨酸激酶受体(IGF-1R和IR)。IGF -1和IGF- 2都可以促进胎儿生长。在出生后, 生长激素可以促进自主增长和诱导全身和局部生产IGF-1, 通过IGF-1R信号通路来促进增殖。因此, IGF-1在动物的生长过程中起着至关重要的作用。NEDD4是一个E3泛素连接酶, 它可以调节PTEN蛋白的稳定性。虽然NEDD4与IGF1R不是直接相互作用的, 但是NEDD4能够通过与Grb10相互作用, 调节其稳定性, 进一步调控IGF1R的定位。Grb10抑制了IGF-1R和IR正确的细胞膜定位。因此, NEDD4可以促进IGF-1R的激活。NEDD4基因敲除小鼠其表型是生长迟缓和围产期死亡[64]。
2.3泛素蛋白酶体系统与遗传疾病
正常细胞的生长和发育离不开蛋白的合成与降解之间的平衡。毫无疑问, 如果这个平衡被打破, 包括蛋白的降解受到抑制和过度降解, 都有可能参与许多人类疾病的发病过程。与UPS相关的许多疾病的病理因素根据其机制主要分为2类:第一类是UPS 系统的酶或者某些底物突变(功能丧失)导致这些底物不能正常降解; 第二类是加速降解(功能获得)某些蛋白[47]。泛素介导的蛋白质降解与肿瘤的发生存在着非常密切的联系, 李艳凤等[65]系统阐述了泛素介导的蛋白质降解途径与肿瘤发生的关系。表1介绍了一些与UPS相关的人类疾病。由于在这里不可能把所有与UPS相关的疾病一一列出, 本文主要以几个突出的例子来介绍UPS的紊乱是如何导致疾病的。
2.3.1 VHL相关肿瘤
VHL是一个E3泛素连接酶, 它在常氧下介导缺氧诱导因子(HIF)异二聚体α亚基的泛素化降解。HIF是一个具有结合特异DNA序列的转录因子, 它
14 HEREDITAS
(Beijing) 2012第34卷表1 由UPS异常导致的人类疾病
疾病缺陷参考文献天使综合征(Angelman syndrome, AS) E3连接酶E6-AP突变[47]遗传性帕金森氏症(AR-JP) E3连接酶parkin突变[47] Liddle 综合征 UPS底物肾钠离子通道β/γ亚基突变[47] VHL相关肿瘤 E3连接酶VHL突变[47]结肠癌 UPS底物β-catenin突变[47]范可尼贫血症 UPS底物FANCD2蛋白突变[47]宫颈癌 HPV介导的加速p53的泛素化降解[47]
各种恶性肿瘤E3连接酶HDM2和SKP2的突变
UPS底物中许多癌基因和抑癌基因突变
[47]
乳腺癌和卵巢癌 E3连接酶BRCA1突变[47]家族性圆柱瘤去泛素酶CYLD突变[47]肥厚性心肌病 UPS底物MYBPC3突变[66]动脉粥样硬化UPS活性受到抑制[67]精神分裂症(SCZ)和双相情感障碍(BPD)UPS发生紊乱[68]囊性纤维化疾病CFTR蛋白的过度降解[69]肌肉萎缩 E3连接酶MURF-1和atrogin-1参与肌肉萎缩的发生[70]
可以激活大约100~200个促进细胞在低氧条件下生存的基因, 例如一些基因可能在缺血组织中和在大多数实体瘤中被检测到。HIFα蛋白家族有3个成员:HIF1α、HIF2α和HIF3α。HIF1α和HIF2α都含有2个转录激活结构域, 然而HIF3α的转录激活活性还没有被证实[71]。VHL基因的突变可以导致肿瘤的发生, 例如肾癌、嗜铬细胞瘤和胶质母细胞瘤等。由VHL 基因突变导致E3连接酶活性丧失从而使HIFα上调其转录活性升高促进了肾癌发生, 也有可能是导致胶质母细胞瘤的主要原因[71]。
目前, 有许多VHL-/-的肾癌细胞系被建立用于研究VHL在肿瘤发生过程中的作用, 特别是由HIF 所贡献的。在这些细胞系中重新转入VHL则可以抑制裸鼠中肿瘤的发生[72]。一些证据表明HIFα特别是HIF2α的失调是促进VHL?/?肾癌的主要原因。首先, 在VHL-/-肾癌中, HIF1α和HIF2α都上调或者只有HIF2α上调。其次, 在异种移植研究中, 超表达不能被VHL泛素化的HIF2α突变蛋白足以废除VHL的肿瘤抑制功能, 此外, 利用shRNA技术下调HIF2α的表达能够抑制肾癌细胞在体内的生长[73]。这说明在VHL-/-的肾癌发生过程中HIF2α的上调起着重要的作用。许多HIFα的靶基因被认为在肿瘤发生过程中起着重要的作用, 这些基因编码的蛋白负责葡萄糖的吸收和代谢(G L U T1、P F K1和P D K等)、血管生成(VEGF、PDGF和CTCF等)、细胞外基质的形成和更替(MMP1和LOX)和促进细胞增殖的因子(TGFα和EGFR)等[71]。此外, HIF2α的上调还可以导致E-cadherin的下调从而诱导上皮细胞向间质细胞转化, 这是肾癌细胞的一个标志[74]。
2.3.2 HPV介导p53降解诱发的肿瘤
人乳头状瘤病毒(HPVs)是一类小的DNA病毒, 它能够感染皮肤或粘膜上皮细胞。HPVs是导致肛门瘤的主要因素, 也导致了头部和颈部鳞状细胞癌。根据造成的恶性肿瘤的能力大小, 可以把HPVs分为两类, 即高危型HPVs和低危型HPVs。HPVs基因组编码了E6和E7这2个原癌基因, 它们在肿瘤转化过程中起着重要的作用[72]。
有研究表明, 在高危型HPVs阳性宫颈癌细胞系中, 肿瘤抑制蛋白p53的表达下调。在那些p53未突变的肿瘤中, 一个选择性的机制是使p53失活, 通常是p53的E3连接酶MDM2由于失控而上调从而过度降解p53蛋白[75]。实验证实高危型HPVs中E6也能够与p53相互作用从而增强E3连接酶E6相关蛋白(E6-AP)介导的p53的泛素化降解。E6-AP只有在HPV 感染的细胞内既E6存在时, 它才能与p53相互作用并且使其降解[76]。因此, 病毒感染后使p53的降解等同于p53基因突变失活,这被认为是高危
第1期陈科等:自噬与泛素化蛋白降解途径的分子机制及其功能 15
型HPVs诱发恶性肿瘤的一个重要机制。有意思的是, 低危型HPVs来源的E6与p53相互作用后并不介导p53的降解, 因此不会导致肿瘤[77]。
2.3.3 UPS与帕金森氏症
研究发现在各种神经退行性疾病中聚集了许多泛素化的蛋白, 包括帕金森氏综合征、阿尔茨海默氏病、朊病毒感染疾病、肌萎缩性侧索硬化症和亨廷顿氏病等[78]。在这些疾病中, 有些疾病是由于特定蛋白质的聚集抑制了UPS活性间接导致的, 而有些疾病是由UPS异常直接导致的。帕金森氏症的病理学特征是产生黑质多巴胺神经元选择性的退化和在残存的神经元细胞内出现聚集的蛋白—Lewy 小体。多巴胺是控制肌肉运动的一种化学物质, 缺失多巴胺会造成震颤、僵硬和说话含糊等帕金森氏症患者常见的症状。Lewy 小体主要是由一些泛素化蛋白聚集而成的, 这说明Lewy 小体的形成与UPS 紊乱存在关联[47]。
到目前为止, 已经鉴定了许多与帕金森氏症相关的基因, 包括α-synuclein、uchl1、parkin、dj1和pink1等[47]。研究发现在大多数家族性帕金森氏症(也叫常染色体隐性遗传帕金森氏症)患者中parkin 基因发生了突变。Parkin蛋白是一个E3泛素连接酶, 并且在常染色体隐性遗传帕金森氏症患者中parkin 基因的突变都导致了Parkin蛋白的E3泛素连接酶活性丧失, 这可能是这一疾病的发病机理[79]。因此, parkin基因的突变可能使其一种或者多种底物在神经细胞中聚集。虽然现在已经鉴定了许多Parkin的底物, 但是它们是否导致这种疾病还不是很清楚。
在一个德国家庭家族性帕金森氏症患者中发现了uchl1基因的错译突变( I93M), 突变后的UCHL1的泛素水解酶活性下降了大约50%, 因此, 这个突变可能导致细胞内短缺自由的泛素。缺少自由的泛素可能会引起细胞内聚集一些特定的蛋白从而导致帕金森氏症[80]。此外, UCHL1除了具有泛素水解酶活性外, 它还具有泛素连接酶活性, 它可以延伸多聚泛素链促进蛋白的泛素化降解, 特别是促进α-Synuclein的多聚泛素化[81]。α-Synuclein是Lewy 小体的一个重要组成成分, 并且α-Synuclein的突变聚集成包涵体从而导致帕金森氏症。Lewy 小体内除了α-Synuclein外, 还有泛素和一些蛋白酶体亚基等, 这说明了α-Synuclein的不正常蛋白酶体降解可能导致了帕金森氏症[82]。因此, UPS的异常与帕金森氏症存在着密切的联系。
3结语
自噬与蛋白的泛素化在细胞内是协同作用的, 一些聚集的蛋白能够通过自噬途径降解, 它们首先被多聚泛素化修饰, 然后才被p62识别后运送到自噬体内降解。此外, 线粒体自噬也是泛素化和自噬协同作用的结果, 其过程为Pink-1促使E3泛素连接酶Parkin发生易位, 转运到线粒体上, 从而促进线粒体蛋白VDAC1的K27位连接多聚泛素, 随后泛素化的VDAC1被p62所招募并运送到自噬体内降解[14]。因此, 蛋白泛素化和自噬存在着密切联系。
在体内, 所有的细胞内和大多数细胞外的蛋白质都在不断地进行更新。细胞外的蛋白质降解主要是通过蛋白酶的作用, 而细胞内蛋白质的降解可以分为两类, 一是由溶酶体介导的自噬, 另一种是由泛素-蛋白酶体介导的蛋白泛素化降解。自噬可以分为3类, 即分子伴侣介导的自噬、巨自噬和微自噬。蛋白的降解在细胞的生理活动中发挥着不可替代的作用, 包括处理损伤或错误折叠的蛋白、不需要的组分、翻译后修饰的蛋白、外来蛋白降解成氨基酸在细胞内的再利用和维持细胞的自我平衡等。其异常将导致很多人类疾病, 例如肿瘤、神经退行性疾病、免疫系统相关疾病等。尽管现在对蛋白降解与人类疾病的分子机理有了一定的了解, 但是远还没认识清楚。
由于蛋白降解在所有细胞内执行最基本的生物学功能, 抑制蛋白降解途径的主要组成部分, 例如UPS或E1连接酶, 可能会非特异性地影响其他生物学过程, 从而产生很多其他的副作用。因此, 还需要更加详细的研究来确定具体蛋白是通过什么途径来降解的。然后再设计一些药物来抑制或者激活其降解通路, 用于治疗一些人类疾病。我们可以预计在将来, 将鉴定出更多介导蛋白底物降解的酶或者信号通路, 并且会有更多、更有效的药物用于治疗与蛋白降解相关的人类疾病。
参考文献(References):
[1] Lecker SH, Goldberg AL, Mitch WE. Protein degradation
16 HEREDITAS
(Beijing) 2012第34卷
by the ubiquitin-proteasome pathway in normal and disease states. J Am Soc Nephrol, 2006, 17(7): 1807–1819.DOI
[2] Luo H, Wong J, Wong B. Protein degradation systems in
viral myocarditis leading to dilated cardiomyopathy.
Cardiovasc Res, 2010, 85(2): 347–356. DOI
[3] Wang CW, Klionsky DJ. The molecular mechanism of
autophagy. Mol Med, 2003, 9(3?4): 65–76. DOI
[4] Kuma A, Hatano M, Matsui M, Yamamoto A, Nakaya H,
Yoshimori T, Ohsumi Y, Tokuhisa T, Mizushima N. The
role of autophagy during the early neonatal starvation
period. Nature, 2004, 432(7020): 1032–1036. DOI
[5] Mizushima N, Yamamoto A, Matsui M, Yoshimori T,
Ohsumi Y. In vivo analysis of autophagy in response to
nutrient starvation using transgenic mice expressing a
fluorescent autophagosome marker. Mol Biol Cell, 2004,
15(3): 1101–1111. DOI
[6] Yorimitsu T, Klionsky DJ. Autophagy: molecular machinery
for self-eating. Cell Death Differ, 2005, 12(Suppl. 2):
1542–1552. DOI
[7] Kuma A, Mizushima N. Physiological role of autophagy as
an intracellular recycling system: with an emphasis on
nutrient metabolism. Semin Cell Dev Biol, 2010, 21(7):
683–690. DOI
[8] Rabinowitz JD, White E. Autophagy and metabolism.
Science, 2010, 330(6009): 1344–1348. DOI
[9] Maiuri MC, Zalckvar E, Kimchi A, Kroemer G. Self-eating
and self-killing: crosstalk between autophagy and apoptosis. Nat Rev Mol Cell Biol, 2007, 8(9): 741–752.
DOI
[10] Tanida I, Ueno T, Kominami E. LC3 conjugation system in
mammalian autophagy. Int J Biochem Cell Biol, 2004,
36(12): 2503–2518. DOI
[11] Berry DL, Baehrecke EH. Growth arrest and autophagy
are required for salivary gland cell degradation in Drosophila.
Cell, 2007, 131(6): 1137–1148. DOI
[12] Mathew R, Karp CM, Beaudoin B, Vuong N, Chen GH,
Chen HY, Bray K, Reddy A, Bhanot G, Gelinas C, Dipaola
RS, Karantza-Wadsworth V, White E. Autophagy suppresses
tumorigenesis through elimination of p62. Cell, 2009,
137(6): 1062–1075. DOI
[13] Okamoto K, Kondo-Okamoto N, Ohsumi Y. Mitochondria-
anchored receptor Atg32 mediates degradation of mitochondria via selective autophagy. Dev Cell, 2009,
17(1): 87–97. DOI
[14] Geisler S, Holmstr?m KM, Skujat D, Fiesel FC, Rothfuss
OC, Kahle PJ, Springer W. PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1.
Nat Cell Biol, 2010, 12(2): 119–131. DOI
[15] Mizushima N. The role of the Atg1/ULK1 complex in
autophagy regulation. Curr Opin Cell Biol, 2010, 22(2):
132–139. DOI
[16] Huang J, Manning BD. A complex interplay between Akt,
TSC2 and the two mTOR complexes. Biochem Soc Trans,
2009, 37(Pt 1): 217–222. DOI
[17] Arico S, Petiot A, Bauvy C, Dubbelhuis PF, Meijer AJ,
Codogno P, Ogier-Denis E. The tumor suppressor PTEN
positively regulates macroautophagy by inhibiting the
phosphatidylinositol 3-kinase/protein kinase B pathway. J
Biol Chem, 2001, 276(38): 35243–35246. DOI
[18] Shackelford DB, Shaw RJ. The LKB1-AMPK pathway:
metabolism and growth control in tumour suppression. Nat
Rev Cancer, 2009, 9(8): 563–575. DOI
[19] Liang JY, Shao SH, Xu ZX, Hennessy B, Ding ZY, Larrea
M, Kondo S, Dumont DJ, Gutterman JU, Walker CL,
Slingerland JM, Mills GB. The energy sensing LKB1-
AMPK pathway regulates p27kip1 phosphorylation mediating
the decision to enter autophagy or apoptosis. Nat Cell Biol,
2007, 9(2): 218–224. DOI
[20] Kim J, Kundu M, Viollet B, Guan KL. AMPK and mTOR
regulate autophagy through direct phosphorylation of Ulk1.
Nat Cell Biol, 2011, 13(2): 132–141. DOI
[21] Egan DF, Shackelford DB, Mihaylova MM, Gelino S,
Kohnz RA, Mair W, Vasquez DS, Joshi A, Gwinn DM,
Taylor R, Asara JM, Fitzpatrick J, Dillin A, Viollet B,
Kundu M, Hansen M, Shaw RJ. Phosphorylation of ULK1
(hATG1) by AMP-activated protein kinase connects energy sensing to mitophagy. Science, 2011, 331(6016):
456–461. DOI
[22] Brugarolas J, Lei K, Hurley RL, Manning BD, Reiling JH,
Hafen E, Witters LA, Ellisen LW, Kaelin WG Jr. Regulation
of mTOR function in response to hypoxia by REDD1 and
the TSC1/TSC2 tumor suppressor complex. Genes Dev,
2004, 18(23): 2893–2904. DOI
[23] Zhang HF, Bosch-Marce M, Shimoda LA, Tan YS, Baek
JH, Wesley JB, Gonzalez FJ, Semenza GL. Mitochondrial
autophagy is an HIF-1-dependent adaptive metabolic response to hypoxia. J Biol Chem, 2008, 283(16): 10892–
10903. DOI
[24] Feng ZH, Zhang HY, Levine AJ, Jin SK. The coordinate
regulation of the p53 and mTOR pathways in cells. Proc
Natl Acad Sci USA, 2005, 102(23): 8204–8209. DOI
[25] Crighton D, Wilkinson S, O'Prey J, Syed N, Smith P,
Harrison PR, Gasco M, Garrone O, Crook T, Ryan KM.
DRAM, a p53-induced modulator of autophagy, is critical
for apoptosis. Cell, 2006, 126(1): 121–134. DOI
[26] Budanov AV, Karin M. p53 target genes sestrin1 and
sestrin2 connect genotoxic stress and mTOR signaling.
Cell, 2008, 134(3): 451–460. DOI
[27] Tasdemir E, Maiuri MC, Galluzzi L, Vitale I,
第1期陈科等:自噬与泛素化蛋白降解途径的分子机制及其功能 17
Djavaheri-Mergny M, D'Amelio M, Criollo A, Morselli E,
Zhu CL, Harper F, Nannmark U, Samara C, Pinton P,
Vicencio JM, Carnuccio R, Moll UM, Madeo F, Paterlini-Brechot P, Rizzuto R, Szabadkai G, Pierron G,
Blomgren K, Tavernarakis N, Codogno P, Cecconi F, Kroemer G. Regulation of autophagy by cytoplasmic p53.
Nat Cell Biol, 2008, 10(6): 676–687. DOI
[28] Meijer AJ, Codogno P. Autophagy: a sweet process in
diabetes. Cell Metab, 2008, 8(4): 275–276. DOI
[29] Huang J, Klionsky DJ. Autophagy and human disease.
Cell Cycle, 2007, 6(15): 1837–1849. DOI
[30] Perlmutter DH. The role of autophagy in alpha-1-antitrypsin
deficiency: a specific cellular response in genetic diseases
associated with aggregation-prone proteins. Autophagy,
2006, 2(4): 258–263. DOI
[31] Nixon RA. Autophagy in neurodegenerative disease:
friend, foe or turncoat? Trends Neurosci, 2006, 29(9):
528–535. DOI
[32] Kegel KB, Kim M, Sapp E, McIntyre C, Casta?o JG,
Aronin N, DiFiglia M. Huntingtin expression stimulates
endosomal-lysosomal activity, endosome tubulation, and
autophagy. J Neurosci, 2000, 20(19): 7268–7278. DOI [33] 林芳, 顾振纶, 秦正红. 自噬及其在细胞代谢和疾病中
的作用. 生物化学与生物物理进展, 2005, 32(4): 198–
205. DOI
[34] Fukuda T, Roberts A, Ahearn M, Zaal K, Ralston E, Plotz
PH, Raben N. Autophagy and lysosomes in Pompe disease.
Autophagy, 2006, 2(4): 318–320. DOI
[35] Karantza-Wadsworth V, Patel S, Kravchuk O, Chen GH,
Mathew R, Jin SK, White E. Autophagy mitigates metabolic
stress and genome damage in mammary tumorigenesis.
Genes Dev, 2007, 21(13): 1621–1635. DOI
[36] Mathew R, Kongara S, Beaudoin B, Karp CM, Bray K,
Degenhardt K, Chen GH, Jin SK, White E. Autophagy
suppresses tumor progression by limiting chromosomal
instability. Genes Dev, 2007, 21(11): 1367–1381. DOI [37] Yousefi S, Perozzo R, Schmid I, Ziemiecki A, Schaffner T,
Scapozza L, Brunner T, Simon HU. Calpain-mediated cleavage of Atg5 switches autophagy to apoptosis. Nat
Cell Biol, 2006, 8(10): 1124–1132. DOI
[38] Komatsu M, Waguri S, Koike M, Sou YS, Ueno T, Hara T,
Mizushima N, Iwata JI, Ezaki J, Murata S, Hamazaki J,
Nishito Y, Iemura SI, Natsume T, Yanagawa T, Uwayama J,
Warabi E, Yoshida H, Ishii T, Kobayashi A, Yamamoto M,
Yue ZY, Uchiyama Y, Kominami E, Tanaka K.
Homeostatic levels of p62 control cytoplasmic inclusion
body formation in autophagy-deficient mice. Cell, 2007,
131(6): 1149–1163. DOI
[39] Yang ZJ, Chee CE, Huang SB, Sinicrope F. Autophagy
modulation for cancer therapy. Cancer Biol Ther, 2011,
11(2): 169–176. DOI
[40] Boya P, González-Polo RA, Casares N, Perfettini JL,
Dessen P, Larochette N, Métivier D, Meley D, Souquere S,
Yoshimori T, Pierron G, Codogno P, Kroemer G. Inhibition
of macroautophagy triggers apoptosis. Mol Cell Biol, 2005,
25(3): 1025–1040. DOI
[41] 章晟, 于长明, 殷瑛, 陈薇. 细胞自噬在病原体感染过
程中的作用研究进展. 军事医学科学院院刊, 2009, 33(5): 469–473. DOI
[42] Espert L, Codogno P, Biard-Piechaczyk M. Involvement of
autophagy in viral infections: antiviral function and subversion by viruses. J Mol Med, 2007, 85(8): 811–823.
DOI
[43] Tallóczy Z, Virgin HWt, Levine B. PKR-dependent
autophagic degradation of herpes simplex virus type 1.
Autophagy, 2006, 2(1): 24–29. DOI
[44] Jackson WT, Giddings TH Jr., Taylor MP, Mulinyawe S,
Rabinovitch M, Kopito RR, Kirkegaard K. Subversion of
cellular autophagosomal machinery by RNA viruses. PLoS
Biol, 2005, 3(5): e156. DOI
[45] Schimke RT, Doyle D. Control of enzyme levels in animal
tissues. Annu Rev Biochem, 1970, 39: 929–976. DOI [46] Haider M, Segal HL. Some characteristics of the alanine
aminotransferase- and arginase-inactivating system of lysosomes. Arch Biochem Biophys, 1972, 148(1): 228–237.
DOI
[47] Reinstein E, Ciechanover A. Narrative review: protein
degradation and human diseases: the ubiquitin connection.
Ann Intern Med, 2006, 145(9): 676–684. DOI
[48] Ciechanover A. The ubiquitin-proteasome pathway: on
protein death and cell life. EMBO J, 1998, 17(24): 7151–
7160. DOI
[49] Glickman MH, Ciechanover A. The ubiquitin-proteasome
proteolytic pathway: destruction for the sake of construc-
tion. Physiol Rev, 2002, 82(2): 373–428. DOI
[50] Rape M, Jentsch S. Taking a bite: proteasomal protein
processing. Nat Cell Biol, 2002, 4(5): E113–E116. DOI [51] Havens CG, Ho A, Yoshioka N, Dowdy SF. Regulation of
late G1/S phase transition and APC Cdh1 by reactive oxygen
species. Mol Cell Biol, 2006, 26(12): 4701–4711. DOI [52] Oh YM, Kwon YE, Kim JM, Bae SJ, Lee BK, Yoo SJ,
Chung CH, Deshaies RJ, Seol JH. Chfr is linked to tumour
metastasis through the downregulation of HDAC1. Nat
Cell Biol, 2009, 11(3): 295–302. DOI
[53] Kang DM, Chen J, Wong J, Fang GW. The checkpoint
protein Chfr is a ligase that ubiquitinates Plk1 and inhibits
Cdc2 at the G2 to M transition. J Cell Biol, 2002, 156(2):
249–259. DOI
[54] Maddika S, Sy SMH, Chen JJ. Functional interaction
between Chfr and Kif22 controls genomic stability. J Biol
18 HEREDITAS
(Beijing) 2012第34卷
Chem, 2009, 284(19): 12998–13003. DOI
[55] Kim JM, Cho EN, Kwon YE, Bae SJ, Kim M, Seol JH.
CHFR functions as a ubiquitin ligase for HLTF to regulate
its stability and functions. Biochem Biophys Res Commun,
2010, 395(4): 515–520. DOI
[56] Schwartz LM, Myer A, Kosz L, Engelstein M, Maier C.
Activation of polyubiquitin gene expression during developmentally programmed cell death. Neuron, 1990, 5(4): 411–419. DOI
[57] Orlowski RZ. The role of the ubiquitin-proteasome pathway
in apoptosis. Cell Death Differ, 1999, 6(4): 303– 313. DOI [58] Lahav G, Rosenfeld N, Sigal A, Geva-Zatorsky N, Levine
AJ, Elowitz MB, Alon U. Dynamics of the p53-Mdm2
feedback loop in individual cells. Nat Genet, 2004, 36(2):
147–150. DOI
[59] Garrido C, Brunet M, Didelot C, Zermati Y, Schmitt E,
Kroemer G. Heat shock proteins 27 and 70: anti-apoptotic
proteins with tumorigenic properties. Cell Cycle, 2006, 5(22): 2592–2601. DOI
[60] Goldberg AL. Functions of the proteasome: from protein
degradation and immune surveillance to cancer therapy.
Biochem Soc Trans, 2007, 35(Pt 1): 12–17. DOI
[61] Wang J, Maldonado MA. The ubiquitin-proteasome system
and its role in inflammatory and autoimmune diseases.
Cell Mol Immunol, 2006, 3(4): 255–261. DOI
[62] Moon J, Parry G, Estelle M. The ubiquitin-proteasome
pathway and plant development. Plant Cell, 2004, 16(12):
3181–3195. DOI
[63] Dharmasiri S, Estelle M. The role of regulated protein
degradation in auxin response. Plant Mol Biol, 2002, 49(3?4): 401–409. DOI
[64] Cao XR, Lill NL, Boase N, Shi PP, Croucher DR, Shan
HB, Qu J, Sweezer EM, Place T, Kirby PA, Daly RJ, Kumar S, Yang BL. Nedd4 controls animal growth by
regulating IGF-1 signaling. Sci Signal, 2008, 1(38): ra5.
DOI
[65] 李艳凤, 张强, 朱大海. 泛素介导的蛋白质降解与肿瘤
发生. 遗传, 2006, 28(12): 1591–1596. DOI
[66] van Driest SL, Vasile VC, Ommen SR, Will ML, Tajik AJ,
Gersh BJ, Ackerman MJ. Myosin binding protein C mutations and compound heterozygosity in hypertrophic
cardiomyopathy. J Am Coll Cardiol, 2004, 44(9): 1903–
1910. DOI
[67] Herrmann J, Ciechanover A, Lerman LO, Lerman A. The
ubiquitin-proteasome system in cardiovascular diseases-a
hypothesis extended. Cardiovasc Res, 2004, 61(1): 11–21.
DOI
[68] Bousman CA, Chana G, Glatt SJ, Chandler SD, Lucero GR,
Tatro E, May T, Lohr JB, Kremen WS, Tsuang MT, Everall
IP. Preliminary evidence of ubiquitin proteasome system
dysregulation in schizophrenia and bipolar disorder: convergent pathway analysis findings from two independent
samples. Am J Med Genet B Neuropsychiatr Genet, 2010,
153B(2): 494–502. DOI
[69] Turnbull EL, Rosser MF, Cyr DM. The role of the UPS in
cystic fibrosis. BMC Biochem, 2007, 8(Suppl. 1): S11.
DOI
[70] Carvalho RF, Castan EP, Coelho CA, Lopes FS, Almeida
FLA, Michelin A, de Souza RWA, Araújo JP Jr, Cicogna
AC, Dal Pai-Silva M. Heart failure increases atrogin-1 and
MuRF1 gene expression in skeletal muscle with fiber type-specific atrophy. J Mol Histol, 2010, 41(1): 81–87.
DOI
[71] Kaelin WG Jr. The von Hippel-Lindau tumour suppressor
protein: O2 sensing and cancer. Nat Rev Cancer, 2008,
8(11): 865–873. DOI
[72] Scheffner M, Whitaker NJ. Human papillomavirus-induced
carcinogenesis and the ubiquitin-proteasome system.
Semin Cancer Biol, 2003, 13(1): 59–67. DOI
[73] Kondo K, Kim WY, Lechpammer M, Kaelin WG Jr.
Inhibition of HIF2alpha is sufficient to suppress pVHL-
defective tumor growth. PLoS Biol, 2003, 1(3): E83. DOI [74] Esteban MA, Tran MGB, Harten SK, Hill P, Castellanos
MC, Chandra A, Raval R, O'Brien TS, Maxwell PH.
Regulation of E-cadherin expression by VHL and hypoxia-
inducible factor. Cancer Res, 2006, 66(7): 3567–3575.
DOI
[75] Chène P. Inhibiting the p53-MDM2 interaction: an important
target for cancer therapy. Nat Rev Cancer, 2003, 3(2): 102–109. DOI
[76] Scheffner M, Werness BA, Huibregtse JM, Levine AJ,
Howley PM. The E6 oncoprotein encoded by human papillomavirus types 16 and 18 promotes the degradation
of p53. Cell, 1990, 63(6): 1129–1136. DOI
[77] Scheffner M, Takahashi T, Huibregtse JM, Minna JD,
Howley PM. Interaction of the human papillomavirus type
16 E6 oncoprotein with wild-type and mutant human p53
proteins. J Virol, 1992, 66(8): 5100–5105. DOI
[78] Ciechanover A, Brundin P. The ubiquitin proteasome
system in neurodegenerative diseases: sometimes the chicken,
sometimes the egg. Neuron, 2003, 40(2): 427–446. DOI [79] Hattori N, Mizuno Y. Pathogenetic mechanisms of parkin
in Parkinson's disease. Lancet, 2004, 364(9435): 722–724.
DOI
[80] Betarbet R, Sherer TB, Greenamyre JT. Ubiquitin-proteasome
system and Parkinson's diseases. Exp Neurol, 2005, 191
(Suppl. 1): S17–S27. DOI
[81] Liu YC, Fallon L, Lashuel HA, Liu ZH, Lansbury PT Jr.
The UCH-L1 gene encodes two opposing enzymatic activities that affect α-synuclein degradation and Parkinson's
第1期陈科等:自噬与泛素化蛋白降解途径的分子机制及其功能 19
disease susceptibility. Cell, 2002, 111(2): 209–218. DOI [82] Polymeropoulos MH, Lavedan C, Leroy E, Ide SE,
Dehejia A, Dutra A, Pike B, Root H, Rubenstein J, Boyer
R, Stenroos ES, Chandrasekharappa S, Athanassiadou A, Papapetropoulos T, Johnson WG, Lazzarini AM, Duvoisin RC, Di Iorio G, Golbe LI, Nussbaum RL. Mutation in the α-synuclein gene identified in families with Parkinson's disease. Science, 1997, 276(5321): 2045–2047. DOI
泛素-蛋白酶体通路与癌症关系的研究进展 张海满 (山东农业大学生命科学学院山东泰安201018) 摘要:泛素化过程是真核细胞内重要的蛋白质质控系统,参与细胞的多种生理活动过程,对维持细胞正常的生理功能具有十分重要的意义。泛素-蛋白酶体途径(UPP)的异常改变不仅与癌症的病因学有着直接关素,并且与癌症的发展和预后有着密切的关系。本文综述了泛素的构成、泛素链的形成过程、UPP的生理和病理功能及UPP与癌症的关系的研究进展。 关键词:泛素-蛋白酶体通路;UPP;癌症;研究 细胞内蛋白质的产生和降解必须保持着动态平衡,才能维持细胞的稳态和正常功能。泛素-蛋白酶体途径( ubiquitin-pro-teasome pathway, UPP)是细胞内蛋白质选择性降解的重要途径,泛素分子主要通过泛素活化酶、泛素结合酶和泛素-蛋白连接酶与靶蛋白结合形成一条多泛素链,将底物蛋白泛素化,使靶蛋白被26S蛋白酶体所识别和降解。UPP可高效并高选择性地降解细胞内蛋白质,尤其是一些短寿命的细胞周期调节蛋白、癌基因和抑癌基因产物以及变性变构蛋白等。 1.泛素-蛋白酶体途径(UPP)的构成 UPP成分十分复杂,主要包括泛素( ubiquitin, Ub)、泛素活化酶( ubiquitin-activatingenzyme, E1)、泛素连接酶( ubiquitin-conjugatingenzyme, E2)、泛素蛋白连接酶( ubiquitin-protein ligating enzyme, E3)、26S蛋白酶体及去泛素化酶( deubiquitinating enzyme, DUBs)等。UPP存在于所有真核生物的细胞内,是蛋白质选择性降解的主要方式。 1.1泛素( ubiquitin, Ub) 泛素是一种广泛分布在真核细胞中的高度保守的小分子球状蛋白质。1975年由Goldstein首次提出,此后不断出现有关报道[1]。单个泛素分子由76个氨基酸残基组成,相对分子质量约8.5×103,有一个明显的疏水核心和大量的氢键,表现出特殊的稳定性,能够防止其自身在结合和靶向性降解循环中变性失活,从而保证泛素循环的进行。依赖于ATP的酶促反应,E1通过在Ub的羧基末端和E1自身激活位点半胱氨酸之间形成一个硫酯键而激活Ub,激活的Ub被转到E2结合酶上,然后E2在E3作用下共价结合到需要降解的胞质或胞核的蛋白上,使底物蛋白发生泛素化,形成Ub单体,多个Ub单体通过异肽键连接形成多聚Ub链,每个多聚Ub链至少含有4个Ub单体。 1.2泛素活化酶( ubiquitin-activating enzymes, E1) 泛素活化酶是单基因编码的相对分子质量分别为110×103和117×103的2个亚基,存在于细胞核
泛素化蛋白检测方法 蛋白质泛素化简介蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76 个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3 酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7 个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48 位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63 位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB )将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD )所 识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90 种DUB 酶和20 种UBD ,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。E3 酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT 结构域的E3 酶和其它含有RING 结构域或RING 样结构域(比如U-box 或PHD 结构域)的E3 酶。这两种E3 酶都在免疫调控过程中起到了关键性的作用。 蛋白质泛素化的检测方法研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是 如何发生泛素化的,影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3 酶是什么? 然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应?对下游
泛素-蛋白酶体及其抑制剂 沈子珒许啸声李稻审校 上海交通大学医学院病理生理学教研室 摘要:蛋白酶体与泛素化信号系统一起构成的泛素—蛋白酶体(UPP)是哺乳动物细胞内主要的蛋白水解酶体系,参与和调控细胞的增殖、分化和凋亡。蛋白酶体是一个由20S 催化颗粒、11S调控因子和2个19S调节颗粒组成的ATP依赖性蛋白水解酶复合体。蛋白酶体的活性状态对细胞功能正常维持是非常重要的。26S蛋白酶体对蛋白的降解依赖于靶蛋白的泛素化和泛素化蛋白识别。蛋白酶体抑制剂能通过抑制蛋白酶体活性进而干扰和影响细胞原有的功能,尤其对肿瘤细胞生长有明显的抑制作用。同时,利用蛋白酶体抑制剂改变蛋白酶体的酶切位点活性也成为免疫、炎症等研究的热点。蛋白酶体的抑制剂可分为天然化合物和合成化合物两类,其中Bonezomib(Velcade,PS-341)是近年研究较多的一种蛋白酶体抑制剂。 关键词:肿瘤蛋白酶体泛素蛋白酶体抑制剂PS-341 泛素—蛋白酶体通路(Ubiquitin–proteasome pathway,UPP)的蛋白酶体(proteasome)是一种具有多个亚单位组成的蛋白酶复合体,蛋白酶体沉降系数为26S,故又称26S蛋白酶体。蛋白酶体水解蛋白的前提是靶蛋白的泛素化。在UPP中,各种靶蛋白质泛素化后,先被26S蛋白酶体的19S亚单位识别,随后泛素化靶蛋白脱泛素链和变性,进入20S亚单位的筒状结构内被降解成3~22个多肽。由于蛋白酶体具有精确降解细胞内各种目的靶蛋白,进而参与基因转录和细胞周期调节,以及受体胞吞、抗原呈递等各种细胞生理过程[1]。因此,应用蛋白酶体抑制剂改变其酶切位点活性已成为抗肿瘤治疗的研究热点,蛋白酶体是影响和改变细胞功能重要的目的靶标。 1.蛋白酶体组成 1979年,Goldberg等首先报道在大鼠肝脏和网织红细胞中存在一种分子质量为700 kD的受A TP激活的中性蛋白水解酶。此后,一些在形态、功能及免疫学特征上与之相同的颗粒通过不同途径被分离出来,被统一命名为蛋白酶体[2]。在真核生物进化中,蛋白酶体具有高度的保守性,其简单形式甚至存在于古细菌和真细菌中。真核细胞内的蛋白酶体分布于胞质与胞核内,有的与内质网或细胞骨架相结合,约占细胞蛋白质总量的1%。有功能的26S蛋白酶体是由20S催化颗粒(catalytic particle, CP)、11S调控因子(11S regulator)和2个19S调节颗粒(regulatory particle, RP)组成,其分子量为2.4MD,是ATP依赖性蛋白水解酶复合体。 1.120S催化颗粒(20S CP) 人类蛋白酶体CP的沉降系数为20S,分子量700~750kD。它由α环和β环组成,每个环各有7个相同的亚单位,分别以α1-7β1-7β1-7α1-7顺序排列成圆桶状结构,20S CP中间由两个β亚单位环组成。几乎所有β亚单位都含有一个N 端前导序列,尽管此序列在20S CP装配过程中被切除,但在引导真核生物β亚单位的正确折叠以及β与α亚单位的组装中有重要作用[3]。当β亚单位的N端前导序列被切除后,Thr残基被暴露出来,Thr是酶的活性位点,分别存在于β环的内表面,使β亚单位具有类似的丝氨酸蛋白酶的催化作用[4]。例如,β亚单位N端的折叠方式允许Thr的-OH对底物发动亲核反应形成半缩醛,而Thr的α-NH3可代替丝氨酸蛋白酶中His的咪唑基作为质子受体。此外,活性位点附近的一个Lys残基与特定的丝氨酸蛋白酶中一样,也起着催化剂的作用。目前认为,在20S CP内起催化作用的亚单位主要是β1、β2、β5。不同的β亚单位的催化活性尽管不同,但能互相协调使蛋白酶体具有多种蛋白酶活性,如类糜蛋白酶活性(chymotrypsin-like, ChTL)、类胰蛋白酶活性(trypsin-like,TL)、肽-谷氨酰肽水解酶活性(post-glutamyl-peptide hydrolyzing,PGPH)、支链氨基酸肽酶活性、中性氨基酸切割活性。在20S CP圆桶状的两端由α亚单位环组形成,环口的中央被α亚单位(α
蛋白质泛素化研究进展——探索蛋白修饰的秘密 泛素是一种含76个氨基酸的多肽,存在于除细菌外的许多不同组织和器官中,具有标记待降解蛋白质的功能。被泛素标记的蛋白质在蛋白酶体中被降解。由泛素控制的蛋白质降解具有重要的生理意义,它不仅能够清除错误的蛋白质,还对细胞周期调控、DNA修复、细胞生长、免疫功能等都有重要的调控作用。 2004年,以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose就因发现泛素调节的蛋白质降解而被授予2004年诺贝尔化学奖。正是因为泛素调节的蛋白质降解在生物体中如此重要,因而对它的开创性研究也就具有了特殊意义。目前,在世界各地的很多实验室中,科学家不断发现和研究与这一降解过程相关的细胞新功能。现在,研究人员已发现泛素具有多种非蛋白水解功能,包括参与囊泡转运通路、调控组蛋白修饰以及参与病毒的出芽过程等。 鉴于蛋白质降解异常与许多疾病,例如癌症、神经退行性病变以及免疫功能紊乱的发生密切相关,而基因的功能是通过蛋白质的表达实现的,因此,泛素在蛋白质降解中的作用机制如能被阐明将对解释多种疾病的发生机制和遗传信息的调控表达有重要意义。 《生命奥秘》本月专题将介绍泛素系统的来源、研究进展,并重点介绍以“泛素-蛋白酶”为靶位的抗癌疗法,希望能给相关领域的研究人员带来崭新的思路。 一、泛素样蛋白的来源及功能 1. 泛素样蛋白及其相关蛋白结构域 2. 泛素样蛋白连接后的结果 3. 泛素样蛋白修饰途径的起源 4. 前景展望 二、泛素化途径与人体免疫系统调节 1. 泛素修饰途径与NF-κB信号通路的关系 2. 泛素蛋白在天然免疫中的作用 3. 泛素化修饰途径在获得性免疫机制中的作用
HEREDITAS (Beijing) 2012年1月, 34(1): 5―18 ISSN 0253-9772 https://www.doczj.com/doc/2411477767.html, 综 述 收稿日期: 2011?06?03; 修回日期: 2011?08?19 基金项目:转基因生物新品种培育重大专项(编号:2009ZX08009-148B)资助 作者简介:陈科, 博士研究生, 研究方向:动物发育遗传学。E-mail: chenke@https://www.doczj.com/doc/2411477767.html, 通讯作者:周荣家, 教授, 博士生导师, 研究方向:动物发育遗传学。E-mail: rjzhou@https://www.doczj.com/doc/2411477767.html, 网络出版时间: 2011-8-24 11:11:40 URL: https://www.doczj.com/doc/2411477767.html,/kcms/detail/11.1913.R.20110824.1111.004.html DOI: 10.3724/SP.J.1005.2012.00005 自噬与泛素化蛋白降解途径的分子机制及其功能 陈科, 程汉华, 周荣家 武汉大学生命科学学院, 武汉 430072 摘要: 细胞内所有的蛋白质和大多数的细胞外蛋白都在不断的进行更新, 即它们在不断地被降解, 并被新合成 的蛋白质取代。细胞内蛋白的降解主要通过两个途径, 即自噬和泛素蛋白酶体系统。自噬是一种由溶酶体介导的细胞内过多或异常蛋白质的降解机制。在细胞内主要有3种类型的自噬, 即分子伴侣介导的自噬、微自噬和巨自噬。泛素蛋白酶体系统是由泛素介导的一种高度复杂的蛋白降解机制, 它参与降解细胞内许多蛋白质并且这个过程具有高度特异性。细胞内蛋白质的降解参与调节许多细胞过程, 包括细胞周期、DNA 修复、细胞生长和分化、细胞质量的控制、病原生物的感染反应和细胞凋亡等。许多严重的人类疾病被认为是由于蛋白质降解系统的紊乱而引起的。文章综述了自噬和泛素化途径及其分子机制, 以及蛋白质降解系统紊乱的病理学意义。 关键词: 蛋白质降解; 自噬; 泛素蛋白酶体系统 Molecular mechanisms and functions of autophagy and the ubiq-uitin-proteasome pathway CHEN Ke, CHENG Han-Hua, ZHOU Rong-Jia Life Science College , Wuhan University , Wuhan 430072, China Abstract: All proteins in eukaryotic cells are continually being degraded and replaced. Autophagy and the ubiq-uitin-proteasome system are two mechanisms for intracellular protein degradation. Autophagy is mediated by lysosome, and is further divided into chaperone-mediated autophagy, microautophagy and macroautophagy. The ubiquitin-proteasome system is highly complex and mediated by ubiquitin, which participates in intracellular protein degradation in a specific manner. It is now known that degradation of intracellular proteins is involved in regulation of a series of cellular processes, including cell-cycle division, DNA repair, cell growth and differentiation, quality control, pathogen infection, and apoptosis. The aberrations in the protein degradation systems are involved in many serious human diseases. The present review sum-marizes the mechanisms of protein degradation and related human diseases. Keywords: protein degradation; autophagy; ubiquitin-proteasome system 细胞内所有的蛋白质和大多数的细胞外蛋白都在不断的进行更新, 即它们在不断地被降解和被新 合成的蛋白质取代。虽然不断降解细胞内的蛋白似乎很浪费, 但是这个过程在功能上却是非常重要
蛋白质降解的泛素—蛋白酶体途径 泛素(ubiquitin,Ub)是76个氨基残基组成的小分子多肽,可以以共价结合的方式与蛋白质的赖氨酸相连。蛋白质一旦接有泛素,称为发生泛素化(uhiquitylation)。泛素化在A TP的参与下被三种酶依序催化,形成蛋白质与一条泛素聚合链相结合的复合结构,进入蛋白酶体,然后降解为肽段(图8—15A)。此为生物大分子在胞质中降解的泛素—蛋白酶体途径(ubiquitim proteosome pathway)。泛素化是一个具有普遍意义的免疫生物学现象。例如第一章提到NF-~B激活中抑制成分I-~cB的降解,以及免疫调节一章中将提到细胞因子信号转导抑制蛋白(SOCS)对底物的作用,皆涉及这一泛素—蛋白酶体途径。 蛋白质泛素化系统由3个组分构成,一个称为泛素激活酶n,它可利用水解A TP释放的能量以其胱氨酸残基(Cys)的巯基与泛素C端的甘氨酸残基(Gly)形成高能硫酯键。然后连接在殿上的泛素被转移到另一个泛素结合酶E2上,同时,被选中的靶蛋白与第三个组分即靶蛋白泛素连接酶E3结合(图8—15A)。E2然后将与其连接的泛素转移到靶蛋白上,并与靶蛋白赖氨酸残基(Lys)—NH2基团形成异肽键(isopeptidebond),E2被释放。选择什么样的蛋白质进行泛素化主要取决于E2和E3。 内源性抗原在胞内的降解 A.泛素蛋白酶体降解途径;B.泛素化的内源性被28S免疫蛋白酶体降解成肽段。 单个连接的泛素残基尚不足以引起底物降解,活细胞中有一系列的泛素残基可加到前一个泛素赖氨酸残基上,形成泛素聚合链(polyUb),这一过程受细胞活性的调控。连接到降解蛋白质底物上的多聚泛素链可为蛋白酶体提供识别的信号,也是调控蛋白质降解的环节之一。 内源性抗原肽依据该途径实施降解,具体涉及两个作用环路。其一是泛素与底物结合,然后在分解酶(deconjugatmg enzyme)DUB的作用下重新游离,已如上述;二是结合有调节复合物的28S免疫蛋白酶体,对带有泛素聚合链的内源性抗原肽实施降解,然后再回复到19S 调节复合物及20S蛋白酶体,构成第二个环路。两者共同作用的结果是,泛素化的内源性抗原进入免疫蛋白酶体的孔道后,在蛋白水解酶的作用下降解成为5~15个氨基酸残基的短肽。
精心整理 泛素化蛋白检测方法 ● 蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶7个赖氨蛋白链(位赖氨酸)将泛素E2酶、600种E3E3E3E3酶都● 影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3酶是什么? 然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应?对下游的信号通路有什么影响? 研究上述内容的实验方法和实验流程: 方法一:westernblotandstrip 通过WB 检测所有发生泛素化的蛋白条带,拍照后,将膜strip 。然后与特定蛋白的抗体和特定泛素化位点的抗体反应,显色拍照。通过阳性条带的对比来初步判断某一特定蛋白的特定
位点发生了泛素化。【具体实验流程附后】 方法二:westernblotandimmunoprecipitations 通过免疫共沉淀方法将某一特定蛋白以及与其结合的蛋白分离出来。分离出来的蛋白再进行SDS电泳和westernblot分析。【具体实验流程附后】。这一方法可以明确具体哪个蛋白的哪个赖氨酸残基发生了泛素化修饰。 方法三:invitroubiquitinationassay 将要研究的目的基因转染293细胞,使其大量表达。24h后提取并分离目的蛋白。在体外反应buffer中将我们要研究的蛋白A(被泛素化的那个蛋白)与UBE1, A泛 。 SDS电
蛋白酶体 蛋白酶体(Proteasome)是一种巨型蛋白质复合物,主要作用是通过打断肽键来实现降解 细胞不需要的或受到损伤的蛋白质。 简介
蛋白酶体在真核生物和古菌中普遍存在,在一些原核生物中也存在。在真核生物中,它位于细胞核和细胞质中。[1] 能够发挥这一作用的酶被称为蛋白酶。蛋白酶体是细胞用来调控特定蛋白质的浓度和除去错误折叠蛋白质的主要机制。经过蛋白酶体的降解,蛋白质被切割为约7-8个氨基酸长的肽段;这些肽段可以被进一步降解为单个氨基酸分子,然后被用于合成新的蛋白质。[2] 反应过程 需要被降解的蛋白质会先被一个称为泛素的小型蛋白质所标记(即连接上)。这一标记反应是被泛素连接酶所催化。一旦一个蛋白质被标记上一个泛素分子,就会引发其它连接酶加上更多的泛素分子;这就形成了可以与蛋白酶体结合的“多泛素链”,从而将蛋白酶体带到这一标记的蛋白质上,开始其降解过程。[2] 分子结构 从蛋白质结构上看,蛋白酶体是一个桶状的复合物,[3] 包括一个由四个堆积在一起的环所组成的“核心”(右图中蓝色部分),核心中空,形成一个空腔。其中,每一个环由七个蛋白质分子组成。中间的两个环各由七个β亚基组成,并含有六个蛋白酶的活性位点。这些位点位于环的内表面,所以蛋白质必须进入到蛋白酶体的“空腔”中才能够被降解。外部的两个环各含有七个α亚基,可以发挥“门”的作用,是蛋白质进入“空腔”中的必由之路。这些α亚基,或者说“门”,是由结合在它们上的“帽”状结构(即调节颗粒,右图中红色部分)进行控制;调节颗粒可以识别连接在蛋白质上的多泛素链标签,并启动降解过程。包括泛素化和蛋白酶体降解的整个系统被称为“泛素-蛋白酶体系统”。 作用 蛋白酶体降解途径对于许多细胞进程,包括细胞周期、基因表达的调控、氧化应激反应等,都是必不可少的。2004年诺贝尔化学奖的获奖主题就是蛋白质酶解在细胞中的重要性和泛素在酶解途径的作用,而三位获奖者为阿龙·切哈诺沃、阿夫拉姆·赫什科和欧文·罗斯。 [4] 发现 在发现泛素-蛋白酶体系统之前,细胞中的蛋白质降解被认为主要依赖于溶酶体,一种膜包裹的囊状细胞器,内部为酸性环境且充满了蛋白酶,可以降解并回收外源蛋白质以及衰老或损伤的细胞器。[2] 然而,在对网织红血球的研究中发现,在缺少溶酶体的情况下,ATP依赖的蛋白质降解依然能够发生;这一结果提示,细胞中存在另一种蛋白质降解机制。1978年,一些研究者发现这一新的降解机制有多种不同的蛋白质参与,在当时被认为是新的蛋白酶。[5] 随后在对组蛋白修饰的研究工作中发现,组蛋白发生了意外的共价修饰:组蛋白上的一个赖氨酸残基与泛素蛋白C-端的甘氨酸残基之间形成了共价连接,但其对应的功能未知。[6] 而后又发现先前鉴定的一个参与新的降解机制的蛋白质,ATP依赖的蛋白质水解因子1(ATP-dependent proteolysis factor 1,APF-1),实际上就是泛素。[7]
李艳凤, 张强, 朱大海 (中国医学科学院基础医学研究所中国协和医科大学基础医学院, 北京100005) 摘要: 泛素介导的蛋白质降解途径是降解细胞内蛋白质的主要途径, 在维持细胞正常的蛋白质代谢中起着至关重要的作用。泛素介导的蛋白质降解途径的异常与许多疾病特别是肿瘤的发生密切相关。通过介绍泛素介导的蛋白质降解途径在细胞周期、DNA修复、细胞凋亡中的作用, 系统阐述了泛素介导的蛋白质降解途径与肿瘤发生的关系。 关键词: 基因表达调控; 泛素; 蛋白质降解; 细胞周期; DNA修复; 细胞凋亡; 肿瘤发生 中图分类号: Q519 文献标识码: A 文章编号: 0253-9772(2006)12-1591-06 The Ubiquitin-Proteasome Proteolytic Pathway and Tumorigenesis LI Yan-FenG, ZHANG Qiang, ZHU Da-Hai (Department of Biochemistry and Molecular Biology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 10005, China) Abstract: The ubiquitin-proteasome proteolytic pathway, a major pathway for protein degradation in cells, plays a critical role in the protein metabolism. So abnormality of the ubiquitin-proteasome proteolytic pathway is closely related to many diseases, especially cancer. In this paper, we reviewed the study of the significant role of the ubiquitin-proteasome proteolytic pathways during the cell cycle, DNA repair and apoptosis, especially the relationship between these pathways and tumorigenesis. Key words: gene expression and regulation; ubiquitin; protein degradation; cell cycle; DNA repair; apoptosis; tumorigenesis 蛋白质是执行生命活动的基本分子, 细胞中的蛋白质不断地处于合成、修饰与降解的代谢更新过程中。保持细胞正常的蛋白质代谢对于生命的正常功能至关重要。目前所知蛋白质的降解主要通过两种途径: 溶酶体降解途径和泛素介导的蛋白酶体降解途径。溶酶体降解途径是一个非选择的蛋白质降解途径, 主要降解通过摄粒作用或胞饮作用进入细胞内的外源蛋白质; 而泛素介导的途径是一个受到严格的时空调控的特异性蛋白质降解途径, 被降解的蛋白通过E1(泛素激活酶, Ubiquitin-activating enzyme)、E2(泛素偶联酶, Ubiquitin-conjungating enzyme)和E3(泛素连接酶, Ubiquitin ligase)一系列的作用与多个泛素共价结合后被蛋白酶复合体(Proteasome)识别并降解。泛素介导的蛋白质降解参与到细胞周期[1]、炎症反应[2]、细胞凋亡[3]、抗原提呈[4]等许多生命过程中。因此, 泛素介导的蛋白质降解途径的异常与许多疾病, 如恶性肿瘤、肌肉萎缩等的发生密切相关。本综述主要从细胞周期、DNA修复和细胞凋亡几个方面来介绍泛素介导的蛋白降解与肿瘤发生之间的关系。
泛素—蛋白酶体途径代谢异常与2型糖尿病发生的关系 随着社会的进步发展,人们生活水平的提高,糖尿病(diabetes mellitus,DM) 的发病率逐年增高。据统计2011年全球糖尿病患者总数约 3.66 亿[1],到2030 年患病人数预计将达到 5.52 亿,这其中 85%~90%为 2 型糖尿病(type 2 diabetes mellitus,T2DM),而中国、印度和美国为世界糖尿病三大国[2]。T2DM以及其相应带来的并发症已成为严重威胁人类机体健康的主要慢性病之一,不仅给患者身心带来巨大困扰,而且增加了患者家庭乃至社会的医疗负担。T2DM主要表现为胰岛素抵抗和胰岛素分泌缺陷而非胰岛B细胞自身免疫破坏。然而其确切发病机制尚未明确。近年来,人们发现在肥胖、糖尿病等众多机体代谢紊乱情况下,胰岛素靶器官中泛素-蛋白酶体系统(Ubiquitin-Proteasome System, UPS)活性明显上调,并且表现出相应的病理表现[3],UPS在T2DM及其并发症的发生、发展过程中起了重要作用。现将其机制作一综述。 1. 泛素—蛋白酶体系统的组成 UPS由泛素(ubiquitin, Ub)、泛素活化酶(ubiquitin—activating enzyme, E1 )、泛素结合酶(ubiquitin—conjugating enzyme, E2)、泛素蛋白连接酶(ubiquitin—protein ligase, E3 )、蛋白酶体及其底物(蛋白质)构成,其对靶蛋白的降解是一种三级酶联反应过程。通过UPS,细胞几乎可以对其内在的任何一种蛋白质进行高度特异性的降解,整个过程由底物蛋白的泛素化和蛋白酶体降解两个部分组成[4]【4】。泛素化是对特异的靶蛋白进行泛素修饰的过程,泛素化修饰涉及泛素激活酶 E1、泛素结合酶 E2 和泛素连接酶 E3 的一系列反应。首先在 ATP 供能的情况下,泛素分子 C 端的 Gly 残基与 E1 激活酶上的 Cys 残基结合,将泛素激活;接着,激活酶将活化的泛素分子通过转酰基作用转移到 E2 结合酶的 Cys 残基上,二者以硫酯键连接;之后,随着泛素连接酶识别靶蛋白,E3 连接酶分别结合着携带着泛素分子的 E2 结合酶和待泛素化修饰的底物蛋白,在连接酶的作用下,泛素分子从结合酶上转移到底物蛋白上,完成泛素化修饰。在此过程中,E3 连接酶尤其重要,它决定着泛素化修饰的时间性和特异性。根据连接在靶蛋白上的泛素分子的连接方式和数目,可以将泛素化修饰分为单泛素化修饰和多聚泛素化【5】。由泛素控制的蛋白质降解具有重要的生理意义,它不仅能够清除错误的蛋白质,还对细胞周期调控、DNA修复、细胞生长、免疫功能等都有重要的调控作用。 1.1泛素(Ub) Ub是1975 年由 Goldstein首先发现的一种在真核生物细胞内高度保守的多肽,单个泛素分子是由76个氨基酸组成,分子量约85kD , 泛素以共价键与底物蛋白连接,它的主要功能是标记待降解的蛋白质,使其被转运至蛋白酶体,进而发生降解【6】。泛素也可以标记跨膜蛋白,比如受体,将其从细胞膜上除去。泛素分子中散布着7个赖氨酸残基,这些残基可以作为其他泛素共价结合的位点。经过几轮结合后,泛素链将会变得很长,这样有助于对“标记”蛋白的识别【7】。泛素化蛋白可被泛素解离酶识别,而将泛素分子从底物蛋白上水解下来,重复利用【8】。 1.2 参与泛素化降解的酶 E1是一种广泛表达的多肽,大约1100 个氨基酸,含有位置固定的保守的半胱氨酸残基。有2个亚型,是由同一个mRNA 在不同的起始位点翻译而成的,存在于细胞浆和细胞核中。目前在脊椎动物中已发现的E1只有一个,有数目不等的E2和大量的E3;E1酶可以激活所有的E2酶,每个E2酶又可以与多个E3酶相互作用【9】。E1首先与ATP结合,然后与泛素相互作用,催化泛素C端腺嘌呤化并释放焦磷酸,使其C端甘氨酸残基与E1的半胱氨酸残基形成高能硫酯键而获得活性,E1—泛素结合的中间体再将泛素转移给E2s,形成E2-泛素中间体。
真核细胞内蛋白质的降解途径 作者:valley 日期:2009-3-9 11:13:00 1 推荐 真核细胞内蛋白质的降解途径主要有三种,溶酶体途径、泛素化途径和胱天蛋白酶(caspase)途径。 1、溶酶体途径:蛋白质在同酶体的酸性环境中被相应的酶降解,然后通过溶酶体膜的载体蛋白运送至细胞液,补充胞液代谢库。胞内蛋白:胞液中有些蛋白质的N端含有KFERQ信号,可以被HSC70识别结合,HSC70帮助这些蛋白质进入溶酶体,被蛋白水解酶降解。胞外蛋白:通过胞吞作用或胞饮作用进入细胞,在溶酶体中降解。 2、泛素-蛋白水解酶途径:一种特异性降解蛋白的重要途径,参与机体多种代谢活动,主要降解细胞周期蛋白Cyclin、纺锤体相关蛋白、细胞表面受体如表皮生长因子受体、转录因子如NF-KB、肿瘤抑制因子如P5 3、癌基因产物等;应激条件下胞内变性蛋白及异常蛋白也是通过该途径降解。该通路依赖ATP,有两步构成,即靶蛋白的多聚泛素化?多聚泛素化的蛋白质被26S蛋白水解酶复合体水解。 (1)、物质基础: 泛素(ubiquitin):一种76个氨基酸组成的蛋白质,广泛存在于真核生物中,又称遍在蛋白。在一系列酶的作用下被转移到靶蛋白上,介导靶蛋白的降解。 蛋白水解酶(proteasome):识别、降解泛素化的蛋白质的复合物,由30多种蛋白质及酶组成,其沉降系数为26S,又称26S蛋白酶体,由20S的圆柱状催化颗粒和19S的盖状调节颗粒组成,是一个具有胰凝乳蛋白酶、胰蛋白酶、胱天蛋白酶等活性的多功能酶。所有蛋白酶体的活性中心都含有Thr残基。经泛素化的底物蛋白可以被26S蛋白酶体的盖状调节颗粒识别,并被运送到20S的圆柱状核心内,在多种酶的作用下水解为寡肽,最后从蛋白酶体中释放出来。泛素则在去泛素化酶的作用下与底物解离后回到胞质重新利用。 (2)、具体过程: ①靶蛋白的多聚泛素化:泛素激活酶E1利用ATP在泛素分子C端Gly残基与其自身的半胱氨酸的SH间形成高能硫脂键,活化的泛素再被转移到泛素结合酶E2上,在泛素连接酶E3的作用下,泛素分子从E2转移到靶蛋白,与靶蛋白的Lys的ε-NH2形成异肽键,接着下一个泛素分子的C-末端连接到前一个泛素的lys48上,完成多聚泛素化(一般多于4个) ②多聚泛素化的蛋白质被26S蛋白水解酶复合体水解:经泛素化的底物蛋白可以被26S蛋白酶体的盖状调节颗粒识别,并被运送到20S的圆柱状核心内,在多种酶的作用下水解为寡肽,最后从蛋白酶体中释放出来。泛素则在去泛素化酶的作用下与底物解离后回到胞质重新利用。 3、胱天蛋白酶(caspase)途径:细胞凋亡的蛋白质降解途径。 Caspase的含义指该类蛋白酶的活性部位为极为保守的半胱氨酸(cysteine)及特异性切割底物的天冬氨酸(aspase),简称caspase。根据其具体功能分为调控caspase(caspase1,2,4,5,8,9,10)和效应caspase(caspase3,6,7,11)。 Caspase以酶原形式存在于正常细胞中,细胞凋亡启动后被激活。一条途径是由死亡信号分子和受体结合后的
仅作参考,如有抄袭,依法追究目录: 1.研究背景 2.泛素化降解途径 2.1泛素的基本结构 2.2泛素化的过程 2.3 E3酶对蛋白底物的识别 2.4 蛋白底物在26S蛋白酶体中的降解 3.研究的意义以及应用 4.研究展望
真核生物细胞中的蛋白质泛素化降解 摘要: 蛋白质是执行生命活动的基本分子,细胞中的蛋白质不断地处于合成、修饰与降解的代谢更新过程中。保持细胞正常的蛋白质代谢对于生命的正常功能至关重要。目前所知蛋白质的降解主要通过两种途径:溶酶体降解途径和泛素介导的蛋白酶体降解途径。溶酶体降解途径是一个非选择的蛋白质降解途径,主要降解通过摄粒作用或胞饮作用进入细胞内的外源蛋白质;而泛素介导的途径是一个受到严格的时空调控的特异性蛋白质降解途径。泛素系统广泛存在于真核生物中,是精细的特异性的蛋白质降解体系。泛素是一种序列保守的小分子蛋白质,蛋白质与泛素结合后,被蛋白酶体通过消耗ATP的方式降解。泛素系统由泛素、26S 蛋白酶体、多种酶(E1、E2、E3去泛素酶等)组成。其中E1和E2被称为泛素活化酶和泛素载体酶。泛素连接酶E3负责连接泛素与特异性底物,这样泛素化底物可以被26S蛋白酶体降解为若干肽段。泛素系统在真核生物中有非常重要的作用,通过降解蛋白质,调节细胞的分化、免疫,参与转录、分泌调控和细胞形成等,与人类的某些疾病有关。本文就泛素系统的组成、调控机制和研究进展做一介绍。 关键字:泛素系统;E3;26S蛋白酶体 正文: 1.研究背景 蛋白质在细胞内的降解是一个复杂的过程,但是又是一个高度有序的过程。真核生物中蛋白质的降解绝大多数都是由泛素系统完成。蛋白质首先是由泛素分子所特异性识别结合,在泛素分子的介导下,由泛素活化酶E1、泛素载体蛋白E2以及泛素连接酶E3特异性作用,与26S蛋白酶体作用,被切割成多肽。多聚泛素链可以还原成单体,循环使用。泛素与细胞的多种生命活动有关,例如细胞生长发育过程中组织抑制因子的选择性降解;细胞周期中,周期蛋白选择性降解等。许多疾病和泛素化的过程有关,利用泛素系统治疗疾病也成为了热点。 2.泛素蛋白酶系统 2.1泛素的基本结构 泛素是一种热稳定性蛋白,含有76个氨基酸,相对分子质量8.6kDa。结构保守,如图一是人和酵母细胞中泛素分子序列比对,我们可以看到,只有三个氨基酸的差别。 图一人和酵母的泛素分子序列比对
泛素标记的蛋白质降解 ——探索生命活动中化学过程的又一成果 李静雯陆真 (南京师范大学化学教育研究所南京 210097) 摘要:本文主要介绍了2004年诺贝尔化学奖--泛素调节蛋白质降解的原理、模型及应用实例。该成果将有助于科学家从分子水平对细胞控制蛋白质分裂进行研究,并有利于研发新型药物,从而造福人类。 关键词:2004诺贝尔化学奖泛素标记蛋白质降解 2004年10月16日瑞典皇家科学院将本年度诺贝尔化学奖授予以色列科学家阿龙·切哈诺沃、阿夫拉姆·赫什科和美国科学家欧文·罗斯,以表彰他们在泛素调节的蛋白质降解研究领域中的卓越成就。 图1 2004年诺贝尔化学奖获得者,从左至右依次为阿龙·切哈诺沃、阿弗拉姆·赫尔什科、欧文·罗斯 阿龙·切哈诺沃1947年出生在以色列城市海法,现年57岁,1976-1981年间在赫什科指导下攻读博士学位,1981年获得以色列工学院医学博士学位,曾在麻省理工学院从事研究,后返回以色列工学院任教;阿弗拉姆·赫尔什科1937年出生在匈牙利,犹太后裔,13岁移民以色列,现年67岁,1969年在耶路撒冷希伯来大学获得医学博士学位,曾在旧金山加州大学从事研究,1972年起在以色列工学院任教;来自美国的欧文·罗斯现年78岁,1952年在芝加哥大学获得博士学位,现就职于美国加利福尼亚大学欧文分校。三名获奖者自20世纪70~80年代以来就一直致力于这一领域的研究。1970年代末,赫什科借着带薪休假的机会,带着当时还是博士后的切哈诺沃,到美国费城福克斯·蔡斯癌症研究中心的罗斯实验室进行访问研究,在那里完成了三位获奖者的大部分合作研究,发表了一系列生物化学论文。 1 泛素调节的蛋白质降解的生物学概述 蛋白质是包括人类在内各种生物体的重要组成成分。对于生物体而言,蛋白质的生成与降解至关重要。过去几十年来,生物化学界对于细胞如何制造出各种蛋白质有很多解释,但是对蛋白质降解的研究还很少,上世纪80年代初期这三名学者深入蛋白质降解过程的研究领域,进而发现了细胞最重要的循环过程以及有规律的蛋白质降解活动。
泛素化蛋白检测方法 ●蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB)将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD)所识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。E3酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT结构域的E3酶和其它含有RING结构域或RING样结构域(比如U-box或PHD结构域)的E3酶。这两种E3酶都在免疫调控过程中起到了关键性的作用。 ●蛋白质泛素化的检测方法 研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3酶是什么?
泛素化蛋白检测方法 蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB)将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD)所识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB 酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。E3酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT结构域的E3酶和其它含有RING结构域或RING样结构域(比如U-box 或PHD结构域)的E3酶。这两种E3酶都在免疫调控过程中起到了关键性的作用。
蛋白质泛素化的检测方法 研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3酶是什么? 然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应?对下游的信号通路有什么影响? 研究上述内容的实验方法和实验流程: 方法一:western blot and strip 通过WB检测所有发生泛素化的蛋白条带,拍照后,将膜strip。然后与特定蛋白的抗体和特定泛素化位点的抗体反应,显色拍照。通过阳性条带的对比来初步判断某一特定蛋白的特定位点发生了泛素化。【具体实验流程附后】 方法二:western blot and immunoprecipitations 通过免疫共沉淀方法将某一特定蛋白以及与其结合的蛋白分离出来。分离出来的蛋白再进行SDS电泳和western blot分析。【具体实验流程附后】。这一方法可以明确具体哪个蛋白的哪个赖氨酸残基发生了泛素化修饰。 方法三:in vitro ubiquitination assay 将要研究的目的基因转染293细胞,使其大量表达。24h后提取并分离目的蛋白。在体外反应buffer中