
1、目的:建立氨咖黄敏胶囊工艺规程,作为全面指导生产和控制质量的基准性技术文件。
2、适用范围:适用于氨咖黄敏胶囊生产。
3、责任者:车间管理人员、质量监督员、操作人员。
4、内容:
4.1产品概述:
4.1.1 名称:
通用名:氨咖黄敏胶囊
英文名:Paracetamol,Caffein,Atificial cow-bezoar And Chlorphenamine Maleate Capsules
4.1.2产品代码:C025
4.1.3剂型:胶囊剂。
4.1.4性状:本品为胶囊剂,其内容物为着色颗粒和粉末。
4.1.5规格:本品为复方制剂,每粒含对乙酰氨基酚250mg、咖啡因15mg、马来酸氯苯那敏 1mg,人工牛黄10mg。
4.1.6批量:150.0万粒
4.1.7适应症:适用于缓解普通感冒及流行性感冒引起的发热、头痛、四肢酸痛、打喷嚏、流鼻涕、鼻塞、咽痛等症状。
4.1.8用法用量:口服。成人:一次1-2粒,一日3次。
4.1.9贮藏:密封,在阴凉干燥处保存。
4.1.10有效期:2年。
4.1.11包装:材质:铝箔、PVC包装: 10粒/板×50板/盒×60盒;
12粒/板×1板/盒×400盒; 12粒/板×2板/盒×400盒;
4.1.12申报批准文号的沿革:
首次86年12月27日批准,文号为皖卫药准字(86)348号;96年10月21日省卫生厅变更文号为皖卫药准字(1996)第102094;2001年8月6日省药监局统一变更文号为皖药准字(2001)第X004528号;2003年国家食品药品监督管理局统一换发文号为国药准字H34022182。
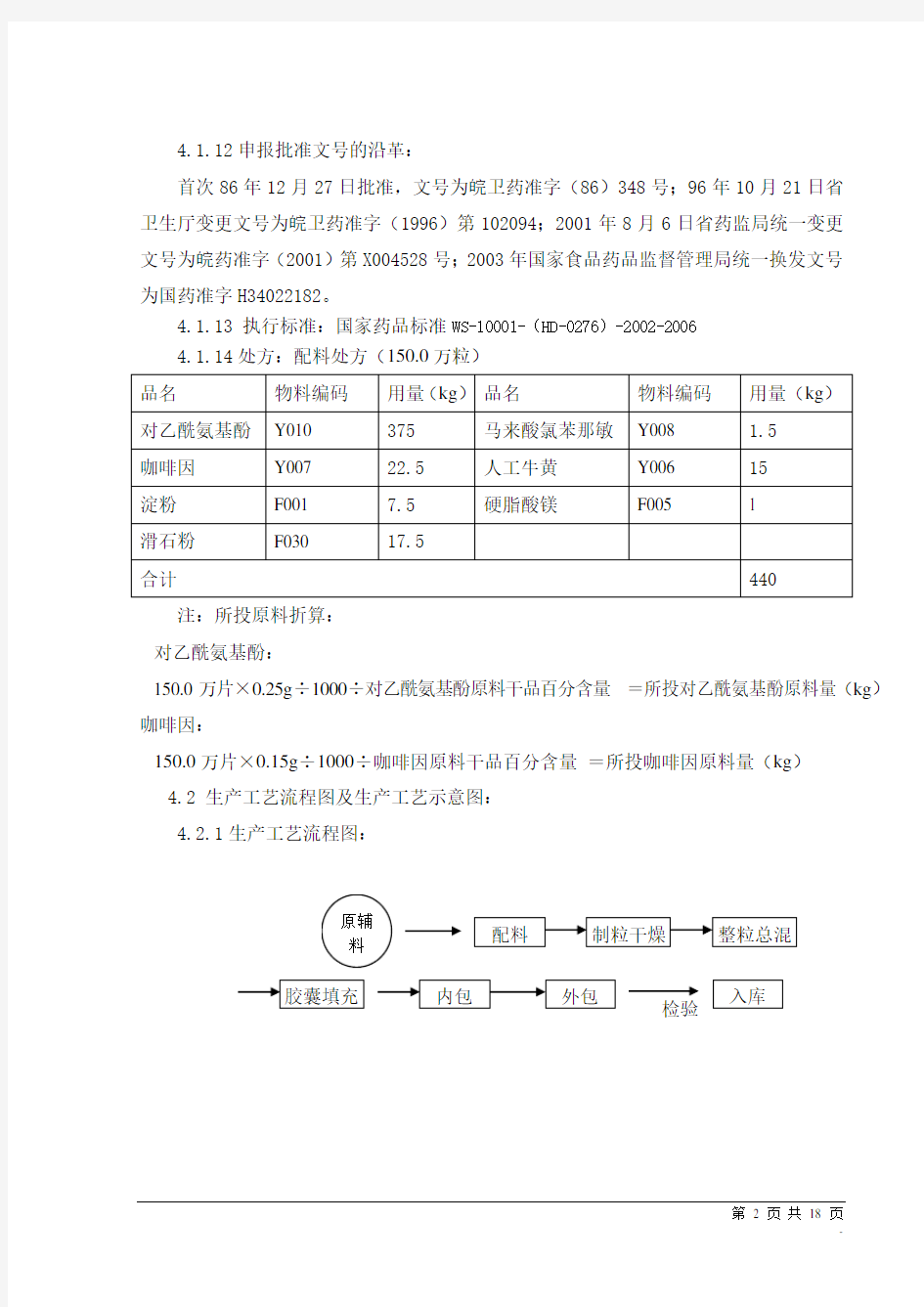
4.1.13 执行标准:国家药品标准WS-10001-(HD-0276)-2002-2006 4.1.14处方:配料处方(150.0万粒)
注:所投原料折算: 对乙酰氨基酚:
150.0万片×0.25g ÷1000÷对乙酰氨基酚原料干品百分含量 =所投对乙酰氨基酚原料量(kg ) 咖啡因:
150.0万片×0.15g ÷1000÷咖啡因原料干品百分含量 =所投咖啡因原料量(kg ) 4.2 生产工艺流程图及生产工艺示意图: 4.2.1生产工艺流程图:
检验
4.2.2生产工艺示意图:
* 质控点 工艺流向工序物料
万级洁净区,温度控制为18℃ — 26℃;湿度45% — 65%
4.3 操作过程及工艺条件:
4.3.1 进入洁净区的岗位操作人员,必须严格按照《进出洁净区更衣程序》(JMSOPWS02502)进行更衣后经人流通道进入洁净区。
4.3.2 领料:根据批生产指令单,开领料单从仓库限额领取合格的原辅料、包装材料,经质量监督员复核,确认合格后,按《物料进入洁净区程序》(JMSOPWS02902)进入车间备料间和包装材料存放间,贮存备用。咖啡因的领用按《精神药品领用发放程序》(JMSOPWL00303)执行。
4.3.3 配料:配料岗位的工作人员根据批生产指令单,从备料间领取原辅料,并核对品名、批号、数量、生产厂家、检验报告书等,确认无误后根据处方进行配料,配料
时应有人复核,配料人和复核人均要记录并签字。将配好的物料盛于装有洁净内袋的周转桶中,内外附上桶卡,桶卡应标明品名、批号、数量、操作者、复核者和日期,移交下道工序以备待用,剩余的原辅料退回备料间。及时做好岗位记录,按《片剂配料岗位清场程序》(JMSOPSC07802)清场,由质监员检查合格后发放《清场合格证》,更换状态标志,做好清场记录,严禁混料、配错。
4.3.4制粒
4.3.4.1 操作人员按《进出洁净区更衣程序》(JMSOPWS02502)进行更衣后进入工作岗位。
4.3.4.2 制粒前应先检查所用设备、容器是否完好、清洁,有无《清场合格证》,并检查清场合格证是否在有效期内,如超过清场有效期须重新清场,更换生产状态标志。
4.3.4.3制软材干燥
4.3.4.3.1 10%淀粉浆的培植:
4.3.4.3.2 淀粉和水的比例是:1:9
4.3.4.3.3将处方量的淀粉放入洁净的容器中,用冷水把淀粉冲散,再加沸水至规定的比例,边加边搅拌即可。(冷水用量以刚刚溶散淀粉为宜。)
4.3.4.3 更换设备运行标志,将上道工序配好的对乙酰氨基酚、马来酸氯苯那敏、咖啡因、人工牛黄投入混合机中加盖搅拌20±5分钟,加10%淀粉浆适量搅拌均匀制成软材,在摇摆式颗粒机上安装18目尼龙筛网,将制好的软材移入颗粒机中,湿粒的松紧度要求细小、均匀。
4.3.4.4 制好的湿颗粒应及时干燥,防止结块。
4.3.5 沸腾干燥:
4.3.
5.1干燥时气压控制在0.2Mpa-0.4Mpa,干燥时间35分钟±5分钟/料,进风温度70℃±5℃,出风温度35℃±5℃,水分在<3.0%,取样孔取干燥颗粒目测合格后收料,交整粒岗位。
4.3.
5.2槽形混合机的使用按《CH-200槽形混合机操作规程》(JMSOPSB00203)
摇摆式颗粒机的使用按《摇摆式颗粒机操作规程》(JMSOPSB00302)。沸腾制粒干燥机的使用按《FL-120沸腾制粒干燥机的操作规程》(JMSOPSB00503)。
4.3.
5.3槽形混合机的清洁消毒按《槽形混合机清洗规程》(JMSOPSB10202)摇摆式
颗粒机的清洁消毒按《摇摆式颗粒机清洁规程》(JMSOPSB10302)沸腾制粒干燥机的清洁消毒按《沸腾制粒干燥机清洗规程》(JMSOPSB10502)。
4.3.6整粒:
4.3.6.1干燥后的颗粒应进行整粒,根据要求安装好16目不锈钢筛网。
4.3.6.2按《KZL-200快速整粒机操作规程》(JMSOPSB00903)进行整粒,将整好的颗粒移交下道工序。
4.3.6.3 快速整粒机的清洁消毒详见《快速整粒机清洗规程》(JMSOPSB10802)。
4.3.7 总混:
4.3.7.1将整粒好的颗粒,和滑石粉、硬脂酸镁等辅料,投入二维运动混合机混合25±5分钟,二维运动混合机的操作详见《二维运动混合机操作规程》(JMSOPSB00804)。
4.3.7.2总混好的颗粒放入清洁干燥的中转桶内并密封,并在中转桶内外附桶卡,桶卡应注明品名、批号、规格、重量、操作者、复核者和操作日期。
4.3.7.3制粒、干燥、总混岗位生产结束后,认真填写岗位生产记录,按《胶囊剂、散剂、颗粒剂制粒干燥岗位清场程序》(JMSOPSC09002)和《胶囊剂、散剂、颗粒剂整粒总混岗位清场程序》(JMSOPSC09102)进行清场,由质监员检查合格后,发放《清场合格证》。更改各岗位生产状态标志及设备运行标志,并做好清场记录。
4.3.8胶囊填充
4.3.8.1 将总混好的颗粒由质监员及时向中间体化验室请验,测定颗粒的含量和水分,为囊重计算提供真实、准确、可靠的数据。
4.3.8.2 囊重计算:由车间技术人员根据中间体化验室提供的检验数据计算囊重,并有人复核。
4.3.8.3 全自动硬胶囊充填机:从中转站和原辅材料存放间领取合格颗粒和空心胶囊,分别置于充填机的料斗中,开车试机,控制真空度为-0.010 ~ -0.080Mpa,充填机速率为1100 ~1200粒/分钟,调节好囊重,而后正式运转。填充时装量差异控制在±8.0%之内,在充填过程中,每隔15分钟用天平称量一次,以保证其符合质量要求。检查过囊重颗粒需放入废料容器内另行处理。车间质监员应在充填过程的前、中、后抽查三次,每次抽查10粒检查外观和装量,结果应符合规定并记录。
填充好的胶囊经抛光机抛光后盛入放有内袋的洁净周转桶中,扎好袋口,内外附上桶卡,桶卡上应标明品名、规格、批号、重量、操作者、复核者和生产日期,交中转站贮存、
待验、备用。
4.3.9内包装:(印刷包材实样或备案复制品见附页,批号及有效期见印刷包材实样或备案复制品)
铝塑包装:从内包装材料存放间领取合格的内包装材料(铝箔、PVC等),并核对上道工序移交的半成品,确认无误后,开车试机正常后将内包材装于铝塑包装机上,把合格的胶囊置于饲料斗中,开始正式生产,生产过程中注意生产出的板塑应符合质量要求:封口严密无虚空,泡径均匀,板面花纹清晰,不歪斜,批号印字正确清晰,冲裁切割整齐。DPP-140D型铝塑机上成形温度:100℃±10℃,下成形温度:100℃±10℃,热合温度:150℃±10℃,冲切速度:20~30次/分钟;DPP-250型铝塑机下成形温度:100℃±10℃,下成形温度:100℃±10℃,热合温度:160℃±10℃,冲切速度:20~30次/分钟控制吸压缩空气压力0.5Mpa-0.9Mpa。生产出的半成品盛入洁净的周转桶中,附上桶卡,桶卡上应标明品名、批号、数量、操作者、复核者和日期后移交下道工序备用。
4.3.10外包装:(印刷包材实样或备案复制品见附页,批号及有效期见印刷包材实样或备案复制品)10.0万粒印刷外包材清单:
根据包装指令单,从外包装材料存放间领取合格的外包材,核对上道工序移交的半成品,确认无误后根据包装规格进行包装。包装出的成品应符合质量要求:外观整洁、印字清晰、数量准确。质量监督人员要随机抽检。每批生产结束后,请质监员填写请验
单送质量保证部申请检验,经检验合格后入库。做好生产记录。
4.4 工艺卫生和环境卫生:
4.4.1 常用清洁剂:洗洁精。
4.4.2 常用消毒剂:0.1%新洁尔灭、5%甲酚皂、75%乙醇。
4.4.3工艺卫生和环境卫生管理执行以下文件:
《胶囊剂、散剂、颗粒剂配料岗位清场程序》(JMSOPSC08902)
《胶囊剂、散剂、颗粒剂制粒干燥岗位清场程序》(JMSOPSC09002)《胶囊剂、散剂、颗粒剂整粒总混岗位清场程序》(JMSOPSC09102)《胶囊剂充填岗位清场程序》(JMSOPSC09202)
《胶囊剂内包装岗位清场程序》(JMSOPSC09302)
《制剂外包装岗位清场程序》(JMSOPSC08402)
《清场管理制度》(JMSMPWS01102)
《生产区域卫生管理制度》(JMSMPWS01302)
《洁净区工艺卫生管理制度》(JMSMPWS01002)
《生产区域卫生管理制度》(JMSMPWS01302)
《中间体化验室卫生管理制度》(JMSMPWS01402)
《洁净区更衣室管理制度》(JMSMPWS00902)
《洁净区清洁工具管理制度》(JMSMPWS01202)
《清洁工具清洁规程》(JMSOPWS01802)
《中转站清洁规程》(JMSOPWS00202)
《缓冲间清洁规程》(JMSOPWS00402)
《传递窗清洁消毒规程》(JMSOPWS00602)
《卫生间清洁规程》(JMSOPWS02802)
《地漏清洁消毒规程》(JMSOPWS00902)
《一般生产区清洁规程》(JMSOPWS02302)
《洁净区厂房清洁规程》(JMSOPWS01301)
《空气净化系统清洁规程》(JMSOPSB13002)
《进出微生物限度检测室更衣程序》(JMSOPWS01202)
《一般生产区容器具清洁规程》(JMSOPWS02402)
《洁净区容器具清洁规程》(JMSOPWS01402)
《洁净区设备清洁规程》(JMSOPWS01502)
《洁净区走廊、通道清洁消毒规程》(JMSOPWS01602)
《洁具存放间清洁规程》(JMSOPWS01702)
《洁具清洗间清洁规程》(JMSOPWS01902)
《容器具存放间清洁规程》(JMSOPWS02002)
《容器具清洗间清洁规程》(JMSOPWS02102)
《物料进入洁净区程序》(JMSOPWS02902)
4.5 本剂型工艺过程中所需要的操作规程名称:
4.5.1《胶囊剂、散剂、颗粒剂配料岗位操作规程》(JMSOPSC01602)。
4.5.2《胶囊剂、散剂、颗粒剂制粒干燥操作规程》(JMSOPSC01702)。
4.5.3《胶囊剂、散剂、颗粒剂整粒总混岗位操作规程》(JMSOPSC01802)。
4.5.4《胶囊剂填充岗位操作规程》(JMSOPSC01902)。
4.5.5《胶囊剂内包装岗位操作规程》(JMSOPSC02102)。
4.5.6《胶囊剂外包装岗位操作规程》(JMSOPSC02202)。
4.6 原辅材料、中间产品、成品的质量标准。
4.6.1原辅材料质量标准:
4.6.1.1对乙酰氨基酚:
4.6.1.2马来酸氯苯那敏:
4.6.1.3咖啡因:
4.6.1.4人工牛黄:
4.6.1.5玉米淀粉质量标准:
4.6.1.6硬脂酸镁质量标准:
4.6.2半成品质量标准
4.6.3成品质量标准:
4.7 中间产品的检查方法及控制:
中间产品的检查按《氨咖黄敏胶囊检验操作规程》执行。
4.7.1 颗粒
含量:
咖啡因:4.83%-5.7%
对乙酰氨基酚:83%-87%
水份:≤ 3%,用快速水份测定仪。
外观:颗粒应均匀,无异物,色泽一致。
4.7.2 填充:
4.7.2.1 填充过程中,要每15分钟称重一次,并记录。装量差异±8.0%。
4.7.2.2 在胶囊填充完成后,可先进行检验,合格后再生产。
4.7.3 包装要求、标签、说明书。
4.7.3.1 直接接触药品的包装材料必须经过批准后方可使用
4.7.3.2 标签说明书按品种规格专柜或专区存放,凭包装指令发放。
4.7.3.3 标签发放使用必须有记录。
4.7.3.4 包装要求:数量准确、标签端正、印字清晰、封口严密。
4.7.3.5 标签、说明书附后。
4.8 需要进行验证的关键工序。
4.8.1需要进行的验证的关键工序有:制粒干燥、整粒总混、胶囊填充、内包装。
4.9 原辅材料的消耗定额及物料平衡、技术经济指标的计算。
4.9.1 原辅材料的消耗定额。
4.9.1.1 原料:按照理论量允许损耗≤0.5%。
4.9.1.2 辅料:按处方量允许损耗≤0.8%,空心胶囊:允许损耗≤4%。
4.9.1.3 包装材料:复合袋允许损耗≤3%,PVC、铝箔允许损耗≤5%,说明书、标签允许损耗≤1%,纸盒、大袋、纸箱等无损耗。
4.9.1.4物料平衡范围98%-102%。
4.9.2物料平衡计算:
4.9.2.1物料平衡计算式:
总收入
×100%
总投入
总收入=成品(或投入下道工序中间产品量)+不合格品+回收粉+取样量+废品
4.9.3技术经济指标的计算:
4.9.3.1囊重(g)=
规格
颗粒含量(%)
4.9.3.2 收率(%)= 实际产量
×100% 理论产量
4.9.3.3 优级品率(%)优级品入库数量×100%
= 实际入库数量
4.9.3.4 损耗率= 投入量-产出量
×100% 投入量
4.9.3.5 人均劳动生产率(万粒/人月)=
月入库数
×100% 月实际参加人数
4.9.3.6 实际产量=理论产量×收率
4.10 技术安全及劳动保护:
4.10.1 技术安全:
4.10.1.1药品生产过程中不合格的中间产品应明确标示并不得留入下到工序,因特殊原因需处理使用时应按书面程序处理并记录。。
4.10.1.2在生产过程中,操作人员穿戴好工作衣帽、鞋、口罩和手套,不准用手直接接触原辅料,半成品,以免污染药品。。
4.10.1.3凡是装有筛网的设备生产结束时,检查筛网的完整性,通过断裂筛网的物料必须经过二次过筛粉碎
4.10.1.4在生产过程中每批产品留有标签,应注明:品名、批号、规格、生产日期、数量、重量、操作者等,以防混药、混批
4.10.1.5对有毒有害的药品操作时,要戴防毒面具、胶皮手套,扎紧袖口、裤脚,尽量不和皮肤接触。
4.10.1.6对易燃易爆岗位要严禁明火,并要在车间内设置防火设施。
4.10.1.7 各工序所有尾料、残料都作废料处理,不得再回收利用,包括撒落地面的原辅料。
4.10.2 劳动保护:
4.10.2.1 在搬运物料时应小心轻放,防止砸伤、摔伤、压伤等事故发生。
4.10.2.2 各岗位的电器设备要有良好的接地装置,机械运转部位要有保护装置,禁止在运转的设备上放置杂物和工具。
4.10.2.3 对有毒、有害、易燃易爆岗位要建立相应的防范措施,以防事故发生。
4.10.2.4 劳动保护用品一览表:
4.11 主要设备一览表:
4.12 劳动组织和岗位定员:
生产周期:5~7天。
4.13 附录(常见理化常数,计算公式等)
长度以米(m)表示
1 dm(分米)=1/10m, 1cm(厘米)=1/100m
1 mm(毫米)=1/1000m, 1 um(微米)=1/1,000,000m
容积以升(L)表示
1 ml=1/1,000L 1 ul=1/1,000,000L
重量以公斤(㎏)表示
1 g=1/1000kg, 1 mg=1/1,000,000kg
乙醇在没有指明浓度时均系指95%(ml/ml)。
4.14 附页:(供修改登记批准日期、文号和内容用)
1、产品概述 1.1产品名称:明胶空心硬胶囊。 1.2药品生产批准文号:国药准字F20020024号。 1.3性能:本品系由药用明胶加药用或食用要求的色素、防腐剂、遮光剂等赋形剂制作而成的呈圆筒状,由帽和体两节套合的质硬且具有弹性的空囊,具有不同颜色和锁口,囊体有光泽,色泽均匀,切口平整,无变形,无异臭,用于填充药物和保健食品。 1.4规格:00#、00# B型、0#、1#、2#、3#、4# 1.5品种:产品分为透明(两节均不含遮光剂)、不透明(两节均含遮光剂)、一节透明另一节不透明等三种。 1.6包装:内包装采用符合药用要求的防静电聚乙烯塑料袋包装材料,外包装采作瓦楞纸箱。 1.7运输:产品在运输过程中应防压、防晒、防潮、防热。不可与有毒物品或腐败变质物品混在一起装运。 1.8贮存:本产品必须密封,贮存在清洁、干燥、通风的仓库中,不得露天堆放,贮存条件为相对湿度35%~65%,温度为15~25℃。产品保质期为2年。 2、配方组成及组方原则 2.1配方组成 明胶1000克 胶囊囊壳角料适量 色素适量 球磨胶体钛白粉适量 十二烷基硫酸钠适量 防腐剂适量 水适量
2.2组方原则 2.2.1明胶应为药用或食用要求,可根据产品要求视明胶冻力、粘度等质量指标予以混配。 2.2.2胶囊囊壳角料视同原料明胶,原则上为原色泽配比且无污染的同质角料,在不影响产品质量情况下无限量要求,但不需另配其它赋形剂,如为无色全透明角料,则完全视同明胶添加所需赋形剂;如角料颜色赋形剂组成从属于所要配制的颜色,则添加赋形剂需计算后加入。 2.2.3色素是根据用户需求的颜色来决定添加色素的品种和数量。基本色素源有胭脂红、苋菜红、赤鲜红、柠檬黄、日落黄、亮兰、葡萄紫等,色素应符合食用要求,其添加量应不超过国家规定的相应品种的最高限量。 2.2.4钛白粉即为二氧化钛(TiO2),为遮光剂,应符合药用或食用要求,并达到规定晶型、细度和纯度质量标准,本配方组成中的钛白粉是经过一定工艺(球磨)加工处理后的一种混悬胶体。其添加量应不超过国家规定的最高限量。 2.2.5十二烷基硫酸钠为表面活性剂,有去污作用,应符合药用要求,其添加量应不超过国家规定的最高限量。 2.2.6防腐剂应符合药用或食用要求,其添加量应不超过国家规定的最高限量。 2.2.7水质应达到纯化水要求,本企业为二级反渗透所制得,其加入量是根据型号规格而定,一般情况下,00#产品使其胶液浓度达到26%±2,0#产品使其胶液浓度达到24%±2,1#产品使其胶液浓度达到22%±2,2#产品使其胶液浓度达到20%±2,3#产品使其胶液浓度达到19%±2,4#产品使其胶液浓度达到18%±2。另添加水量应根据不同厂家原料性质、烘干线特性作相应调整,使浓度偏离度较小且相对稳定,以方便醮胶前的调胶操作。 3、工艺流程及质量控制点
1 感冒药的分类 目前,治疗感冒的药物种类繁多,大体可分四类。 (1)抗过敏类:这类药物均含有马来酸氯苯那敏(扑尔敏)或苯海拉明成分,如氨咖黄敏胶囊、感康、泰诺感冒片、白加黑、快克、泰诺儿童感冒液、小儿速效感冒颗粒、感冒清片、感冒通片、VC银翘片、新康泰克胶囊。 (2)解热镇痛药类:如复方阿斯匹林(APC),对乙酰氨基酚(扑热息痛)、泰诺林(对乙酰氨基酚缓释片)、复方苯巴比妥注射液(安痛定)、柴胡注射液。 (3)抗病毒类:利巴韦林、阿昔洛韦、金刚烷胺。 (4)中成药:银翘解毒丸、桑菊感冒片、羚羊感冒片、抗感颗粒、清热解毒口服液(或胶囊)、正柴胡饮颗粒、银黄颗粒、板蓝根颗粒、双黄连口服液(或胶囊、片)、清开灵颗粒(或胶囊)、抗病毒口服液、莲花清瘟胶囊、藿香正气水(或胶囊)。 2 感冒药的分期运用 2.1 早期一般为起病的1~2天,此期大多有程度不同的过敏症状,症状见喷嚏、鼻塞、鼻流清涕、咽痒、鼻咽部不适,身冷,轻度恶寒或恶风。此期治疗原则重点是抗过敏,故应服用含有抗过敏药物的感冒药为主。 2.2 发作期起病后2~4天,症见发热、恶寒、体温升高;咽痛、头痛,全身关节或肌肉酸痛;轻度咳嗽、咯出白痰。此时过敏症状已有减轻,若继续服用抗过敏类药,效果欠佳。故应及时改服解热镇痛类感冒药,或加服抗病毒药和抗感冒中成药。 2.3 感染期若发作期症状不能控制则易发生上呼吸道炎症如:咽炎、喉炎、扁桃体炎及支气管炎等呼吸系统疾病。此期除对症治疗外,还应使用抗生素或抗病毒药物治疗。另外,若除感冒症状外,还有恶心、呕吐、食欲不振、轻度腹泻(除外各型痢疾)者,属胃肠型感冒,可加服藿香正气水(或丸、胶囊)。若感冒迁延月余不愈,仍有喷嚏、流涕、鼻塞者、属鼻炎型感冒(已确诊的各型鼻炎不属此例),宜加服治鼻炎的药物,如鼻炎康、鼻渊舒等。若年老体弱乏力,汗出畏风者,属体虚感冒,可酌加补中益气丸。若症状不典型而诸症悉具者,应作系统检查,以防它变。流行性感冒一般症状重,并发感染多,严重的可造成死亡。治疗流行性感冒则以清热解毒、抗病毒、抗感染为主。 3 体会 (1)应用抗过敏类感冒药,宜早不宜迟。用药时间要短,一般不超过2天。抗过敏类感冒药中所含扑尔敏、苯海拉明,属抗组织胺类药。抗组织胺药能阻断组织胺的释放过程,从而有助于缓解或消除由于组织胺释放所引起的打喷嚏、流清鼻涕或咯吐白稀痰等过敏症状。所以应尽早地在感冒初期应用抗过敏类感冒药,最好在发病的1~2天甚或几小时内应用。至中晚期时,由于病毒在体内大量繁殖及其代谢物毒素的作用,产生了全身症状,仅靠抗过敏类感冒药的药力已不能控制,若继续应用便会延误治疗时机。故中晚期应该改用后三
净石灵胶囊工艺规程 目录: 1、产品名称及剂型 2、产品概述 3、处方和依据 4、生产工艺流程图 5、原料药材的整理炮制 6、制剂操作过程和工艺条件 7、质量监控 8、原辅料质量标准和检查方法及复检前、最长储存期 9、半成品质量标准、成品法定标准、企业内控标准及依据 10、包装材料质量标准、检验方法及内包材包装前的最长使用时间 11、工艺卫生要求 12、关键设备的准备工作 13、各设备标准操作程序及生产能力 14、技术安全及劳动保护 15、劳动组织、岗位定员、工时定额、产品生产周期 16、原辅料消耗定额 17、包装材料消耗定额 18、动力消耗定额 19、物料平衡
20、综合利用和环境保护 21、附页 1、产品名称及剂型 1.1产品名称:净石灵胶囊 1.2汉语拼音:Jingshiling Jiaonang 1.3剂型:胶囊剂 1.4批准文号:ZZ-5832-吉卫药准字(1998)第4236号 2、产品概述 2.1性状:本品为胶囊剂,内容物为棕色粉末,气微,味微苦。 2.2功能主治:补肾、利尿、排石。用于治疗肾结石、输尿管结石、膀胱结石以及由结石引起的肾盂积水、尿路感染等。 2.3用法用量:口服,一次5粒,一日3次,饭后1小时饮水300~500ml,并做跳跃运动10~15次,体弱者酌减。每次排尿注意结石排出情况。 2.4规格:0.3g 2.5有效期:三年 2.6贮藏:密封,防潮。 3、处方和依据
3.1工艺处方: 金钱草(广)250g 黄芪76.6g 茯苓76.6g 萹蓄76.6g 海金沙76.6g 淫羊藿76.6g 夏枯草76.6g 滑石76.6g 元胡(醋制)50g 当归50g 巴戟天50g 赤芍40g 冬葵子40g 车前子40g 桃仁40g 鸡内金40g 甘草25g 制成1000粒3.2生产处方: 金钱草(广)250kg 黄芪76.6kg 茯苓76.6kg 萹蓄76.6kg 海金沙76.6kg 淫羊藿76.6kg 夏枯草76.6kg 滑石76.6kg 元胡(醋制)50kg 当归50kg 巴戟天50kg 赤芍40kg 冬葵子40kg 车前子40kg 桃仁40kg 鸡内金40kg 甘草25kg 制成100万粒 3.3处方依据:《中华人民共和国卫生部药品标准》(中药)第20册。 4、生产工艺流程图:
XX胶囊工艺规程 1引言: 制订本标准的目的是规范XX胶囊生产全过程,对生产一定数量的成品所需的起始原料和包装材料的数量,以及工艺、加工说明、注意事项进一步标准化。 2、依据: 《保健食品良好生产管理规范》 3、适用范围:本标准适用于海克胶囊生产的全过程。 4、责任:生产技术部、品质管理部以及工艺规程起草人员对本标准的实施负责。 5、程序: 5.1产品概述: 本品是以XX钙、维生素D3、XX、XX盐酸盐、淀粉、硬脂酸镁为主 要原料制成的保健食品,经动物功能试验证明,具有增加骨密度的保健功能。 【主要原料】XX钙、维生素D3、XX、XX盐酸盐、淀粉、硬脂酸镁 【功效成分/标志性成分及含量】每100g含:钙22g、维生素D3l90ug X X盐酸盐11g、XX盐酸盐盐酸盐27g 【保健功能】增加骨密度 【适宜人群】中老年人 【食用方法及食用量】每日2次,每次3粒 【规格】0.45g/粒 【保质期】24个月 【贮藏方法】室温,阴凉干燥处保存 5.2 配方 原辅料称量配料配比:以每批10万粒计 5.3 XX胶囊批号的划分原则:
固体制剂在成型或分装前使用同一台混合设备一次混合量所生产的均质产品 为一批。 XX 胶囊的批号确定原则为:使用二维运动混合机总混的一批料为一个 批号的产品。 5.4生产工艺流程和主要控制要点: 5.5 操作过程及工艺条件 5.5.1 生产工艺 5.5.1.1原辅料领料:称量岗位操作工依据《生产指令》,经小组负责人审核批准后 从库房领取原辅料。清洁脱去外包装,放置缓冲间,移至物料暂存间。 5.5.1.2物料预处理 5.5.1.2.1 生产前准备: 1) 检查工作场所:确认无前次生产遗留物,卫生清洁,温度、湿度等环境符 合要求。 2) 电子台秤:反应灵敏,回零、计量准确。 3) 复核原辅料:品名无误、批号(编号)与检验报告单一致,质量合格。 5.5.1.2.2 操作: 1) 按电子台秤操规程,准确秤量各物料重量。 2) 过筛:将原辅料分别按工艺要求细度过振荡筛,操作按《振荡筛操作规程》 操作,将上述物料过筛。 3)过筛好的物料应袋入双层塑料袋中,扎紧后转入周转桶内,挂物料卡,转称 量配料工序。 [80目 80目 检验(装量 差异) "检验(含 、量) X 钙、维生 素D3 XX 脂酸镁 外包 淀粉、硬 筛粉 80目 打印生产 成品 为10万级
家庭用药课程论文 感 冒 成 因 及 感 冒 药 成 分 分 析
与 选 择 姓名:XXX 班级:XXX 学号:XXX
感冒成因及感冒药成分分析与选择 作者 【摘要】:本文分别介绍了感冒的原因、感冒药不同成分的药理机制以及毒理作用,如何选择感冒药等相关内容。第一部分,分别介绍了普通感冒与流行性感冒,以及它们的区别,普通感冒发生的原因。第二部分,按功能将感冒药中常用的成分分别做了毒理及药理介绍,帮助大家了解这些成分的作用。第三部分,简单介绍了感冒药选择的相关知识,及感冒药的选择原则。 关键词:普通感冒;流感;抗病毒;抗过敏;感冒药;解热镇痛 引言 感冒是一种常见的呼吸系统疾病,日常的家庭生活中最常见的疾病就是感冒。那么感冒是由什么原因的引起的,是否必须服用感冒药,应该如何选择合适的感冒药,是我们日常家庭用药时需要注意的问题。如果用药不当,不但起不到什么效果,反而有可能加重病情。因此,我们需要了解引起感冒的原因以及不同感冒药的作用机理,对症下药,减少药物副作用对身体的伤害,避免抗生素滥用等问题,本文就着重探讨一下感冒的不同原因及对应感冒药的作用机制及其选择,为家庭中合理使用感冒药提供参考。 1.感冒的分类及其诱因 1.1普通感冒 普通感冒是最为常见的感冒类型,生活中我们大部分人的感冒都属于普通感冒。 普通感冒又被称为上呼吸道感染,包括鼻腔、咽喉、扁桃体、支气管等炎症诱发的 一系列不适身体反应。 1.1.1原因及症状 普通感冒由于其形成原因的不同可分为病毒性感冒、细菌感染,中医理论将感冒分为风寒感冒、风热感冒、暑湿感冒以及时节型感冒。感冒的原因随季节、病人年龄、流行病环境及其他因素的不同而不同[1],但其根本原因也是由于外部环境因素造成体内细菌病毒繁殖,自身免疫力下降,引起上呼吸道系统感染,造成流涕、鼻塞、发热、咳嗽等症状的疾病。即我们通常所说的感冒。 1.1.2病毒性感冒及其发病机理 诱发感冒的病毒多数属于粘液病毒、副枯液病毒、腺病毒、冠病毒及微小RNA病毒类。在所有这些病毒群中鼻病毒最重要,占所有成人感冒总数的30~50%[1]。然而引发感冒症状的
净石灵胶囊工艺规程 目录: 1、产品名称及剂型 2、产品概述 3、处方和依据 4、生产工艺流程图 5、原料药材的整理炮制 6、制剂操作过程和工艺条件 7、质量监控 8、原辅料质量标准和检查方法及复检前、最长储存期 9、半成品质量标准、成品法定标准、企业内控标准及依据 10、包装材料质量标准、检验方法及内包材包装前的最长使用时间 11、工艺卫生要求 12、关键设备的准备工作 13、各设备标准操作程序及生产能力 14、技术安全及劳动保护 15、劳动组织、岗位定员、工时定额、产品生产周期 16、原辅料消耗定额 17、包装材料消耗定额 18、动力消耗定额
19、物料平衡 20、综合利用和环境保护 21、附页 1、产品名称及剂型 1.1产品名称: 净石灵胶囊 1.2汉语拼音: Jingshiling Jiaonang 1.3剂型: 胶囊剂 1.4批准文号: ZZ-5832-吉卫药准字( 1998) 第4236号 2、产品概述 2.1性状: 本品为胶囊剂, 内容物为棕色粉末, 气微, 味微苦。 2.2功能主治: 补肾、利尿、排石。用于治疗肾结石、输尿管结石、膀胱结石以及由结石引起的肾盂积水、尿路感染等。 2.3用法用量: 口服, 一次5粒, 一日3次, 饭后1小时饮水300~500ml, 并做跳跃运动10~15次, 体弱者酌减。每次排尿注意结石排出情况。 2.4规格: 0.3g 2.5有效期: 三年
2.6贮藏: 密封, 防潮。 3、处方和依据 3.1工艺处方: 金钱草( 广) 250g 黄芪76.6g 茯苓76.6g 萹蓄76.6g 海金沙76.6g 淫羊藿76.6g 夏枯草76.6g 滑石76.6g 元胡( 醋制) 50g 当归50g 巴戟天50g 赤芍40g 冬葵子40g 车前子40g 桃仁40g 鸡内金40g 甘草25g 制成1000粒 3.2生产处方: 金钱草( 广) 250kg 黄芪76.6kg 茯苓76.6kg 萹蓄76.6kg 海金沙76.6kg 淫羊藿76.6kg 夏枯草76.6kg 滑石76.6kg 元胡( 醋制) 50kg 当归50kg 巴戟天50kg 赤芍40kg 冬葵子40kg 车前子40kg 桃仁40kg 鸡内金40kg 甘草25kg 制成100万粒 3.3处方依据: 《中华人民共和国卫生部药品标准》( 中药) 第20册。 4、生产工艺流程图:
1、目的:建立氨咖黄敏胶囊工艺规程,作为全面指导生产和控制质量的基准性技术文件。 2、适用范围:适用于氨咖黄敏胶囊生产。 3、责任者:车间管理人员、质量监督员、操作人员。 4、内容: 4.1产品概述: 4.1.1 名称: 通用名:氨咖黄敏胶囊 英文名:Paracetamol,Caffein,Atificial cow-bezoar And Chlorphenamine Maleate Capsules 4.1.2产品代码:C025 4.1.3剂型:胶囊剂。 4.1.4性状:本品为胶囊剂,其内容物为着色颗粒和粉末。 4.1.5规格:本品为复方制剂,每粒含对乙酰氨基酚250mg、咖啡因15mg、马来酸氯苯那敏 1mg,人工牛黄10mg。 4.1.6批量:150.0万粒 4.1.7适应症:适用于缓解普通感冒及流行性感冒引起的发热、头痛、四肢酸痛、打喷嚏、流鼻涕、鼻塞、咽痛等症状。 4.1.8用法用量:口服。成人:一次1-2粒,一日3次。 4.1.9贮藏:密封,在阴凉干燥处保存。 4.1.10有效期:2年。 4.1.11包装:材质:铝箔、PVC包装: 10粒/板×50板/盒×60盒; 12粒/板×1板/盒×400盒; 12粒/板×2板/盒×400盒;
4.1.12申报批准文号的沿革: 首次86年12月27日批准,文号为皖卫药准字(86)348号;96年10月21日省卫生厅变更文号为皖卫药准字(1996)第102094;2001年8月6日省药监局统一变更文号为皖药准字(2001)第X004528号;2003年国家食品药品监督管理局统一换发文号为国药准字H34022182。 4.1.13 执行标准:国家药品标准WS-10001-(HD-0276)-2002-2006 4.1.14处方:配料处方(150.0万粒) 注:所投原料折算: 对乙酰氨基酚: 150.0万片×0.25g ÷1000÷对乙酰氨基酚原料干品百分含量 =所投对乙酰氨基酚原料量(kg ) 咖啡因: 150.0万片×0.15g ÷1000÷咖啡因原料干品百分含量 =所投咖啡因原料量(kg ) 4.2 生产工艺流程图及生产工艺示意图: 4.2.1生产工艺流程图: 检验
天龙胶丸GMP管理文件 1产品概述 1.1产品名称:明胶空心硬胶囊。 1.2药品生产批准文号:国药准字F20020024号。 1.3性能:本品系由药用明胶加药用或食用要求的色素、防腐剂、遮光剂等赋形剂制作 而成的呈圆筒状,由帽和体两节套合的质硬且具有弹性的空囊,具有不同颜色和锁口,囊体有光泽,色泽均匀,切口平整,无变形,无异臭,用于填充药物和保健食品。 1.4 规格:00#、00# B 型、0#、1#、2#、3#、4# 1.5品种:产品分为透明(两节均不含遮光剂)、不透明(两节均含遮光剂)、一节透明另一节不透明等三种。 1.6包装:内包装采用符合药用要求的防静电聚乙烯塑料袋包装材料,外包装采作瓦楞纸箱。 1.7运输:产品在运输过程中应防压、防晒、防潮、防热。不可与有毒物品或腐败变质物品混在一起装运。 1.8贮存:本产品必须密封,贮存在清洁、干燥、通风的仓库中,不得露天堆放,贮存 条件为相对湿度35%~65%,温度为15~25C。产品保质期为2年。 2、配方组成及组方原则 2.1配方组成 明胶1000克 胶囊囊壳角料适量 色素适量 球磨胶体钛白粉适量 十二烷基硫酸钠适量 防腐剂适量 水适量
2.2.1明胶应为药用或食用要求,可根据产品要求视明胶冻力、粘度等质量指标予以混 配。 2.2.2胶囊囊壳角料视同原料明胶,原则上为原色泽配比且无污染的同质角料,在不影响产品质量情况下无限量要求,但不需另配其它赋形剂,如为无色全透明角料,则完全视同明胶添加所需赋形剂;如角料颜色赋形剂组成从属于所要配制的颜色,则添加赋形剂需计算后加入。 2.2.3色素是根据用户需求的颜色来决定添加色素的品种和数量。基本色素源有胭脂红、苋菜红、赤鲜红、柠檬黄、日落黄、亮兰、葡萄紫等,色素应符合食用要求,其添加量应不超过国家规定的相应品种的最高限量。 2.2.4钛白粉即为二氧化钛(TiO2),为遮光剂,应符合药用或食用要求,并达到规定晶型、细度和纯度质量标准,本配方组成中的钛白粉是经过一定工艺(球磨)加工处理后的一种混悬胶体。其添加量应不超过国家规定的最高限量。 2.2.5十二烷基硫酸钠为表面活性剂,有去污作用,应符合药用要求,其添加量应不超过国家规定的最高限量。 2.2.6防腐剂应符合药用或食用要求,其添加量应不超过国家规定的最高限量。 2.2.7水质应达到纯化水要求,本企业为二级反渗透所制得,其加入量是根据型号规格而定,一般情况下,00#产品使其胶液浓度达到26%±2, 0#产品使其胶液浓度达到24%±2, 1#产品使其胶液浓度达到22%±2, 2#产品使其胶液浓度达到20%±2, 3#产品使其胶液浓度达到19% 土2,4#产品使其胶液浓度达到18%土2。另添加水量应根据不同厂家原料性质、 烘干线特性作相应调整,使浓度偏离度较小且相对稳定,以方便醮胶前的调胶操作。 3、工艺流程及质量控制点
文件编号:DS-P04-001 版号:A/0 氨咖黄敏胶囊工艺 验证方案 起草人起草日期 审核人审核日期 批准人批准日期 生效日期 药业股份有限公司
氨咖黄敏胶囊工艺验证方案 验证方案组织与实施 该工艺验证工作生产部负责组织,质检部、动力设备部、生产车间有关人员参与实施。验证小组成员 组长:刘伟副组长:于桂莉
目录1验证的目的和范围 2工艺验证小组成员及职责划分 3有关背景材料 3.1产品概况 3.2背景 3.3 生产工艺 3.4 主要生产设备 3.5 饮用水、纯化水 3.6 生产环境 3.7 与本验证方案相关文件及规程 4工艺验证 4.1原辅料处理 4.1.1目的 4.1.2操作方法 4.1.3中间控制标准 4.1.4收集验证资料 4.1.5小结 4.2 混合制粒 4.2.1 目的 4.2.2 操作方法 4.2.3 中间控制标准 4.2.4 收集验证资料 4.2.5 小结 4.3批混 4.3.1 目的 4.3.2 操作方法 4.3.3 中间控制标准
4.3.4 收集验证资料 4.3.5 小结 4.4胶囊充填 4.4.1目的 4.4.2 操作方法 4.4.3 中间控制标准 4.4.4 收集验证资料 4.4.5 小结 4.5铝塑包装 4.5.1目的 4.5.2 操作方法 4.5.3 中间控制标准 4.5.4 收集验证资料 4.5.5 小结 4.6外包装 4.6.1目的 4.6.2 操作方法 4.6.3 中间控制标准 4.6.4 收集验证资料 4.6.5 小结 5氨咖黄敏胶囊成品质量检查及成品率6包装材料的物料平衡 7验证批次 8验证周期 9验证结果收集及整理 10验证结果评定与结论 11附件
常用药品禁忌大全 1、阿奇霉素心脏病患者慎用。 2、甲硝唑哺乳期妇女、妊娠3个月内的孕妇、有中枢神经系统病变和血病患者禁用。 3、阿司匹林: (1)妊娠期、哺乳期妇女禁用。 (2)哮喘、鼻息肉综合症,对阿司匹林及对其他解热镇痛药过敏者禁用。 (3)血友病或血小板减少症,溃疡病活动期的患者禁用 (4)痛风、肝肾功能减退、心功能不全、鼻出血、月经过多等患者,以及有溶血性贫血史者禁用。 4、氨咖黄敏胶囊消化道溃疡患者禁用。 5、消炎痛片胃与十二指肠溃疡患者忌用。 6、双氯灭痛肠溶衣片对阿司匹林或其它非甾体抗炎药引起的哮喘、荨麻疹或其他变态反应的患者禁用。 7、双氯芬酸钠片胃与十二指肠溃疡患者忌用。 8、腰痛宁胶囊 (1)孕妇小儿及心脏病患者禁服。 (2)脑溢血后遗症及脑血栓形成的后遗症偏瘫患者试服时遵医嘱。 (3)癫痫患者忌服。 9、盐酸苯海索片青光眼、尿潴留、前列腺肥大患者禁用。 10、维生素AD滴剂(胶囊型) 慢性肾功能衰竭、高钙血症、高磷血症伴肾性佝偻病者禁用。
11、参一胶囊有出血倾向者忌用。 12、(富露施)乙酰半胱氨酸颗粒剂患有支气管哮喘的病人禁用。 13、甲巯咪唑片(他巴唑片) 结节性甲状腺肿伴甲状腺功能亢进者,甲状腺癌及哺乳期妇女禁用。 14、盐酸塞庚啶片青光眼、尿潴留、幽门梗阻、前列腺肥大忌用。 15、葡萄糖酸钙注射液应用强心甙期间禁用。 16、科恒滴眼液霉菌性角膜溃疡,树枝状、地图状角膜炎禁用。 17、润洁滴眼露(蓝) 青光眼或眼部有剧痛感者禁用。 18、(意可贴)醋酸地塞米松粘贴片严重活动性结核病胃或十二指肠溃疡,早期妊娠,角膜溃疡,严重心或肾功能不全者均禁用。 19、人工牛黄甲硝唑: (1)三个月以内孕妇忌用。 (2)禁酒,有器质性中枢神经系统疾病和血液病患者禁用。 20、强力痔根断完全性机械性肠梗阻、绞窄性肠梗阻、脱肛患者及孕妇忌服。 21、净石灵胶囊双肾结石,直径超过37.5px或结石嵌顿时间很长者忌服。 22、前列泰片过敏体质(尤其是花粉过敏者)禁用。 23、酚酞片: (1)充血性心力衰竭、高血压、粪块阻塞、肠梗阻禁用 (2)哺乳期妇女和婴儿禁用。 24、氨基酸螯合钙胶囊肾功能不全或血钙过高者禁用。洋地黄化的病人禁用。 25、多抗甲素片风湿性心脏病患者禁用、支气管哮喘和支气管炎患者禁用。 26、颠茄片青光眼患者忌服。
目的:制订盐酸雷尼替丁胶囊生产工艺规程,以提供生产车间组织生产和进行生产操作的依据。 适用范围:盐酸雷尼替丁胶囊的生产。 责任:生产车间按该工艺规程组织生产和按该规程编制标准操作程序,生产部、质管部负责监督该规程的实施。 内容: 目录 1.品名 2.剂型 3.产品概述 4.处方 5.生产工艺流程 6.生产工艺操作要求及工艺技术参数 7.生产过程的质量控制 8.物料、中间产品、成品的质量标准 9.成品容器、包装材料要求,贮存条件 10.标签、使用说明书的内容 11.设备一览表及主要设备生产能力(包括仪表) 12.技术安全、工艺卫生及劳动保护 13.物料消耗定额 14.物料平衡计算公式及其正常范围值 15.技术经济指标及其计算方法 16.劳动组织与岗位定员 17.操作工时与生产周期 18.附录
1.品名 通用名称:盐酸雷尼替丁胶囊 汉语拼音:Yansuan Leinitiding Jiaonang 英文名称:Ranitidine Hydrochloride Capsules 2.剂型 硬胶囊剂。 3.产品概述 盐酸雷尼替丁胶囊的规格为0.15g,于1985年正式批准在我厂生产,批准文号为&卫药准字(1996)第****号。 受体阻滞药,主要用于治疗十二指肠溃疡、良性胃溃疡、术后溃疡、本品为组胺H 2 反流性食管炎等。 本品原料极易潮解,所以严格控制生产环境的湿度是生产过程质量控制的一个重点。 4.处方 以原料含量为98.0%计算,生产29.27万粒的生产处方是(单位:kg): 原辅料名称规格用量备注 盐酸雷尼替丁97—103% 50.0 原料 滑石粉药用17.0 内加辅料 磷酸氢钙药用19.0 内加辅料 75%酒精药用7.0 润湿剂 二氧化硅药用0.925 外加润滑剂 5.生产工艺流程
目的:建立氨咖黄敏胶囊的生产工艺规程。 范围:氨咖黄敏胶囊的生产。 职责:生产管理部经理、质量管理部经理、车间主任、工艺员、班长、操作工、QA。 规程: 1.品名、剂型与处方依据 1.1通用名称:氨咖黄敏胶囊 汉语拼音:An Ka Huang Min Jiaonang 英文名:Paracetamol ,Caffein ,Atificial Cow-bezoar and chlorphenamine Maleate Capsules 1.2剂型:胶囊剂 1.3处方与处方依据项的说明 1.3.1处方(共制成40万粒) 对乙酰氨基酚 102.4kg 马来酸氯苯那敏 0.4kg 咖啡因 6kg 人工牛黄 4kg 硫脲 99.2g 氢氧化铝 2.4kg 滑石粉 2.4kg 蔗糖 32.5kg 淀粉 35.9kg 胭脂红 48g 柠檬黄 36g
亚甲基蓝 2.8g 40%单糖浆 2kg (相当于蔗糖 8kg ) 15%淀粉浆 1.6kg (相当于干淀粉2.4kg ) 5%淀粉浆 25kg (相当于干淀粉12.5kg ) 75%乙醇 78ml 1.3.2 处方依据项说明: 药品的生产批文: 批准时间: 质量标准编号: 2. 生产工艺流程: ← ← ↓ → ↓ ← ↓ ↓ → ↓ ← → ← → ← → 一般生产区 三十万级生产区
3.生产工艺操作与工艺技术参数中关键的注意事项: 3.1操作过程与生产过程质量控制 3.1.1配料工序: ●色粉的制备:以生产生400万粒计算,按下述比例称量物料,色素溶于温水中,加入淀 粉混和,以75%乙醇作润湿剂,软材过12目尼龙筛制粒,置75℃烘箱干燥4小时,干粉过100目筛网备用。 ●按S原辅料处理岗位标准操作规程要求对原辅料分别进行前处理:准确计算、称量色粉 用量及各色小丸原辅料,分别按白色丸:红色丸:黄色丸:绿色丸为3:1:1:1的投产比例混合均匀,粉碎,过筛(100目筛)处理。 ●按总混岗位操作规程要求将各色细粉置三维混合机中,按三维混合机标准操作规程干混 10分钟,装桶称量交中间站。 ●按S粘合剂配制岗位标准操作规程制备粘合剂粘合剂(15%淀粉浆):以生产40万粒计 算,取淀粉240g,先用250g纯化水将淀粉搅拌成混悬液,再加入煮沸的纯化水用冲浆法冲至160g,搅拌均匀,置冷即得。 ●色糖浆的制备:以生产40万粒计算,按下述比例称量物料,将色素分别溶解于80℃纯 化水中,倒入配制好的40%单糖浆糖浆中,搅拌均匀,即得。 ●将处理好的主药、淀粉准确称量,按湿法制粒岗位标准操作规程,以总重的1/20量(约
验证报告编号:2305·429-00 ×××酯工艺验证报告 起草人:日期:年月日 审核人:日期:年月日 批准人:日期:年月日 ×××生物化学药业有限公司
1 概述 在2007年7月10日~9月23日,依据《×××酯类工艺验证方案》(验证方案号:1305·429-00),对三批×××酯类的制品生产过程实施了工艺验证,验证工序有中间体I制备、中间体Ⅱ制备、中间体Ⅲ制备、中间体Ⅳ制备、中间体Ⅳ制备、粗品制备、精制(层析分离)、、精制(蒸发干燥)、混合分装和外包装。对关键工序的关键项目及参数进行了验证考察确认,验证确认结果如下: 1.1 验证规程号 《×××酯工艺验证方案》(1305·429-00) 1.2 验证产品批号与批量: 1.3 验证工艺流程图(见附件1) 1.4 验证主要原辅材料(见附件2) 1.5 验证主要生产设备(见附件3) 1.6 验证生产质量控制点(见附件4)
2 工序验证结果及数据分析
3 偏差分析和评价建议 ×××酯生产工艺的每道工序,完整地进行了三个连续批次的验证,在验证过程中未发现偏差情况,结果均在允许的可接收标准范围内。为保证验证状态能得到维持,在正常生产过程中,严格按照经验证工艺控制方法、批量、设备、材料进行生产。当生产设备、批量、关键原辅料、工艺方法发生变更时,应及时进行再验证。 4 验证总结论: 经过正常生产规模的连续三批产品工艺验证,结果符合验证标准,可以投入生产使用。 5 再验证周期: 再验证周期为一年半。
6 附件清单: 附件1 验证工艺流程图 附件2 验证主要原辅材料 附件3 验证主要生产设备 附件4 验证生产质量控制点
目的:制订诺氟沙星胶囊生产工艺规程,以提供生产车间组织生产和进行生产操作的依据。 适用围:诺氟沙星胶囊的生产。 责任:生产车间按该工艺规程组织生产和按该规程编制标准操作程序,生产部、质管部负责监督该规程的实施。 容: 目录 1.品名 2.剂型 3.产品概述 4.处方 5.生产工艺流程 6.生产工艺操作要求及工艺技术参数 7.生产过程的质量控制 8.物料、中间产品、成品的质量标准 9.成品容器、包装材料要求,贮存条件 10.标签、使用说明书的容 11.设备一览表及主要设备生产能力(包括仪表) 12.技术安全、工艺卫生及劳动保护 13.物料消耗定额 14.物料平衡计算公式 15.技术经济指标及其计算方法 16.劳动组织与岗位定员 17.操作工时与生产周期 18. 附录
1.品名 通用名称:诺氟沙星胶囊 汉语拼音:Nuofushaxing Jiaonang 英文名称:Norfloxacin Capsules 2.剂型 硬胶囊剂。 3.产品概述 本品为抗菌药;规格为0.1g,于1988年正式批准在我厂生产,批准文号为&卫药准字(1996)第&&&&&号。 本品为抗菌药原料类白色至淡黄色结晶性粉末;无臭,味微苦;在空气中能吸收水分,遇光色渐变深;生产过程注意防潮及避光。 4.处方 以原料含量为99.5%计算,生产19.9万粒的生产处方是(单位:kg): 原料:诺氟沙星20.0 加辅料:淀粉22.4 微晶纤维素10.0 粘合剂:15%预胶化淀粉浆24.8 外加辅料:羧甲淀粉钠 1.68 硬脂酸镁0.32 5.生产工艺流程 用示意图描述如下:
6.生产工艺要求及工艺技术参数 6.1原辅料过筛 6.1.1原料粉碎过140目筛,过筛后外观检查无异物。 6.1.2加辅料淀粉、微晶纤维素过100目筛,外加辅料羧甲淀粉钠过100目筛,硬脂酸镁过60目筛,外观检查无异物。 6.2加辅料与原料的混合:用高速混合制粒机混合,混合时间为180秒。 6.3加入粘合剂的混合要求:加入粘合剂后,混合制粒60秒。 6.4制粒:粒度应细小均匀,外观检查无异物。 6.5干燥 6.5.1采用GFG-500高效沸腾干燥机干燥。 6.5.2干燥过程最高温度不能超过55℃。 6.5.3颗粒水分须低于9.0%。 6.6整粒 6.6.1用快速整粒机整粒,20目筛。 6.6.2整粒过程,操作间相对湿度必须低于60%。 6.7总混 6.7.1采用三维混合机混合,总混时间为20分钟。 6.7.2总混过程,操作间相对湿度不能低于60%。 6.8填充 6.8.1采用全自动胶囊填充机填充。 6.8.2填充过程,必须控制操作间相对湿度保持在60%以下。 6.8.3用2#蓝白胶囊填充。 6.9铝塑包装 6.9.1操作间相对湿度必须低于60%。
氨咖黄敏胶囊说明书 请仔细阅读说明书并按说明使用或在药师指导下购买和使用 严重肝肾功能不全者禁用 【药品名称】 通用名称:氨咖黄敏胶囊 英文名称:Paracetamol,Caffein,Atific ial Cow-bezoar and chlorphenamine Maleate capsules 汉语拼音:Ankahuangmin Jiaonang 【成份】本品为复方制剂,每粒含对乙酰氨基酚250毫克,咖啡因15毫克,马来酸氯苯那敏1毫克,人工牛黄10毫克。辅料为:淀粉。 【性状】本品为硬胶囊剂,内容物为着色混合颗粒;味苦。 【作用类别】本品为感冒用药类非处方药药品。 【适应症】适用于缓解普通感冒及流行性感冒引起的发热、头痛、四肢酸痛、打喷嚏、流鼻涕、鼻塞、咽痛等症状。 【规格】复方。 【用法用量】口服。成人,一次1~2粒,一日3次。 【不良反应】有时有轻度头晕、乏力、恶心、上腹不适、口干、食欲缺乏和皮疹等,可自行恢复。 【禁忌】严重肝肾功能不全者禁用。 【注意事项】 1.用药3-7天,症状未缓解,请咨询医师或药师。 2.服用本品期间不得饮酒或含有酒精的饮料。 3.不能同时服用与本品成份相似的其他抗感冒药。 4.前列腺肥大、青光眼等患者以及老年人应在医师指导下使用。 5.肝、肾功能不全者慎用。 6.孕妇及哺乳期妇女慎用。 7.服药期间不得驾驶机、车、船、从事高空作业、机械作业及操作精密仪器。 8.如服用过量或出现严重不良反应,应立即就医。 9.对本品过敏者禁用,过敏体质者慎用。 10.本品性状发生改变时禁止使用。 11.请将本品放在儿童不能接触的地方。 12.儿童必须在成人监护下使用。 13.如正在使用其他药品,使用本品前请咨询医师或药师。 【药物相互作用】 1.与其他解热镇痛药同用,可增加肾毒性的危险。 2.本品不宜与氯霉素、巴比妥类(如苯巴比妥)等并用。 3.如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。 【药理作用】本品中对乙酰氨基酚能抑制前列腺素合成,有解热镇痛作用;咖啡因为中枢兴奋药,能增强对乙酰氨基酚的解热镇痛效果,并减轻其他药物所致的嗜睡、头晕等中枢抑制作用;马来酸氯苯那敏为抗组胺药,能减轻流涕、鼻塞、打喷嚏症状;人工牛黄具有解热、镇惊作用。 【贮藏】密封,在阴凉干燥处保存(不超过20℃)。 【包装】药品包装用PTP铝箔、药用PVC硬片,12粒×1板/盒;12粒×50板/盒。【有效期】暂定24个月。 【执行标准】HD-0276 【批准文号】国药准字H22024962 【说明书修订日期】 【生产企业】
40种药店最常见疾病用药大全 药店对于常见疾病相关知识的把握必须全面而准确,这是赢得顾客信任、提高业绩的关键。以下10大类,共40种疾病的一般用药及联合用药知识,有了这些,药店人在日常工作中将变得更加信心满满、应对自如,销售业绩将不再是压力! 降血压药 降血压用药原则 1、利尿剂:呋噻米、氢氯噻嗪(珍菊降压片、罗己降压片、复方罗布麻) 适用:心衰。 禁用:糖尿病、痛风。 2、β受体阻滞剂:酒石酸美托洛尔,康忻 适用:心绞痛、心率快。 禁用:心动过缓、哮喘。 3、钙离子拮抗剂:硝苯地平、氨氯地平、拉西地平 适用:高血压伴稳定型心绞痛。 禁用:偏头痛。 4、血管紧张素转换酶抑制剂:卡托普利、依那普利、赖诺普利 适用:心衰、心梗、糖尿病。 禁用:老慢气、干咳患者,肾动脉狭窄者。 5、血管紧张素Ⅱ受体拮抗剂:替米沙坦、缬沙坦、厄贝沙坦 适用:糖尿病。 联合用药 ACEI+小剂量利尿剂,ARB+小剂量利尿剂、β阻滞剂+小剂量利尿剂,小剂量β阻滞剂+二氢吡啶类钙拮抗剂。 还有一种简单的方法是推荐顾客选用复方制剂的降压药,如安博诺(厄贝沙坦+氢氯噻嗪)、海捷亚(氯沙坦+氢氯噻嗪)、复代文(缬沙坦+氢氯噻嗪)、百普乐(培哚普利+吲达帕胺)。 消化系统 胃、十二指肠溃疡症状 胃溃疡--饭后疼痛,十二指肠溃疡--餐前空腹痛或半夜疼痛。常常伴有泛酸,烧心等症状。
用药原则:制酸生肌,和胃止痛。如果有幽门螺旋杆菌感染可对症使用抗生素。 一般用药:奥美拉唑肠溶胶囊,法莫替丁,复胃散胶囊(或者康复新液)快胃片,雷尼替丁, 泮托拉唑钠肠溶片。 联合用药 奥美拉唑+复胃散胶囊(或者康复新液)+复合维生素 B 片。 浅表性胃炎症状 无规律的上腹隐痛,饱胀不适,反酸、嗳气。 用药原则:保护胃黏膜的药物+抗生素+抗厌氧菌感染+促胃肠动力药+抑酸剂。 一般用药:西米替丁,胃痛宁,双姜胃痛丸,胃康灵,多潘立酮片,胃舒平,兰索拉唑,,阿莫西林分散片,克拉霉素,三九胃泰,雷尼替丁等。 联合用药 ①胶体果胶铋+抗 HP(阿莫西林+甲硝唑)。 ②胃康灵或双姜胃痛丸+西米替丁(如有幽门螺杆菌感染可对症使用抗生素)。 萎缩性胃炎症状 以胃脘部胀满疼痛多见,或痞满而无疼痛。必须先分清证型: 1、虚寒型:以胀满不适,食少纳呆,胃脘隐痛,喜温喜按,舌质淡白,胖大有齿痕,舌裂等症状为主。 2、胃阴亏虚型:以胃脘灼热胀痛,口干口苦,纳差,消瘦,舌红少津,舌体小,舌裂等症状为主。 用药原则 ●虚寒型:益气健脾,温胃驱寒(参芪健胃颗粒,丹佛胃尔康)。 ●胃阴亏虚型:养阴和胃(养胃舒颗粒或者软胶囊)。 联合用药 ●虚寒型:参芪健胃颗粒或者丹佛胃尔康+胃优乐(维酶素)+复合维生素 B。 ●胃阴亏虚型:养胃舒颗粒或者软胶囊+胃优乐(维酶素)+复合维生素 B 片。 糜烂性胃炎用药原则 同消化性溃疡治疗用药相同。 急性胃肠炎症状
××胶囊工艺规程 1、引言: 制订本标准的目的是规范××胶囊生产全过程,对生产一定数量的成品所需的起始原料和包装材料的数量,以及工艺、加工说明、注意事项进一步标准化。 2、依据: 《保健食品良好生产管理规范》 3、适用范围:本标准适用于海克胶囊生产的全过程。 4、责任:生产技术部、品质管理部以及工艺规程起草人员对本标准的实施负责。 5、程序: 5.1产品概述: 、××、××盐酸盐、淀粉、硬脂酸镁为主要原料本品是以××钙、维生素D 3 制成的保健食品,经动物功能试验证明,具有增加骨密度的保健功能。 、××、××盐酸盐、淀粉、硬脂酸镁【主要原料】××钙、维生素D 3 【功效成分/标志性成分及含量】每100g含:钙22g、维生素D 190ug、××盐 3 酸盐11g、××盐酸盐盐酸盐27g 【保健功能】增加骨密度
【适宜人群】中老年人 【食用方法及食用量】每日2次,每次3粒【规格】0.45g/粒 【保质期】24个月 【贮藏方法】室温,阴凉干燥处保存 5.2配方 原辅料称量配料配比:以每批10万粒计
5.3××胶囊批号的划分原则: 固体制剂在成型或分装前使用同一台混合设备一次混合量所生产的均质产品为一批。××胶囊的批号确定原则为:使用二维运动混合机总混的一批料为一个批号的 产品。 5.4 生产工艺流程和主要控制要点: 5.5 5.5.1 5.5.1.2物料预处理 5.5.1.2.1生产前准备:
1)检查工作场所:确认无前次生产遗留物,卫生清洁,温度、湿度等环境符 合要求。 2)电子台秤:反应灵敏,回零、计量准确。 3)复核原辅料:品名无误、批号(编号)与检验报告单一致,质量合格。 5.5.1.2.2操作: 1)按电子台秤操规程,准确秤量各物料重量。 2)过筛:将原辅料分别按工艺要求细度过振荡筛,操作按《振荡筛操作规程》操作,将上述物料过筛。 3)过筛好的物料应袋入双层塑料袋中,扎紧后转入周转桶内,挂物料卡,转称量配料工序。 5.5.1.2.3结束: 1)每种物料过筛结束后,应清扫后再过下种物料,过筛完毕,彻底情场。 2)清理作业场所。 3)按规定及时填写生产记录及清场记录。 5.5.1.2.4物料平衡的计算:平衡限度:99.5%--100.0% 5.5.1.2.5过程控制:
金钱草 药材名称: 金钱草 拼音名称: JINQIANCAO 别名: 神仙对坐草、地蜈蚣、蜈蚣草、铜钱草、野花生、仙人对坐草、四川大金钱草、大金钱草、对坐草、一串钱、临时救、黄疸草、一面锣、金钱肺筋草、藤藤侧耳根、白侧耳根、铜钱花、水侧耳根、大连钱草、遍地黄、黄花过路草、龙鳞片、真金草、走游草、铺地莲。 科属: 报春花科植物过路黄的全草或带根全草。 产地: 主产于四川及长江流域各省区。多自产自销。 性味: [性味、归经]甘、咸,微寒。归肝、胆、肾、膀胱经。 功效: 利湿退黄,利尿通淋,解毒消肿。 中成药: 共有99种中成药使用金钱草:净石灵胶囊胆石通胶囊癃闭舒胶囊抗菌消炎片(益金解毒片)快应茶清热凉茶神农茶颗粒(冲剂)药制龟苓膏琥珀消石颗粒复方金钱草颗粒等。 应用:
1、湿热黄疸。本品清肝胆之火,又能除下焦湿热,有清热利湿退黄之效。治湿热黄疸,常与茵陈蒿、栀子、虎杖同用。 2、石淋、热淋。金钱草利尿通淋,善消结石,尤宜于治疗石淋,可单用代茶饮,或与海金沙、鸡内金、石韦等同用,以增强清下焦湿热、通淋排石之功; 石淋兼有肾虚者,可与补肾之桑寄生、胡桃仁等配伍应用。治疗热淋,可与车 前子、萹蓄等同用;本品还能清肝胆湿热,消除胆石,常配伍茵陈、大黄、郁 金等同用,治疗肝胆结石。 3、疮毒痈肿,乳痈,火丹,毒蛇咬伤及跌打损伤。金钱草有解毒散瘀,消肿止痛之功,常用鲜品内服或外敷,可单用鲜草捣汁饮,或捣敷患处,亦可与野 菊花、蒲公英、万年青等同用以加强清热解毒作用。 此外,金钱草用于水肿、臌胀,内服、外敷均有利尿消肿之功,用于肺热咳嗽,小儿高热,是取其清热解毒作用。 配伍效用: 1、金钱草配伍白花蛇舌草:金钱草鲜用解毒消肿;白花蛇舌草清热泻火解毒。二者合用,更增强其清热解毒之功效,用于治疗毒蛇咬伤、疖肿等症。 2、金钱草配伍海金沙:金钱草清热利尿、通淋止痛、利胆、排石;海金沙清降通淋排石。二者相须为用,其清热利尿、通淋排石之功效更著,用于治疗肾 结石、输尿管结石、膀胱结石以及胆结石。 3、金钱草配伍茵陈:二者皆可除湿退黄。但金钱草长于利胆排石;茵陈长于利湿退黄。二者伍用,有利胆退黄排石之功效,用于治疗肝胆结石之身黄、尿 黄或无结石但属湿热之黄疸。 用法用量: 煎汤,15-60克,鲜品加倍;或捣汁饮。外用:适量,鲜品捣敷。 注意事项: 凡阴疽诸毒、脾虚泄泻者,忌捣汁生服。 采收加工: 夏、秋二季采收。除去杂质,晒干,切段生用 炮制工艺: 取原药材,除去杂质,抢水洗净,沥去水,切段,干燥。