
河北定州中学2015—2016学年度第二学期化学周练(四)
一、单选题:共16题每题3分共48分
1.在2 L的密闭容器中,发生以下反应∶2A(g)+B(g) 2C(g)+D(g)。若最初加入的A和B都是4mol,在前10 s A的平均反应速率为0.12 mol ? (L ? s)-1,则10s时,容器中C的物质的量是
A.1.6 mol
B.2.8 mol
C.2.4 mol
D.1.2 mol
2.反应4NH3(g)+5O2(g)4NO(g) + 6H2O(g)在5 L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
A.v(NH3)=0.02 mol ? (L ? s)-1
B.v(NO)=0.002 mol ? (L ? s)-1
C.v(O2)=0.001 mol ? (L ? s)-1
D.v(H2O)=0.045 mol?(L?s)-1
3.将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶
2A(g)+B(g)2C(g)。若经2s后测得C的浓度为0.6 mol ? L-1,现有下列几种说法,其中正确的是
A.用物质A表示的反应的平均速率为0.6 mol ? (L ? s)-1
B.2 s时物质B的浓度为1.4 mol ? L-1
C.2 s时物质A的转化率为70%
D.2 s时物质A的体积分数为
4.在2 L的密闭容器中发生反应:4A(s)+3B(g)2C(g) +D(g),2 min后B减小了1.2 mol。有关此反应的说法正确的是
①用A表示的反应速率是0.4 mol ? (L ? min)-1
②分别用B、C、D表示化学反应速率其比值是3∶2∶1
③在2 min内的反应速率,用C表示是0.4 mol ? (L ? min)-1
④升高温度,反应速率将增大
A.①②
B.③④
C.①③
D.②④
5.一定温度下,在固定容积的密闭容器中发生下列反应∶2HI(g) H2(g)+I2(g)。若HI的浓度由0.1 mol ? L-1 降到0.07 mol ? L-1时需要15s,则HI的浓度由0.07 mol ? L-1降到0.05 mol ? L-1时,所需时间为
A.等于5s
B.等于10 s
C.大于10s
D.小于10 s
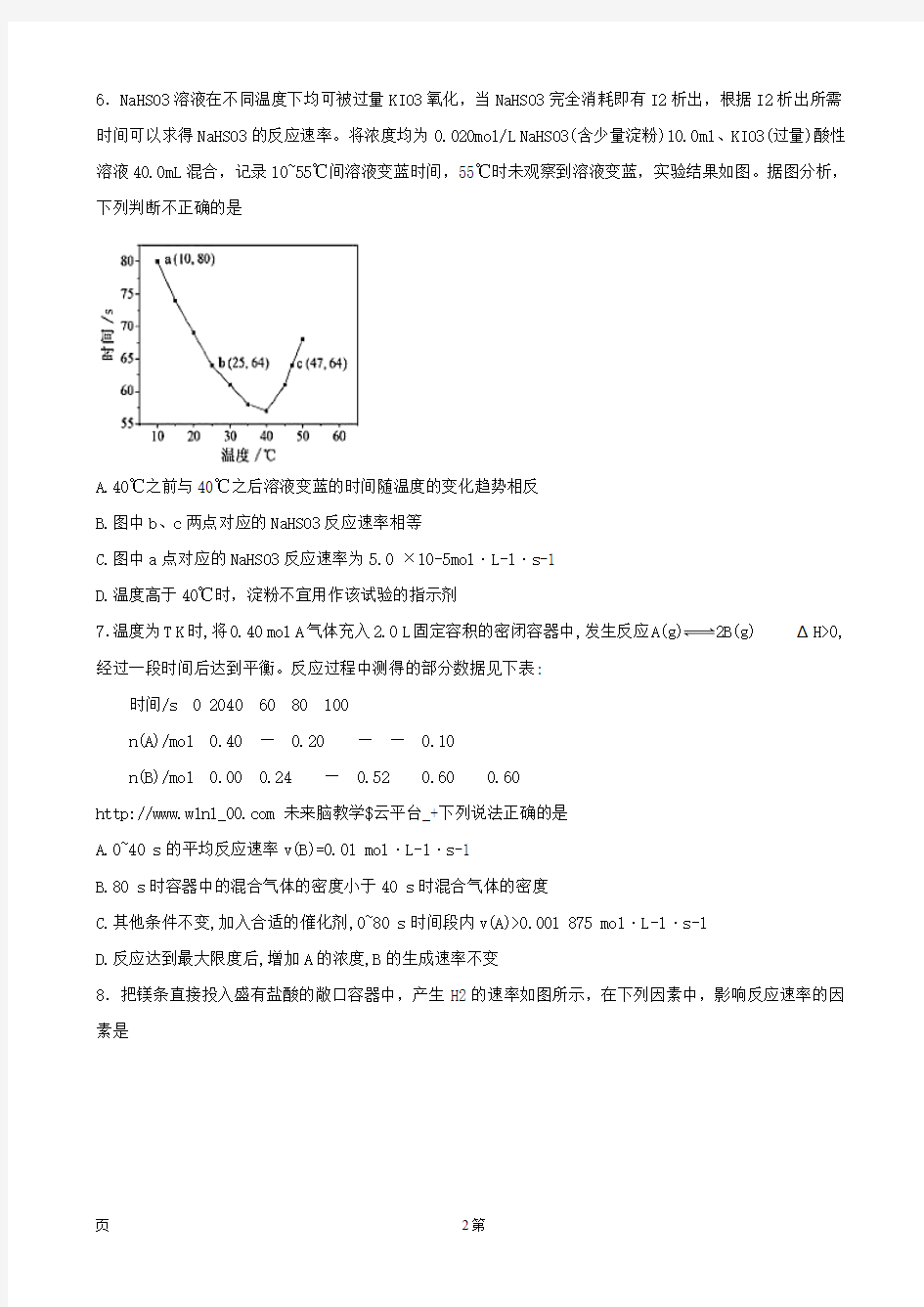
6.NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol/L NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D.温度高于40℃时,淀粉不宜用作该试验的指示剂
7.温度为T K时,将0.40 mol A气体充入2.0 L固定容积的密闭容器中,发生反应A(g)2B(g) ΔH>0,经过一段时间后达到平衡。反应过程中测得的部分数据见下表:
时间/s 0 20 40 60 80 100
n(A)/mol 0.40 —0.20 ——0.10
n(B)/mol 0.00 0.24 —0.52 0.60 0.60
http://www.wln1_https://www.doczj.com/doc/1316577310.html, 未来脑教学$云平台_+下列说法正确的是
A.0~40 s的平均反应速率v(B)=0.01 mol·L-1·s-1
B.80 s时容器中的混合气体的密度小于40 s时混合气体的密度
C.其他条件不变,加入合适的催化剂,0~80 s时间段内v(A)>0.001 875 mol·L-1·s-1
D.反应达到最大限度后,增加A的浓度,B的生成速率不变
8.把镁条直接投入盛有盐酸的敞口容器中,产生H2的速率如图所示,在下列因素中,影响反应速率的因素是
①盐酸的浓度②镁条的表面积③溶液的温度④Cl-的浓度
A.仅①④
B.仅③④
C.仅①②③
D.仅②③
9.对于反应N2+O22NO,在密闭容器中进行,下列条件中能加快化学反应速率的是(假设温度不变)
①缩小体积使压强增大
②体积不变,充入N2使气体压强增大
③体积不变,充入Ne使气体压强增大
④压强不变,充入Ne
A.①②
B.①③
C.①④
D.②④
10.下列有关化学反应速率的说法正确的是
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100 mL 2 mol ? L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
11.关于催化剂的理解中不正确的是
A.由催化剂反应前后质量不变知催化剂不参加化学反应
B.催化剂具有高度的选择性(即催化的专一性)
C.酶是生物体内的一类催化剂
D.催化剂在化学反应前后的化学性质、质量不变
12.反应A+B→C的反应速率方程式为:v= k c (A) c (B),v为反应速率,k为速率常数。当c(A)= c(B)=1mol/L 时,反应速率在数值上等于速率常数。下列说法正确的是
A.只增大c(A)时,v也增大
B.只增大c(A)时,v值不变
C.只升高温度时,k值不变
D.只升高温度时,k值变小
13.下列各条件下发生反应X+Y=XY时,速率最快的是
A.常温下,20mL中含X、Y各0.003mol的溶液
B.常温下,100mL中含X、Y各0.005mol的溶液
C.常温下,0.1mol/L的X、Y溶液各l0mL相混合
D.标准状况下,0.1mol/L的X、Y溶液各l0mL相混合
14.对化学平衡移动的分析,下列说法正确的是
A.已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动
B.已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
C.改变外界条件使正反应速率大于逆反应速率时,化学平衡一定向正反应方向移动
D.已达平衡的反应N2(g)+3H2(g) 2NH3(g),在恒压反应器中充入稀有气体,平衡不移动
15合成氨反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图
下列说法正确的是
A.t1时增大了压强
B.t2时充入了稀有气体
C.t3时升高了温度
D.t4时降低了温度
16.在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)CH3OH(g) ΔH<0。第2 min时只改变一个条件,反应情况如下表:
时间c(CO)/mol/L c(H2)/mol/L c(CH3OH)/mol/L
起始 1 3 0
第2 min 0.8 2.6 0.2
第4 min 0.4 1.8 0.6
第6 min 0.4 1.8 0.6
下列说法不正确的是
A.第4 min至第6 min该化学反应处于平衡状态
B.第2 min时,如果只改变某一条件,则改变的条件可能是降低温度
C.第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D.第6 min时,其他条件不变,如果升高温度,正反应速率增大
二、计算题:共6题共52分
17.实验室H2还原CuO所得的红色固体可能是Cu与Cu2O的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。现有8g CuO被H2还原后,得到红色固体6.8g。
(1)6.8 g上述混合物中含Cu与Cu2O的物质的量之比是;
(2)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体 g;
(3)若将6.8 g上述混合物与一定量的浓硝酸充分反应,生成标准状况下1.568 L的气体(本题不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则推断该气体的成分及物质的量之比(本小题需有解题过程)。
18.化学反应原理对化学反应的研究具有指导意义
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因、。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现?(选填“能”或“不能”),依据是。
(2)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的化学方程式为,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度(选填“增大”、“减小”或“不变”)。
(3)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+I2+2Fe2+,当反应达到平衡后,加入CCl4
充分振荡,且温度不变,上述平衡向(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O22Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.:
①写出此条件下,反应A的热化学方程式。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
19.甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:反应①:CO(g)+2H2(g) CH3OH(g) △H1=-90.77kJ/mol 反应②:CO2(g)+H2(g) CO(g)+H2O(g) △H2反应③:CO2(g)
+3H2(g) CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
(1)反应②的△H2=__________________
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=_________(用K1、K2表示)。已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正________V逆(填“>”、“=”或“<”)
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件
是。当通过改变压强使曲线I变为曲线III时,曲线III达到平衡时容器的体积为_____________。
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________
20.标准状况下,1.68L无色可燃气体在足量氧气中完全燃烧,若将产物通入足量澄清石灰水,可得到15.0g 白色沉淀;若用足量碱石灰吸收燃烧后的产物增重9.3g。
(1)计算燃烧生成的水的质量。
(2)若原气体是一种烃,通过计算确定其分子式
21.室温下,用下图所示的装置进行电解。通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。若电解结束时,A、B装置中共收集到气体1.68 L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000 mL,求此时A溶液的pH值。(提示:pH=-lgc(H+))
22.将一定质量由Cu和CuO组成的固体粉末加入到100 mL 11 mol/L的浓HNO3中,充分反应后,固体溶解完全,收集到NO、NO2混合气体6.72 L(标准状况)。若将该混合气体与2.24 L O2(标准状况)混合并通入到足量水中,恰好生成HNO3。
(1)NO的体积是 L,NO2的体积是 L(标准状况)。
(2)固体粉末中Cu单质的质量是 g。
(3)向浓HNO3反应后的溶液中加入4 mol/L的NaOH溶液,当Cu2+恰好沉淀完时,需要NaOH 溶液的体积是 L
参考答案
1.D
【解析】
试题分析:A.HClO 具有强氧化性,表现出氧化性的是氯元素,所以NaClO也有氧化性,A错误;B.Cl 2+H2O HCl+HClO,加入足量浓盐酸,平衡逆向移动生成Cl2,漂白效果减弱,B错误;C.知道a 点ClO3-和ClO-的物质的量,还有原来氢氧化钠和加入的氯气的量,能够求出溶液中钠离子和氯离子的量,C错误;D.t 2到t 4次氯酸根离子的浓度减小、氯酸根离子的浓度增大,所以是由于ClO-发生反应生成了ClO3-,同时被还原为Cl-,D正确,答案选D。
考点:考查氯气与碱反应
2.A
【解析】
试题分析:X附近溶液先变红,电极X发生的反应是水电离出的氢离子被还原,X极是阴极,电极A是负极,电极B是正极,Y是阳极,A.闭合K时,原电池中阳离子向正极移动,所以K十从左到右通过离子交换膜,A正确;B.闭合K时电池放电,A为原电池的负极,电极反应式为2K2S2-2e-=K2S4+2K+,B错误;C.X为电解池的阴极,发生反应为:2H2O+2e-=H2+2OH-,C错误;D.当有0.1mo1K+通过离子交换膜,有0.1mol电子转移,根据2Cl—-2e- =Cl2,产生0.05mol电氯气,准状况下气体1.12L,D错误,答案选A。
考点:考查电化学原理
3.D
【解析】
试题分析:A.在AgI中加入S2-,沉淀转化为Ag2S沉淀,说明溶解度Ag2S
考点:考查氧化还原反应、焓变的应用、沉淀转化
4.B
【解析】
试题分析:A .该反应是对二甲苯在酸性高锰酸钾的作用被氧化为对二苯甲酸即PTA ,所以PTA 是该反应的氧化产物,A 正确;B .PET 是聚对苯二甲酸乙二酯,是PTA 与乙二醇通过缩聚反应得到的,B 错误;C .PX 即对二甲苯含有苯环的同分异构体还有邻二甲苯、间二甲苯和乙苯三种,C 正确;D .该反应消耗 5molPX ,反应掉12mol 高锰酸钾,转移12mol ×5e --,所以消耗 1molPX ,共转移 12N A 个电子 ( N A 为阿伏加德罗常数),D 正确,答案选B 。 考点:考查有机氧化还原反应、同分构体 5.C 【解析】
试题分析:A .反应物的浓度增大,平衡正向移动,A 正确;B .K sp [Cr(OH)3]=c(Cr 3+)·c 3(OH -)=1×10﹣32
,c(Cr 3+)=1×10﹣5mol/L ,解得氢离子的浓度为1×10﹣9
mol/L ,溶液的pH=5, B 正确;C .转化后所得
溶液中铬元素含量为28.6g/L ,根据电荷守恒列式2Cr~2CrO 42﹣~ Cr 2O 72﹣~ 2Cr 3+~6e -~6 FeSO 4·7H 2O ,,1L 废水中n(Cr 3+)=28.6g/52g/mol=0.55mol/L, n(FeSO 4·7H 2O)=3 n(Cr 3+
),m(FeSO 4·7H 2O)=0.55mol ×3×
278g/mol=458.7g ,C 错误;D .1L 废水中n(Cr)=28.6g/52g/mol=0.55mol/L, CrO 42﹣有10/11转化为Cr 2O 72﹣,
则酸化后c(CrO 42﹣)=1×10﹣5mol/L ×(1-10/11)=0.05mol/L ,c(Cr 2O 7
2
﹣
)=L mol L mol /25.01110/55.021=??,常温下的平衡常数为104
,则4224227210)
()()(=?+
--
H c CrO c O Cr c ,c (H +)=0.1mol/L ,D 正确,答案选C 。 考点:考查物质的量的计算
6.B 【解析】
试题分析:A .气象环境报告中新增的“PM2.5”是可吸入颗粒物,属于混合物,A 错误;B .“光化学烟雾”是NO 引起的,“硝酸型酸雨”也是氮氧化物引起,都与氮氧化合物有关,B 正确;C .治疗胃酸过多和制作面包等糕点的膨松剂,都是小苏打,C 错误;D .过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的,乙醇是使蛋白质变性,不是氧化,D 错误,答案选B 。
考点:考查化学常识 7.C 【解析】
试题分析:A .0.1mol/1L 的HCl 的pH 为1,所以下面的曲线表示的是HCl ,0.1mol/1L 的HX 的pH 等于
5,所以HX 是弱酸,A 正确;B .M 点氢氧化钠的体积为10mL ,根据物料守恒:c (HX )+c (X -)=2c (Na +),根据电荷守恒:c (H +)+c (Na +)=c(X -)+c (OH -),结合上面两个式子有c(HX)—c(X -)=2[c(OH —)—c(H +)],
所以有:c(HX)—c(X-)﹥c(OH—)—c(H+),B正确;C.P点溶液中NaCl、HCl的物质的量相等,N点是NaX 溶液,NaX物质的量为HCl的2倍,两溶液混合后为NaCl、NaX、HX的混合溶液,NaX、HX的物质的量相等,X-的水解大于HX的电离,呈碱性,C错误;D.根据电荷守恒:(H+)+c(Na+)=c(X-)+c(OH-)+c(Cl-),溶液pH=7,则c(Cl-)+c(X-)=c(Na+),根据物料守恒:c(HX)+c(X-)=2c(Na+),
联合两式可得c(HX)=c(Cl-),溶液为NaCl、NaX、HX的混合溶液,相同浓度下X-的水解大于HX的电离,则c(Na+) ﹥c(HX) = c(Cl—) ﹥c(X—),D正确,答案选C。
考点:考查溶液中离子浓度大小关系
8.C
【解析】
试题分析:短周期元素R、W、X、Y、Z的原子序数依次增大,R原子的最外层电子数是其内层电子数的2倍,R是C元素;X 元素的焰色反应呈黄色,X是Na元素;W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,W是O元素,Z是S元素;Y是地壳中除氧外含量最多的非金属元素,Y是Si元素。A.O与Na形成的两种化合物分别是Na2O和Na2O2,它们的阴、阳离子的个数比均为1∶2,A正确;B.Si、C、S的非金属性逐渐增强,所以它们的最高价氧化物对应水化物的酸性强弱顺序:S>C>Si,B正确;C.O 元素的非金属性强于S元素,所以O的简单氢化物稳定性比S的简单氢化物稳定性高,C错误;D.SiO2是原子晶体,具有熔点高、硬度大的特点,D正确,答案选C。
考点:考查元素推断、元素周期律
9.C
【解析】
试题分析:A.燃料电池,即原电池将化学能转化为电能,A正确;B.燃料电池中通入氧气的一极发生还原反应,是正极,加燃料的一极发生氧化反应,是负极,在电池内阳离子向正极移动,所以H+由a极移向b极,B正确;C.电极b发生的反应为4H++O2+4e-=2H2O,氢离子被消耗,pH增大,C错误;D.电极a 是苯酚被氧化生成CO2和H+,反应式为:C6H6O-28e-+ 11H2O?
?微生物6CO2 + 28H+,D正确,答案选C。
?→
考点:考查燃料电池
10.D
【解析】
试题分析:A.向装有Fe(NO3)2溶液的试管中加入稀H2SO4后,在试管口观察到红棕色气体,是由于亚铁离子和硝酸反应生成了NO,NO再与氧气反应生成了NO2,A错误;B.向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有砖红色沉淀生成,醛和新制氢氧化铜必须在碱性条
件下才可以反应,所以要先加氢氧化钠,再加新制氢氧化铜才可以反应,B错误;C.向无水乙醇中加入浓H2SO4,加热至170℃产生的气体是乙烯,但是乙醇易挥发,且乙醇也可以使酸性高锰酸钾褪色,所以通入酸性KMnO4溶液,红色褪去,不一定是乙烯使其褪色的,C;D.向水玻璃中即硅酸钠的水溶液中通入CO2产生白色沉淀是由于生成了H2SiO3,D正确,答案选D。
考点:考查化学实验评估
11.C
【解析】
试题分析:根据密胺的结构式和元素守恒,可知一个密胺分子中有三个碳原子和六个氮原子,所以合成1mol 的密胺需要3mol的CO2和6molNH3,NH3和CO2的质量之比应为:2×17:44=17:22,,答案选C。
考点:考查有机物机构分析、质量守恒、物质的量的计算
12.C
【解析】
试题分析:①甲烷燃料电池中甲烷失电子为负极,①错误;②碱性条件下,正极上氧气得电子生成氢氧根离子,其电极反应式为O2+2H2O+4e﹣=4OH﹣,②正确;③甲烷燃料电池负极是甲烷失电子,碱性条件下生成碳酸根离子,所以负极的电极反应式为:CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O,③错误;④甲烷燃料电池负极是甲烷失电子,碱性条件下生成碳酸根离子,所以负极的电极反应式为:CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O,④正确;⑤⑥原电池工作时,电解质溶液中,阳离子向正极移动,阴离子向负极移动,所以⑤错误,⑥正确;正确的有②④⑥,答案选C。
考点:考查电化学有关的计算
13.B
【解析】
试题分析:A.容器Ⅰ中平衡时c(CH3OCH3)=c(H2O)==0.080mol/L,c(CH3OH)
==0.04mol/L,容器Ⅰ中化学平衡常数K1==4,容器Ⅲ中平衡时c
(CH3OCH3)=c(H2O)==0.090mol/L,c(CH3OH)==0.02mol/L,化
学平衡常数K2==20.25>4,所以降低温度,化学平衡常数增大,反应向正反应方向移动,则正反应是放热反应,A错误;B.c(CH3OH)=0.1mol/L、c(CH3OCH3 )=0.15mol/L、c(H2O)=0.10mol/L,
浓度商==1.5<4,平衡向正反应方向移动,B正确;C.容器I中的温度比容器III的温度高,温度越高反应速率越快,达到平衡所需时间越短,C错误;D.恒容条件下,容器Ⅱ相当于在容器Ⅰ的基
础上加压,但由于该反应是反应前后气体体积不变的反应,因此平衡不移动,所以容器Ⅰ中的CH3OH体积分数和容器Ⅱ中的相等,D错误,答案选B。
考点:考查化学平衡的计算
14.B
【解析】
试题分析:A.密度为1.40g/cm3、质量分数为63%的浓硝酸的物质的量浓度
=mol/L=14mol/L,A正确;B.加入适量的1.0mol/L NaOH溶液,恰使溶液中的金属离子全部沉淀,此时溶液中溶质为NaNO3,由N元素守恒可知n(NaNO3)+n(NO2)=n(HNO3),则n (NaNO3)=0.05L×14mol/L﹣=0.62mol,由钠离子守恒n(NaOH)=n(NaNO3)=0.62mol,故需要1.0mol/L NaOH溶液体积为=0.62L=620mL,B错误;C.起氧化性的硝酸生成NO2气体,根据N原子守恒可知,起氧化剂的硝酸的物质的量==0.08mol,C正确;D.由电荷守恒可知,氢氧化物中氢氧根的物质的量等于转移电子物质的量,即氢氧根的物质的量为0.08mol×(5﹣4)=0.08mol,故氢氧化物质量=1.76g+0.08mol×17g/mol=3.12g,D正确,答案选B。
考点:考查硝酸的性质、物质的量有关的计算
15.C
【解析】
试题分析:正面体中含有1种氢原子,一氯代物有1种,二氯代物只有1种:两个氯原子在立方体同边有一种情况;立方烷中含有1种氢原子,一氯代物有1种,二氯代物有3种:两个氯原子在立方体同边有一种情况,两个氯原子的位置在对角有两种情况;金刚烷的结构可看作是由四个等同的六元环组成的空间构型,分子中含4个﹣CH﹣,6个﹣CH2,分子中含有2种氢原子,所以该物质的一氯代物有2种,当次甲基有一个氯原子取代后,二氯代物有3种,当亚甲基有一个氯原子取代后,二氯代物有3种,共6种,故选C.
考点:考查有机化合物的同分异构体的数目
16.C
【解析】
试题分析:A.氢氧化镁是难溶于水的碱,和盐酸反应不能用H++OH-=H2O来表示,A错误;B.Ba(OH)2溶液滴入稀硫酸中会生成硫酸钡沉淀,不能用H++OH-=H2O来表示,B错误;C.澄清石灰水和稀硝酸反应属于强酸、强碱生成可溶性的盐和水的反应,能用H++OH-=H2O来表示,C正确;D.二氧化碳溶于水是弱酸,通入澄清石灰水中生成沉淀,不能用H++OH-=H2O来表示,D错误,答案选C。
考点:考查离子方程式的意义
17.(1)2︰1;(2)4.8;(3)NO、NO2之比为4︰3
【解析】
试题分析::(1)n(CuO)=8g÷80g/mol=0.1mol,根据Cu、O原子守恒得n(O)=n(CuO)=n(Cu)=0.1mol;固体由CuO生成Cu和Cu2O组成,减少的质量为氧元素的质量,即8g-6.8g=1.2g,减少的n(O)=1.2g÷16g/mol=0.075mol,所以Cu2O中n(O)=0.1mol-0.075mol=0.025mol,所以n(Cu2O)=0.025mol,根据铜元素守恒得n(Cu)=0.1mol-2×0.025mol=0.05mol,所以n(Cu)与n(Cu2O)之比是2:1;
(2)n(Cu)=0.1mol-2×0.025mol=0.05mol,所以m(Cu)=0.05mol×64g/mol=3.2g,m(Cu2O)=6.8g-3.2g=3.6g。Cu2O和稀硫酸反应,铜和稀硫酸不反应,设Cu2O和稀硫酸反应生成铜的质量为x,氧化亚铜和稀硫酸反应的方程式为:
Cu2O+H2SO4=CuSO4+Cu+H2O
144g 64g
3.6g x
144g:64g=3.6g:x
解得x=1.6g
所以可得到固体的质量=3.2g+1.6g=4.8g;
(3)①通过②分析知,6.8克的铜和氧化亚铜的混合物与硝酸反应相当于4.8克的铜与硝酸反应。设铜与硝酸反应全部生成二氧化氮,二氧化氮的体积为:
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
64g 44.8L
4.8g 3.36L
设铜与硝酸反应全部生成一氧化氮,一氧化氮的体积为:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
192g 44.8L
4.8g 1.12L
1.12L<1.568L<3.36L,所以该气体是二氧化氮和一氧化氮的混合物;设生成一氧化氮的物质的量为ymol,生成二氧化氮的物质的量为zmol,则÷
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
192g 2mol
96yg ymol
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
64g 2mol
32zg zmol
y+z=1.568÷22.4、96y+32z=4.8,解得y=0.04、z=0.03,所以一氧化氮和二氧化氮的物质的量之比为4:3。
【考点定位】本题主要是考查化学方程式计算
【名师点晴】该题侧重考查学生分析计算能力,明确物质性质及物质之间关系式是解本题关键,解答时注意利用好各种守恒法,特别是原子守恒、电子得失守恒等。注意(3)题要确定气体成分,方法是利用极限法,也可以直接设出NO和NO2的物质的量根据反应的化学方程式进行计算,题目难度较大。
18.(1)①温度升高,反应速率加快温度升高,有利于平衡反应正向进行
+H2;
②不能;该反应是焓增、熵减的反应,任何温度下均不能自发进行(2)Cl
增大(3)正反应;加入少许铁粉或加入少许碘(其他合理设计即可)
(4)①4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1 ②31.9
【解析】
试题分析:(1)①气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H >0,温度升高,反应速率
加快;温度升高,有利于平衡反应正向进行;
②该反应是焓增、熵减的反应,根据△H - T?ΔS>0可知,任何温度下均不能自发进行;
+H2,在上述平衡体系中加入少量NaOH
(2)氯气溶于水是可逆反应,化学方程式为:Cl
固体,消耗H+,平衡正向移动,溶液中Cl—浓度增大;
(3)Fe3+和I—在水溶液中的反应是2I—+2Fe3+I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,碘溶解在CCl4中,水溶液中,碘单质的浓度降低,平衡正向移动,要想使该反应的化学平衡逆向移动,降低I—或Fe3+的浓度或增大I2或Fe2+浓度即可,所以加入少许铁粉或加入少许碘。
(4)①依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为4HCl(g)+O2(g)
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1;
②焓变=反应物断键吸收热量-生成物形成化学键放出热量,4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1,4×E(H-Cl)+498-[243×2+4×E(H-O)]=-115.6,得到4×E(H-O)-4×E(H-Cl)
=498-486+115.6=127.6,E(H-O)-E(H-Cl)=31.9≈31.9,这说明断开1 mol H—O键与断开1 mol H—Cl 键所需能量相差约为31.9kJ。
考点:考查温度对化学反应速率的影响,化学反应方向,离子方程式的书写,平衡移动方向以及热化学方程式书写和反应热计算等
19.(1)+41.19 kJ?mol—1(2)K1?K2>(3)加入催化剂2L(4)CH3OH—6e-+H2O=CO2+6H+
(5)
【解析】
试题分析:(1)已知反应①:CO(g)+2H2(g) CH3OH(g) △H1=-90.77kJ/mol,反应②:CO2(g)+H2(g) CO(g)+H2O(g) △H2,反应③:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3=-49.58kJ/mol,根据盖斯定律:②=③-①得反应②的△H2=+41.19 kJ?mol—1。
(2)根据已知反应确定K1=c(CH3OH)/c(CO)c2(H2)、K2=c(CO)c(H2O)/c(CO2)c(H2)、K3= c(CH3OH) c(H2O)/ c(CO2)c3(H2),则K3=K1?K2。500℃时K1、K2的值分别为2.5、1.0,则K3= K1?K2=2.5,该温度下反应③在某时刻,Q= c(CH3OH) c(H2O)/ c(CO2)c3(H2)=(0.3×0.15)/(0.83×0.1)=0.9<K3,反应正向进行,则此时V正>V逆。
(3)分析图像知t0时刻改变一个条件,曲线I变为曲线II,一氧化碳的平衡浓度没有变化而达平衡的时间缩短,改变的条件是加入催化剂;反应②为反应前后气体物质的量不变的反应,改变压强,平衡不移动,曲线I变为曲线III时,一氧化碳的浓度由0.3mol/L变为0.45mol/L,容器的体积由3L变为2L。
(4)根据题给装置知本题考查酸性甲醇燃料电池,根据外电路电子流向判断左侧电极为电池的负极,发生氧化反应,即甲醇被氧化为二氧化碳,结合碳元素的化合价变化确定失电子数目,根据原子守恒和电荷守恒配平,电极反应式为CH3OH—6e-+H2O=CO2+6H+。
(5)常温条件下,将a mol/L的CH3COOH与b mol/L Ba(OH)2溶液等体积混合,根据电荷守恒知2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH—),又2c(Ba2+)=c(CH3COO-)= b mol/L,则c(H+)=c(OH—)=1×10-7mol/L,根据醋酸与氢氧化钡溶液反应的化学方程式确定混合液中c(CH3COOH)=(a-2b)/2mol/L,该混合溶液中醋酸
的电离常数为c(CH3COO-) c(H+)/ c(CH3COOH)= 。
考点:考查反应热的计算、盖斯定律,化学平衡分析和电离常数的计算。
20.(1)2.7克(2)C2H4
【解析】
试题分析:(1)m (CO 2)=15.0g ×(44g/mol ÷100g/mol) =6.6g ,m (CO 2+H 2O )=9.3g ,m (H 2O )=9.3g -6.6g=2.7g
(2)n (CO 2)=6.6g ÷44g/mol=0.15mol ,n (H 2O )=2.7g ÷18g/moL=0.15mol ,分子中C ∶H=1∶2 n 。无色可燃气体的物质的量为1.68L ÷22.4L/mol=0.075mol ,分子中C 原子数=0.15mol ÷0.075mol=2,分子中氢原子数=2×2=4 所以该气体的分子式是C 2H 4 。
考点:考查有机物的计算,有机物分子式的确定等知识。
21.pH =1 【解析】
试题分析:湿润的淀粉KI 试纸的C 端变为蓝色,说明I -在C 端失电子,发生氧化反应,则Fe 电极为阴极A 装置中收集到的是O 2,铜电极是阳极,B 装置中收集到的是H 2,两者的体积比为1∶2,设O 2的物质的
量为x ,则有3x =1.68 L ÷22.4 L ·mol -1=7.5×10-2 mol ,x =2.5×10-2
mol ,根据电极反应4OH --4e -=O 2↑+2H 2O, A 中消耗n(OH -)= 4×2.5×10-2 =0.1 mol ,余n(H +
)=0.1 mol ,
c(H +)=0.1 mol ÷1 L =0.1 mol ·L -1,pH =1。 考点:考查pH 值的计算。
22.(1)1.12 5.6(2)12.8(3)n (NO 3-)=0.1L ×11 mol/L -0.3mol=0.8mol, n (NO 3-)= n (NaOH )
=0.8mol ,
【解析】
试题分析:(1)设NO 的物质的量是x mol 、NO 2的物质的量是y mol. 根据得失电子守恒①3x+y=4×0.1 ②22.4(x+y )=6.72
解得x=0.05 y=0.25
NO 的体积是1.12L ,NO 2的体积是5.6L
(2)根据电子守恒,2x Cu NO O →→失电子
失电子
,得22Cu O →失电子
2 1 X 0.1
X=0.05mol 固体粉末中Cu 单质的质量是12.8g ;
(3)向浓HNO 3反应后的溶液中n (NO 3-
)=0.1L ×11 mol/L -0.3mol=0.8mol,加入4 mol/L 的NaOH 溶液,
当Cu 2+恰好沉淀完时,溶液中的溶质恰好变为NaNO 3,根据元素守恒,n (NO 3-)= n (NaOH )=0.8mol ,
需要NaOH
考点:本题考查化学计算。
2019年全国一卷化学试题解析 1.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是 A. “雨过天晴云破处”所描述的瓷器青色,来自氧化铁 B. 闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 C. 陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 D. 陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 【答案】A 陶瓷是以天然粘土以及各种天然矿物为主要原料经过粉碎混炼、成型和煅烧制得的材料的各种制品。陶瓷的传统概念是指所有以黏土等无机非金属矿物为原料的人工工业产品。 【解析】A项、氧化铁为棕红色固体,瓷器的青色不可能来自氧化铁,故A错误; B项、秦兵马俑是陶制品,陶制品是由粘土或含有粘土的混合物经混炼、成形、煅烧而制成的,故B正确; C项、陶瓷的主要原料是取之于自然界的硅酸盐矿物,陶瓷的主要成分是硅酸盐,与水泥、玻璃等同属硅酸盐产品,故C正确; D项、陶瓷的主要成分是硅酸盐,硅酸盐的化学性质不活泼,具有不与酸或碱反应、抗氧化的特点,故D正确。 故选A。 2.关于化合物2?苯基丙烯(),下列说法正确的是 A. 不能使稀高锰酸钾溶液褪色 B. 可以发生加成聚合反应 C. 分子中所有原子共平面 D. 易溶于水及甲苯 【答案】B 2-苯基丙烯的分子式为C9H10,官能团为碳碳双键,能够发生加成反应、氧化反应和加聚反应。【解析】A项、2-苯基丙烯的官能团为碳碳双键,能够与高锰酸钾溶液发生氧化反应,使酸性高锰酸钾溶液褪色,故A错误; B项、2-苯基丙烯的官能团为碳碳双键,一定条件下能够发生加聚反应生成聚2-苯基丙烯,
故B正确; C项、有机物分子中含有饱和碳原子,所有原子不可能在同一平面。2-苯基丙烯中含有甲基,所有原子不可能在同一平面上,故C错误; D项、2-苯基丙烯为烃类,分子中不含羟基、羧基等亲水基团,,难溶于水,易溶于有机溶剂,则2-苯基丙烯难溶于水,易溶于有机溶剂甲苯,故D错误。 故选B。 3.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是 A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K B. 实验中装置b中的液体逐渐变为浅红色 C. 装置c中的碳酸钠溶液的作用是吸收溴化氢 D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯 【答案】D 在溴化铁作催化剂作用下,苯和液溴反应生成无色的溴苯和溴化氢,装置b中四氯化碳的作用是吸收挥发出的苯和溴蒸汽,装置c中碳酸钠溶液呈碱性,能够吸收反应生成的溴化氢气体,倒置漏斗的作用是防止倒吸。 【解析】A项、若关闭K时向烧瓶中加注液体,会使烧瓶中气体压强增大,苯和溴混合液不能顺利流下。打开K,可以平衡气压,便于苯和溴混合液流下,故A正确; B项、装置b中四氯化碳的作用是吸收挥发出的苯和溴蒸汽,溴溶于四氯化碳使液体逐渐变为浅红色,故B正确; C项、装置c中碳酸钠溶液呈碱性,能够吸收反应生成的溴化氢气体,故C正确; D项、反应后得到粗溴苯,向粗溴苯中加入稀氢氧化钠溶液洗涤,除去其中溶解的溴,振荡、静置,分层后分液,向有机层中加入适当的干燥剂,然后蒸馏分离出沸点较低的苯,可以得到溴苯,不能用结晶法提纯溴苯,故D错误。 故选D。
上海市徐汇区位育中学2021年高三上学期期中考历史试题学校:___________姓名:___________班级:___________考号:___________ 一、单选题 1.十九世纪到二十世纪前期,许多历史学家相信,历史研究可以去除主观因素,达到完全客观的境地。下列哪些说法反映了这种对历史客观性的信心?() ①“历史是一门科学,一点也不多,一点也不少。” ②“并不是我在说话,而是历史透过我的口在说话。” ③“我们只要把材料准备好,则事实自然显明了。” ④“所有的历史都是当代史。” A.①②③B.①③④C.①②④D.②③④ 2.古罗马法学家西塞罗曾经说:“环顾我们国家中的其他部分,你会发现一切都依照规则和法律的规定而运转。”这句话反映出当时罗马社会 A.体现了公平公正的原则 B.法律适用于所有人 C.法律至上的原则 D.统治阶级没有法律特权 3.“打一个可笑的比喻,我就像一只牛虻,整天叮住你们不放,唤醒你们、指责你们……我要让你们知道,要是杀死像我这样的人,那么对你们自己造成的损害将会超过对我的残害。”苏格拉底受审时的这几句辩辞,表明他高度重视 A.公民生存权利的重要性B.思想言论自由原则的重要性 C.雅典司法公正的重要性D.反对贵族专权暴政的重要性 4.历史上最后一个控制丝绸之路西段要冲(包括今天的伊斯坦布尔、巴格达、麦加和开罗),并对近代世界产生深远影响的帝国是 A.法兰克王国 B.罗马帝国 C.拜占庭帝国 D.奥斯曼帝国 5.十世纪时,一位阿拉伯学者到西欧去考察,他对于西欧的感观,最可能是: A.对西欧落后和民俗鄙陋大加批评 B.对统一西欧的强大政权印象深刻 C.对西欧经济和城市的繁荣赞赏不已
衡水中学试题 1、下列关于离子共存或离子反应的说法正确的是 A.某无色溶液中可能大量存在、、4-、A13+ = 2的溶液中可能大灰存在、、32-、、 2+与H 2O2在酸性溶液中反应:22 H 2O2+22 3 2O D.稀硫酸与()2 溶液的反应:42- 242O 2、下列有关物质的性质与用途具有对应关系的是 2具有氧化性,可用于漂白纸浆43受热易分解,可用作氮肥 2(4)3易溶于水,可用作净水剂2O3熔点髙,可用作耐高温材料 3、现有两瓶浓度相同的失去标签的23和3的无色饱和溶液,请提出简便的鉴別方法,其中不合理的是 ①用干燥的试纸检验,大的是23 ②取同量的溶液于两支试管中,各滴入酚酞溶液,红色较深的是23 ③取同量的溶液于两支试管中,加热.有气泡产生的是3 ④取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是3 ⑤取同量的溶液于两支试管中,滴加2溶液,生成白色沉淀的是23 ⑥取同量的溶液于两支试管中,滴加()2溶液,生成白色沉淀的是23, A.①② B.③⑥ C.④⑤ D.②⑤ 4、下列说法正确的是 A.足量的在2中燃烧只生成3 B.铁的化学性质比较活泼,它能和水蒸气反应生成H2和()3 C.用酸性4溶液检验3溶液中是否含有2 D.向某溶液中加溶液得白色沉淀,且颜色逐渐变为红褐色,说明该溶液中只含有2+ 5、下列实验操作能达到实验目的的是
6、下列四种有色溶液与2气体作用均能褪色,其实质相同的是 ①酸性高锰酸钾溶液②品红溶液③溴水④滴有酚酞的氢氧化钠溶液 A.①③ B.②③ C.①④ D.②④ 7、下列有关2(4)3溶液的叙述正确的是 A.该溶液中、2+、C6H5、可以大量共存 B.和溶液反应的离子方程式:3222 C.和()2溶液反应的离子方程式:342-23 ()3↓+ 4↓ D. 1 L0.1·1该溶液和足量的充分反应,生成11.2g 8、对中国古代著作涉及化学的叙述,下列解读错误的是 A.《天工开物》中“凡石灰,经火焚炼用”里的“石灰”指的是()2 B.《黄白第十六》中“曾青涂铁,铁赤如铜”,“曾”青是指可溶性铜盐 C.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K23 D.《汉书》中“高奴县有洧水可燃”这里的“洧水”指的是石油 9、某温度下,将2通入溶液中,反应得到、1O、3的混合溶液,经测定,与3-的物质
2020届河北省衡水中学高三理综化学试题 7.化学与生活密切和关。下列对应关系正确的是 选项实际应用解释 A 水泥砂浆用作建筑黏合剂Na2SiO2具有黏性 B 医疗上双氧水用于伤口消毒H2O2能使蛋白质变性 C NH3用作食品加工的制冷剂NH3具有还原性 D 铝用作飞机、火箭的结构材料铝易发生钝化 8.设N A为阿伏加德罗常数的数值,下列有关叙述正确的是 A.1 mol乙醇经催化氧化生成乙醛后转移的电子数为4N A B.1molH2与1molI2(g)混合后充分反应生成的HI分子数为2N A C.30g由14C2H2和C18O组成的混合气休中含有的质子数为14N A D.25 ℃时,100 mL pH=2 的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001N A 9.三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖, 纳米分子机器日益受到关注,机器的“车轮”常用组件如下,下列说法正确的是 A.①③均能发生加成反应 B.①④互为同分异构体 C.①②③④均属于烃 D. ①②③④的一氯代物均只有1种 10.将几滴KSCN(SCN-)是“类卤离子”)溶液加入含有Fe3+的酸性溶液中,溶液变成红色。将该红色溶液分 为两份:①—份中加入适量KMnO4溶液,红色褪色②另一份中通入SO2,红色也褪色。下列推测肯定不正确的是 A. SCN-在适当条件下可失去电子被氧化为(SCN)2 B.①中红色褪去的原因是KMnO4将SCN-氧化 C.②中红色褪去的原因是SO2将Fe3+还原为Fe2+ D.②中红色褪去的原因是SO2将SCN-还原 11.下列根据实验现象得出的实验结论正确的是
1 2019-2020年位育中学高一上10月月考数学卷 一. 填空题 1. 已知集合{|22}A x x =-<<,{|1}B x x =≥-,则A B =I 2. 事件“对任意实数x 与y ,都有222x y xy +≥成立”的否定形式为 3. 已知U =R ,{|3}A x x =≤,{0,1,2,3,4,5}B =,则 图中阴影部分所表示的集合为 4. 已知集合2{|20}A x x x =-->,{|40}B x x p =+<, 且B A ?,则p 的取值范围是 5. 已知全集{1,2,3,4,5,6}U =,{2,3}M =,{1,4}N =,则集合{5,6}用含,,U M N 的集合运算式可以表示为 6. 已知U =R ,{|30}A x mx =->,若1U A ∈e,则实数m 的取值范围是 7. 不等式20ax bx c ++>的解集是1 (,3)2 -,则不等式20cx bx a ++<的解集为 8. 若不等式210ax ax --<的解集为R ,则实数a 的取值范围是 9. 已知集合2{|45}A x x x =+>,2{|0}B x x ax b =++≤,若A B =?I ,(1,6]A B =-U , 则a b += 10. 运动会时,高一某班共有28名同学参加比赛,每人至多报两个项目,15人参加游泳,
2 8人参加田径,14人参加球类,同时参加游泳和田径的有3人,同时参加游泳和球类的有3人,则只参加一个项目的有 人 11. 若x A ∈,则2x A -∈,就称A 是“对偶关系”集合,若集合{,4,2,0,2,4,6,7}a --的所有非空子集中是“对偶关系”的集合一共15个,则实数a 的取值集合为 12. 已知关于x 的不等式22232x kx k x -≤+≤-有唯一解,则实数k 的取值集合为 二. 选择题 13.“2m <”是“1m <”的( )条件 A. 充分非必要 B. 必要非充分 C. 充要 D. 既非充分也非必要 14. 下列选项是真命题的是( ) A. 若a b <,则22ac bc < B. 若a b <,c d <,则a c b d -<- C. 若0a b >>,0c d <<,则ac bd > D. 若0b a <<,则11a b < 15. 已知命题“若0a b c ++≥,则a 、b 、c 中至少有一个非负数”,则该命题的逆命题、否命题、逆否命题3个命题中为真命题的个数是( ) A. 0 B. 1 C. 2 D. 3 16. 定义{}x 为不小于x 的最小整数(例如:{5.5}6=,{4}4-=-),则不等式 2{}5{}60x x -+≤的解集为( ) A. [2,3] B. [2,4) C. (1,3] D. (1,4]
中学试题 1、下列关于离子共存或离子反应的说确的是 A.某无色溶液中可能大量存在H+、Cl-、MnO4-、A13+ B.pH = 2的溶液中可能大灰存在Na+、K+、SiO32-、Cl-、 C.Fe2+与H2O2在酸性溶液中反应:2Fe2++ H2O2+2H+==2Fe3++H2O D.稀硫酸与Ba(OH)2 溶液的反应:H++SO42- +Ba2++OH-= BaSO4+H2O 2、下列有关物质的性质与用途具有对应关系的是 A.SO2具有氧化性,可用于漂白纸浆 B.NH4HCO3受热易分解,可用作氮肥 C.Fe2(SO4)3易溶于水,可用作净水剂 D.Al2O3熔点髙,可用作耐高温材料 3、现有两瓶浓度相同的失去标签的Na2CO3和NaHCO3的无色饱和溶液,请提出简便的鉴別方法,其中不合理的是 ①用干燥的pH试纸检验,pH大的是Na2CO3 ②取同量的溶液于两支试管中,各滴入酚酞溶液,红色较深的是Na2CO3 ③取同量的溶液于两支试管中,加热.有气泡产生的是NaHCO3 ④取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3 ⑤取同量的溶液于两支试管中,滴加BaCl2溶液,生成白色沉淀的是Na2CO3 ⑥取同量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3, A.①② B.③⑥ C.④⑤ D.②⑤ 4、下列说确的是 A.足量的Fe在Cl2中燃烧只生成FeCl3 B.铁的化学性质比较活泼,它能和水蒸气反应生成H2和Fe(OH)3 C.用酸性KmnO4溶液检验FeCl3溶液中是否含有FeCl2 D.向某溶液中加NaOH溶液得白色沉淀,且颜色逐渐变为红褐色,说明该溶液中只含有Fe2+ 6、下列四种有色溶液与SO2气体作用均能褪色,其实质相同的是 ①酸性高锰酸钾溶液②品红溶液③溴水④滴有酚酞的氢氧化钠溶液 A.①③ B.②③ C.①④ D.②④ 7、下列有关Fe2(SO4)3溶液的叙述正确的是 A.该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存 B.和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2 C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42- +Ba2++3OH-= Fe(OH)3↓+ BaSO4↓ D. 1 L0.1mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe 8、对中国古代著作涉及化学的叙述,下列解读错误的是 A.《天工开物》中“凡石灰,经火焚炼用”里的“石灰”指的是Ca(OH)2 B.《黄白第十六》中“曾青涂铁,铁赤如铜”,“曾”青是指可溶性铜盐 C.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3 D.《汉书》中“高奴县有洧水可燃”这里的“洧水”指的是石油 9、某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaC1O、NaClO3的混合溶液,经测定,ClO-与ClO3-的物质的量浓度之比为1:3,则此反应中被还原的氯元素与被氧化的氯元素原子的物质的量之比是 A. 1: 4 B. 11:3 C. 3:1 D.4:1 10、下列说法中不正确的有 ①卤素单质从上到下熔沸点逐渐升高,碱金属单质从上到下熔沸点逐渐降低
2019-2020年位育中学高一上10月月考数学卷 一. 填空题 1. 已知集合,,则 {|22}A x x =-<<{|1}B x x =≥-A B =I 2. 事件“对任意实数与,都有成立”的否定形式为 x y 222x y xy +≥3. 已知,,,则 U =R {|3}A x x =≤{0,1,2,3,4,5}B = 图中阴影部分所表示的集合为 4. 已知集合,, 2{|20}A x x x =-->{|40}B x x p =+<且,则的取值范围是 B A ?p 5. 已知全集,,,则集合用含的集合{1,2,3,4,5,6}U ={2,3}M ={1,4}N ={5,6},,U M N 运算式可以表示为 6. 已知,,若,则实数的取值范围是 U =R {|30}A x mx =->1U A ∈em 7. 不等式的解集是,则不等式的解集为 20ax bx c ++>1 (,3)2 -20cx bx a ++<8. 若不等式的解集为,则实数的取值范围是 210ax ax --
一、选择题:本大题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生活密切相关,下列有关说法错误的是 A.用灼烧的方法可以区分蚕丝和人造纤维 B.食用油反复加热会产生稠环芳香烃等有害物质 C.加热能杀死流感病毒是因为蛋白质受热变性 D.医用消毒酒精中乙醇的浓度为95% 【答案】D 【解析】 试题分析:A、蚕丝的主要成分是蛋白质,蛋白质灼烧能产生烧焦羽毛的气味,可以区别蚕丝和人造纤维,A正确;B、食用油反复加热发生化学变化,从而产生稠环芳香烃等有害物质,B 正确;C、高温能使蛋白质发生变性,从而杀菌消毒,C正确;D、医用消毒酒精中乙醇的浓度为75%,D错误,答案选D。 考点:考查化学与生活的判断 8.设N A为阿伏加德罗常数值。下列有关叙述正确的是 A.14 g乙烯和丙烯混合气体中的氢原子数为2N A B.1 molN2与4 mol H2反应生成的NH3分子数为2N A C.1 molFe溶于过量硝酸,电子转移数为2N A D.标准状况下, LCCl4含有的共价键数为 【答案】A 考点:考查阿伏加德罗常数计算 9.下列关于有机化合物的说法正确的是 A.2-甲基丁烷也称异丁烷 B.由乙烯生成乙醇属于加成反应 C.C4H9Cl有3种同分异构体 D.油脂和蛋白质都属于高分子化合物 【答案】B 【解析】
试题分析:甲基丁烷也称异戊烷,A 错误;B.乙烯与水发生加成反应生成乙醇,B 正确;有4种同分异构体,C 错误;D.油脂不是高分子化合物,D 错误,答案选B 。 考点:考查有机物结构和性质判断 10.下列实验操作能达到实验目的的是 A .用长颈漏斗分离出乙酸与乙醇反应的产物 B .用向上排空气法收集铜粉与稀硝酸反应产生的NO C .配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 D .将Cl 2与HCl 混合气体通过饱和食盐水可得到纯净的Cl 2 【答案】C 【解析】 试题分析:A.用分液漏斗分离出乙酸与乙醇反应的产物乙酸乙酯,A 错误;的密度与空气接近,且能与氧气反应生成NO 2,所以用排水法收集,B 错误;C.铁离子水解,溶液显酸性,因此配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释,C 正确;D.将Cl 2与HCl 混合气体通过饱和食盐水只能除去氯气,但不能除去水蒸气,不能得到纯净的Cl 2,D 错误,答案选C 。 考点:考查化学实验基本操作 11.三室式电渗析法处理含Na 2SO 4废水的原理如图所示,采用惰性电极,ab 、cd 均为离子交换膜,在直流电场的作用下,两膜中间的Na +和SO 42- 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。 下列叙述正确的是 A .通电后中间隔室的SO 42-离子向正极迁移,正极区溶液pH 增大 B .该法在处理含Na 2SO 4废水时可以得到NaOH 和H 2SO 4产品 C .负极反应为2 H 2O –4e –=O 2+4H +,负极区溶液pH 降低 D .当电路中通过1mol 电子的电量时,会有的O 2生成 【答案】B 考点:考查电解原理的应用 12.298K 时,在 1L -?氨水中滴入 mol 1L -?的盐酸,溶液的pH 与所加盐酸的体积关系如图所示。已知 mol 1L -?氨水的电离度为%,下列有关叙述正确的是
上海市位育中学2021届高三下学期开学考试数学试题 学校:___________姓名:___________班级:___________考号:___________ 一、填空题 1.行列式1 23 4 56789 中,6的代数余子式的值是______. 2.若抛物线2 14 y x =上一点M 到焦点F 的距离为4,则点M 的纵坐标的值为___________ 3 .设{} A x x k ==∈N ,{}|5, B x x x =≤∈Q ,则A B =________. 4.若复数z 满足(34)|(2)(12)|i z i i -=+-(其中i 为虚数单位),则z 的虚部是___________. 5 .函数y = ___________. 6..“沃尔玛”商场在国庆“62”黄金周的促销活动中,对10月2日9时至14时的销售额进行统计,其频率分布直方图如右下图所示.已知9时至10时的销售额为2.5万元,则11时至12时的销售额为________万元. 7.关于x 的方程23 lg 4a x a += -有大于1的实数根,则实数a 的取值范围是_________. 8.空间中一条线段在三视图中的长度分别为5 则该线段的长度为______. 9.某学校组织劳动实习,其中两名男生和两名女生参加农场体验活动,体验活动结束后,农场主人与四名同学站一排合影留念.已知农场主人站在中间,两名男生不相邻,则不同的站法共有______种. 10.已知1a ?2a 与1b ?2b 是4个不同的实数,若关于x 的方程
121||||||+x a x a x b -+-=-2||x b -的解集A 不是无限集,则集合A 中元素的个数构 成的集合为___________. 11.如图,已知4AC =,B 为AC 的中点,分别以AB ?AC 为直径在AC 的同侧作半圆,M ?N 分别为两半圆上的动点(不含端点A ?B ?C ),且0BM BN ?=,则 AM CN ?的最大值为___________. 12.已知函数()f x 对于任意实数x ,都有 ()(398)(2158)(3214)f x f x f x f x =-=-=-,则函数值(0)f ,(1)f ,(2)f ,???, (2020)f 中最多有___________个不同的数值 二、单选题 13.如果正数a b c d ,,,满足4a b cd +==,那么( ) A .ab c d ≤+,且等号成立时a b c d ,,,的取值唯一 B .ab c d ≥+,且等号成立时a b c d ,,,的取值唯一 C .ab c d ≤+,且等号成立时a b c d ,,,的取值不唯一 D .ab c d ≥+,且等号成立时a b c d ,,,的取值不唯一 14.“数列{}n a 和数列{}n b 极限都存在”是“数列{}n n a b +和数列{}n n a b -极限都存在”的( )条件 A .充分非必要 B .必要非充分 C .充分必要 D .非充分非必要 15.在ABC 中,若sin A =cos B C 的取值范围是( ) A .(0,1] B .(0,1] (2,5] C .3 (0,1] ( 2,5]2 D .以上答案都不对 16.已知数列{} n a 为有穷数列,共95项,且满足200200n n n n a C -=,则数列{}n a 中的整数项的个数为( ) A .13 B .14 C .15 D .16 三、解答题
位育中学2015学年第一学期期终考试试卷 高 一 历 史 一、选择题(共30题,每小题2分,共60分,每题只有一个正确选项) 1、被古希腊人称为“美索不达米亚“的地方位于今天的 A.伊朗 B.伊拉克 C.印度 D.沙特阿拉伯 2. 世界上保存到今天最早的成文法典诞生于 A. 尼罗河流域 B. 印度河流域 C. 两河流域 D.印度、恒河流域 3.文学是西方文化的主要载体,其源头可追溯到古代世界,下列选项中,对西方文化产生重要影响的是 A .《大藏经》、《荷马史诗》 B .《旧约全书》、《古兰经》 C .《荷马史诗》、《旧约全书》 D .《古兰经》、《荷马史诗》 4. 右图为考古学家对一种古老文字的破译,这种古文字应是 A. 甲骨文 B. 象形文字 C. 拉丁文字 D. 希腊字母 5. 在早期人类文明的形成过程中,地理环境的作用不可小觑。以下地图中,哪张地图所反映的地理环境对人类早期民主政治的产生起到了重要影响 班级_____________ 姓名_________________ 考号_____________
6.公元前6世纪,释迦牟尼创立了佛教,佛教的诞生地在 A. 南亚次大陆 B.两河流域地区 C.小亚细亚 D.黄河流域地区 7.古代雅典民主制的开创者是: A .梭伦 B .克里斯提尼 C .希罗多德 D .伯里克利 8. “如果在夜里行窃的人被人当场杀死,则这种杀人的行为被认为是合法的。”“十二铜表法”中以上的规定反映的实质是 A. 鼓励同态复仇 B. 实行有罪推定 C. 宽恕暴力行径 D. 保护公民私产 9.标志着西欧古代历史终结的时间和事件是 A.公元前27年,罗马帝国的建立 B.公元395年,罗马帝国的分裂 C.公元476年,西罗马帝国的灭亡 D.公元1453年,东罗马帝国灭亡 10.西欧中世纪庄园中设有教堂、法庭等。对此,最合理的解释是 A.庄园是自给自足的经济实体 B.庄园是农村基本的经济组织 C.庄园是农村基本的社会组织 D.庄园是领主统治农奴的工具 11.自13世纪下半叶起,英.法相继出现了如下图所反映的新权力结构。这一结构当是: A .封建等级制 B .等级君主制 C .君主专制 D .君主立宪制 12. “任何伯爵或男爵……等直接领有采邑之人身故时,如已有达成年之继承者,于按照旧时数额缴纳继承税后,即可享有其遗产。”——1215年《自由大宪章》 教皇 国王 城市市民 教会 贵族 世俗贵族
2013年普通高等学校招生全国统一考试(新课标I)(化学部分) 可能用到的相对原子质量:H1C12N14O16Mg24 S32K39Mn55 7.化学无处不在,下列与化学有关的说法不正确 ...的是() A.侯氏制碱法的工艺过程中应用了物质溶解度的差异 B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 C.碘是人体必需微量元素,所以要多吃富含高碘酸的食物D.黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成 【答案】C 【解析】C选项,应多吃富含碘元素的食物,如KIO3。高碘酸为强酸,对人体有很强的腐蚀性。 8.香叶醇是合成玫瑰香油的主要原料,其结构简式如下:下列有关香叶醇的叙述正确的是() A.香叶醇的分子式为C10H18OB.不能使溴的四氯化碳溶液褪色 C.不能使酸性高锰酸钾溶液褪色D.能发生加成反应不能发生取代反应 【答案】A 【解析】根据碳原子的四价原则补齐氢原子,直接查出C、H的原子个数,A选项正确;该有机物分子中含有碳碳双键,B、C选项错误;含有甲基、醇羟基,所以可以发生取代反应,D选项错误。 9.短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是() A.W2-、X+B.X+、Y3+C.Y3+、Z2-D.X+、Z2- 【答案】C 【解析】A选项W在X的上一周期,所以X为第3周期,分别为O、Na;B选项X可能为Li或Na、Y可均为Al;D选项X可能为Li或Na、Z可能为O或S;上述选项中的Na+均不
影响水的电离平衡;C 选项Y 只能为Al 、Z 只能为S ,Al 3+ 、S 2-均影响水的电离平衡。 10.银质器皿日久表面会逐渐变黑,这是生成了Ag 2S 的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是( ) A .处理过程中银器一直保持恒重 B .银器为正极,Ag 2S 被还原生成单质银 C .该过程中总反应为2Al +3Ag 2S===6Ag +Al 2S 3 D .黑色褪去的原因是黑色Ag 2S 转化为白色AgCl 【答案】B 【解析】由“电化学原理”可知正极反应式为Ag 2S +2e -===2Ag +S 2-,负极反应式为Al -3e -===Al 3+;电解质溶液中发 生反应Al 3++3H 2O Al(OH)3+3H +,S 2-与H +结合生成H 2S ,使Al 3++3H 2O Al(OH)3+3H +的平衡右移,最终生成Al(OH)3沉淀,只有B 选项正确。 11.已知K sp (AgCl)=1.56×10-10,K sp (AgBr)=7.7×10-13, K sp (Ag 2CrO 4)=9.0×10-12。某溶液中含有Cl -、Br -和2 4CrO -,浓 度均为0.010mol·L -1,向该溶液中逐滴加入0.010mol·L -1的 AgNO 3溶液时,三种阴离子产生沉淀的先后顺序为( ) A .Cl -、Br -、24CrO - B .24 CrO -、Br -、Cl - C .Br -、Cl -、24CrO -D .Br -、24 CrO -、Cl - 【答案】C 【解析】因为溶液中Cl -、Br -、2 4CrO -浓度相同,假设滴加 AgNO 3溶液的过程中混合液中Cl -、Br -、2 4CrO -浓度不变,均为 0.010mol·L -1,则开始生成AgCl 、AgBr 、Ag 2CrO 4沉淀时溶液中 c (Ag +)浓度分别为 1.56×10-8mol·L -1、7.7×10-11mol·L -1、3.0×10-5mol·L -1,所以首先沉淀的是AgBr ,最后沉淀的是Ag 2CrO 4。 12.分子式为C 5H 10O 2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有 ( ) A .15种 B .28种 C .32种 D .40种 【答案】D 【解析】属于C 5H 10O 2的酯水解可生成的酸有甲酸、乙酸、
2014学年第二学期位育中学零次考试 高三数学试题 一、填空题(每题4分,共56分) 1.(理) 在极坐标系中,直线与直线的夹角大小为. (文) 为虚数单位,复数的虚部是_________. 2.设函数若函数存在两个零点,则实数的取值范围是_________.3.若,则方程的解为___________. 4.已知虚数、满足和(其中),若,则. 5. 在由数字0、1、2、3、4、5所组成的没有重复数字的四位数中任取一个数,该数能被5 整除的概率 是 . 6.已知正方形的四个顶点分别为,,,,点分别在线段上运动,且 ,设与交于点,则点的轨迹方程是_______. 7.已知是双曲线右支上的一点,、分别是圆和上的点,则的最大值等于. 8.已知数列{}的通项公式为,则+++的最简表达式为 __________________. 9 .平面的斜线交于点,过定点的动直线与垂直,且交于点,则动点的轨迹是 _________________. 10.祖暅原理对平面图形也成立,即夹在两条平行线间的两个平面图形被任意一条平行于这两条直线的直线截得的线段总相等,则这两个平面图形面积相等.利用这个结论解答问题:函数、与直线 所围成的图形的面积为_______. 11.对于任意正整数,定义“n的双阶乘n!!”如下:对于n是偶数时, n!!=n·(n-2)·(n-4)……6×4×2;对于n是奇数时,n!!=n·(n-2)·(n-4)……5×3×1. 现有如下四个命题:①(2013!!)·(2014!!)=2014!;②2014!!=21007·1007!;③2014!!的个位数是0;④2015!!的个位数不是5.正确的命题是________.
衡水中学2018年高三年级化学试卷 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分。考试时间110分钟。原子量:H:1 C:12 S:32 O:16 Na:23 Fe:56 Al:27 I:127 Cu:64 一、选择题(下列每小题所给选项只有一个选项符合题意,每小题1分,共10分。) 1.有四种晶体,其离子排列方式如下图所示,其中化学式不属AB型的是() 2.氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是()A.AlON和石英的化学键类型相同 B.AlON和石英晶体类型相同 C.AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同 D.AlON和(工业上通过电解法制备铝用的)Al2O3晶体类型相同 3.元素周期表中铋元素的数据见右图,下列说法正确的是() A.Bi元素的质量数是209 B.Bi元素的相对原子质量是209.0 C.Bi原子6p亚层(能级)有一个未成对电子 D.Bi原子最外层有5个能量相同的电子 4.“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。下列说 法与“低碳经济”不符合 ...的是 A.大力研发新型有机溶剂替代水作为萃取剂 B.加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率 C.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 D.甲烷和乙醇的燃烧热分别是891.0 kJ·mol-1、1366.8 kJ·mol-1,利用甲烷更“低碳” 5、在中学化学实验中使用的玻璃、陶瓷等仪器,在实验操作中不能承受温度的急剧变化,否 则会引起安全事故。下列实验操作过程不是基于上述原因的是() A、用排水法收集气体后,先移出导气管,后熄灭酒精灯 B、在用二氧化锰和浓盐酸制氯气时,在加入二氧化锰后应首先加入浓盐酸,然后再点燃酒 精灯 C、在用固体氯化铵和氢氧化钙制取氨气结束后,将大试管从铁架台上取下置于石棉网上冷
高考全国卷理综化学试 题解析版 Coca-cola standardization office【ZZ5AB-ZZSYT-ZZ2C-ZZ682T-ZZT18】
一、选择题:本大题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生活密切相关,下列有关说法错误的是 A.用灼烧的方法可以区分蚕丝和人造纤维 B.食用油反复加热会产生稠环芳香烃等有害物质 C.加热能杀死流感病毒是因为蛋白质受热变性 D.医用消毒酒精中乙醇的浓度为95% 【答案】D 【解析】 试题分析:A、蚕丝的主要成分是蛋白质,蛋白质灼烧能产生烧焦羽毛的气味,可以区别蚕丝和人造纤维,A正确;B、食用油反复加热发生化学变化,从而产生稠环芳香烃等有害物质,B正确;C、高温能使蛋白质发生变性,从而杀菌消毒,C正确;D、医用消毒酒精中乙醇的浓度为75%,D错误,答案选D。 考点:考查化学与生活的判断 8.设N A为阿伏加德罗常数值。下列有关叙述正确的是 A.14 g乙烯和丙烯混合气体中的氢原子数为2N A B.1 molN 2与4 mol H 2 反应生成的NH 3 分子数为2N A C.1 molFe溶于过量硝酸,电子转移数为2N A D.标准状况下, LCCl 4 含有的共价键数为【答案】A 考点:考查阿伏加德罗常数计算 9.下列关于有机化合物的说法正确的是
A.2-甲基丁烷也称异丁烷 B.由乙烯生成乙醇属于加成反应 C.C 4H 9 Cl有3种同分异构体 D.油脂和蛋白质都属于高分子化合物 【答案】B 【解析】 试题分析:甲基丁烷也称异戊烷,A错误;B.乙烯与水发生加成反应生成乙醇,B 正确;有4种同分异构体,C错误;D.油脂不是高分子化合物,D错误,答案选B。 考点:考查有机物结构和性质判断 10.下列实验操作能达到实验目的的是 A.用长颈漏斗分离出乙酸与乙醇反应的产物 B.用向上排空气法收集铜粉与稀硝酸反应产生的NO C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 D.将Cl 2与HCl混合气体通过饱和食盐水可得到纯净的Cl 2 【答案】C 【解析】 试题分析:A.用分液漏斗分离出乙酸与乙醇反应的产物乙酸乙酯,A错误;的密度与空气接近,且能与氧气反应生成NO 2 ,所以用排水法收集,B错误;C.铁离子水解,溶液显酸性,因此配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加 水稀释,C正确;D.将Cl 2 与HCl混合气体通过饱和食盐水只能除去氯气,但不能 除去水蒸气,不能得到纯净的Cl 2 ,D错误,答案选C。 考点:考查化学实验基本操作 11.三室式电渗析法处理含Na 2SO 4 废水的原理如图所示,采用惰性电极,ab、cd 均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO 4 2-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
位育中学高三期中数学试卷 2020.11 一. 填空题 1. 设集合{|12}A x x =-≤≤,{|04}B x x =≤≤,则A B = 2. 计算:1lim 31 n n n →∞-+=- 3. 已知复数z i =,i 为虚数单位,则z = 4. 已知函数3y x =,则此函数的反函数是 5. 已知x 、y 满足202300x y x y y +-≥??+-≤??≥? ,则2z y x =-的最大值为 6. 已知行列式129300 a b c d =,则a b c d = 7. 某单位现有职工52人,将所有职工编号,用系统抽样的方法抽取一个容量为4的样本, 已知6号、32号、45号职工在样本中,则另一个在样本中的职工编号为 8. 已知数列{}n a 是无穷等比数列,其前n 项和记为n S ,若233a a +=,3432a a +=,则 lim n n S →∞ = 9. 在停课不停学期间,某校有四位教师参加三项不同的公益教学活动,每位教师任选一项, 则每个项目都有该校教师参加的概率为 (结果用数值表示) 10. 已知1F 、2F 是椭圆22 2:1(3 x y C a a +=>的左、右焦点,过原点O 且倾斜角为60° 的直线与椭圆C 的一个交点为M ,若1212||||MF MF MF MF +=-,则椭圆C 的长轴长为 11. 已知点M 、N 在以AB 为直径的圆上,若5AB =,3AM =,2BN =,则AB MN ?= 12. 已知球O 是三棱锥P ABC -的外接球,2PA AB BC CA ==== ,PB =点D 为 BC 的中点,且PD =O 的体积为 二. 选择题 13. 下列不等式恒成立的是( ) A. 222a b ab +≤ B. 222a b ab +≥- C. 22a b +≥ D. 22a b +≥-
上海位育中学六年级上学期英语10月抽考 1.The students are_______about their future in the classr oom. A.talking B.telling C.saying 2.Alice was born_________2019. A.in B.on C.at 3.__________Shanghai is___________biggest city in Chin a. A.The,the B./,the C./,a 4.I was so hungry that I ate two_________. A.bowls of noodle B.bowls of noodles C.bowl of noodles 5.Sophie went to the gym________Wednesday evening. A.in B.on C.at 6.The boys sometimes play_________basketball after school. A./ B.with C.the 7.His ice-cream is as__________as yours. A.big B.bigger C.biggest 8.They enjoyed_________at the party. A.themselves B.them C.theirselves 9.-----_________I do it now? -----No,you__________. A.Must,mustn’t B.Must,can’t C.Must,needn’t 10.Mom read a story for me__________I went to sleep. A.after B.before C.behind 11.This room is__________. A.Tom and Tim B.Tom’s and Tim’s C.Tom and Tim’s 12.There’s_________milk in the fridge.I’ll go and buy s ome.
全国统一高考化学试卷(新课标Ⅱ)及答案可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23 S 32 Cl 35.5 As 75 I 127 Sm 150 一、选择题:本题共7个小题,每小题6分。共42分,在每小题给出的四个选项中,只有 一项是符合题目要求的。 7.“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是 A.蚕丝的主要成分是蛋白质 B.蚕丝属于天然高分子材料 C.“蜡炬成灰”过程中发生了氧化反应 D.古代的蜡是高级脂肪酸酯,属于高分子聚合物 8.已知N A是阿伏加德罗常数的值,下列说法错误的是 A.3 g 3He含有的中子数为1N A B.1 L 0.1 mol·L?1磷酸钠溶液含有的3 4 PO 数目为0.1N A C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N A D.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13N A 9.今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z 为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是 A.原子半径:W B 将镁条点燃后迅速伸入集满CO2的集气 瓶集气瓶中产生浓烟并有黑色颗粒产 生 C 向盛有饱和硫代硫酸钠溶液的试管中滴 加稀盐酸 有刺激性气味气体产生,溶液变浑浊 D 向盛有FeCl3溶液的试管中加过量铁粉, 充分振荡后加1滴KSCN溶液黄色逐渐消失,加KSCN后溶液颜色 不变 11.下列化学方程式中,不能正确表达反应颜色变化的是 A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失:Zn+CuSO4Cu+ZnSO4 B.澄清的石灰水久置后出现白色固体:Ca(OH)2+CO2CaCO3↓+H2O C.Na2O2在空气中放置后由淡黄色变为白色:2Na2O22Na2O+O2↑ D.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀: 3Mg(OH)2+2FeCl32Fe(OH)3+3MgCl2 12.绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是 A.图中a和b分别为T1、T2温度下CdS在水中的溶解度 B.图中各点对应的K sp的关系为:K sp(m)=K sp(n)