
全国化学竞赛初赛讲义——晶体结构
汕头市潮阳第一中学 谢新民 xxmmy@https://www.doczj.com/doc/1a7550996.html,
【初赛要求】
晶胞。原子坐标。晶格能。晶胞中原子数或分子数的计算及化学式的关系。分子晶体、原子晶体、离子晶体和金属晶体。配位数。晶体的堆积与填隙模型。常见的晶体结构类型,如NaCl 、CsCl 、闪锌矿(ZnS )、萤石(CaF 2)、金刚石、石墨、硒、冰、干冰、尿素、金红石、钙钛矿、钾、镁、铜等。点阵的基本概念。
1.晶胞
晶体的外表特征是有一定的、整齐的、有规则的凸多面体外形。晶体的这种外形是晶体中的原子在微观空间里呈周期性整齐排列的结果,为了表达晶体的微观结构,可以从晶体的微观空间中取出一个基本单位,这种基本单位通常是一个平行六面体(如果只研究二维平面则取平行四边形),称为晶胞。晶胞是晶体微观结构的代表物,这就决定了:一个晶胞的上下左右前后都有与之完全无隙且并置的形状与内容完全相同的晶胞,或者说整个晶体就是晶胞按一定方式并置而成的。晶胞是晶体中最小的结构单元,但不是最基本的实体,最基本的实体可以看成是原子、分子、离子或原子团。
简而言之,晶胞是晶体中最小的结构单元,它是一个平行六面体,它按一定方式并置就可以得到整个晶体。
晶胞的最基本特征:
【问题与思考】下图中的氯化钠晶胞和金刚石晶胞是分别指实线的小立方体还是虚线的大立方体?
【分析与归纳】作为晶胞最基本的特征就是顶角、棱、面之间的无差别性,或者说从一个晶胞平移到另一个晶胞,不会察觉是否平移过了。因此上图中的实线小立方体不是氯化钠晶胞和金刚石的晶胞,因为它们的顶角不同,图中的虚线大立方体才是。
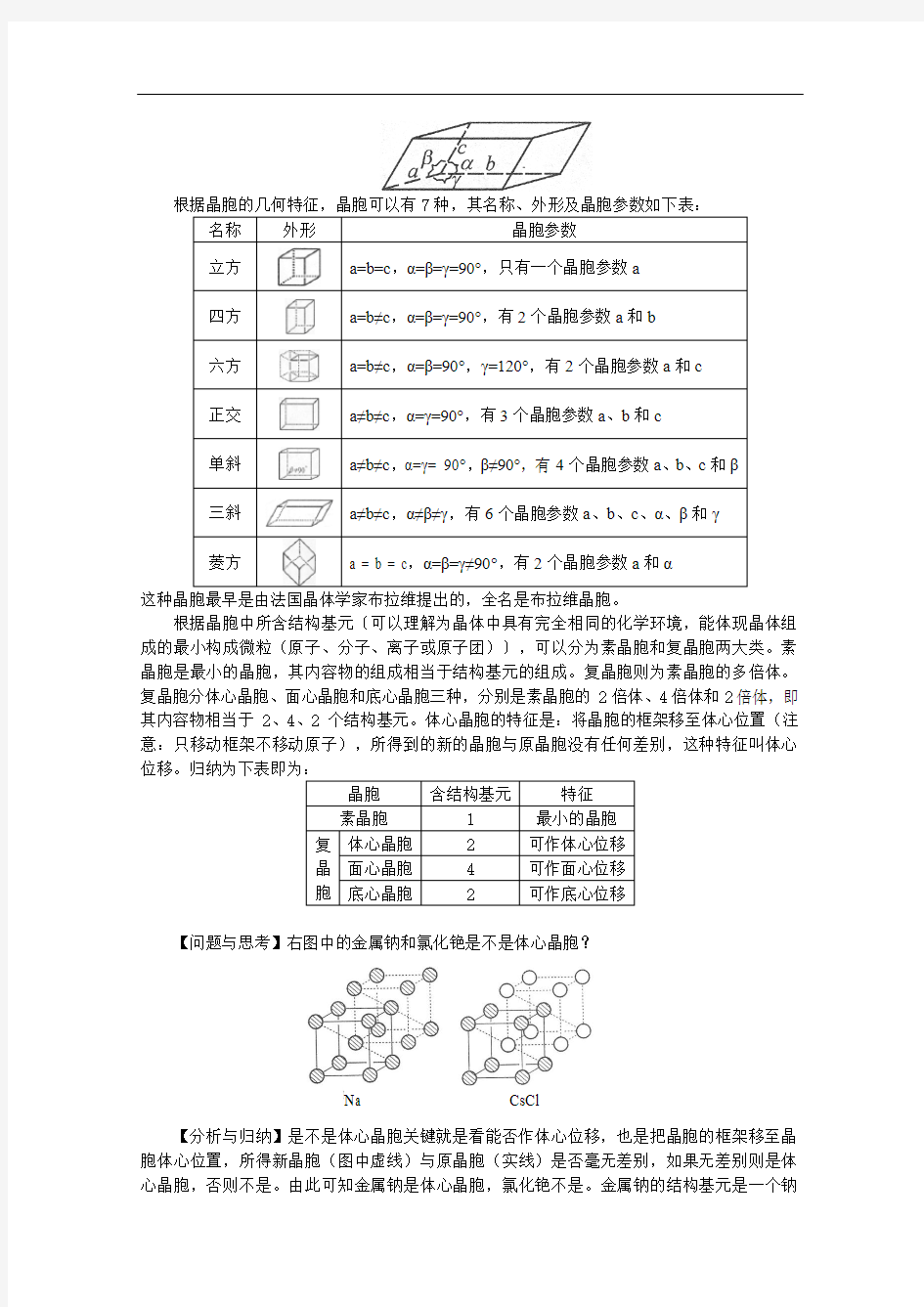
晶胞有两个基本要素:一是晶胞的大小和形状,二是晶胞的内容(晶胞中有哪些微粒以及它们在晶胞中的分布位置)。
晶胞的大小和形状可用晶胞参数来描述。晶胞的边长a 、b 、c 及它们之间的夹角α、β、γ就规定了晶胞的大小和形状,这些总称晶胞参数(符号定义如下图所示)。
顶角(8个):每个顶角为8个晶胞共用,8个顶角无任何差别。 棱(12条):每条棱为4个晶胞共用,互相平行的棱无任何差别。 面(6个):每个面为2个晶胞共用,互相平行的面无任何差别。 晶胞
这种晶胞最早是由法国晶体学家布拉维提出的,全名是布拉维晶胞。
根据晶胞中所含结构基元〔可以理解为晶体中具有完全相同的化学环境,能体现晶体组成的最小构成微粒(原子、分子、离子或原子团)〕,可以分为素晶胞和复晶胞两大类。素晶胞是最小的晶胞,其内容物的组成相当于结构基元的组成。复晶胞则为素晶胞的多倍体。复晶胞分体心晶胞、面心晶胞和底心晶胞三种,分别是素晶胞的2倍体、4倍体和2倍体,即其内容物相当于2、4、2个结构基元。体心晶胞的特征是:将晶胞的框架移至体心位置(注意:只移动框架不移动原子),所得到的新的晶胞与原晶胞没有任何差别,这种特征叫体心
【问题与思考】右图中的金属钠和氯化铯是不是体心晶胞?
【分析与归纳】是不是体心晶胞关键就是看能否作体心位移,也是把晶胞的框架移至晶胞体心位置,所得新晶胞(图中虚线)与原晶胞(实线)是否毫无差别,如果无差别则是体心晶胞,否则不是。由此可知金属钠是体心晶胞,氯化铯不是。金属钠的结构基元是一个钠
Na CsCl
原子,一个钠晶胞中有2个钠原子,因此它是一个复晶胞(含2个结构基元);氯化铯的结构基元是1Cs ++1Cl -,一个晶胞中含一个Cs +和一个Cl -,为素晶胞。
【问题与思考】右图中干冰晶胞是不是面心晶胞?
【分析与归纳】干冰不是面心晶胞,因为干冰晶体中的CO 2分子存在4种不同取向(3对面心和顶角的CO 2分子取向各不相同),若将晶胞的框架移至任何一个面心位置,得到的新晶胞中氧原子的位置将与原晶胞中氧原子的位置不同,该晶胞不具有面心位移的特征,因此不是面心晶胞,而是一个素晶胞。
晶胞中所含微粒的位置可用向量xa +yb +zc 中的(x 、y 、z )三数组(也叫原子坐标或原子的分数坐标)来表示,a 、b 、c 是晶胞的边长,x 、y 、z 是大于或等于零小于1的数。用这种方法描述晶胞内容时,分数坐标的组数应与晶胞中的微粒数相同。例如下图NaCl 晶胞中(大球为Cl -,小球为Na +),有4个Cl -和4个Na +,故原子的分数坐标为:
Na +:(0,0,0),(1/2,1/2,0),(1/2,0,1/2),(0,1/2,1/2)
Cl -:(1/2,0,0),(0,1/2,0),(0,0,1/2),(1/2,1/2,1/2)
通常按晶体微观结构中存在的化学物种及其相互作用力的类型将晶体分为金属晶体、离子晶体、分子晶体和原子晶体4种基本类型,分述如下。
2.金属晶体
金属及其合金一般形成以金属键为作用力的金属晶体。金属键是一种遍布整个晶体的离域键。典型的金属晶体可以看作是等径圆球的堆积。考察堆积的方式和圆球堆积在空间留余的空隙的理论被称为堆积模型。最基本的金属晶体有如下3种:
2.1 六方最密堆积和面心立方最密堆积
等径圆球在同一平面内的最密排列只有一种方式,称为等径圆球密置层。在密置层中每个球都与6个球相接触,并在周围形成6个空隙,每个空隙由3个球围成,所以,由N 个球组成的密置层中,有N ×6×1/3个空隙(6即每个球周围有6个空隙,3即空隙由几个球所围成,也就是该球占每个空隙的多少)。两个密置层组成的最密堆积称为密置双层,为了保持最密堆积必须将第二层的凸部位正好放在第一层的空隙处,但只用去了一半的空隙,另一半仍然空着,如下图(1),这种结构也是唯一的。但此时密置双层结构中原来由三个相邻球围成的空隙已经分化为两种:一种是由3个A 球(第一层)与1个B 球(第二层)或3个B 球与1个A 球所围成的正四面体空隙(连接这4个球的球心得一正四面体);另一种空隙由3个A 球和3个B 球所组成,两层球得投影位置相互错开60 ,这种球围成的空隙称为八面体空隙(连接6个球得球心得 一正八面体)。在这种蜜置双层结构中,球数:八面体空隙:四面体空隙=2:1:2。在蜜置双层之上第三层的放法有两种:一种是第三层中的每个球正对着第一层,即放在1个A 和3个B 围成的正四面体空隙之上,第四层正对着第二层、堆积方式按ABAB ……重复下去,如下图(2)所示,在这种堆积中可以找出六方的晶胞,因此称为六方最密堆积,下图(3)为晶胞形式。另一种是第三层中的每个球落在蜜置双层的正八面体空隙之上,投影
a b c
位置与前两层都不重合,第四层正对着第一层,第五层正对着第二层,堆积方式按ABC ABC ABC ……重复下去,如下图(5)所示,在这种堆积中可以找出面心立方的晶胞,因此称为面心立方最密堆积,下图(6)为晶胞形式。
这两种堆积方式中每个球周围最接近的球数(配位数)都为12个,故配位数为12,球数:八面体空隙:四面体空隙=1:1:2,空间利用率(晶胞中球的总体积与晶胞体积的百分比)都是74.05%,空间利用率最高,因而在堆积前常冠以“最密”的修饰词。金属镁的结构即为六方最蜜堆积,因此六方最蜜堆积也称为镁型。金属铜的结构即为面心立方最蜜堆积,因此把面心立方最蜜堆积称为铜型。
2.2 体心立方蜜堆积
体心立方蜜堆积不是最蜜堆积,其结构如下图所示,在这种堆积中可以找出体心立方的晶胞,因此称为体心立方蜜堆积,注意无“最”字。
在这种堆积方式中每个球有8个最近的球配位,因此配位数为8,空间利用率为68.02%。金属钠、钾的结构即为体心立方蜜堆积,因此体心立方蜜堆积又称为钾型。
对金属晶体结构测定的结果表明,绝大多数金属单质晶体都采用六方、面心立方最蜜堆积和体心立方蜜堆积。有的金属的晶体晶体结构类型不止一种。如铁等。有的p 区金属为“半金属”,甚至有非金属的晶型,如锗和锡均有与金刚石相同的晶体结构。同质异晶在晶体学中是一种常见的现象,不限于金属晶体。同质异晶的相互转化条件有温度与压力不等。
3.离子晶体
离子晶体是由带正、负电的原子或者原子团通过静电引力相互作用形成的晶体。正负离子间的化学作用力叫做离子键。显然,离子晶体中离子间的作用力不能单单考虑一对正负离子,而应考虑所有离子之间的静电引力与斥力的总和。基于这种考虑形成了晶格能的概念,它是指将l 摩离子晶体里的正负离子完全气化而远离所需要吸收的能量。晶格能大小、
影响着
(1)圆球的蜜堆积(投影) (2)六方最蜜堆积图示 (3)六方晶胞 (5)面心立方最蜜堆积图示
(6)面心立方晶胞
(4)六方最蜜堆积中的空隙● (7)面心立方最蜜堆积中的空隙● (1)体心立方蜜堆积图示
(2)体心立方晶胞 (3)体心立方蜜堆积中的空隙●
离子晶体的熔点、硬度以及在水中的溶解度、溶解热等性质,但离子晶体在水中的溶解热不但与晶体中离子克服晶格能进入水中吸收的能量有关,还与离子水化放出的能量有关。
从静电作用的特点及正、负离子的电子云一般都具有球对称的事实可知,离子键与金属键一样是没有方向性和饱和性的。离子键向空间立体方向发展即导致离子晶体的形成。因此,离子晶体的结构可以归结为不等径圆球的蜜堆积问题。一般情况下,负离子半径较大,正离子较小,所以,可把负离子看作大球按一定方式进行等径圆球蜜堆积,正离子看作小球则填在负离子所形成的空隙中。由负离子形成的空隙称为负离子配位多面体。常见的空隙或配位多面体的类型有:正方体、正八面体、正四面体等。
形成稳定晶体结构的条件是:正、负离子相互接触,配位数尽可能地高。离子晶体中的配位数常指阳离子周围最接近的阴离子数和阴离子周围最接近的阳离子数。
离子晶体的结构型式是多种多样的,而且有的很复杂,但它们的结构一般都可归结为一些简单的结构型式及其变形,下图给出AB n型二元离子晶体的6种有代表性的典型结构型式。
-
r
0.732)
在NaCl晶体中,Cl-作面心立方堆积,Na+填充在正八面体空隙中,八面体空隙已全部被填满,四面体空隙全部空着,正、负离子的配位数都为6。
3.2 CsCl型(0.732≤
-
+
r
r
<1.000)
在CsCl晶体中,Cl-作简单立方堆积,8个Cl-堆积成一个正方体,Cs+填充在正方体空隙中,所有空隙都被Cs+占据,正、负离子的配位数都为8。
3.3 立方ZnS型(0.224≤
-
+
r
r
<0.414)
在立方ZnS晶体中,S2-作立方面心密堆积,Zn2+占据正四面体空隙,还有一半的四面体空隙和全部的八面体空隙未被填充。正、负离子的配位数都为4。
3.4 六方ZnS型(0.224≤
-
+
r
r
<0.414)
在六方ZnS晶体中,S2-作六方密堆积,Zn2+占据正四面体空隙,还有一半的四面体空隙和全部的八面体空隙未被填充。正、负离子的配位数都为4。
3.5 CaF2型(0.732≤
-
+
r
r
<1.000)
在CaF2晶体中,F-作简单立方堆积,8个F-堆积成一个正方体,Ca2+填充了一半的正方体空隙,Ca2+的配位数都为8,F-的配位数都为4。
NaCl型●Cl-ΟNa+CsCl型●Cl-ΟCs+立方ZnS型●Zn2+ΟS2-
或闪锌矿(β-ZnS)型
CaF2型●Ca2+ΟF-金红石(TiO2)型●Ti4+ΟO2-
3.6 TiO 2 型(0.414≤-+r r
<0.732)
在TiO 2晶体中,O 2-近似按面心立方堆积,Ti 4+填充在O 2-围成的变形八面体空隙中,还有一半的变形八面体空隙及全部的四面体空隙未被占据,正、负离子的配位数比为6:3。
离子晶体的结构类型的制约因素主要是离子的电荷比(决定数量比)和半径大小比(决定配位数),离子的电子组态在一定程度上也会影响它的晶体结构,这三个性质综合起来还会决定离子键的共价性成分,后者过分强烈时,将使离子晶体转变为原子晶体,其间存在离子晶体到原子晶体的过渡型。
4.原子晶体
原子晶体是原子以共价键相互连接形成无限伸展网络状结构的晶体。金刚石和二氧化硅是典型的原子晶体,如下图不仅画出了晶胞,而且画出了其中的共价键。附带可以指出,二氧化硅有许多种同质异晶。下图给出的是其中对称性最高的结构。而天然二氧化硅矿物最大量的存在形式是水晶(也叫低温石英),它的共价键结构与下图所示的很相近,只是共价键骨架从上到下整体地看是螺旋状的,结果不再保持立方晶胞而是一种六方晶胞,细节从略。
由于共价键具有方向性和饱和性,所以原子晶体中原子的排列不能采取球的密堆积方式。原子晶体主要有同种元素组成的金刚石型以及不同种元素组成的AB 型和AB 2型等。AB 型原子晶体主要有立方ZnS 型和六方ZnS 型两种类型。AB 2型原子晶体典型代表是SiO 2。
5.分子晶体
单原子分子或以共价键结合成的有限分子彼此间靠范德华力结合而成的晶体叫分子晶体。因为范德华力没有方向性和饱和性,所以分子晶体都有形成密堆积得倾向,特别是球形对称的分子大都采用紧密堆积方式。例如Ne 、Ar 、Kr 、XE 的晶体为立方面心结构的最密堆积,He 为六方最密堆积。对于其他有限分子构成的晶体,堆积方式与分子形状有关,接近球形或通过旋转呈球形的分子形成的晶体,有的也作紧排列,堆积成配位数较大、对称性较高的分子,如H 2、F 2、HX 、H 2X 、CO 2、CH 4等。但对于其他较大的非近似球形分子堆积成的晶体,尽管能量最低原理驱使它们尽量较少空隙,但分子本身的结构将使它们仍然不能作最密堆积,一般堆积成配位数较小,对称性较低的晶体,如有机分子构成的晶体。
分子之间还存在另外一种作用力——氢键。氢键是已经与强电负性原子(一般为氟、氧、氮)形成共价键的氢原子呈现的吸引其他强电负性原子(一般为氟、氧、氮的孤对电子)的一种“余力”。氢键的键能数量级介于范德华力和化学键之间;氢键具有方向性和饱和性等(共价键才具有的)性质。由于范德华力和氢键比较弱,比化学键弱得多,所以分子晶体一般熔点较低、硬度较小。例如干冰在常压下没有熔点,-78.5℃升华,氧、氮等晶体的熔点更是超低温。
冰中水分子之间的作用力的主要贡献是氢键。如果冰中没有氢键只有范德华力,经计算,熔点应比实际低100℃。冰晶体中每周个水分子周围通过氢键与4个水分子作用形成三维的四面体(可以把水分子比作金刚石里的碳原子,于是水分子之间的氢键就可比作金刚石中的共价键,不过冰中的这种四面体是不正的,因而冰的晶体不是立方晶体)。氢键的这种方向性和饱和性使冰中大量空间不能被水分子填塞,从而密度较小,致使水结成的冰反而漂浮在水面。冰的这种特性使水生动植物得以在冰下的水中安全越冬。氢键还是生命分子DNA
双螺旋链间
金钢石共价键骨架
一种天然二氧化硅晶体
碱基对之间的作用力。蛋白质的高级蜷曲结构原因之一也是蛋白质长链不同部位之间形成氢键。酶与底物的作用中氢键也占有重要的位置。
6.混合晶体
上面按化学作用力把晶体分成四种基本类型。事实上,许许多多实际晶体里的化学作用力是多种多样的。如果把混合晶体定义为所有的具有不止一种化学作用力的晶体,那么,绝大多数晶体是混合晶体。
除单原子分子(氦、氖、氩等稀有气体分子)形成的分子晶体外,其他所有分子晶体的分子间虽然是范德华力或者再加上氢键,而分子内部却是共价键。如果分子内原子数目很多,就有可能向一维、二维或三维方向伸展,形成原子晶体。如果大分子只在原地“抱成团”,就仍然是分子晶体,许多病毒晶体就是这样的分子晶体。
石墨晶体是一种复杂的晶体,它除二维平面内的共价键外还存在层内碳原子都参与的离域大π键,使层内电子可以流动,类似金属键,可以导电;石墨晶体的层间则是范德华力,电子不可穿越。
硫酸镁晶体的镁离子与硫酸根离子之间是离子键,而硫酸根离子内部是共价键。许许多多含氧酸盐、金属氢氧化物都有这种“岛状”的共价结构。但有些含氧酸盐具有无限伸展的以共价键连接的巨大的阴离子,例如长石、云母、石棉等天然硅酸盐或铝硅酸盐,金属阳离子则通过静电引力把这些无限伸展的大阴离子维系在—起。
有的晶体含大量结晶水。例如芒硝(Na2SO4·10H2O)加热到32.8℃就变成硫酸钠水溶液了。可以这样来理解:芒硝晶体里的水分子用氢键相互连接形成一种类冰结构,钠离子和硫酸根离子则填在这种氢键网络的空隙中,加热使氢键破坏,结晶水自由移动,变成液态水,倘若芒硝中钠离子和硫酸根形成强大的离子键是这种晶体的主要作用力,就不会有这种现象,芒硝的熔点就应相当高。
有的晶体,在受热时化学键会发生变动,情况就更为复杂,例如三氯化铝,如果一定要说它是原子晶体还是离子晶体,一定要指明它的熔化是物理变化还是化学变化,这是过于简单化的思维方式。
【竞赛试题分析】
【例1】理想的宏观单一晶体呈规则的多面体外形。多面体的面叫晶面。今有一枚MgO 单晶如图所示。它有6个八角形晶面和8个正三角形晶面。宏观晶体的晶面是与微观晶胞中一定取向的截面对应的。已知MgO的晶体结构属NaCl型。它的单晶的
八角形面对应于它的晶胞的面。请指出排列在正三角形晶面上的原子
(用元素符号表示原子,至少画出6个原子,并用直线把这些原子连起,
以显示它们的几何关系)。(2000年全国初赛试题)
【分析】
(1)解决此题的关键是对题目中“宏观晶体的晶面是与微观晶胞中一定取向的截面对应的”以及“它的单晶的八角形面对应于它的晶胞的面”的正确理解。晶体与晶胞之间的关系是:①宏观晶体是微观晶胞的宏观反映,微观晶胞是宏观晶体的实质;②有什么样的宏观晶体,就必有什么样的晶胞,微观晶胞是宏观晶体的具体代表物;③宏观晶体是无限个微观晶胞以一定的规律向空间无限伸展的产物。就本题而言这一MgO单晶是氧化镁晶胞的宏观反映,MgO单晶有如图所示的外形特征,那么氧化镁晶胞也有这种外形特征。
(2)由于MgO的晶体结构属NaCl型,这就告诉我们氧化镁晶胞具有氯化钠晶胞的外形。又因氧化镁晶胞有6个八角形晶面和8个正三角形晶面,因此,我们只要NaCl晶胞按图示(切割就可得一个由四个等边三角形组成的等边三角形,每一个三角形的顶点表示一个镁离子(或氧离子)。每一个小三角形表示一个氧化镁晶胞的一个三角形晶面。
;
所有原子都是Mg(3分)所有原子都是O(3分)
注:画更多原子者仍应有正确几何关系;右图给出了三角形与晶胞的关系,不是答案。
【例2】钨酸钠Na2WO4和金属钨在隔绝空气的条件下加热得到一种具有金属光泽的、深色的、有导电性的固体,化学式Na x WO3,用X射线衍射法测得这种固体的立方晶胞的边长a =3.80×10-10m,用比重瓶法测得它的密度为d=7.36g/cm3。已知相对原子质量:W 183.85,Na 22.99,O 16.00,阿伏加德罗常数L=6.022×1023mol-1。求这种固体的组成中的x值(2位有效数字),给出计算过程。(1998年全国初赛试题)
【分析】
(1)阿伏加德罗数是中学化学的一个重要概念。测定已知确切化学组成和晶系的纯净晶体的密度是获得阿伏加德罗数的实验方法之一。关系式是:dVL=ZM,其中d是密度,V是一个晶胞的体积,L是阿伏加德罗数(因奥地利人劳施密特Loschmidt第一个测定了阿伏加德罗数,国际上习惯用劳施密特的第一个字母L作为阿伏加德罗数的符号),如果一个晶胞里的原子数相当于化学式表达的原子数(Z=1),该乘积就等于该物质的摩尔质量M了。如果Z 不等于1,乘积dVL当然等于ZM。在这一实验方法中,d,V,M都是测定值,都会影响阿伏加德罗数的准确性。本题是这个重要实验方法的逆运算,而且也是一种获得化学组成的常规实验方法。
(2)试题告诉我们Na x WO3属于立方晶系,晶胞边长a=3.80×10-10m,这等于就告诉我们晶胞体积V cell=a3=5.49×10-29m3。试题也给了密度d和阿伏加德罗数L,因而可以得到:dVL=7.36×103 kg/m3×5.49×10-29m3×6.022×1023 mol-1=243 g/mol
然而试题并没有告诉我们Z=?,也没有告诉我们Na x WO3中的x=?这就要进行假设。这是解题的关键。命题人认为这体现一种科学方法。试题明确要求计算过程, 也就是考察学生能否领悟而且表述出这个科学方法。
【解】取1mol晶体,设其中含有y mol晶胞,则:
22.99xg+183.85g+48g=(6.022×1023×5.49×10-29m3×7.36×103Kg/m3×1000)y=243g
解得22.99x+231.85=243y
讨论:y=1时,x=0.48
y=2时,x=11.05(不合理,舍去)
故x=0.48。
【能力训练】
1.2001年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,
如图是该晶体微观空间中取出的部分原子沿C 轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。(2001年全国初赛试题)
1-1 由图可确定硼化镁的化学式为: 。
1-2 在图右边的方框里画出硼化镁的一个晶胞的透视图,标出该晶胞内面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球,硼原子用小黑球表示)。
最近有人用一种称为“超酸”的化合物H(CB 11H 6Cl 6) 和
2.C 60反应,使C 60获得一个质子,得到一种新型离于化合物[HC 60]+[CB 11H 6CL 6]-。回答如下问
题:
2-1 以上反应看起来很陌生,但反应类型上却可以跟中学化学课本中的一个化学反应相比拟,后者是: 。
2-2 上述阴离子[CB 11H 6Cl 6]-的结构可以跟如下左图的硼二十面体相比拟,也是一个闭合
的纳米笼,而且,[CB 11H 6Cl 6]-离子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转
360°/5的度数,不能察觉是否旋转过。请在如下右边的图上添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子。(2001年全国初赛试题)
图10-1 3.研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。设氯化钠晶体中钠离子跟离它最近的氯离子之间的距离为d ,以钠离子为中心,则:(2001年全国初赛试题)
3-1 第二层离子有 个,离中心离子的距离为 d ,它们是 离子。
3-2 已知在晶体中Na +离子的半径为116pm ,Cl -离子的半径为167pm ,它们在晶体中是
紧密接触的。求离子占据整个晶体空间的百分数。
3-3 纳米材料的表面原子占总原子数的比例极大,这是它的许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。
3-4 假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞边长的10
倍,试估算表面原子
硼化镁的晶体结构示意图
占总原子数的百分比。
4.已经探明,我国南海跟世界上许多海域一样,海底有极其丰富的甲烷资源。其总量超过已知蕴藏在我国陆地下的天然气总量的一半。据报导,这些蕴藏在海底的甲烷是高压下形成的固体,是外观像冰的甲烷水合物。
4-1 试设想,若把它从海底取出,拿到地面上,它将有什么变化?为什么?它的晶体是分子晶体、离子晶体还是原子晶体?你作出判断的根据是什么?
4-2 已知每1立方米这种晶体能释放出164立方米的甲烷气体,试估算晶体中水与甲烷的分子比(不足的数据由自己假设,只要假设得合理均按正确论)。(2000年全国初赛试题)
5.2003年3月日本筑波材料科学国家实验室一个研究小组发现首例带结晶水的晶体在5K 下呈现超导性。据报道,该晶体的化学式为Na0.35CoO2? 1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构;在以“CoO2”为最简式表示的二维结构中,钴原子和氧原子呈周期性排列,钴原子被4个氧原子包围,Co-O键等长。(2003年全国初赛试题)
5-1 钴原子的平均氧化态为。
5-2 以代表氧原子,以代表钴原子,画出CoO2层的结构,用粗线画出两种二维晶胞。
6.钒是我国丰产元素,储量占全球11%,居第四位。在光纤通讯系统中,光纤将信息导入离光源1km外的用户就需用5片钒酸钇晶体(钇是第39号元素)。我国福州是全球钒酸钇晶体主要供应地,每年出口几十万片钒酸钇晶体,年创汇近千万美元。钒酸钇是四方晶体,晶胞参数a = 712 pm, c = 629 pm,密度d = 4.22 g/cm3,含钒25%,求钒酸钇的化学式以及在一个晶胞中有几个原子。给出计算过程。(2003年全国初赛试题)
7.最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由镍原子构成,另一种由镍原子和镁原子一起构成,两种八面体的数量比是1 : 3,碳原子只填充在镍原子构成的八面体空隙中。
7-1 画出该新型超导材料的一个晶胞(碳原子用小球,镍原子用大球,镁原子用大
球)。
7-2 写出该新型超导材料的化学式。(2004年全国初赛试题)
8.超硬材料氮化铂是近年来的一个研究热点。它是在高温、超高压条件下合成的(50GPa、2000K)。由于相对于铂,氮原子的电子太少,衍射强度太弱,单靠X-射线衍射实验难以确定氮化铂晶体中氮原子数和原子坐标,2004年以来,先后提出过氮化铂的晶体结构有闪锌矿型、岩盐型(NaCl)和萤石型,2006年4月11日又有人认为氮化铂的晶胞如下图所示(图中的白球表示氮原子,为便于观察,该图省略了一些氮原子)。结构分析证实,氮是四配位的,而铂是六配位的;Pt—N键长均为209.6pm,N—N键长均为142.0 pm(对比:N2分子的键长为110.0pm)。(2006年全国初赛试题)
备用图
8-1 氮化铂的上述四种立方晶体在结构上有什么共同点?
8-2 分别给出上述四种氮化铂结构的化学式。
8-3 试在图上挑选一个氮原子,不添加原子,用粗线画出所选氮原子的配位多面体。
8-4 请在本题的附图上添加六个氮原子(添加的氮请尽可能靠前)。
9.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。(2006年全国初赛试题)
9-1 写出合成磷化硼的化学反应方程式。
9-2 分别画出三溴化硼分子和三溴化磷分子的结构。
9-3 磷化硼晶体中磷原子作立方最密堆积,硼原子填入四面体空隙中。画出磷化硼的正当晶胞示意图。
9-4 已知磷化硼的晶胞参数a = 478 pm,计算晶体中硼原子和磷原子的核间距(d B-P)。
9-5 画出磷化硼正当晶胞沿着体对角线方向的投影(用实线圆圈表示P原子的投影,用虚线圆圈表示B原子的投影)。
10.LiCl和KCl同属NaCl型晶体,其熔点分别为614℃和776℃。Li+、K+和Cl-的半径分别为76pm、133pm和181pm。在电解熔盐LiCl以制取金属锂的生产工艺中,加入适量的KCl晶体,可使电解槽温度下降至400℃,从而使生产条件得以改善。(2005年全国初赛试题) 10-1 简要说明加入熔点高的KCl反而使电解温度大大下降的原因;
10-2 有人认为,LiCl和KCl可形成固溶体(并画出了“固溶体的晶胞”)。但实验表明,液相LiCl和KCl能以任意比例混溶而它们的固相完全不混溶(即不能生成固溶体!)。请解释在固相中完全不混溶的主要原因。
10-3 写出计算LiCl和KCl两种晶体密度之比的表达式(须包含离子半径的符号);
10-4 在KCl晶体中,K+离子占据由Cl- 离子围成的八面体空隙,计算相距最近的八面体空隙中心之间的距离。
10-5 实验证明,即使产生了阳离子空位,KCl晶体在室温下也不导电。请通过计算加以说明。
B
Cl H
参考答案:
1-1 MgB 2(注:给出最简式才得分)
或 a = b ≠ c ,c 轴向上
1-2 (注:任何能准确表达出Mg ︰B =1︰2的晶胞都得满分,但所取晶胞应满足晶胞是晶体微观空间基本平移单位的定义,例如晶胞的顶角应完全相同等。) 2-1.NH 3+HCl = NH 4Cl 2-2参考图形: (注:硼上氢氯互换如参考图形仍按正确论,但上下的C 、
B 分别连接H 和Cl ,不允许互换。) 3-1 12, 3-2 晶胞体积V =[2×(116pm +167pm)]3=181×106pm 3 离子体积 v =4×(4/3)π(116pm)3+4×(4/3)π(167pm)3=104×106 pm 3
离子占据整个晶体空间的百分数=v/V =57.5%(有效数字错误扣1分,V 和v 的计算结果可取4位,其中最后1位为保留数字,不扣分。)
3-3表面原子为8(顶角)+6(面心) +12(棱中心)=26
总原子数为 8(顶角)+6(面心)+12(棱中心)+1(体心)=27
表面原子占总原子数 26/27×100%=96 %
注:26和27均为整数值,比值26/27是循环小数0.962, 取多少位小数需根据实际应用而定, 本题未明确应用场合,无论应试者给出多少位数字都应按正确结果论。
3-4 方法一:
计算分两个步骤:
步骤一:计算表面原子数。可用n =2、3的晶胞聚合体建立模型,得出计算公式,用以计算n =10。例如,计算公式为:
[8]+[(n -1)×12]+[n ×12]+[(n -1)2×6]+[n 2x6]+[(n -1)×n ×2×6]
顶角 棱上棱交点 棱上棱心 面上棱交点 面上面心 面上棱心
n =10,表面原子总数为2402
步骤二:计算晶胞聚合体总原子数:
n 3×8+[8] ×7/8+[(n -1)×12]×3/4+[n×12]×3/4+[(n -1)2×6]/2+[n 2×6]/2+[(n -1)×n×2×6]/2
=8000+7 + 81 + 90 + 243 + 300 + 540
=9261
表面原子占总原子数的百分数: (2402/9261)×100%=26%
方法二:
如果立方体的边长是氯化钠晶胞的n 倍,则一条边上的原子数为2n +1,一个面可以看成时这条边重复了(2n +1)次,因此面上的原子数为一条边的二次方,即(2n +1)2,整个立方体可以看成是一个面重复了(2n +1)次,因此整个立方体的总原子数为(2n +1)3。
内部的原子也可以依次类推,内部一个边的原子数为2n -1,内部的原子总数为(2n -1)3。表面的原子总数=总原子数-内部原子数=(2n +1)3-(2n -1)3。
当立方体的变成是氯化钠晶胞的10倍时,表面原子占总原子数的百分数为
[(2×10+1)3-(2×10-1)3]/(2×10+1)3=26%
(注:本题计算较复杂,若应试者用其他方法估算得出的数值在26% 左右,其估算公式可不
在(面心)立方最密堆积-填隙模型中,八面体空隙与堆
积球的比例为1 : 1, 在如图晶胞中,八面体空隙位于体心
位置和所有棱的中心位置,它们的比例是1 : 3,体心位置
的八面体由镍原子构成,可填入碳原子,而棱心位置的八
面体由2个镁原子和4个镍原子一起构成,不填碳原子。
同于标准答案,但其运算应无误。本题要求作估算,故标准答案仅取整数,取更多位数不扣分。)
4-1 从海底取出的甲烷水合物将融化并放出甲烷气体,该晶体是分子晶体,因为甲烷分子和水分子都是由有限数目的原子以共价键结合的小分子,水分子和甲烷分子之间范德华力,而水分子之间是范德华力和氢键。(2分)
4-2 假设甲烷气体体积是折合成标准状况下的数据,则1m3水合物中有甲烷164m3÷22.4m3/kmol=7.32kmol;假设甲烷水合物固体中的水的密度为1g/cm3,则其中有水1m3×1000kg/m3÷18 kg/mol=55.56kmol;因此有:CH4︰H2O=7.32kmol︰55.6kmol=1︰7.6。
甲烷水合物的组成可能是6CH4·46H2O(6分)
【说明】
以上是最简单的参考答案,设密度为1g/cm3也可包含甲烷,只要答案为CH4·6~9H2O,均可按满分计。但设密度为0.9g/cm3又包含甲烷则不能认为是合理的(岂不会漂到海面上来?另外,必须给出解题时的假设,否则不能得满分。)
5-1 +3.65 (不写“+”扣分)
5-2
6.钒酸钇的化学式:YVO4
计算过程:设钒酸钇化学式为Y x VO y,则M=50.9/0.25=203.6,可得:
88.9x+16y=203.6-50.9=152.7 因此,x=1,y=4。
1mol的YVO4体积为203.8/4.22 = 48.3(cm3/mol)
一个YVO4的体积为:48.3/6.02X1023= 8.02X10-23cm3
四方晶胞的体积V= 7122X629X10-30cm3=3.18X10-22cm3
一个晶胞中含3.18X10-22/8.02X10-23= 3.97 ≈ 4个YVO4
一个晶胞中的原子数:4X6=24 (类似过程或步骤合并,得分相同)
7-1
7-2 MgCNi3(化学式中元素的顺序可不同,但原子数目不能错)。
8-1铂原子面心立方最密堆积。
8-2依次为PtN、PtN、PtN2、PtN2
8-3 8-4
画成不符合化学式者如右图,不是同一形状平行四边形的最小
体积者以及不符合平移特征的图形均不得分。
Br B Br Br P
Br Br
Br ( 注:填入另外四个四面体空隙也
可,但不能一层空一层填)
注:最中间中的原子(磷原子)是晶胞的一个顶角,与它相对的另一个顶角刚好处在它的下面。最中间的原子与三个面心上的磷原子围成的四个四面体空隙中心填入硼原子,它的位置刚好处在晶胞的对角线上,被中间的原子“挡个正着”,依此类推,另外3个硼原子也刚好处在3个面心上的原子下面。
9-1 BBr 3+PBr 3+3H 2=BP +6HBr
9-2
平面三角形 三角锥 (画不画磷上的孤对电子不影响得分)
9-3
9-4
9-5
10-1熔点降低效应;或形成有低共熔点的二元体系;或固相不互溶,而在液相中产生混合熵。 (三者中答出任一者即可)
10-2 在固相中,离子呈周期性排列,对“相似相溶”的“相似条件”的要求比液相中严格得多。LiCl 和KCl 的结构型式相同,Li+和K+的电价相等,Li 和K 的电负性差别也有限。显然,两个组分在固相中完全不互溶源于Li+和K+的半径差别太大。(关键要回答出最后一句话) 10-3 ()()=
?????????+?+?=?=????=??? ????? ??=-+-+333332244Cl Li Cl K KCl LiCl LiCl KCl KCl LiCl A KCl KCl A LiCl LiCl KCl LiCl KCl LiCl
r r r r M M a a M M N a M N a M V m V m D D
KCl LiCl M M
()()3????????++-+-+Cl Li Cl K r r r r 只写出最后的表达式也可
10-4 a 22=22
()2?+-+Cl K r r =22(133+181)×2pm =444pm
10-5 可按如下思路说明:离子晶体能够导电是由于离子离开原位而迁移到距离最近的空位所致。迁移中必须经过由异号离子围成的最小窗孔。比较离子半径和窗孔的大小,可判断
d B-P = 207pm pm 478341341=?=a
或 d B-P =
能否发生迁移,即能否成为快离子导体。
取体积为KCl 正当晶胞体积1/8的小立方体(见图)来考虑。三个分布在正当晶胞0,0,0;1/2,0,1/2;0,1/2,1/2位置的Cl-围成的三角形半径为:
()()pm pm pm pm r r r r a r a a Cl
Cl K Cl Cl 4.751811811333
62666642223221
22=-+=-?+=-=-????????????
??-???? ??--+-- 该半径远小于K +的半径, K +不能穿过此窗口,因而KCl 晶体
不能成为固体离子导体。大白球为Cl -, 黑球为K +, 虚线球为
空位。
(2000)4.理想的宏观单一晶体呈规则的多面体外形。多面体的面叫晶面。今有一枚 MgO单晶如附图1所示。它有6个八角形晶面和8个正三角形晶面。宏观晶体的晶面 是与微观晶胞中一定取向的截面对应的。已知MgO的晶体结构属NaCl型。它的单晶 的八角形面对应于它的晶胞的面。请指出排列在正三角形晶面上的原子(用元素符号表示原子,至少画出6个原子,并用直线把这些原子连起,以显示它们的几何关系)。(6分) 【答案】 ; 所有原子都是Mg(3分)所有原子都是O(3分) 注:画更多原子者仍应有正确几何关系;右图给出了三角形与晶胞的关系,不是答案。 (2000)5.最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示,顶角 和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是______。 【答案】Ti14C13(2分)说明:凡按晶胞计算原子者得零分。 (2001)第5题(5分)今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,图5-1是该晶体微观空间中取出的部分原子沿C轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。 5-1 由图5-1可确定硼化镁的化学式为:。 5-2 在图5-l右边的方框里画出硼化镁的一个晶胞的透视图,标出该晶胞内面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球,硼原子用小黑球表示)。 图5-1硼化镁的晶体结构示意图 第5题(5分)5-1 MgB2(2分)(注:给出最简式才得分)
或 a = b ≠ c,c轴向上(3分) 5-2 (注:任何能准确表达出Mg︰B=1︰2的晶胞都得满分,但所取晶胞应满足晶胞是晶体微观空间基本平移单位的定义,例如晶胞的顶角应完全相同等。) (2001)第10题(5分)最近有人用一种称为“超酸”的化合物H(CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。回答如下问题: 10-1 以上反应看起来很陌生,但反应类型上却可以跟中学化学课本中的一个化学反应相比拟,后者是:。 10-2 上述阴离子[CB11H6Cl6]-的结构可以跟图10-1的硼二十面体相比拟,也是一个闭合的纳米笼,而且,[CB11H6Cl6]-离子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过。请在图10-1右边的图上添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子。 图10-1 第10题(5分)NH3+HCl = NH4Cl (2分) (注:答其他非质子转移的任何“化合反应”得1分)。(3分)(注:硼上氢氯互换如参考图形仍按正确论,但上下的C、B分别连接H和Cl,不允许互换。) (2001)第11题(10分)研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。设氯化钠晶体中钠离子跟离它最近的氯离子之间的距离为d,以钠离子为中心,则: 11-1 第二层离子有个,离中心离子的距离为 d,它们是离子。 11-2 已知在晶体中Na+离子的半径为116pm,Cl-离子的半径为167pm,它们在晶体中是紧密接触的。求离子占据整个晶体空间的百分数。 11-3 纳米材料的表面原子占总原子数的比例极大,这是它的许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。
2008高中化学竞赛初赛模拟试卷(18) 第一题(9分) 光气学名“碳酰氯”,化学式COCl 2,是窒息性毒剂之一。 1.光气化学性质活泼,具有酰卤的典型反应,易发生水解、氨解和醇解。 (1)光气与足量乙醇反应所得产物的化学名称是【 】; (2)光气与足量氨气反应的化学方程式【 】; (3)足量苯在AlCl 3催化剂作用下与光气反应所得产物的结构简式【 】; (4)光气与苯胺分两步反应可得异氰酸苯酯,中间产物的结构简式是【 】,异氰酸苯酯的结构简式是【 】。 .是一种稳定的白色结晶体,熔点为~℃,沸点为~℃。可在一定条件下分解产生3mol 光气,所以又被称为“三光气”。工业上可以利用碳酸二甲酯的氯代反应制备BTC 。BTC 的反应活性与光气类似,可以和醇、醛、胺、酰胺、羧酸、酚、羟胺等多种化合物反应,因此低毒性的BTC 在化学反应中完全可替代剧毒(被禁用)的光气合成相关的化工产品。 (1)BTC 分子中所有氯原子都等价,试写出结构简式
(2)除毒性外,BTC 比光气还有什么优点? (2) 第二题(10分) 电解食盐溶液的氯碱生产技术,已由传统的隔膜法变革为离子膜法高新技术。这种技术进步,如下表所示: 表1 产品液碱质量比较 项目 离子膜法 ??? ? ??液碱产品电解即得的 隔膜法 ??? ? ??成品电解碱液电解先得的半 隔膜法 ??? ? ??的碱液产品脱盐浓缩后 NaOH% 35(已有50%的报道) 10~12 30 NaCl% 0.0025 14~16 4 Na 2CO 3% 0.02 (一般不计量) 1 项 目 离子膜法 隔膜法 电解用电 度/吨 2160 2600 蒸汽用电 度/吨 80 700 隔膜法和离子膜法新技术中所用的膜有本质区别。前者是有条件地阻止阴、阳极电解产 物相混合的多孔石棉隔膜。后者由阳离子交换树脂(几类氟碳树脂)组成,树脂的高分子骨 架上接有能电离出H +而可与Na + 等阳离子交换的离子交换基团—SO 3H 、—COOH ,所以是一类厚度虽仅0.l ~0.5mm ,但一般只允许溶液中的阳离子在膜中通过,更不能自由通过气体或液体的阳离子交换膜。 1.在所给离子膜法电解食盐溶液示意图中的括号内,填写开始电解时进入电解槽用作电解液的液体A 、B 的组成名称,以及电解产出气体C 、D 的化学式。 2.离子膜法电解槽的极间距,由于膜在电极间的结构紧凑而远小于隔膜法电解槽,这将如何影响能耗? 3.传统隔膜法的阴极电解碱液,它所含NaOH 的质量分数,为什么只能控制得低些?
2020高中化学竞赛讲义 天然产物化学 2020苏州中学竞赛讲义 第一章绪论 一、天然产物化学的含义及研究内容 天然产物是包括了存在于陆生动植物、海洋生物和微生物体内各类物质成分,甚至还可以包括人与动物体内许多内源性成分(包括天然药物、天然树脂、天然精油、天然高分子、天然香精、天然色素等等)。 天然产物是由各种化学成分所组成的复杂体系。如在陆生植物体内的主要成分就有:生物碱、萜类、甾体、苷类、黄酮类、蒽醌类、糖类、蛋白质、脂类等等。不同的天然产物在其组成和含量等方面具有生命体的一般特征,某一相同的化学成分可能分布于各种不同的天然产物中,同时,不同来源的天然产物,所含的物质成分及其含量也存在很大的不同。 有效成分(active compound)(1)在药理和生物学角度来看是指有生物活性的物质,这种物质在化学上能用分子式和结构式来表示,并具有一定的物理常数;(2)在食品领域中,有效成分的范畴可扩展到除生物活性成分、功效成分之外,如:营养成分、天然食品添加剂成分等。但随着认识水平的提高,有效成分也在发生变化(多糖和不饱和脂肪酸在降血脂方面的功效;一些天然色素如叶黄酸在抗氧化方面的作用等)。 应当强调指出,在中草药及其他天然药物中,真正搞清有效成分的品种是不多的,更多的只是一些生理活性成分,即经过不同程度药效实验或生物活性实验,包括体外(in vitro)、体内实验(in vivo),证明对机体有一定生理活性的成分。但它不一定是真正代表天然药物临床疗效的有效成分。另外,有效成分或
生理活性成分不能简单而机械地理解。以氨基酸、蛋白质、多糖类成分为例,在多数场合均视为无效成分,并在加工过程中应尽量除去;但在鹧鸪菜、天花粉、猪苓等药物中,却分别证实是中药驱虫(鹧鸪菜中的氨基酸)、引产(天花粉中的蛋白质)及抗肿瘤(猪苓中的多糖)的有效成分。 天然产物化学是运用现代科学的理论与方法研究天然产物中化学成分的一门学科。 二、天然产物研究的发展史 在人类的史前时期,我们的祖先就已经掌握了用动植物制作箭毒的技术。先民们从各种天然物质中提取药用成分治疗疾病,但在19世纪以前,制药的手段比较原始。 据国外文献记载,从天然药物中分离其中所含的有机化学成分,始于1769年舍勒将酒石(酒石酸氢钾)转化为钙盐,再用硫酸分解制得酒石酸(2,3-二羟基丁二酸)。后来又用类似的方法从天然产物中得到了苯甲酸(1775)、乳酸(1785)(2-羟基丙酸)、没食子酸(1786)(倍酸、五倍子酸,化学名:3,4,5-三羟基苯甲酸)等有机酸类物质。但古代中国早在这之前就有了明确的记载。例如,明代李延的《医学入门》(1575)中记载了用发酵法从五倍子中得到没食子酸的过程。《本草纲目》卷39中则有“看药上长起长霜,则药已成矣”的记载。这里的“生白”、“长霜”均为没食子酸生成之意,是世界上最早制得的有机酸,比舍勒的发明早了二百年。(黑龙江大庆市中医院日前采用了一项中西医结合新疗法,在超声引导穿刺下,将自行研制的“五倍子硬化剂”用于卵巢囊肿的治疗,迄今共为400多名患者解除了隐疾。据介绍,“五倍子硬化剂”是由五倍子、鸦胆子、元胡等组方而成,经科学提炼形成针剂型。现代药理学研究证实:五倍子具有明显的收敛作用,内含鞣酸能使蛋白沉淀;鸦胆子所含的鸦胆子油,
2010年全国初中学生化学素质和实验能力竞赛 (第二十届天原杯)初赛试题 说明:1.本卷分两部分,共32小题。满分为130分,考试时间为90分钟。 2.可能用到的相对原子质量:H-1 C -12 N-14 O-16 Mg-24 S-32 K-39 Ca-40 Ba-137 第一部分 (共100分) 一.选择题(本大题包括14小题,每小题2分,共28分。每小题只有一个选项符合题意,请将正确选项的字母填在该题后的括号内) 1.我们生活在绚丽多彩的物质世界里,下列色彩是由化学变化呈现出来的是 ( ) A .雨后的彩虹 B .夜晚的霓虹灯 C .节日的礼花 D .彩色的图画 2下列物质中,属于纯净物的是 ( ) A .空气 B .石油 C .沼气 D .干冰 3.人们常说“墙内开花墙外香”,这句话的科学本意揭示了 ( ) A .分子间有间隙 B .分子的质量和体积都很小 C .分子总是在不断运动着 D .分子是保持物质化学性质的最小粒子 4.2009年世界气候大会在丹麦首都哥本哈根举行,旨在控制大气中二氧化碳、甲烷和其他造成“温室效应”的气体的排放,将温室气体的浓度稳定在使气候系统免遭破坏的水平上。控制二氧化碳排放,更需要从人人做起,“低碳生活”有望成为新的时尚流行全球。“低碳生活”是指生活作息时所耗用能量要减少,从而减低碳特别是二氧化碳的排放。下列不属于“低碳生活”方式的是 ( ) A .多用电邮、QQ 等即时通讯工具,少用传真打印机 B .乘地铁上下班 C .将呼吸产生的二氧化碳用石灰水吸收 D .吃天然食品、穿棉质服装 5.中国科学家以二氧化碳和金属钠为原料,在一定条件下制得了金刚石,化学方程式为: 3CO 2+4Na ===== xR + C (金刚石),则x 、R 为 ( ) A .1、Na 2CO 3 B .2、Na 2CO 3 C .4、Na 2CO 3 D .2、Na 2O 2 6.下列对相关实验现象的描述正确的是 ( ) A .把银片浸入硫酸铜溶液一段时间后取出,银片表面覆盖一层红色物质 B .在稀硫酸中滴加紫色石蕊试液后溶液变红 C .硫在空气中燃烧产生蓝紫色火焰 D .棉纱线灼烧会产生烧焦羽毛味 7.把分别盛有甲、乙、丙气体的试管倒插入盛有水的烧杯中,一段时间后,观察到如图所示的 现象,对甲、乙、丙气体的分析正确的是 ( ) A .甲、乙、丙气体都易溶于水 B .乙气体比甲气体更易溶于水 C .可以采用排水集气方法收集丙气体 D .不可以用排空气方法收集甲气体 -1- 8.20℃时,NaCl 溶解于水的实验数据如下表。则下列叙述正确的是 ( ) 470℃ 80 MPa
第28届中国化学奥林匹克初赛试题及标准答案 第1题(6分)合成氨原料气由天然气在高温下与水和空气反应而得。涉及的主要反应如下:(1)CH4(g)+H2O(g)→CO(g)+3H2(g) (2)2CH4(g)+O2(g) →2CO(g)+4H2(g) (3)CO(g)+H2O(g) →H2(g)+CO2(g) 假设反应产生的CO全部转化为CO2,CO2被碱液完全吸收,剩余的H2O通过冷凝干燥除去。进入合成氨反应塔的原料气为纯净的N2和H2。 1-1 为使原料气中N2和H2的体积比为1:3,推出起始气体中CH4和空气的比例。设空气中O2和N2的体积比为1:4,所有气体均按理想气体处理。 1-2 计算反应(2)的反应热。已知: (4)C(s)+2H2(g) →CH4(g) ΔH4=-74.8 kJ·mol-1 (5)C(s)+1/2O2(g) →CO(g) ΔH5=-110.5 kJ·mol-1 1-14份N2,需12份H2;4份N2由空气引入时,同时引入l份O2。 由反应(2)和(3),l份O2需2份CH4,产生6份H2; 另外的6份H2由反应(l)和(3)提供,再需要6/4份CH4; 因此,起始体系中CH4和O2的比例为3.5:1,故CH4和空气的比例为3.5:5,即7:10。1-2 反应(5)×2-1反应(4)×2,得反应(2),(2)的反应热: ΔH2=-110.5 kJ·mol-1×2-(-74.8 kJ·mol-1×2)=-71.4 kJ·mol-1 第2题(5分)连二亚硫酸钠是一种常用的还原剂。硫同位素交换和顺磁共振实验证实,其水溶液中存在亚磺酰自由基负离子。 2-1 写出该自由基负离子的结构简式,根据VSEPR理论推测其形状。 2-2 连二亚硫酸钠与CF3Br反应得到三氟甲烷亚磺酸钠。文献报道,反应过程主要包括自由基的产生、转移和湮灭(生成产物)三步,写出三氟甲烷亚磺酸根形成的反应机理。 2-1 ·SO- 2角型或 V 型 2-2 -O2S—SO- 2→-O2S·+·SO- 2 CF3Br+·SO- 2→·CF3+BrSO- 2 -O 2S·+·CF3→F3CSO- 2 第3题(6分)2013年,科学家通过计算预测了高压固态氮的一种新结构:N8分子晶体。其中,N8分子呈首尾不分的链状结构;按价键理论,氮原子有5种成键方式;除端位以外,其他氮原子采用3种不同类型的杂化轨道。 3-1画出N8分子的Lewis结构并标出形式电荷。写出端位之外的N原子的杂化轨道类型。3-2 画出N8分子的构型异构体。 3-1 3-2
初赛基本要求 1.有效数字在化学计算和化学实验中正确使用有效数字。定量仪器(天平、量筒、移液 管、滴定管、容量瓶等等)测量数据的有效数字。数字运算的约化规则和运算结果的有效数字。实验方法对有效数字的制约。 2.气体理想气体标准状况(态)。理想气体状态方程。气体常量R。体系标准压力。分 压定律。气体相对分子质量测定原理。气体溶解度(亨利定律)。 3.溶液溶液浓度。溶解度。浓度与溶解度的单位与换算。溶液配制(仪器的选择)。重 结晶的方法及溶质/溶剂相对量的估算。过滤与洗涤(洗涤液选择、洗涤方式选择)。重结晶和洗涤溶剂(包括混合溶剂)的选择。胶体。分散相和连续相。胶体的形成和破坏。 胶体的分类。胶体的基本结构。 4.容量分析被测物、基准物质、标准溶液、指示剂、滴定反应等基本概念。酸碱滴定曲 线(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系)。酸碱滴定指示剂的选择。 以高锰酸钾、重铬酸钾、硫代硫酸钠、EDTA为标准溶液的基本滴定反应。分析结果的计算。分析结果的准确度和精密度。 5. 原子结构核外电子运动状态: 用s、p、d等来表示基态构型(包括中性原子、正离子 和负离子)核外电子排布。电离能、电子亲合能、电负性。 6.元素周期律与元素周期系周期。1—18族。主族与副族。过渡元素。主、副族同族元 素从上到下性质变化一般规律;同周期元素从左到右性质变化一般规律。原子半径和离子半径。s、p、d、ds区元素的基本化学性质和原子的电子构型。元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。最高氧化态与族序数的关系。对角线规则。金属与非金属在周期表中的位置。半金属(类金属)。主、副族的重要而常见元素的名称、符号及在周期表中的位置、常见氧化态及主要形态。铂系元素的概念。 7.分子结构路易斯结构式。价层电子对互斥模型。杂化轨道理论对简单分子(包括离子) 几何构型的解释。共价键。键长、键角、键能。σ键和π 键。离域π键。共轭(离域)体系的一般性质。等电子体的一般概念。键的极性和分子的极性。相似相溶规律。对称性基础(限旋转和旋转轴、反映和镜面、反演和对称中心)。 8.配合物路易斯酸碱。配位键。重要而常见的配合物的中心离子(原子)和重要而常见的配体(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。螯合物及螯合效应。重要而常见的配合反应。配合反应与酸碱反应、沉淀反应、氧化还原反应的关系(定性说明)。配合物几何构型和异构现象基本概念和基本事实。配合物的杂化轨道理论。用杂化轨道理论说明配合物的磁性和稳定性。用八面体配合物的晶体场理论说明Ti(H2O)63+的颜色。软硬酸碱的基本概念和重要的软酸软碱和硬酸硬碱。 9.分子间作用力范德华力、氢键以及其他分子间作用力的能量及与物质性质的关系。 10.晶体结构分子晶体、原子晶体、离子晶体和金属晶体。晶胞(定义、晶胞参数和原子 坐标及以晶胞为基础的计算)。点阵(晶格)能。配位数。晶体的堆积与填隙模型。常见的晶体结构类型:NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、硒、冰、干冰、金红石、二氧化硅、钙钛矿、钾、镁、铜等。 11.化学平衡平衡常数与转化率。弱酸、弱碱的电离常数。溶度积。利用平衡常数的计算。 熵(混乱度)的初步概念及与自发反应方向的关系。 12.离子方程式的正确书写。
2008 年全国化学竞赛(初赛)试题 第1 题(14 分) 1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。 ( 1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。 2) Ca(EDTA) 2溶液可用于静脉点滴以排除体内的铅。写出这个排铅反应的化学方 程式(用 Pb2+表示铅)。 3)能否用 EDTA 二钠盐溶液代替 Ca(EDTA) 2溶液排铅?为什么? 1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。晶体中的分子有一个三重 旋转轴,有极性。画出这种分子的结构式,标出正负极。 1-3 Na2[Fe(CN)5(NO)] 的磁矩为零,给出铁原子的氧化态。 Na2[Fe(CN) 5(NO)] 是鉴定S2的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。 11 1-4 CaSO4 ? 2H2O 微溶于水,但在 HNO 3 ( 1 mol L 1)、HClO 4 ( 1 mol L 1)中可溶。写出能够解释 CaSO4 在酸中溶解的反应方程式。 1 1-5 取质量相等的 2 份 PbSO4 (难溶物 )粉末,分别加入 HNO3 ( 3 mol L 1) 和 HClO4 ( 3 mol L 1),充分混合, PbSO4在 HNO3 能全溶,而在 HClO 4中不能全溶。简要解释PbSO4在 HNO 3 中溶解的原因。 1-6 X 和 Y 在周期表中相邻。 CaCO3 与 X 的单质高温反应,生成化合物 B 和一种气态氧化物;B 与 Y 的单质反应生成化合物 C 和 X 的单质; B 水解生成 D;C 水解生成E,E 水解生成尿素。确定 B、C、D、 E、X 和 Y。 第2题(5 分) 化合物 X 是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。年产量达 300 万吨的氯酸钠是生产 X 的原料, 92%用于生产 X —在酸性水溶液中用盐酸、二氧化硫或草酸还原。此外,将亚氯酸钠固体装柱,通入用空气稀释的氯气氧化,也可生产 X。 X 有极性和顺磁性,不形成二聚体,在碱性溶液里可发生歧化反应。 2-1 写出 X 的分子式和共轭π键( n m )。
第1题(4分) 2004年2月2日,俄国杜布纳实验室宣布用核反应得到了两种新元素X 和Y 。X 是用高能48Ca 撞击Am 24395靶得到的。经过100微秒,X 发生α-衰变,得到Y 。然后Y 连续发生4 次α-衰变,转变为质量数为268的第105号元素Db 的同位素。以X 和Y 的原子序数为新元素的代号(左上角标注该核素的质量数),写出上述合成新元素X 和Y 的核反应方程式。 答案: Am 24395+ 4820Ca = 288115+3n (2分)不写3n 不得分。答291115不得分。 288115 = 284113 + 4He (2分) 质量数错误不得分。 4He 也可用符号α。 (答下式不计分:284113-44He = 268105或268105Db )(蓝色为答案,红色为注释,注释语不计分,下同) 第2题(4分)2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮, 这种高聚氮的N-N 键的键能为160 kJ/mol (N 2的键能为942 kJ/mol),晶体结构如图所示。在这种晶体中,每个氮原子的配位数为 ;按键型分类时,属于 晶体。这种固体的可能潜在应用是 ,这是因为: 。 答案: 3 原子晶体 炸药(或高能材料) 高聚氮分解成N 2释放大量能量。(各1分) 第3题(6分)某实验测出人类呼吸中各种气体的分压/Pa 如下表所示: 3-1 请将各种气体的分子式填入上表。 3-2 指出表中第一种和第二种呼出气体的分压小于吸入气体分压的主要原因。 答案: 姓名学校赛场报名号赛区省市自治区
(每空1分,共4分) 呼出气中的N2的分压小于吸入气中的分压的主要原因是呼出气中的CO2和水蒸气有较大分压,总压不变,因而N2的摩尔分数下降(1分);呼出气中的O2的分压小于吸入气中的分压的主要原因是吸入的O2被人体消耗了。(1分)(共2分) 第4题(15分)在铜的催化作用下氨和氟反应得到一种铵盐和一种三角锥体分子A(键角102o,偶极矩0.78x10-30 C·m;对比:氨的键角107.3o,偶极矩4.74x10-30 C·m); 4-1 写出A的分子式和它的合成反应的化学方程式。 答案:NF3(1分)4NH3 + 3F2 = NF3 + 3NH4F(1分)(共2分) 4-2 A分子质子化放出的热明显小于氨分子质子化放出的热。为什么? 答案:N-F 键的偶极方向与氮原子孤对电子的偶极方向相反,导致分子偶极矩很小,因此质子化能力远比氨质子化能力小。画图说明也可,如: (1分) 4-3 A与汞共热,得到一种汞盐和一对互为异构体的B和C(相对分子质量66)。写出化学方程式及B和C的立体结构。 答案: 2NF3 +2Hg = N2F2 + 2HgF2(1分) (14+19)X2=66(每式1分)(共3分) 4-4 B与四氟化锡反应首先得到平面构型的D和负二价单中心阴离子E构成的离子化合物;这种离子化合物受热放出C,同时得到D和负一价单中心阴离子F构成的离子化合物。画出D、E、F 的立体结构;写出得到它们的化学方程式。 答案: D E F (每式1分) 2 N2F2 + SnF4 = [N2F+]2[SnF6]2-(1分) [N2F+]2[SnF6]2- = [N2F] +[SnF5]- + N2F2 (1分)(共5分) 4-5 A与F2、BF3反应得到一种四氟硼酸盐,它的阳离子水解能定量地生成A和HF,而同时得到的O2和H2O2的量却因反应条件不同而不同。写出这个阳离子的化学式和它的合成反应的化学方程式,并用化学方程式和必要的推断对它的水解反应产物作出解释。 答案: 阳离子的化学式为NF4+。(1分) NF3 + F2 + BF3 = NF4+BF4-(1分) NF4+水解反应首先得到HOF (否则写不出配平的NF4+水解反应):
初中化学竞赛辅导讲义(十) 可能用到的相对原予质量:H 一1 C--12 N 一14 O--16 Na 一23 Mg-24 S-32 C1—35.5 K —39 Ca —40 一、选择题(本题共l0小题,每小题1分,共10分。每小题只有1个选项符合题意) 1.下列有关数据项目中,描述物质化学性质的是 ( ) A .熔点 B .沸点 C .硬度 D .着火点 2.下列说法中,你不赞成的是 ( ) A .生产和使用电瓶车时无污染,不应限制生产和使用 B .为了保护环境,充分利用资源,要将垃圾分类回收 C .即使将烟囱建的高一些,也未必能够避免烟所产生的环境污染 D .认识酸雨、温室效应、臭氧空洞的产生需要一定的化学知识 3.中科院广州化学研究所采用最新的纳米技术,成功地开发了“用二氧化碳制取全降解塑料”的新技术。下列说法错误的是 ( ) A .该技术有助于减少“白色污染” B .泫技术有助于缓解“温室效应” C .该技术开辟了利用二氧化碳的新途径 D .全降解塑料不属于有机合成材料 4.“群众利益无小事,食品安全是大事”下列做法会导致食品对人体健康有害的是 ( ) A .用蔗糖作食品的甜味剂 B .用干冰保藏易腐败的食物 C .用甲醛溶液浸泡海产品 D .用袋装生石灰作饼干类食品的干燥剂 5.受热时软化成型,冷却后固化,但一经固化后,就不能用加热的方法使之软化的塑料,属于热同性塑料。制造下列物品应该用热固性塑料的是 ( ) A .炒菜用的铁锅手柄 B .食品包装袋 C .雨衣 D .电线外面的塑料护皮 6.近来我国航天事业的发展突飞猛进,“神六”载人航天飞船已经顺利升空和返航。下列燃料电池比较适合在宇宙飞船上使用的是 ( ) A .氢氧燃料电池 B .乙醇燃料电池 C .甲烷燃料电池 D .一氧化碳燃料电池 7 8,氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等领域,已知 氮、硅的原子结构示意图依次为:N ,Si 。请推测氮化硅的化学式(分子式) 为 ( ) A .Si 3N 4 B .Si 4N 3 C .Si 3N 7 D .Si 7N 3 9.双氧水(H 2O 2)的沸点比水高,但受热易分解。某试剂厂制得7%一8%的双氧水,欲将其浓缩 成30%的溶液,可采用的适宜方法是(蒸馏是利用液体沸点不同分离液体混合物的一种方法) +14 2 8 4 +7 2 5
2020年全国化学竞赛初赛模拟试卷 (时间:3小时 满分:100分) 题 号 1 2 3 4 5 6 7 8 9 10 11 12 13 满 分 H 1.008 相对原子质量 He 4.003 Li 6.941 Be 9.012 B 10.81 C 12.01 N 14.01 O 16.00 F 19.00 Ne 20.18 Na 22.99 Mg 24.31 Al 26.98 Si 28.09 P 30.97 S 32.07 Cl 35.45 Ar 39.95 K 39.10 Ca 40.08 Sc 44.96 Ti 47.88 V 50.94 Cr 52.00 Mn 54.94 Fe 55.85 Co 58.93 Ni 58.69 Cu 63.55 Zn 65.39 Ga 69.72 Ge 72.61 As 74.92 Se 78.96 Br 79.90 Kr 83.80 Rb 85.47 Sr 87.62 Y 88.91 Zr 91.22 Nb 92.91 Mo 95.94 Tc [98] Ru 101.1 Rh 102.9 Pd 106.4 Ag 107.9 Cd 112.4 In 114.8 Sn 118.7 Sb 121.8 Te 127.6 I 126.9 Xe 131.3 Cs 132.9 Ba 137.3 La -Lu Hf 178.5 Ta 180.9 W 183.8 Re 186.2 Os 190.2 Ir 192.2 Pt 195.1 Au 197.0 Hg 200.6 Tl 204.4 Pb 207.2 Bi 209.0 Po [210] At [210] Rn [222] Fr [223] Ra [226] Ac -Lr Rf Db Sg Bh Hs Mt Ds α-Al 2O 3既难溶于酸、也难溶于碱,但高温下与某盐反应可转化为可溶物;所得产物溶于适量水可结晶得到明矾。写出熔解α-Al 2O 3的反应方程式。 第二题(4分) 将一小块具有规则形状的胆矾晶体投入某温度下的饱和硫酸铜溶液中,甲、乙同学都观察到晶体未发生变化。甲同学认为:根据现象说明未发生晶体的溶解和结晶。乙同学认为:虽然未观察到晶体的变化,但存在溶解和结晶的动态平衡。你同意哪一位同学的分析?请设计2个实验实验证明。 第三题(7分) 氯代有机物通过各种途径进入到环境后会对生态环境和人体健康产生极大的危害。利用电化学方 法去除氯代芳烃污染物是极具应用前景的方法之一。某研究小组以Ag + 为媒质作用进行间接电化学氧 化,对大多数氯代芳烃的去除率都可达到99%以上。具体过程为Ag + 在阳极转化为A ,A 与水反应生成具有高度活性的自由基B ,B 攻击氯代芳烃分子,并最终将其氧化 1.写出电极反应方程式; 2.写出A →B 的反应方程式; 3.以五氯苯酚为例,写出B 将其氧化的方程式; 4.Ag +用于氯代芳烃处置的缺点除费用高外,还有1个不足之处是什么? 第四题(6分) 氮化碳结构如右图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。 1.写出氮化碳的化学式; 2.指出氮化碳的晶体类型; 3.请在右图中用粗线画出两种二维晶胞。 第五题(8分) 二亚胺X (结构如右图)广泛地用于聚氨酯、聚酯及聚氨酯塑料的生产,也用于医药、农药、生物化工等领域。其合成方法如下: A ??→?+2COCl B ??→?-HCl C ??→?缩合X 1.X 中两个苯环是否共平面,为什么?两个苯环对位4个碳原子是否共直线,为什么?
晶体结构综合例题 一.有一立方晶系的离子晶体,其结构如右图所示,试回答: 1.晶体所属的点阵形式及结构基元; 2.已知=169,=181,试问此两种离于联合组成了何种型式 的密堆积; 3.2+处在何种空隙里? 4.指出各离子的配位情况? 解:1. 立方P,3 ; 2. A1型(立方面心)堆积, +,-离子半径大致相近; 3. 八面体空隙中; 4. 2+周围-配位数6,+配位数8;-周围2+配位数2,+配位数4;+周围-配位数12,2+配位数8。 二.黄铜矿是最重要的铜矿,全世界的2/3的铜是由它提炼 的。 1.右图为黄铜矿的晶胞。计算晶胞中各种原子的数目,写出 黄铜矿的化学式; 2.在高温下,黄铜矿晶体中的金属离子可以发生迁移。若铁 原子与铜原子发生完全无序的置换,可将它们视作等同的金属离 子,请说出它的晶胞。 3.在无序的高温型结构中,硫原子作什么类型的堆积? 金属原子占据什么类型的空隙?该空隙被金属原子占据的分数是 多少? 4.计算黄铜矿晶体的密度; (晶胞参数:52.4,103.0;相对 原子量:63.5 55.84 S 32.06)。 解:1. 各种原子的数目, , S: 4, 4, 8; 黄铜矿的化学式2 ; 2.它的晶胞与晶胞相同;但金属离子随机性为50%; (如图); 3.硫原子作A1型(立方F)堆积; 金属原子占据四面体空 隙; 该空隙被金属原子占据的分数1/2; 4.容易计算黄铜矿晶体的密度4.313 . 1/21/2 S
三.冰晶石(36)用作电解法炼铝的助熔剂。冰晶石晶胞是以大阴离子(63- )构成的面 心立方晶格,+ 可看作是填充在晶格的空隙中,已知冰晶石的密度为2.953,—F 键长181 ,相对原子质量: 23.0; 27.0;F 19.0。 1.指出63- 配离子中心离子的杂化轨道类型、配离子空间构型和所属分子点群。 2.指出36的点阵形式;阴离子作何种形式的堆积,阳离子占据何种空隙及占有率;写出它们的分数坐标。 3.计算冰晶石晶体的晶胞参数。 4. 计算+ 的半径。 解:1. 63- 配离子中心离子的杂化轨道类型为 3d 2杂化; 配离子空间构型为正八面体; 所属分子点群为 。 2. 36的点阵形式为立方F ;阴离子作A 1型堆积,阳离子占据100%八面体空及 100%四面体空隙;它们的分数坐标为 63-: (0,0,0) (1/2,1/2,0) (1/2,0,1/2) (0,1/2,1/2)(1分); : (1/4,1/4,1/4) (1/4,1/4,3/4) (1/4,3/4,1/4) (1/4,3/4,3/4) (3/4,1/4,1/4) (3/4,1/4,3/4) (3/4,3/4,1/4) (3/4,3/4,3/4) (1/2,1/2,1/2) (0,0,1/2) (0,1/2,0) (1/2,0,0). 3.晶胞内含4个[36]单元,36摩尔质量为210。设晶胞边长为a ,则95.21 1002.642103 23=???a 780 4. 181, 按四面体空隙计算 pm R a 1564 3 =--;按八面体空隙计算为209(舍去); 真实值为157. 四.合金可看作由下图所示的a 、b 两种原子层交替堆积排列而成:a 是由和共同组成的层,层中-之间由实线相连;b 是完全由原子组成的层,-之间也由实线相连。图中由虚线勾出的六角形,表示由这两种层平行堆积时垂直于层的相对位置。c 是由a 和b 两种原子层交替堆积成的晶体结构图。在这结构中:同一层的-为294;相邻两层的-为327。 1.确定该合金的化学式; 2.有几个原子配位(周围的原子数,不一定要等距最近); 的配位情况如何,列式计算的平均配位数; 3.该晶体属何种晶系;写出各原子的分数坐标;计算晶胞参数。 4.计算该合金的密度( 40.1 63.5) 5.计算、原子半径。
1-3该离子是()。
A.质子酸 B.路易斯酸 C.自由基 D.亲核试剂 2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板。该分子的结构简图如下: 1-4该分子的分子式为; 1-5该分子有无对称中心? 1-6该分子有几种不同级的碳原子? 1-7该分子有无手性碳原子? 1-8该分子有无手性? 第2题(5分) 羟胺和用同位素标记氮原子(N﹡)的亚硝酸在不同介质中发生反应,方程式如下: NH2OH+HN﹡O2→A+H2O NH2OH+HN﹡O2→B+H2O A、B脱水都能形成N2O,由A得到N﹡NO和NN﹡O,而由B只得到NN﹡O。 请分别写出A和B的路易斯结构式。 第3题(8分) X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。该晶体的六方晶胞的参数:a=363.63pm,c=1766.63pm;p=2.53g·cm-3。 3-1 以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层 型结构的堆积方式。
3-2计算一个六方晶胞中“MgCl2”的单元数。 3-3 假定将该晶体中所有八面体空隙皆填满Mg2+离子,将是哪种晶体结构类型? 第4题(7分) 化合物A是一种热稳定性较差的无水的弱酸钠盐。用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表: 利用上述信息,通过作图,推断化合物A的化学式,并给出计算过程。 第5题(10分) 甲苯与干燥氯气在光照下反应生成氯化苄,用下列方法分析粗产品的纯度:称取0.255g 样品,与25mL 4mol·L-1氢氧化钠水溶液在100 mL圆底烧瓶中混合,加热回流1小时;冷至室温,加入50 mL20%硝酸后,用25.00mL 0.1000mol·L-1硝酸银水溶液处理,再用0.1000mol·L-1NH4SCN水溶液滴定剩余的硝酸银,以硫酸铁铵为指示剂,消耗了6.75 mL。
高中化学竞赛第三讲热分解反应基本规律 本讲的主题是“有规则拆分”! 一、热分解反应的“推动力” 从热力学角度看,热分解反应是向着能量低产物方向进行,反应的“推动力”是能量降低的过程(△r G=△r H-T△r S)。 用上述观点可以解释下列反应为什么是按(1)式而不是按(2)式进行: CaCO3→CaO+CO2(1)CaCO3→CaC+3/2O2(2) KClO3→KCl+3/2O2(1)KClO3→1/2K2O+1/2Cl2O5(2) 二、含氧酸盐的热分解反应规律 按上述能量观点,由于氧化物能量低于相应硫化物、氮化物、磷化物、碳化物,所以(大多数)硫酸盐、硝酸盐、碳酸盐、草酸盐的(固态)热分解按以下规律进行:含氧酸盐(s)→金属氧化物(s)+酸酐(热分解通式) 还要考虑的是,酸酐是否稳定?金属氧化物是否稳定?两种产物间是否还会发生氧化还原反应?(实例见下)。 (一)硫酸盐的热分解反应 规律:硫酸盐(s)→金属氧化物(s)+SO3 例: 1、当温度显著高于758℃时,SO3分解,气态产物以SO2和O2为主,反之气态产物以SO3为主。(758℃是从△r G=△r H-T△r S计算出来的数据。) 例: 2、在活动序中位于铜以后的金属硫酸盐,因碱性氧化物对热不稳定而分解。 例: 若分解温度不很高,则得HgO和SO3;若高于HgO显著分解的温度,则产物为Hg和SO3、O2。 3、两种产物间发生氧化还原反应 例: 产物中有Fe2O3、SO2,原因是“高温”下SO3有一定的氧化性,氧化FeO为Fe2O3,自身转化为SO2。 (二)硝酸盐的热分解反应 1、NaNO3、KNO3在温度不很高条件下分解为MNO2和O2。 例:2KNO32KNO2+O2↑ 2、其余硝酸盐均可按照热分解反应通式讨论:硝酸盐→金属氧化物+硝酸酐(N2O5) ∵N2O5在室温下就明显分解:N2O5=2NO2+1/2O2
全国高中学生化学竞赛初赛试题 考试时间:3小时 第1题(1分) (1)金属锰可以用四氧化三锰为原料通过铝热法来制备。试写出配平的化学方程式。 (2)CS2是一种有恶臭的液体,把它滴入硫酸酸化的高锰酸钾水溶液,将析出硫磺,同时放出CO2,写出配平的化学式方程式。 第2题(10分) (1)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;这个用酶为催化剂的反应的另一个反应物是CO2,它在反应后转变成有机物,可用甲醛来表示,试写出配平的离子方程式。 (2)地球化学家用实验证实,金矿常与磁铁矿共生的原因是:在高温高压的水溶液(即所谓“热液”)里,金的存在形式是[AuS-]络离子,在溶液接近中性时,它遇到Fe2+离子会发生反应,同时沉积出磁铁矿和金矿,试写出配平的化学方程式。 第3题(10分) 矿物胆矾就是CuSO4·5H2O,当它溶于水渗入地下,遇到黄铁矿(FeS2),铜将以辉铜矿(Cu2S)的形式沉积下来;而反应得到的铁和硫则进入水溶液,该溶液无臭味,透明不浑浊,绿色,呈强酸性,在有的矿区常可见到这种具有强腐蚀性的地下水(俗称黑水)渗出地面,上述反应可以用一个化学方程式来表示,试写出配乎的化学方程式。 第4题(10分) 制备硫代硫酸钠的方法之一是把二氧化硫通人硫化钠和碳酸钠(摩尔比2︰1)的混合溶液。在反应过程中,先生成黄色的固体,其量先逐渐增多,然后又逐渐减少,溶液的pH 值降到7左右时,溶液近于无色,反应已经完成。如果继续通入二氧化硫,溶液的pH值降到5,又会有固体物质出现。 写出和以上现象有关的各个配干的化学方程式。 第5题(10分) 取2.5克KClO3粉末置于冰水冷却的锥形瓶中,加入5.0克研细的I2,再注入3cm3水,在45分钟内不断振荡,分批加入9~10cm3浓HCl,直到I2完全消失为止(整个反应过程保持在40℃以下)。将锥形瓶置于冰水中冷却,得到橙黄色的晶体A。 将少量A置于室温下的干燥的试管中,发现A有升华现象,用湿润的KI-淀粉试纸在管口检测,试纸变蓝.接着把试管置于热水浴中,有黄绿色的气体生成,管内的固体逐渐变成红棕色液体。 将少量A分别和KI,Na2S2O3,H2S等溶液反应,均首先生成I2。 酸性的KMnO4可将A氧化,得到的反应产物是无色的溶液。 (1)写出A的化学式;写出上述制备A的配平的化学方程式。 (2)写出A受热分解的化学方程式。 (3)写出A和KI反应的化学方程式。 附:原子量K 39.10;Cl 35.45;I 126.9;O 16.00 第6题(10分) 某烃,在标准状态下呈气态,取10cm3该烃跟70cm3氧气混合,并用电火花引燃。反应后先使水蒸气冷凝,测出混合气体的体积是65cm3,再将气体通过氢氧化钾溶液,剩余的气体的体积为45cm3。所有的气体体积都是在标准状态下测定的,试求这种烃的分子式。 第7题(10分)
高中化学竞赛用书推荐 常规/高考类: 化学岛 用户名: 密码:woaihuaxuedao 以下是另一个公邮 icholand. 密码:huaxuedaogongyou 提供公共邮箱的目的还是方便大家交流,如果遇到超出流量限制的问题,可以直接把邮件转发出去。 尽管以前有XX的Gbaopan。。但是貌似很多人并不清楚密码。。 附上: 部分优秀资料帖索引 《高中化学重难点手册》(华中师范大学出版社,王后雄老师主编);历年高考试题汇编(任何一种,最好有详细解析的,比如三年高考两年模拟);《高中化学读本》(很老的人民教育出版社甲种本化学教材,最近有更新版本);《高中化学研究性学习》(龙门书局,施华、盛焕华主编)南师大化科院创办的《化学教与学》每年的十套高考模拟题题型新颖质量比较高,可作为江苏预赛的模拟卷,不少5月份预赛原题就出自本套模拟题。 初赛类: 比较经典的有《化学高考到竞赛》(陕西师范大学出版社,李安主编,比较老);《高中化学奥林匹克初级本》(江苏教育出版社,段康宁主编);《高中化学竞赛初赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《高中化学竞赛热点专题》(湖南师范大学出版社,肖鹏飞、苏建祥、周泽宇主编,版本比较老,但编排体系不错);最新奥林匹克竞赛试题评析·高中化学》(南京师范大学出版社,马宏佳主编,以历年真题详细解析为主,可作为课外指导);《最新竞赛试题选编及解析高中化学卷》(首都师范大学出版社);《化学竞赛教程》(华东师范大学出版社,三本,王祖浩、邓立新、施华等人编写,适合同步复习),还有一套西南师范大学出版社的《奥林匹克竞赛同步教材·高中化学》(分高一、高二和综合卷,综合卷由严先生、吴先生、曹先生等参加编写,绝对经典),还有浙江大学出版社《高中化学培优教程》AB教程、《金牌教程·高一/二化学》(邓立新主编,南京大学出版社)。江苏省化学夏令营使用的讲义是马宏佳主编的《全国高中化学竞赛标准教程》(东南大学出版社),简明扼要,但由于不同教授编写不同章节,参差不齐;春雨出版的《冲刺金牌·高中化学奥赛辅导》(任学宝主编,吉林教育出版社)、《冲刺金牌·高中化学奥赛解题指导》(孙夕礼主编,吉林教育出版社)。《赛前集训·高中化学竞赛专题辅导》(施华编著,体现他的竞赛培训思维,华东师范大学出版社) 比较新颖的包括浙江大学出版社的林肃浩主编的竞赛系列《高中化学竞赛实战演练》(高一、高二)、《高中化学竞赛解题方法》、《冲刺高中化学竞赛(省级预赛)》、《冲刺高中化学竞赛(省级赛区)》、《高中化学竞赛解题方法》、《决战四月:浙江省高中化学竞赛教程(通向金牌之路)》《金版奥赛化学教程》(高一、高二、·综合)都是近年来体系、选题新颖的竞赛资料,足见浙江省对化学竞赛的重视,端木非常推荐。南京教研室刘江田老师2010年5月份主编的《高中化学竞赛全解题库》(南京大学出版社)选择了近年来省级赛区真题和各地新颖的预赛题,解析详细,适合缺少老师指导的同学参考。 决赛类: 比较经典的有《高中化学奥林匹克高级本》(江苏教育出版社,段康宁主编,完全按照大学的思路);《金牌之路高中化学竞赛辅导》以及配套解题指导书(陕西师范大学出版社,李安主编);《高中化学竞赛决赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《历届国际化学奥林匹克竞赛试题分析》(学苑出版社);《最新国际国内化学奥林匹克竞赛优化解题题典》(吉林教育出版社),还有浙江大学出版社的浙江大学出版社《高中化学培优教程》“专题讲座”,《高中化学奥赛一