
62 MICROBIOLOGICAL EXAMINATION OF NONSTERILE PRODUCTS: TESTS FOR SPECIFIED
MICROORGANISMS
非无菌产品微生物限度检查:控制菌(USP38)
1.INTRODUCTION导言
The tests described hereafter will allow determination of the absence of, or limited occurrence of, specified microorganisms that may be detected under the conditions described.
控制菌检查法系用于在规定的试验条件下,检查供试品中是否存在特定的微生物。
The tests are designed primarily to determine whether a substance or preparation complies with an established specification for microbiological quality. When used for such purposes, follow the instructions given below, including the number of samples to be taken, and interpret the results as stated below.
当本法用于检查非无菌制剂及其原辅料是否符合相应的微生物限度标准时,应按下列规定进行检验,,包括样品的取样量,结果的判断.
Alternative microbiological procedures, including automated methods, may be used, provided that their equivalence to the Pharmacopeial method has been demonstrated.
可以使用包括自动化法在内的方法,需确认与药典方法的等同性.
2.GENERAL PROCEDURES通用规程
The preparation of samples is carried out as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61.
供试品制备,同USP<61>
If the product to be examined has antimicrobial activity, this is insofar as possible removed or neutralized as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61.
若供试品有抗菌活性,应尽可能中和或去除,中和或去除的方法同USP<61>
If surface-active substances are used for sample preparation, their absence of toxicity for microorganisms and their compatibility with any inactivators used must be demonstrated as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61.
若供试品制备过程中使用了表面活性剂,应确认其对微生物的无毒性以及与所用的中和剂/灭活剂的相容性,同USP<61>
3.GROWTH-PROMOTING AND INHIBITORY PROPERTIES OF THE MEDIA, SUITABILITY
OF THE TEST AND NEGATIVE CONTROLS 培养基适用性检查,控制菌检查方法的适用性
确认,阴性对照
The ability of the test to detect microorganisms in the presence of the product to be tested must be established. Suitability must be confirmed if a change in testing performance or a change in the product that may affect the outcome of the test is introduced.
在有供试品存在的情况下,所建立的方法应能检测微生物。若检测程序或产品发生变化可能影响检测结果时,控制菌检查方法应重新进行适用性试验。
3.1.Preparation of Test Strains试验菌液的制备
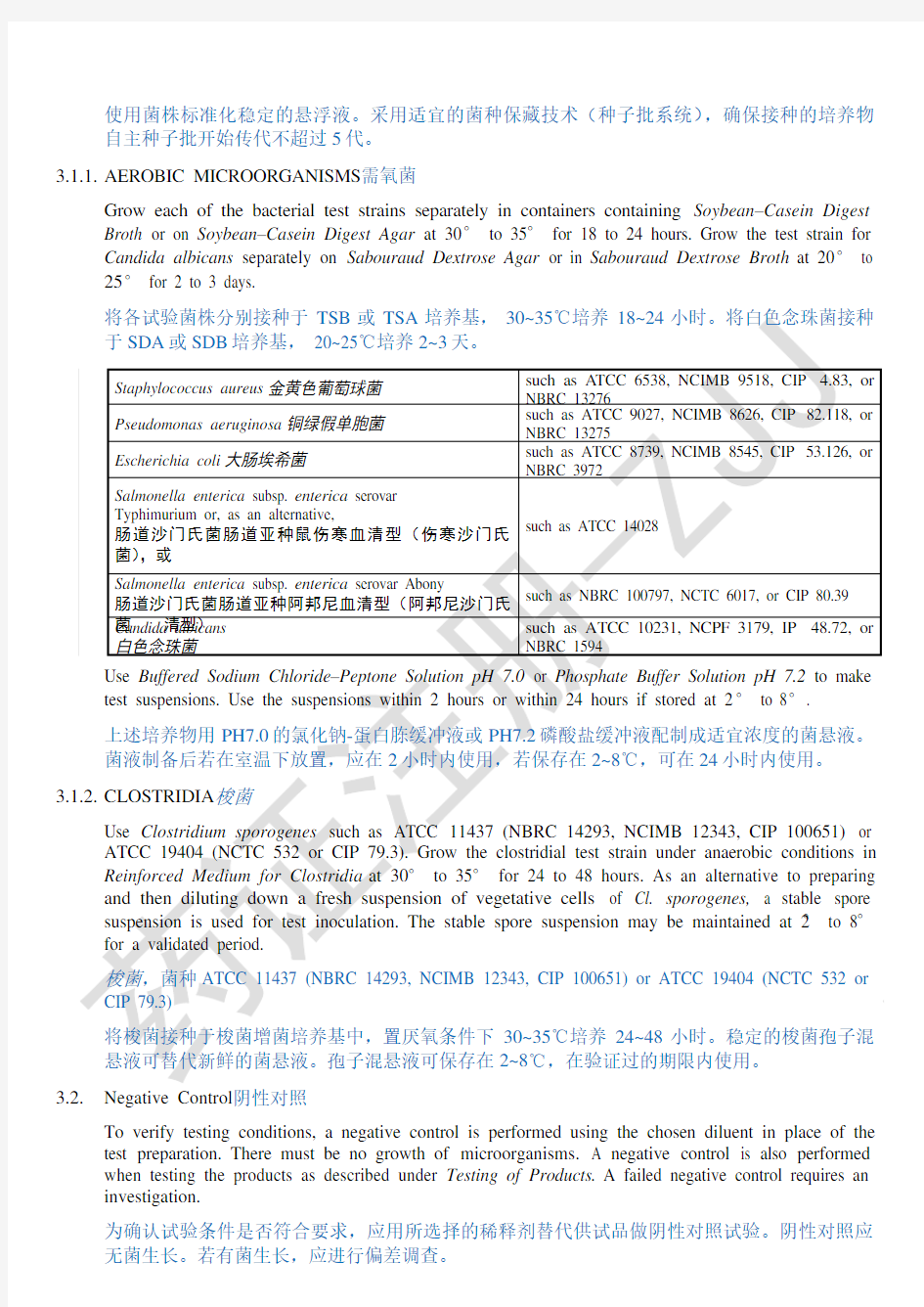
Use standardized stable suspensions of test strains as stated below. Seed-lot culture maintenance techniques (seed- lot systems) are used so that the viable microorganisms used for inoculation are not more than five passages removed from the original master seed-lot.
使用菌株标准化稳定的悬浮液。采用适宜的菌种保藏技术(种子批系统),确保接种的培养物自主种子批开始传代不超过5代。
3.1.1.AEROBIC MICROORGANISMS需氧菌
Grow each of the bacterial test strains separately in containers containing Soybean–Casein Digest Broth or on Soybean–Casein Digest Agar at 30° to 35° for 18 to 24 hours. Grow the test strain for Candida albicans separately on Sabouraud Dextrose Agar or in Sabouraud Dextrose Broth at 20° to 25° for 2 to 3 days.
将各试验菌株分别接种于TSB或TSA培养基,30~35℃培养18~24小时。将白色念珠菌接种于SDA或SDB培养基, 20~25℃培养2~3天。
Staphylococcus aureus金黄色葡萄球菌such as A TCC 6538, NCIMB 9518, CIP 4.83, or
NBRC 13276
Pseudomonas aeruginosa铜绿假单胞菌such as ATCC 9027, NCIMB 8626, CIP 82.118, or
NBRC 13275
Escherichia coli大肠埃希菌such as ATCC 8739, NCIMB 8545, CIP 53.126, or
NBRC 3972
Salmonella enterica subsp. enterica serovar
Typhimurium or, as an alternative,
肠道沙门氏菌肠道亚种鼠伤寒血清型(伤寒沙门氏
菌),或
such as ATCC 14028
Salmonella enterica subsp. enterica serovar Abony
肠道沙门氏菌肠道亚种阿邦尼血清型(阿邦尼沙门氏菌清型)such as NBRC 100797, NCTC 6017, or CIP 80.39
Candida albicans 白色念珠菌such as A TCC 10231, NCPF 3179, IP 48.72, or NBRC 1594
Use Buffered Sodium Chloride–Peptone Solution pH 7.0 or Phosphate Buffer Solution pH 7.2 to make test suspensions. Use the suspensions within 2 hours or within 24 hours if stored at 2° to 8°.
上述培养物用PH7.0的氯化钠-蛋白胨缓冲液或PH7.2磷酸盐缓冲液配制成适宜浓度的菌悬液。
菌液制备后若在室温下放置,应在2小时内使用,若保存在2~8℃,可在24小时内使用。
3.1.2.CLOSTRIDIA梭菌
Use Clostridium sporogenes such as ATCC 11437 (NBRC 14293, NCIMB 12343, CIP 100651) or ATCC 19404 (NCTC 532 or CIP 79.3). Grow the clostridial test strain under anaerobic conditions in Reinforced Medium for Clostridia at 30° to 35° for 24 to 48 hours. As an alternative to preparing and then diluting down a fresh suspension of vegetative cells of Cl. sporogenes, a stable spore suspension is used for test inoculation. The stable spore suspension may be maintained at 2° to 8°for a validated period.
梭菌,菌种ATCC 11437 (NBRC 14293, NCIMB 12343, CIP 100651) or ATCC 19404 (NCTC 532 or CIP 79.3)
将梭菌接种于梭菌增菌培养基中,置厌氧条件下30~35℃培养24~48小时。稳定的梭菌孢子混悬液可替代新鲜的菌悬液。孢子混悬液可保存在2~8℃,在验证过的期限内使用。
3.2.Negative Control阴性对照
To verify testing conditions, a negative control is performed using the chosen diluent in place of the test preparation. There must be no growth of microorganisms. A negative control is also performed when testing the products as described under Testing of Products. A failed negative control requires an investigation.
为确认试验条件是否符合要求,应用所选择的稀释剂替代供试品做阴性对照试验。阴性对照应无菌生长。若有菌生长,应进行偏差调查。
供试品检查时,也需要做阴性对照。
3.3. Growth Promotion and Inhibitory Properties of the Media 培养基的促生长和抑制能力试验(适用性
检查)
Test each batch of ready-prepared medium and each batch of medium prepared either from dehydrated medium or from ingredients. Verify suitable properties of relevant media as described in Table 1.
已制备培养基,干燥的培养基或按照组分配制的培养基,每一批都需要进行适用性检查,检查项目包括促生长能力,抑制能力及指示特性的检查。各培养基的检查项目及所用菌株见表1. Table 1 . Growth Promoting, Inhibitory, and Indicative Properties of Media
培养基促生长能力,抑制能力和指示特性
Test/Medium 培养基 Property 项目
Test Strains 试验菌株 Test for bile-tolerant Gram-negative bacteria 耐胆盐革兰阴性菌
Enterobacteria Enrichment Broth Mossel
肠道菌增菌液体培养基 Growth promoting 促生长能力 E. coli 大肠埃希菌 P . aeruginosa 铜绿假单胞菌 Inhibitory 抑制能力
S. aureus 金黄色葡萄球菌 Violet Red Bile Glucose Agar 紫红胆盐葡萄糖琼脂培养基 Growth promoting +Indicative
促生长能力+指示特性 E. coli 大肠埃希菌 P . aeruginosa 铜绿假单胞菌
Test for Escherichia coli 大肠埃希菌
MacConkey Broth 麦康凯液体培养基 Growth promoting 促生长能力
E. coli 大肠埃希菌 Inhibitory 抑制能力 S. aureus 金黄色葡萄球菌
MacConkey Agar 麦康凯琼脂培养基 Growth promoting +Indicative 促生长能力+指示特性
E. coli 大肠埃希菌 Test for Salmonella 沙门氏菌
Rappaport Vassiliadis Salmonella Enrichment Broth
RV 沙门菌增菌液体培养基
Growth promoting 促生长能力 Salmonella enterica subsp. Enterica
serovar Typhimurium or
肠道沙门氏菌肠道亚种鼠伤寒血清
型(伤寒沙门氏菌),或 Salmonella enterica subsp. enterica serovar Abony 肠道沙门氏菌肠道亚种阿邦尼血清
型(阿邦尼沙门氏菌,血清型)
Inhibitory 抑制能力 S. aureus 金黄色葡萄球菌
Xylose Lysine Deoxycholate Agar 木糖赖氨酸脱氧胆酸盐琼脂培养基 Growth promoting +Indicative
促生长能力+指示特性
Salmonella enterica subsp. Enterica
serovar Typhimurium or
肠道沙门氏菌肠道亚种鼠伤寒血清
型(伤寒沙门氏菌),或 Salmonella enterica subsp. enterica serovar Abony
肠道沙门氏菌肠道亚种阿邦尼血清
型(阿邦尼沙门氏菌,血清型)
Test for Pseudomonas aeruginosa 铜绿假单胞菌
Cetrimide Agar 溴化十六烷基三甲铵琼脂培养基 Growth promoting 促生长能力
P . aeruginosa 铜绿假单胞菌 Inhibitory 抑制能力 E. coli 大肠埃希菌
Test for Staphylococcus aureus 金黄色葡萄球菌
Mannitol Salt Agar 甘露醇盐琼脂培养基 Growth promoting +Indicative 促生长能力+指示特性 S. aureus 金黄色葡萄球菌 Inhibitory 抑制能力 E. coli 大肠埃希菌
Test for Clostridia 梭菌
Reinforced Medium for Clostridia 梭菌增菌培养基
Growth promoting 促生长能力 Cl. Sporogenes 生孢梭菌 Columbia Agar 哥伦比亚琼脂培养基 Growth promoting 促生长能力 Cl. Sporogenes 生孢梭菌
Test for Candida albicans白色念珠菌
Sabouraud Dextrose Broth沙氏葡萄
糖液体培养基
Growth promoting促生长能力 C. albicans白色念珠菌
Sabouraud Dextrose Agar沙氏葡萄糖琼脂培养基Growth promoting +Indicative
促生长能力+指示特性 C. albicans
白色念珠菌
Test for Growth-Promoting Properties, Liquid Media— Inoculate a portion of the appropriate medium with a small number (not more than 100 cfu) of the appropriate microorganism. Incubate at the specified temperature for not more than the shortest period of time specified in the test. Clearly visible growth of the microorganism comparable to that previously obtained with a previously tested and approved batch of medium occurs.
液体培养基的促生长能力检查:
接种不大于100cfu的试验菌至液体培养基,在相应控制菌检查规定的培养温度及不大于规定的最短培养时间下培养。与参比培养基比较(之前检测并批准的培养基),菌落生长良好。
Test for Growth-Promoting Properties, Solid Media— Perform Surface-Spread Method (see Plate-Count Methods under Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61, inoculating each plate with a small number (not more than 100 cfu) of the appropriate microorganism. Incubate at the specified temperature for not more than the shortest period of time specified in the test. Growth of the microorganism comparable to that previously obtained with a previously tested and approved batch of medium occurs.
固体培养基的促生长能力检查,按涂布法(详见USP61)操作:
接种不大于100cfu的试验菌,在相应控制菌检查规定的培养温度及不大于规定的最短培养时间下培养。与参比培养基比较(之前检测并批准的培养基),菌落大小,形态特征应一致。
Test for Inhibitory Properties, Liquid or Solid Media— Inoculate the appropriate medium with at least 100 cfu of the appropriate microorganism. Incubate at the specified temperature for not less than the longest period of time specified in the test. No growth of the test microorganism occurs.
液体或固体培养基的抑制能力检查——接种不少于100cfu的试验菌。在相应控制菌检查规定的培养温度及不小于规定的最长培养时间下培养。试验菌应不得生长。
Test for Indicative Properties— Perform Surface-Spread Method (see Plate-Count Methods under Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61, inoculating each plate with a small number (not more than 100 cfu) of the appropriate microorganism. Incubate at the specified temperature for a period of time within the range specified in the test. Colonies are comparable in appearance and indication reactions to those previously obtained with a previously tested and approved batch of medium.
培养基的指示特性检查,按涂布法(详见USP61)操作:
接种不大于100cfu的试验菌。在相应控制菌检查规定的培养温度和培养时间范围内培养。参照之前检测和批准的培养基,试验菌生长的菌落大小,形态特性,指示剂反应应一致。
3.4.Suitability of the Test Method控制菌检查方法的适用性试验
For each new product to be tested perform sample preparation as described in the relevant paragraph under Testing of Products. At the time of mixing, add each test strain in the prescribed growth medium.
Inoculate the test strains individually. Use a number of microorganisms equivalent to not more than 100 cfu in the inoculated test preparation.
根据“供试品检查”项下的要求制备供试品溶液。混合步骤,分别接种不大于100cfu的各试验菌至规定的培养基中。
Perform the test as described in the relevant paragraph under Testing of Products using the shortest
incubation period prescribed.
按“供试品检查”项下要求操作,并在规定的最短培养时间内培养。
The specified microorganisms must be detected with the indication reactions as described under Testing of Products.
应能检出所加控制菌“供试品检查”项下描述的反应特征。
Any antimicrobial activity of the product necessitates a modification of the test procedure (see Neutralization/Removal of Antimicrobial Activity under Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61
若供试品有抗菌活性,需调整方法,对供试品进行中和或灭活,具体方法详见USP 61
For a given product, if the antimicrobial activity with respect to a microorganism for which testing is prescribed cannot be neutralized, then it is to be assumed that the inhibited microorganism will not be present in the product.
如果经过试验确证供试品对某微生物的抑菌活性无法中和,那么可假设被抑制的微生物将不会存在于该供试品中。
4.TESTING OF PRODUCTS供试品检查
4.1.Bile-Tolerant Gram-Negative Bacteria耐胆盐革兰阴性菌
Sample Preparation and Pre-Incubation— Prepare a sample using a 1 in 10 dilution of not less than 1 g of the product to be examined as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61, but using Soybean–Casein Digest Broth as the chosen diluent, mix, and incubate at 20°to 25°for a time sufficient to resuscitate the bacteria but not sufficient to encourage multiplication of the organisms (usually 2 hours but not more than 5 hours).
供试液制备和预培养:
取不少于1g供试品,TSB作为稀释剂,按1:10稀释得到供试品溶液,其他操作同USP 61,混匀,在20~25℃培养,培养时间应使供试品中的细菌复苏但不增值(通常适宜的培养时间为2小时,最长不得多于5小时)
4.1.1.Test for Absence— 定性检测
Unless otherwise prescribed, use the volume corresponding to 1 g of the product, as prepared in Sample Preparation and Pre-Incubation, to inoculate Enterobacteria Enrichment Broth Mossel.
Incubate at 30° to 35° for 24 to 48 hours. Subculture on plates of Violet Red Bile Glucose Agar.
Incubate at 30° to 35° for 18 to 24 hours. The product complies with the test if there is no growth of colonies.
除另有规定外,取相当于1g样品的上述预培养物,接种至适宜体积的增菌培养基(经方法适用性试验确定),在30~35℃培养24~48小时后,划线接种至紫红胆盐葡萄糖琼脂培养基上进行分离培养,30~35℃培养18~24小时。如果平板上无菌落生长,判断供试品未检出耐胆盐革兰阴性菌。
4.1.2.Quantitative Test—定量检测
Selection and Subculture— Inoculate suitable quantities of Enterobacteria Enrichment Broth Mossel with the preparation as directed under Sample Preparation and Pre-Incubation and/or dilutions of it containing respectively 0.1 g, 0.01 g, and 0.001 g (or 0.1 mL, 0.01 mL, and 0.001 mL) of the product to be examined. Incubate at 30 to 35 for 24 to 48 hours. Subculture each of the cultures on a plate of Violet Red Bile Glucose Agar. Incubate at 30° to 35° for 18 to 24 hours.
选择和分离培养——取按“供试品制备”和“预培养”项下制备的相当于0.1g, 0.01g 0.001g(0.1
mL,0.01mL 和0.001mL)供试品的预培养物及其稀释液,分别接种至适宜体积的增菌培养基(经方法适用性试验确认),30~35℃培养24~48小时。上述各培养物分别划线接种至紫红胆盐葡萄糖琼脂培养基进行分离培养, 30~35℃培养18~24小时。
Interpretation— Growth of colonies constitutes a positive result. Note the smallest quantity of the product that gives a positive result and the largest quantity that gives a negative result. Determine from Table 2 the probable number of bacteria.
结果判断——若紫红胆盐葡萄糖琼脂培养基平板上有菌落生长,则对应培养管为阳性,否则为阴性。记录阳性结果的最少样品量以及阴性结果的最大样品量。根据表2查每克或每毫升供试品中含有耐胆盐革兰阴性菌的可能菌数。
Table 2. Interpretation of Results结果判断
Results for Each Quantity of Product各样品量结果
0.1g or 0.1mL 0.01g or 0.01mL 0.001g or 0.001mL Probable Number of Bacteria per g or mL of Product 每克或每毫升供试品中可能菌数
+ + + more than 103
+ + – less than 103 and more than 102
+ – – less than 102 and more than 10
– – – less than 10
4.2.Escherichia coli大肠埃希菌
Sample Preparation and Pre-Incubation— Prepare a sample using a 1 in 10 dilution of not less than 1 g of the product to be examined as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61and use 10 mL or the quantity corresponding to 1 g or 1 mL, to inoculate a suitable amount (determined as described under Suitability of the Test Method) of Soybean–Casein Digest Broth, mix, and incubate at 30° to 35° for 18 to 24 hours.
供试液制备和预培养:
取不少于1g供试品,照USP61制成1:10的供试品液,取10mL,或相当于1g或1mL样品量的供试品溶液,接种至适宜体积的TSB (经方法适用性试验确定),混匀,30~35℃培养18~24小时。
Selection and Subculture— Shake the container, transfer 1 mL of Soybean–Casein Digest Broth to 100 mL of MacConkey Broth, and incubate at 42 to 44 for 24 to 48 hours. Subculture on a plate of MacConkey Agar at 30° to 35° for 18 to 72 hours.
选择和分离培养——摇晃并转移1mL上述TSB培养物至100mL麦康凯液体培养基,在42~44℃条件下培养48小时。取适量培养物,划线接种至麦康凯琼脂培养基,30~35℃培养18~72小时。
Interpretation— Growth of colonies indicates the possible presence of E. coli. This is confirmed by identification tests. The product complies with the test if no colonies are present or if the identification tests are negative.
结果判断——若麦康凯琼脂培养基平板上有菌落生长说明可能有大肠埃希菌,需进行鉴别试验,判断是否为大肠埃希菌。若无菌落生长或鉴别结果为阴性,判断供试品未检出大肠埃希菌
4.3.Salmonella沙门菌
Sample Preparation and Pre-Incubation— Prepare the product to be examined as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61,and use the quantity corresponding to not less than 10 g or 10 mL to inoculate a suitable amount (determined as described under Suitability of the Test Method) of Soybean–Casein Digest Broth, mix, and incubate at 30° to 35° for 18 to 24 hours.
供试品液制备和预培养——按USP 61制备供试品液,取相当于不少于10g或10mL样品量的供
试品液,接种至适宜体积的TSB (经方法适用性试验确定),混合,30~35℃培养18~24小时。
Selection and Subculture— Transfer 0.1 mL of Soybean–Casein Digest Broth to 10 mL of Rappaport Vassiliadis Salmonella Enrichment Broth, and incubate at 30° to 35° for 18 to 24 hours. Subculture on plates of Xylose Lysine Deoxycholate Agar. Incubate at 30° to 35° for 18 to 48 hours.
选择和分离培养——取0.1mL上述TSB培养物至10mLRV沙门增菌液体培养基, 30~35℃培养18~24小时。取上述培养物,划线接种到木糖赖氨酸脱氧胆酸琼脂培养基, 30~35℃培养18~48小时。
Interpretation— The possible presence of Salmonella is indicated by the growth of well-developed, red colonies, with or without black centers. This is confirmed by identification tests. The product complies with the test if colonies of the types described are not present or if the confirmatory identification tests are negative.
结果判断——若木糖赖氨酸脱氧胆酸琼脂培养基平板上有红色,生长良好,有或无黑色中心的菌落生长说明可能存在沙门氏菌。需进行鉴别试验,确证是否为沙门菌。若无上述类型的菌落生长或鉴别结果为阴性,判断供试品未检出沙门菌。
4.4.Pseudomonas aeruginosa铜绿假单胞菌
Sample Preparation and Pre-Incubation— Prepare a sample using a 1 in 10 dilution of not less than 1 g of the product to be examined as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61, and use 10 mL or the quantity corresponding to 1 g or 1 mL to inoculate a suitable amount (determined as described under Suitability of the Test Method) of Soybean–Casein Digest Broth, and mix. When testing transdermal patches, filter the volume of sample corresponding to one patch of the preparation (see Transdermal Patches under Preparation of the Sample in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61 through a sterile filter membrane, and place in 100 mL of Soybean–Casein Digest Broth. Incubate at 30°to 35° for 18 to 24 hours.
供试品液制备和预培养——取不少于1g的供试品,按USP 61 制成1:10的供试品液,取10mL 或相当于1g或1mL样品量的供试品液接种至适宜体积的TSB(经方法适用性试验确定),混合。
透皮贴剂的检测,取相当于1片贴剂的供试品液(详见USP61中透皮贴剂供试品制备),无菌滤膜过滤后加入100mLTSB培养基中, 30~35℃培养18~24小时。
Selection and Subculture— Subculture on a plate of Cetrimide Agar, and incubate at 30° to 35° for
18 to 72 hours.
选择和分离培养——取上述培养物,划线接种至溴化十六烷基三甲胺琼脂培养基,30~35℃培养18~72小时。
Interpretation— Growth of colonies indicates the possible presence of P. aeruginosa. This is confirmed by identification tests. The product complies with the test if colonies are not present or if the confirmatory identification tests are negative.
结果判断——若溴化十六烷基三甲胺琼脂培养基平板上有菌生长说明可能存在铜绿假单胞菌。
需进行鉴别试验,确证是否为铜绿假单胞菌。如果无菌生长或鉴别试验为阴性,判断供试品未检出铜绿假单胞菌。
4.5.Staphylococcus aureus金黄色葡萄球菌
Sample Preparation and Pre-Incubation— Prepare a sample using a 1 in 10 dilution of not less than 1 g of the product to be examined as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61, and use 10 mL or the quantity corresponding to 1 g or 1 mL to inoculate a suitable amount (determined as described under Suitability of the Test Method) of Soybean–Casein Digest Broth, and homogenize. When testing transdermal patches, filter the volume of sample corresponding to one patch of the preparation (see Transdermal Patches under Preparation of the
Sample in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61 through a sterile filter membrane, and place in 100 mL of Soybean–Casein Digest Broth. Incubate at 30 to 35 for 18 to 24 hours.
供试品液制备和预培养——取不少于1g供试品,根据USP 61 制成1:10的供试品液,取10mL,或相当于1g或1mL样品量的供试品溶液,接种至适宜体积的TSB(经方法适用性试验确定),混合均匀。透皮贴剂的检测,取相当于1片贴剂的供试品液(详见USP61中透皮贴剂供试品制备),无菌滤膜过滤后加入100mLTSB培养基中, 30~35℃培养18~24小时。
Selection and Subculture— Subculture on a plate of Mannitol Salt Agar, and incubate at 30° to 35°for 18 to 72 hours.
选择和分离培养——取上述培养物,划线接种至甘露醇盐琼脂培养基,30~35℃培养18~72小时。
Interpretation—The possible presence of S. aureus is indicated by the growth of yellow or white colonies surrounded by a yellow zone. This is confirmed by identification tests. The product complies with the test if colonies of the types described are not present or if the confirmatory identification tests are negative.
结果判断——若甘露醇盐琼脂培养基平板上有黄色菌落或外周有黄色圈的白色菌落生长说明可能有金黄色葡萄球菌,需进行鉴别试验,确证是否为金黄色葡萄球菌。若无上述类型的菌落生长或鉴别试验显阴性,判断供试品未检出金黄色葡萄球菌。
4.6.Clostridia梭菌
Sample Preparation and Heat Treatment— Prepare a sample using a 1 in 10 dilution (with a minimum total volume of 20 mL) of not less than 2 g or 2 mL of the product to be examined as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61. Divide the sample into two portions of at least 10 mL. Heat one portion at 80° for 10 minutes, and cool rapidly.
Do not heat the other portion.
供试品液制备和热处理:
取不少于2g或2mL的供试品,按USP 61 制成1:10的供试品溶液(总体积最少20mL)。将供试品液一分为二,每份至少10mL。一份在80℃加热10分钟立即冷却,另一份不加热。
Selection and Subculture— Use 10 mL or the quantity corresponding to 1 g or 1 mL of the product to be examined of both portions to inoculate suitable amounts (determined as described under Suitability of the Test Method) of Reinforced Medium for Clostridia. Incubate under anaerobic conditions at 30°to 35°for 48 hours. After incubation, make subcultures from each container on Columbia Agar, and incubate under anaerobic conditions at 30 to 35° for 48° to 72 hours.
选择和分离培养——分别从上述两份供试品液中各取10mL或相当于1g或1mL样品量的供试品液,接种至适宜体积的梭菌增菌培养基(经方法适用性试验确定)。置厌氧条件下, 30~35℃培养48小时。分别取上述培养物适量,涂抹接种至哥伦比亚琼脂培养基,置厌氧条件下,30~35℃培养48~72小时。
Interpretation— The occurrence of anaerobic growth of rods (with or without endospores) giving a negative catalase reaction indicates the presence of Clostridia. This is confirmed by identification tests.
The product complies with the test if colonies of the types described are not present or if the confirmatory identification tests are negative.
结果判断——若哥伦比亚琼脂培养基平板上有厌氧杆菌生长(有或无芽孢),且过氧化氢酶的反应呈阴性,说明可能有梭菌。需进行鉴别试验,确证是否为梭菌。若无上述菌落类型生长或鉴别试验呈阴性,判断供试品未检出梭菌。
4.7.Candida albicans白色念珠菌
Sample Preparation and Pre-Incubation—Prepare the product to be examined as described in Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests 61, and use 10 mL or the quantity corresponding to not less than 1 g or 1 mL, to inoculate 100 mL of Sabouraud Dextrose Broth, and mix. Incubate at 30° to 35° for 3 to 5 days.
供试品液制备和预培养——按USP 61制备供试品,取10mL或相当于不少于1g或1mL样品量的供试品溶液,接种至100mLSDB培养基,混合均匀。30~35℃培养3~5天。
Selection and Subculture— Subculture on a plate of Sabouraud Dextrose Agar, and incubate at 30° to 35° for 24 to 48 hours.
选择和分离培养——取适量上述培养物,划线接种至SDA培养基, 30~35℃培养24~48小时。
Interpretation— Growth of white colonies may indicate the presence of C. albicans. This is confirmed by identification tests. The product complies with the test if such colonies are not present or if the confirmatory identification tests are negative.
结果判断——若SDA培养基平板上有白色菌落生长说明可能有白色念珠菌,需进行鉴别试验,确证是否为白色念珠菌。若无上述类型菌落存在,或鉴别试验呈阴性,判断供试品未检出白色念珠菌。
5.RECOMMENDED SOLUTIONS AND CULTURE MEDIA推荐的溶液和培养基
NOTE— This section is given for information.本部分内容仅供参考
The following solutions and culture media have been found satisfactory for the purposes for which they are prescribed in the test for microbial contamination in the Pharmacopeia. Other media may be used provided that their suitability can be demonstrated.
以下是药典中规定的用于检测微生物污染的溶液和培养基。其他培养基的使用需确认适用性。
Stock Buffer Solution— Transfer 34 g of potassium dihydrogen phosphate to a 1000-mL volumetric flask, dissolve in 500 mL of Purified Water, adjust with sodium hydroxide to a pH of 7.2 ± 0.2, add Purified Water to volume, and mix. Dispense in containers, and sterilize. Store at a temperature of 2°to 8°.
缓冲液的储备溶液——取34g磷酸二氢钾至100mL容量瓶中,用500mL的纯化水溶解,用氢氧化钠调节PH至7.2 ± 0.2,纯化水稀释至刻度并摇匀。分装并灭菌处理。2~8℃条件下保存。
Phosphate Buffer Solution pH 7.2— Prepare a mixture of Purified Water and Stock Buffer Solution (800:1 v/v), and sterilize.
PH7.2磷酸盐缓冲溶液——纯化水:缓冲液的储备溶液按800:1(v/v)稀释,灭菌处理。
Buffered Sodium Chloride–Peptone Solution pH 7.0
PH7.0氯化钠—蛋白胨缓冲液
Potassium Dihydrogen Phosphate磷酸二氢钾 3.6 g
Disodium Hydrogen Phosphate Dihydrate 磷酸氢二钠二水化合物7.2 g (equivalent to 0.067 M phosphate) 相当于0.067M磷酸
Sodium Chloride氯化钠 4.3 g
Peptone (meat or casein)
蛋白胨(肉类或酪蛋白)
1.0 g
Purified Water纯化水1000 mL
Sterilize in an autoclave using a validated cycle.配制后采用验证合格的灭菌程序灭菌。
Soybean–Casein Digest Broth大豆酪蛋白消化液体培养基
Pancreatic Digest of Casein胰酪胨17.0 g
Papaic Digest of Soybean大豆木瓜蛋白酶水解物 3.0 g
Sodium Chloride氯化钠 5.0 g
Dibasic Hydrogen Phosphate磷酸二氢盐 2.5 g
Glucose Monohydrate单水葡萄糖 2.5 g
Purified Water纯化水1000 mL
Adjust the pH so that after sterilization it is 7.3 ± 0.2 at 25°. Sterilize in an autoclave using a validated cycle.
配制后采用验证合格的灭菌程序灭菌。调节PH使灭菌后在25℃的PH值为7.3 ± 0.2。Soybean–Casein Digest Agar大豆酪蛋白消化琼脂培养基
Pancreatic Digest of Casein 胰酪胨15.0 g
Papaic Digest of Soybean大豆木瓜蛋白酶水解物 5.0 g
Sodium Chloride氯化钠 5.0 g
Agar琼脂15.0 g
Purified Water纯化水1000 mL
Adjust the pH so that after sterilization it is 7.3 ± 0.2 at 25°. Sterilize in an autoclave using a validated cycle
配制后采用验证合格的灭菌程序灭菌。调节PH使灭菌后在25℃的PH值为7.3 ± 0.2。
Sabouraud Dextrose Agar沙氏葡萄糖琼脂培养基
Dextrose葡萄糖40.0 g Mixture of Peptic Digest of Animal Tissue and Pancreatic Digest of Casein (1:1)动物组织
胃蛋白酶水解物与胰酪胨(1:1)
10.0 g Agar琼脂15.0 g
Purified Water纯化水1000 mL
Adjust the pH so that after sterilization it is 5.6 ± 0.2 at 25°. Sterilize in an autoclave using a validated cycle
配制后采用验证合格的灭菌程序灭菌。调节PH使灭菌后在25℃的PH值为5.6 ± 0.2。
Potato Dextrose Agar马铃薯葡萄糖培养基
Infusion from potatoes土豆浸出物200 g
Dextrose葡萄糖20.0 g
Agar琼脂15.0 g
Purified Water纯化水1000 mL
Adjust the pH so that after sterilization it is 5.6 ± 0.2 at 25°. Sterilize in an autoclave using a validated cycle. 配制后采用验证合格的灭菌程序灭菌。调节PH使灭菌后在25℃的PH值为5.6 ± 0.2。
Sabouraud Dextrose Broth沙氏葡萄糖液体培养基
Dextrose葡萄糖20.0 g Mixture of Peptic Digest of Animal Tissue and Pancreatic Digest of Casein (1:1) 动物组织
胃蛋白酶水解物与胰酪胨(1:1)
10.0 g
Purified Water纯化水1000
mL Adjust the pH so that after sterilization it is 5.6 ± 0.2 at 25. Sterilize in an autoclave using a validated cycle.
配制后采用验证合格的灭菌程序灭菌。调节PH使灭菌后在25℃的PH值为5.6 ± 0.2。
Enterobacteria Enrichment Broth Mossel肠道增菌液体培养基
Pancreatic Digest of Gelatin明胶胰酶水解物10.0 g
Glucose Monohydrate单水葡萄糖 5.0 g
Dehydrated Ox Bile脱水牛胆汁20.0 g
Potassium Dihydrogen Phosphate磷酸二氢钾 2.0 g
Disodium Hydrogen Phosphate Dihydrate磷酸氢二钠水合物8.0 g
Brilliant Green亮绿15 mg
Purified Water纯化水1000 mL
Adjust the pH so that after heating it is 7.2 ± 0.2 at 25°. Heat at 100°for 30 minutes, and cool immediately
100℃加热30分钟,立即冷却。冷却后调节PH使得25℃的PH值为7.2 ± 0.2。
Violet Red Bile Glucose Agar紫红胆盐葡萄糖琼脂培养基
Yeast Extract酵母浸粉 3.0 g
Pancreatic Digest of Gelatin明胶胰酶水解物7.0 g
Bile Salts胆盐 1.5 g
Sodium Chloride氯化钠 5.0 g
Glucose Monohydrate单水葡萄糖10.0 g
Agar琼脂15.0 g
Neutral Red中性红30 mg
Crystal Violet结晶紫 2 mg
Purified Water纯化水1000 mL
Adjust the pH so that after heating it is 7.4 ± 0.2 at 25°. Heat to boiling; do not heat in an autoclave
加热煮沸,不要使用高压灭菌器加热。冷却后调节PH使得25℃的PH值为7.4 ± 0.2。
MacConkey Broth麦康凯液体培养基
Pancreatic Digest of Gelatin明胶胰酶水解物20.0 g
Lactose Monohydrate单水乳糖10.0 g
Dehydrated Ox Bile脱水牛胆汁 5.0 g
Bromocresol Purple溴甲酚紫10 mg
Purified Water纯化水1000 mL
Adjust the pH so that after sterilization it is 7.3 ± 0.2 at 25°. Sterilize in an autoclave using a validated cycle
配制后采用验证合格的灭菌程序灭菌。调节PH使灭菌后在25℃的PH值为7.3 ± 0.2。
MacConkey Agar麦康凯琼脂培养基
Pancreatic Digest of Gelatin明胶胰酶水解物17.0 g
Peptones (meat and casein) 蛋白胨(肉类或酪蛋白) 3.0 g
Lactose Monohydrate单水乳糖10.0 g
Sodium Chloride氯化钠 5.0 g
Bile Salts 胆汁盐 1.5 g
Agar琼脂13.5 g
Neutral Red中性红30.0 mg
Crystal Violet结晶紫 1 mg
Purified Water纯化水1000 mL
Adjust the pH so that after sterilization it is 7.1 ± 0.2 at 25°. Boil for 1 minute with constant shaking, then sterilize in an autoclave using a validated cycle.
加热煮沸一分钟,并不断振摇,采用验证合格的灭菌程序灭菌。调节PH使灭菌后在25℃的
PH值为7.1 ± 0.2
Rappaport Vassiliadis Salmonella Enrichment Broth RV沙门菌增菌液体培养基
Soya Peptone大豆蛋白胨 4.5 g
Magnesium Chloride Hexahydrate六水合氯化镁29.0 g
Sodium Chloride氯化钠8.0 g
Dipotassium Phosphate磷酸氢二钾0.4 g
Potassium Dihydrogen Phosphate磷酸二氢钾0.6 g
Malachite Green孔雀绿0.036 g
Purified Water纯化水1000 mL
Dissolve, warming slightly. Sterilize in an autoclave using a validated cycle, at a temperature not exceeding 115°. The pH is to be 5.2 ± 0.2 at 25° after heating and autoclaving.
微温溶解。采用验证合格的灭菌程序灭菌,灭菌温度不得超过115℃。调节PH使加热灭菌后在25℃的PH值为5.2 ± 0.2。
Xylose Lysine Deoxycholate Agar木糖赖氨酸脱氧胆酸盐琼脂培养基
Xylose木糖 3.5 g
L-Lysine L-赖氨酸 5.0 g
Lactose Monohydrate单水乳糖7.5 g
Sucrose蔗糖7.5 g
Sodium Chloride氯化钠 5.0 g
Yeast Extract酵母浸出物 3.0 g
Phenol Red酚红80 mg
Agar琼脂13.5 g
Sodium Deoxycholate脱氧胆酸钠盐 2.5 g
Sodium Thiosulfate硫代硫酸钠 6.8 g
Ferric Ammonium Citrate枸橼酸铁铵0.8 g
Purified Water纯化水1000 mL
Adjust the pH so that after heating it is 7.4 ± 0.2 at 25°. Heat to boiling, cool to 50°, and pour into Petri dishes. Do not heat in an autoclave.
加热煮沸,冷却至50℃,倾注入无菌平皿。不要使用高压灭菌锅。冷却后调节PH使得25℃的PH值为7.4 ± 0.2。
Cetrimide Agar溴化十六烷基三甲胺琼脂培养基
Pancreatic Digest of Gelatin明胶胰酶水解物20.0 g
Magnesium Chloride氯化镁 1.4 g
Dipotassium Sulfate硫酸钾10.0 g
Cetrimide溴化十六烷基三甲胺0.3 g
Agar琼脂13.6 g
Purified Water纯化水1000 mL
Glycerol甘油10.0 mL
Heat to boiling for 1 minute with shaking. Adjust the pH so that after sterilization it is 7.2 ± 0.2 at 25. Sterilize in an autoclave using a validated cycle.
摇晃加热煮沸1分钟。采用验证合格的灭菌程序灭菌。调节PH使灭菌后在25℃的PH值为7.2 ± 0.2。
Mannitol Salt Agar甘露醇盐琼脂培养基
Pancreatic Digest of Casein酪胨 5.0 g
Peptic Digest of Animal Tissue动物组织胃蛋白酶水解物 5.0 g
Beef Extract牛肉浸出粉 1.0 g
D-Mannitol D-甘露醇10.0 g
Sodium Chloride氯化钠75.0 g
Agar琼脂15.0 g
Phenol Red酚红0.025 g
Purified Water纯化水1000 mL
Heat to boiling for 1 minute with shaking. Adjust the pH so that after sterilization it is 7.4 ± 0.2 at 25°. Sterilize in an autoclave using a validated cycle.
摇晃加热煮沸1分钟。采用验证合格的灭菌程序灭菌。调节PH使灭菌后在25℃的PH值为7.4 ± 0.2。
Reinforced Medium for Clostridia梭菌增菌培养基
Beef Extract牛肉浸出粉10.0 g
Peptone蛋白胨10.0 g
Yeast Extract酵母浸出粉 3.0 g
Soluble Starch可溶性淀粉 1.0 g
Glucose Monohydrate单水葡萄糖 5.0 g
Cysteine Hydrochloride盐酸半胱氨酸0.5 g
Sodium Chloride氯化钠 5.0 g
Sodium Acetate醋酸钠 3.0 g
Agar琼脂0.5 g
Purified Water纯化水1000 mL
Hydrate the agar, and dissolve by heating to boiling with continuous stirring. If necessary, adjust the pH so that after sterilization it is about 6.8 ± 0.2 at 25°. Sterilize in an autoclave using a validated cycle.
水化琼脂,加热煮沸并不停搅拌。采用验证合格的灭菌程序灭菌。如有必要,调节PH使灭菌后在25℃的PH值为6.8 ± 0.2。
Columbia Agar哥伦比亚琼脂培养基
Pancreatic Digest of Casein胰酪胨10.0 g
Meat Peptic Digest肉胃蛋白酶水解物 5.0 g
Heart Pancreatic Digest心胰酶水解物 3.0 g
Yeast Extract酵母浸出粉 5.0 g
Maize Starch玉米淀粉 1.0 g
Sodium Chloride氯化钠 5.0 g
Agar, according to gelling power琼脂,依据胶凝力选择加入量10.0–15.0 g
Purified Water纯化水1000 mL
Hydrate the agar, and dissolve by heating to boiling with continuous stirring. If necessary, adjust the pH so that after sterilization it is 7.3 ± 0.2 at 25°. Sterilize in an autoclave using a validated cycle. Allow to cool to 45° to 50°; add, where necessary, gentamicin sulfate corresponding to 20 mg of gentamicin base, and pour into Petri dishes.
水化琼脂,加热煮沸并不停搅拌。如有必要,调节PH使灭菌后在25℃的PH值为7.3 ± 0.2。采用验证合格的灭菌程序灭菌。冷却至45~50℃,如有必要,加入相当于20mg庆大霉素的硫酸庆大霉素,倾注无菌平皿。
文件编号:73021微生物限度检查方法及其验证报告
目录1 样品相关信息 1.1 基本信息 2 主要仪器设备和试验耗材信息 2.1 主要使用的仪器设备 2.2 试验用培养基 2.3 试验用试剂 2.4 试验用菌种 3 试验环境 3.1 无菌室 3.2 洁净工作台 3.3 生物安全柜 4 试验方案 4.1 验证试验目的 4.2 微生物限度检查方法草案 5 方法验证试验 5.1 菌液制备 5.2 计数培养基适用性检查 5.3 控制菌检查用培养基使用性检查 5.4 供试液制备 5.5 方法验证 5.5.1 菌落计数方法验证试验 5.5.2 控制菌检查方法的验证 5.6 方法验证结论 6 供试品微生物限度检查结果
1 样品相关信息 1.1 基本信息(三批) 2 主要仪器设备和试验耗材信息2.1 主要使用的仪器设备 2.2 试验用培养基 2.2.1 对照培养基
2.2.2 试验用培养基 2.3 试验用试剂 2.4 试验用菌种
3 试验环境 《中国药典》2015版规定,微生物限度检查应在环境洁净度10000级下的局部洁净度100级的单向流空气区域进行。 本公司微生物限度室、阳性对照室、生物安全柜及超净工作台洁净度检测无特殊情况下每季度进行一次。 3.1 无菌室 无菌室按《医药工业洁净厂房设计规》GB 50457-2008监测,静态洁净度检测结果符合GB50457-2008对10000级洁净度要求。 3.2 超净工作台 超净工作台按《医药工业洁净厂房设计规》GB50457-2008监测,静态洁净度检测结果符合GB50457-2008对100级洁净度要求。 超净工作台沉降菌检测记录 2015.11.15 3.3生物安全柜 生物安全柜按《生物安全实验室建筑技术规》GB50346-2011监测,静态洁净度检测结果符合GB50457-2008对100级洁净度要求。 生物安全柜沉降菌监测记录 2015.11.15 4 试验方案 按《中国药典》2015年版第四部:(通则1105)非无菌产品微生物限度检查:微生物计数法、(通则1106)非无菌产品微生物限度检查:控制菌检查法、(通则1107)非无菌药品微生物限度标准及(通则1121)抑菌效力检查法规定,本品微生物限度标准为:1g供试品中,需氧菌总数不得过1000cfu,霉菌和酵母菌总数不得过100cfu,大肠埃希菌不得检出。
1.目的:建立非无菌药品微生物限度检查检验标准操作规程,规范检验操作,确保检验结果准确。 2.适用范围:适用于本公司所有采用非无菌药品微生物限度检查法测定的供试品。 3.责任者:QC检验员、QC经理。 4.正文: 4.1非无菌产品微生物限度检查:微生物计数法 4.1.1简述 微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。 当本法用于检查非无菌制剂及其原、辅料等是否符合规定的微生物限度标准时,应按下述规定进行检验,包括样品的取样量和结果的判断等。除另有规定外,本法不适用于活菌制剂的检查。 本检查法可采用替代的微生物检查法,包括自动检测方法,但必须证明替代方法等效于药典规定的检查方法。 微生物计数试验应在受控洁净环境下的局部洁净度不低于B级的单向流空气区域内进行。检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。单向流空气区域、工作台面及环境应定期进行监测。 如供试品有抗菌活性,应尽可能去除或中和。供试品检查时,若使用了中和剂或灭活剂,应确认其有效性及对微生物无毒性。 供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。 4.1.2计数方法
计数方法包括平皿法、薄膜过滤法和最可能数法(Most-Probable-NumberMethod,简称MPN 法)。MPN法用于微生物计数时精确度较差,但对于某些微生物污染量很小的供试品,MPN法可能是更适合的方法。 供试品检查时,应根据供试品理化特性和微生物限度标准等因素选择计数方法,所选的方法必须具备检测充足样品量的能力,以保证所获得的试验结果能够判断供试品是否符合规定。所选方法的适用性须经确认。 4.1.3计数培养基适用性检查和供试品计数方法适用性试验 供试品微生物计数中所使用的培养基应进行适用性检查。 供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数。 若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验。 表1试验菌液的制备和使用
表:微生物限度检查记录(通用) 三、大肠埃希菌检查 胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)
微生物限度检查记录 (30~35℃,3~5天) 20℃~25℃,5~7天) 沙氏葡萄糖琼脂培养基(配制批号:) 三、控制菌检查(30-35℃)
表: 胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:) (30℃~35℃) 胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:) 五、耐胆盐革兰阴性菌检查 胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:)
表: (含药材原粉的片剂) 胰酪大豆胨液体培养基(配制批号: )、麦康凯液体培养基(配制批号: )麦康凯琼脂培养基(配制批号: ) (30℃~35℃) 胰酪大豆胨液体培养基(配制批号: )、RV 沙门增菌液体培养基(配制批号: ),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号: )、三糖铁琼脂(配制批号: ) 五、耐胆盐革兰阴性菌检查 胰酪大豆胨液体培养基(配制批号: )、肠道菌增菌液体培养基(配制批号: ),紫红胆盐葡萄糖琼脂培养基(配制批号: )
表:微生物限度检查记录(蛇胆川贝液) 三、大肠埃希菌检查 胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)
微生物限度检查若干问题 微生物限度检查若干问题 微生物限度检查是对非规定灭菌制剂及其原、辅料受到微生物污染程度的一种检查方法,是药品微生物学检验的重要容之一。中国药典2000年版二部附录ⅪJ“微生物限度检查法”、《中国药品检验标准操作规》(2000年版)及参考书《药品微生物学检验手册》均做了详尽的阐述。下面对几个比较重要的问题,谈一点工作学习体会,仅供参考。 一、实验室要求 开展微生物限度检查工作,首先要按照《药品检验所实验室质量管理规》及《药品生产质量管理规》的要求,建立一个布局合理,使用方便,操作安全的实验室,并且配有完善的实验设施和管理制度。微生物限度检查、无菌检查、抗生素微生物检定实验室以及接种室(接种对照菌及菌种传代)均应严格分开。 (一)无菌室: 1结构与要求: 最好设在二楼以上(防潮、防霉、采光好),面积不超过10平方米,高度不超过24米,由2个缓冲间和操作间组成。缓冲间与操作间之间应有样品传递窗,出入操作间和缓冲间的门不应直对。无菌室应六面光滑平整,能耐受清洗消毒,墙壁与地面、墙壁与天花板连接处应呈凹弧形,无缝隙、无死角。 无菌室光照应不低于300勒克斯,缓冲间和操作间均应装有紫外线杀
菌灯2-25w/m3作空气消毒用。紫外线波长200-300nm者''具有杀菌作用,其中以265-266nm最强,这与DNA的吸收光谱围一致。其杀菌机理可能是在DNA中引起胸腺嘧啶双聚体形成,从而干扰DNA复制,导致细菌变异或死亡。紫外线杀菌灯1m以距离杀菌效果最佳''每次开灯照射时间为 20min。其缺点:穿透力弱,一纸可以挡住,不能穿透固体物,对人的皮肤眼睛有损伤,所以紫外线灯开关应装在无菌室外便于开关。 2温度、湿度:温度应控制在18-26℃''相对湿度40-60''操作间或净化工作台的洁净空气应保持对环境形成正比''不低于49Pa。 3操作间:应安装空气除菌过滤层流装置,操作间不应安装下水道,洁净度不低于1万级,净化工作台局部应为100级。操作间应准备电子称(感量01g''最大称量300g''乙醇灯''火柴''2碘酊及75乙醇棉球,大、小橡皮乳头,记号笔,灭菌的剪刀,镊子、注射器等。 4缓冲间:应有洗手盒、消毒液、无菌衣、帽、口罩,拖鞋等,不应放置培养箱和其他杂物。 (二)洁净级别及检查方法: 通常采用尘粒数及浮游菌数或沉降菌数测定法。 98年国家药监局颁布药品生产质量管理规''把药品生产洁净区空气洁 净度划分为四个级别: 空气洁净度级别表 ──────────────────────────── 尘埃数/立方米活微生物数个 洁净级别─────────────────────
标准操作规程 目的:建立一个药品微生物限度检验标准操作规程。 范围:适用于本企业生产的所有品种,本企业所有洁净生产区域,QC微生物限度检查室,洁净工作室等。 责任者:QC主任、化验员。 规程: 本规程引至《中国药典》2000年版。 1. 概述:微生物限度检查系指非规定灭菌制剂及其原辅料受到微生物污染程度的一种检查方法,包括染菌量及控制菌的检查。我公司QC设无菌操作室,用于微生物限度检查。无菌操作室的管理及使用制度见本文附录一。 2. 抽样:供试品应按批号随即抽样,一般抽样量为检验用量(2个以上最小包装单位)的3倍。抽样时,凡发现有异常可疑的样品,应缺陷选用疑问的样品,但因机构损伤明显破裂的包装不得作为样品,凡已能从药品、瓶口(外盖内侧及瓶口周围)外观看出长螨、长霉、虫蛀及变质的药品,可直接判为不合格,无需要再抽样检验。 3. 供试品的保存:供试品在检验之前,应保存在阴凉干燥处,以防供试品中的污染菌因保藏条件所引起致死、损伤或繁殖。供试品在检验之前,应该保持原有包装状态,严禁开启,包装已开启的样品不得作为供试品。 4. 检查: 4.1. 使用设备:电热恒温培养箱、电热恒温水温箱、试管、刻度吸管、量筒、三角瓶、培养皿、试管架、注射器、针头、注射器盒、研钵、75%酒精棉球、紫外灯(365nm波长)。 4.2. 检查的全过程应严格遵守无菌操作,严防再污染。使用设备、仪器、人员及无菌操作室常用的消毒、灭菌方法见本文附录二。除另有规定外,供试品制备成供试液后,均在均匀状态取样。制成供试液后,应该在60分钟内注皿操作完毕。 标准操作规程
4.3. 培养:除另有规定外,本检查法中细菌培养温度为30-35℃,霉菌、酵母菌培养温度为25-28℃,控制菌培养温度为36±1℃,检验结果的报告以1g、1ml或10cm2为单位。 4.4. 复检 4.4.1. 菌数测定不合格者应复检,控制菌检查以一次检出为准,不再复试,但应保留检出菌株一个月备查。 4.4.2. 以复试项下不合格项目为准,作单项复试。复试需另取同批号样品,测定2次。 4.4.3. 复试报告,以3次测定结果的算术平均值报告。 4.5. 检验报告 4.5.1. 检验报告以1g、1ml或10cm2为单位。 4.5.2. 测定菌数报告,以每次测定结果全部平均值报告。 4.5.3. 控制菌按检验结果报告,如未检出控制菌时,报告为“按规定抽样检验结果未检出XX菌”,如抽样中任意一样品要检出控制菌时,报告为“按规定抽样,检出XX菌,不符合药品微生物限度标准。” 4.6. 培养基、试药及稀释剂的相关内容见本文件附录三。 4.7. 供试液的制备:按供试液的理化特性与生物学特性可采取适宜的方法制成供试液。 4.7.1. 供试品的取样及注意事项 供试品取样应有一定数量,以使检验结果具有代表性,正常的供试品一般每批应随机抽取两瓶或两盒以上的包装单位,检验时每次应分取两瓶(盒)以上的样品共10g或10ml。 供试品在检验前,应严格保持包装的原有状态,不得启开,并放在阴凉干燥处,防止微生物再繁殖,以免影响检验结果,凡已将原包装启开,则无代表性应另取样。 供试品稀释后须在1-2小时内操作完毕,防止微生物繁殖或死亡。 供试品稀释成供试液后,应在均匀状态下取样,凡因抑菌或不溶于水的剂型,其供试品应作特殊处理后进行检验。 4.7.2. 液体供试品:取供试品10ml,加入稀释剂90ml中,混匀,作为供试液。油剂可加适量 聚山梨酯80,混匀,吸取相当于10g或10ml供试品,标准操作规程 再稀释成100ml作为供试液;合剂(系指含王桨或蜂蜜者,下同)可用供试品作为供试液。 4.7.3. 固体、半固体或黏稠液供试品:称取供试品10g,置0.9%无菌氯化钠溶液100ml中,用匀浆仪或其他适宜的方法混匀后作为供试液。在制备过程中,必要时可加适量聚山梨酯80,并适当加温,但不应超过45℃。 (1)非水溶性供试品:取供试品5g(5ml)加入含溶化的无菌司盘80 5g、单硬脂酸甘油酯3g、聚山梨酯80 10g混合物的烧杯中,用无菌玻棒搅拌成团后,慢慢加入45℃左右的0.9%无菌氯化钠溶
控制菌检查培养基适用性检查记录 一、菌液制备(需要的菌种在□内划“√”): □(1)大肠埃希菌新鲜肉汤培养物1ml ,9ml0.9%无菌NaCl溶液,10倍递增稀释; □(2)金黄色葡萄球菌新鲜肉汤培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释; □(3)乙型副伤寒沙门菌新鲜肉汤培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释; □(4)铜绿假单胞菌新鲜肉汤培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释; □(5)生孢梭菌新鲜硫乙醇酸盐流体培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释; 二、每ml菌液含菌量的计数测定。 测定方法:取稀释后的菌液1ml(剩余的菌液冷藏保存),置直径90mm的无菌平皿中,注入15-20ml已经过适用性检查确正的温度不超过45℃的溶化的营养琼脂培养基(细菌类别计数选用该培养基)或玫瑰红钠琼脂培养基(霉菌、酵母菌类别计数选用该培养基),混匀,凝固,倒置培养。每稀释级每种培养基至少制备2个平板。细菌类别培养温度为30℃~35℃;霉菌、酵母菌类别培养温度为23℃~28℃。细菌类别培养3天,霉菌、酵母菌类别培养5天。 三、检查结果:需做的检查在□内划“√”。 □ 1. 增菌培养基促生长能力检查
分别接种不大于100cfu的试验菌于被检培养基和对照培养基中,在相应控制菌检查规定的培养温度及最短培养时间下培养。与对照培养基管比较,被检培养基管试验菌。 检验标准:与对照培养基管比较,被检培养基管试验菌应生长良好。 结论: □ 2. 固体培养基促生长能力检查 检验标准:被检培养基的菌落数与对照培养基菌落数相比大于70%,且菌落形态大小应与对照培养基上的菌落一致。判该培养基的适用性检查符合规定。 结论: □ 3. 培养基抑制能力检查 分别接种试验菌于被检培养基中,在相应控制菌检查规定的培养温度和时间下培养,试验菌。 检验标准:试验菌应不得生长。 结论: □ 4. 培养基指示能力检查 分别接种少量试验菌于被检培养基和对照培养基中,在相应控制菌检查规定的培养温度和时间下培养。被检培养基中试验菌生长的菌落形态、大小、指示剂反应情况等。 检验标准:被检培养基中试验菌生长的菌落形态、大小、指示剂反应情况等应与对照培养基一致。 结论: 结论: 检验人:复核人:
无菌检查和微生物限度检查操作规范 (中国药品生物制品检定所) 一、无菌室的要求: 无菌室是无菌检查、微生物限度检查的重要设备,面积不小于6平米,高度2.4-2.8m为宜。建筑材料要光洁,不吸潮,无凸起,耐腐蚀,易清洗。无菌室内部应六面光滑,无缝隙,里面连接处应呈凹凸形,不留死角。操作间和缓冲间的门不应直对,缓冲间两个。 无菌室内采光面积要大,照明灯应镶嵌在天花板内,光照应分布均匀,光照度不低于300lux,电源开关应设在室外。 无菌室、缓冲间和操作间均应设置紫外线杀菌灯,每立方米2-2.5瓦,距实验台高度不超过1米,并应定期检查辐射强度,距1米处应不低于70微瓦/平方厘米,无菌室内应安装空气除菌过滤层流装置及调温装置,控制温度18-26℃,相对湿度40%-60%,操作间或净化工作台的洁净空气应保持与相临环境形成正压,不低于4.9帕。操作区洁净度100级,操作间洁净度10000级,洁净度定期检查。 无菌室及缓冲间不得存放其他杂物,如培养箱。 用消毒液清洁无菌室操作台面,开启无菌室紫外灯和层流空气过滤30分钟以上。无菌室的无菌程度,常用的沉降菌测定方法为:取营养肉汤琼脂平板3个,置无菌室的操作区台面左、中、右位置上,开盖暴露30分钟,在30-35℃培养2天后,计算菌落数。用于无菌检查的无菌室或微生物限度检查的无菌室,细菌总数应小于3个,浮游菌每立方米应小于5个,否则,不能用于无菌检查和微生物限度检查。 二、培养基的准备 1、培养基的制备: 配制培养基的蒸馏水或去离子水应符合规定。再称取需气菌、厌气菌培养基、真菌培养基的干燥培养基,加水溶化后,调节PH值,使灭菌后需气菌、厌气菌培养基的PH值为7.0-7.3,真菌培养基的PH值为6.2-6.6,分装、盖塞、灭菌,待用。 2、培养基灵敏度试验: 培养基是无菌试验的基准物质,关系到无菌试验结果的科学、准确、可信度,因此,培养基灵敏度试验是无菌试验的重要组成部分。只有使用灵敏度试验合格的培养基,才能保证无菌试验结果准确、可靠。 培养基灵敏度试验操作如下:取藤黄微球菌、生孢梭菌、白色念珠菌的新鲜培养液,分别10倍递增稀释,制成每ml 含10-100个菌,并作菌落记数。将制备好的菌液分别加至需气菌、厌气菌培养基、真菌培养基各3管。至规定温度培养5天,每株菌接种的培养基不少于2管生长,则改培养基的灵敏度试验合格。 3、培养基用前的检查: (1)无菌检查:各种培养基在规定温度培养3天,应无菌生长。 (2)新鲜程度检查:需气菌、厌气菌培养基氧化层的颜色用前不能超过1/5,否则,不能使用。应煮沸去氧,只限加热一次。 4、培养基的保存时限: 配制好的无菌试验用培养基在2周内用完。 三、菌种复苏和保藏 1、菌种复苏: 先将冻干菌种的封口端用砂轮刻痕,在刻痕处过火焰数次,用无菌湿棉球炸裂后打开,然后,加入0.3-0.4ml稀释液于菌种管底部,将菌种稀释、混匀,并吸出菌液,接种于适宜的培养基。培养时间和温度根据不同的菌种而定。仔细检查菌种的有关特性,如无发现异常,即可传代、使用。 2、药品微生物用的菌种传代方法: 取复苏好的菌种一支,接种于规定的培养基数管,培养后,置冰箱中保藏。取出使用的菌种,经一段时间后即可废弃。 为防止微生物突变,菌种应尽量避免不必要的接种和传代。
微生物基础知识培训试题(卷) 姓名部门得分 一、填空题(每空2分、共50分) 1.微生物(microorganism, microbe)是一些肉眼看不见的微小生物的总称。 2.微生物按其结构、化学组成及生活习性等差异可分成三大类:真核细胞型、原核细胞型、非细胞型。 3.微生物按形态结构分为:细菌、霉菌、酵母菌、放线菌、病毒。 4.微生物的营养:水分、碳源、氮源、无机盐类、生长因子。 5.洁净室对温湿度、压差及微生物和尘粒进行严格的控制。 6.辐射灭菌法:辐射有两种类型:一种是电磁波辐射,如紫外线、红外线、微波;一种是电离辐射,如可引起被照射物电离的X射线、γ射线。 7.过滤除菌的效果与滤膜的性能、孔径的大小、密度、滤膜的厚度等因素有关。 8.高压蒸汽灭菌法:超过一个大气压时,水的沸点高于100℃,反之亦然。此法适用于耐高温和潮湿的物品。 二单项选择题(每题2分、共16分) 1.真菌属于___A__型微生物。 A. 真核细胞型 B. 原核细胞型 C. 非细胞型 D.多核细胞型 2.下列不属于原核细胞型的是____D__ A.细菌 B.衣原体 C. 放线菌 D.病毒 3. 杀灭芽胞最可靠的方法是___C___ A.干热灭菌法 B. 流通蒸汽灭菌法 C. 高压蒸汽灭菌 D. 巴氏灭菌法 4. 下列那个是构成细胞的重要物质__B____ A.水 B.碳源 C. 细胞核 D.无机盐 5. 滤过除菌法要求最终过滤的滤膜孔径为__A____ A.0.22μm B.0.36μm C.0.45μm D.0.65μm 6. 紫外线杀菌的常用波长为 D A.80-100nm B.120-140nm C.160-195nm D. 253.7nm 7. 新洁尔灭为常用消毒剂,其浓度为____B__ A. 0.01% B.0.1% C.1% D.10% 8.常用乙醇消毒剂的浓度为____A__ A. 55% B.65% C.75% D.85% 三多项选择(每题4分、共16分) 1.下列哪些是我们常用的消毒剂 ABCD A. 75%乙醇水溶液 B. 37%~40%甲醛溶液 C. 新洁尔灭 D. 过氧乙酸 2. 高压蒸汽灭菌常用条件为:ABC A. 115.5℃ 30min B. 121.5℃ 20min C. 126.5℃ 15min D. 200℃ 45min 3.下列哪些属于微生物的特点ABCD A. 体积小,面积大 B. 吸收多,转化快 C. 生长旺,繁殖快
微生物限度检查方法验证方案 1.目的: 为确认所采用的方法适合于该药品的微生物限度检查,包括细菌、霉菌及酵母菌计数和控制菌检查,特制定本验证方案,通过比较试验菌的恢复生长结果,来评价整个检验方法的准确性、有效性和重现性,以确认供试品在该实验条件下无抑菌活性或其抑菌活性可忽略不计,所采用的方法适用于该品种的微生物限度检查。 验证过程应严格按照本方案规定的内容进行,若因特殊原因确需变更时,应填写验证方案修改申请并报验证领导小组批准 2.范围: 本验证方案适用于微生物限度检查方法的验证。 3.规范性引用文件: 根据《中国药典》2010年版二部附录Ⅺ J 微生物限度检查法的要求,由于某些供试品具有抗菌活性,在建立微生物检查方法或产品的组分发生改变或原检查法的检验条件发生改变时,可能影响检验结果的准确性,必须对供试品的抑菌活性及测定方法的可靠性进行验证。 4.验证实施: 4.4.1 试验前的准备: 4.4.1.1 试验用具的准备:将试验需用的试管、刻度吸管、薄膜过滤器、滤膜(孔径0.22um、直径50mm)、平皿、空三角瓶、称量纸等,用牛皮纸包扎好后,放于湿热灭菌器中,在121℃,灭菌30 min,在3天内使用。 4.4.1.2试验用培养基的制备:取适用性检查合格的营养琼脂培养基、玫瑰红钠琼脂培养基、营养肉汤培养基、胆盐乳糖培养基(BL)、改良马丁琼脂培养基、4-甲基伞形酮葡糖苷酸培养基(MUG)等脱水培养基,按照相应的配制说明,用纯化水配制、分装后,在2小时内,放于湿热灭菌器中,在121℃,灭菌15 min,在3周内使用。 4.4.1.3试验用稀释剂/缓冲液、冲洗液的制备:取在有效期内的试剂,按照相应的配制方法,配制pH7.0无菌氯化钠-蛋白胨缓冲液、0.9%无菌氯化钠溶液、0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液等,用纯化水配制,加热使溶,过滤,分装,在121℃,灭菌15 min,在3周内使用。 4.4.2 试验菌的制备和稀释:
药品微生物限度标准 王知坚
?我国药品微生物限度标准的历史沿革?药品微生物限度检查在制剂通则中的修订内容 ?药品微生物限度标准的修订内容 ?限度标准的注意事项 ?国外药典微生物限度标准的收载情况
历史沿革
?检查法的历史沿革 –国务院1973年121号文件标志着我国药品微生 物限度检查工作正式启动 –在1974年颁布了74版《卫生部药品卫生学检查法》,是首次颁布与药品微生物限度检查有关 的检查方法 –先后于84年和90年两次修订,颁布新的检查法–1995年版《中国药典》首次在附录中收载微生物限度检查法 –2000年版、2005年版和2010年版《中国药 典》先后收载该检查法,并进行了不同程度的 修订和完善
?限度标准的变迁 –1986年版《卫生部部颁药品微生物限度标准》?国内首次颁布与药品微生物质量有关的限度标准 ?限度标准的分类依据为剂型,不同剂型制订不同的 限度标准值;控制菌检查的分类依据为给药途径, 不同途径的制剂有不同的检查内容 –1989年版《卫生部部颁药品卫生补充规定》?是对86版限度标准的修订和补充 ?分类方式上与86版相同
–《中国药典》2000年版 ?首次将微生物限度标准收载入国家药典 ?在编制体例上仍延用部颁标准的做法,按剂型制订限度标准,按给药途径和剂型特点制订控制菌标准–《中国药典》2005年版 ?首次确定按给药途径来制订不同产品的限度标准和控制菌标准 ?首次在制剂通则中对某一类制剂制订较为特殊的微生物控制要求,如眼用液体制剂需要达到近似无菌的要求 ?在标准的具体规定上,体现了当时对微生物质量的研究水平,如含生药原粉的制剂要求开展大肠菌群检查,用于深部组织的制剂要求不得检出梭菌。
药品微生物限度检验方法标准操作规 程
标准操作规程 目的:建立一个药品微生物限度检验标准操作规程。 范围:适用于本企业生产的所有品种,本企业所有洁净生产区域,QC微生物限度检查室,洁净工作室等。 责任者:QC主任、化验员。 规程: 本规程引至《中国药典》。 1. 概述:微生物限度检查系指非规定灭菌制剂及其原辅料受到微生物污染程度的一种检查方法,包括染菌量及控制菌的检查。我公司QC设无菌操作室,用于微生物限度检查。无菌操作室的管理及使用制度见本文附录一。 2. 抽样:供试品应按批号随即抽样,一般抽样量为检验用量(2个以上最小包装单位)的3倍。抽样时,凡发现有异常可疑的样品,应缺陷选用疑问的样品,但因机构损伤明显破裂的包装不得作为样品,凡已能从药品、瓶口(外盖内侧及瓶口周围)外观看出长螨、长霉、虫蛀及变质的药
品,可直接判为不合格,无需要再抽样检验。 3. 供试品的保存:供试品在检验之前,应保存在阴凉干燥处,以防供试品中的污染菌因保藏条件所引起致死、损伤或繁殖。供试品在检验之前,应该保持原有包装状态,严禁开启,包装已开启的样品不得作为供试品。 4. 检查: 4.1. 使用设备:电热恒温培养箱、电热恒温水温箱、试管、刻度吸管、量筒、三角瓶、培养皿、试管架、注射器、针头、注射器盒、研钵、75%酒精棉球、紫外灯(365nm波长)。 4.2. 检查的全过程应严格遵守无菌操作,严防再污染。使用设备、仪器、人员及无菌操作室常见的消毒、灭菌方法见本文附录二。除另有规定外,供试品制备成供试液后,均在均匀状态取样。制成供试液后,应该在60分钟内注皿操作完毕。 标准操作规程 4.3. 培养:除另有规定外,本检查法中细菌培养温度为30-35℃,霉菌、酵母菌培养温度为25-28℃,控制菌培养温度为36±1℃,检验结果的报告以1g、1ml或10cm2为单位。 4.4. 复检
微生物、洁净区基础知识及无菌保证知识培训试卷姓名: 一、填空题(每空1分,共 20分) 1、进入洁净区的工作人员(包括维修、辅助人员)应定期进行卫生、微生物学基础知识和洁净作业等方面的培训及考核。 2、洁净区的设计必须符合相应的洁净度要求,包括达到“静态”和“动态”的标准。 3、无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染 4、常见微生物:细菌、霉菌、酵母菌、病毒。 5、微生物的五大特点:小,多,快,强,广。 6、传播污染的四大媒介为:空气、水、表面、人。 二、单选题(每空2分,共20分) 1、微生物是存在于自然界中的个体微小,结构简单、肉眼看不见,必须借助于显微镜才能看清它们外形的一群低等的、原始的微小生物。 A、个体微小 B、个体庞大 C、结构复杂 D、结构简单 2、无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药 A、无菌 B、热原 C 细菌内毒 D 微生物限度 3、采用湿热灭菌方法进行最终灭菌的,通常标准灭菌时间F0值应大于 __8__分钟,流通蒸汽灭菌处理不属于最终灭菌。 A、6 B、12 C、10 D、8 4、无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产
品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。 A、最终灭菌产品 B、非最终灭菌产品 C、辅助灭菌产品 5、内毒素——是革兰氏阴性菌产生的具有强致热效应的脂多糖类物质。 A、霉菌 B、革兰氏阳性菌 C、革兰氏阴性 D酵母菌 6、A级洁净区静态环境下≥5.0μm悬浮粒子的最大允许数/立方米为(20 ) A、 20 B、200 C、290 D、29 7、洁净区与非洁净区之间、不同级别洁净区之间的压差应当不低于10帕斯卡。 A、 5 B、10 C、15 D、20 8、2010版药典规定注射用水细菌内毒素检测限度为:为每1ml中含内毒素量应小于0.25EU。 A、 0.125 B、0.25 C、0.5 D、0.1 二、多选题(共5题,每题2分,共10分) 1、洁净区防止交叉污染的重要措施:(ABCD) A、合理布置空间面积 B、提高设备水平 C、分设空调净化系统 D、严格控制人流物流 2、洁净区气流组织形式中单向流的特点:( ACDE ) A、空气流线呈平行 B、具有不规则运动轨迹 C、类似活塞作用 D、各流线间的尘粒不易相互扩散 E、达到净化程度高 3、药品污染热原的途径(生产过程):(ABCDF) A、注射溶媒 B、容器和设备、管道、滤器 C、原辅料 D、制造过程及生产环境 E、输液器带入 F、由于包装不严密产生热原
Appendix XVI D. Microbiological Quality of Non- sterile Pharmaceutical Preparations and Substances 非无菌制剂的微生物限度 (Ph. Eur. general text 5.1.4) The presence of certain micro-organisms in non-sterile preparations may have the potential to reduce or even inactivate the therapeutic activity of the product and has a potential to adversely affect the health of the patient. Manufacturers therefore have to ensure a low bioburden of finished dosage forms by implementing current guidelines on Good Manufacturing Practice during the manufacture, storage and distribution of pharmaceutical preparations. 非无菌制剂中存在一定量的微生物可能导致药物的治疗活性降低或消失,并对患者健康有着潜在的危害。因此生产商应在药品生产、储存、运输过程中实施GMP管理,使制剂的微生物负荷保持在低水平。 Microbial examination of non-sterile products is performed according to the methods given in general chapters 2.6.12 and 2.6.13. Acceptance criteria for non-sterile pharmaceutical products based upon the total aerobic microbial count (TAMC) and the total combined yeasts/moulds count (TYMC) are given in Tables 5.1.4.-1 and 5.1.4.-2. Acceptance criteria are based on individual results or on the average of replicate counts when replicate counts are performed (e.g. direct plating methods). 非无菌制剂的微生物检测按照通则2.6.12和2.6.13的方法执行。非无菌制剂的微生物限度基于表5.1.4-1和5.1.4-2的需氧微生物总数(TAMC)及酵母菌/霉菌总数(TYMC)。接受标准适用于单个检出结果或者做重复样品时结果的平均数(例如,直接平板法)。 When an acceptance criterion for microbiological quality is prescribed it is interpreted as follows: 给出的微生物质量接受标准解读如下: — 101 CFU: maximum acceptable count = 20; — 101 CFU: 最大可接受数= 20; — 102 CFU: maximum acceptable count = 200; — 102 CFU: 最大可接受数= 200; — 103 CFU: maximum acceptable count = 2000; — 103 CFU: 最大可接受数= 2000; Table 5.1.4.-1 includes a list of specified micro-organisms for which acceptance criteria are set. The list is not necessarily exhaustive and for a given preparation it may be necessary to test for other micro-organisms depending on the nature of the starting materials and the manufacturing process. 表5.1.4-1给出了各种剂型的具体微生物接受标准。此表格并不完全,根据起始物料和生产工艺的性质可能需要其他的微生物检查。 If it has been shown that none of the prescribed tests will allow valid enumeration of micro-organisms at the level prescribed, a validated method with a limit of detection as close as possible to the indicated acceptance criterion is used.
微生物限度检查方法验证方案 1. 目的: 为确认所采用的方法适合于该药品的微生物限度检查,包括细菌、霉菌及酵母菌计数和控制菌检查,特制定本验证方案,通过比较试验菌的恢复生长结果,来评价整个检验方法的准确性、有效性和重现性,以确认供试品在该实验条件下无抑菌活性或其抑菌活性可忽略不计,所采用的方法适用于该品种的微生物限度检查。 验证过程应严格按照本方案规定的内容进行,若因特殊原因确需变更时,应填写验证方案修改申请并报验证领导小组批准 2. 范围: 本验证方案适用于微生物限度检查方法的验证。 3. 规范性引用文件: 根据《中国药典》2010 年版二部附录ⅪJ 微生物限度检查法的要求,由于某些供试品具有抗菌活性,在建立微生物检查方法或产品的组分发生改变或原检查法的检验条件发生改变时,可能影响检验结果的准确性,必须对供试品的抑菌活性及测定方法的可靠性进行验证。 4. 验证实施: 4.4.1 试验前的准备: 4.4.1.1 试验用具的准备:将试验需用的试管、刻度吸管、薄膜过滤器、滤膜(孔径 0.22um、直径50mm)、平皿、空三角瓶、称量纸等,用牛皮纸包扎好后,放于湿热灭菌器中,在121℃,灭菌30 min,在3 天内使用。 4.4.1.2 试验用培养基的制备:取适用性检查合格的营养琼脂培养基、玫瑰红钠琼脂培养基、营养肉汤培养基、胆盐乳糖培养基(BL)、改良马丁琼脂培养基、4- 甲基伞形酮葡糖苷酸培养基(MUG)等脱水培养基,按照相应的配制说明,用纯化水配制、分装后,在 2 小时内,放于湿热灭 菌器中,在121℃,灭菌15 min,在3 周内使用。 4.4.1.3 试验用稀释剂/ 缓冲液、冲洗液的制备:取在有效期内的试剂,按照相应的配制方法, 配制pH7.0无菌氯化钠-蛋白胨缓冲液、0.9%无菌氯化钠溶液、0.05%(ml/ml )聚山梨酯80的 0.9%无菌氯化钠溶液等,用纯化水配制,加热使溶,过滤,分装,在121℃,灭菌15 min,在3
1. 目的:建立非无菌药品微生物限度检查检验标准操作规程,规范检验操作,确保检验结果准确。 2. 适用范围:适用于本公司所有采用非无菌药品微生物限度检查法测定的供试品。 3. 责任者:QC检验员、QC经理。 4. 正文: 4.1 非无菌产品微生物限度检查:微生物计数法 4.1.1 简述 微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。 当本法用于检查非无菌制剂及其原、辅料等是否符合规定的微生物限度标准时,应按下述规定进行检验,包括样品的取样量和结果的判断等。除另有规定外,本法不
适用于活菌制剂的检查。 本检查法可采用替代的微生物检查法,包括自动检测方法,但必须证明替代方法等效于药典规定的检查方法。 微生物计数试验应在受控洁净环境下的局部洁净度不低于B 级的单向流空气区域内进行。检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。单向流空气区域、工作台面及环境应定期进行监测。 如供试品有抗菌活性,应尽可能去除或中和。供试品检查时, 若使用了中和剂或灭活剂,应确认其有效性及对微生物无毒性。 供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。 4.1.2 计数方法 计数方法包括平皿法、薄膜过滤法和最可能数法(Most-Probable-NumberMethod,简称MPN 法)。MPN 法用于微生物计数时精确度较差,但对于某些微生物污染量很小的供试品,MPN 法可能是更适合的方法。 供试品检查时, 应根据供试品理化特性和微生物限度标准等因素选择计数方法,所选的方法必须具备检测充足样品量的能力,以保证所获得的试验结果能够判断供试品是否符合规定。所选方法的适用性须经确认。 4.1.3 计数培养基适用性检查和供试品计数方法适用性试验 供试品微生物计数中所使用的培养基应进行适用性检查。 供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数。 若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试
附录×××非无菌药品微生物限度检查指导原则 为更好应用非无菌产品微生物限度检查:微生物计数法(附录×××)、 非无菌产品微生物限度检查:控制菌检查法(附录×××)及非无菌药品 微生物限度标准(附录×××),特制定本指导原则。 非无菌药品中污染的某些微生物可能导致药物活性降低,甚至使药品丧失疗效,从而对患者健康造成潜在的危害。因此,在药品生产、贮藏和流通各个环节中,药品生产企业应严格遵循GMP的指导原则,以降低产品受微生物污染程度。非无菌产品微生物计数法、控制菌检查法及药品微生物限度标准可用于判断非规定无菌制剂及原料、辅料是否符合药典的规定,也可用于指导制剂、原料、辅料的微生物质量标准的制定,及指导生产过程中间产品微生物质量的监控。本指导原则将对标准和方法中的特定内容及标准的应用做进一步的说明。 1.非无菌药品微生物限度检查中,受控的洁净环境是指不低于GMP现行版要求的D级洁净环境。 2. 非无菌药品微生物限度检查过程中,如使用表面活性剂、灭活剂及中和剂,在确定其能否适用于所检样品及其用量时,除应证明该试剂对所检样品的处理有效外,还须确认该试剂不影响样品中可能污染的微生物的检出(即无毒性),因此无毒性确认试验的菌株不能仅局限于验证试验菌株,而应当包括产品中可能污染的微生物。 3.供试液制备方法、抑菌成分的消除方法及需氧菌总数、霉菌和酵母菌总数计数方法应尽量选择微生物计数方法中操作简便、快速的方法,同时,所选用的方法应避免损伤供试品中污染的微生物。对于抑菌作用较强的供试品,在供试品溶液性状允许的情况下,应尽量选用薄膜过滤法进行试验。 4.对照培养基系指按培养基处方特别制备、质量优良的培养基,用于培养基适用性检查,以保证药品微生物检验用培养基的质量。对照培养基由中国食品药品检定研究院研制及分发。 5.进行微生物计数方法适用性试验时,若因没有适宜的方法消除供试品中的抑菌作用而导致微生物回收的失败,应采用能使微生物生长的更高稀释级供试液进行方法适用性试验。此时更高稀释级供试液的确认要从低往高的稀释级进行,
微生物及无菌知识培训 一.前言 我们所生活的环境中,到处都存在着大量的微生物。在一般空气中,微生物达800~3500个/m3,在土壤中达1~500×108个/g,在严重污染的水中可达107个/ml。(饮用水要求细菌总数≤100个/ml,大肠杆菌≤3个/ml。经水塔或贮水池贮存后,短期内可繁殖至105~106个/ml。)人的头皮上有140万个/cm2,两手上约有4~40万个,1g指甲污垢有38亿个,1g粪便可达10~1000亿个。可以说微生物是无处不在,无处不有。许多以前被人们认为是极端(高温、高压、强酸、强碱、低温等)甚至是致死的环境,现在已发现生活着各种类型的微生物(称为极端微生物)。事实说明,微生物有特别顽强的生存、繁殖和变异能力来适应环境。 微生物种类繁多,有的对人有益,有的有害,有的无益也无害。但在药品生产过程中,不可能对环境中的各种微生物加以区别对待,为保证药品的安全有效,需要对其进行控制。空气中的微生物多数附着在灰尘上,或以芽孢形式悬浮于空气中,1μm以下者处于悬浮状态,10μm以上者会逐渐沉下来而形成菌尘。所以也要对尘粒进行控制。 大量临床资料表明,注射剂(尤其是静脉注射剂)如污染了7~12μm的尘粒,可导致热原反应、肺动脉炎、微血栓或异物肉芽肿等,严重的还会致人死命。而如果污染了细菌,轻则局部红肿化脓,重则引起全身细菌性感染。因此,对微生物和尘粒进行更加严格的控制对于针剂生产洁净室非常重要。 人是洁净室最大的污染源,占90%左右。一般男性每人每分钟向周围排放1000个以上的含菌粒子,女性为750个以上。穿无菌服时,静止时的发菌量为10~300个/min,一般活动时发菌量为150~1000个/min,行走时发菌量为900~2500个/min。咳嗽一次发菌量为70~700个/min,喷嚏一次为4000~60000个/min。所以在洁净室中,人的数量和活动应有特别严格的限制。 二.微生物简介 微生物是广泛存在于自然界的一群体形微小(直径小于1mm)、结构简单、肉眼看不见,必须藉助光学或电子显微镜放大数百至数万倍才能观察到的生物。需要说明的是,微生物是一个比较笼统的概念,界线有时非常模糊。如单细胞藻类和一些原生动物也应算是微生物,但通常它们并不放在微生物中进行研究。 微生物具有以下特点:①体积小,面积大;②吸收多,转化快(2000倍体重/h);③生长旺,繁殖快(20min分裂一次);④易变异,适应强;⑤分布广,种类多(10万种以上)。 微生物按其结构、化学组成及生活习性等差异可分成三大类: 1.真核细胞型细胞核的分化程度较高,有核膜、核仁和染色体;胞质内有完整的细胞器(如内质网、核糖体及线粒体等)。真菌属于此类型微生物。 2.原核细胞型细胞核分化程度低,仅有原始核质,没有核膜与核仁;细胞器不很完善。这类微生物种类众多,有细菌、支原体、衣原体、立克次体、螺旋体和放线菌。