
第二章 原子的结构和性质
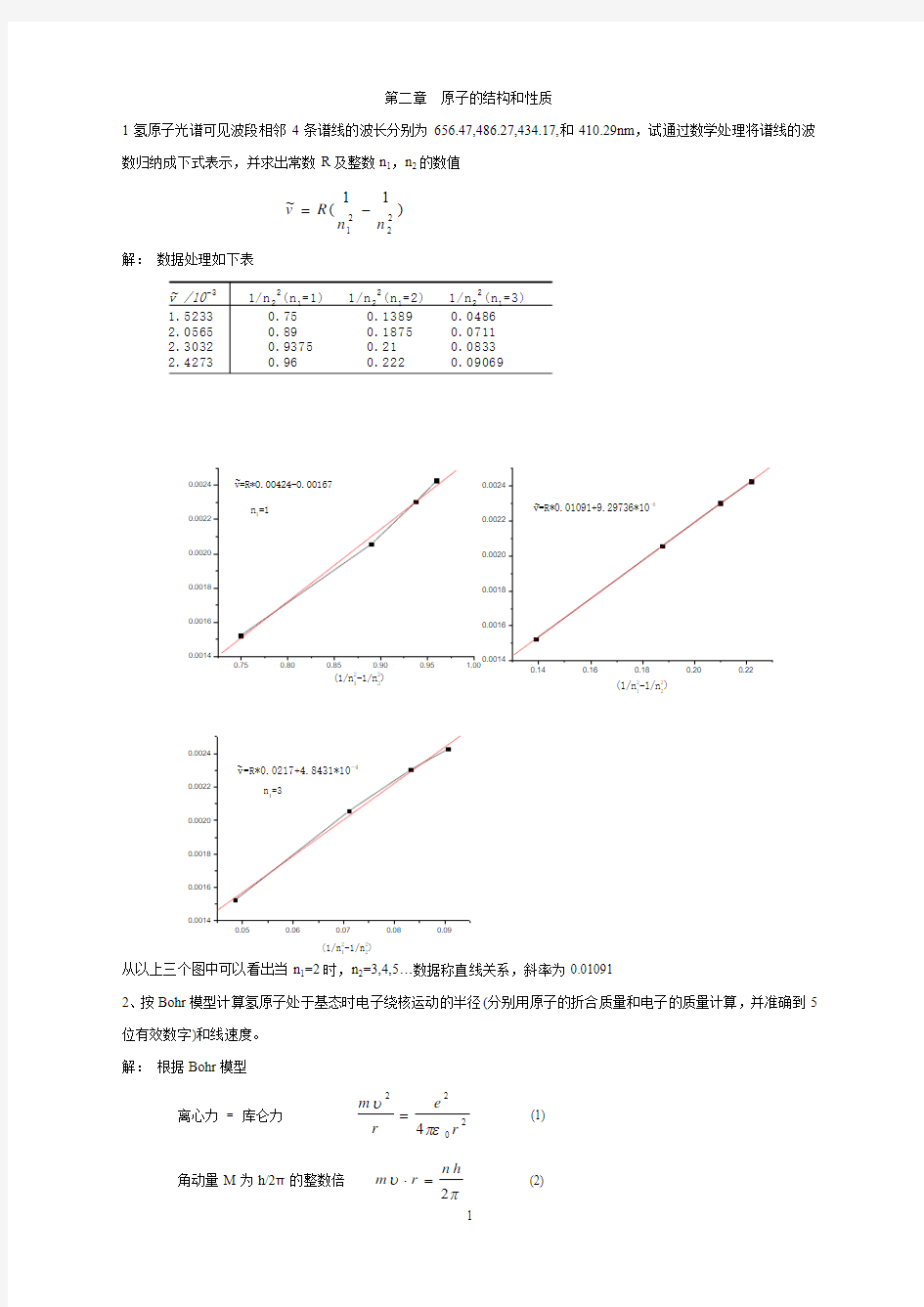
1氢原子光谱可见波段相邻4条谱线的波长分别为656.47,486.27,434.17,和410.29nm ,试通过数学处理将谱线的波数归纳成下式表示,并求出常数R 及整数n 1,n 2的数值
)11(~2
2
21
n n R v -= 解: 数据处理如下表
从以上三个图中可以看出当n 1=2时,n 2=3,4,5…数据称直线关系,斜率为0.01091
2、按Bohr 模型计算氢原子处于基态时电子绕核运动的半径(分别用原子的折合质量和电子的质量计算,并准确到5位有效数字)和线速度。 解: 根据Bohr 模型
离心力 = 库仑力
2
02
2
4r
e
r
m πευ=
(1)
角动量M 为h/2π的整数倍 π
υ2n h r m =? (2)
波数、c m -1
(1/n 21-1/n 22
)
(1/n 2
1
-1/n
2
2
)
波数、c m -1
(1/n 21
-1/n 2
2
)
v /10-3 1/n 22(n 1=1) 1/n 22(n 1=2) 1/n 22(n 1=3)
1.5233 0.75 0.1389 0.0486
2.0565 0.89 0.1875 0.07112.3032 0.9375 0.21 0.08332.4273 0.96 0.222 0.09069
~
由(1)式可知 mr
e
02
2
4πευ
=
;由(2)式可知 υ
πm n h r 2=
nh e
02
2ευ=
基态n=1线速度, 5
34
12
2
19
02
10
*18775.210
*626.6*10
*854188.8*2)
10
*60219.1(2----==
=
h
e ευ
基态时的半径,电子质量=9.10953*10-31kg
10
5
31
34
10
*29196.510
*18755.2*10
*10953.9*1416.3*210
*626.62----==
=
υ
πm nh r
折合质量,μ=9.10458*10-31kg 10
5
31
34
10
*29484.510
*18755.2*10
*10458.9*1416.3*210
*626.62----==
=πμυ
nh r
3、对于氢原子
(1) 分别计算从第一激发态和第六激发态跃迁到基态的光谱线的波长,说明这些谱线所属的线系及所处的光谱范围
(2) 上述两谱线产生的光子能否使;(a) 处于基态的另一个氢原子电离,(b)金属铜钟的铜原子电离(铜的功函数为7.44*10-19J)
(3) 若上述两谱线所产生的光子能使金属铜晶体的电子电离,请计算从金属铜晶体表面发射出的光电子的德布罗意波长
解:(1) H 原子的基态n=1,第一激发态n=2,第六激发态 n=7 m E E hc 7
4
23
834
1
210
*2159.110
*649.9*)125.0(595.1310
*02205.6*10*99793.2*10
*626.6--=--=
-=
λ
m E E hc 8
4
23
8
34
1
710
*3093.910
*649.9*)10205.0(595.1310
*02205.6*10*99793.2*10
*626.6--=--=
-=λ
谱线属于莱曼系,
(2) 从激发态跃迁到基态谱线的能量,E=hc/λ eV mol
hc
E 19.1010
*036.1*10*023.6*10*2159.110
*999.2*10
*626.65
1
237
8
34
1
1==
=
----λ
eV mol
hc
E 31.1310
*036.1*10*023.6*10
*3093.910
*999.2*10
*626.65
1
238
8
34
2
2==
=
----λ
基态H 原子电离需要的电离能为 13.6eV ,谱线不能使另一个基态H 原子电离。
J hc
E 8
1-7
8
34
1
110
*64.110*2159.110
*999.2*10
*626.6==
=
--λ
J hc
E 18
8
8
34
2
210*134.210
*3093.910
*999.2*10
*626.6==
=
--λ
谱线的能量大于铜的功函7.44*10-19J,可以使铜电离。 (3) 根据光电效应公式:
K E W hv += K
mE
p 2=
19
19
18
110
*96.810
*44.710
*64.1---=-=-=W hv E K
18
19
18
210
*39.110
*44.710*134.2---=-=-=W hv E K
10
24
34
19
31
34
1
110
*185.510*278.110*626.610
*96.8*10
*11.9*210
*626.62------==
=
=
K mE h λ
10
24
34
18
31
34
2210
*165.410
*591.110*626.610
*39.1*10
*11.9*210
*626.62------==
=
=K mE
h λ
4、请通过计算说明,用氢原子从第六激发态跃迁到基态所产生的光子照射长度为1120pm 的线性分子,该分子能否产生吸收光谱,若能,计算谱线的最大波长;若不能,请提出将不能变为可能的思路 解 根据氢原子能级公式
eV n
E 2
16
.13-=
从第六激发态跃迁到基态的能级差为 J eV E 18
2
10
*118.2222.13)16
1(6.13-==--=?
根据一维势箱模型,势箱长度为1120pm 的分子CH 2CHCHCHCHCHCHCH 2,能级公式为 2
22
8ma
n h E n =,电
子受光照射激发为△E=E 5-E 4 J ma
h
E E E 19
2
12
31
2
34
2
24510
*32.4)
10*1120(*10
*10953.9*8)
10
*626.6(*989----==
=
-=?
共轭分子吸收光谱的最大波长为 m E
hc 7
19
8
34
10
*598.410
*32.410
*9979.2*10
*626.6---==
?=
λ
5、计算氢原子φ1s 在r=a 0和r=2a 0处的比值
解 已知氢原子0
2
/30
1)
1(
1
a r s e a -
=
π
φ
e e
e e
a a a a a s a s ===---
-
)
21(2)2(1)(10
00
000//φφ
6、计算氢原子的1s 电子出现在r=100pm 的球形界面内的概率 )(1
c dx e x
a
n a
e x dx e
x ax
n ax
n ax
n +-
=
?
?
-
解:已知氢原子0
2
/30
1)
1(
1
a r s e a -
=
π
φ,r=100pm 的球形界面内的几率为
dr e
r a dr r Ddr P a r s ??
?
?-
===
100
100
22
3
2
120
)
1(
44φπ
dr re a a e
r dr e
r a r a r a r ??
?-
-?-
--
-=
100
20
100
22
100
22
)
/2(2|/2
}2
/2{
03.1143.1140100
200
200100
2000
dr e a a re
a a dr re
a a a r a r a r ?
?
-
-
-
+
-+-=+-=
}2
14.103.114100
22
02
000
dr e a a a a r ?
-
+
--=
)}2()2
(2
14.103.1140
100
202
02
000
a d e a a a a a r -
-
+
--=?
-
100
023
02
00|4
14.103.1140
a r e
a a a -
-
--=
3
02
0024423.014.103.114a a a +--=
)24423.014.103.114(443
02003
100
22
3
a a a a dr e
r a Ddr P a r +--=
=
=
??
?-
7282.024423.0*4/4*14.1/03.114*402
0=+--=a a
7、计算氢原子的积分:???
∞
=ππφθθ?20
2
21sin )(r
s d drd r r P ,作P(r)--r 图,求P(r)=0.1时的r 值,说明在该r
值以内电子出现的概率是90%。 解
??????∞∞?==π
πππφθθ?φθθ?2002
2
2002
2
1sin sin )(d d dr r d drd r r P r r s
??∞∞
-
==r r o
a r o
dr r e a dr r 2
22
/32
2
])
1(
1
[
44π
π?π
==
?∞
-
r
o
a r o
dr r e
a 2
23
4
分部积分:积分上下限 0< r < r =?∞
-
r o
a r dr r e
2
2
令u=r 2, du = 2r dr dr e dv o
a r 2-= o
a r o e
a v 22
-
-
=
??∞
-
∞
-
∞
-
+-
=r o
a r o r o
a r o r
o
a r rdr e
a r e
a dr r e
2222
2|2
rdr e
a r e
a r a r a r ?∞
-
-
+=
202
202 dr e
a r e a r e a r a r a r a r ?∞
-
-
-
+
+
=0
22
00
22
02
20222
2300
22
02
204
2
2
a r a r a r e a r e a r e a --
-
++
=
20
22
222)(a r a r a r e r e r e r P -
-
-
++=
2.6 8、已知氢原子的归一化基态波函数为: 0 3 11 a r s e a -= π? (1) 利用量子力学基本假设求该基态的能量和角动量 (2) 利用维利定理求该基态的平均势能和零点能 解:(1) 能量算符为H r e r r r r r r m h o πε?θθθθπ4]sin 1sin sin 11[8- H 2 2 2 2222 222 -?? +????+???? = 氢原子的1s 波函数与角度无关,只与r 有关 r e r r r r m h o πεπ418- H 2 2 2 22 - ???? = 30 2 2 2 30 2 2 1 4118- a r o a r e a r e e r r r r a m h - -?- ???? ?=ππεππ 30 2 2 2 030 2 2 1 41) 1(1 8- a r o a r e a r e e r r r a a m h - - ?- ?? - ?=ππεππ 30 2 2 2030 2 2 1 4])1(2[1 )1 (1 8- a r o a r a r e a r e e r a re r a a m h - -- ?- -+-?=ππεππ 30 2 30 2 2 1 41 )] 1(2)[1(8- a r o a r e a r e e a a r a m h - - ?- ?- +- =ππεππ 当r=a 0时 30 2 2 2 2 1 ] 41 8[ a r o e a a e a m h - ?- =ππεπ 30 12 12 2 19 2 12 31 2 2 34 1 ] 10 *92.52*10 *854.8*14.3*4) 10 *602.1(10 *92.52*10 *11.9*14.3*8) 10 *626.6([ a r e a - ------?-- =π) ( s a r e a 118 30 18 18 10 *18.21 ] 10 *36.410 *181.2[?π-- ---=?-= H 原子1s 基态的能量为-13.6eV 角动量平方算符为 ]sin 1 sin sin 1[ )2( ?2 2 2 2 2 φ θθ θ θπ ?? + ???? -=h M s s M 1120????= 所以1s 轨道的角动量为0 (2) 根据维利定理,对于H 原子 基态H 原子的能量为 – 13.6eV = 9、已知氢原子的θπ?cos )( 2410 20 3 2a r p e a r a Z -= ,试回答下列问题: (1) 原子轨道能E=? (2) 轨道角动量|M|=?,轨道磁矩|μ|=? (3) 轨道角动量M 和z 轴的夹角是多少度 (4) 列出计算电子离核平均距离的公式 (5) 节面的个数、位置和形状怎样 (6) 概率密度极大值的位置在何处 (7) 画出径向分布示意图。 解:(1) 2P Z 的原子轨道能为 E 2p(Z)= -13.6/n 2 = -13.6/4=-3.4eV (2) 轨道角动量π π 22 2) 1(h h l l M =+= , 轨道磁矩e e l l ββμ2)1(=+= (3) 轨道角动量M 和z 轴的夹角是90o 度 (4) 计算电子离核平均距离的公式 φθθθπππd d r d e a r r e a r a r a r a r c o s c o s ) 241( 20 20 20 2 30 - ∞ - ? ?>= (5) 节面的个数等于1、2P z 轨道沿Z 轴方向呈哑铃型 (6) 概率密度极大值的位置在何处 2 50 2 2 20 30 2 2*16cos )cos 241( a r a r e r dr d a e a r a dr d dr d - - = = πθθπ? 0])1(2[2*16cos 2*16cos 0 2 50 2 2 50 2 =- += = - - - a r a r a r e r a re a e r dr d a πθπθ 020 2 =- a r r r=0 或 r=2a 0 θπθπθ ?2 2 5 2 20 3 02 cos 2*161)cos 241( dr d e r a e a r a dr d d d a r a r - - = = 0sin cos 22*1610 2 50 =- =- θθπa r e r a cos θsin θ=0 cos θ=0, θ=90;sin θ=0,θ=0或360 因为θ=90是界面,所以2P z 轨道的密度极大值是沿Z 轴分布,距离核为2a 0。 (7) 画出径向分布示意图。 10、对氢原子,φ=c 1φ 210+c 2φ211+c 3φ31(-1),所有波函数都已归一化,请对φ 所描述的状态计算 (1) 能量平均值及能量-3.4eV 出现的概率 (2) 角动量平均值及角动量 π2/2h 出现的概率 (3) 角动量在Z 轴上的分量的平均值及角动量z 轴分量h/π出现的概率 解:φ=c 1φ 210+c 2φ211+c 3φ31(-1) (1) 能量平均值及能量-3.4eV 出现的概率 2 32 22 132 322 212 1)51.1()4.3(4.3c c c E c E c E c E -+-+-=++>=< 出现能量为-3.4的概率为c 12+c 22 (2) 角动量平均值及角动量π2/2h 出现的概率 π π π π 22 22 22 22 2 32 22 13 2 32 2 212 1h c h c h c h M c M c M c M = + + =++>=< 出现角动量为 π2/2h 的几率为1 (3) 角动量在Z 轴上的分量的平均值及角动量z 轴分量h/π出现的概率 )(2222 3222 32 23 2 32 2 21 2 1c c h c h c h M c M c M c M z z z z -= - = ++>=<π π π 出现角动量在Z 轴上分量为π/h 的几率为 0 2P z 径向分布图示意图 11、作氢原子φ 1s 2 —r 图及D 1s —r 图,证明D 1s 极大值在r=a 0处,说明两图形不同的原因。 解H 原子的1s 波函数为0 3 11 a r s e a -=π? 计算数据为: φ 1s 2~r 的图形: D 1s (D 1s =4πr 2φ1s 2 )—r 图形 φ 2 12、试在直角坐标系中划出氢原子的5种3d 轨道的轮廓图,比较这些轨道在空间的分布,正、负号,节面及对称性。 解: 13、写出He 原子的Schr?dinger 方程,说明用中心力场模型解此方程是要做哪些假设,计算其激发态(2s)1(2p)1的轨道角动量和轨道磁矩。 解:He 原子的Schr?dinger 方程为,采用核不动近似 ψψπεπεπεππE r e r ze r ze m h m h =+ - - ? - ? - -]44488[2 102 2 02 1 02 22 2 22 1 2 2 用中心力场模型解此方程时,首先是单电子假设,另一电子对目标电子的斥能看做是削弱原子核对目标电子的吸引力,用屏蔽常数σ表示,Schr?dinger 方程为 ψψπεσπE r e z m h =-- ? - ]4)(8[1 02 2 2 2 激发态(2s)1(2p)1的轨道角动量和轨道磁矩。 总轨道角动量量子数 L = 1; π π 22 2) 1(h h L L M =+= e e L L ββμ2)1(=+= 14、写出Li 2+粒子的Schr?dinger 方程,说明方程中各符号及各项的意义;写出Li 2+粒子1s 态的波函数并计算 (1) 1s 电子离核的平均距离; (2) 1s 电子径向分布最大值离核的距离 (3) 1s 电子概率密度最大处离核距离 (4) 比较Li 2+粒子的2s 和2p 态能量的高低 (5) Li 原子的第一电离能(按Slater 屏蔽常数算有效核电荷 ) d xy d xz d yz d x 2 -y 2 d z 2 解:Li 2+为类氢离子,Li 2+粒子的Schr?dinger 方程 ψψπεπE r ze m h =- ?- ]48[1 02 2 2 2 第一项为电子的动能项,第二项为核与电子势能项, 2 ?为Laplace 算符, E 为能量 Li 2+粒子1s 态的波函数为: 0 2 /30 1) ( 1 a r Z s e a Z ?- =π φ (1) 1s 电子离核的平均距离 dr e r d d a d re a d e r e a r a r a r a r a r ?????∞ - - - - ?= ?= >= <0 63 20 30 3 630 3 30 330 3 sin 3 3 3 θθφπτπτπππ dr e r a a r ? ∞ -?= 63 3 3 4*3ππ (2) 1s 电子径向分布最大值离核的距离 0 23 2 2 12 1)( 1 44a r Z s s e a Z r r D ?- ?=?=ππ?π 22 3 03 23 2 14])( 1 4[a Zr a r Z s e r dr d a Z e a Z r dr d dr dD - ?- = ?= ππ 0])2(2[40 22 230 3 =-+= - - a Zr a Zr e r a z re a Z 2r-2zr 2/a 0=0 r = 0; r = a 0/2z = a 0 /6 (3) 1s 电子概率密度最大处离核距离 20 30 3 230 3 21)2(a r Z a r Z s e a z a z e dr d a z dr d ?- ?- - = = ππφ φ 1s 2 是单调函数,当 r →0时,概率密度最大,当r →∞时,概率密度趋于零。 (4) 比较Li 2+粒子的2s 和2p 态能量的高低 Li 2+的2s 和2p 态能量是相同的 2 2 22/*6.13n z E E p s -== (5) Li 原子的第一电离能(按Slater 屏蔽常数算有效核电荷) Li 原子的电子组态为1s 22s 1 σ=2*0.85=1.7 eV z I 476.54 3.16 .134 ) (6 .132 2 1=-=--=σ 15、Li 原子的3个电离能分别为I 1=5.392eV ,I 2=75.638eV ,I 3=122.451eV ,请计算Li 原子的1s 电子结合能 解:解法(1),利用屏蔽常数计算 1s 轨道结合能 Li(1s 22s 1) Li +(1s 12s 1) 6.13*)4225.058.14(2 ) 85.0*23(6 .13*11 ) 3.03(6 .13*2)(2 2 2 2 --=----=Li E 6.13*)156.19(2 ) 85.0*3(6 .13*11 36 .13*)(2 2 2 2 --=---=+ Li E eV Li E Li E E 9.656.13*8465.46.13*)003.15156.10()()(==+-=-=?+ Li 的1s 轨道结合能为65.9eV 。 解法(2) eV I I I Li E 48.203)(321=++= eV Li E 12.1386.13*)156.19()(-=--=+ Li 的1s 轨道结合能=-138.12 +203.48=65.36 16、已知He 原子的第一电离能I 1=24.59eV ,试计算: (1) 第二电离能,1s 的单电子原子轨道能和电子结合能 (2) 基态能量; (3) 在1s 轨道中两个电子的互斥能; (4) 屏蔽常数; (5) 根据(4)所得结果求H -的基态能量 解:(1) 第二电离能,1s 的单电子原子轨道和电子结合能 eV I 4.541 26 .132 22== eV E s 3.391 ) 3.02(6 .132 2 1-=--= 当He 原子(1s 2)电离一个电子需要I 1=24.59eV ,根据电子结合能的定义,1s 电子结合能=I 1=24.59eV ,第二电离能I 2=54.4eV (2) 基态能量 E(基)=-(I 1+I 2)= 2E 1s = -78.99eV (3) 在1s 轨道中两个电子的互斥能 根据图示:-2I 2+J s-s = -I 1-I 2 J s-s = I 2 – I 1 = 54.4-24.59 =29.81eV (4) 屏蔽常数 设屏蔽常数为σ 2 2 11 )2(6 .13σ--=s E 99.78)2(2*6.13*22 1-=--==σs E E 基 2 - σ=1.70 σ=0. 3 He(1s 2 ) He +(1s 1 ) He 2+ (1s 0 ) I I 2 (5) 根据(4)所得结果求H -的基态能量 H -(1s 2) 1s 的屏蔽常数σ=0.3, eV E s 664.61 3.0-16.131 )1(6 .132 2 2 2 1-=-=--=) (σ H -基态的能量=2*E 1s = -2*6.664= -13.3eV 18、用2.4节(2.4.10)式计算Na 和F 的3s 和2p 轨道的有效半径r * 解:Na(1s 22s 22p 63s 1) F(1s 22s 22p 5) 1、Na 原子的3s 和2p 轨道的有效半径 8.885.0*81*23=+=s σ 15.435.0*785.0*22=+=p σ o o o s a a Z a n r 09.4) 8.811(32 * 2 * 3=-= = o o o p a a Z a n r 58.0) 15.411(22 * 2 * 2=-= = 2、F 原子的3s 和2p 轨道的有效半径 95.785.0*700.1*23=+=s σ 8.335.0*685.0*22=+=p σ o o o s a a Z a n r 57.8)95.79(32 * 2 * 3=-= = o o o p a a Z a n r 769.0) 8.39(22 * 2* 2=-= = 19、写出下列原子的基态光谱支项的符号 (1) Si (2) Mn (3) Br (4) Nb (5) Ni 解:(1) Si(1s 22s 22p 63s 23p 2) L= 1; S= 1; J = 2, 1, 0 基态光谱项为 3P 0 (2) Mn(1s 22s 22p 63s 23p 23d 54s 2) L = 0; S= 5/2; J=5/2 基态光谱项为 6S 5/2 (3) Br(1s 22s 22p 63s 23p 23d 104s 24p 5),P 5光谱项与P 1等同 L = 1; S= 1/2; J=3/2, 1/2(半满后J 大者稳定) 基态光谱项为 2P 3/2 (4) Nb(4d 45s 1),先计算d 4组态的L ,S 值 d 4组态的电子排布为: L 1=2, S 1= 2 s 1组态 L 2=0 , S 2 = 1/2 L 耦合 L = L 1+L 2 L 1+L 2-1 |L 1-L 2| 0+2=2 0+2-1=1 |1-2|=1 L可以取2, 1 S 耦合S1+S2S1+S2-1 |S1-S2| 2+1/2=5/2 3/2 |2-1/2|= 3/2 光谱项为6D 4D 6P 4P 基态光谱项为6D1/2 (5) Ni(3d84s2)(方法同第四小题)3d8与3d2光谱项等同 3d2L=3, S=1, J= 4,3,2 基态光谱项为3F4 20、写出Na和F原子基态组态以及C的激发态C(1s22s22p13p1)存在的光谱符号解:Na原子的基态的在电子组态为,1s22s22p63s1 总轨道角动量量子数为:L=0 总自旋角动量量子数为:S= 1/2 基态光谱项为:2S1/2 F原子的基态的在电子组态为,1s22s22p5,其光谱项与2P1等同 总轨道角动量量子数为:L=1 总自旋角动量量子数为:S= 1/2 总角动量量子数为:J=3/2, 1/2 基态光谱项为:2P3/2 C原子的基态的在电子组态为,1s22s22p13p1, 总轨道角动量量子数为:L=2, 1, 0 总自旋角动量量子数为:S= 1, 0 当L=2,S=1,J= 3, 2,1, 光谱项为3D3, 3D2, 3D1 当L=2,S=0,J= 2 光谱项为1D2, 当L=1,S=1,J= 2,1,0 光谱项为3P2, 3P1, 3P0 当L=1,S=0,J= 1, 光谱项为1P1, 当L=0,S=1,J= 1, 光谱项为3S1 当L=0,S=0,J= 0, 光谱项为1S0 21、对于Sc原子(Z=21),写出 (1) 能级最低的光谱支项 (2) 在该光谱支项表征的状态中,原子的总轨道角动量; (3) 在该光谱支项表征的状态中,原子的总自旋角动量; (4) 在该光谱支项表征的状态中,原子的总角动量; (5) 在磁场中此光谱支项分裂为多少个微观能态 解:(1) Sc价原子电子组态为3d1 L=l =2; S=1/2; J= 5/2, 3/2, 光谱项为 2D 5/2 2D 3/2 能级最低的光谱支项为2D 3/2 (2) 原子的总轨道角动量为ππ26 2) 1(h h L L M L =+= (3) 原子的总自旋角动量 ππ22) 1(4 3h h S S M S = += (4) 原子的总角动量 π π 22)1(4 15h h J J M J = += (5) 在磁场中此光谱支项分裂为多少个微观能态 因为J=3/2,m J 可以取2J+1个值,即 4个值(3/2, 1/2 -1/2 -3/2),该光谱项有4个微观状态 (2D 3/2 , 2D 1/2 , 2D -1/2, 2D -3/2 ) 22、基态Ni 原子可能的电子组态为:(1)[Ar]3d 84s 2, (2) [Ae]3d 94s 1。由光谱实验确定其能量最低的光谱支项为3F 4,试判断它是哪种组态。 解:(1)设Ni 原子电子组态为 [Ar]3d 84s 2, 基态光谱项为 3F 4 (2) 设Ni 原子电子组态为[Ae]3d 94s 1。 L 1=2, l =0, L= 2 S 1 = 1/2 s 2 = 1/2 S =1, 0 (基态S 大者稳定) J = 3,2,1 基态光谱项为 3D 3 所以有试验确定Ni 的基态电子组态为[Ar]3d 84s 2,而不是[Ae]3d 94s 1。 结构化学复习题 一、选择填空题 第一章量子力学基础知识 1.实物微粒和光一样,既有性,又有性,这种性质称为性。 2.光的微粒性由实验证实,电子波动性由实验证实。 3.电子具有波动性,其波长与下列哪种电磁波同数量级? ( A)X 射线(B)紫外线(C)可见光(D)红外线 4.电子自旋的假设是被下列何人的实验证明的? ( A) Zeeman ( B) Gouy(C)Stark(D)Stern-Gerlach 5. 如果 f 和 g 是算符,则(f+g)(f-g)等于下列的哪一个? (A)f 2-g 2;(B)f2-g2-fg+gf;(C)f2+g2;(D)(f-g)(f+g) 6.在能量的本征态下,下列哪种说法是正确的? ( A)只有能量有确定值;(B)所有力学量都有确定值; ( C)动量一定有确定值;(D)几个力学量可同时有确定值; 7. 试将指数函数e±ix表示成三角函数的形式------ 8.微观粒子的任何一个状态都可以用 概率密度。 9.Planck常数h的值为下列的哪一个? ( A) 1.38 × 10-30 J/s(B)1.38× 10-16J/s 10.一维势箱中粒子的零点能是 答案 : 1.略. 2.略. 3.A 4.D 5.B 6.D 7. 来描述;表示粒子出现的(C) 6.02 × 10-27J· s(D)6.62×10-34J· s 略8.略9.D10.略 第二章原子的结构性质 1. 用来表示核外某电子的运动状态的下列各组量子数(n, 1, m, m s)中,哪一组是合理的? (A)2 ,1, -1,-1/2;(B)0 , 0,0, 1/2 ;(C)3 ,1, 2, 1/2 ;(D)2 , 1, 0, 0。 2.若氢原子中的电子处于主量子数n=100 的能级上,其能量是下列的哪一个: (A)13.6Ev ;(B)13.6/10000eV;(C)-13.6/100eV;(D)-13.6/10000eV; 3.氢原子的 p x状态,其磁量子数为下列的哪一个? (A)m=+1;(B)m=-1;(C)|m|=1;(D)m=0; 4.若将 N 原子的基电子组态写成 1s 22s22p x22p y1违背了下列哪一条? (A)Pauli 原理;( B) Hund 规则;(C)对称性一致的原则;( D)Bohr 理论 5.B 原子的基态为1s22s2p1, 其光谱项为下列的哪一个? (A) 2 P;(B)1S;(C)2D;(D)3P; 6.p 2组态的光谱基项是下列的哪一个? ( A)3F;(B)1D;(C)3P;(D)1S; 7.p 电子的角动量大小为下列的哪一个? ( A) h/2 π;( B) 31/2 h/4 π;( C) 21/2 h/2 π;( D) 2h/2 π; 第二章 原子的结构和性质 1、(南开99)在中心力场近似下,Li 原子基态能量为_____R, Li 原子的第一电离能I 1=____R ,第二电离能I 2=_____R 。当考虑电子自旋时,基态Li 原子共有_____个微观状态。在这些微观状态中,Li 原子总角动量大小|M J |=__________。 (已知R=13.6eV ,屏蔽常数0.01,σ=0.30;σ=0.85;σ=s 1s 2s,1s 1s,2s ) 注意屏蔽常数的写法 解: Li 1s 2 2s 1 ()()22 122 -30.37.291 s Z E R R R n σ-=-=-=- ()2 22 3-0.852-0.42252 s E R R ?==- 12215.0025Li s s E E E R =+=- 电离能: 1()-()A A e I E A E A ++ →+= 222 ()-()A A e I E A E A ++++→+= 第一电离能:1Li Li I E E +=- 12s Li E E += 120.4225s I E R ∴=-= 第二电离能: 2 2231 Li E R + =- 12s Li E E += 29(27.29) 5.58I R R R =---?= 2122 :12Li S S S ? 2个微观状态 11 022 S l J === 13 3||)22 2 J M = = ?= (Be 原子的第一和第二电离能如何求?) 2、(南开04)若测量氢原子中电子的轨道角动量在磁场方向(Z 轴方向)的分量Z M 值,当电子处在下列状态时,Z M 值的测量值为的几 率分别是多少? 2221(1)(2)(3)px PZ P +ψψψ 解: 2(1)10.5px Z m m ψ=±=的几率为 2211211)px ψψψ-=+ 2(2)00PZ Z m m ψ==的几率为 21(3)11P Z m m +ψ==的几率为 3、在下表中填写下列原子的基谱项和基支项(基支项又称基谱支项,即能量最低的光谱支项) 464346433/25/29/22 233:44As Mn Co O S S F P S S F P As S P P ?????????????????????????????????????? ↑ ↑ ↑ 原子 基谱项基谱支项 43/2 525 65/2 72749/2 24433 02255:3402239 :34322 :22L S J S Mn d S d L S J S Co d S d L S J F O S P P === ↑↑↑↑↑===↑↓↑↓↑ ↑ ↑ ===↑↓↑ ↑ 32 112L S J P === 4、(南开04) 02 原子的结构和性质 【2.1】氢原子光谱可见波段相邻4条谱线的波长分别为656.47、486.27、434.17和410.29nm ,试通过数学处理将谱线的波数归纳成为下式表示,并求出常数R 及整数n 1、n 2的数值。 2212 11 ( )R n n ν=-% 解:将各波长换算成波数: 1656.47nm λ= 1115233v cm - -= 2486.27nm λ= 1220565v cm - -= 3434.17nm λ= 1323032v cm - -= 4410.29nm λ= 1424373v cm - -= 由于这些谱线相邻,可令1n m =,21,2,n m m =++……。列出下列4式: ()2 2152331R R m m = - + ()22205652R R m m =- + ()2 2230323R R m m = - + ()2 2243734R R m m =- + (1)÷(2)得: ()()()2 3212152330.7407252056541m m m ++==+ 用尝试法得m=2(任意两式计算,结果皆同)。将m=2带入上列4式中任意一式,得: 1109678R cm -= 因而,氢原子可见光谱(Balmer 线系)各谱线的波数可归纳为下式: 221211v R n n - ??=- ? ?? 式中, 1 12109678,2,3,4,5,6R cm n n -===。 【2.2】按Bohr 模型计算氢原子处于基态时电子绕核运动的半径(分别用原子的折合质量和电子的质量计算并精确到5位有效数字)和线速度。 解:根据Bohr 提出的氢原子结构模型,当电子稳定地绕核做圆周运动时,其向心力与核和电子间的库仑引力大小相等,即: 02 原子的结构和性质 【】氢原子光谱可见波段相邻4条谱线的波长分别为、、和,试通过数学处理将谱线的波数归纳成为下式表示,并求出常数R 及整数n 1、n 2的数值。 2 21211 ( )R n n ν=- 解:将各波长换算成波数: 1656.47nm λ= 1115233v cm - -= 2486.27nm λ= 1220565v cm - -= 3434.17nm λ= 1323032v cm - -= 4410.29nm λ= 1424373v cm - -= 由于这些谱线相邻,可令1n m =,21,2,n m m =++……。列出下列4式: ()2 2152331R R m m = - + ()22205652R R m m =- + ()2 2230323R R m m = - + ()2 2243734R R m m =- + (1)÷(2)得: ()()()2 3212152330.7407252056541m m m ++==+ 用尝试法得m=2(任意两式计算,结果皆同)。将m=2带入上列4式中任意一式,得: 1109678R cm -= 因而,氢原子可见光谱(Balmer 线系)各谱线的波数可归纳为下式: 221211v R n n - ??=- ? ?? 式中, 1 12109678,2,3,4,5,6R cm n n -===。 【】按Bohr 模型计算氢原子处于基态时电子绕核运动的半径(分别用原子的折合质量和电子的质量计算并精确到5位有效数字)和线速度。 解:根据Bohr 提出的氢原子结构模型,当电子稳定地绕核做圆周运动时,其向心力与核和电子间的库仑引力大小相等,即: 《结构化学》第一章习题 1001 首先提出能量量子化假定的科学家是:---------------------------( ) (A) Einstein (B) Bohr (C) Schrodinger (D) Planck 1002 光波粒二象性的关系式为_______________________________________。 1003 德布罗意关系式为____________________;宏观物体的λ值比微观物体的λ值_______________。 1004 在电子衍射实验中,│ ψ│2 对一个电子来说,代表___________________。 1005 求德布罗意波长为0.1 nm 的电子的动量和动能。 1006 波长λ=400 nm 的光照射到金属铯上,计算金属铯所放出的光电子的速率。已知铯的临阈波长为600 nm 。 1007 光电池阴极钾表面的功函数是2.26 eV 。当波长为350 nm 的光照到电池时,发射的电子最大速率是多 少? (1 eV=1.602×10-19J , 电子质量m e =9.109×10-31 kg) 1008 计算电子在10 kV 电压加速下运动的波长。 1009 任一自由的实物粒子,其波长为λ,今欲求其能量,须用下列哪个公式---------------( ) (A) λc h E = (B) 222λm h E = (C) 2) 25.12 (λ e E = (D) A ,B ,C 都可以 1010 对一个运动速率v< 一选择题 1、电子自旋是电子( c ) A 、具有一种类似地球自转的运动 B 、具有一种非轨道的运动 C 、具有一种空间轨道外的顺逆时针的自转 D 、具有一种空间轨道中的顺逆时针的自转 2、下列分子中哪些不存在大π键( a ) A. CH 2=CH-CH 2-CH=CH 2 B. CH 2=C=O C. CO(NH 2)2 D.C 6H 5CH=CHC 6H 5 3、某原子的电子组态为1s 22s 22p 63s 14d 1,其基谱项为( a ) A 3D B 1D C 3S D 1S 4、已知类氢波函数ψ2px 的各种图形,推测ψ3px 图形,下列结论不正确的是 ( b ): A 、角度部分图形相同 B 、电子云相同 C 、径向分布不同 D 、界面图不同 5、单个电子的自旋角动量在z 轴方向上的分量是:( d ) 6、 具有的π 键类型为:( a ) A 、109π B 、108π C 、99π D 、119π 7、 下列光谱项不属于p 1d 1组态的是( c )。 A. 1P B . 1D C. 1S D. 3F 8、对氢原子和类氢离子的量子数l ,下列叙述不正确的是( b )。 A l 的取值规定m 的取值范围 B 它的取值与体系能量大小有关 C 它的最大可能取值由解方程决定 D 它的取值决定了|M| = )1(+l l 9、通过变分法计算得到的微观体系的能量总是( c )。 A 等于真实体系基态能量 B 大于真实体系基态能量 C 不小于真实体系基态能量 D 小于真实体系基态能量 10、已知类氢波函数Ψ2px 的各种图形,推测Ψ3px 图形,下列说法错误的是( b ) A 角度部分的图形相同 B 电子云图相同 C 径向分布函数图不同 D 界面图不同 11、对氢原子Φ方程求解,下列叙述有错的是( c ). A. 可得复函数解Φ=ΦΦim m Ae )(. B. 由Φ方程复函数解进行线性组合,可得到实函数解. C. 根据Φm (Φ)函数的单值性,可确定|m |=0,1,2,……l 根据归一化条件1)(220=ΦΦΦ?d m π求得π21=A 12、He +的一个电子处于总节面数为3的d 态,问电子的能量应为?R 的 ( c ). A.1 B.1/9 C.1/4 D.1/16 13、电子在核附近有非零几率密度的原子轨道是( d ). 一、填空题 1. 已知:类氢离子He +的某一状态Ψ=0202/30)22()2(241a r e a r a -?-?π此状态的n ,l ,m 值分别为_____________________.其能量为_____________________,角动量平方为_________________.角动量在Z 轴方向分量为_________. 2. He +的3p z 轨道有_____个径向节面, 有_____个角度节面。 3. 如一原子轨道的磁量子数m=0,主量子数n ≤2,则可能的轨道为__________。 二、选择题 1. 在外磁场下,多电子原子的能量与下列哪些量子数有关( ) A. n,l B. n,l,m C. n D. n,m 2. 用来表示核外某电子运动状况的下列各组量子数(n ,l ,m ,ms )中,哪一组是合理的() A. (2,1,-1,-1/2) B. (0,0,0,1/2) C. (3,1,2,1/2) D.(2,1,0,0) 3. 如果一个原子的主量子数是4,则它( ) A. 只有s 、p 电子 B. 只有s 、p 、d 电子 C. 只有s 、p 、d 和f 电子 D. 有s 、p 电子 4. 对氢原子Φ方程求解,下列叙述有错的是( ). A. 可得复函数解Φ=ΦΦim m Ae )(. B. 由Φ方程复函数解进行线性组合,可得到实函数解. C. 根据Φm (Φ)函数的单值性,可确定|m|=0.1.2…………I D. 根据归一化条件1)(220=ΦΦΦ?d m π求得π21 =A 5. He +的一个电子处于总节面数为3的d 态问电子的能量应为 ( ). A.1 B.1/9 C.1/4 D.1/16 6. 电子在核附近有非零几率密度的原子轨道是( ). A.Ψ3P B. Ψ3d C.Ψ2P D.Ψ2S 7. 氢原子处于下列各状态 (1)ψ2px (2) ψ3dxz (3) ψ3pz (4) ψ3dz 2 (5)ψ322 ,问哪些状态既是M 2算符的本征函数,又是M z 算符的本征函数? A. (1) (3) B. (2) (4) C. (3) (4) (5) D. (1) (2) (5) 习 题 1. 用VSEPR 理论简要说明下列分子和离子中价电子空间分布情况以及分子和离子的几何构型。 (1) AsH 3; (2)ClF 3; (3) SO 3; (4) SO 32-; (5) CH 3+ ; (6) CH 3- 2. 用VSEPR 理论推测下列分子或离子的形状。 (1) AlF 63-; (2) TaI 4-; (3) CaBr 4; (4) NO 3-; (5) NCO -; (6) ClNO 3. 指出下列每种分子的中心原子价轨道的杂化类型和分子构型。 (1) CS 2; (2) NO 2+ ; (3) SO 3; (4) BF 3; (5) CBr 4; (6) SiH 4; (7) MnO 4-; (8) SeF 6; (9) AlF 63-; (10) PF 4+ ; (11) IF 6+ ; (12) (CH 3)2SnF 2 4. 根据图示的各轨道的位向关系,遵循杂化原则求出dsp 2 等性杂化轨道的表达式。 5. 写出下列分子的休克尔行列式: CH CH 2 123 4 56781 2 34 6. 某富烯的久期行列式如下,试画出分子骨架,并给碳原子编号。 0100001100101100001100 001101001 x x x x x x 7. 用HMO 法计算烯丙基自由基的正离子和负离子的π能级和π分子轨道,讨论它们的稳定性,并与烯丙基自由基相比较。 8. 用HMO法讨论环丙烯基自由基C3H3·的离域π分子轨道并画出图形,观察轨道节面数目和分布特点;计算各碳原子的π电荷密度,键级和自由价,画出分子图。 9. 判断下列分子中的离域π键类型: (1) CO2 (2) BF3 (3) C6H6 (4) CH2=CH-CH=O (5) NO3- (6) C6H5COO- (7) O3 (8) C6H5NO2 (9) CH2=CH-O-CH=CH2 (10) CH2=C=CH2 10. 比较CO2, CO和丙酮中C—O键的相对长度,并说明理由。 11. 试分析下列分子中的成键情况,比较氯的活泼性并说明理由: CH3CH2Cl, CH2=CHCl, CH2=CH-CH2Cl, C6H5Cl, C6H5CH2Cl, (C6H5)2CHCl, (C6H5)3CCl 12. 苯胺的紫外可见光谱和苯差别很大,但其盐酸盐的光谱却和苯很接近,试解释此现象。 13. 试分析下列分子中的成键情况,比较其碱性的强弱,说明理由。 NH3, N(CH3)2, C6H5NH2, CH3CONH2 14. 用前线分子轨道理论乙烯环加成变为环丁烷的反应条件及轨道叠加情况。 15. 分别用前线分子轨道理论和分子轨道对称性守恒原理讨论己三烯衍生物的电环化反应 在加热或者光照的条件下的环合方式,以及产物的立体构型。 参考文献: 1. 周公度,段连运. 结构化学基础(第三版). 北京:北京大学出版社,2002 2. 张季爽,申成. 基础结构化学(第二版). 北京:科学出版社,2006 3. 李炳瑞.结构化学(多媒体版).北京:高等教育出版社,2004 4. 林梦海,林银中. 结构化学. 北京:科学出版社,2004 5. 邓存,刘怡春. 结构化学基础(第二版). 北京:高等教育出版社,1995 6.王荣顺. 结构化学(第二版). 北京:高等教育出版社,2003 7. 夏少武. 简明结构化学教程(第二版). 北京:化学工业出版社,2001 8. 麦松威,周公度,李伟基. 高等无机结构化学. 北京:北京大学出版社,2001 9. 潘道皑. 物质结构(第二版). 北京:高等教育出版社,1989 10. 谢有畅,邵美成. 结构化学. 北京:高等教育出版社,1979 11. 周公度,段连运. 结构化学基础习题解析(第三版). 北京:北京大学出版社,2002 12. 倪行,高剑南. 物质结构学习指导. 北京:科学出版社,1999 13. 夏树伟,夏少武. 简明结构化学学习指导. 北京:化学工业出版社,2004 14. 徐光宪,王祥云. 物质结构(第二版). 北京:科学出版社, 1987 15. 周公度. 结构和物性:化学原理的应用(第二版). 北京:高等教育出版社, 2000 16. 曹阳. 结构与材料. 北京:高等教育出版社, 2003 17. 江元生. 结构化学. 北京:高等教育出版社, 1997 18. 马树人. 结构化学. 北京:化学工业出版社, 2001 19. 孙墨珑. 结构化学. 哈尔滨:东北林业大学出版社, 2003 结构化学第二章原子的结构和性质习题及答案 https://www.doczj.com/doc/0317345478.html,work Information Technology Company.2020YEAR 一、填空题 1. 已知:类氢离子He +的某一状态Ψ=0202/30)22()2(241a r e a r a -?-?π此状态的n ,l ,m 值分别为_____________________.其能量为_____________________,角动量平方为_________________.角动量在Z 轴方向分量为_________. 2. He +的3p z 轨道有_____个径向节面, 有_____个角度节面。 3. 如一原子轨道的磁量子数m=0,主量子数n ≤2,则可能的轨道为 __________。 二、选择题 1. 在外磁场下,多电子原子的能量与下列哪些量子数有关( ) A. n,l B. n,l,m C. n D. n,m 2. 用来表示核外某电子运动状况的下列各组量子数(n ,l ,m ,ms )中,哪一组是合理的() A. (2,1,-1,-1/2) B. (0,0,0,1/2) C. (3,1,2,1/2) D.(2,1,0,0) 3. 如果一个原子的主量子数是4,则它( ) A. 只有s 、p 电子 B. 只有s 、p 、d 电子 C. 只有s 、p 、d 和f 电子 D. 有s 、p 电子 4. 对氢原子Φ方程求解,下列叙述有错的是( ). A. 可得复函数解Φ=ΦΦim m Ae )(. B. 由Φ方程复函数解进行线性组合,可得到实函数解. C. 根据Φm (Φ)函数的单值性,可确定|m|=0.1.2…………I D. 根据归一化条件1)(220=ΦΦΦ?d m π求得π21 =A 5. He +的一个电子处于总节面数为3的d 态问电子的能量应为 ( ). A.1 B.1/9 C.1/4 D.1/16 第二章 分子结构 一、填空题 1、等性sp n 杂化轨道夹角公式为 。 2、离域π键的形成条件: 。 3、LCAO-MO 成键三原则 。 4、在极性分子AB 中的一个分子轨道上运动的电子,在A 原子的ΨA 原子轨道上出现几率为36%,在B 原子的ΨB 原子轨道上出现几率为64%,写出该分子轨道波函数 。 5、在极性分子AB 中的一个分子轨道上运动的电子,在A 原子的ΨA 原子轨道上出现几率为80%,在B 原子的ΨB 原子轨道上出现几率为20%,写出该分子轨道波函数 。 6、O 2的电子组态 。磁性 。 7、HF 分子的电子组态为 。 8、F 2分子的电子组态为 。 9、N 2分子的电子组态为 。 10、CO 分子的电子组态为 。 11、NO 分子的电子组态为 。 12、OF ,OF +,OF -三个分子中,键级顺序为 。 13、判断分子有无旋光性的标准是 Sn 轴 。 14、判断分子无极性的对称性条件是 两对称元素仅交于一点 。 15、O=C=O 分子属于h D ∞点群,其大π键类型是432π。 16、丁二炔分子属于h D ∞点群,其大π键类型是442π。 17、NH 3分子属于3v C 点群。 18、CHCl 3和CH 3Cl 分子均属于3v C 点群。 19、N 2的键能比N 2+的键能 小 。 20、自由价 。 21、Px 与Px 轨道沿z 轴重叠形成 键。Px 与Px 轨道沿x 轴重叠形成 键。 22、变分积分表达式为 。 23、分子轨道 。 24、分子图 。 25、MOT 中,电子填充应遵守 。26、群的四个条件 。 27、根据分子对称性可以确定只有属于Cs, , ,等几类点群的分子才具有偶极矩不为零。 二、选择题 一、填空题 1. 已知:类氢离子He+的某一状态Ψ=此状态的n,l,m值分别为_____________________.其能量为_____________________,角动量平方为_________________.角动量在Z轴方向分量为_________. 2. He+的3p z轨道有_____个径向节面,有_____个角度节面。 3. 如一原子轨道的磁量子数m=0,主量子数n≤2,则可能的轨道为__________。 二、选择题 1. 在外磁场下,多电子原子的能量与下列哪些量子数有关( B ) A. n,l B. n,l,m C. n D. n,m 2. 用来表示核外某电子运动状况的下列各组量子数(n,l,m,ms)中,哪一组是合理的(A) A. (2,1,-1,-1/2) B. (0,0,0,1/2) C. (3,1,2,1/2) D.(2,1,0,0) 3. 如果一个原子的主量子数是4,则它( C ) A. 只有s、p电子 B. 只有s、p、d电子 C. 只有s、p、d和f电子 D. 有s、p电子 4. 对氢原子Φ方程求解,下列叙述有错的是( C ). A. 可得复函数解. B. 由Φ方程复函数解进行线性组合,可得到实函数解. C. 根据Φm(Φ)函数的单值性,可确定|m|=…………I D. 根据归一化条件求得 5. He+的一个电子处于总节面数为3的d态问电子的能量应为 ( D ). 9 4 16 6. 电子在核附近有非零几率密度的原子轨道是( D ). A.Ψ3P B. Ψ3d C.Ψ2P D.Ψ2S 7. 氢原子处于下列各状态 (1)2px (2) 3dxz (3) 3pz (4) 3dz2 (5)322 ,问哪些状态既是2算符的本征函数,又是M z算符的本征函数C A. (1) (3) B. (2) (4) C. (3) (4) (5) D. (1) (2) (5) 8. Fe的电子组态为[Ar]3d64s2,其能量最低的光谱支项( A ) B. 3P2 C. 5D0 D. 1S0 9. 立方箱中在E6h2/4ml2的能量范围内,能级数和状态数为(C )。 结构化学第二章习题(周公度) 第二章原子的结构和性质 1氢原子光谱可见波段相邻4条谱线的波长分别为656.47,486.27,434.17, 和 410.29nm ,试通过数学处理将谱线的波数归纳成下式表示,并求出常数R 及整数n 1,n 2的数值 ~=R (1-1) v 22 n 1 n 2 解:数据处理如下表 -3222 v /10~(n=1) 1/n(n=2) 1/n(n=3) 波数、c m -1 2 2 (1/n2-1/n2) 12 (1/n-1/n) 2 1 波数、c m -1 2 2 (1/n-1/n) 21 从以上三个图中可以看出当n 1=2时,n 2=3,4,5…数据称直线关系,斜率为0.01091 2、按Bohr 模型计算氢原子处于基态时电子绕核运动的半径(分别用原子的折合质量和电子的质量计算,并准确到5位有效数字) 和线速度。解:根据Bohr 模型 离心力 = 库仑力 m υr 2 = e 2 2 4πε0r n h 2π (1) 角动量M 为h/2π的整数倍 m υ?r = (2)由(1)式可知υ 2 = 2 e 2 4πε0mr ;由(2)式可知 r = n h 2πm υ υ= 2 e 2ε0nh = 基态n=1线速度,υ= e (1. 60219*10 2*8. 854188*10 -12 -19 ) 2 -34 2ε0h *6. 626*10 =2. 18775*10 -5 基态时的半径,电子质量=9.10953*10-31kg r = nh 2πm υ = 6. 626*10 2*3. 1416*9. 10953*10 -34 -31 *2. 18755*10 -5 =5. 29196*10 -10 折合质量,μ=9.10458*10-31kg r =3、对于氢原子 《结构化学》第三章习题 3001 H 2+的H ?= 21?2- a r 1 - b r 1 +R 1, 此种形式已采用了下列哪几种方法: ------------------------------ ( ) (A) 波恩-奥本海默近似 (B) 单电子近似 (C) 原子单位制 (D) 中心力场近似 3002 分析 H 2+的交换积分(β积分) H ab 为负值的根据。 3003 证明波函数 ()()() ()b a b a ψψψψψψS S s 1s 121u s 1s 121g 221221--=++= 是相互正交的。 3004 通过变分法计算得到的微观体系的能量总是:----------------- ( ) (A) 等于真实基态能量 (B) 大于真实基态能量 (C) 不小于真实基态能量 (D) 小于真实基态能量 3006 什么叫分子轨道?按量子力学基本原理做了哪些近似以后才有分子轨道的概念? 这些近似的根据是什么? 3007 描述分子中 _______________ 空间运动状态的波函数称为分子轨道。 3008 对于"分子轨道"的定义,下列叙述中正确的是:----------------- ( ) (A) 分子中电子在空间运动的波函数 (B) 分子中单个电子空间运动的波函数 (C) 分子中单电子完全波函数(包括空间运动和自旋运动) (D) 原子轨道线性组合成的新轨道 3009 试述由原子轨道有效地形成分子轨道的条件。 3010 在 LCAO-MO 中,所谓对称性匹配就是指两个原子轨道的位相相同。这种说法是 否正确? 3011 在LCAO-MO 方法中,各原子轨道对分子轨道的贡献可由哪个决定: ----------------- ( ) (A) 组合系数 c ij (B) (c ij )2 《结构化学》第二章习题 2001 在直角坐标系下, Li 2+ 的Schr ?dinger 方程为________________ 。 2002 已知类氢离子 He + 的某一状态波函数为: () 22-02 302 1 e 222241a r a r a ??? ? ??-???? ??π 则此状态的能量为 )(a , 此状态的角动量的平方值为 )(b , 此状态角动量在 z 方向的分量为 )(c , 此状态的 n , l , m 值分别为 )(d , 此状态角度分布的节面数为 )(e 。 2003 已知 Li 2+ 的 1s 波函数为 32 130s 1e 27a r -α? ? ????π=ψ (1)计算 1s 电子径向分布函数最大值离核的距离; (2)计算 1s 电子离核平均距离; (3)计算 1s 电子概率密度最大处离核的距离。 (1 0!d e +∞ -=?n ax n a n x x ) 2004 写出 Be 原子的 Schr ?dinger 方程 。 2005 已知类氢离子 He + 的某一状态波函数为 ) 22-02 302 1 e 222241a r a r a ??? ? ??-??? ? ??π 则此状态最大概率密度处的 r 值为 )(a , 此状态最大概率密度处的径向分布函数值为 )(b , 此状态径向分布函数最大处的 r 值为 )(c 。 2006 在多电子原子中, 单个电子的动能算符均为2 2 28?π- m h 所以每个 电子的动能都是相等的, 对吗? ________ 。 2007 原子轨道是指原子中的单电子波函数, 所以一个原子轨道只能容纳一个电子,对 吗? ______ 。 《结构化学》第四章习题 4001 I 3和I 6不是独立的对称元素,因为I 3=,I 6= 。 4002 判断:既不存在C n 轴,又不存在σh 时,S n 轴必不存在。---------------------------- ( ) 4003 判断:在任何情况下,2 ?n S =E ? 。---------------------------- ( ) 4004 判断:分子的对称元素仅7种,即σ ,i 及轴次为1,2,3,4,6的旋转轴和反轴。---------------------------- ( ) 4005 下面说法正确的是:---------------------------- ( ) (A) 分子中各类对称元素的完全集合构成分子的对称群 (B) 同一种分子必然同属于一个点群,不同种分子必然属于不同的点群 (C) 分子中有 S n 轴,则此分子必然同时存在 C n 轴和σh 面 (D) 镜面σd 一定也是镜面σv 4006 下面说法正确的是:---------------------------- ( ) (A) 如构成分子的各类原子均是成双出现的,则此分子必有对称中心 (B) 分子中若有C 4,又有i ,则必有σ (C) 凡是平面型分子必然属于C s 群 (D) 在任何情况下,2 ?n S =E ? 4008 对称元素C 2与σh 组合,得到___________________;C n 次轴与垂直它的C 2组合,得到______________。 4009 如果图形中有对称元素S 6,那么该图形中必然包含:---------------------------- ( ) (A) C 6, σh (B) C 3, σh (C) C 3,i (D) C 6,i 一选择题 1、电子自旋是电子( c ) A 、具有一种类似地球自转的运动 B 、具有一种非轨道的运动 C 、具有一种空间轨道外的顺逆时针的自转 D 、具有一种空间轨道中的顺逆时针的自转 2、下列分子中哪些不存在大π键( a ) A. CH 2=CH-CH 2-CH=CH 2 B. CH 2=C=O C. CO(NH 2)2 D.C 6H 5CH=CHC 6H 5 3、某原子的电子组态为1s 22s 22p 63s 14d 1,其基谱项为( a ) A 3D B 1D C 3S D 1S 4、已知类氢波函数ψ2px 的各种图形,推测ψ3px 图形,下列结论不正确的是( b ): A 、角度部分图形相同 B 、电子云相同 C 、径向分布不同 D 、界面图不同 5、单个电子的自旋角动量在z 轴方向上的分量是:( d ) :12/2 :6/2 C: 6/4 D:/4A h B h h h ππππ±±±± 6、 具有的π 键类型为:( a ) A 、109π B 、108π C 、99π D 、11 9π 7、 下列光谱项不属于p 1d 1组态的是( c )。 A. 1P B . 1D C. 1S D. 3F 8、对氢原子和类氢离子的量子数l ,下列叙述不正确的是( b )。 A l 的取值规定m 的取值范围 B 它的取值与体系能量大小有关 C 它的最大可能取值由解方程决定 D 它的取值决定了|M| = )1(+l l 9、通过变分法计算得到的微观体系的能量总是( c )。 A 等于真实体系基态能量 B 大于真实体系基态能量 C 不小于真实体系基态能量 D 小于真实体系基态能量 10、已知类氢波函数Ψ2px 的各种图形,推测Ψ3px 图形,下列说法错误的是( b ) A 角度部分的图形相同 B 电子云图相同 C 径向分布函数图不同 D 界面图不同 11、对氢原子Φ方程求解,下列叙述有错的是( c ). A. 可得复函数解Φ=ΦΦim m Ae )(. B. 由Φ方程复函数解进行线性组合,可得到实函数解. C. 根据Φm (Φ)函数的单值性,可确定|m |=0,1,2,……l 选择题 ( 附答案 ) 2. 1 分 x d d 和 i x d d 哪个是自轭算符----------------------------------- ( ) 3. 1 分 测不准关系式是判别经典力学是否适用的标准,对吗?---------------( ) 4. 2 分 1927年戴维逊和革未的电子衍射实验证明了实物粒子也具有波动性。欲使电子射线产 生的衍射环纹与Cu 的K α线(波长为154 pm 的单色X 射线)产生的衍射环纹相同, 电 子的能量应为___________________J 。 5. 1 分 若)(r R nl 已归一化,则1)()(=?dr r r R R nl nl ,是否正确---------------- ( ) 6. 2 分 H 2+的H ?= 21?2- a r 1 - b r 1 +R 1, 此种形式已采用了下列哪几种方法: ------------------------------ ( ) (A) 波恩-奥本海默近似 (B) 单电子近似 (C) 原子单位制 (D) 中心力场近似 7. 2 分 对于"分子轨道"的定义,下列叙述中正确的是:----------------- ( ) (A) 分子中电子在空间运动的波函数 (B) 分子中单个电子空间运动的波函数 (C) 分子中单电子完全波函数(包括空间运动和自旋运动) (D) 原子轨道线性组合成的新轨道 8. 2 分 已知 ψ= Y R ? = ΦΘ??R , 其中Y R ,,,ΦΘ皆已归一化, 则下列式中 哪些成立?----------------------------------------------------( ) (A)? ∞=021d r ψ (B)?∞ =021d r R (C)? ?∞=0π2021d d φθY (D)? =π021d sin θθΘ 9. 2 分 作图示出刚性转子转动能级排布。 10. 1 分 X-射线的产生是由于:------------------------------------ ( ) 1.简要说明原子轨道量子数及它们的取值范围? 解:原子轨道有主量子数 n ,角量子数I ,磁量子数m 与自旋量子数s ,对类氢原子(单电子原子)来 间相互作用。角量子数|决定轨道角动量大小,磁量子数 m 表示角动量在磁场方向(z 方向)分量的大小, 自旋量子数s 则表示轨道自旋角动量大小。 n — 1 ; m= 0、土 1、土 2、……± I ; s 取值只有 1 2 2.在直角坐标系下,Li 2+的Schr?dinger 方程为 角动量Z 分量的平均值为多少? 13=1, m i =-1; 2 h 2 h 2 h C 1 ■. I1 I 1 1 ——C 2 . I 2 I 2 1 ——C 3 . I 3 I 3 1 o 2 2 2 C ; V '1 1 1 — c | <1 1 1 ~ c ; J 11 1 — 2 2 2 2 说,原子轨道能级只与主量子数 n 相关En R 。 n 对多电子原子,能级除了与 n 相关,还要考虑电子 n 取值为1、2> 3 0、1、2、 解:由于Li 2+属于单电子原子,在采取“B -O' 近似假定后,体系的动能只包括电子的动能,则体系 h 2 的动能算符:T? -^― 8 2m 2 ;体系的势能算符: 3e 2 4 0r 故 Li 的 Schr?d inger 方程为: h 2 式中: 2 2、 1/2 z ) 3.对氢原子, x 2 y 2 z 2 C 1 210 C 2 211 C 3 31 1 ,其中 211 和 31 1都是归一化 的。那么波函数所描述状态的(1) 能量平均值为多少?( 2)角动量出现在 ,2h 2的概率是多少?, 解:由波函数 C 1 210 C 2 211 C 3 31 1 得:m=2, 11=1, m n =0; n 2=2, I 2=1, m ?=1; n 3=3, (1) 由于 210 , 211 禾口 31 1都是归一化的,且单电子原子 2 136务(eV) n C 1 E 1 C 2 E 2 C 3 E 3 2 C 1 13.6 送 13?6+eV c2 13?6 13.6 2 4 C1 c f eV ⑵ 由于| M | 第二章 一选择题 1、电子自旋是电子( c ) A 、具有一种类似地球自转的运动 B 、具有一种非轨道的运动 C 、具有一种空间轨道外的顺逆时针的自转 D 、具有一种空间轨道中的顺逆时针的自转 2、下列分子中哪些不存在大π键( a ) A. CH 2=CH-CH 2-CH=CH 2 B. CH 2=C=O C. CO(NH 2)2 D.C 6H 5CH=CHC 6H 5 3、某原子的电子组态为1s 22s 22p 63s 14d 1,其基谱项为( a ) A 3D B 1D C 3S D 1S 4、已知类氢波函数ψ2px 的各种图形,推测ψ3px 图形,下列结论不正确的是( b ): A 、角度部分图形相同 B 、电子云相同 C 、径向分布不同 D 、界面图不同 5、单个电子的自旋角动量在z 轴方向上的分量是:( d ) :12/2 :6/2 C: 6/4 D:/4A h B h h h ππππ±±±± 6、 具有的π 键类型为:( a ) A 、109π B 、108π C 、9 9π D 、119π 7、 下列光谱项不属于p 1d 1组态的是( c )。 A. 1P B . 1D C. 1S D. 3F 8、对氢原子和类氢离子的量子数l ,下列叙述不正确的是( b )。 A l 的取值规定m 的取值范围 B 它的取值与体系能量大小有关 C 它的最大可能取值由解方程决定 D 它的取值决定了|M| = )1(+l l 9、通过变分法计算得到的微观体系的能量总是( c )。 A 等于真实体系基态能量 B 大于真实体系基态能量 C 不小于真实体系基态能量 D 小于真实体系基态能量 10、已知类氢波函数Ψ2px 的各种图形,推测Ψ3px 图形,下列说法错误的是( b ) A 角度部分的图形相同 B 电子云图相同 C 径向分布函数图不同 D 界面图不同 11、对氢原子Φ方程求解,下列叙述有错的是( c ). A. 可得复函数解Φ=ΦΦim m Ae )(. B. 由Φ方程复函数解进行线性组合,可得到实函数解. C. 根据Φm (Φ)函数的单值性,可确定|m |=0,1,2,……l 结构化学习题(选编) (兰州大学化学化工学院李炳瑞) 习题类型包括:选择答案、填空、概念辨析、查错改正、填表、计算、利用结构化学原理分析问题;内容涵盖整个课程,即量子力学基础、原子结构、分子结构与化学键、晶体结构与点阵、X射线衍射、金属晶体与离子晶体结构、结构分析原理、结构数据采掘与QSAR等;难度包括容易、中等、较难、难4级;能力层次分为了解、理解、综合应用。 传统形式的习题,通常要求学生在课本所学知识范围内即可完成,而且答案是唯一的,即可以给出所谓“标准答案”。根据21世纪化学演变的要求,我们希望再给学生一些新型的题目,体现开放性、自主性、答案的多样性,即:习题不仅与课本内容有关,而且还需要查阅少量文献才能完成;完成习题更多地需要学生主动思考,而不是完全跟随教师的思路;习题并不一定有唯一的“标准答案”,而可能具有多样性,每一种答案都可能是“参考答案”。学生接触这类习题,有助于培养学习的主动性,同时认识到实际问题是复杂的,解决问题可能有多钟途径。但是,这种题目在基础课中不宜多,只要有代表性即可。 以下各章的名称与《结构化学》多媒体版相同,但习题内容并不完全相同。 第一章量子力学基础 1.1 选择题 (1) 若用电子束与中子束分别作衍射实验,得到大小相同的环纹,则说明二者 (A) 动量相同(B) 动能相 同(C) 质量相同 (2) 为了写出一个经典力学量对应的量子力学算符,若坐标算符取作 坐标本身,动量算符应是(以一维运动为例) (A) mv (B) (C) (3) 若∫|ψ|2dτ=K,利用下列哪个常数乘ψ可以使之归一化: (A) K (B) K2 (C) 1/ (4) 丁二烯等共轭分子中π电子的离域化可降低体系的能量,这与简单 的一维势阱模型是一致的,因为一维势阱中粒子的能量 (A) 反比于势阱长度平方 (B) 正比于势阱长度 (C) 正比于量子数 (5) 对于厄米算符, 下面哪种说法是对的 (A) 厄米算符中必然不包含虚数 (B) 厄米算符的本征值必定是实数 (C) 厄米算符的本征函数中必然不包含虚数 (6) 对于算符?的非本征态Ψ (A) 不可能测量其本征值g. (B) 不可能测量其平均值结构化学练习题带答案
结构化学 第二章练习题
(完整版)结构化学课后答案第二章
结构化学课后答案第二章
结构化学第一章习题
2019安徽高中化学竞赛结构化学 第二章 原子的结构和性质习题精品教育.doc
结构化学第二章原子的结构和性质习题及答案(教学材料)
结构化学-第五章习题及答案
结构化学第二章原子的结构和性质习题及答案
结构化学第二章习题-分子结构
结构化学第二章习题及答案
结构化学 第二章习题(周公度)
结构化学习题答案(3).doc
《结构化学》第二章习题
结构化学第四章习题讲解
安徽高中化学竞赛-结构化学 第二章 原子的结构和性质习题
结构化学选择题及答案
结构化学课后答案第2章习题原子的结构与性质(20200916124438)
结构化学第二章习题
结构化学李炳瑞习题