研究背景:
细胞铁死亡是一种非细胞凋亡形式的受调节细胞死亡,其广泛涉及肾脏、肝脏和大脑等多种组织的退行性疾病,是多种原发性和难治性癌症的易感因素。磷脂氢过氧化物在细胞膜中的积累是细胞铁死亡的标志和限速步骤。利用全基因组的crispr-cas9介导的抑制因子筛选,和系统脂质组学分析,揭示细胞色素P450氧化还原酶(POR)参与细胞铁死亡的机制。
研究思路:
研究结果:
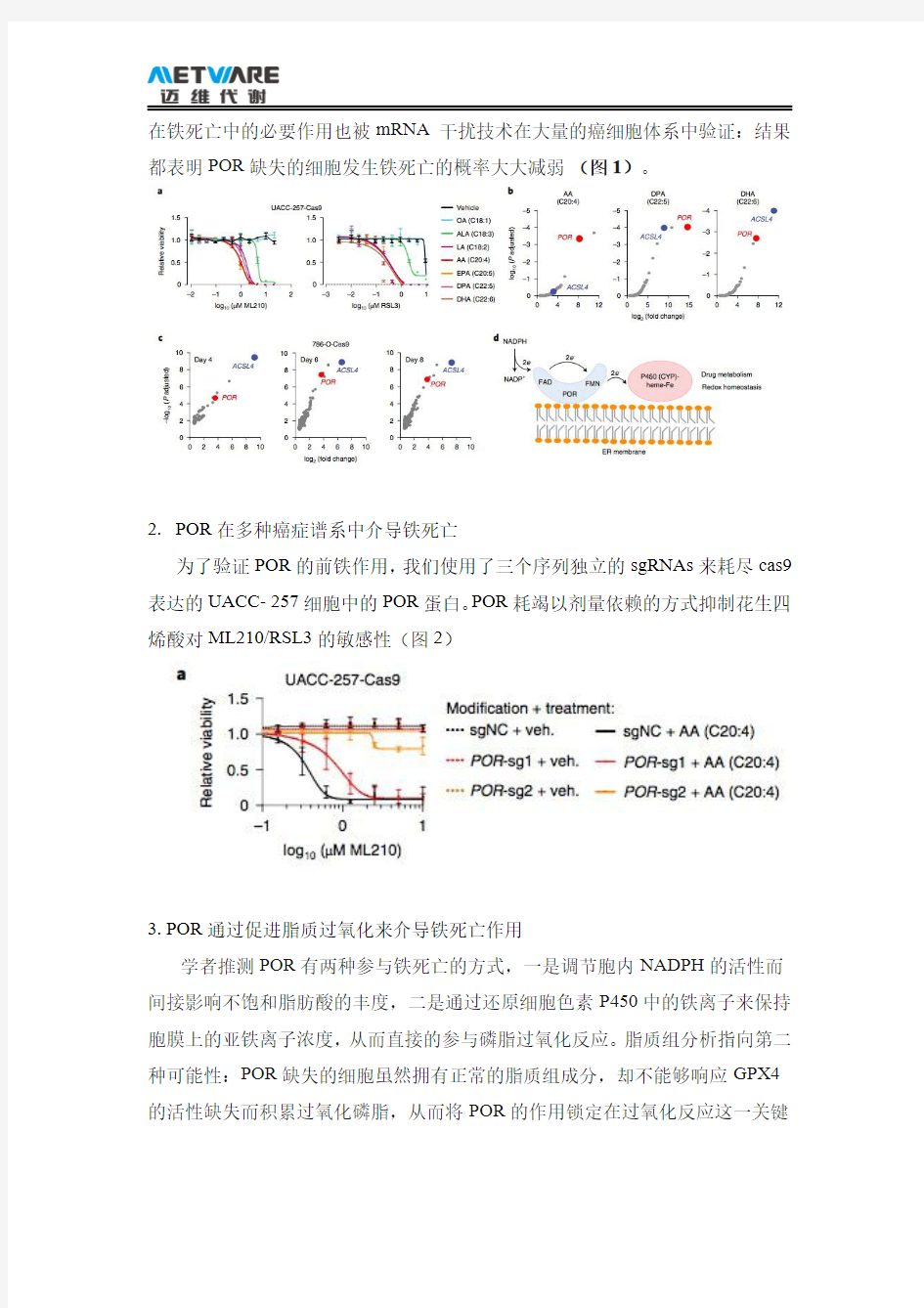
1.CRISPR筛选鉴定POR为铁死亡作用基因
利用全基因组CRISPR/Cas9的无偏筛选方式来寻找铁死亡过程中的正向促进蛋白。设计了两组互补的全基因组的CRISPR-Cas9筛选:透明细胞肾癌细胞、UACC-257黑色素瘤细胞,在所有的筛选中,POR都是处于前列的靶标。POR
在铁死亡中的必要作用也被mRNA干扰技术在大量的癌细胞体系中验证:结果都表明POR缺失的细胞发生铁死亡的概率大大减弱(图1)。
2.POR在多种癌症谱系中介导铁死亡
为了验证POR的前铁作用,我们使用了三个序列独立的sgRNAs来耗尽cas9表达的UACC-257细胞中的POR蛋白。POR耗竭以剂量依赖的方式抑制花生四烯酸对ML210/RSL3的敏感性(图2)
3.POR通过促进脂质过氧化来介导铁死亡作用
学者推测POR有两种参与铁死亡的方式,一是调节胞内NADPH的活性而间接影响不饱和脂肪酸的丰度,二是通过还原细胞色素P450中的铁离子来保持胞膜上的亚铁离子浓度,从而直接的参与磷脂过氧化反应。脂质组分析指向第二种可能性:POR缺失的细胞虽然拥有正常的脂质组成分,却不能够响应GPX4的活性缺失而积累过氧化磷脂,从而将POR的作用锁定在过氧化反应这一关键
步骤。对786-O和769-P细胞进行了氧化还原脂质组学研究。Lip-1治疗有效地抑制氧化不饱和磷脂酰乙醇胺(PUFA-PEs;图3)的积累。
研究结论:
POR是通过参与细胞内膜磷脂的过氧化修饰来促进铁死亡的执行,从而填补了铁死亡研究中仍然未知的执行蛋白这一重要空白。这项研究有可能为针对铁死亡的药物开发带来新的契机。
迈维代谢是中国代谢组领域的知名企业,专注于创新代谢组技术在生命科学研究与医学健康两大领域的应用,提供的服务包括针对各种不同类型的标本制备(包括血液、尿液、组织提取液和脊髓液等,项目类别涵盖临床研究、疾病机理、动植物研究及中药药理等多个领域。
细胞色素P450的特性及其研究进展 摘要:细胞色素P450是内质网膜上混合功能氧化酶系统的末端氧化酶,在生物体内分布广泛,主要催化机体内源和外源性物质在体内的氧化反应。在临床药物的生物学转化中,它参与大部分药物的生物氧化,因此具有重要的生物学意义。 关键词:细胞色素P450 特性机理功能 Characteristics of cytochrome P450 and its research development ABSTRACT: Being the terminal oxidase component of mixed function oxidase system in the membrane of endoplasmic reticulum, cytochrome P450 (CYP450) has been found in all living organisms and can catalyze the oxidation of a variety of endogenous and xenobiotic compounds. This article reviewed the mechanistic explorations on CYP450- catalyzed reactions , especially the recent investigations on the mechanism of ethanol oxidation catalyzed by CYP450, as well as those in CYP450 drug metabolism. Keywords cytochrome P450;structure; catalytic mechanism; function 前言 细胞色素P450是一组结构和功能相关的超家族基因编码的含铁血红素同工酶,主要存在于肝细胞平滑肌内质网内,由血红素蛋白、
循环伏安法判断铁氰化钾K3Fe(CN)6的电极反应过程 一、实验目的 1. 掌握用循环伏安法判断电极反应过程的可逆性 2. 学会使用伏安极谱仪 3. 学会测量峰电流和峰电位 二、实验原理 循环伏安法是用途最广泛的研究电活性物质的电化学分析方法,在电化学、无机化学、有机化学、生物化学等领域得到了广泛的应用。由于它能在很宽的电位范围内迅速观察研究对象的氧化还原行为,因此电化学研究中常常首先进行的是循环伏安行为研究。 循环伏安是在工作电极上施加一个线性变化的循环电压,记录工作电极上得到的电流与施加电压的关系曲线,对溶液中的电活性物质进行分析。由于施加的电压为三角波,这种方法也称为三角波线性扫描极谱法。 典型的循环伏安图如图所示: 选择施加在a点的起始电位E i,然后沿负的电位即正向扫描,当电位负到能够将Ox还原时,在工作电极上发生还原反应:Ox + Ze = Red,阴极电流迅速
增加(b-d),电流在d点达到最高峰,此后由于电极附近溶液中的Ox转变为Red而耗尽,电流迅速衰减(d-e);在f点电压沿正的方向扫描,当电位正到能够将Red氧化时,在工作电极表面聚集的Red将发生氧化反应:Red = Ox + Ze,阳极电流迅速增加(i-j),电流在j点达到最高峰,此后由于电极附近溶液中的Red转变为Ox而耗尽,电流迅速衰减(j-k);当电压达到a点的起始电位E i时便完成了一个循环。 循环伏安图的几个重要参数为:阳极峰电流(i pa)、阴极峰电流(i pc)、阳极峰电位(E pa)、阴极峰电位(E pc)。对于可逆反应,阴阳极峰电位的差值,即△E=E pa-E pc ≈56 mV/Z,峰电位与扫描速度无关。 而峰电流i p=2.69×105n3/2AD1/2V1/2C,i p为峰电流(A),n为电子转移数,A 为电极面积(cm2),D为扩散系数(cm2/s),V为扫描速度(V/s),C为浓度(mol/L)。由此可见,i p与V1/2和C都是直线关系。对于可逆的电极反应,i pa ≈ i pc。 三、仪器和试剂 1. CHI832B 电化学分析仪,三电极系统(金盘电极为工作电极、饱和甘汞电极为参比电极、铂丝电极为辅助电极) 2. 铁氰化钾标准溶液(5.0×10-3 mol/L,含H2SO4溶液0.5 mol/L),10 mL电解杯,10 mL容量瓶 四、实验步骤 1. 打开仪器预热20分钟,打开电脑,打开CHI832B电化学分析仪操作界面。 2. 电极抛光:用AI2O3粉将金盘电极表面抛光,然后用蒸馏水清洗,待用。 3. 将铁氰化钾标准溶液转移至10 mL电解池中,插入三支电极,在“实验”菜单中选择“实验方法”,选择“Cyclic V oltammetry”,点“确定”,设置实验参数:起始电位(+0.6 V);终止电位(-0.2 V);静止时间(2 s);扫描时间(任意扫速);扫描速度(0.1 V/s);灵敏度(1.0×e-5);循环次数(2);点“确定”。从“实验”菜单中选择“开始实验”,观察循环伏安图,记录峰电流和峰电位。 4. 考察峰电流与扫描速度的关系,使用上述溶液,分别以不同的扫描速度:0.1、0.2、0.5 V/s(其他实验条件同上)分别记录从+0.6V~ -0.2V扫描的循环伏安图,记录峰电流。 5. 考察峰电流与浓度的关系,分别准确移取上述溶液1.00、2.00、5.00 mL,置
细胞色素P450 [摘要]:简要介绍了生物细胞色素P450分布的多样性、P450的功能、P450在不同领域的研究现状与进展。鉴于P450的研究无论在理论上探索生物的生理代谢、选择进化和生物与环境的关系方面,或在环境保护、农业生态、生物防治、作物基因工程和医药卫生等应用方面,都有广泛的实践意义,因此,应该受到更大的关注和重视。 [关键词]:细胞色素P450;生物;生理代谢;环境保护 通过体内的解毒酶来催化完成的代谢解毒作用是生物主要而常见的一种适应机制。解毒酶的种类很多,其中单加氧酶的作用最为重要。1954年发现兔肝微粒体对苯异丙胺有脱氨作用。随后人们注意到肝微粒体是多种外源化合物(如药物、毒物及类固醇)的氧化代谢发生部位。并且这些氧化代谢中普遍需要分子氧和NADPH,其共同特点是在作用物分子中加入一个氧原子,因此这些酶可称为单加氧酶或羟化酶和多功能氧化酶。 单加氧酶是一种多酶复合体。一般认为它由细胞色素P450、细胞色素b5、黄素蛋白—NADPH—P450还原酶、黄素蛋白—NADH—细胞色素b5还原酶和磷酯组成,它们共同组成电子传递体系。P450为整个酶系中的末端氧化酶,它不仅负责活化氧分子,同时负责与底物结合,并决定酶系底物的专一性,在整个酶系功能中起着关键的作用。 P450是1958年被发现的,它是一类以还原态与CO结合后在波长450nm处有吸收峰的含血红素的单链蛋白质。近年来,每年发表的有关P450的文章已超过2000篇。研究证实,动物、植物、微生物体内均存在P450,它们以氧活化成分参与各种各样的代谢反应,能代谢包括脂肪酸、甾类化合物、脂肪烃、芳香烃、杀虫剂和除草剂、药物、致癌物等多种化合物,由于该方面的研究涉及到生物化学、临床药物学、环境科学、健康科学、分子生物学等多个领域,因此成为生物技术领域中研究热点。 1 P450分布的多样性 1.1动物体内P450的分布 P450首先在哺乳动物的肝脏微粒体中发现。在同一动物的许多不同组织中都存在P450。哺乳动物的肝脏是P450含量最丰富的器官,它还主要分布在肺、皮肤、消化道、肾、肾上腺皮质和髓质、睾丸、卵巢、主动脉和血小板等部分。P450虽然在许多组织或器官中存在,但其分布具有一定的选择性。耿益民等人对大鼠的心肌组织与肝脏组织的P450含量进行测定,结果证明肝脏组织中的P450明显高于心肌组织[1]。 昆虫中存在P450的报道见于20世纪60年代。1967年,Ray首先在家蝇中确定P450的存在。相继在烟草天蛾中也发现了P450。目前证明,P450在蝗虫、按蚊、蜚蠊、北美黑尾风蝶等几十种昆虫中都有分布。昆虫的许多器官和组织,如中肠、脂肪体、马氏管甚至头壳中都有P450。家蝇的腹部微粒体中P450的含量最高。吴益东等人研究表明,棉铃虫六龄幼虫的不同组织中P450分布有明显差异,在中肠中含量最高,脂肪体中次之,体壁中最低[2]。 在其它动物中,研究较多的是淡水鱼类、海洋鱼类和贝壳类。Cristine Nasci等研究了P450在海洋鱼类中的分布。Briubo证明,鱼类的P450主要分布于肺、肾和鳃。而赤鲷鱼心肌中的P450含量明显低于肝脏。
货号:MS1110 规格:100管/96样 硫氧还蛋白氧化还原酶 (thioredoxin reductase,TrxR)试剂盒说明书 微量法 注意:正式测定之前选择2-3个预期差异大的样本做预测定。 测定意义: TrxR是一种NADPH依赖的包含FAD结构域的二聚体硒酶,属于吡啶核苷酸-二硫化物氧化还原酶家族成员,与硫氧还蛋白以及 NADPH 共同构成了硫氧还蛋白系统。TrxR与GR活性类似,催化GSSG还原生成GSH,是谷胱甘肽氧化还原循环关键酶之一。 测定原理: TrxR催化NADPH还原DTNB生成TNB和NADP+,TNB在412nm有特征吸收峰,通过测定412nm波长处TNB的增加速率,即可计算TrxR活性。 自备仪器和用品: 低温离心机、可调节移液器、可见分光光度计/酶标仪、微量玻璃比色皿/96孔板、和蒸馏水。 试剂组成和配制: 试剂一:液体×1 瓶,4℃保存。 试剂二:粉剂×1 瓶,4℃避光保存。临用前加入 2mL 蒸馏水溶解。 试剂三:粉剂×1 管,4℃保存。临用前加入 2mL 蒸馏水溶解。 粗酶液提取: 1. 组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g 组织,加 入1mL试剂一)进行冰浴匀浆。8000g,4℃离心10min,取上清置冰上待测。 2. 细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500 万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min); 然后8000g,4℃,离心10min,取上清置于冰上待测。 3. 血清等液体:直接测定。 TrxR 测定操作: 1. 分光光度计/酶标仪预热30min,调节波长到412nm,用蒸馏水调零。 2. 试剂一在25℃(一般物种)或者37℃(哺乳动物)预热30min。 3. 空白管:取微量玻璃比色皿或96孔板,加入20μL试剂二,20μL试剂三,160μL试剂一, 迅速混匀后于412nm 测定10s和310s吸光度,记为A1和A2。△A空白管=A2-A1。 4. 测定管:取微量玻璃比色皿或96孔板,加入20μL试剂二,20μL试剂三,140μL试剂一, 20μL上清液,迅速混匀后于412nm测定10s和310s吸光度,记为A3和A4。△A 测定管=A4-A3。注意:空白管只需测定一次。 TrxR 活性计算公式: (1). 按蛋白浓度计算 活性单位定义:在25℃或者37℃中,每毫克蛋白每分钟催化1nmol DTNB还原为1个酶活单位。 TrxR(nmol/min/mg prot)=(△A测定管-△A空白管)÷ε÷d×V反总÷(Cpr×V样)÷T = 147×(△A 测定管-△A 空白管)÷Cpr 第1页,共2页
实验五铁氰化钾循环伏安法有关性质的测定 一. 实验目的 掌握循环伏安法(CV)基本操作;了解可逆电化学过程及条件电极电位的测定;获得峰电流随电位扫描速度的变化曲线,获得峰电流随溶液浓度的变化函数关系;并学会电化学工作站仪器的使用。 二. 循环伏安法原理 电化学中随着氧化还原反应的进行,会导致电流和电位的变化。其中根据公式峰电流与电位扫描速度的1/2次方、溶液浓度成正比。对于循环伏安法,扫描图像中前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。 三. 实验仪器和药品 铁氰化钾溶液、氯化钾溶液、铝粉、四个25ml容量瓶、电化学工作站,银电极,铂碳电极,银丝电极 四. 实验步骤 打开电脑并将仪器预热20分钟,打开电化学工作站操作界面。将铁氰化钾标准 的循环伏安曲线,看电位差的大小;超过100mv则用粗细的铝粉抛光铂碳电极,使得电位差在70--80以下;确定各参量:起始电位在0.5V左右,扫速为10、20、40、80、160mv/s,灵敏度为10-5--10-6,以标准铁氰化钾溶液测定不同扫速下的伏安曲线,测定并保存;配制4组不同浓度的铁氰化钾溶液:0.1、0.2、0.5、1.0ml 的铁氰化钾标准溶液于容量瓶中,在加入5ml氯化钾溶液,定容;控制参量:扫速为80,每个浓度6段三次扫描,依次对四组溶液测定伏安曲线,导出实验数据和曲线。 五.数据处理 实验参数设定:打磨后电位差为81mv左右,比较合理。 亚铁氰化钾溶液的条件电极电位:
研究背景: 细胞铁死亡是一种非细胞凋亡形式的受调节细胞死亡,其广泛涉及肾脏、肝脏和大脑等多种组织的退行性疾病,是多种原发性和难治性癌症的易感因素。磷脂氢过氧化物在细胞膜中的积累是细胞铁死亡的标志和限速步骤。利用全基因组的crispr-cas9介导的抑制因子筛选,和系统脂质组学分析,揭示细胞色素P450氧化还原酶(POR)参与细胞铁死亡的机制。 研究思路: 研究结果: 1.CRISPR筛选鉴定POR为铁死亡作用基因 利用全基因组CRISPR/Cas9的无偏筛选方式来寻找铁死亡过程中的正向促进蛋白。设计了两组互补的全基因组的CRISPR-Cas9筛选:透明细胞肾癌细胞、UACC-257黑色素瘤细胞,在所有的筛选中,POR都是处于前列的靶标。POR
在铁死亡中的必要作用也被mRNA干扰技术在大量的癌细胞体系中验证:结果都表明POR缺失的细胞发生铁死亡的概率大大减弱(图1)。 2.POR在多种癌症谱系中介导铁死亡 为了验证POR的前铁作用,我们使用了三个序列独立的sgRNAs来耗尽cas9表达的UACC-257细胞中的POR蛋白。POR耗竭以剂量依赖的方式抑制花生四烯酸对ML210/RSL3的敏感性(图2) 3.POR通过促进脂质过氧化来介导铁死亡作用 学者推测POR有两种参与铁死亡的方式,一是调节胞内NADPH的活性而间接影响不饱和脂肪酸的丰度,二是通过还原细胞色素P450中的铁离子来保持胞膜上的亚铁离子浓度,从而直接的参与磷脂过氧化反应。脂质组分析指向第二种可能性:POR缺失的细胞虽然拥有正常的脂质组成分,却不能够响应GPX4的活性缺失而积累过氧化磷脂,从而将POR的作用锁定在过氧化反应这一关键
1.1细胞色素P450研究进展 1.1.1细胞色素P450 细胞色素P450(cytochrome P450或CYP,简称P450)是一个古老的以血红素为辅基的B族细胞色素蛋白酶基因超家族,广泛存在于细菌、真菌、植物以及动物等各种生物体内[1],通常与质体、线粒体、内质网、高尔基体等细胞器膜结合。还原态P450与CO结合后在450nm处能检测到最大吸收峰,故命名为P450。因其能使疏水性分子插入一个氧原子而变得更具有亲水性或者活性,因此又称之为单加氧酶(mixed-function oxidase,简称MFO)[2]。P450酶系作为自然界中生物催化剂,它所催化的反应类型多样,最典型的反应是把分子氧还原为水的同时,将其中一个氧原子转移至底物形成产物,催化反应为[3]: RH+O2+NADPH+H+ROH+H2O+NADP+ 1958年,在大鼠肝微粒体中第一次发现P450。D.S Frear于1969年首次在棉花(Gossypium hirsutum L.)中发现了它的存在[4]。此后,大量的研究表明在拟南芥(Arabidopsis thaliana L.)[5]、小麦(Triticum aestivum L.)[6]、苜蓿(Medicago sativa L.)[7]、蓖麻(Ricinus communis L.)[8]等许多植物中也均有P450存在。P450酶系在植物中参与多种代谢反应,发挥重要的催化作用。 [1]Omura T(1999).Forty years of cytochrome P450.Biochem Biophys Res Commun,266(3):690~698. [2]Nelson D R,Kaymans L,Kamataki T,et al.P450superfamily:update
货号:QS1111 规格:50管/48样 谷胱甘肽还原酶(glutathione reductase, GR)活性测定试剂盒说明书 紫外分光光度法 注意:正式测定之前选择2-3个预期差异大的样本做预测定。 测定意义: GR是广泛存在于真核和原核生物中的一种黄素蛋白氧化还原酶,是谷胱甘肽氧化还原循环的关键酶之一(通常昆虫中GR被TrxR取代)。GR催化NADPH还原GSSG生成GSH,有助于维持体内GSH/GSSG比值。GR在氧化胁迫反应中对活性氧清除起关键作用,此外GR还参与抗坏血酸-谷胱甘肽循环途径。 测定原理: GR能催化NADPH还原GSSG再生GSH,同时NADPH脱氢生成NADP+;NADPH在340 nm有特征吸收峰,相反NADP+在该波长无吸收峰;通过测定340 nm吸光度下降速率来测定NADPH脱氢速率,从而计算GR活性。 自备实验用品及仪器: 紫外分光光度计、低温离心机、水浴锅、移液器、1mL石英比色皿和蒸馏水 试剂组成和配置: 试剂一:液体×1瓶,4℃保存。 试剂二:粉剂×1瓶,4℃保存。临用前加入5.0 mL蒸馏水,混匀。 试剂三:液体×1支,4℃保存。 粗酶液提取: 1.组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加 入1mL试剂一)进行冰浴匀浆。8000g,4℃离心15min,取上清,置冰上待测。 2.细菌、真菌:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500 万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后8000g,4℃,离心15min,取上清置于冰上待测。 3.血清等液体:直接测定。 操作步骤: 1. 分光光度计预热30 min,调节波长到340 nm,蒸馏水调零。 2. 试剂一置于25℃(普通物质)或者37℃(哺乳动物)中预热30min。 3. 空白管:取1mL石英比色皿,加入850μL试剂一,100μL试剂二,50μL试剂三,充分混匀,于340nm 处测定10 s和190 s吸光度,记为A空1和A空2,△A空白管= A空1﹣A空2。 4. 测定管:取1mL石英比色皿,加入750μL试剂一,100μL试剂二,100μL上清液,50μL 试剂三,充分混匀,于340nm测定10 s和190 s吸光度,记为A测1和A测2,△A测定管= A 测1﹣A测2。 注意:空白管只需要测定一次。 计算公式: 第1页,共2页
5.1 线性扫描循环伏安法——铁氰化钾溶液的氧化还原曲线 5.1.1 实验原理 铁氰化钾体系( Fe(CN)63-/4-)在中性水溶液中的电化学行为是一个可逆过程,其氧化峰和还原峰对称,两峰的电流值相等,峰峰电位差理论值为59mV体系本身很稳定,通常用于检测电极体系 和仪器系统。 5.1.2 仪器 可选用的仪器有:RST1000 RST2000 RST3000或RST5000系列电化学工作站。 5.1.3 电极与试剂 工作电极:铂圆盘电极、金圆盘电极或玻碳圆盘电极,任选一种。参比电极:饱和甘汞电极。 辅助电极:也称对电极,可选用铂片电极或铂丝电极,电极面积应大于工作电极的5倍。 -2 试剂A:电活性物质,1.00 X 10 mol/LK 3Fe(CN)6水溶液,用于配置各种浓度的实验溶液。试剂B:支持电解质,2.0mol/L KNO 3水溶液,用于提升溶液的电导率。 5.1.4 溶液的配置 在5个50mL容量瓶中,依次加入KNO溶液和K s Fe(CN)6溶液,使稀释至刻度后KNO浓度均为 -4 -4 -4 0.2mol/L,而K3Fe(CN)6浓度依次为1.00 X10 mol/L、2.00 X 10 mol/L、5.00 X 10 mol/L、8.0 X 10-4 mol/L、1.00 X 10-3 mol/L,用蒸馏水定容。 5.1.5 工作电极的预处理 用抛光粉(Al 2O3, 200?300目)将电极表面磨光,然后在抛光机上抛成镜面。最后分别在1:1乙醇、1:1HNO和蒸馏水中超声波清洗。
5.1.6 测量系统搭建 在电解池中放入电活性物质 5.00 x 10-4mol/L铁氰化钾及支持电解质0.20mol/L 硝酸钾溶液。插入工作电极、参比电极、辅助电极。将仪器的电极电缆连接到三支电极上,电缆标识如下: 辅助电极--- 参比电极---- 红色;- 黄色;- 红色; 为防止溶液中的氧气干扰,可通Na除O。 5.1.7 运行线性扫描循环伏安法 溶液: 5.00 x 10-4mol/L 铁氰化钾、0.20mol/L 硝酸钾。 运行RST电化学工作站软件,选择“线性扫描循环伏安法”。 参数设定如下: 静置时间(S):10 起始电位(V):-0.2 终止电位(V) :0.6 扫描速率(V/S) :0.05 采样间隔(V) :0.001 启动运行,记录循环伏安曲线,观察峰电位和峰电流,判断电极活性。如果峰峰电位差过大,则需重新处理工作电极。 量程依电极面积及扫速不同而异。以扫描曲线不溢出、能占到坐标系Y方向的1/3以上为宜。选择合适的量程,有助于减小量化噪声,提高信噪比。 5.1.8 不同扫描速率的实验 溶液: 5.00 x 10-4mol/L 铁氰化钾、0.20mol/L 硝酸钾。 参数设定如下: 静置时间(S):10 起始电位(V):-0.2 终止电位(V) :0.6 采样间隔(V) :0.001 分别设定下列扫描速率进行实验: (1 )扫描速率(V/S) :0.05 (2)扫描速率(V/S) :0.1 (3)扫描速率(V/S) :0.2 (4)扫描速率(V/S) :0.3 (5)扫描速率(V/S) :0.5 实验运行:分别将以上5次实验得到的曲线以不同的文件名存入磁盘。利用曲线叠加功能,可将以上5 条曲线叠加在同一个坐标系画面中。
细胞色素P450分子生物学研究进展 饶勇曾振灵 (广东省兽药研制与安全性评价重点实验室,华南农业大学兽医药理研究室,广州,510640) 细胞色素P450 (cytochrome P450, CYP)是人、哺乳动物及一些昆虫体内参与各类药物、毒物及其它外来化合物代谢含血色素的酶系,具单加氧氧化特性,是微粒体混合功能氧化酶系的末端氧化酶,起着与底物结合以及从NADPH传递电子到NADPH- cytochrome P450还原酶的重要作用[1, 2]。随着分子生物学技术的发展,80年代以来,CYP新基因不断被克隆,其结构与表达调控,转基因细胞系以及单克隆抗体等研究进展迅速。 1 CYP基因的分离与鉴定 细胞色素P450是一个由结构和功能相关的基因超家族(superfamily)编码的同工酶所组成的超家族酶系,由多个基因家族(family)组成,每个基因家族又包含若干个基因亚族(subfamily)。根据Nebert的分类命名系统,CYP基因全序列同源部分<36%为家族标准,40%-65%为亚族界限,>97%则可以认为是等位变异基因[3,4]。现在已经发现,人类P450有16个基因家族31个亚家族[5],哺乳动物有12个家族22个亚家族[6],昆虫也已发现8个家族20个亚家族[7]。已在原核生物、植物及动物体内至少发现300余种P450同工酶[8]。 1985年Jaiswal等[9]第一次获得CYP1A1的cDNA克隆,经二恶英诱导,测定了人的CYP1A1完全的DNA和氨基酸顺序。Feyereisen等[10]获得第一个昆虫P450基因,被命名为CYP6A1。CYP6A1具有1629个核苷酸,其开放阅读框架为1530 bp,编码509个氨基酸的P450蛋白(Mr=56 738)。其氨基酸序列与哺乳动物CYP3家族只有27%的同源部分,表明昆虫存在一个独立的P450基因家族。Yamano等[11]利用大鼠2B1cDNA为探针从人肝脏的λgt11文库中克隆出了h2B1 cDNA。H2B1蛋白质含491个氨基酸残基,分子量56286,与鼠2B1蛋白有76%氨基酸序列相同,具有7-乙氧香豆素脱乙基活性。同时还克隆了h2B2cDNA 和h2B3cDNA。h2B2cDNA与h2B1cDNA 相比,在5'-端外显子4有一个明显的改变:缺失了29 bp而同时插入了44 bp的非同源DNA,此改变常发生在外显子3和4的结合处。h2B3cDNA和h2B1cDNA相比,其核苷酸和氨基酸的同源性分别为95%和93%。用体细胞杂交迹印方法确定人的CYP2B基因位于19号染色体上。1990年Yamano等[12]还克隆了CYP2A3,CYP2A3v,CYP2A4的cDNA,测序结果为在CYP2A3和CYP2A3v 间只有1个氨基酸不同,Leu160→His,是由于T488→A而引起的,另外两处核苷酸的变化是G60→A,G1645→C,属于无意义突变,说明CYP2A3v为CYP2A3的等位基因变化型。CYP2A4与CYP2A3和CYP2SA3v相比,氨基酸序列有94%相同。1990年Matsunaga等[13]测定了CYP2A1和CYP2A2,CYP2A1基因全长12835 bp,CYP2A2较CYP2A1长10 kbp,除位于第2号位长1.5 kbp和位于第5号位长12 kbp的内含子未测序外,CYP2A2 基因的序列都被测出。CYP2A1和CYP2A2都含有9个外显子,有93%的核苷酸序列相同。转录起点为CYP2A1上游的4544 bp及CYP2A2上游的5 529 bp处,两者都含典型的TATA箱但没有CCAAT箱。 在国内,董海涛等[14]采用RT-PCR技术特异性地扩增CYP1A1cDNA,为1.5 kbp大小,将此片段克隆至质粒pGEM-3Z并进行部分序列分析。结果显示克隆片段包含CYP1A1 DNA 5’端和3’端部分编码区及完整的编码区。吴健敏等[15]测得CYP2B6的3’端190 bp序列,与Yamano等[11]报道的序列相同。1995年Wang等[16]根据已知昆虫P450和哺乳动物CYP3在血红素结合位点附近的一段保守氨基酸序列设计探针,筛选棉铃虫(Heliothis zea)cDNA文库,获得了CYP6B2 cDNA。其编码504个氨基酸残基的P450
铁氰化钾在玻碳电极上的氧化还原 一、实验目的。 (1)掌握循环伏安扫描法。 (2)学习测量峰电流和峰电位的方法。 (3)掌握受扩散控制电化学过程的判别方法。 二、实验原理 循环伏安法也是在电极上快速施加线性扫描电压,起始电压从Ei开始,沿某一方向变化,当达到某设定的终止电压Em后,再反向回扫至某设定的起始电压,形成一个三角波,电压扫描速率可以从每秒数毫伏到1V。 当溶液中存在氧化态物质Ox时,它在电极上可逆地还原生成还原态物质,即 Ox + ne → Red 反向回扫时,在电极表面生成的还原态Red则可逆地氧化成Ox,即 Red → Ox + ne 由此可得循环伏安法极化曲线。 在一定的溶液组成和实验条件下,峰电流与被测物质的浓度成正比。 从循环伏安法图中可以确定氧化峰峰电流Ipa、还原峰峰电流Ipc、氧化峰峰电位φpa和还原峰峰电位φpc。 对于可逆体系,氧化峰峰电流与还原峰峰电流比为 Ipa/Ipc =1 25℃时,氧化峰峰电位与还原峰峰电位差为 △φ=φpa- φpc≈58/n (mV) 条件电位为 φ。′=(φpa+ φpc)/2 由这些数值可判断一个电极过程的可逆性。 三、仪器与试剂 仪器 1,电化学分析仪;
的惰性电极,具有导电性好,硬度高,光洁度高,氢过电位高,极化范围宽,化学性稳定,可作为惰性电极直接用于 阳极溶出,阴极和变价离子的伏安测定,还可以作化学修饰电极)、Ag/AgCl电极、铂电极 3. 铁氰化钾标准溶液(50mM) 4.氯化钾溶液(0.5M) 四、实验步骤 1.溶液的配置 1)铁氰化钾标准溶液(50mmol/L)50mL容量瓶中。 2)配置1、2、5、10mM 一系列浓度的溶液。(分别移取0.5,1.0,2 .5,5.0mL 的铁氰化钾标准溶液于25mL的容量瓶中加入5mL的KCl溶液,用蒸馏水稀释至刻度,摇匀备用。) 2.体系换成浓度工作电极的预处理 用Al2O3粉末在湿的抛光布上抛光玻碳电极表面,在用蒸馏水冲洗干净. 3.调试 (1)打开仪器,电脑,准备好玻璃电极,Ag/AgCl电极,和铂电极并清洗干净。(2)双击桌面上的VaLab图标 4. 选择实验方法:循环伏安法 设置参数: 低电位: -100mv ; 高电位:800 mv 初始电位:-100mv; 扫描速度:50mv/s; 取样间隔: 2mv;静止时间:1S; 扫描次数:1; 5. 开始扫描:点击绿色的“三角形”。 6.将上述体系改变扫描速度分别为10mv/s、20mv/s、40mv/s、80mv/s、160mv/s,其他条件不变,作不同速度下的铁氰化钾溶液的循环伏安曲线 7.在同一扫速下扫不同浓度的铁氰化钾溶液的循环伏安曲线。 五、数据记录与处理 1. 峰值电流与扫描速度的二分之一次方的曲线。 2.峰电流对不同浓度下峰电流的曲线。 六结果与讨论 1实验时为什么要保持溶液静止? 为了使液相传质过程只受扩散控制 2为什么要抛光电极的表面? 在使用任何固体电极之前都必须清洁其表面,以便清除表面上玷污或吸附杂质造成的污染。正如大多数金属材料电极表面易生成氧化层一样,碳电极表面发生氧化后,会产生各种含氧基团(如醇、酚、羧基、酮醌和酸酐等),从而使电极的重现性、稳定性变差,灵敏度下降,失去应有的选择性。实验时,将直径为3mm的玻碳电极先用金相砂纸(1#~7#)逐级抛光,再依次用1.0、0.3μm的Al2O3浆在麂皮上抛光至镜面,每次抛光后先洗去表面污物,再移入超声水浴中清洗,每次2~3min,重复三次,最后依次用1:1乙醇、1:1HNO3和蒸馏水超
细胞色素P450与药物代谢的关系 众所周知,药物的主要代谢场所是在肝脏内,药物在肝内所进行的生物转化过程,可分为两个阶段:1.氧化、还原和水解反应;2.结合作用。这两个阶段就是药物代谢通常所说的Ⅰ和Ⅱ相反应。 一、药物在肝脏内的代谢反应 Ⅰ相反应――药物通过氧化、还原和水解反应使多数药物灭活的过程,称为Ⅰ相反应。多数药物的Ⅰ相反应在肝细胞的微粒体中进行。是由一组药酶(又称混合功能氧化酶系)所催化的各种类型的氧化作用,使非极性脂溶性化合物(烃基及芳香基羟)产生带氧的极性基因(如羟基),从而增加其水溶性。 Ⅱ相反应――药物经过Ⅰ相反应后,往往要通过结合反应,分别与极性配体如葡萄糖醛酸、硫酸、甲基、乙酰基、巯基、谷胱甘肽、甘氨酸、谷酰胺等基因结合。这一过程成为Ⅱ相反应。通过结合作用,不仅遮盖了药物分子上某些功能基因,而且还可改变其理化性质,增加其水溶性,通过胆汁或尿液排出体外。 二、药酶 药物在肝脏内主要通过氧化、还原、水解和结合等反应进行代谢。在肝细胞微粒体内有1个氧化还原的酶系统,是由多种水解酶和结合酶组成。这个酶系统在生理情况下,可以促进生理活性物质的灭活和排泄,另一方面也可以促进药物代谢,所以又叫药酶。 三、细胞色素P450 细胞色素P450是药酶中的一种多功能氧化还原酶,它可以使药物的烃基及芳香基羟化,使硝基及偶氮化合物还原成氨基,因它的一氧化碳结合物的最大吸收峰在450nm处,故叫P450。药物代谢的Ⅰ相反应,主要在肝细胞的微粒体中进行,此过程系由一组混合功能氧化酶系所催化促进,其中最重要的是P450和有关的辅酶类。细胞色素P450是一种铁卟啉(红细胞血红素)蛋白,能进行氧化和还原。当外源性化学物质(药物)进入肝细胞后,在微粒体中与氧化型P450结合,形成一种复合物,经一系列反应,药物被氧化成为氧化产物。 1.细胞色素P450酶系的分类 细胞色素P450酶系也称CYP酶系实际上为同一家族的多种异构型。迄今为止,人类P450的基因已发现有27种,编码多种的P450。 1.1按基因族分类P450基本上分成至少4个基因族,又可进一步区分为不同亚族。其分类为CYP1,CYP2,CYP3和CYP4,按英语A、B、C……和阿拉伯数字1,2,3,……进一步分类。 1.2按功能分类人类的P450可分成二类。CYP1,2,3,主要代谢外源性化合物,如药物、毒物等,有交叉的底物特异性,常可被外源性物质诱导和抑制,在药物代谢过程中,其特异性差。CYP4则主要代谢内源性物质,有高度特异性,通常不能被外源性物质影响,此类P450在类固醇、脂肪酸和前列腺素代谢中起作用。 2. 人肝微粒体细胞色素P450酶的情况 参与人体药物代谢的P450酶主要有:CYP1A、CYP2C、CYP2D、CYP2E和CYP3A五大类。人肝微粒体内参与药物代谢的主要P450酶的含量,CYP3A4占52%,CYP2D6占30%。CYP3A 占成人肝中总CYP450酶的25%,临床中使用的60%药物经CYP3A代谢,CYP3A活性的高低,影响许多药物对患者的使用效果和毒性反应。 3. 细胞色素P450酶系对药物代谢的影响 由细胞色素P450酶系催化的Ⅰ相反应是药物体内代谢转化的关键性步骤,其可以影响药物的半衰期、清除率和生物利用度等许多重要的药物动力学特性。P450酶系具有的可诱导和可抑制的特性,许多化学物对P450酶可产生诱导或抑制作用,进而使某些P450酶的量和活性增加或活性明显降低,因此,一些外源性物质可影响P450酶对其底物的代谢活性,从而
铁氰化钾溶液的循环伏安法研究 1、实验目的 (1)学习固体电极表面的处理方法。 (2)掌握循环伏安仪的使用技术。 (3)了解电位扫描速率和电活性物质浓度对循环伏安图的影响。 2、实验原理 铁氰化钾离子[Fe(CN)6]3-/亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的电极反应为: 电极电位与电极表面电活性物质浓度间的关系符合Nernst方程式。 在一定扫描速率下,从起始电位(+0.8 V)负向扫描到转折电位(-0.2 V)时,工作电极表面的[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生还原电流;当反向扫描从转折电位(-0.2 V)变化到起始电位(+0.8 V)时,在工作电极表面生成的[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流。 为了使溶液相传质过程只受扩散控制,应加入支持电解质并在溶液处于静止状态下进行电解。25℃时,在0.10 mol/L KCl 溶液中K3[Fe(CN)6]的扩散系数约为6.3×10-6 cm2 s-1,标准电极反应速率常数约为5.2×10-2 cm s-1,电子转移速率大,为可逆体系。 3、仪器与试剂 天津兰力科LK9805电化学分析仪;玻碳盘电极(Φ3 mm);铂辅助电极;饱和甘汞电极;超声波清洗仪;电解池。 K3[Fe(CN)6]溶液:1.0 mmol/L(含0.10 mol/L KCl)。 KCl溶液:0.10 mol/L。 4、实验步骤 1)玻碳盘工作电极的预处理: 用Al2O3粉末(粒径0.05 μm)将电极表面抛光,然后在蒸馏水中超声波清洗,再用蒸馏水清洗,待用。
2)K3[Fe(CN)6]溶液的循环伏安图: (1)不同扫描速率下K3[Fe(CN)6]溶液的循环伏安图 取1.0 mmol/L K3[Fe(CN)6]溶液20 mL置于电解池中,放入玻璃碳圆盘电极、饱和甘汞电极及铂辅助电极(玻璃碳圆盘电极为工作电极,铂丝电极为辅助电极,饱和甘汞电极为参比电极),设置起始电位为+0.8 V,终止电位为-0.2 V,扫描速率(v)分别为10、25、50、75、100、150、200、250、500 mV s-1,进行循环伏安扫描,记录下循环伏安图中氧化峰、还原峰的峰电位和峰电流(i pa、i pc、E Pa、E Pc)。 (2)不同浓度K3[Fe(CN)6]溶液的循环伏安图 将0.10 mol/L KCl溶液和1.0 mmol/L K3[Fe(CN)6]溶液按照一定体积比例配制成20 mL混合溶液,体积比分别为2:18;5:15,10:10;15:5;18:2。放入玻璃碳圆盘电极、饱和甘汞电极及铂辅助电极(玻璃碳圆盘电极为工作电极,铂丝电极为辅助电极,饱和甘汞电极为参比电极),设置起始电位为+0.8 V,终止电位为-0.2 V,进行循环伏安扫描,记录下循环伏安图中氧化峰、还原峰的峰电位和峰电流(i pa、i pc、E Pa、E Pc)。 5、数据处理 (1)从K3[Fe(CN)6]溶液的循环伏安图,测量i pa、i pc、E Pa、E Pc值。 (2)分别以i pa和i pc对K3[Fe(CN)6]溶液浓度作图,说明峰电流与浓度的关系。(3)分别以i pa和i pc对v1/2作图,说明峰电流与扫描速率间的关系。 (4)计算i pa/i pc值以及ΔE P,说明K3[Fe(CN)6]在KCl溶液中的电极过程的可逆性。 6、思考题 1. K3[Fe(CN)6与K4[Fe(CN)6溶液的循环伏安图是否相同?为什么? 2. 请简要阐述循环伏安法的原理和作用。
细胞色素 P450 与药物代谢的关系众所周知,药物的主要代谢场所是在肝脏内,药物在肝内所进行的生物转化过程,可分为两个阶段:1. 氧化、还原和水解反应;2. 结合作用。这两个阶段就是药物代谢通常所说的I和H相反应。 一、药物在肝脏内的代谢反应 I相反应一一药物通过氧化、还原和水解反应使多数药物灭活的过程,称为I相反应。多数药物的I相反应在肝细胞的微粒体中进行。是由一组药酶(又称混合功能氧化酶系)所催化的各种类型的氧化作用,使非极性脂溶性化合物(烃基及芳香基羟)产生带氧的极性基因(如羟基),从而增加其水溶性。 H相反应——药物经过I相反应后,往往要通过结合反应,分别与极性配体如葡萄糖醛酸、硫酸、甲基、乙酰基、巯基、谷胱甘肽、甘氨酸、谷酰胺等基因结合。这一过程成为H相反应。通过结合作用,不仅遮盖了药物分子上某些功能基因,而且还可改变其理化性质,增加其水溶性,通过胆汁或尿液排出体外。二、药酶药物在肝脏内主要通过氧化、还原、水解和结合等反应进行代谢。在肝细胞微粒体内有1个氧化还原的酶系统,是由多种水解酶和结合酶组成。这个酶系统在生理情况下,可以促进生理活性物质的灭活和排泄,另一方面也可以促进药物代谢,所以又叫药酶。 三、细胞色素P450 细胞色素P450是药酶中的一种多功能氧化还原酶,它可以使药物的 烃基及芳香基羟化,使硝基及偶氮化合物还原成氨基,因它的一氧化碳结合物的最大吸收峰在450nm处,故叫P45O药物代谢的I相反应,主要在肝细胞的微粒体中进行,此过程系由一组混合功能氧化酶系所催化促进,其中最重要的是
P450和有关的辅酶类。细胞色素P450 是一种铁卟啉(红细胞血红素)蛋白,能进行氧化和还原。当外源性化学物质(药物)进入肝细胞后,在微粒体中与氧化型P450结合, 形成一种复合物,经一系列反应,药物被氧化成为氧化产物。 1.细胞色素P450酶系的分类 细胞色素P450酶系也称CYP酶系实际上为同一家族的多种异构型。迄今为止,人类P450的基因已发现有27种,编码多种的P450b 1.1按基因族分类P450 基本上分成至少4个基因族,又可进一步区分为不同亚族。其分类为CYP1 CYP2 CYP3和CYP4按英语A B、C??…和阿拉伯数字1, 2, 3,……进一步分类。 1.2按功能分类人类的P450可分成二类。CYP1 2, 3,主要代谢外源性化合物,如药物、毒物等,有交叉的底物特异性,常可被外源性物质诱导和抑制,在药物代谢过程中,其特异性差。CYP4则主要 代谢内源性物质,有高度特异性,通常不能被外源性物质影响,此类P450在类固醇、脂肪酸和前列腺素代谢中起作用。 2.人肝微粒体细胞色素P450酶的情况 参与人体药物代谢的P450酶主要有:CYP1A CYP2C CYP2D CYP2E 和CYP3A 五大类。人肝微粒体内参与药物代谢的主要P450酶的含量,CYP3A4占52%, CYP2D占30%。CYP3A占成人肝中总CYP450酶的 25%,临床中使用的60%药物经CYP3A弋谢,CYP3A舌性的高低,影响许多药物对患者的使用效果和毒性反应。 3.细胞色素P450酶系对药物代谢的影响
货号:MS1111 规格:100管/96样谷胱甘肽还原酶(GR)活性测定试剂盒说明书 微量法 注意:正式测定之前选择 2-3个预期差异大的样本做预测定。 测定意义: GR是广泛存在于真核和原核生物中的一种黄素蛋白氧化还原酶,是谷胱甘肽氧化还原循环的关键酶之一(通常昆虫中GR被TrxR取代)。GR催化NADPH还原GSSG生成GSH,有助于维持体内GSH/GSSG比值。GR在氧化胁迫反应中对活性氧清除起关键作用,此外GR还参与抗坏血酸-谷胱甘肽循环途径。 测定原理: GR能催化NADPH还原GSSG再生GSH,同时NADPH脱氢生成NADP+;NADPH在340nm有特征吸收峰,相反NADP+在该波长无吸收峰;通过测定340nm吸光度下降速率来测定NADPH脱氢速率,从而计算GR活性。 自备仪器和用品: 低温离心机、水浴锅、移液器、紫外分光光度计/酶标仪、微量石英比色皿/96孔板、和蒸馏水 试剂组成和配置: 试剂一:液体×1 瓶,4℃保存。 试剂二:粉剂×1 瓶,4℃保存。临用前加入 2mL 蒸馏水,混匀。 试剂三:液体×1 支,4℃保存。 粗酶液提取: 1. 组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加 入1mL试剂一)进行冰浴匀浆。8000g,4℃离心15min,取上清,置冰上待测。 2. 细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500 万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min); 然后8000g,4℃,离心15min,取上清置于冰上待测。 3. 血清等液体:直接测定。 操作步骤: 1. 分光光度计/酶标仪预热30min,调节波长到340nm,蒸馏水调零。 2. 试剂一置于25℃(普通物质)或者37℃(哺乳动物)中预热30min。 3. 空白管:取微量石英比色皿或96孔板,加入170μL试剂一,20μL试剂二,10μL试剂三, 于340nm 测定10s和190s吸光度,记为A空1和A空2,△A空白管= A空1﹣A空2。 4. 测定管:取微量石英比色皿或96孔板,加入150μL试剂一,20μL试剂二,20μL上清液, 10μL试剂三,于340nm测定10s和190s吸光度,记为A测1和A测2,△A测定管=A测1﹣A测2。注意:空白管只需要测定一次。 计算公式: a.使用微量石英比色皿测定的计算公式如下 (1). 按蛋白浓度计算 第1页,共3页