
人白血病-NOD/SCI D小鼠髓外浸润模型的建立
杨文华1,于文俊2,史哲新1,杨向东1,高宏1,汤毅1,吕俊秀2
Buil di ng of t he model of out er ma rr ow i n filtr a ti on of l euke m i a-N OD/S CI D m i ce
YANG W en-hua1,YU W en-j u n2,S H I Zhe-xi n1,YANG X iang-dong1,GAO H ong1,TANG Y i1,L V Jun-xi u2 1Depa rt m ent o f H e m a tolo gy,Tianjin Universit y o f Trad itio na l ChineseM edicine,T i a nji n300193,China;2Tianjin Universit y of T rad iti ona l ChineseM edicine,T ianjin300193,China.
=Ab stra ct> O bjective:To build m o de l of oute r ma rro w i n filtrati on of leuke m ia-NOD/SC ID m i ce by i n j ec ting leu2
ke m ia patient s'bone ma rro w mononuc lea r ce lls(B MMNC)and CE M cell li ne i nto tail ve i n.M e thods:M i ce,irrad i a2
ted270c Gy on body by137Cs,were rando m l y d i vi ded i nto four groups,each group were9.Inoculati ng l euke m ia pa2
ti ents'bone m arro w m ononuc l ear ce lls(B MMNC)and CE M ce ll li ne w ithi n24ho urs.gro up?:B MMNC1@107pe r
m o use;groupò:B MMNC2@107per m o use;groupó:CE M ce ll1@107per mouse;control group:0.2m l sa line pe r
m o use to observe the genera l situa ti on and survi va l ti m e,mon it or peripheral b l ood white bloo d ce ll coun t and s m ear,
outer m arro w infiltrati on of leukem ia cells by hist opatholog y and flo w cyto m etry.R esults:4-8W a fter the injecti on,
all the experi m ent gro ups took p lace outer m a rro w infiltrati on,succeeded i n bu il d i ng m ode.l Group?had5mouse
which were m ade m ode l successfull y.Gro upòwere7,wh ile groupówere9.C onc l usion:The model of oute rm ar2
ro w i nfiltra ti on of l euke m i a-NOD/SC I D m ice can be m ade by in jecti ng leukem ia patient s'bo ne m arro w m ononuc l ea r
cell s(B M MNC)and CE M ce ll li ne i nto ta il vein ofm i ce,and t h i s m ethod have h i gher m ak i ngm ode l s uccess ra te and
longer survi ve ti m e,provi de a go od m odel f or study ofm echanis m of leukem ia o u ter m arro w i nfiltra ti on and screen i ng
drug of an ti-leukem ia o u ter m arro w i nfiltra ti on.
=K ey w or ds>NOD/SC I D;o ut m arro w i nfiltrati on;leukem ia;an i m a lm ode l
M odern Oncology2009,17(04):0605-0609
=摘要> 目的:通过给NOD/SCID小鼠尾静脉注射白血病人骨髓单个核细胞(B MMNC)或CE M细胞株的方
式,建立人白血病-NOD/SC I D小鼠髓外浸润模型,并进行模型鉴定。方法:将36只NOD/SC I D小鼠经137Cs
全身照射270cGy后,随机分为4组,每组9只,24h内尾静脉注射接种白血病人B MMNC或CE M细胞系。实
验?组:B MMNC1@107/只;实验ò组:B MMNC2@107/只;实验ó组:CE M细胞1@107/只;对照组:生理盐
水0.2m l/只。持续观察其一般情况和生存时间,监测外周血白细胞计数和涂片,并应用组织病理、流式细胞
术等监测白血病细胞髓外浸润表现。结果:注射4-8周后,三组实验组均发生髓外浸润,成功建立人白血病
-NOD/SC I D小鼠髓外浸润模型。实验?组有5只成功建立模型;实验ò组7只成功建立模型;实验ó组9
只均成功建立模型。结论:应用尾静脉注射白血病人B MMNC或CE M细胞株的方法,可成功建立人白血病-
NOD/SC I D小鼠髓外浸润模型,且尾静脉注射白血病人B MMNC成模率高,生存时间长,为白血病髓外浸润机
制的研究和抗白血病髓外浸润药物的筛选提供了良好的实验模型。
=关键词>NOD/SC I D;髓外浸润;白血病;动物模型
=中图分类号>R733.7=文献标识码>A=文章编号>1672-4992-(2009)04-0605-05
NOD/SC I D(非肥胖糖尿病/重症联合免疫缺陷)[1]小鼠是在SC I D(重症联合免疫缺陷)小鼠的基础上与非肥胖性糖
=收稿日期> 2008-11-28
=修回日期> 2008-12-19
=基金项目> 国家自然科学基金项目(编号:30672743);天津市应用基础研究项目(编号:07J C YBJ C11500)
=作者单位>1天津中医药大学第一附属医院血液科,天津
300193
2天津中医药大学,天津300193
=作者简介> 杨文华(1951-),女,满族,主任医师,教授,博士生导师,主要从事临床血液病的诊疗工作。尿病小鼠(N OD/Lt)品系回交的免疫缺陷鼠。N OD/SCID小鼠既有先天免疫缺陷,又有T和B淋巴细胞缺乏,各种肿瘤细胞可以植入,且较少发生排斥反应及移植物抗宿主病(G VHD),所以N OD/S C ID小鼠已成为血液学实验研究的有用工具。人骨髓经静脉注射于N OD/SCID小鼠体内,可以在外周血、脾脏、淋巴结等处检测到并长期存在,各类白血病细胞及杂交瘤细胞均能在其体内迅速增殖。本研究取白血病人骨髓单个核细胞(B MMNC)和CE M细胞系尾静脉接种到NOD/SC I D小鼠体内,探索建立人白血病-NOD/SC I D小鼠髓外浸润模型。
1材料和方法
1.1实验动物及预处理
SPF级NOD/SCID小鼠,5-6周龄,雌雄各半,购于中国医学科学院实验动物研究所,饲养于中国医学科学院血液学研究所动物实验中心SPF级层流室,标准颗粒饲养,饮水酸化处理,垫料及一切与鼠接触物品均灭菌处理。
接种前将小鼠置于无菌透气木盒中,外罩无菌消毒巾,在137C s源环境下照射270c Gy,预处理后24h内接种细胞。对小鼠所有操作均在无菌层流室内进行。
1.2主要实验试剂和仪器
R P M I1640培养基、PBS缓冲液(美国G I B I O公司产品),特级胎牛血清(美国H yc l one公司),淋巴细胞分离液(中国医学科学院血研所科技公司),CD2、CD3、CD8、CD11、CD19、CD45和H L A-DR等抗体及流式细胞仪(美国BD公司),倒置显微镜(日本奥林巴斯I X71),低速自动平衡离心机(北京医用离心机厂),CO
2
培养箱(美国T H ERMO公司)。
1.3白血病人BMM NC制备和CEM细胞的培养
选取急性白血病人或慢性粒细胞白血病急变病人,常规无菌采集骨髓5m,l肝素抗凝。用15m l离心管,先注入5m l 淋巴细胞分离液,再将骨髓液缓缓注入,使其浮于分离液上
层;水平离心1800r/m i n,10m i n;将离心管垂直缓慢移入超净工作台,吸取中间白色单个核细胞悬浮层,PBS液洗两遍, 2%台盼蓝计数活细胞,将活细胞终浓度调至5@107/m l或1 @108/m l。
CE M细胞系由中国医学科学院血研所实验中心赠予,在含有10%胎牛血清的RP M I1640培养液中,于37e、5%CO
2饱和湿度条件下常规培养,每2天换液传代。用2%台盼蓝计数活细胞数,PBS液调整浓度至5@107/m l。
1.4实验分组与接种
随机分为四组,每组9只,采用尾静脉注射的方式,每只注射剂量为0.2m l。实验?组:B MMNC1@107/只;实验ò组:B MMNC2@107/只;实验ó组:CE M细胞1@107/只;对照组:生理盐水0.2m l/只。
1.5外周血白细胞计数,骨髓细胞形态学检查
接种前及接种后,每周行剪尾或目内眦取血行外周血白细胞计数,同时涂片数张,瑞氏-吉姆萨染色、高倍油镜下连续分类计数200个有核细胞,计数原始、幼稚细胞,计算肿瘤细胞的比例。
小鼠处死后取双侧股骨,用5m l PBS液反复冲洗股骨,直至股骨外观呈白色。将冲洗液离心后取骨髓沉渣加少量血清涂片,瑞氏-吉姆萨染色后镜检。
1.6病理检查和胸腹水涂片
将濒死状态或已死亡小鼠解剖,取出脾脏、肝脏、肾脏、肺脏、心脏、大脑、眼球、股骨以及腹腔内肿块,10%甲醛固定,石蜡包埋切片,H E染色后镜检。小鼠发生胸腹水,濒死或死亡者,取胸水和腹水直接涂片,瑞氏-吉姆萨染色后镜检。
1.7流式细胞术检测(FCM)
取小鼠骨髓细胞,PBS洗2次,分别加入F ITC单抗CD3、CD8、CD13、CD19和CD45各20L,l混匀,4e暗室孵育30m i n 后PBS洗两次,加入配制好的溶血剂,室温避光孵育10m i n, PBS洗涤两次;加入PBS300L l及4%多聚甲醛200L,l充分混匀固定。24h内上流式细胞仪检测,用Ce ll Quest3.1软件获取和分析细胞。
1.
8统计方法
所有数据均以均数?标准差(
x?s)表示。采用SPSS 13.0软件包处理,组间采用t检验,组内配对t检验,P<0.05为差异有显著性。
2结果
2.1一般情况
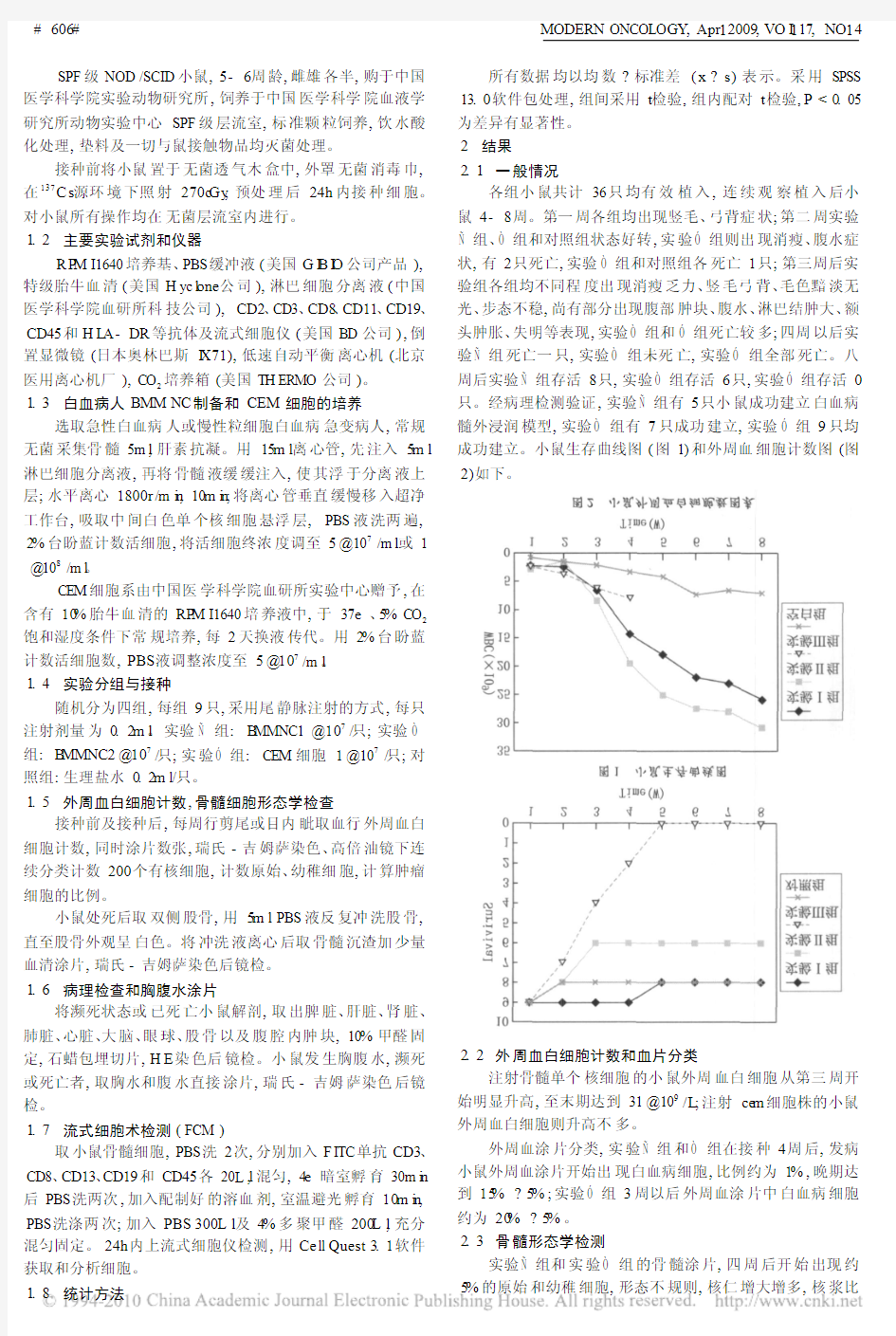
各组小鼠共计36只均有效植入,连续观察植入后小鼠4-8周。第一周各组均出现竖毛、弓背症状;第二周实验?组、ò组和对照组状态好转,实验ó组则出现消瘦、腹水症状,有2只死亡,实验ò组和对照组各死亡1只;第三周后实验组各组均不同程度出现消瘦乏力、竖毛弓背、毛色黯淡无光、步态不稳,尚有部分出现腹部肿块、腹水、淋巴结肿大、额头肿胀、失明等表现,实验ò组和ó组死亡较多;四周以后实验?组死亡一只,实验ò组未死亡,实验ó组全部死亡。八周后实验?组存活8只,实验ò组存活6只,实验ó组存活0只。经病理检测验证,实验?组有5只小鼠成功建立白血病髓外浸润模型,实验ò组有7只成功建立,实验ó组9只均成功建立。小鼠生存曲线图(图1)和外周血细胞计数图(图2)如下。
2.2外周血白细胞计数和血片分类
注射骨髓单个核细胞的小鼠外周血白细胞从第三周开始明显升高,至末期达到31@109/L;注射ce m细胞株的小鼠外周血白细胞则升高不多。
外周血涂片分类,实验?组和ò组在接种4周后,发病小鼠外周血涂片开始出现白血病细胞,比例约为1%,晚期达到15%?5%;实验ó组3周以后外周血涂片中白血病细胞约为20%?5%。
2.3骨髓形态学检测
实验?组和实验ò组的骨髓涂片,四周后开始出现约5%的原始和幼稚细胞,形态不规则,核仁增大增多,核浆比
例失调,核染色质增多、分布不均、着色深染,晚期原始和幼稚细胞比例达到约20%。实验ó组小鼠存活时间较短,3周后骨髓涂片检测出约2%-5%的原始和幼稚细胞。
2.4流式细胞仪检测
各组实验组濒死小鼠或小鼠造模到期后处死,流式细胞仪检测骨髓细胞,均有CD45表达。实验?组和实验ò组尚表达HLA-DR占有核细胞5.3%、CD11b占有核细胞11.0%、CD2占有核细胞7.5%。实验ó组CD2占有核细胞3.2%,CD5占有核细胞1.7%,如图3-4。
2.5脏器组织病理解剖和腹水涂片形态学检查
实验?、ò组肉眼可见肝脾肿大,有的可见肾脏肿大;实验ó组肉眼可见肝脾明显肿大,肾脏肿大或萎缩并布满出血点,满腹可见白色菜花样瘤块广泛黏连各脏器,眼球浑浊,颅脑肿胀。
实验?、ò组病理可见肝多发性、灶性坏死,肝血管旁瘤细胞浸润(图5);脾大量瘤细胞浸润,正常组织结构破坏(图6);股骨骨髓白血病细胞浸润(图7)。实验ó组除可见肝脾白血病细胞大量浸润外,尚见胰腺大量瘤细胞浸润,瘤细胞坏死,正常胰组织破坏;股骨、胸骨骨髓大量瘤细胞浸润,瘤细胞侵犯胸骨旁肌肉组织;肺、肾、脑膜可见瘤细胞浸润,如图8-11。
实验ó组7只出现不同程度的胸腹水,胸腹水图片可见比例约为25%-30%的肿瘤细胞,这些肿瘤细胞胞浆丰富、核大,呈深紫色,染色质细颗粒状,可见多个核仁(图12)
。
3讨论
在重症联合免疫缺陷小鼠(seve re co mb i ned i m m u-node2 fi c iency m i ce,SC I D)体内建立人的免疫系统,提供研究人免疫系统的体内实验平台,对研究开发疫苗、药物试验、肿瘤防治等方面具有重要意义[2-3]。NOD/SC I D小鼠具有多方免疫缺陷,包括缺乏功能性淋巴细胞、血清免疫球蛋白水平低, NK细胞活性明显减弱,成熟巨噬细胞减少,补体活性减低,渗漏率低等。人源性细胞更容易在其体内生长,复制出更合适的人源性疾病模型。国外学者多采取直接注射B MMNC 的方式建立模型,如Dazzi等将处于慢性期、加速期、急变期C ML患者外周血细胞植入经全身照射预处理后的NOD/ SC I D体内,发现可以顺利植入生长,其生长情况和和临床分期相关[4]。国内研究普遍利用SC I D或NOD/SC I D小鼠尾静脉或腹腔注射细胞系的方式进行建立白血病小鼠模型,常用的细胞系有K562[5-6]、HL60[7-8]、CE M[9]、S H I-1[10]等,而较少利用B MMNC直接进行白血病小鼠造模实验研究。
本研究利用尾静脉注射白血病人骨髓单个核细胞和CE M细胞系,均成功地建立了人白血病-NOD/SC I D小鼠髓外浸润模型。接种1@107和2@107个B M MNC相比,成模的比例分析P>0.05,没有统计学意义,但是两组小鼠死亡率相比P<0.05,有统计学差异。接种CE M细胞系,快速播散到体内各个脏器,髓外浸润现象明显而广泛,但是生存时间短,不适宜做长期的药物疗效观察。实验ó组小鼠生存率和实验?组、ò组相比,P<0.05具有显著性差异。考虑主要原因是注射B MMNC的小鼠有一个归巢的过程,人白血病干细胞需要在归巢以后才开始复制,而接种细胞系的小鼠,是直接通过静脉播散形成了一个全身脏器浸润的模型。
目前N OD/SCID移植模型主要用于体内药敏实验研究,预测指导临床治疗方案的选择和设计,以及探索放疗、内分泌治疗、免疫治疗、基因治疗及分子靶向治疗等新型的治疗手段[11]。本课题研究发现接种B MMNC的NOD/SCID小鼠,成活时间长,成活率高,发病率比较稳定,可以观察的时间更长,更适宜进行白血病髓外浸润的发病机制研究和治疗药物的筛选,并在体内评价其疗效。接种细胞系的小鼠,由于细胞系侵袭快,对很多脏器组织均有浸润,这对从分子水平研究白血病细胞对机体的侵袭机制等方面的研究提供了良好模型。
=参考文献>
[1]G rei n er DL,H esselt on RA,Shu ltz LD,et a.l S CI D m ouse m odels of
hum an ste m cell engraft m en t[J].Ste m Cells,1998,16(3):166-
177.
[2]林晨,谭玉波,白雪,等.人源化NOD/SCI D小鼠免疫细胞的动
态变化与鉴定[J].中国病理生理杂志2007,23(5):986-
990.
[3]H i ra m atsu H,N is h i ko m oriR,H ei ke T,et a.l Co m p l ete reconsti2
t u tion of hu m an l y m phocyt es fro m cord b l ood CD34+cell s u si ng
t h e NOD/S CID/ga mm a c nu ll m ice m odel[J].Bl ood,2003,
102(3):873-880.
[4]DazziF,Capelli D,H asserjian R,et a.l The k i neti cs and extent
of engraft m ent of chron icm yel ogenou sleuk e m ia cells i n non-obese
d iabetic/sever
e co m b i ned i m m unodefi ciency m i ce refl ect the phase
of t h e dorors'd is ease:an i n vi vom odelof chron icm yel ogenou s leu2
ke m i a b ioli ge[J].Blood,1998,92(4):1390-1396.
[5]费小明,汪承亚,缪扣荣,等.建立非肥胖型糖尿病/重症联合
免疫缺陷(NOD/SCI D)小鼠人白血病模型的实验研究[J].南
京医科大学学报(自然科学版),2007,27(10):1111-1114. [6]黎阳,张绪超,黄绍良,等.小剂量K562细胞NOD/S CID小鼠
动物模型的建立[J].中山大学学报(医学科学版),2005,26
(05):523-527.
[7]解启莲,甄素芬,李丽红.人急性早幼粒细胞白血病SCID小鼠
模型的建立[J].中国比较医学杂志,2005,15(04):202-205.
[8]舒琦,徐诣芝.白血病M I C分型法鉴定S CI D-人白血病模型
[J].江西医学院学报,2007,47(03):5-9.
[9]林祥华,陈志哲,林景娟,等.人白血病细胞重度联合免疫缺陷
小鼠模型的建立和监测[J].福建医科大学学报,2002,36
(4):352-355.
[10]周斌,居颂光,居颂文,等.人M5型白血病-SCID小鼠模型
的建立及白血病病理变化的分析[J].细胞与分子免疫学杂
志,2007,23(06):501-503.
[11]孙冰,吴世凯,宋三泰.NOD/SCI D小鼠平台上的肿瘤实验研
究进展[J].中华肿瘤防治杂志,2008,15(4):307-310.
(编校:闫旭冲)
转染L i vi n基因后骨肉瘤细胞系的多药耐药性研究
安贵峰1,吕刚1,曾艳2,黄涛1,王明月3,屠冠军1,王岩峰1,于德水1
St udy on mul ti drug resi st a nce of ost eosa rco ma cell s t ransf ect ed li vi n gene
AN Gui-feng1,L V Gang1,ZE NG Yan2,HUANG Tao1,WANG M ing-yue3,T U Guan-jun1,WA NG Yan-f eng1, YU De-shu i1
1Depa rt m ent o f Or t ho pe d ics,the F irstAff ilia ted Hos pita l,China M e d ica l Un i versit y,Shenya ng110001,China;2D e par t m ent o f Obstetrics and Gynecolo gy,Shenzhou H os pita l,Shenya ng M ed i a l College,Shenya ng110002,Chi na;3Lia o ning P rovi ncia l C orpsH os pita l,Ch i nes e P eople'sArm e d P olice F orce,Shenyang110034,Ch i na.
=Ab stra ct>O bjective:To exp l ore t he mu lti drug res i stance a fter t he Livi n gene was transfected i nto hu m an osteo2
sarco m a ce11s.M eth ods:The technol ogy of gene reco mb i nati on was used to co nstruc t t he eucary oti c express i on vector
pcD NA3.1(+)/L i vi n.Inc i d i ng w it h enzy m es and gene sequenc i ng were used to verify the vectors.The hum an osteo2
sarco m a U-2OS ce11swere transfected w it h pcDN A3.1(+)/L i vi n by lipofecta m i ne i ntro duced transfecti on and ge2
netic transcripti on level was eva l uated by RT-PCR.The ce ll s urvi va l and drug resistance trea ted w it h d ifferent che2
m otherapeutics we re detected byMTT m etho d.R esu lts:The reco mb i nan t vector pcD NA3.1(+)/L i vi n was co nstruc2
ted successfull y confir m ed by i ncidi ngw ith enzy m es and gene sequenci ng ana l ys i s.The expressio n l eve l ofL i vin gene
was h i ghe r in pcD NA3.1(+)/Livi n than t hat i n U-2OS and U-2OS/neo which was transfected w it h vec t or pcD2
NA3.1(+).Co mpared with U-2OS and U-2OS/neo.U-2OS/Livin sho wed a h i gher survi va l rate and drug res i st2
ance.C on clusi on:The h i gh expressi on of L i vi n gene is one of the i m portant reasons ofm ultidrug resistance of hu m an
osteosa rco m a.
=K ey w or ds>osteosarco ma;genes;L i vi n;mu lti p l e drug resistance;transfecti on
M odern Oncology2009,17(04):0609-0613
=摘要> 目的:探讨转染L i vi n基因后人骨肉瘤细胞的多药耐药变化。方法:采用基因重组技术构建L i vi n基
因的真核表达载体pc DNA3.1(+)/L i vi n,经酶切和基因测序分析对构建结果进行鉴定;通过脂质体将含
Livi n基因的表达载体转染人骨肉瘤细胞U-2OS,RT-PCR检测基因转录水平;应用四甲基偶氮唑蓝(MTT)
比色法检测细胞在不同化疗药物作用下的细胞耐药性。结果:经酶切鉴定和基因测序分析证明真核表达载
体pcDN A3.1(+)/L i vi n构建成功。将该表达载体转染U-2OS细胞后,Livi n基因的表达水平与野生型U-
2OS细胞和转染空载体的U-2OS/neo细胞相比显著提高(P<0.01)。与U-2OS细胞和U-2OS/neo细胞
相比,U-2OS/Li vin细胞对AD M、CTX、MMC和DDP等化疗药物的耐药性也明显增强(P<0.01)。结论:
Livi n基因高表达是人骨肉瘤多药耐药的原因之一。
=收稿日期> 2008-05-05=修回日期> 2008-06-23
=基金项目> 辽宁省教育厅高等学校基础研究计划资助项目(编号:05L502);沈阳市社会发展科技计划(编号:1072054-5-00)
=作者单位> 1中国医科大学附属第一医院骨科,辽宁沈阳110001
2沈阳医学院沈洲医院妇产科,辽宁沈阳110002
3武警辽宁省总队医院骨科,辽宁沈阳110034
=作者简介> 安贵峰(1979-),男,辽宁沈阳人,医学博士,医师,主要从事脊柱脊髓疾病与骨肿瘤的基础和临床研究工作。
=通讯作者> 吕刚(1956-),男,辽宁盖州人,博士生导师,教授,主要从事脊柱外科与骨肿瘤的基础和临床研究工作。
006111 7 栏目中药药物评价>>非临床安全性和有效性评价 标题银屑病药效学动物模型及其在中药新药研究中应用的思考 作者韩玲 部门 正文内容 审评一部韩玲 摘要:本文综述了银屑病药效学动物模型的进展,对治疗银屑病中药新药 药效学研究方面存在的问题进行了分析,提出了应结合银屑病发病机制的 研究进展完善药效学方法学研究的建议。 银屑病是一种慢性复发性皮肤病,其发病机制复杂,至今尚未明了。可能是一种具有基因遗传特性的疾病,也与感染、内分泌机能障碍、免疫功 能紊乱等有关。中医学认为以风湿毒邪内侵为标,血虚、血燥为根源,血 热、血虚、血瘀是本病的基本病机,故清热解毒、凉血、活血化瘀、祛风 除湿成为治疗本病的基本法。 银屑病的组织病理学主要表现为角质形成细胞过度增生、炎症细胞聚集和真皮乳头部血管增生扩张三大特征,从而出现角化过度、角化不全、颗 粒层消失、棘细胞层增厚等。尽管许多不同的动物模型能复制银屑病的某 个方面的病理特征,并能解释部分病因,但长期以来仍缺乏一种能够研究 所有有关的潜在因素的动物模型。即-缺乏理想的动物模型。 一、银屑病药效学动物模型 银屑病动物模型是根据银屑病的特征,人为建立的一种与之相似的模型。 有人总结了银屑病动物模型的建立过程,包括以下4个不断完善的阶段: 1.诱发性动物模型 该模型是通过工方法在动物,如豚鼠、大鼠等皮肤上诱发银屑病样增生。
其方法包括紫外线照射、化学刺激剂外涂或药物外涂、缺乏必须脂肪酸的饲料喂养等。这些方法均为过度增殖模型,可引起表皮增生加快。但这些方法仅是针对表皮损伤的一种迟发反应,持续时间较短。 如缺乏必须脂肪酸饲料喂养的大鼠模型,因缺乏必须脂肪酸,故可使大鼠皮肤逐渐出现角化过度、棘层肥厚、基底细胞有丝分裂加快,DNA合成增加等变化,表皮细胞呈慢性增生状态,与药物诱发的急性表皮增生相比,其与银屑病更为相似。 如心得安诱导银屑病动物模型,是利用心得安特有的药理作用,即心得安可阻断角阮细胞的β-肾上腺能受体而降低了细胞内cAMP水平所致。应用后可出现动物表皮角化过度、角化不全和棘层肥厚等类似银屑病的组织病理改变,其皮损并非是刺激性皮炎。黄畋[1]和Gaylarde[2]等分别用心得安成功地在豚鼠背部和耳部皮肤上制备了银屑病样皮肤模型,并发现药物可抑制其所致的表皮异常角化与增殖、角化不全等。 已有研究[3-4]发现IL-20是与银屑病密切相关的细胞因子,在体外可明显促进角质形成细胞增殖;IL-20的转基因鼠可出现皮损,其组织病理学改变与人类银屑病有相似之处;此外,IL-20受体在银屑病皮损处有高表达。有人在心得安造模的基础上,利用原位杂交等方法检测了动物皮损中IL-20 及角蛋白的K14,K16,K17表达水平的变化情况,发现正常皮肤IL-20的表达仅限于基底层,且为低表达,但模型动物皮损中基底层及棘层均有高表达,且显著高于正常组。应用IL-20反义寡核苷酸外涂皮肤后,可使其明显好转。也观察到皮损中角蛋白K14,K16表达水平明显增高。提示心得安所致的豚鼠银屑病样动物模型不仅在组织病理学,而且在分子水平上与人类银屑病皮损一致。从而在分子水平上证实了此动物模型的可行性。 上述这些方法的优点是可在短时间内复制出某些方面与银屑病相似的动物模型,方法简便、易行、重复性较好,可用于表皮增殖动力学、药物筛选等研究,但这些模型只是模拟了银屑病中的部分组织病理特征,在许多方面与诱发或自然产生的疾病毕竟存在差异。 2.裸鼠-皮损移植模型 该模型是将银屑病人皮损组织移植到裸鼠背部。其具体方法是,选择经组织学证实,2周内未经任何治疗的寻常型银屑病患者的典型皮损,麻醉后取全层皮肤,裸鼠背部麻醉后切除部分圆形皮肤至肌肉筋膜,将皮损间段缝合到移植点。因裸鼠是先天性无胸腺小鼠,其免疫缺陷,在一定情况
二十种常见实验动物模型 一、缺铁性贫血动物模型 缺铁性贫血(iron deficiency anemia,IDA)是体内用来合成血红蛋白(HGB)的贮存铁缺乏,HGB合成减少而导致的小细胞低色素性贫血,主要发生于以下情况:(1)铁需求增加而摄入不足,见于饮食中缺铁的婴幼儿、青少年、孕妇和哺乳期妇女。(2)铁吸收不良,见于胃酸缺乏、小肠粘膜病变、肠道功能紊乱、胃空肠吻合术后以及服用抗酸和H2受体及抗剂等药物等情况。(3)铁丢失过多,见于反复多次小量失血,如钩虫病、月经量过多等。 IDA是一种多发性疾病,据报道,在多数发展中国家,约2/3的儿童和育龄妇女缺铁,其中1/3患IDA,因此,研究IDA的预防和治疗具有重要的意义。在这些研究中,缺铁性贫血的动物模型(Animal model of IDA),又是实施研究的基础工具。常见的IDA动物模型的构建技术如下: 实验动物:一般选用SD大鼠,4周龄,雌雄不拘,体重65g左右,HGB≥130g/L。 建模方法:低铁饲料加多次少量放血法。低铁饲料一般参照AOAC 配方配制,采用EDTA浸泡处理以去除饲料中的铁,饲料中的含铁量是诱导SD大鼠形成缺铁性贫血模型的关键,现有研究表明,饲喂含铁量<15.63mg/Kg的饲料35天,SD大鼠出现典型IDA表现,而饲喂
含铁40.30mg/Kg的饲料SD大鼠出现缺铁,但并不表现贫血症状。建模时一般采用去离子水作为动物饮水,以排除饮水中铁离子的影响。少量多次放血主要用于模拟反复多次小量失血导致的铁丢失,还可以加速贫血的形成。放血一般在低铁饲料饲喂2周后进行,常用尾静脉放血法,1~1.5ml/次,2次/周。 模型指标:(1)HGB≤100g/L;(2)血象:红细胞体积较正常红细胞偏小,大小不一,中心淡染区扩大,MCV减小、MCHC降低;(3)血清铁(SI)降低,常小于10μmol/L,血清总铁结合力(TIBC)增高,常大于60μmol/L。 需要指出的是,以上模型不能用于铁吸收不良相关IDA的防治研究。根据具体的研究需要,也可以适当调整建模方法。 二、白血病动物模型 用免疫耐受性强的人类胎儿骨片植入重症联合免疫缺陷病(SCID)小鼠皮下,出于人类造血细胞与造血微环境均植入小鼠,建立具有人类造血功能的SCID小鼠模型称为SCID-hu小鼠。再将髓系白血病患者的骨髓细胞植入SCID-hu小鼠皮下的人类胎儿骨片内,植入的髓系白血病细胞选择性生长在SCID-hu小鼠体内的人类造血微环境中,即为人类髓系白血病的小鼠模型。SCID小鼠是由于其scid所致。T、B淋巴细胞功能联合缺陷,这种小鼠能接受人类器官移植物。 造模方法:
肿瘤动物模型的构建——白血病篇 导读白血病( Leukemia )是一种常见的恶性血液疾病,俗称血癌。据统计,白血病是儿童恶性肿瘤的头号原因,在儿童及35 岁以下成人中发病率位居第一[1] 。同时也是十大恶性肿瘤之一。目前,白血病具体的发病原因至今尚未研究透彻,因此建立合适的白血病动物模型,对于白血病发病机制及药物研发具有重要意义。本期为大家综述了白血病的基本情况及小鼠模型的分类、建立方法和应用。 第一章:白血病基本常识白血病是常见液体瘤白血病是常见的液体瘤,与结肠癌、肝癌等实体瘤不同的是,它是造血干细胞的异常分化和过度增殖导致,因此肿瘤细胞会遍布全身,会侵犯身体的每个脏器,造成全身衰竭。造血干细胞是血液系统中的成体干细胞,具有长期自我更新和分化成各类成熟血细胞的能力。如下图为造血干细胞可分类形成各种血细胞,如红细胞、血小板和白细胞:造血干细胞分化成各类血细胞(图片来自https://www.doczj.com/doc/0210531042.html, 网站) 白血病致病因素有哪些呢? 现阶段认为白血病的发病因素:化学因素、电离辐射、药物、毒物、病毒、遗传因素等有关。 白血病主要分为四类 根据白血病细胞的成熟程度和自然病程,白血病可分为急性
和慢性两大类,临床上,白血病共分为四大类:急性髓系白 血病(AML )、急性淋巴细胞白血病(ALL )、慢性髓系白血病(CML )和慢性淋巴细胞白血病(CLL )。儿童白血病90% 以上是急性的,其中急性白血病中70% ~80%是ALL。第二章:实验研究所用白血病模型首先,来了解一下常用 的细胞株白血病中常用的小鼠品系用于建立白血病小鼠模型的小鼠可分为近交系和突变系。根据不同类型和目的选择不同的小鼠品系,具体如下图所示:最后说说常用的动物模型,主要分为三类: 一、异种移植模型异种移植模型是最常用的淋巴瘤动物模型。根据实验目的选择相应的小鼠品系和细胞株后,通常细胞的接种方式为皮下注射、腹腔注射和尾静脉注射。 皮下注射和腹腔注射操作简单,很快在接种部位形成肿瘤或 腹腔内形成多发性肿瘤,适合筛选针对白血病的药物。但该 类模型与白血病临床病人实际情况差距较大。异种移植型白 血病模型异种移植示意图[2] 尾静脉注射接种模型,可形成全身性扩散的白血病模型。符 合白血病临床过程规律,此模型以动物生存期作为评价药效 的主要指标,并对采血样本进行血细胞的形态学检测。下面以尾静脉注射模型实验步骤为例: 根据实验目的选择实验小鼠和细胞(如NOD-SCID 小鼠和人急性早幼粒细胞白血病细胞株);荷瘤细胞量一般1-2 ×
实验小鼠(laboratory mouse)学名(Mus muscculus),实验小鼠来自于野生小鼠,经人们长期选择培育而成。18世纪就被用做动物试验,是目前应用最广泛、被研究的最清楚、最深入的实验动物。已育成的小鼠品种品系有500多种。 一、生物学特性 (一)、动物学分类位置 小鼠属于脊椎动物门,哺乳纲、啮齿目、鼠科、鼷鼠属、小家鼠种。 (二)、一般特性 1、外观:小鼠面部尖突,头呈锥体形,嘴脸前部两侧有19根触须,耳耸立呈半圆形,眼睛大。尾长约与身长相等,尾部覆有短毛和环状角质鳞片。健康小鼠皮毛光滑紧贴皮肤,四肢匀称,眼睛亮而有神。小鼠有多种毛色。 2、体形小,生命周期短,易于饲养管理。出生体重仅1.5克左右,一月龄体重约18--22克。成年小鼠每日食量5--8克,饮水4--7毫升,排粪1.4--2.8克/天,排尿1--3毫升/天。 3、性情温顺,胆小怕惊。 4、成熟早,繁殖力强。雌35--50日龄,雄45-60日龄就可性成熟,雌65--75日龄,雄70--80日龄可达体成熟。性周期4--5天,妊娠期19--21天,哺乳期20--21天,年产6--9胎。属全年多发情动物,产后即发情。 5、反应敏感,适应性差。对多种病原体、毒素及致癌物都很敏感,外界环境光照、噪音、营养、温度、空气质量等多种因素均可对小鼠造成影响。 6、昼伏夜动,喜欢啃咬。喜光线较暗的安静环境,进食、分娩都常发生在夜间,傍晚和黎明前是小鼠活动的两个高峰。 7、喜群居。 8、小鼠有20对染色体,推测有3万多个结构基因,已查明的已有648个。 9、寿命为2--3年。 (三)、解剖生理特点: 1、小鼠上、下颌各有两个门齿,六个臼齿,门齿终生不断生长,需经常磨损来维持齿端的长短,保持恒定。 2、小鼠下颌骨形态有品系特征,可用下颌骨形态分析技术进行近交系小鼠遗传监测。 3、内部脏器:食道细长约2cm,胃分前胃和腺胃,胃容量小(1--1.5ml),胃功能较差,不耐饥饿;有胆囊;胰腺分散在十二指肠、胃底及脾门处;无汗腺;淋巴系统发达;脾脏有明显造血功能;无腭或咽部扁桃体;左肺单叶,右肺四叶;骨髓为红骨髓而无黄骨髓,终生造血;雌鼠为双子宫型,呈Y字型,卵巢有系膜包绕,不与腹腔相通;乳腺发达,共有五对乳头,胸部3对,鼠蹊部2对;雄鼠睾丸大,幼鼠时藏于腹腔内,性成熟后下降到阴囊;前列腺分背、腹两叶。 二、在生物医学中的应用 (一)、药物研究 1、药物安全性评价 小鼠常用于药物的急性、亚急性、慢性毒性试验以及最大耐药量的测定等,“三致”试验也常用小鼠进行。 2、生物制品的检定 3、药物筛选 4、药效学评价试验
氧化苦参碱对银屑病样小鼠模型氧化应 激的拮抗作用 (作者:___________ 单位: __________ 邮编:____________) 【摘要】目的研究氧化苦参碱对银屑病样小鼠模型氧化应激的拮抗作用,探讨其防治银屑病的机制。方法采用注射雌激素刺 激小鼠阴道上皮组织增生的方法复制银屑病小鼠动物模型,同时给予 不同剂量的氧化苦参碱干预,实验10d后,取小鼠血清测定超氧化物歧化酶(SOD)总抗氧化能力(T-AOC)、丙二醛(MDA)谷光甘肽(GSH) 及一氧化氮(NO)水平的含量,并观察氧化苦参碱对小鼠阴道上皮细胞有丝分裂的影响。结果氧化苦参碱80、40和20mg? kg-1均可抑制小鼠阴道上皮的有丝分裂(P0.01);氧化苦参碱80mg - kg-1可升高雌激素周期小鼠血清SOD和T-AOC的含量(P0.05,P0.01),降低MDA GSH和NC含量(P0.01);氧化苦参碱40mg?kg-1可降低雌激素周期小鼠血清MDA和NC 含量(P0.05,P0.01)。结论氧化苦参碱对实验性银屑病具有保护作用,该作用可能与其抑制表皮细胞增殖并降低血清 MDA GSH及NO含量,升高SOD和T-AOC的含量有关。 【关键词】氧化苦参碱;银屑病;有丝分裂指数;超氧化物歧化酶;丙
二醛;谷光甘肽 氧化苦参碱(Oxymatrine , OMT是苦豆子生物碱的一种,具有抗炎、抗增殖、改善机体免疫功能等作用[1]。银屑病(psoriasis)是一种以皮肤组织为主要病理改变的慢性炎症性皮肤病。近年来研究表明,银 屑病患者体内释放大量的超氧阴离子自由基,对生物膜的结构造成广 泛损伤,引起皮肤炎症的发生[2-3]。作者通过给小鼠注射己烯雌酚的方法复制银屑病样小鼠模型[4],观察氧化苦参碱对银屑病小鼠血清超氧化物歧化酶(SOD)总抗氧化能力(T-AOC)、丙二醛(MDA)谷光甘肽(GSH)及一氧化氮(NO)水平及阴道上皮组织细胞有丝分裂的影响,探讨了其防治银屑病的机制。 1材料与方法 1.1实验材料 1.1.1实验动物昆明种雌性小鼠,体重18?22g,宁夏医科大 学实验动物中心提供,合格证SYXK (宁2005- 0001)。 1.1.2药品氧化苦参碱(宁夏制药厂,批号64041201);甲氨蝶呤(Methotrexate ,MTX浙江海正药业股份有限公司,批号080903A); 己烯雌酚(Diethylstilbestrol ,DES上海通用药业股份有限公司,批号090203);秋水仙碱(Colchicin ,CLC昆明制药厂,批号841201)。 1.1.3 试剂和主要仪器SOD MDA GSH T-AOC和NO测试盒(南 京建成生物工程研究所,批号20091115);752N紫外可见分光光度计(上海精密科学仪器有限公司)。
小鼠肿瘤模型 肿瘤模型我们一般常用的就是小鼠模型和人肿瘤裸小鼠移植瘤模型。其中用得最多的是皮下模型,另外还有腹水(或者尾静脉注射)以及原位模型,其他的模型很少用,就不提他们了。 小鼠模型分三大类:第一类是以S180、EAC、H22等为代表的,他们的宿主小鼠多选用KM,可产生腹水,也可在皮下成瘤。多以腹水传代,实验时抽取腹水,经过一定稀释后皮下接种构建模型,接踵后第二天开始给药,给药7到10天,接种10天后结束试验,剥取肿瘤称瘤重。 1. 关于构建瘤种 可以用体外细胞株培养后,用PBS悬浮至1~3×106/0.1ml/mouse,i.p接种即可,最好用6号左右的针头,就是常用的2ml一次性注射的针头。 2. 关于腹水传代 观察到第一代的种鼠肚子较大后(一般约8~9天左右),可以传代,传代时取1ml 注射器,用2ml注射器的针头,种鼠腹部消毒后直接将针头插入抽取腹水即可,注意不要把针头插得很深,尽量浅一点,还可以把老鼠拎起来,利用重力,让腹水集中在某处便于抽取,一般抽个0.5ml就可以了,不用离心,直接用PBS3~6倍稀释后,接种到新的老鼠腹腔,腹水颜色为白色或者略有发黄都是正常的,但是血性腹水说明不好,需要注意调整,第二代以后,尽量6~7天的时候传代,不要等的时间太久,否则腹水容易血性。三代后可用于试验。 3. 关于接种进行试验 这个时候抽取的腹水需要量比较多,一般需要处死种鼠后,小心地用消毒眼科剪刀镊子剥开腹部皮肤,注意不要弄破肌肉,然后,用镊子(最好是哪种前面有倒勾的镊子,学名好像是唇型镊)拎起腹部的肌肉,用剪刀剪开一个小口,然后用玻璃滴管或者去掉针头的注射器吸取腹水。然后进过一定的稀释后,接种到小鼠的腋下。关于稀释量,各个实验室的情况都不一样,最好摸索一下,开始的时候可以适当的计数,但是要用台盼兰染色后计活细胞数。接种部位在小鼠腋下,但是不要深入到腋窝里面,会给以后的操作带来麻烦。接种时的进针处离接种处远一点,让针头在皮下多走一段,不容易污染。有的人接种的时候喜欢针头向上用力,紧贴着表皮往里走,然后注射的时候感觉阻力较大,打出来的皮丘又紧又圆,这样的接种,会使肿瘤与皮肤严重粘连,不利于最后肿瘤的剥取。也不要紧靠肌肉,肿瘤会与肌肉严重粘连。应该在两者之间,进针的感觉轻松自如,针头很自由,虽然打出来的肿瘤不会很圆很漂亮,但是相对好剥取一些。 4. 关于观测指标 主要是按时称体重,试验结束后剥取肿瘤称瘤重。因为出瘤已经是接种后的第6天左右了,第10天就结束时间,瘤体积的数据意义就不大。小鼠肿瘤很难剥,这是没有办法的,只能耐心,没有太好的办法,剥多了以后,手上会掌握一些巧力,有一些帮助,但是我们还是很头痛小鼠肿瘤试验结束。肿瘤组织周围经常会有一些血窦的形成,弄破后会有血和黄色的液体流出,正常的,但是剥瘤子的时候不要把它弄破,会严重影响瘤重。按照SFDA的规定,平均瘤重小于1g,或
常用疾病动物模型 上海丰核可以为广大客户提供各种疾病动物模型定制服务,同时提供相关疾病模型的药物敏感性实验分析服务。 客户只需要提供疾病模型的用途及建模方法的选择,我们会根据客户的具体要求量身定做各种动物模型服务。
小鼠或裸 鼠 加贴近实际(八)心血管疾病模型 1. 动脉粥样硬化(高脂高胆固醇+维生素D喂养)兔高脂、高胆固醇饲喂兔造模,成 膜后血脂变化显著,为伴高血脂 症的动脉粥样硬化 4月血管组织病 理切片染色 2. 主动脉粥样硬化(高脂高胆固醇+主动脉球囊损伤)兔此模型用大球囊损伤加高脂饲 养方法成功建立兔主动脉粥样 硬化狭窄的动物模型,为相关基 础研究提供可靠模型。 2月动物实验模型病理切片展示 一、CCl4诱导的肝脏纤维化 简介:肝纤维化是肝细胞坏死或损伤后常见的反应,是诸多慢性肝脏疾病发展至肝硬化过程中的一个中间环节。肝纤维化的形成与坏死或炎症细胞释放的多种细胞因子或脂质过氧化产物密切相关。CCl4为一种选择性肝毒性药物,其进入机体后在肝内活化成自由基,如三氯甲基自由基,后者可直接损伤质膜,启动脂质过氧化作用,破坏肝细胞的模型结构等,造成肝细胞变性坏死和肝纤维化的形成。通过CCl4复制肝纤维化动物模型通常以小鼠或大鼠为对象,染毒途径主要为灌胃、腹腔注射或皮下注射。 动物模型图. 经过3个月的CCl4注射造模,小鼠的肝脏在中央静脉区形成了比较明显的肝纤维化,中央静脉之间形成了纤维桥接。(Masson染色) 二、CXCL14诱导的急性肝损伤动物模型
简述:CCl4是最经典的药物性肝损伤造模毒素之一,其在肝内主要被微粒体细胞色素P450氧化酶代谢,产生三氯甲烷自由基和三氯甲基过氧自由基,从而破坏细胞膜结构和功能的完整性,引起肝细胞膜的通透性增加,可溶性酶的大量渗出,最终导致肝细胞死亡,并引发肝脏衰竭。根据CCl4代谢和肝毒性机制可复制不同的肝损伤模型,其中给药剂量和给药方法是其技术关键。对于复制急性肝衰竭动物模型,往往采用大剂量一次性灌胃或腹腔注射给药。 图. (A) CCl4注射后0.5 d的HE染色表明CXCL14过表达增加了肝脏组织的嗜酸性变性面积(在照片中用虚线标记)(p < 0.05)。 (B) 1.5天组织样本的HE染色表明CXCL14过表达造成了比对照组更大面积的细胞坏死(p < 0.05)。 (C)同时还造成了中央静脉周围肝细胞中明显的脂肪滴积累。图中P和C分别表示动物模型的门静脉和中央静脉。KU指凯氏活性单位。 细胞凋亡检测结果 TUNEL标记没有显示CXCL14免疫中和小鼠和对照小鼠在凋亡细胞数量上的差异。C0, C1和C2分别是对照组0 d,1 d,和2 d样本,T1
成人急性髓系白血病(非APL)中国诊疗指南(2017年版)2017-04-14 来源:中华血液学杂志 成人急性髓系白血病 2017 一、初诊患者入院检查、诊断 (一)病史采集及重要体征 ?年龄 ?此前有无血液病史[主要指骨髓增生异常综合征(MDS)、骨髓增殖性肿瘤(MPN)等] ?是否为治疗相关性(包括肿瘤放疗、化疗) ?有无重要脏器功能不全(主要指心、肝、肾功能等) ?有无髓外浸润[主要指中枢神经系统白血病(CNSL)、皮肤浸润、髓系肉瘤] (二)实验室检查 ?血常规、血生化、出凝血检查 ?骨髓细胞形态学(包括细胞形态学、细胞化学、组织病理学) ?免疫分型 ?细胞遗传学检测[染色体核型分析、荧光原位杂交(FISH)] ?分子学检测 初级检查:PML-RARα、AML1-ETO、CBFβ-MYH11、MLL重排、BCR-ABL融合基因及C-Kit、FLT3-ITD、NPM1、CEBPA、TP53、RUNX1(AML1)、ASXL1基因突变,这些检查是急性髓系白血病(AML)分型和危险度分组的基础。 次级检查:IDH1、IDH2、DNMT3a、TET2及RNA剪接染色质修饰基因突变(包括SF3B1、U2AF1、SRSF2、ZRSR2、EZH2、BCOR、STAG2),这些检查对于AML的预后判断及治疗药物选择具有一定的指导意义。 ?有意愿行异基因造血干细胞移植(allo-HSCT)的患者可以行HLA配型 (三)诊断、分类 AML的诊断标准参照WHO(2016)造血和淋巴组织肿瘤分类标准,诊断AML的外周血或骨髓原始细胞比例下限为0.200。当患者被证实有克隆性重现性细胞遗传学异常t(8;21)
发布日期20061110 栏目化药药物评价>>非临床安全性和有效性评价 标题银屑病药效学模型及结果评价-姚治孙涛 作者姚治孙涛 部门 正文内容审评三部姚治、孙涛 摘要:近来国内创新性的抗银屑病药物的申报呈上升趋势,但由于银屑病发病机制不完全清楚,现有药效学模型与 临床的相关性尚存在一定问题,给研究和评价带来一定困难。本文整理总结了现有的一些抗银屑病体内外药效学模 型和试验方法,并对其结果的评价价值做了一定探讨。希望对相关研究和评价提供参考。 关键词:银屑病、药效学、评价 银屑病是以表皮角质形成细胞过度增殖和分化不全、真皮浅层微血管扩张并伴有炎症反应为病理特征的表皮角化性皮肤病,其发病机制迄今尚未完全清楚。综合近年来的研究报道,关于银屑病发病的新概念认为:银屑病是多基 因遗传背景下T细胞失常的免疫性疾病,表皮过度增殖与分化异常和炎症等疾病现象涉及到细胞和分子水平的异常 调控,后者是指在银屑病中异常表达的免疫分子、细胞因子、炎症介质和调节分子。国外文献报导ET-1(内皮素1)、 sE-selectin(可溶性选择素E)、sIL-2R(可溶性白介素2受体)、IL-6(白介素6)、IL-8(白介素8)、CD4+/CD8+ 等与银屑病有关。 下面简要介绍一下几种与银屑病有关的体内外药效学试验模型及结果评价: 一、体内试验 表皮细胞增殖过快和角化不全是银屑病的基本病理特点,小鼠尾部鳞片的表皮缺乏颗粒层的形成,雌激素周期的小鼠阴道上皮细胞增殖活跃,上皮细胞转换加快,均与人银屑病表皮病理特征相似。药物如能抑制小鼠阴道上皮有 丝分裂和促进鼠尾颗粒层形成,就可能具有抗银屑病作用。下面两种方法是被广泛使用的较为经典的银屑病药效学 模型: 1、对小鼠阴道上皮细胞有丝分裂的影响试验 雌性小鼠预先注射雌激素(如乙烯雌酚)数日,使其处于雌激素生理周期。阴道给予药物数日,末次给药后腹腔注射秋水仙碱以终止细胞分裂。取小鼠阴道组织,固定,染色,观察阴道上皮细胞的有丝分裂指数。常以甲氨蝶呤 为阳性对照。 若试验结果表明药物有抑制阴道上皮细胞的有丝分裂的作用,则可提示对银屑病的疗效。 2、对小鼠尾鳞片表皮细胞生成的影响试验 取小鼠,将试验药物直接在尾部外涂给药一定时段(一般为2周),取尾根部皮肤,固定,染色,测量鼠尾表皮厚度和颗粒形成情况。 若试验结果表明药物有促进鼠尾颗粒层形成作用,则可提示对银屑病的疗效。 3、对盐酸普奈洛尔所致豚鼠耳部皮肤银屑样皮损的影响 采用盐酸普奈洛尔乳剂型搽剂(5%)连续涂抹豚鼠两侧耳廓皮肤,每日2次,连续2周后取少量豚鼠的两侧耳廓皮肤,固定,染色,光镜观察评价造模质量。于耳廓皮肤涂抹给药,每日2次,连续2周。同法观察耳部皮肤的角 化层、颗粒层、棘细胞层、基底细胞层及固有层的变化情况,并测定表皮厚度。
肿瘤动物模型的构建——白血病篇
肿瘤动物模型的构建——白血病篇 导读白血病(Leukemia)是一种常见的恶性血液疾病,俗称血癌。据统计,白血病是儿童恶性肿瘤的头号原因,在儿童及35岁以下成人中发病率位居第一[1]。同时也是十大恶性肿瘤之一。目前,白血病具体的发病原因至今尚未研究透彻,因此建立合适的白血病动物模型,对于白血病发病机制及药物研发具有重要意义。 本期为大家综述了白血病的基本情况及小鼠模型的分类、建立方法和应用。 第一章:白血病基本常识白血病是常见液体瘤 白血病是常见的液体瘤,与结肠癌、肝癌等实体瘤不同的是,它是造血干细胞的异常分化和过度增殖导致,因此肿瘤细胞会遍布全身,会侵犯身体的每个脏器,造成全身衰竭。 造血干细胞是血液系统中的成体干细胞,具有长期自我更新和分化成各类成熟血细胞的能力。如下图为造血干细胞可分类形成各种血细胞,如红细胞、血小板和白细胞: 造血干细胞分化成各类血细胞(图片来自https://www.doczj.com/doc/0210531042.html,网站)白血病致病因素有哪些呢? 现阶段认为白血病的发病因素:化学因素、电离辐射、药物、毒物、病毒、遗传因素等有关。
白血病主要分为四类 根据白血病细胞的成熟程度和自然病程,白血病可分为急性和慢性两大类,临床上,白血病共分为四大类:急性髓系白血病(AML)、急性淋巴细胞白血病(ALL)、慢性髓系白血病(CML)和慢性淋巴细胞白血病(CLL)。儿童白血病90%以上是急性的,其中急性白血病中70%~80%是ALL。 第二章:实验研究所用白血病模型首先,来了解一下常用的细胞株白血病中常用的小鼠品系 用于建立白血病小鼠模型的小鼠可分为近交系和突变系。根据不同类型和目的选择不同的小鼠品系,具体如下图所示: 最后说说常用的动物模型,主要分为三类: 一、异种移植模型 异种移植模型是最常用的淋巴瘤动物模型。根据实验目的选择相应的小鼠品系和细胞株后,通常细胞的接种方式为皮下注射、腹腔注射和尾静脉注射。 皮下注射和腹腔注射操作简单,很快在接种部位形成肿瘤或腹腔内形成多发性肿瘤,适合筛选针对白血病的药物。但该类模型与白血病临床病人实际情况差距较大。异种移植型白血病模型异种移植示意图[2]
文章编号(Article ID ):1009-2137(2014)03-0779-06 ·论著· 白血病小鼠H-2全不相合微移植模型的建立及鉴定吴惠惠,刘铁强,孙雪冬,黄晓梅,张锐,刘志强,满秋红,黄雅静, 孙琪云,左红莉,乔建辉,余长林,胡锴勋,艾辉胜,郭梅 * 军事医学科学院附属医院血液科,北京100071 摘要本研究旨在建立白血病小鼠H-2全不相合微移植模型并进行鉴定。受、供鼠分别为雌性BALB /c 和雄性 C57BL /6J ,H-2为全不相合。受鼠微移植前5d 静脉接种WEHI-3细胞约1?106 个,微移植前3d 开始给予MA 化疗(米托蒽醌+阿糖胞苷),0d 末次化疗后8h 之内回输经G-CSF 动员的供体脾单个核细胞,回输细胞数分别为 (3、6、12)?107 个。化疗对照组用等量生理盐水。所有受鼠不予GVHD 预防。比较各组早期死亡率、白细胞恢复及白血病负荷情况。RT-PCR法检测微移植后供体嵌合率。从临床表现和病理情况综合评价微移植组小鼠GVHD 情况。结果表明,化疗对照组早期死亡率为25%, (3、6、12)?107组分别为16.67%、8.33%、8.33%。(3、6)?107组白细胞恢复明显优于化疗对照和12?107 组(P <0.05)。白血病负荷(3、 6、12)?107组明显低于化疗对照组(P <0.01),而(6、 12)?107组明显低于3?107组(P <0.05)。微移植后供体成分在2周之内以微嵌合形式存在。微移植组小鼠均未发生明显GVHD 证据。结论:成功建立了白血病小鼠H-2全不相合微移植模型,为后续研究及临床微移植相关研究提供了基础。 关键词 白血病小鼠;H-2全不相合;微移植;微移植模型;微嵌合中图分类号R733.7;R332文献标识码A doi :10.7534/j.issn.1009-2137.2014.03.038Establishment and Identification of a H-2Completely Mismatched Microtransplantation Model of Leukemia Mouse WU Hui-Hui ,LIU Tie-Qiang ,SUN Xue-Dong ,HUANG Xiao-Mei ,ZHANG Rui ,LIU Zhi-Qiang , MAN Qiu-Hong ,HUANG Ya-Jing ,SUN Qi-Yun ,ZUO Hong-Li ,QIAO Jian-Hui ,YU Chang-Lin , HU Kai-Xun ,AI Hui-Sheng ,GUO Mei * Department of Hematology ,Affiliated Hospital ,Academy of Military Medical Sciences ,Beijing 100071,China * Corresponding Author :GUO Mei ,Associate Senior Physician.E-mail :guom 196801@aliyun.com Abstract This study was purposed to establish and identify a H-2completely mismatched microtransplantation model of leukemia mouse.The recipients were female BALB /c mice ,while donors were male C57BL /6J mice.Recipients were inoculated intravenously with 1?106of WEHI-3cells ,a cell line of myelomonocytic leukemia.Donors received 100μg /kg G-CSF mobilization through hypodermic injection ,every 12hours ,and it last 5days.Chemotherapy regi-mens was MA (mitoxantrone +cytarabine ),and it last 4days.Recipients were given chemotherapy conditioning without GVHD prophylaxis after inoculation of leukemic cells for 2days ,and within 8hours after last chemotherapy received do-nor mobilized spleen mononuclear cells (sMNC ).The number of sMNC was (3、6、12)?107,respectively.The early death rate ,recovery level of WBC in peripheral blood and leukemia load were compared between chemotherapy and mi-crotransplantation groups.The donor chimerism was detected by RT-PCR.From the clinical manifestation and pathologi-cal features ,the GVHD in recipients was evaluated.The results showed that the early mortality in chemothearpy group was 25%,meanwhile those in the (3、6、12)?107groups were 16.67%、8.33%、8.33%,respectively.The (3、6)?107groups has a stronger hematopoietic recovery capability than that in chemotherapy and 12?107groups (P <0.05).There were more leukemic cells in chemothearpy mice than that in microtransplantation mice (P <0.01),and (12、6)?107groups had lower leukemia load than that in 3?107group (P <0.05).No signs of GVHD were observed in microtrans-plantation mice.The donor microchimerism could be discovered at eraly 2weeks after donor cell transfusion.It is con-cluded that a H-2completely mismatched microtransplantation model of leukemia mouse has been successfully estab-lished ,and it will provide a experimental base for studing microtransplantation in clinic.Key words leukemia mouse ;H-2completely mismatched ;microtransplantation ;microtransplantation model ;mi-crochimerism J Exp Hematol 2014;22(3):779-784 基金项目:国家自然科学基金面上项目(861739);国家自然科学基金重点项目(81130054);首都临床特色应用研究(Z1211070001012082)* 通讯作者:郭梅,副主任医师, E-mail :guom196801@aliyun.com 2014-03-11收稿;2014-03-25接受 · 977·中国实验血液学杂志Journal of Experimental Hematology 2014;22(3):779-784
肿瘤模型我们一般常用的就是小鼠模型和人肿瘤裸小鼠移植瘤模型。其中用得最多的是皮下模型,另外还有腹水(或者尾静脉注射)以及原位模型,其他的模型很少用,就不提他们了。 小鼠模型分三大类:第一类是以S180、EAC、H22 等为代表的,他们的宿主小鼠多选用KM可产生腹水,也可在皮下成瘤。多以腹 水传代,实验时抽取腹水,经过一定稀释后皮下接种构建模型,接踵后第二天开始给药,给药7到10天,接种10天后结束试验,剥取肿 瘤称瘤重。 1.关于构建瘤种 可以用体外细胞株培养后,用PBS悬浮至1~3X 106/mouse,接种 即可,最好用6号左右的针头,就是常用的2ml 一次性注射的针头。 2.关于腹水传代 观察到第一代的种鼠肚子较大后(一般约8~9 天左右),可以传代,传代时取1ml注射器,用2ml注射器的针头,种鼠腹部消毒后直接将针头插入抽取腹水即可,注意不要把针头插得很深,尽量浅一点,还可以把老鼠拎起来,利用重力,让腹水集中在某处便于抽取,一般抽个就可以了,不用离心,直接用P BS3~6倍稀释后,接种到新的老 鼠腹腔,腹水颜色为白色或者略有发黄都是正常的,但是血性腹水说明不好,需要注意调整,第二代以后,尽量6~7 天的时候传代,不要等的时间太久,否则腹水容易血性。三代后可用于试验。 3.关于接种进行试验 这个时候抽取的腹水需要量比较多,一般需要处死种鼠后,小心地用消毒眼科剪刀镊子剥开腹部皮肤,注意不要弄破肌肉,然后,用镊子(最好是哪种前面有倒勾的镊子,学名好像是唇型镊)拎起腹部的肌肉,用剪刀剪开一个小口,然后用玻璃滴管或者去掉针头的注射器吸取腹水。然后进过一定的稀释后,接种到小鼠的腋下。关于稀释量,各个实验室的情况都不一样,最好摸索一下,开始的
白血病是造血组织的恶性增殖性疾病,其特点是骨髓及其它造血组织中大量无核细胞无限制增生,进入外周血液,临床表现以骨髓、脾、肝等造血器官中的白血病细胞恶性增生与肿大,并浸润到全身各组织脏器中,伴有不同程度的贫血、出血、感染发热以及骨骼疼痛。白血病的发病率和死亡率逐年增加,居35岁以下青少年恶性肿瘤的首位。 小鼠(mouse,musculus)属哺乳纲(Mammalia)啮齿目(Rodentia)鼠科(Muridae)动物,在遗传学与造血系统等方面和人类十分相似,因此建立小鼠白血病模型以研究人类白血病的细胞分子生物学特性、生化免疫特征、病理生理改变、发病机制以及药物治疗和预后具有重要意义,本文就白血病小鼠模型的建立与应用现状进行综述。 1 建立白血病模型的小鼠种类 目前最常用于建立白血病模型的有近交系(inbred strain)和突变系(mutant strain)小鼠。 1.1 近交系(inbred strain)小鼠 主要包括:BALB/c小鼠、C57BL小鼠、AKR 小鼠、L615小鼠等。 1.1.1 BALB/c小鼠:基因型为Aabbcc,毛白色,其特征是肝、脾等富于网状内皮细胞的器官所占与体重比值较大。BALB/c小鼠的白血病发病率雌性为12%,雄性为10%,对放射线极度敏感,常用于单克隆抗体和免疫学研究,在白血病研究中较常使用。 1.1.2 C57BL小鼠:基因型为aaBBCC,毛黑色,对Graf?白血病因子较敏感,而对化学致癌物诱导作用敏感性低,但全身经放射线照射后,淋巴瘤发生率可达90%~100%。Noren nystrm等[1]用C57BL/6小鼠建立了T淋巴细胞白血病动物模型来评价血管形成抑制因子TN P2470的抗肿瘤效应。 1.1.3 AKR和 C58自发白血病小鼠:其它近交系小鼠还有AKR和 C58自发白血病小鼠。AKR小鼠最早由洛克菲勒大学随机交配而得,后获得“淋巴瘤病”原种,继而选择培育成白血病高发品系,基因型为aaBBcc,带Thy-la基因,缺乏补体C5,容易诱发免疫耐受性,对白血病因子敏感。当AKR小鼠发育 白血病小鼠模型的建立与应用现状 周晓燕 邹琳★ [摘 要] 小鼠是白血病研究中最重要的动物模型,本文主要综述了白血病小鼠模型的建模方法和研 究进展,以及白血病小鼠模型在医学领域中的应用。 [关键词] 白血病;小鼠;动物模型 Establishment and application of leukemia mouse model ZHOU Xiaoyan,ZOU Lin★ (Center for Clinical Molecular Medicine at Children's Hospital, Chongqing Medical University, Chongqing 400014, China) [ABSTRACT] The mouse is one of the most important animal models in the leukemia study. Here, we mainly reviewed the establishment methods, research progress, and the application of leukemia mice model in the medical ?led. [KEY WORDS] Leukemia; Mouse; Animal model 基金项目:国家自然科学基金(90919013,30871103);重庆市自然科学基金(CSTC2008BB5072,CSTC2010BA5008);教育部“新世纪优秀人才支持计划”(2008-CET) 作者单位:重庆医科大学附属儿童医院临床分子医学中心,重庆 400014 ★通讯作者:邹琳,E-mail: zoulin_74@https://www.doczj.com/doc/0210531042.html, ?综述?
疾病动物模型 1复制方法和应用 动物疾病模型的复制,是用人为的方法,使动物在一定的致病因素(物理的、化学的、生物的)作用下,造成动物组织、器官或全身一定损害,出现某些类似人类疾病的功能、代谢、形态结构方面的变化或各种疾病,通过这种手段来研究人类疾病的发生、发展规律,为研究人类疾病的预防、治疗(包括新药物试用)提供理论依据。所以动物疾病模型的复制,在医学科学研究中占有十分重要的地位。 目前我国生物医学科学研究中,动物疾病模型主要用于三个方面:即实验生物学、实验病理学和实验治疗学(新药筛选亦属于实验治疗学范畴)。由于研究目的不同,对于疾病模型的要求也有所区别。如实验病理学,它着重于研究用某种特定方法复制出某些疾病。整个疾病复制过程,就是它的研究内容,目的是通过疾病的复制去探讨疾病的病因学和发病原。而实验治疗学则完全不同,疾病的复制仅是它研究的开始,因为它的主要目的是为了阐明在该病的发生发展过程中,某些治疗措施或药物的疗效如何。 诱发性动物模型的复制方法不外是用生物的、物理的、化学的和各种环境因子作用于动物而产生。 生物学因素包括细菌、病毒、寄生虫、细胞、生物毒素、激素等各种致病原,通过接种而使正常动物发生疾病。如接种细菌、病毒于敏感动物使其产生各种传染病。目前已知的150余种人畜共患病提供了极有意义的传染病材料。从流行病学、病理学或并发症等不同角度研究,首先要充分了解动物与人在疾病易感性和临床表现等方面的同异处。例如轮状病毒可引起婴儿急性坏死性肠类,犬感染轮状病毒后的表现只是亚临床的。然而严重威胁幼犬的肠道病毒是细小病毒,而人对细小病毒则并不易感。 物理因素是多方面的。例如在机械力作用下产生各种外伤性脑损伤、骨折等模型,气压变动复制高空病、潜水病;温度改变产生各种烧伤和冻伤;放射线照射可复制各型放射病,引起免疫功能抑制或诱发Spragae-Dawley系大鼠乳腺癌;闪光刺激诱发癫痫模型;噪音刺激引起听源性高血压及改变行为记忆功能等。复
第一部分急性髓系白血病(AML)的治疗 一、年龄<60岁,无前驱血液病史患者的治疗 (一)诱导治疗阶段 1.方案:建议采用标准诱导缓解方案,①含Ara-C、蒽环类药物和蒽醌类药物的方案(即DA 3+7方案);②HA(HHT)③以HA+蒽环类药物,如 HAD(DNR)、HAA(阿克拉霉素)等 (1)标准剂量:Ara-C 100-200mg/㎡·d×7d+蒽环类或蒽醌类3d,或+HHT 7(或3)d,可能需要2个疗程 (2)含中大剂量Ara-C:中:1.0-2.0g/㎡每12h1次×6次,+蒽环类和(或)蒽醌类或HHT。DNR 40-45 mg/㎡·d×3d,HHT 2.0-2.5mg/㎡·d×7d(或4mg/㎡·d×3d,米托蒽醌6-10mg/㎡·d×3d 2.诱导治疗过程中方案调整: (1)标准剂量治疗后: ①化疗后第7天查骨髓象: 如果残留白血病细胞明显(≥10%),可考虑双诱导治疗:a.标准剂量Ara-C +蒽环类;b.中剂量Ara-C为基础的联合方案(如FLAG方案:氟达拉滨+Ara-C +G-CSF);c.小剂量(如CAG:G-CSF+Ara-C+阿克拉霉素);d .也可不治疗,单纯观察(尤其在骨髓增生低下)残留白血病细胞<10%且无增生低下可选标准剂量:Ara-C+蒽环类等继续化疗(可与第一个疗程不同);还可联合蒽醌类或HHT、吖啶类、鬼臼类 残留白血病细胞<10%且骨髓增生低下可不再化疗,等随象恢复,此时可给予G-CSF,建议用量:5ug/kg/d(或300ug/d) ②骨髓恢复期:21天复查骨髓象和血常规:a.CR,进入缓解后治疗;b.幼稚细胞比例下降不足60%,按诱导失败对待;c.未CR,但幼稚细胞比例下降超过60%可重复原方案1疗程;d.增生低下,残留白血病细胞<10%时等待骨髓象和血常规恢复;≥10%考虑下一步治疗(参考双诱导或按诱导治疗失败对待)