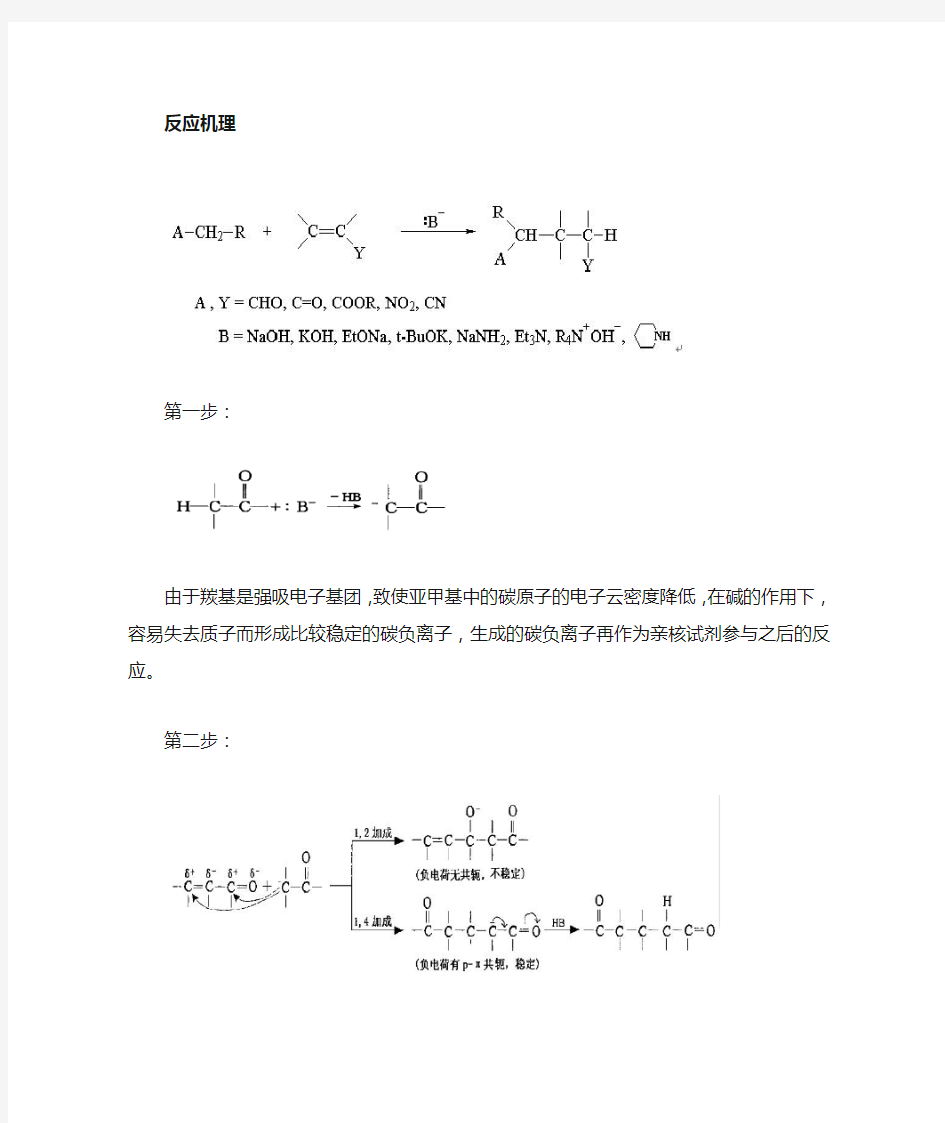

反应机理
第一步:
由于羰基是强吸电子基团,致使亚甲基中的碳原子的电子云密度降低,在碱的作用下,容易失去质子而形成比较稳定的碳负离子,生成的碳负离子再作为亲核试剂参与之后的反应。第二步:
R基是给电子基团,具有+I效应,使π电子云发生偏移。
碳负离子可以有两种进攻方式,即就是进行1,2加成,或是1,4加成,分别是2号,4号位上的C。由产物我们可以知道,1,2加成得到的产物中无共轭效应,氧负离子不能分散,不稳定,而1,4加成得到的产物,有共轭体系,负电荷能被很好的分散,生成比较稳定的碳负离子。所以迈克尔加成反应实际上是不饱和醛、酮的1,4-加成反应。
收稿日期:2002212213;修回日期:2003205215 基金项目:江西省自然科学基金资助项目(9920009) 文章编号:100421656(2003)0620847202 用固体碱催化Michael 加成反应的研究 徐景士,王红明,陈慧宗 (江西师范大学化学学院,江西南昌 330027) 关键词:固体碱;催化;M ichael 反应中图分类号:O62117 文献标识码:A 用固体碱催化Michael 加成反应已有报道[1]。 本文报道用K 2O/γ2Al 2O 3和用微波法制备的K F/ γ2Al 2O 3、MgO/γ2Al 2O 3、MgO/NaY 作为催化剂催化 某些Michael 反应。产物的编号如下: CH 3 C O CH CH CH 3 CH 2 CHO C O OC 2H 5 CH 3 C O CH CH CH 2 CN C O OC 2H 5 CH 2CH 2 CN CH 2CN A B C 1 实验部分 将所用γ2Al 2O 3、NaY 分子筛分别研磨并过(100目)筛,与干燥的MgO 、K F 按一定比例混合研磨混合均匀,分别置于微波炉中加热20min 。一定量的K NO 3与上述粉末混合研磨均匀,置于马弗炉中在737K 焙烧3h 。 100ml 的三颈烧瓶中加入8ml 无水乙醇和1g 催化剂,按等物质的量加入两种反应物,反应温度80℃,一定时刻取样用气相色谱分析(FI D 检测,归一法定量)。 产物B 的分离:反应一定时间后,过滤,取滤液在常压下蒸干2/3的溶液后在余液中加入足量水,有大量晶体析出,静置过夜,过滤,晶体用无水乙醇重结晶。产物归属如下: A :(N o.11708)黄色固体,m.p.93~95℃,IR (K Br )ν:296014,293118,287511(C 2H ),173213,170914,168014(C =O ),145517,133712(C 2H ). B :(N o.11076)白色晶体,m.p.106~108℃,IR (K Br )ν:299014,296313,283512( C 2H ),225011(C ≡N ),173713,170515(C =O ),146412,145114(CH 3),137016(CH 3). C :(N o.5187)无色液体,IR (K Br )ν:297814,293518,287715(C 2H ),225117(C ≡N ),144613,137917(C 2H ). 2 结果与讨论 211 Michael 催化反应 表1为K 2O/γ2Al 2O 3、K F/γ2Al 2O 3和MgO/γ2Al 2O 3催化Michael 反应的结果,产率均达85%以上,特别是乙酰乙酸乙酯与巴豆醛反应生成产物(A ),产率高达96%。并且能使在一般的碱性催化剂催化下不能发生Michael 反应的乙腈能与α,β2不饱和腈发生加成反应,产率,均可达85%以上,乙腈和丙烯腈的反应产率达89%。 表1 K 2O/γ 2Al 2O 3、K F/γ2Al 2O 3和MgO/γ2Al 2O 3催化M ichael 反应的结果 T able 1 Several M ichael reactions catalyzed by K 2O/γ2Al 2O 3、K F/γ2Al 2O 3and MgO/γ2Al 2O 3 Reactants Catalyst React time/h Product Y ield/%A +D K 2O/γ2Al 2O 312E 96A +C K 2O/γ2Al 2O 312F 85B +C K 2O/γ2Al 2O 312G 89A +D K F/γ2Al 2O 312E 82A +C K F/γ2Al 2O 312F 72B +C K F/γ2Al 2O 312G 79A +D M gO/γ2Al 2O 312E 89 A +C M gO/γ2Al 2O 324— —B +C M gO/γ2Al 2O 3 24 —— Reaction tem perature :80℃ 表1显示了MgO/γ2Al 2O 3对乙酰乙酸乙酯与 第15卷第6期2003年12月 化学研究与应用Chemical Research and Application V ol.15,N o.6 Dec.,2003
中国地质大学 姓名:孙旭 班级:031111 学号:20111004203
迈克尔加成反应的初步认识 摘要本文从Michael 反应的发展、反应范围、反应条件、反应历程、反应区的选择性简要叙述Michael addition reactions。 关键词Michael addition reactions 反映的发展 Michael反应是美国化学家Arthur Michael于1887年发现的。早在1883年,Komnenos等人已经报道了第一例碳负离子与α,β-不饱和酯的共轭加成反应 。但是,直到1887年Michael发现使用乙醇钠可以催化丙二酸二乙酯与肉桂酸乙酯的1,4-共轭加成,对该类反应的研究才得以真正发展。此后Michael又系统地研究了各稳定的碳负离子与α,β-不饱和体系进行的共轭加成反应,并在1849年报道了缺电子炔烃也可以
与碳负离子发生类似的反应。几十年来,化学工作者对本反应在有机合成的研究不断深入,反应范围也在不断扩大。本反应在有机合成中用途广泛,有些合成路线复杂、难以合成的化合物,通过本反应可一直被许多具有药理性的物质和天然产物,所以,近年来,对这个仍具有一定生命力的反应的研究十分活跃。 Michael反应是指在强碱作用下稳定的碳负离子与α,β-不饱和羰基化合物共轭加成反应。因此该反应也可以被称为Michael加成反应或者Michael缩合反应,在该反应中可以生成碳负离子的底物被称为Michael 给体,带有与拉电子基团共轭的烯烃或炔烃底物被称为Michael受体,反应产物也被称为Michael加成产物。现在人们把任何带有活泼氢的亲核试剂与活性π-体系发生共轭加成的过程统称为Michael反应。 反应历程及机理 碳-碳双键上有吸引电子的取代基时,其亲电性减弱而亲核性加强,能够接受亲核试剂的进攻。
加成反应 (addition reaction) ?定义 烯烃或炔烃分子中存在 键, 键键能较小,容易断裂形成两个 键。即能在含双键或三键的两个碳原子上各加上一个原子或原子团的反应即为加成反应(多为放热,是烯烃和炔烃的特征反应)。不稳定的环烷烃的开环反应也属于加成反应。 (1)催化加氢 在Pt、Pd、Ni等催化剂存在下,烯烃和炔烃与氢进行加成反应,生成相应的烷烃,并放出热量,称为氢化热(heat of hydrogenation,1mol不饱和烃氢化时放出的热量) ?催化加氢的机理(改变反应途径,降低活化能) 吸附在催化剂上的氢分子生成活泼的氢原子与被催化剂削弱了 键的烯、炔加成。 ?氢化热与烯烃的稳定性 乙烯丙烯 1-丁烯顺-2-丁烯反-2-丁烯 氢化热/kJ?mol-1 -137.2 -125.9 -126.8 -119.7 -115.5 (1)双键碳原子上烷基越多,氢化热越低,烯烃越稳定: R2C=CR2 > R2C=CHR > R2C=CH2 > RCH=CH2 > CH2=CH2 (2)反式异构体比顺式稳定: (3)乙炔氢化热为-313.8kJ?mol-1,比乙烯的两倍(-274.4kJ?mol-1)大,故乙炔稳定性小于乙烯。 ?炔烃加氢的控制 ——使用活性较低的催化剂,可使炔烃加氢停留在烯烃阶段。 ——使用不同的催化剂和条件,可控制烯烃的构型: 如使钯/碳酸钙催化剂被少量醋酸铅或喹啉钝化,即得林德拉(Lindlar)催化剂,它催化炔烃加氢成为顺式烯烃;炔烃在液氨中用金属钠或锂还原,能得到反式烯烃: ?炔烃催化加氢的意义: ——定向制备顺式或反式烯烃,从而达到定向合成的目的; ——提高烷烃(由粗汽油变为加氢汽油)或烯烃的含量和质量。 ?环烷烃的催化加氢 环烷烃催化加氢后生成烷烃,比较加氢条件知,环丙烷、环丁烷、环戊烷、环己烷开环难度依次增加,环的稳定性依次增大。 (2)与卤化氢加成 (a)对称烯烃和炔烃与卤化氢加成对称烯烃和炔烃与卤化氢进行加成反应,生成相应的卤化物:
(0) 回复 1楼 2006-09-09 23:09 举报|个人企业举报垃圾信息举报 雷酸 六年级 9 乙基正碳离子的形成过程中,一个碳原子由sp2杂化转变为sp3杂化,另一个带正电碳原子仍是sp2杂化,它缺电子,有一个空的p轨道。该未杂化的空p轨道与相邻甲基上C-H键几乎平行,空p轨道与C-H键有一定程度的相互重叠,这就是-p超共轭效应 ?超共轭效应的后果 使碳正离子的正电荷分散到相邻的烷基上,增加了碳正离子的稳定性。碳正离子相邻碳原子上烷基越多,超共轭效应越强,碳正离子越稳定。碳正离子的稳定性次序:叔碳正离子(3R+)>仲碳正离子(2R+)>伯碳正离子(1R+)>甲基碳正离子(CH3+)。 (f)马氏规则的理论解释例:丙烯与HX亲电加成 ?用诱导效应解释 甲基有+I效应,使双键电子云向C1偏移,C1比C2有较高电子云密度带负电荷,亲电试剂H+首先进攻C1,生成主要产物2-卤丙烷。
?用共轭较应解释 亲电试剂H+进攻双键上两个碳原子,分别生成CH3CH2CH2+和(CH3)2CH+。(CH3)2CH+稳定性大于CH3CH2CH2+(2R+>1R+),故主要产物是2-卤丙烷。 3)与卤素的加成 ?反应类型离子型反应,中间体是环状溴鎓离子,产物是反式邻二或邻四卤代烃。同时含有双键和三键时,双键首先溴加成。原因:sp杂化更靠近原子核,难于给出电子。 ?应用溴的四氯化碳溶液红色消失,用于含碳碳重键的鉴定(炔反应较慢)。 ?活性次序氟>氯>溴>碘。氟加成过于剧烈,碘加成较困难。 ?环烷烃的加成 ?注意:加成与取代的机理不同 (4)与H2SO4的加成 ?反应烯烃与硫酸加成生成硫酸氢酯(也称烷基硫酸),经酸性水解得到醇。不对称烯烃与硫酸的加成,也符合马氏规则: ?应用 ——工业制备醇的一种方法,称烯烃的间接水合法制醇(或硫酸法)。注意:仅乙烯可得伯醇,其余得仲、叔醇。 ——除去烷烃中少量的烯烃,提高石油产品的质量(硫酸氢酯溶于硫酸,烷烃不溶)。 注:由上式还可见,第二式较易进行 (5)与水的加成 ?烯烃加成及应用 磷酸作催化剂,不对称烯与水加成服从马氏规则: 工业制醇的另一种方法——直接水合法。与间接水合法相比,可减少硫酸对设备的腐蚀。 注意:仅乙烯可得伯醇,其余得仲、叔醇。 ?炔烃加成及构造异构 硫酸汞的硫酸溶液作催化剂,生成中间产物烯醇(羟基与双键碳原子直接相连),它很快重排成醛或酮,例如:
有机反应和反应机理总结
有机反应和反应机理 有机反应:在一定的条件下,有机化合物分子中的成键电子发生重新分布, 原有的键断裂,新的键形成,从而使原分子中原子间的组合发生了变化,新的分子产 生。这种变化过程称为有机反应(organic reaction)。b5E2RGbCAP 一级反应:在动力学上,将反应速率只取决于一种化合物浓度的反应称为一级反 应。 二级反应:在动力学上,将反应速率取决于两种化合物浓度的反应称为二级反
应。p1EanqFDPw 按化学键的断裂和生成分类 协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中 完成的反应称为协同反应。协同反应往往有一个环状过渡态。它是一种基元反应。
DXDiTa9E3d
自由基型反应:由于分子经过均裂产生自由基而引发的反应称为自由基型反应。 自由基型反应分链引发、链转移和链终止三个阶段:链引发阶段是产生自由基的阶 段。由于键的均裂需要能量,所以链引发阶段需要加热或光照。链转移阶段是由一个 自由基转变成另一个自由基的阶段,犹如接力赛一样,自由基不断地传递下去,像一 环接一环的链,所以称之为链反应。链终止阶段是消失自由基的阶段,自由基两两结 合成键,所有的自由基都消失了,自由基反应也就终止了。RTCrpUDGiT 离子型反应:由分子经过异裂生成离子而引发的反应称为离子型反应。离子型反 应有亲核反应和亲电反应,由亲核试剂进攻而发生的反应称为亲核反应,亲核试剂是
1 / 23
对原子核有显著亲和力而起反应的试剂。由亲电试剂进攻而发生的反应称为亲电反 应。亲电试剂是对电子有显著亲合力而起反应的试剂。5PCzVD7HxA 按反应物和产物的结构关系分类 加成反应:两个或多个分子相互作用,生成一个加成产物的反应称为加成反应。 取代反应:有机化合物分子中的某个原子或基团被其它原子或基团所置换的反应称为 取代反应。jLBHrnAILg 重排反应:当化学键的断裂和形成发生在同一分子中时,会引起组成分子的原子 的配置方式发生改变,从而形成组成相同,结构不同的新分子,这种反应称为重排反 应。 消除反应: 在一个有机分子中消去两个原子或基团的反应称为消除反应。
可以根据两个消去基团的相对位置将其分类。若两个消去基团连在同一个碳原子上, 称为 1,1-消除或 α -消除;两个消去基团连在两个相邻的碳原子上,则称为 1,2-消除 或 β -消除;两个消去基团连在 1,3 位碳原子上,则称为 1,3-消除或 γ -消除。其余类 推。xHAQX74J0X 氧化还原反应:有机化学中的氧化和还原是指有机化合物分子中碳原子和其它原 子的氧化和还原,可根据氧化数的变化来确定。氧化数升高为氧化,氧化数降低为还 原。氧化和还原总是同时发生的,由于有机反应的属性是根据底物的变化来确定的, 因此常常将有机分子中碳原子氧化数升高的反应为氧化反应,碳原子氧化数降低的反 应为还原反应。有机反应中,多数氧化反应表现为分子中氧的增加或氢的减少,多数 还原反应表现为分子中氧的减少或氢的增加。LDAYtRyKfE 缩合反应:将分子间或分子内不相连的两个碳原子连接起来的反应统称为缩合反 应。在缩合反应中,有新的碳碳键形成,同时也往往有水或其它比较简单的有机或无 机分子形成。缩合反应通常需要在缩合剂的作用下进行,无机酸、碱、盐或醇钠、醇
2 / 23