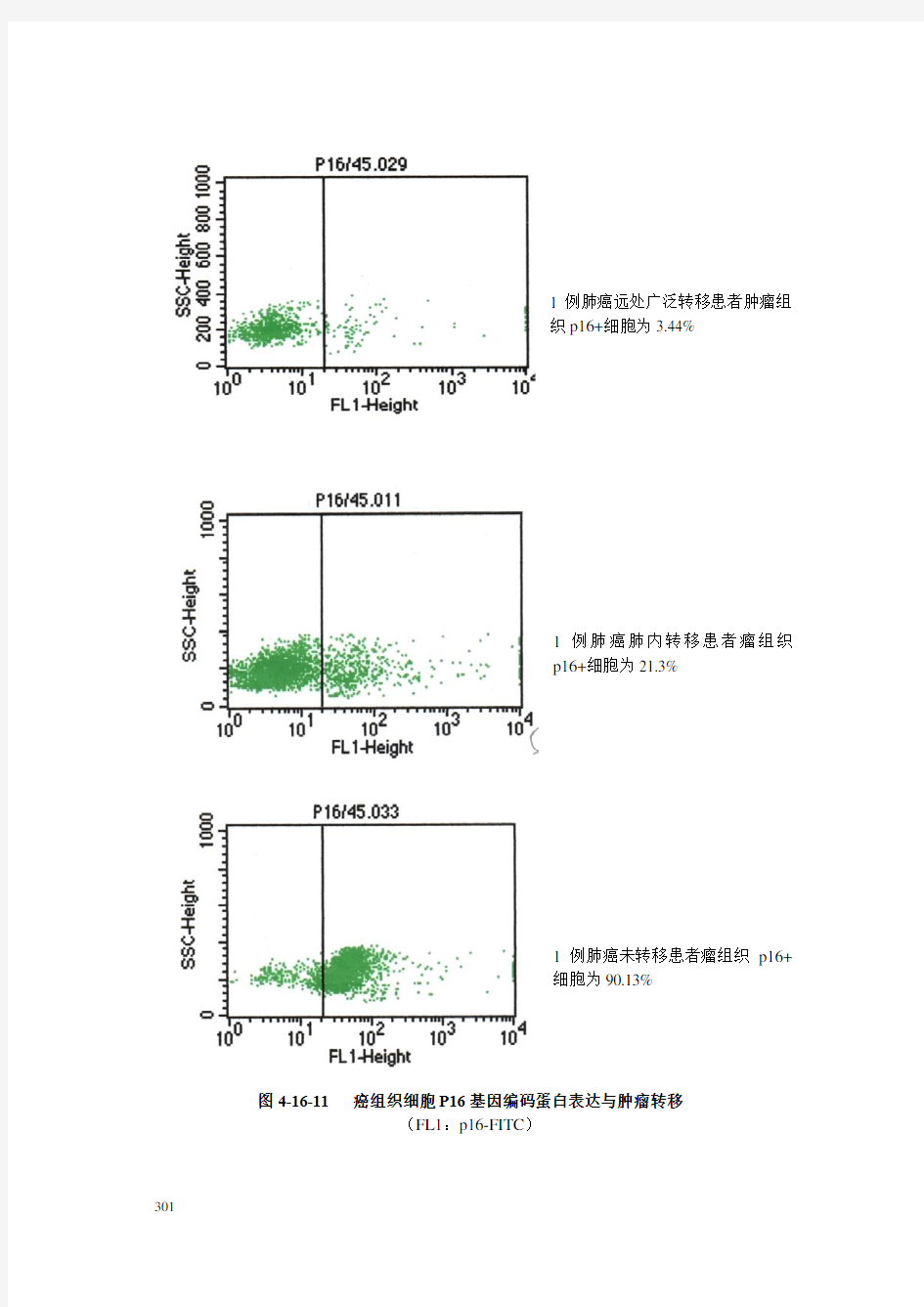
1例肺癌远处广泛转移患者肿瘤组
织p16+细胞为3.44%
1例肺癌肺内转移患者瘤组织
p16+细胞为21.3%
1例肺癌未转移患者瘤组织p16+
细胞为90.13%
图4-16-11 癌组织细胞P16基因编码蛋白表达与肿瘤转移
(FL1:p16-FITC)
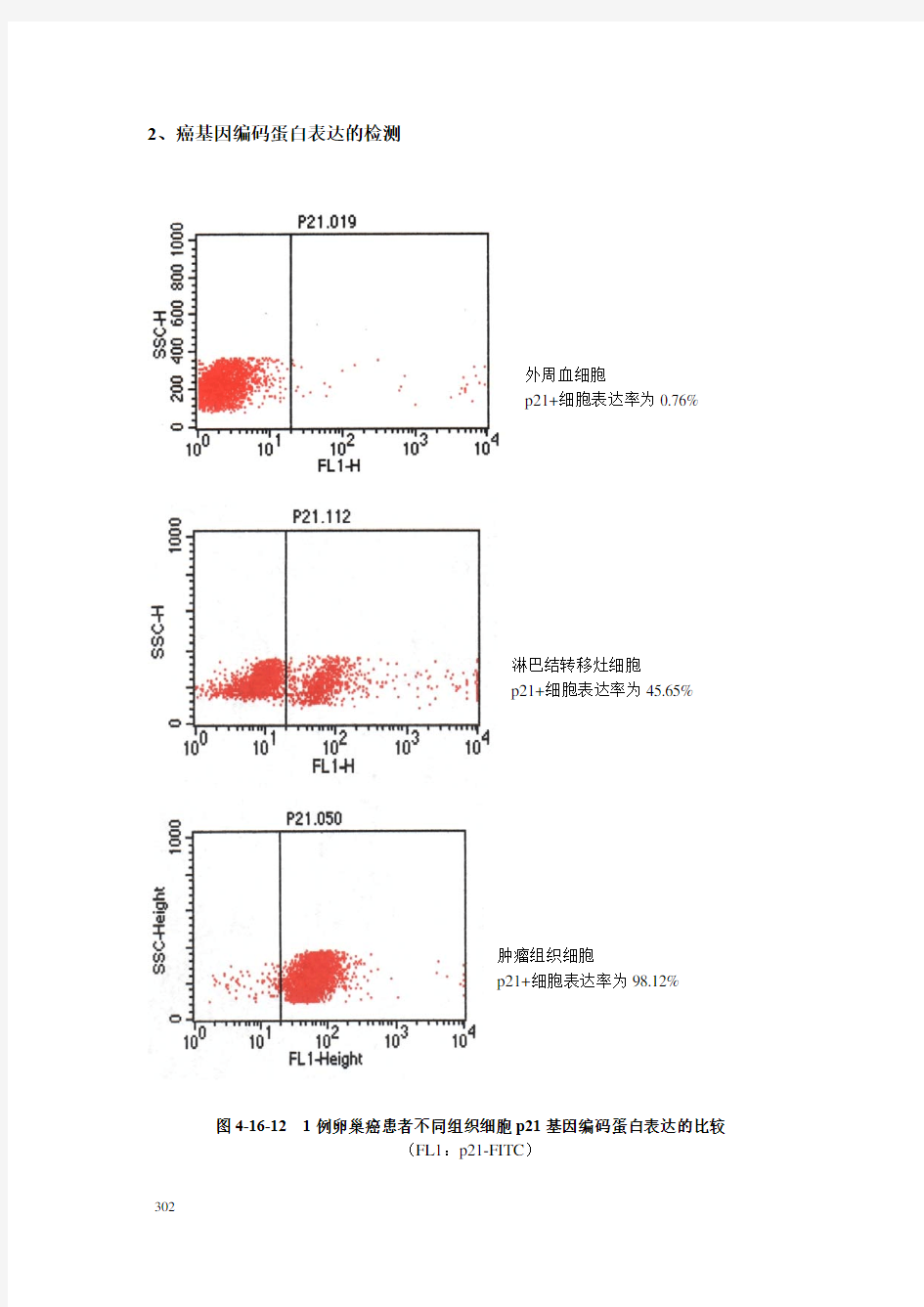
2、癌基因编码蛋白表达的检测
外周血细胞
p21+细胞表达率为0.76%
淋巴结转移灶细胞
p21+细胞表达率为45.65%
肿瘤组织细胞
p21+细胞表达率为98.12%
图4-16-12 1例卵巢癌患者不同组织细胞p21基因编码蛋白表达的比较
(FL1:p21-FITC)
1例胃癌Ⅱ期患者肿瘤组织乳腺癌患者肿瘤组织(1.38%)(4.76 %)
1例卵巢癌患者肿瘤组织1例宫颈癌患者肿瘤组织(39.76%)(69.5%)
1例胰腺癌肝转移患者肿瘤组织结肠癌肺转移肿瘤组织(73.89%)(94.42%)
图4-16-13 不同肿瘤患者癌组织p21基因编码蛋白的表达
(FL1:p21-FITC)
外周血细胞癌旁正常组织
CerbB-2+细胞表达率为7.64% CerbB-2+细胞表达率为12.34%
淋巴结转移灶瘤组织
CerbB-2+细胞表达率为66.74% CerbB-2+细胞表达率为85.79%
图4-16-14 1例卵巢癌患者不同组织CerbB-2基因编码蛋白的表达
(FL1:CerbB-2 -FITC)
1例食管癌患者肿瘤组织1例乳腺癌术后肺转移患者肿瘤组织(3.88%)(13.48%)
1例卵巢癌大网膜转移患者大肠癌淋巴结转移患者
肿瘤组织cerbB-2+细胞为33.13% 肿瘤组织cerbB-2+细胞为55.65%
1例胃癌LNM患者肿瘤组织1例胰头癌肺转移患者肿瘤组织(86.87%)(96.33%)
图4-16-15 各种癌组织细胞CerbB-2基因编码蛋白表达的不同水平
(FL1:CerbB-2 -FITC)
1例胃癌Ⅱ期患者肿瘤组织Bcl-2+
细胞为3.65%
1例胃癌附近淋巴结转移患者肿瘤
组织Bcl-2+细胞为63.64%
1例胃癌肝、肺、骨广泛转移患者
肿瘤组织Bcl-2+细胞为96.68%
图4-16-16 癌组织细胞Bcl-2基因编码蛋白表达与肿瘤转移
(FL1: Bcl-2 -FITC)
1例高分化肺癌组织 1例高分化结肠癌患者肿瘤组织
(14.91%) (18.11%)
1例中分化肺癌患者肿瘤组织 1例中分化结肠癌患者肿瘤组织 (31.55% ) (73.49%)
1例低分化肺癌组织 1例低分化结肠癌组织
(74.48%) (79.33%)
图4-16-17 肿瘤组织细胞BCL-2基因编码蛋白表达与病理分级
(FL1: Bcl-2 -FITC )
3、调整基因编码蛋白的检测
1例胃癌转移患者肿瘤组织1例肝细胞癌转移患者肿瘤组织
(1.24 %)(11.54 %)
1
1例结肠癌患者肿瘤组织1例胃癌患者肿瘤组织
(20.13%)(50.63%)
1例卵巢癌患者肿瘤组织布1例食管癌患者肿瘤组织
(83. 38%)(89. 46%)
图4-16-18 不同癌组织细胞CD44S基因编码蛋白的表达
外
图4-16-19 1例肺癌患者CD44S基因在不同组织中的表达(左:外周血,98.54%;右:肿瘤组织,42.58%)
点
1例直肠癌患者肿瘤组织CD44S+细胞为71.91%
图4-16-20 CD44S基因编码蛋白在组织中表达的不同分析方法(左:散点图,右:直方图)
1例胃癌患者外周血1例肠癌患者肿瘤组织
(3.80%)(2.76%)
1例乳腺癌淋巴结转移患者骨髓组织1例卵巢癌Ⅲ期化疗后患者瘤组织(20.66%)(49.24%)
1例子宫内膜癌Ⅱ-Ⅲ期患者肿瘤组织 1 例卵巢癌手术化疗后复发患者肿瘤组织(66.87%)(98.64%)
图4-16-21 CD44V5基因编码蛋白在各种癌组织细胞中表达
(FL1:CD44V5 -FITC)
1例升结肠癌患者外周血1例子宫内膜癌患者外周血(3.46%)(3.86.%)
1例胃癌患者外周血1例乳腺癌转移子宫内膜癌肿瘤组织(2.87%)(36.47%)
1例子宫内膜癌Ⅱ-Ⅲ级患者瘤组织1例直肠癌腹腔转移患者肿瘤组织(48.86%)(49.76%)
图4-16-22 CD44V6基因编码蛋白在各种肿瘤组织中的表达
(FL1: CD44V6 -FITC)
1例胃癌患者肿瘤组织CD44V6+
细胞为14.52%
1例胃癌淋巴结转移患者肿瘤组织
CD44V6+细胞为28.51%
1例胃癌远处广泛转移患者癌组织
CD44V6+细胞为94.28%
图4-16-23 胃癌患者肿瘤组织CD44V6基因编码蛋白表达与肿瘤转移
(FL1: CD44V6 -FITC)
1例结肠癌患者肿瘤组织
nm23+细胞为16.74%
1例直肠癌患者肿瘤组织
nm23+细胞为45.68%
1例升结回肓部肠癌患者
肿瘤组织nm23+细胞为83.65%
图4-16-24 nm23基因编码蛋白在各种癌组织细胞中的表达
(FL1: nm23 -FITC)
4、多药耐药基因编码蛋白(p170)的表达
外周血样本p170+细胞率为15.32%,平均荧光强度为90
肿瘤组织样本p170+细胞为97.78% ,平均荧光强度为57.6
图4-16-25 1 例卵巢癌患者p170蛋白在外周血及肿瘤组织细胞中的表达
(左:散点图,右:直方图; FL2:p170-PE )
1例小细胞肺癌肿瘤组织p170+细胞表达率为0.59% ,平均荧光强度为3.2
1例原发性肝癌肿瘤组织p170+细胞表达率为8.05%,平均荧光强度为6.0
P
1例非霍杰金淋巴瘤肿瘤组织p170+细胞表达率为49.54%,平均荧光强度为32.3
1例胰腺癌肿瘤组织p170+细胞表达率为99.59%,平均荧光强度为37.9
1例直肠癌肿瘤组织p170+细胞表达率为31.26%,平均荧光强度为56.2
图4-16-26 各种肿瘤组织多药耐药基因(p170)的表达
(左:散点图,右:直方图;FL2:p170-PE)
化疗前p170表达率为17.44%,平均荧光强度为41.8
化疗后1个月p170表达率为50.3%,平均荧光强度为67.0
图4-16-27 1例胃癌患者化疗前后肿瘤活检组织p170蛋白表达的变化(左:散点图,右:直方图;FL2:p170-PE)
化疗前p170表达率为0.53%,平均荧光强度为10.9
图4-16-28 1例非霍奇金淋瘤患者化疗前后骨髓细胞p170蛋白的表达
(左:散点图,右:直方图;FL2:p170-PE)
化疗前p170基因在外周血细胞中的低水平表达(9.98%)
化疗后3个月p170基因在外周血细胞中的高水平表达(97.11%)
化疗后9个月p170基因在外周血细胞中的较高水平表达(43.25%)
图4-16-29 肿癌患者外周血细胞p170基因骗蛋白表达与化疗时间的关系(左:散点图,右:直方图;FL2:p170-PE)
5、Fas基因蛋白的检测.
1例升结肠癌肿瘤组织样本CD95的低水平表达(0.57%)
1例乳腺癌肿瘤组织样本CD95的中水平表达(47.15%)
1例胃癌患者瘤组织样本CD95的高水平表达(68.97%)
图4-16-30 在癌组织细胞中CD95表达的不同水平和不同分析方法
(左:散点图,右:直方图;FL2:CD95-FITC)
流式细胞仪实验方法 一、实验准备 1.标本制备: 2.最小化非特异性结合: 二、凋亡 1.凋亡的检测方法:和其它 2.PI染色法 3.Annexin V 法 4.TUNNEL法 三、细胞因子 1.激活的细胞因子 2.CBA 四、血小板 1.活化 2.活化检测 3.网织血小板 五、红细胞 1.网织红细胞 2.PNH 3.胎儿红细胞 六、肿瘤学 1.DNA 细胞周期 2.蛋白 3.多药耐药 4.微小残留白血病
第一部分标本处理 一、流式细胞术常规检测时的样品制备 (一)直接免疫荧光标记法 取一定量细胞(约1X106细胞/ml),在每一管中分别加入50μl的HAB,并充分混匀,于室温中静置1分钟以上(),再直接加入连接有荧光素的抗体进行免疫标记反应(如做双标或多标染色,可把几种标记有不同荧光素的抗体同时加入),。孵育20-60分钟后,用PBS(pH7.2—7.4)洗1-2次,加入缓冲液重悬,上机检测。本方法操作简便,结果准确,易于分析,适用于同一细胞群多参数同时测定。虽然直标抗体试剂成本较高,但减少了间接标记法中较强的非特异荧光的干扰,因此更适用于临床标本的检测。 (二)间接免疫荧光标记法 取一定量的细胞悬液(约1X106细胞/ml),先加入特异的第一抗体,待反应完全后洗去未结合抗体,再加入荧光标记的第二抗体,生成抗原—抗体—抗抗体复合物,以FCM检测其上标记的荧光素被激发后发出的荧光。本方法费用较低,二抗应用广泛,多用于科研标本的检测。但由于二抗一般为多克隆抗体,特异性较差,非特异性荧光背景较强,易影响实验结果。所以标本制备时应加入阴性或阳性对照。另外,由于间标法步骤较多,增加了细胞的丢失,不适用测定细胞数较少的标本。 二、最小化非特异性结合的方法 1.荧光标记的抗体的浓度应该合适,如果浓度过高,背景会因为非特异性的相互作用的增加而增加。 2.在使用第一抗体之前,将样品与过量的蛋白一起培育,如小牛血清蛋白(BSA),脱脂干奶酪,或来自于同一寄主的正常血清来作为标记的第二抗体。这个步骤通过阻断第一抗体和细胞表面或胞结构的非特异性的交互作用来降低背景。 3.在使用第一抗体之后,将样品与5%至10%的来自于同一寄主的正常血清和作为标记的第二抗体一起培育。这个步骤会减少不必要的第二抗体与第一抗体、细胞表面或胞结构之间的交互作用。 通过用来自于同样的样品的血清稀释标记过的抗体可以略过此步骤。此步骤适用于很多方面,但有时候它也会导致已标记的第二抗体和正常血清中的免疫球蛋白的免疫复合体的形成。这种复合体会优先与一些细胞结构进行结合,或者它们最终会导致期望得到的抗体活性的丢失。 4.使用F(ab’)2片段会使背景决定于第一或第二抗体与FC受体的全分子结合。大多数的第二抗体的F(ab’)2片段容易利用。而第一抗体的F(ab’)2 存在的条件下,将新鲜组织或片段一般是不能利用或很难制作。因此,在NaN 3
1、MFI和GFI的意义? Geo Mean,叫做几何均数(geometric mean),常用于等级资料和对数正态分布资料,和常用的算数均数(mean)的计算方法不同。“ %total或者%gate的结果”代表的是百分率,即细胞占总体细胞或者是门内细胞的百分比;用百分比作为统计指标,适用于荧光表达较强的指标。我看到你的流式图上,检测样本的荧光强度不是很强,属于弱表达的指标,若用百分率统计,就是会失去一部分弱阳性的数据。我建议可以用平均荧光强度(也就是 mean值)作为统计指标,比较荧光强度的变化。 2、FCM检测表达结果到底是用百分比还是MFI?我作出是单峰,原本我觉得用MFI表示较好。但我做的2个蛋白很奇怪,一个表达率高,但MFI值低;另一个表达率低,但MFI值高。我又作了SYBR GREEN 定量PCR,发现mRNA 的表达基本与百分比相符,而与MFI值不太一致。 个人认为如果有明显阴性细胞群和阳性细胞群,应计算百分比;无明显分群,仅荧光强度发生变化的应该用MFI。如果是整体峰移(或者叫单峰),那么根本不存在MFI之外的任何合理的指标,不管MFI跟其它指标吻合度如何,这就是客观数据、客观事实。 3、请问下表中流式细胞仪给出的平均值是什么意思,是怎样得到的,有些文献中提到“fluorescence per cell",是下面的mean值吗,还是要用mean值除以第1栏的细胞数events,才能得到fluorescence per cell ? mean 值就是每个细胞的平均荧光强度,不用再除细胞数。这只是个相对值,如果求绝对值,应用已知荧光剂浓度值对应仪器给出的mean值,做标准曲线。以后你得到的mean值,就可以根据这条标准曲线查出真正的荧光浓度值。
流式细胞术 FCM 介绍及简易操作步骤 分享 首次分享者:☆秋秋☆已被分享29次评论(0)复制链接分享转载举报一. 流式细胞术概述 流式细胞术(Flow Cytometry, FCM)是七十年代发展起来的高科学技术,?它集计算机技术、激光技术、流体力学、细胞化学、细胞免疫学于一体,同时具有分析和分选细胞功能。它不仅可测量细胞大小、内部颗粒的性状,还可检测细胞表面和细胞浆抗原、细胞内DNA、RNA含量等,可对群体细胞在单细胞水平上进行分析,在短时间内检测分析大量细胞,并收集、储存和处理数据,进行多参数定量分析; 能够分类收集(分选)某一亚群细胞,分选纯度>95%。在血液学、免疫学、肿瘤学、药物学、分子生物学等学科广泛应用。 国内使用的流式细胞仪主要由美国的两个厂家生产: Becton-Dickinson公司(简称B-D公司)和BECKMAN- COULTER公司。流式细胞仪主要有两型:临床型(又称小型机、台式机)和综合型(又称大型机、分析型)。B-D?公司最新产品为FACS Vantage和FACS Calibur。BECKMAN-COULTER公司最新产品为EPICS ALTRA和EPICS XL/XL-MCL。EPICS XL/XL-MCL和FACS Calibur是临床型;EPICS ALTRA 和 FACS Vantage是综合型,除具备检测分析功能外,还具有细胞分选功能,?多用于科学研究。 二.流式细胞仪主要技术指标 1.流式细胞仪的分析速度: 一般流式细胞仪每秒检测1000~ 5000个细胞,大型机可达每秒上万个细胞。2.流式细胞仪的荧光检测灵敏度:一般能测出单个细胞上<600个荧光分子,两个细胞间的荧光差>5%即可区分。 3.前向角散射(FSC)光检测灵敏度:前向角散射(FSC)反映被测细胞的大小,一般流式细胞仪能够测量到0.2μm~0.5μm。 4.流式细胞仪的分辨率:通常用变异系数CV值来表示,,一般流式细胞仪能够达到<2.0%,这也是测量标本前用荧光微球调整仪器时要求必须达到的。 5.流式细胞仪的分选速度:一般流式细胞仪分选速度>1000个/秒,分选细胞纯度可达99%以上。 三.流式细胞仪主要构造和工作原理流动室及液流驱动系统 流式细胞仪主要由以下五部分构成:①流动室及液流驱动系统②激光光源及光束形成系统③光学系统④信号检测与存储、显示、分析系统⑤细胞分选系统。 流动室(Flow Cell或Flow Chamber)是流式细胞仪的核心部件,流动室由石英玻璃制成,单细胞悬液在细胞流动室里被鞘流液包绕通过流动室内的一定孔径的孔,检测区在该孔的中心,细胞在此与激光垂直相交,在鞘流液约束下细胞成单行排列依次通过激光检测区。流动室里的鞘液流是一种稳定流动,控制鞘液流的装置是在流体力学理论的指导下由一系列压力系统、压力感受器组成,只要调整好鞘液压力和标本管压力,鞘液流包绕样品流并使样品流保持在液流的轴线方向,能够保证每个细胞通过激光照射区的时间相等,从而使激光激发的荧光信息
细胞分选的简要操作步骤 一、上样前的准备 FACSCalibu可以分选细胞进行培养或功能性研究,而这些研究需要清洁环境以保持分选后细胞不受污染继续培养,因此在样本制备,上机检测分选等过程中需严格按无菌技术操作。 1、应用无菌技术制备下列无菌工作液。 3L 70%乙醇(用无菌蒸馏水配制) 5L无菌蒸馏水 5L无菌PBS 2、在干净的鞘液筒中加入3L 70%乙醇。盖紧盖子,振摇鞘液筒,确保桶内壁被乙醇充分洗 涤。安好鞘液筒。 3、将过滤器短接,否则乙醇将破坏滤膜。。 4、用70%乙醇冲洗收集管接口处,并喷洒进样口处的空气。 5、在收集管接口处安装2支BD 50ml收集管(若不使用浓缩器)。 6、放上一支装有70 %乙醇的进样管。 7、设分选门(画一个空门使机器进行分选操作)。 9、从Acquire menu选择SortSetup。在Sort Gate菜单中选择步骤7设定的分选门。按液流控制 键RUN。 10、在Setup 方框中打叉,点击Acquisition Control 菜单中Acquire。。 11、跑乙醇直至2支收集管注满(每管注满需要9min ),点击Pause, Abort。 12、再重复上述步骤2次,共需要1h。 13、断开鞘液筒,在鞘液筒中加入500mL无菌蒸馏水,振摇鞘液筒,倒掉液体,反复操作直 至洗净桶内壁残余乙醇。 14、在鞘液筒中加入3L无菌蒸馏水,盖紧盖子。安好鞘液筒。 15、在收集管接口处安装2支新的收集管。 16、放上一支装有无菌蒸馏水的进样管。 17、点击Acquisition Control 菜单中Acquire。 18、跑无菌蒸馏水直至2支收集管注满(每管注满需要9min),点击Pause Abort。 19、再重复上述步骤2次,共需要1h。 20、断开鞘液筒,在鞘液筒中加入3L无菌PBS盖紧盖子。安好鞘液筒。 21、在收集管接口处安装2支新的收集管。 22、放上一支装有无菌PBS的进样管。 23、点击Acquisition Control 菜单中Acquire。 24、第一支收集管(最左)中收集15 mL PBS后取下,使PBS由左至右流入下一收集管。重复 操作至2个管都收集了15 mL PBS为止。点击Pause, Abort。 25、在收集管接口处安装2支新的收集管。若要分选动物细胞,则应用无菌技术,用无菌 PBS4 % BSA缓冲液过夜包被50mL锥型管,将包被好的锥型管安置于收集接口。 26、按下述分选步骤分选样本 二、分选细胞
「实验笔记」流式细胞术实验过程中的操作要点 流式细胞术可以同时分析单个细胞的多个参数。目前广泛应用于细胞表面和细胞内分子表达特征的分析,界定不同种类的细胞群,测定分离出的亚类纯度,分析细胞的大小和总量等方面,在流式流式细胞术实验过程中,以下操作要点一定要注意,避免影响实验结果。 1、上机前处理 小心荧光淬灭 操作时必须严格按照孵育时间,如果抗体孵育时间过长,荧光是会逐渐淬灭的。那如果不得不推迟实验怎么办?可以把试管放在冰里面,这样会稍稍延长淬灭的时间。
注意染色顺序 在进行多荧光染色的时候,相同的细胞会因为染色顺序不同而导致荧光强度的差异。解决办法为:预实验。做一系列的不同染色顺序的样本,通过对染色前和染色后的各种样本进行比较分析,判断染色顺序对细胞造成的影响。 选好染色方案 染色方案不合理也可能会导致荧光染色信号太弱。解决的方案:预实验。在正式开始实验之前,通过预实验,设计出一个完美的染色方案。(考虑试剂种类,试剂质量,试剂用量,孵育时间,洗涤次数,染料浓度,染色时间及染色温度等其他因素。) 做好阴性对照及同型对照试验 细胞阴性对照可以显示细胞基准的荧光水平。 同型对照则是为了查看抗体非特异性结合的水平。选择同型对照需要注意采用相同物种、相同亚类、相同染料、相同浓度,否则,检测的时候会出现乱七八糟的同型对照结果。
选择合适的抗体 通用原则是:为表达最弱的抗原选择染色指数最高的荧光素。根据使用的流式细胞仪性能、激光器、滤光片种类来选择。对于多色实验,需选择发射光谱重叠小的染料。 2、参数设定 数据的获取必须是在仪器性能的校准均合格的基础上进行。仪器散射光和荧光信号的光电倍增管电压、增益、颜色补偿等参数的设定会直接影响结果。 电压 电压的调节需根据阴性对照管来调节。
流式检测细胞凋亡 Annexin V 检测细胞凋亡 (2) 实验原理 (2) 实验用品 (2) 操作步骤 (3) Annexin V Blocking (5) 凋亡细胞的DNA 断裂片段分析 (7) 实验原理 (7) 实验用品 (8) 操作步骤 (9) BrdU Flow Kits 检测细胞增殖 (12) 实验原理 (12) BrdU Flow Kits 试剂盒 (12) 结果分析 (17) 流式仪器设置指南 (18) 线粒体膜电位变化检测细胞凋亡 (22) 实验原理 (22) 实验用品 (22) 样本制备 (23) 结果分析 (24) 注意事项 (24) Active Caspase-3 检测细胞凋亡 (26) 实验原理 (26) 实验步骤 (27) 结果分析 (28)
Annexin V 检测细胞凋亡 实验原理 Annexin V 是检测细胞凋亡的灵敏指标之一。它是一种磷脂结合蛋白,可以与早期凋亡细胞的胞膜结合,而细胞质膜的改变是细胞发生凋亡时最早的改变之一。在细胞发生凋亡时,膜磷脂酰丝氨酸(PS) 由质膜内侧翻向外侧。Annexin V 与磷脂酰丝氨酸有高度亲和力,因而与细胞外侧暴露的磷脂酰丝氨酸结合。由于在发生凋亡时,磷脂酰丝氨酸外翻的发生早于细胞核的改变,因此,与DNA 碎片检测比较,使用Annexin V 可以更早地检测到凋亡细胞。因为细胞坏死时也会发生磷脂酰丝氨酸外翻,所以Annexin V 常与鉴定细胞死活的核酸染料(如PI 或7-AAD)合并使用,来区分凋亡细胞(Annexin V+/核酸染料-) 与死亡细胞(Annexin V+/核酸染料+)。 实验用品 1. 一次性12×75mm Falcon试管。 2. PBS缓冲液:含0.1%NaN ,过滤后2-8°C保存。 3 3. 微量加样器和加样头。
图4-8-42 B系恶性淋巴瘤患者化疗中骨髓的细胞凋亡 (巨大细胞凋亡峰,20.23 %;伴异倍体) ③体腔液细胞凋亡检测 图4-8-43 1例胃恶性淋巴瘤合并白血病患者化疗及放疗后脑脊液细胞的凋亡 (较小细胞凋亡峰,12.72 %;伴异倍体) 图4-8-44 1例卵巢恶性肿瘤患者腹水细胞的凋亡 (较大细胞凋亡峰,16.55 %;伴异倍体)
④转移淋巴结的细胞凋亡检测 图4-8-45 1例食管中段癌患者食管旁转移淋巴结的细胞凋亡 (较小细胞凋亡峰,2.83 %;伴异倍体) ⑤癌组织的细胞凋亡 图4-8-46 1例胃癌患者化疗后癌组织细胞的凋亡 (明显细胞凋亡峰,13.44%) 图4-8-47 1例左乳腺癌患者癌组织细胞的凋亡 (明显凋亡细胞峰,4.80 %;伴异倍体)
⑥培养细胞的细胞凋亡 图4-8-48 家兔血管内皮细胞在药物浓度5.0μU / ml培养3h后的凋亡 (小细胞凋亡峰,21.43%) 图4-8-49 家兔血管内皮细胞在药物浓度12.5μU / ml培养3h后的凋亡 (较大细胞凋亡峰,46.23%) 图4-8-50 家兔血管内皮细胞在药物浓度20μU / ml培养3h后的凋亡 (巨大细胞凋亡峰,63.70%)
图4-8-51 SGC-7901细胞(胃癌细胞株)在呋尿嘧啶处理前的细胞凋亡 (小凋亡细胞峰,1.05%) 图4-8-52 SGC-7901细胞(胃癌细胞株)在呋尿嘧啶处理后12h的细胞凋亡 (较大细胞凋亡峰,6.55%) 图4-8-53 SGC-7901细胞(胃癌细胞株)在呋尿嘧啶处理后24h的细胞凋亡 (大细胞凋谢亡峰,37.49%)
一、开机程序: 1.检查鞘液桶和废液桶。确认鞘液充满状态(鞘液为鞘液桶体积的3/4位 置,可以连续工作3个小时左右)、盖紧黑盖、管道畅通、废液桶有足 够空间容纳本批标本排弃的废液。如果要添加鞘液,要先释放鞘液桶中 气压。 2.依次打开流式细胞仪FACSCalibur稳压器、主机开关、电脑开关,打印 机。 3.气压阀置于加压位置,待流式细胞仪处于STANDBY状态,做Prime,以 排除管路中气泡。 二、运行FACSComp软件、检查仪器状况 1.制备三色标准微球样本。一般情况向1ml鞘液(或过滤PBS)中加入 1滴质控小微球,也可以根据实际情况调节浓度。 2.机器预热5 min,打开FACSComp软件,选择保持路径。选择所需校 正内容,如果使用的微球是新一批产品要输入微球的批号。 3.在软件界面左侧Assay Selection选项中选择质控类型,即实验过 程中是否需要清洗样品。 4.上样品,微球溶液上样之前要充分混匀。功能键设置在“RUN”。 5.仪器自动检查,并做电压、补偿等设置。 6.FACSComp软件运行完毕,显示结果通过测试。 7.做Set up。 8.打印校正结果,退出FACSComp程序。 备注:在质控过程中,如果提示收集细胞速度慢可以提高细胞收集速度,但是在调节灵敏度(Sens)时,一定要用“Low”的状态上样,保证仪器灵敏度的准确。在使用仪器过程中要养成好的习惯,在上样品过程中,仪器保持在“Low”“Standby”状态。 三、样品分析软件:CellQuest Pro 软件,选择“联机”。 1.
(2)对实验样本进行命名; (3)对实验通道进行预设(FSC,SSC,FL1-FL4)。 备注:如果界面被关闭,重新调出步骤: 2.调出质控模板。 3.画图 选择画图工具(一般选择散点图),Inspect 界面会自动弹出,对几个常用选项进行设定:将散点图选中(用鼠标点击散点图边框才能够 选中图形),将 更改横纵坐 备注:第一个散点图横坐标为FSC,纵坐标为SSC 。 (1一般获取10000个细胞。 (2 ( 3)将所有补偿调为0 (4)将非 52 (5)FSC和SSC (6 4.上阴性对照 将阴性对照管混匀,上机,功能键设置在“RUN”,散点图出现细胞信 号,第一个图:让细胞信号出现在自己看上去舒服的区域;其他三个 散点图,要将细胞信号调整到阴性区域,即左下角区域。通过移动通
流式细胞术检测淋巴细胞表面标记 一、实验目的 1.了解流式细胞仪的组成、原理及应用:初步了解流式细胞仪的工作元件及基本应用原理;能够认识流式细胞术的应用,特别是常用的一些功能。 2. 熟悉用流式细胞术检测小鼠脾脏T细胞表面标志的基本流程 3. 学习并掌握流式细胞术结果的分析:能够基本看懂结果图,重点掌握“门”和“补偿”两个概念。 二、实验原理 1.流式细胞术(Flow Cytometry, 简称FCM)是一种可以快速、准确、客观,并且同时检测单个微粒(通常是细胞)的多项特性(多参数)的技术,同时可以对特定群体加以分选。 特点:可检测的样本种类多样,大小范围较广(0.2~50μm);检测速度快,分析样本量大(快速、大量);细胞及细胞器或微粒的结构及功能不被破坏;采用激光作为激发光源,保证其具有更好的单色性与激发效率;利用荧光染料与单克隆抗体技术结合的标记技术,保证检测的灵敏度和特异性;用计算机系统对流动的单细胞悬液中单个细胞的多个参数信号进行数据处理分析,保证了检测速度10000个细胞(微粒)/秒与统计分析精确性。 2. 流式细胞仪组成及原理 Fluidics (液流系统)——流体动力学聚焦样本形成单细胞流。 鞘液是辅助样本流被正常检测的基质液。主要作用是包裹样本流的周围,保持样本流中细胞处于喷嘴中心位置,防止其靠近孔壁而阻塞喷孔。匀速流动,保证每个细胞通过激光照射区的时间相等,从而得到准确的细胞荧光信息。 Optics (光学系统)——激发和收集光信号。 激发系统包括:激光器、透镜和反射镜,将激光聚焦到检测区 收集系统包括:光学镜片和滤光片、光信号检测器 流式细胞仪收集的信号:(1)散射光信号:细胞在液柱中与激光束相交时向周围360°立体角方向散射的光线信号,它的强弱与细胞的大小、形状、胞内颗粒折射等有关,主要分为前向散射光(信号强弱与细胞体积大小成正比)和侧向散射光(检测细胞粒度和细胞内相对复杂性)。FS-SS图可对未染色的活细胞进行分析或分选,但不能分析表面分子(2)荧光信号:荧光信号由被检细胞上标记的特异性荧光染料受激发后产生,发射的荧光波长与激发光波长不同;每种荧光染料会产生特定波长的荧光和颜色,通过波长选择通透性滤片,可将不同波长的散射光和荧光信号区分开,送入不同的光电倍增管;选择不同的单抗及染料就可同时测定一个细胞上的多个不同特征。 Electronics (电子系统)——数据处理系统,扩大信号,将光信号转化为电信号,处理信号并存储于电脑。 3.流式步骤 第一步:用带有不同荧光基团的抗体分别识别并结合细胞上不同抗原(染色);第二步:带有荧光的细胞一个接一个通过激光;第三步:不同荧光基团有不同发射光谱,荧光染料选择原则:必须能够被流式细胞仪上所配备的激光器所激发、激发光谱必须在仪器上滤光片能够接受的合适范围内、荧光素光谱的重叠应当尽量减少;第四步:复杂的荧光信号被不同分色镜和滤光片分解;第五步:光电倍增管(PMT)将光信号变成电信号;第六步:模数变换器(ADC)进一步将模拟信号变成计算机能处理的数字信号 4.分选基本原理
2.2.2.5 流式细胞术检测细胞周期 2.2.2.5.1 实验原理 用流式细胞仪检测细胞周期,通常用碘化丙啶(propidium iodide,PI)染细胞核。PI在一定波长的光下发出荧光,其强度与DNA含量成正比。通过流式细胞仪分析各时期的细胞百分数,可检测细胞的增殖、凋亡。 2.2.2.5.2流式细胞仪检测A549细胞周期步骤 收集对数生长期细胞,计数,以(1~5)×105/孔接种于6孔板,置37℃,5%CO2条件下培养过夜,使细胞贴壁。次日更换培养液,各孔分别加入含有0、80、400、2000、10000 mg/L不同浓度茶氨酸的细胞培养液2 mL/孔,继续常规培养;每24 h同法换液一次。每个浓度设3个重复。 48 h后,中止培养,胰酶消化后,收集细胞于流式管1000 r/min离心5min,弃上,冷PBS洗涤细胞3次,离心去上清; 一边震荡一边向细胞沉淀中加入70%预冷乙醇混匀,4℃固定18 h以上;离心,弃去乙醇上清,加入预冷的PBS洗沉淀1次,离心去上清; 加入RNA酶(50 mg/L)10 μL/孔和PI(50 mg/L)300 μL/孔,震荡混匀。室温、避光反应30 min; 流式细胞仪进行DNA检测,用Modifit软件分析各时相细胞周期的比例。 2.2.2.6流式细胞仪检测A549细胞凋亡 2.2.2.6.1实验原理 在正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧。AnnexinV 是一种分子量为35~36 kD的Ca2+依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。因此AnnexinV被作为检测细胞早期凋亡的灵敏指标之一。 碘化丙啶(PI)是一种核酸染料,它不能透过完整的细胞膜,但对凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核染红。因此将AnnexinV与PI匹配使用,就可以将处于不同凋亡时期的细胞区分开来。 2.2.2.6.2 结果判断 凋亡细胞对所有用于细胞活性鉴定的染料如PI 有抗染性,坏死细胞则不能。 细胞膜有损伤的细胞的DNA 可被PI着染产生红色荧光,而细胞膜保持完好的细胞则不会有红色荧光产生。因此,在细胞凋亡的早期PI 不会着染而没有红色荧光信号。正常活细胞与此相似。在双变量流式细胞仪的散点图上,左下象
流式细胞术实验方法 PI 染色操作步骤 1、将单细胞悬液加入2ml圆底离心管中,离心,1500rpm , 5min,弃上清液。 2、加入PBS 1ml离心洗涤1次,弃上清。 3、加入2ml预冷的70%酒精,4℃固定30min,或是-20℃固定过夜。 4、离心,弃上清液。 5、用1×PBS 1ml洗涤1次,离心。 6、加入RNase A (工作浓度20ug/ml)于500ul 1×PBS中,37℃孵育30min,离心。 7、用1×PBS 1ml洗涤1次,离心。 8、加入PI(工作浓度50ug/ml) 于500ul 1×PBS中,室温避光孵育30min。 9、混匀,过300目筛网,置流式管中, 4℃冰箱保存,待测。 GFP PI染色操作步骤 1、将单细胞悬液加入2ml圆底离心管中,离心,1500rpm , 5min,弃上清液。 2、加入PBS 1ml离心洗涤1次,弃上清。 3、加入2ml预冷PFA,PFA的浓度根据细胞的特点进行调节,4℃固定30min。 以下步骤同PI 染色操作步骤的(4-9) 细胞表面直接免疫荧光染色操作步骤 1、将单细胞悬液加入2ml圆底离心管中,离心,1500rpm , 5min,弃上清液。 2、以冷PBA 1ml,离心洗涤,弃上清液。 3、加入用PBA稀释的荧光素标记的抗体200ul。用微量移液器轻轻吹打混匀,4℃或置冰上孵育30min-1h。 4、离心弃上清液。 5、加入冷PBS1ml,离心洗涤2次,以除去未结合的多余抗体成分。 6、向细胞中加入冷PBS 500ul,吹打混匀,置流式管中,4℃避光保存,待测。 细胞表面间接免疫荧光染色操作步骤 1-2、同细胞表面直接免疫荧光染色操作步骤 3、用PBA稀释的第一抗体200ul,对照管加入对应于一抗的正常实验动物IgG,轻轻吹打混匀,4℃或置冰上孵育1、5-2h。离心,弃上清。 4、 BS1ml离心洗涤1次,以去除多余的未结合的特异性抗体。 5、 PBA适当稀释的荧光素标记的第二抗体200ul。吹打混匀,4℃或置冰上孵育30min,避光。 6、 PBS 1ml离心洗涤2次。
流式细胞仪的使用方法及相关资料 仪器名称:流式细胞仪 生产厂家:美国贝克曼库尔特有限公司 使用方法: 一.开机程序 1.检查稳压器电源,打开电源,稳定5分钟。 2.打开储液箱,倒掉废液, 并在废液桶中加入400ml漂白水原液。打开压力阀,取出鞘液桶,将鞘液桶加至4/5满(一般可用三蒸水,做分选必须用PBS或FACSFlow),合上压力阀。确实盖紧桶盖,检查所有管路是否妥善安置。 3.将FACSCalibur开关打开,此时仪器功能控制钮的显示应是STANDBY,预热5-10分钟。排出过滤器内的气泡。 4.如果需要打印,打开打印机电源。 5.打开电脑,等待屏幕显示出标准的苹果标志。 6.执行仪器PRIME功能一次,以排除Flow cell中的气泡。 7.分析样品时,先用FACAFlow 或PBS进行HIGH RUN约2分钟。 做过分选后,每次开机后需冲洗管道:向分选装置上装上两个50ml离心管,不接通浓缩系统,摁下右下角白色按钮开始冲洗。待自动停止后接通浓缩装置,同上法冲洗一次。 二.预设获取模式文件(Acquisition Template Files) 1.从苹果标志中选择CELLQuest见一个新视窗,可利用此视窗编辑一个获取模式文件。 2.选取屏幕左列绘图工具中的Dot plot,绘出一个或多个Dot Plots(点图)。从Dot Plot对话框中选取Acquisition作为图形资料来源,并确定适当的x轴和y轴参数。 3.选取屏幕左列绘图工具中的Histogram,同上法可绘出Histogram(直方图)。4.将此视窗命名后储存于FACStation G3\BD Applications \CELLQuest Folder \EXP文件夹中,下次进行相同实验时可直接调用。 本计算机中已设定两个模式文件:ACQ和EXP,储存于FACStation G3\BD Applications \CELLQuest \EXP文件夹中,ACQ用于细胞DNA检测,EXP用于细胞表面标志分析。 三.用CELLQuest进行仪器的设定和调整 1.从苹果画面中选取CELLQuest,进入CELLQuest后在File指令栏中打开合适的获取模式文件。 2.从屏幕上方Acquire指令栏中,选取Connect to Cytometer(快捷键:+B)进行电脑和仪器的连机。将出现的Acquisiton Control对话框移至合适位置。3.从Cytometer指令栏中,开启Detectors/Amps、Threshold、Compensation、Status 等四个对话框,并将它们移至屏幕右方,以便获取数据时随时调整获取条件。也可以用+1,2,3,4获得此四个对话框。 4.在Detectors/Amps对话框中,先为每个参数选择适当的倍增模式(amplifier mode):线性模式Lin或对数模式Log。一般进行细胞表面抗原分析如分析外周
1、流式细胞术(英文flow cytometry)是一种生物学技术,用于对悬浮于流体中的微小颗粒进行计数和分选。这种技术可以用来对流过光学或电子检测器的一个个细胞进行连续的多种参数分析。 目录 * 1 原理 * 2 流式细胞仪(flow cytometer) * 3 应用 * 4 参见 原理 一束单色光(通常是激光)照到流体力学聚焦的一股流体上。若干个检测器瞄向流束和激光相交的这个点,其中一个和激光在同一直在线(称作前散射(FSC)),其它几个和激光垂直(旁散射(SSC)和一个或几个荧光监测器)。当每个悬浮颗粒通过光束时会按某种方式把光散射,同时所带有的荧光化合物被激发并发射出频率低于激发光的荧光。这些散射光和荧光的组合数据被检测器记录,根据各检测器亮度的波动(每个细胞会显出一个散射或荧光的峰)就能够推算出每个颗粒的物理和化学性质。前散射与细胞体积相关,而旁散射取决于颗粒的内部复杂程度(比如核的形状、胞质内颗粒的种类或者末的粗糙程度)。 可以检测的参数有: 细胞的体积和形态复杂程度、细胞中的色素、DNA(细胞周期分析、细胞动力学、细胞增殖等)、RNA 染色体分析和分选(文库构建、染色体涂染)、蛋白质、细胞表面抗原(CD标记)、胞内抗原(各种细胞因子(cytokine)、次级媒介等)、核抗原、酶活性、pH,胞内离子化的钙、镁,膜电势、膜流动性细胞凋亡(apoptosis)(定量检测DNA降解、线粒体膜电位、通透性变化)、细胞存活能力、监测细胞电通透性、氧爆作用(oxidative burst) 、研究癌细胞中的多重耐药性(multi-drug resistance, MDR) 、谷胱甘肽、各种组合(DNA/表面抗原等等) 流式细胞仪(flow cytometer) 流式细胞仪又称荧光激活细胞分选器、荧光活化细胞分类计(FACS,Fluorescence Activated Cell Sorter)。现代的流式细胞仪每秒可以实时检测几千个颗粒,并且可以主动分离具有不同特性的颗粒。 流式细胞仪和显微镜比较像,但能够对大量的单个细胞利用一组参数进行高通量的自动量化。固体组织需要在检测前制备成单细胞的悬浮液。 一个流式细胞仪包括五个组成部分: * 细胞流动系统:液流(鞘液(sheath fluid))携带细胞,使颗粒以串流形式通过光束。 * 光源:有通常的灯(汞或氙)、高功率水冷的激光源(氩、氪、染料激光)、低功率气冷激光(氩(488nm),红氦氖(633nm),绿氦氖,氦镉(紫外))、偶极激光(蓝、绿、红、紫)。 * 检测和模数转换(analogue-to-digital conversion, ADC)系统:产生前散射、旁散射光和荧光的信号。 * 放大系统,线性或对数放大。 * 计算机,用于分析信号。 早期的流式细胞仪主要是实验设备,但目前仪器和相关的试剂有了很广的市场。不同厂商的仪器特性也不同,主要的厂商和品牌如下: * Beckman-Coulter (ex-Coulter): Epics XL/XL-MCL; Epics Altra (Hypersort) (IBM-PC compatible platforms) * Becton, Dickinson: (FACS's): FACSCAlibur, FACScan, FACSort, FASCSVantage (Mac OS platform) FACS Canto, LSRII, Aria, DiVa (PC PLatform) * Cytomation: MoFlo, Cyan (IBM-PC platform) * Partec/Dako: Galaxy; PAS; CCA; PA (IBM-PC compatible platforms) 应用 流式细胞术在很多领域中都有应用,包括分子生物学、病理学、免疫学和海洋生物学等。在分子生物学中,
CD34阳性细胞绝对计数的流式细胞术测定指南(完整版) 造血干细胞移植(HSCT)是治疗血液系统疾病、自身免疫性疾病、某些实体瘤和基因缺陷疾病的重要手段之一。在HSCT的过程中,采集足够数量的造血干细胞(HSC)是HSCT成功的关键。但至今为止,尚无一个与体内重建造血完全吻合的HSC体外检测法。早期,人们通过有核细胞计数、集落形成单位(CFU)来计算移植物中HSC/造血祖细胞(HPC)数量,但前者与HSC数量一致性差,后者实验变异性大、耗时长,其临床实用性大大减弱。20世纪80年代,CD34分子在造血祖细胞上表达的发现,为临床HSCT提供了可评估植入最低阈值的强有力工具。尽管近年来体外研究表明,人类CD34阴性脐血组分也有造血活性,然而大量的临床研究证实用富含CD34+细胞组分移植可安全、持久地获得多系造血重建[1,2]。因此,目前临床及实验室仍然是应用CD34+细胞进行HSCT、基因转染和HPC扩增,而流式细胞术计数CD34+细胞因具有快速、简便、可定量等特点,已广泛应用于移植物中HSC/HPC数量的检测及确定采集时机等[3,4,5]。流式细胞术计数CD34+细胞经历了从单参数到多参数分析、从双平台到单平台计数、从各实验室自由抗体组合到商业化试剂盒应用等一系列的演变。1995年血液病治疗与移植国际联合会(International Society of Hematotherapy and Graft Engineering,ISHAGE)成立了干细胞计数小组,致力于寻求一种快速、简便、敏感、对不同的流式细胞仪都有效的流式细胞术CD34+细胞计数方法。1996年ISHAGE采纳了Sutherland等提出的CD45/CD34双色标记多参数累积设门的方法,被
第四部分流式细胞术分析血小板 流式细胞术分析血小板 血栓性疾病、出血性疾病、心血管疾病以及自身免疫性血小板减少症等疾病的病理生理过程与血小板相关。血小板功能检测包括黏附、聚集和活化功能试验。使用流式细胞仪检测全血中血小板表面相关标志物是一种新技术,它拓宽了血小板相关疾病的诊断与功能研究方法,丰富了血小板功能评估指标。 一、流式细胞仪血小板分析应用范围 1.通过分析信号传递、细胞骨架结构、颗粒释放、糖蛋白构形、膜磷脂、与抗凝因子的结合和微粒形成,分析血小板活化,血小板对刺激物的反应性。 2. 通过分析受激后表面结合蛋白触发凝血链式反应和表面糖蛋白缺陷检测,分析血小板止血功能的 获得性和遗传性缺陷。 3. 结合血小板大小,检测血小板RNA含量,分析血小板成熟度,计数网织血小板。 4. 发现血小板抗体,做定性和定量分析。 二、血小板分析的临床意义 1. 血栓性疾病:活化血小板的检测能预测冠状血管成形术后发生急性缺血事件的危险性,非风湿 性心房纤颤患者栓塞和栓塞前期均有血小板活化,胰岛素依赖性糖尿病,子痫前期,外周血管疾病等均可测出血小板活力增加和(或)循环中存在活化血小板,而早产儿的血小板对凝血酶、二磷酸腺苷(ADP)、TXA2的体外激活能力降低。 2. 血小板缺陷性疾病:全血法流式细胞术提供了一个简单、迅速的方法来诊断血小板膜糖蛋白缺 陷性疾病,如巨大血小板综合征,血小板无力症等。前者是由于GPIb-IX复合物先天缺陷所致的血小板形态巨大,功能异常的出血性疾病。后者由于GPⅡb/Ⅲa复合物先天缺陷,导致血小板聚集功能障碍 3. 贮存池疾病:原发性贮存池疾病(δ-SPD)常规用血小板聚集法检测,但特异性和灵敏度均不理想。 检测血小板致密颗粒的阿的平荧光显微镜法,主观性大,操作繁琐,而且一次检测的血小板数目有限。 全血法流式细胞术为δ-SPD的诊断提供了一个简单、迅速的方法,一次能定量检测5 000个以上阿的平染色的血小板。与正常人相比,δ-SPD患者阿的平染色显著下降(从49%降至15%)。常在骨髓增殖异常综合征和晚期肾衰中出现的获得性致密颗粒贮存池疾病,也能用全血法流式细胞术进行检测和诊断。 4. 血小板减少性疾病:破坏过多或生成减少均能导致血小板减少。血小板相关抗体(PAIg)是反 映血小板的破坏的指标,虽然其临床意义仍有争议。PAIg的检测有多种方法,但流式细胞术法有其优越性。流式细胞仪能测定单个血小板上的PAIg,只要测定104甚至103个血小板,在统计学上就能精确地得出PAIg的平均水平,因而用血量少,只要1 ml血液制备的血小板就足够。流式细胞术还能同时测定其他一些反映血小板破坏的指标,如PAIgG、PAIgM、C3等。血小板的生成与巨核细胞有
流式细胞术及其应用 作者:贾宇臣 第一部分流式细胞术的一般介绍 概念 流式细胞术(Flow Cytometry,FCM)利用流式细胞仪对处在快速、直线、流动状态中的单细胞或生物颗粒进行多参数、快速定量分析,同时对特定群体加以分选的现代细胞分析技术。 流式细胞仪(Flow Cytometer)集激光技术、电子物理技术、光电测量技术、电子计算机技术、细胞荧光化学技术、单克隆抗体技术为一体的一种新型高科技仪器。 流式细胞仪特点
FACSCalibur 临床型(台式机) 特点: 光路调节系统固定 自动化程度高 操作简便 使用寿命长 配备1-2根激光 细胞分选速度慢,主要用于细胞分析
BD LSR
FACS Vantage DiVa 科研型(大型机) 特点: 多数字化 适用用各类细胞分选 4路分选
FACSAria 科研型 特点: 分辨率高 选配多种波长和类型激光器 可把感兴趣细胞分选到特定培养孔或板上(4路和24孔板)适用于高速分选和多色分析 流式细胞仪检测范围
临床研究 淋巴细胞亚群测定、血小板分析、网织红细胞分析、白血病和淋巴瘤免疫分型、HLA-B27分析、PNH诊断、人类同种异体器官移植中应用、细胞因子测定、AIDS诊断与治疗和疗效评价、flow-FISH法测定端粒长度 基础研究 淋巴细胞功能、树突状细胞(DC)研究、造血干细胞研究、细胞周期分析、细胞凋亡分析、凋亡相关蛋白分析、细胞功能研究、多药耐药基因研究(MDR)、肿瘤相关基因表达研究、RNA测定、DNA测定、总蛋白测定、癌基因和抑癌基因表达产物测定、血管内皮细胞研究 流式细胞仪的工作原理 -光学系统 激光光源 光收集系统 -液流系统 流动室 液流驱动系统 -电子系统 光电转换 数据处理系统 -细胞分选系统 激光光源 单波长、高强度、高稳定性 多采用氩离子激光器或氦氖激光器
查看文章 流式细胞仪-细胞凋亡检测Ⅰ 2008-11-01 10:20 一PI单染色法 基本原理 其原理主要是根据细胞凋亡时在细胞、亚细胞和分子水平上所发生的特征性改变。这些改变包括细胞核的改变、细胞器的改变、细胞膜成分的改变和细胞形态的改变等,其中细胞核的改变最具特征性,主要包括以下几个方面: 1. 细胞核的改变:由于凋亡细胞核的改变,造成各种染色体荧光染料对凋亡细胞DNA可染性发生改变。研究表明,用各种染色体荧光染料对经固定的凋亡细胞进行染色,其DNA可染性降低。许多学者把这种DNA可染性的降低认为是凋亡细胞的标志之一。 2. 光散射特性:凋亡细胞形态上的改变影响它们的光散射特性。在流式细胞仪上,前散射光与细胞的大小有关,而侧散射光反映的是光在细胞内的折射作用,与细胞内的颗粒多少有关。在细胞凋亡时,细胞固缩,体积变小,故前散射光降低,这一特性往往被认为是凋亡细胞的特点之一。此外细胞凋亡时由于染色体降解,核破裂形成,细胞内颗粒往往增多,故凋亡细胞侧散射光常增加。细胞坏死时,由于细胞肿胀,其前散射光增大;侧散射光在细胞坏死时也增大,因此可根据前散射光和侧散射光区别凋亡细胞和坏死细胞。但需要注意的是,根据前散射光和侧散射光判断凋亡细胞的可靠性受被检测细胞形态上的均一性和核胞浆比率影响很大。因此在某些淋巴细胞凋亡中,用光散射特性检测凋亡的可靠性较好,而在肿瘤细胞凋亡中,其可靠性就较差。根据光散射特性检测凋亡细胞最主要的优点是可以将光散射特性与细胞的表面免疫荧光分析结合起来,用以区别经这些特殊处理发生选择性凋亡的淋巴细胞亚型。也可用于活细胞的分类。 试剂与仪器 l PBS溶液(配制方法见附录); l PI染液:将PI溶于PBS(pH7.4)中,终浓度为100ug/ml。用棕色瓶4℃避光保存。 l 70%乙醇 l 400目筛网 l 流式细胞仪 实验步骤 1. 收集细胞{数目约(1~ 5)×106个/mL},500 ~ 1000 r/min离心5min,弃去
流式细胞术实验中的常见问题及其解决方法 一、细胞无法标记1.确保所有的抗体都按照厂商的说明书正确存储。2.确保商品化抗体没有超过有效期。3.确保已正确加入足量的抗体。4.确保抗体已连接荧光素。如果未连接荧光素,需加入连接有荧光素的二抗。5.确保二抗是好的,也就是说二抗曾经能与另外的一抗成功结合。6.确保使用了正确的二抗,就是说二抗能够识别你的一抗。如果使用的是PE或APC荧光素的抗体,确保该抗体未被冰冻过。你要检测的组织上是否表达该抗原?可查看相关文献了解该抗原的表达情况,或者同时做一个阳性对照。抗体是否能识别检测物种的抗原位点?可检查抗体的交叉反应列表,看看抗体是否适用于你要检测的物种标本。不是所有的抗体都能够检测所有物种相应抗原。7.确保使用正确的激光来激发荧光素,并使用了正确的通道来检测该荧光。 二、PE抗体无法标记,而FITC抗体的结果却很好1.PE荧光素可能冰冻过。如果冰冻过,建议另外买一管新的抗体。2.多聚甲醛(PFA)可能会导致此问题。PFA降解后可释放出甲醇,从而影响染色。所以切记PFA尽可能新鲜配制,或者细胞尽可能不要固定,染完色就立即检测。 三、非特异性染色1.非特异性染色可能是由于自发荧光。解决方法:用一管只加细胞不加抗体的空白管,查看细胞自发荧光水平。某些细胞可表达低亲和力的Fc受体CD16/CD32,这种受体
可通过Fc片段结合大多数抗体。对于小鼠细胞,可使用SeroBlock FcR阻断该位点。2.非特异性染色也可能是由于二抗引起,建议选择一种只与一抗反应、却不会与检测组织发生交叉反应的二抗。确保洗涤充分。3.小心滴定抗体。降低抗体浓度可减少非特异性染色。 四、荧光强度弱1.荧光弱可能是由于抗体过度稀释。因此使用前通过正确滴定抗体,以确保抗体浓度适当。2.直标时,荧光弱也可能是由于前带现象引起(概念见表格后解释),因此,小心正确滴定抗体很有必要。3.荧光弱可能由于细胞数量过多。建议正确调整细胞密度,一般低于110E7/ml。4.荧光弱可能是由于抗原本身就表达低,可通过查阅文献,明确抗原表达水平。5.如果查阅到该抗原确实本身表达弱,那么建议选择更亮的荧光素。6.在交叉反应明显的抗体中,其荧光强度弱于特异性高的单克隆抗体。7.一抗或二抗的孵育时间和温度均需优化。散射光异常8.确保细胞是新鲜收集的,否则容易出现大量死细胞和碎片。9.对细胞进行刺激、活化时,可影响细胞散射光特性。10.如果要裂解红细胞,确保裂解液新鲜配制并且配制正确。 五、结果与预期的相反1.有些试剂可能会影响某些抗原检测,例如EDTA可影响一些血小板标记的检测。2.裂解液也可以影响一些抗原检测,此时可采用PBMC提取法试试。3.有些抗原是表达在胞内的,故需选择正确的破膜剂进行正确的破膜处理。前带现象:1929年Heidelberger利用等量抗体检测浓度递增抗